麦角病菌荧光定量PCR检测试剂及检测试剂盒和应用的制作方法
本发明涉及病原真菌的检测领域,具体涉及一种麦角病菌荧光定量PCR检测试剂及检测试剂盒和应用。
背景技术:
麦角菌(Claviceps purpurea)属于真菌门,子囊菌亚门,核菌纲,球壳目,麦角菌科,麦角菌属。在黑麦、小麦、大麦、燕麦等禾本科植物子房内寄生,将子房变为菌核,因形状如同麦粒,故称之为麦角。麦角病菌可侵染许多粮谷类植物和禾本科杂草。
麦角的危害有两方面,一方面由麦角病菌引起的麦角病是麦类的重要病害,造成农作物大幅减产,黑麦的产量损失一般为5%,小麦的产量损失一般为10%。经济损失还包括污染的谷物不能使用或降低等级。另一方面,麦角中含有麦角碱、麦角胺、麦碱等多种有毒的麦角生物碱。人、畜误食后会引起中毒,例如食物中含0.5%麦角(重量比)即可引起牛食欲减退和体重减轻。
近年来,随着进出口贸易的发展,我国大豆进口持续增长,仅2016年进口大豆8391万t。在进口大豆不断增加的同时,许多有害生物也随之而来,在对进口大豆进行检疫的过程中,经常检出鼠粪状的黑色物质,大多数是大豆菌核病的菌核。但是,进口大豆中常常混杂有小麦、大麦、黑麦草、雀麦等禾本科杂草,黑色物质是麦角的可能性也很大,国内多个口岸已有从美国、巴西大豆中多次截获麦角病菌的报道。由于大豆菌核病菌的菌核和麦角形态上相似,并且麦角病菌侵染不同寄主麦类,侵染环境等因素的变化,可使形成的菌核形态有差异,同时收获和加工过程中,由于机械作用,麦角也可能破碎,形态上变化较大。根据GB 2715-2016《食品安全国家标准粮食》规定大米、玉米、豆类中不得检出麦角。GB 19641-2015《植物油料卫生标准》规定油菜籽中“麦角/%≤0.05%”,其他油料中不得检出麦角。因此对大豆中混杂的麦角的检测鉴定具有重要意义。
麦角菌(Claviceps purpurea)的检测方法主要包括,传统感官生物碱显色法、血清学方法、分子生物学方法等。GB/T 5009.36-2003《粮食卫生标准的分析方法》,GB 19641-2015《植物油料卫生标准》及最新的GB 2715-2016《食品安全国家标准粮食》,均采用了对疑似物质进行感官和麦角红素与麦角生物碱定性检测的方法。但是,上述方法所需样品量大,过程比较复杂,在实际操作中显色现象不明显,并且进口粮食及油料作物中发现的样品数量本来就少,进一步加大了检疫鉴定困难。酶联免疫吸附法(ELISA),具有检测时间短、特异性强、仪器设备和样品前处理简单的特点,适用于大批量样品筛查与现场检测,然而也存在酶标记抗体保存时间有限且用量大,交叉反应,可能出现假阳性和假阴性等弊端;核糖体DNA序列分析,通过真菌ITS通用引物对提取的DNA进行扩增,扩增产物测序后进行序列分析从而确定是否是麦角病菌。虽然获得生物信息量大,但是实验操作繁琐,检测周期长;限制性片段长度多态性(RFLP)、随机扩增DN A多态性(RAPD)、脉冲区带电泳(PFGE)等技术用于描述麦角病菌种的分子特性、菌种鉴定以及为建立亚种分类提供依据。可省去序列分析中许多繁琐工序,但是需要进行多种酶切也费时费工,并且以上的分子检测方法都要进行电泳等PCR后处理,接触有毒试剂溴化乙锭,还易发生交叉污染而造成假阳性结果。环介导等温扩增(Loop-mediated isothermal amplification,LAMP)技术具有灵敏度高、反应快、操作简单,但正是由于灵敏度高,一旦开盖容易形成气溶胶污染,假阳性问题比较严重。
荧光定量PCR(Real-time fluorescent PCR)具有检测周期短、特异性与灵敏度高以及无需PCR后处理等优点。并且Ct值与反应体系中起始模板量的对数值有严格的线性关系。除了可定性确定反应体系中是否含有目标DNA之外,还可以对反应体系中的模板DNA进行相对定量。普通TaqMan探针的Tm值为65~72℃,片段长度为25~40nt,由于其高特异性的特点,如果探针与目标基因序列没有完全匹配,则会发生检测效率低甚至没有荧光信号的产生等问题。TaqMan MGB(Minor Groove Binder)探针技术。探针由于3′端具有MGB分子,提高了探针的Tm值,从而使探针长度缩短,以满足整个荧光PCR的反应条件。
因此,研究建立特异、敏感、可对低含量麦角菌(C.purpurea)直接进行检测的荧光定量PCR检测的方法,在检疫、诊断等方面具有重要的实际应用价值。
技术实现要素:
本发明所要解决的技术问题是提供一种对麦角病菌具有特异性高、敏感性强,定量和快速检测的荧光定量PCR检测试剂。
第一方面,本发明要求保护一种用于检测麦角病菌的成套单链DNA。
本发明所要求保护的用于检测麦角病菌的成套单链DNA,由引物对和单链DNA探针组成。
其中,所述引物对可为如下任一:
(a1)由SEQ ID No.1所示的单链DNA和SEQ ID No.2所示的单链DNA组成的引物对;
(a2)由将SEQ ID No.1和SEQ ID No.2经过一个或几个核苷酸的取代和/或缺失和/或添加后所得序列所示的两条单链DNA分子组成的,且与(a1)中所述引物对功能相同的引物对。
所述单链DNA探针的核苷酸序列为SEQ ID No.3。
进一步地,所述单链DNA探针的5’端标记有荧光报告基团,3’端标记有荧光淬灭基团。
更进一步地,所述荧光报告基团可为FAM;所述荧光淬灭基团可为TAMRA。荧光报告基团FAM也可以用TET、VIC、JOE等发光基团代替。
第二方面,本发明要求保护用于检测麦角病菌的引物对。
本发明所要求保护的引物对为前文第一方面中所述的引物对。
第三方面,本发明要求保护用于检测麦角病菌的试剂。
本发明要求保护的用于检测麦角病菌的试剂中除了含有前文所述的成套单链DNA或所述引物对外,还可含有TaqMan实时荧光定量PCR扩增缓冲液和dd H2O。
第四方面,本发明要求保护用于检测麦角病菌的试剂盒。
本发明所要求保护的用于检测麦角病菌的试剂盒含有如下组分(10μL反应×100次):
溶液I:Universal PCR Master Mix(如Thermo Fisher Scientific公司产品,货号4324018)50mL;
溶液II:引物溶液20μL;所述引物溶液中,SEQ ID No.1所示的单链DNA和SEQ ID No.2所示的单链DNA浓度均为10μmol/L;
溶液III:探针溶液70μL;所述探针溶液中,SEQ ID No.3所示的单链DNA的浓度为10μmol/L;
溶液IV:灭菌去离子水1.25mL×2支;
溶液V:阳性对照液100μL;所述阳性对照液中含有麦角病菌基因组DNA;
溶液VI:阴性对照液100μL;所述阴性对照液不含麦角病菌基因组DNA,具体可为含有核盘菌基因组DNA的溶液;
溶液VII:定量标准液100μL;所述定量标准液中含有浓度为100ng/μL的麦角病菌基因组DNA。
第五方面,本发明要求保护一种检测待测样本中是否含有麦角病菌的方法。
本发明所要求保护的检测待测样本中是否含有麦角病菌的方法,可为如下(b1)或(b2):
(b1)包括如下步骤:从待测样本中提取总DNA,作为模板,以前文所述引物对进行PCR扩增,得到扩增产物;然后按照如下确定所述待测样本中是否含有麦角病菌:如果所述扩增产物中含有59bp的DNA片段,则所述待测样本中含有或候选含有麦角病菌;如果所述扩增产物中不含有59bp的DNA片段,则所述待测样本中不含有或候选不含有麦角病菌。
(b2)包括如下步骤:从待测样本中提取总DNA,作为模板,以前文所述成套单链DNA进行荧光定量PCR扩增;然后根据Ct值和扩增曲线按照如下确定所述待测样本中是否含有麦角病菌:如果Ct值小于等于35且扩增曲线为阳性(S型或J型曲线),则所述待测样本中含有或候选含有麦角病菌(阳性);如果无Ct值或Ct值大于等于40或无扩增曲线,则所述待测样本中不含有或候选不含有麦角病菌(阴性)。
进一步地,如果Ct值大于35.0且小于40.0,且扩增曲线为S型或J型曲线,则需所述待测样本进行重新检测,结果判定方法同上。
在上述(b1)中,所述59bp的DNA片段具体为SEQ ID No.4所示DNA片段。
第六方面,本发明要求保护一种检测待测样本中麦角病菌基因组DNA含量的方法。
本发明所提供的检测待测样本中麦角病菌基因组DNA含量的方法,可包括如下步骤:
(c1)将前文所述试剂盒中的定量标准液稀释为系列已知浓度,分别作为模板(如进行10倍系列稀释,得到10-1~10-7倍稀释的DNA模板),以前文所述成套单链DNA进行荧光定量PCR扩增,绘制荧光定量PCR标准曲线;
如:以模板浓度的对数值为X轴,Ct值为Y轴作回归曲线并得出回归方程。根据结果换算,可从未知样品的Ct值得出其含有麦角病菌的基因组DNA含量。
(c2)从待测样本中提取总DNA,作为模板,以前文所述成套单链DNA进行荧光定量PCR扩增;然后根据步骤(c1)所绘制的荧光定量PCR标准曲线得出所述待测样本中麦角病菌基因组DNA的含量。
在前文第五方面和第六方面中,进行所述荧光定量PCR扩增时,组成所述引物对的两条单链DNA在反应体系中浓度均可为0.2μmol/L,所述单链DNA探针在反应体系中浓度可为0.7μmol/L。
具体的,反应体系10μL:5μLUniversal PCR Master Mix,0.2μL CP-F(10μmol/L),0.2μL CP-R(10μmol/L),0.7μL CP-P(10μmol/L),1μL待测DNA,用灭菌去离子水补至10μL。其中,CP-F、CP-R和CP-P分别为SEQ ID No.1-3所示的三条单链DNA(引物或探针)。
在前文第五方面和第六方面中,进行所述荧光定量PCR扩增时,退火温度为60℃。具体可为:95℃预变性10min;95℃ 15s,60℃ 1min,40个循环。
在前文第五方面和第六方面中,本发明的具体实施方式中,所述待测样本具体为麦角菌(C.purpurea)或核盘菌(Sclerotinia sclerotiorum)或杜鹃花枯萎病菌(Ovulinia azaleae)或山茶花腐病菌(Ciborinia camelliae)。
第七方面,本发明要求保护如下任一应用:
(d1)前文所述成套单链DNA或前文所述引物对在制备前文所述试剂中的应用;
(d2)前文所述成套单链DNA或前文所述引物对或前文所述试剂在制备前文所述试剂盒中的应用;
(d3)前文所述成套单链DNA或前文所述引物对或前文所述试剂或前文所述试剂盒在检测麦角病菌中的应用,或者在制备用于检测麦角病菌的产品中的应用。
在本发明中,所述麦角病菌具体为麦角菌(C.purpurea)。
本发明的麦角病菌荧光定量PCR检测试剂是将PCR技术与荧光检测相结合,构建并筛选出上述扩增效率和特异性好的一对引物和一条探针,克服了常规PCR费时、易污染以及扩增后需电泳检测等缺点,可对样品中的麦角病菌进行快速准确的定性与定量检测,具有简单、易操作、结果直观、敏感性高、重复性好等优点。具体优点如下:
1、本发明与常规PCR的检测试剂相比,具有特异、敏感的优点;可对样品中低含量的麦角病菌进行准确检测,是一种非常适合麦角病菌检测的方法。
2、本发明与常规PCR的检测试剂相比,具有适用范围广,使用安全的优点;可对麦角病菌进行快速检测,适用范围广;本发明克服了常规PCR的产物需电泳检测、接触有毒试剂的缺点,降低了生物安全隐患,提高了使用安全性。
3、本发明与常规PCR的检测试剂相比,具有检测量大和快速检测的优点;可同时进行大量样品检测,具有高通量性,可减少DNA或PCR产物污染的风险;常规PCR的检测时间一般6小时以上,本发明无需扩增后的电泳分析,样品检测时间在4小时之内。
4、与常规PCR相比,荧光定量PCR作出一个定量的、客观的估计,判断出阳性、阴性和可疑结果。更重要的是荧光定量PCR特别适用于样品量少,难以分离培养的样品中病菌的快速检测。
5、本试剂所组成的试剂盒可在收到样品后4小时之内作出定性、定量检测结果。用该荧光定量PCR试剂盒检测麦角病菌是一种的特异、敏感和稳定的检测方法。
附图说明
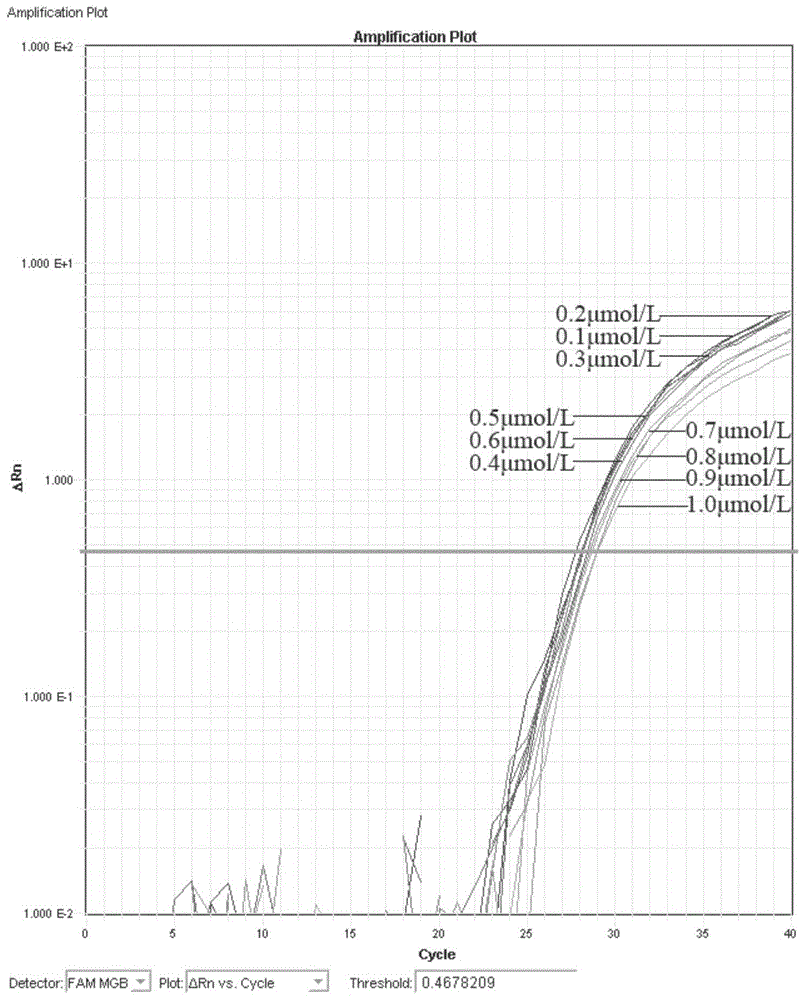
图1为Claviceps purpurea荧光定量PCR的引物优化试验结果。
图2为Claviceps purpurea荧光定量PCR的探针优化试验结果。
图3为Claviceps purpurea荧光定量PCR的特异性试验结果。
图4为Claviceps purpurea荧光定量PCR的灵敏度试验结果。
图5为Claviceps purpurea荧光定量PCR的标准曲线。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1、用于检测麦角病菌的荧光定量PCR试剂盒的制备
1、设计引物和探针
本发明系选择麦角病菌翻译延长因子(Elongation factor 1α,EF-1α)区保守片段为靶目标,通过GenBank中报道的麦角菌(C.purpurea)及近似种EF-1α序列进行同源性分析比较,选定麦角病菌EF-1α区保守片段(59bp),应用primer Express5.0软件,设计引物和探针。引物和探针的合成采用β-乙腈亚磷酸胺化学合成法,使用全自动DNA合成仪进行OligoDNA的合成探针,合成同时进行两端荧光标记,探针5′端标记的荧光报告基团是FAM,3′端标记的是不发荧光的淬灭基团TAMRA。将设计合成的多对引物和探针进行最佳配对筛选实验后,确定扩增效率和特异性最好的一对引物和一条探针,引物序列分别如SEQ ID No.1和SEQ ID No.2所示,探针序列如SEQ ID No.3所示,扩增目标片段长度为59bp,其序列如SEQ ID No.4所示。
引物序列:
CP-F:5′-TCAACCACCCCGGTCAAG-3′(SEQ ID No.1);
CP-R:5′-GGCAGTGTGGCAATCAAGAA-3′(SEQ ID No.2);
特异性探针序列CP-P:5′-FAM-CTGGTTACGCCCCC-TAMRA-3′(SEQ ID No.3)。
2、标准化试剂盒组份(10μL反应×100次),如表1所示。
表1标准化试剂盒组份(10μL反应×100次)
注:Universal PCR Master Mix为Thermo Fisher Scientific公司产品,货号4324018。
实施例2、荧光定量PCR检测麦角病菌
一、检测方法及结果判定标准
1、C.purpurea荧光定量PCR扩增
C.purpurea荧光定量PCR采用10μL体积反应体系,在ABI7900型荧光定量PCR仪中,反应体系为:5μLUniversal PCR Master Mix,0.2μL CP-F(10μmol/L),0.2μL CP-R(10μmol/L),0.7μL CP-P(10μmol/L),1μL基因组DNA,用灭菌去离子水补至10μL。用等体积水代替基因组DNA,作为空白对照。同时设阳性对照和阴性对照10μL反应体系2管。
按下列反应参数进行PCR反应:50℃预热2min;95℃预变性10min;95℃ 15s,60℃ 1min,40个循环。
用阳性麦角病菌基因组DNA,按上述反应体系和反应参数对设计的多对引物和探针最佳配对筛选实验,对筛选的引物和探针的浓度进行精确筛选,以获得最低的Ct值和较高的荧光强度增加值(ΔRn)。每次检测时,每个样品检测做3管平行试验。在阴性对照为阴性、阳性对照为阳性时,整个试验有效,结果本发明的一对特异性引物和一条特异性荧光探针为Ct值低、灵敏度高,为合适的引物和探针。每个样品须作多个备份,以进行稳定性、重复性试验。
其中,引物和探针及其浓度的筛选:
选择引物、探针、模板的最佳浓度配比,获得荧光定量PCR反应的最低Ct值和最高ΔRn,提高扩增效率和敏感性。将引物浓度从0.1μmol/L~1μmol/L以0.1μmol/L递增,确定引物最佳终浓度。探针浓度从0.1μmol/L~1μmol/L以0.1μmol/L递增,确定探针最佳终浓度。
结果如图1和图2所示显示,上下游引物浓度为0.2μmol/L扩增效果最好;探针浓度0.7μmol/L扩增效果最好。
2、麦角病菌定量标准液的制备、标准曲线的建立以及样品中麦角病菌含量的计算
按照Plant DNA Auto Kit试剂盒提取麦角病菌的DNA,用分光光度计测定其OD260值来进行DNA模板定量,OD260值为1相当于50μg/mL双链DNA。采用灭菌去离子水,把提取得到的DNA稀释定量到100ng/μL。对该标准品进行10倍系列稀释,得到10-1~10-7倍稀释的DNA模板用于荧光定量PCR扩增,以模板浓度的对数值为X轴,Ct值为Y轴作回归曲线并得出回归方程。根据结果换算,可从未知样品的Ct值得出其含有麦角病菌的DNA含量。
3、结果分析条件设定
阈值线设定原则根据仪器噪声情况进行调整,以阈值线刚好超过正常阴性样品扩增曲线的最高点为准。
4、质控标准
——阴性对照无Ct值,并且无典型扩增曲线。
——阳性对照的Ct值应小于35.0,并出现典型的阳性扩增曲线(S型或J型扩增曲线)。
——定量用的标准品扩增曲线:出现典型的扩增曲线,指数区较明显,7个点具良好的线性范围,平台区汇于一起,相关系数在0.99以上。
5、结果描述及判定
——阴性
无Ct值或无扩增曲线或Ct值大于等于40,则表示样品中无麦角病菌。
——阳性
Ct值应小于等于35.0,且出现典型的阳性扩增曲线(S型或J型扩增曲线),表示样品中存在麦角病菌。
——有效原则
Ct值在35.0~40.0(不含35和40),且出现典型的阳性扩增曲线(S型或J型扩增曲线)的样本,建议重做。重做结果,判定同上。
——定量:样品DNA的回归曲线与根据标准品的回归曲线比对,作出样品DNA定量。
二、C.purpurea荧光定量PCR的特异性试验
选取了不同植物产品上的菌核进行特异性比较检测,包括了大豆菌核病的菌核,以及大豆和大麦中检出的麦角。待测样本:SC1(麦角菌C.purpurea分离自大麦中),SC2(麦角菌C.purpurea分离自大麦中),SC3(麦角菌C.purpurea分离自大麦中),SC4(麦角菌C.purpurea分离自大豆中),SC5(麦角菌C.purpurea分离自大豆中),SC6(麦角菌C.purpurea分离自大豆中),SC7(核盘菌Sclerotinia sclerotiorum分离自大豆中),SC8(核盘菌S.sclerotiorum分离自大豆中),SC9(杜鹃花枯萎病菌Ovulinia azaleae分离自杜鹃中),SC10(山茶花腐病菌Ciborinia camelliae分离自茶梅中)。
1、提取待测样本的基因组DNA;
2、以步骤1获得的基因组DNA为模板,进行实时荧光PCR。反应体系10μL:5μLUniversal PCR Master Mix,0.2μL CP-F(10μmol/L),0.2μL CP-R(10μmol/L),0.7μL CP-P(10μmol/L),1μL基因组DNA,用灭菌去离子水补至10μL。该反应体系中,CP-F浓度为0.2μmol/L,CP-R浓度为0.2μmol/L,CP-P浓度为0.7μmol/L。用等体积水代替基因组DNA,作为空白对照。反应参数:95℃预变性10min;95℃ 15s,60℃ 1min,40个循环;
结果如图3所示。表明,只有以C.purpurea作为待测样本(SC1~SC6)时显示阳性扩增曲线,其他待测样本均不显示阳性扩增曲线。表明本发明的检测麦角病菌的成套试剂具有较强的特异性。
三、C.purpurea荧光定量PCR的灵敏度试验
1、以步骤二中的SC1的DNA为模板,用灭菌去离子水将基因组DNA进行梯度稀释后作为模板。
2、以步骤1获得的基因组DNA为模板,进行实时荧光PCR。反应体系10μL:5μLUniversal PCR Master Mix,0.2μL CP-F(10μmol/L),0.2μL CP-R(10μmol/L),0.7μL CP-P(10μmol/L),1μL基因组DNA,用灭菌去离子水补至10μL。该反应体系中,CP-F浓度为0.2μmol/L,CP-R浓度为0.2μmol/L,CP-P浓度为0.7μmol/L。用等体积水代替基因组DNA,作为空白对照。
共有8个反应体系,反应体系1中,模板的DNA含量为30ng;反应体系2中,模板的DNA含量为3ng;反应体系3中,模板的DNA含量为300pg;反应体系4中,模板的DNA含量为30pg;反应体系5中,模板的DNA含量为3pg;反应体系6中,模板的DNA含量为300fg;反应体系7中,模板的DNA含量为30fg;反应体系8中,模板的DNA含量为3fg;实验室设3次重复。
反应参数:95℃预变性10min;95℃ 15s,60℃ 1min,40个循环;
结果如图4所示。显示,反应体系1-5均显示阳性扩增曲线,反应体系6、7和8以及空白对照中均无阳性扩增曲线,表明,检测麦角病菌的成套试剂的最低检测限为3pg模板DNA/10μL体系。
四、C.purpurea荧光定量PCR的标准曲线
1、以步骤二中的SC1的DNA为模板,用灭菌去离子水将基因组DNA进行梯度稀释后作为模板。
2、以步骤1获得的基因组DNA为模板,进行实时荧光PCR。反应体系10μL:5μLUniversal PCR Master Mix,0.2μL CP-F(10μmol/L),0.2μL CP-R(10μmol/L),0.7μL CP-P(10μmol/L),1μL基因组DNA,用灭菌去离子水补至10μL。该反应体系中,CP-F浓度为0.2μmol/L,CP-R浓度为0.2μmol/L,CP-P浓度为0.7μmol/L。用等体积水代替基因组DNA,作为空白对照。
共有5个反应体系,反应体系1中,模板的DNA含量为30ng;反应体系2中,模板的DNA含量为3ng;反应体系3中,模板的DNA含量为300pg;反应体系4中,模板的DNA含量为30pg;反应体系5中,模板的DNA含量为3pg;实验室设3次重复。
反应参数:95℃预变性10min;95℃ 15s,60℃ 1min,40个循环;
扩增结果如图4所示。通过对已知浓度梯度的总DNA进行实时荧光PCR检测发现,模板浓度越高,Ct值越小,3个平行试验结果显示,DNA模板浓度与Ct值极相关。y=-3.78x+21.17(R2=0.9960),x代表DNA模板浓度,y代表相应的Ct值,标准曲线见图5。
五、C.purpurea荧光定量PCR的稳定性和重复性试验
在评估荧光定量PCR检测麦角病菌方法的重现性、稳定性时,用阳性样品和阴性样品,在按步骤一同样反应条件下,反复进行荧光定量PCR检测,每次试验的每个样品做6个平行的反应管,重复12次。结论是:本发明的一对特异性引物和一条特异性荧光探针稳定性和重复性好。
<110> 宁波检验检疫科学技术研究院
<120> 麦角病菌荧光定量PCR检测试剂及检测试剂盒和应用
<130> GNCLN191146
<160> 4
<170> PatentIn version 3.5
<210> 1
<211> 18
<212> DNA
<213> Artificial sequence
<400> 1
tcaaccaccc cggtcaag 18
<210> 2
<211> 20
<212> DNA
<213> Artificial sequence
<400> 2
ggcagtgtgg caatcaagaa 20
<210> 3
<211> 14
<212> DNA
<213> Artificial sequence
<400> 3
ctggttacgc cccc 14
<210> 4
<211> 59
<212> DNA
<213> Artificial sequence
<400> 4
tcaaccaccc cggtcaagtc ggtgctggtt acgcccccgt tcttgattgc cacactgcc 59
- 还没有人留言评论。精彩留言会获得点赞!