一种可信号特异放大的二氧化锰/核酸探针复合纳米探针及其制备方法、应用与流程
本发明属于肿瘤活细胞检测
技术领域:
,涉及一种二氧化锰/核酸探针复合纳米材料及其制备方法、应用,尤其涉及一种可信号特异放大的二氧化锰/核酸探针复合纳米探针及其制备方法、成像及信号特异放大材料、应用。
背景技术:
:microrna是一类由内源基因编码的长度约为22个核苷酸的非编码单链rna分子,其种类和数量与肿瘤的发生和发展密切相关,因此microrna常用作肿瘤检测的标志物。然而,肿瘤部位的microrna浓度较低,因此,常采用放大策略实现检测。常用的检测microrna的放大策略分为两种:microrna分子的放大,即扩增;检测信号的放大。microrna分子的扩增技术包括实时荧光聚合酶链式反应(参见nat.biotechnol.2008,26,462-469.)和一系列dna等温扩增技术(参见nature,1991,350,91-92;proc.natl.acad.sci.,1992,89,392-396;nat.genet.,1998,19,225-232;chem.sci.,2017,8,3668-3675;chem.sci.,2015,6,6777-6782)等。然而,这些核酸扩增技术常需要酶的参与,对酶的活性要求较高,检测条件较为苛刻、需要保证酶的活性。而microrna无酶信号放大技术则基于toehold介导链置换反应,按照反应机理,可以分为杂化链式反应(hcr)、催化发夹组装(cha)、熵驱动催化(edc)。其中,基于熵驱动催化反应的无酶信号放大技术设计简单且检测耗时短。目前,大多数的纳米探针(参见science,2007,318,1121-1125;angew.chem.2016,128,3125-3128),在肿瘤部位放大的同时,在正常细胞中也会发生信号放大,大大降低了检测的特异性。而通过引入复杂的探针序列来增强核酸探针的特异性,会在前期设计、筛选序列过程中消耗大量的时间和人力,也阻碍核酸探针进入下一步临床应用。因此,如何能够得到一种简单、特异的信号放大探针,克服现有的纳米探针存在的精确性和复杂的问题,为肿瘤的精准检测提供可能,已成领域内诸多前沿学者在肿瘤检测
技术领域:
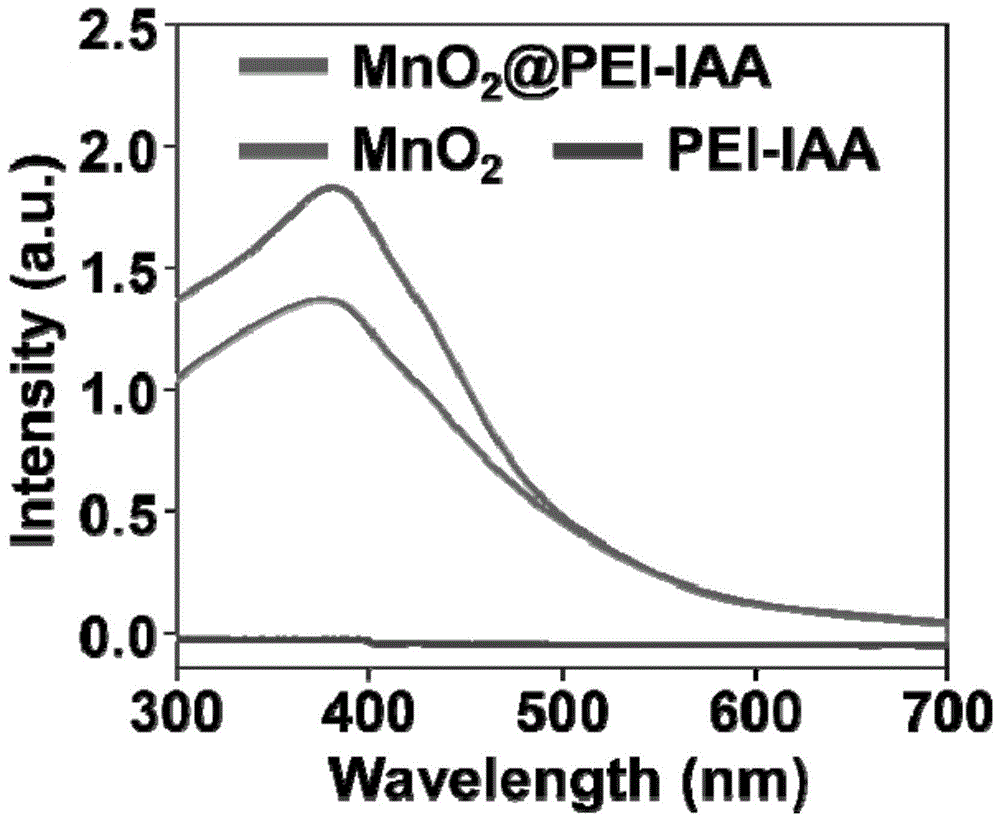
的进行探索的焦点之一。技术实现要素:有鉴于此,本发明要解决的技术问题在于提供一种二氧化锰/核酸探针复合纳米材料及其制备方法、应用,特别是一种可信号特异放大的二氧化锰/核酸探针复合纳米探针,本发明提供的二氧化锰/核酸探针复合纳米探针具有肿瘤微环境响应性,产生荧光信号,而且还能实现在肿瘤细胞中进行信号放大,在正常细胞中信号不放大,大大简化了特异性信号放大探针的序列设计,也可以同时满足特异性的要求。本发明提供了一种二氧化锰/核酸探针复合纳米材料,包括二氧化锰、阳离子聚合物和核酸探针;所述核酸探针由双链dna分子和单链dna分子组成。优选的,所述复合纳米材料为复合纳米探针;所述单链dna复合在所述二氧化锰上;所述双链dna与所述阳离子聚合物相复合;所述阳离子聚合物复合在所述二氧化锰上。优选的,所述阳离子聚合物包括聚乙烯亚胺、咪唑改性聚乙烯亚胺、聚赖氨酸和咪唑改性聚赖氨酸中的一种或多种;所述阳离子聚合物的分子量为600~30000da;所述二氧化锰与单链dna的质量比为(1~200):1;所述阳离子聚合物与双链dna的质量比为(1~20):1;所述双链dna与单链dna的质量比为1:(0.1~10)。优选的,所述二氧化锰包括二氧化锰纳米片和/或二氧化锰纳米球;所述二氧化锰的尺寸为100~250nm;所述核酸探针用于检测microrna;所述单链dna为信号放大链;所述双链dna为信号报告链。优选的,所述microrna包括microrna-21、microrna-221和microrna-155中的一种或多种;所述双链dna通过静电作用复合在所述阳离子聚合物上;所述单链dna通过多种非共价键复合在所述二氧化锰上;所述阳离子聚合物与所述二氧化锰的复合方式包括络合;所述核酸探针为针对肿瘤细胞中高表达的microrna设计的核酸探针。优选的,所述单链dna的序列包括cttatcagactgatgttgattgg、cttatcagactgatgttgattggt、cttatcagactgatgttgattgga、cttatcagactgatgttgattggat和cttatcagactgatgttgattggta中的一种或多种;所述双链dna分子由标记荧光分子的第一单链dna和标记淬灭团的第二单链dna组成;所述第一单链dna的序列包括tatcagactgatgttgattgg、tatcagactgatgttgattggt、tatcagactgatgttgattgga、tatcagactgatgttgattggat和tatcagactgatgttgattggta中的一种或多种;所述第二单链dna的序列包括ccaatcaacatcagtctgataagcta、accaatcaacatcagtctgataagcta、tccaatcaacatcagtctgataagcta、atccaatcaacatcagtctgataagcta和taccaatcaacatcagtctgataagcta中的一种或多种;所述双链dna分子的组成方式包括碱基互补配对。本发明提供一种二氧化锰/核酸探针复合纳米材料的制备方法,包括以下步骤:1)将二氧化锰与缓冲液混合,然后与单链dna均匀混合后,第一混合物;将阳离子聚合物与缓冲液进行第一混合,再与双链dna进行涡旋混合后,得到第二混合物;2)将上述步骤得到的第一混合物和第二混合物进行均匀混合后,得到二氧化锰/核酸探针复合纳米材料。优选的,所述缓冲液包括三羟甲基氨基甲烷-盐酸缓冲液和/或4-羟乙基哌嗪乙磺酸-盐酸缓冲液;所述涡旋混合的时间为10~30秒;所述缓冲液的ph值为7.2~8.5;所述均匀混合后还包括静置步骤;所述静置的时间为5~40分钟。本发明提供了一种成像及信号特异放大材料,包括上述技术方案任意一项所述的二氧化锰/核酸探针复合纳米材料或上述技术方案任意一项所述的制备方法制备的二氧化锰/核酸探针复合纳米材料;所述成像材料包括荧光成像造影剂。本发明提供了上述技术方案任意一项所述的二氧化锰/核酸探针复合纳米材料、上述技术方案任意一项所述的制备方法制备的二氧化锰/核酸探针复合纳米材料或上述技术方案所述的成像材料在肿瘤检测领域中的应用。本发明提供了一种二氧化锰/核酸探针复合纳米材料,包括二氧化锰、阳离子聚合物和核酸探针;所述核酸探针由双链dna分子和单链dna分子组成。与现有技术相比,本发明针对现有的核酸信号放大探针中存在的信号放大特异性差的现状。而通过引入复杂的带有特异性探针序列的增强核酸探针,则会在前期设计、筛选序列过程中消耗大量的时间和人力,进而阻碍核酸探针进入下一步临床应用的缺陷。本发明提供的二氧化锰/核酸探针复合纳米探针可以实现肿瘤细胞特异地信号放大,该二氧化锰/核酸探针复合纳米探针可以在肿瘤细胞中高表达的microrna触发下打开双链核酸产生荧光信号;其次,在肿瘤细胞中特异地快速释放单链核酸,实现肿瘤细胞荧光信号特异的放大。该二氧化锰/核酸探针复合纳米探针可以实现肿瘤细胞信号放大,这种信号特异放大策略,借助于纳米颗粒的优势,增强了核酸检测的特异性。本发明借助纳米颗粒的肿瘤微环境响应性,实现在肿瘤细胞中进行信号放大,在正常细胞中信号不放大,可以大大简化特异性信号放大探针的序列设计,也可以同时满足特异性的要求。而且该二氧化锰/核酸探针复合纳米探针基于非共价键进行复合,而且制备简单,条件温和,可有效降低在正常细胞中的检测信号,具有普适性和良好的应用前景。实验结果表明,与本发明提供的二氧化锰/核酸探针复合纳米探针共孵育的肿瘤细胞具有较强的信号,与本发明提供的二氧化锰/核酸探针复合纳米探针共孵育的正常细胞具有较弱的信号。附图说明图1为本发明实施例18制备的二氧化锰/核酸探针复合纳米探针的透射电镜图;图2为本发明实施例18制备的二氧化锰/核酸探针复合纳米探针的紫外可见光谱图;图3为本发明提供的二氧化锰/核酸探针复合纳米探针在存在谷胱甘肽条件下,分别与不同浓度microrna反应一段时间后的荧光强度;图4为本发明提供的二氧化锰/核酸探针复合纳米探针分别与mcf-7肿瘤细胞和cho非肿瘤细胞共培养的的平均荧光强度。具体实施方式为了进一步了解本发明,下面结合实施例对本发明的优选实施方案进行描述,但是应当理解,这些描述只是为进一步说明本发明的特征和优点而不是对本发明专利要求的限制。本发明所有原料,对其来源没有特别限制,在市场上购买的或按照本领域技术人员熟知的常规方法制备的即可。本发明所有原料,对其纯度没有特别限制,本发明优选采用分析纯、医药领域或其应用领域常规的纯度。本发明所有名词表达和简称均属于本领域常规名词表达和简称,每个名词表达和简称在其相关应用领域内均是清楚明确的,本领域技术人员根据名词表达和简称,能够清楚准确唯一的进行理解。本发明提供了一种二氧化锰/核酸探针复合纳米材料,包括二氧化锰、阳离子聚合物和核酸探针;所述核酸探针由双链dna分子和单链dna分子组成。本发明上述二氧化锰/核酸探针复合纳米材料是一种二氧化锰/核酸探针复合纳米探针,包括二氧化锰、阳离子聚合物和核酸探针,也可以称为阳离子聚合物/二氧化锰/核酸探针复合纳米材料。本发明原则上对所述复合没有特别限制,以本领域技术人员熟知的复合的概念即可,可以是搭载、掺杂、吸附、包裹或生长中的一种或多种,本领域技术人员可以根据应用情况、应用需求或产品性能要求进行调整,本发明为提高复合纳米材料的信号放大特异性,更准确的响应性和稳定性,所述复合优选为搭载或吸附。本发明原则上对所述复合的具体结构和方式没有特别限制,本领域技术人员可以根据应用情况、应用需求或产品性能要求进行调整,本发明为提高复合纳米材料的信号放大特异性,更准确的响应性和稳定性,所述单链dna优选复合在所述二氧化锰上。所述双链dna与所述阳离子聚合物优选相复合。所述阳离子聚合物,即双联dna和阳离子聚合物复合后的材料优选复合在所述二氧化锰上。在复合方式上,所述双链dna优选通过静电作用复合在所述阳离子聚合物上,具体的,本发明所述二氧化锰/核酸探针复合纳米材料自身不带电,阳离子聚合物带正电,核酸探针带负电,通过静电吸附作用,所述核酸探针通过静电吸附作用复合在所述阳离子聚合物上。本发明所述单链dna优选通过多种非共价键复合在所述二氧化锰上,具体的,所述核酸探针通过π-π相互作用、氢键作用和静电作用中的一种或多种复合在所述二氧化锰上。所述阳离子聚合物与所述二氧化锰的复合方式优选包括络合。本发明原则上对所述阳离子聚合物的具体选择没有特别限制,以本领域技术人员熟知的常规阳离子聚合物即可,本领域技术人员可以根据应用情况、应用需求或产品性能要求进行调整,本发明为提高复合纳米材料的信号放大特异性,更准确的响应性和稳定性,所述阳离子聚合物包括聚乙烯亚胺、咪唑改性聚乙烯亚胺、聚赖氨酸和咪唑改性聚赖氨酸中的一种或多种,更优选为聚乙烯亚胺、咪唑改性聚乙烯亚胺、聚赖氨酸或咪唑改性聚赖氨酸。本发明原则上对所述阳离子聚合物的参数没有特别限制,本领域技术人员可以根据应用情况、应用需求或产品性能要求进行调整,本发明为提高复合纳米材料的信号放大特异性,更准确的响应性和稳定性,所述阳离子聚合物的分子量优选为600~30000da,更优选为1800~25000da,更优选为5000~20000da,更优选为10000~15000da。本发明原则上对二氧化锰/核酸探针复合纳米材料中,阳离子聚合物的比例没有特别限制,本领域技术人员可以根据应用情况、应用需求或产品性能要求进行调整,本发明为提高复合纳米材料的信号放大特异性,更准确的响应性和稳定性,所述阳离子聚合物与双链dna的质量比优选为(1~20):1,更优选为(3~18):1,更优选为(5~15):1,更优选为(8~12):1。本发明原则上对所述二氧化锰的形貌没有特别限制,本领域技术人员可以根据应用情况、应用需求或产品性能要求进行调整,本发明为提高复合纳米材料的信号放大特异性,更准确的响应性和稳定性,所述二氧化锰优选包括二氧化锰纳米片和/或二氧化锰纳米球,更优选为二氧化锰纳米片或二氧化锰纳米球,更优选为二氧化锰纳米片。本发明所述二氧化锰的尺寸优选为100~250nm,更优选为120~220nm,更优选为150~200nm。本发明原则上对二氧化锰/核酸探针复合纳米材料中,二氧化锰的比例没有特别限制,本领域技术人员可以根据应用情况、应用需求或产品性能要求进行调整,本发明为提高复合纳米材料的信号放大特异性,更准确的响应性和稳定性,所述二氧化锰与单链dna的质量比优选为(1~200):1,更优选为(10~180):1,更优选为(40~150):1,更优选为(70~120):1,,更优选为(90~100):1。本发明原则上对所述核酸探针的具体选择没有特别限制,本领域技术人员可以根据应用情况、应用需求或产品性能要求进行调整,本发明为提高复合纳米材料的信号放大特异性,更准确的响应性和稳定性,所述核酸探针优选为用于检测microrna的核酸探针,更具体的,所述核酸探针优选为针对肿瘤细胞中高表达的microrna设计的核酸探针。其中,所述microrna优选包括microrna-21、microrna-221和microrna-155中的一种或多种,更优选为microrna-21、microrna-221或microrna-155。本发明所述核酸探针由双链dna分子和单链dna分子组成。本发明原则上对所述核酸探针的具体作用没有特别限制,本领域技术人员可以根据应用情况、应用需求或产品性能要求进行调整,本发明为提高复合纳米材料的信号放大特异性,更准确的响应性和稳定性,所述单链dna优选作为信号放大链;所述双链dna优选作为信号报告链。本发明所述信号(检测信号)优选为荧光信号。其中,所述双链dna分子优选由标记荧光分子的第一单链dna和标记淬灭团的第二单链dna组成,更优选由标记荧光分子的第一单链dna和标记淬灭团的第二单链dna通过碱基互补配对后得到。本发明中双链dna分子优选作为荧光检测信号的报告部分,即信号报告链。本发明对上述双链dna分子的来源没有特别限制,以本领域技术人员熟知的此类双链dna分子的制备方法制备即可,或从市场上购买均可。本发明所述第一单链dna的序列优选包括tatcagactgatgttgattgg、tatcagactgatgttgattggt、tatcagactgatgttgattgga、tatcagactgatgttgattggat和tatcagactgatgttgattggta中的一种或多种,更优选为tatcagactgatgttgattgg、tatcagactgatgttgattggt、tatcagactgatgttgattgga、tatcagactgatgttgattggat或tatcagactgatgttgattggta,更优选为tatcagactgatgttgattgg、atcagactgatgttgattggt或tatcagactgatgttgattgga。所述第二单链dna的序列优选包括ccaatcaacatcagtctgataagcta、accaatcaacatcagtctgataagcta、tccaatcaacatcagtctgataagcta、atccaatcaacatcagtctgataagcta和taccaatcaacatcagtctgataagcta中的一种或多种,更优选为ccaatcaacatcagtctgataagcta、accaatcaacatcagtctgataagcta、tccaatcaacatcagtctgataagcta、atccaatcaacatcagtctgataagcta或taccaatcaacatcagtctgataagcta,更优选为ccaatcaacatcagtctgataagcta、accaatcaacatcagtctgataagcta或tccaatcaacatcagtctgataagcta。其中,本发明所述单链dna分子优选作为荧光检测信号的增强部分,即信号放大链。本发明对上述所述单链dna分子的来源没有特别限制,以本领域技术人员熟知的此类所述单链dna分子的制备方法制备即可,或从市场上购买均可。本发明所述单链dna的序列优选包括cttatcagactgatgttgattgg、cttatcagactgatgttgattggt、cttatcagactgatgttgattgga、cttatcagactgatgttgattggat和cttatcagactgatgttgattggta中的一种或多种,更优选为cttatcagactgatgttgattgg、cttatcagactgatgttgattggt、cttatcagactgatgttgattgga、cttatcagactgatgttgattggat或cttatcagactgatgttgattggta,更优选为cttatcagactgatgttgattgg、cttatcagactgatgttgattggt或cttatcagactgatgttgattgga。本发明原则上对所述双链dna分子和单链dna分子的具体比例没有特别限制,本领域技术人员可以根据应用情况、应用需求或产品性能要求进行调整,本发明为提高复合纳米材料的信号放大特异性,更准确的响应性和稳定性,所述双链dna分子和单链dna分子的质量比优选为1:(0.1~10),更优选为1:(0.5~8),更优选为1:(1~5),更优选为1:(2~4)。本发明还提供了一种二氧化锰/核酸探针复合纳米材料的制备方法,包括以下步骤:1)将二氧化锰与缓冲液混合,然后与单链dna均匀混合后,第一混合物;将阳离子聚合物与缓冲液进行第一混合,再与双链dna进行涡旋混合后,得到第二混合物;2)将上述步骤得到的第一混合物和第二混合物进行均匀混合后,得到二氧化锰/核酸探针复合纳米材料。本发明所述制备方法中所述原料的性质、结构以及比例等优选原则或具体优选方案与前述二氧化锰/核酸探针复合纳米材料的性质、结构以及比例等优选原则或具体优选方案,优选一一对应,在此不再一一赘述。本发明首先将二氧化锰与缓冲液混合,然后与单链dna均匀混合后,第一混合物;将阳离子聚合物与缓冲液进行第一混合,再与双链dna进行涡旋混合后,得到第二混合物。本发明原则上对所述二氧化锰的来源没有特别限制,本领域技术人员可以根据熟知的方法制备或从市场上购买,本发明为提高复合纳米材料的信号放大特异性,更准确的响应性和稳定性,所述二氧化锰优选由二价锰盐、氧化剂、表面活性剂和水进行反应后得到。其中,所述二价锰盐优选为四水氯化锰。本发明原则上对所述缓冲液的选择和参数没有特别限制,本领域技术人员可以根据应用情况、应用需求或产品性能要求进行调整,本发明为提高复合纳米材料的信号放大特异性,更准确的响应性和稳定性,所述缓冲液优选包括三羟甲基氨基甲烷-盐酸缓冲液和/或4-羟乙基哌嗪乙磺酸-盐酸缓冲液,更优选为三羟甲基氨基甲烷-盐酸缓冲液或4-羟乙基哌嗪乙磺酸-盐酸缓冲液。本发明所述缓冲液的ph值优选为7.2~8.5,更优选为7.5~8.2,更优选为7.8~8。本发明原则上对所述混合和第一混合的方式和参数没有特别限制,本领域技术人员可以根据应用情况、应用需求或产品性能要求进行调整,本发明为提高复合纳米材料的信号放大特异性,更准确的响应性和稳定性,所述混合和第一混合的方式优选为涡旋混合。本发明所述混合的时间优选为5~30秒。本发明所述第一混合的时间优选为5~30秒。本发明原则上对所述涡旋混合的参数没有特别限制,本领域技术人员可以根据应用情况、应用需求或产品性能要求进行调整,本发明为提高复合纳米材料的信号放大特异性,更准确的响应性和稳定性,所述涡旋混合的时间优选为10~30秒。本发明最后将上述步骤得到的第一混合物和第二混合物进行均匀混合后,得到二氧化锰/核酸探针复合纳米材料。本发明原则上对所述均匀混合的方式和参数没有特别限制,本领域技术人员可以根据应用情况、应用需求或产品性能要求进行调整,本发明为提高复合纳米材料的信号放大特异性,更准确的响应性和稳定性,所述均匀混合的方式优选为搅拌混合。本发明所述均匀混合的时间优选为10~30秒。本发明为完整和细化制备过程,进一步保证复合纳米材料的信号放大特异性,更准确的响应性和稳定性,所述均匀混合后优选还包括静置步骤。本发明所述静置的时间优选为5~40分钟,更优选为10~30分钟,更优选为20~30分钟。本发明上述制备二氧化锰/核酸探针复合纳米材料的步骤具体可以为:将二氧化锰与水介质(缓冲液)混合后,再加入单链dna混合;将阳离子聚合物与水介质(缓冲液)混合后,加入双链dna,涡旋30s进行混合;将两部分再次混合均匀,得到二氧化锰/核酸探针复合纳米探针。本发明提供了一种信号特异放大策略,在肿瘤高谷胱甘肽的触发下,复合在二氧化锰上的单链dna被释放,可以和双链dna以及目标microrna进行dna链式取代反应,实现特异的荧光信号放大。本发明上述步骤提供了一种二氧化锰/核酸探针复合纳米探针,该复合纳米探针可以在肿瘤细胞中高表达的microrna触发下打开双链核酸产生荧光信号;其次,在肿瘤细胞中特异地快速释放单链核酸,实现肿瘤细胞荧光信号特异的放大。本发明提供的二氧化锰/核酸探针复合纳米探针可以实现肿瘤细胞信号放大;本发明提供的信号特异放大策略,借助于纳米颗粒的优势,增强了核酸检测的特异性。本发明制备的二氧化锰/核酸探针复合纳米探针基于非共价键进行复合,该制备方法简捷,可有效降低在正常细胞中的检测信号,具有良好的应用前景。本发明还提供了一种成像及信号特异放大材料,包括上述技术方案任意一项所述的二氧化锰/核酸探针复合纳米材料或上述技术方案任意一项所述的制备方法制备的二氧化锰/核酸探针复合纳米材料。本发明对所述成像材料没有特别限制,本领域技术人员可以根据应用情况、应用需求或产品性能要求进行调整,本发明所述成像材料优选包括成像剂,更优选包括荧光成像造影剂。本发明对所述成像材料(成像剂)中的其他成分没有特别限制,以本领域技术人员熟知的用于此类成像剂的常规辅助成分即可。本发明还提供了上述技术方案任意一项所述的二氧化锰/核酸探针复合纳米材料、上述技术方案任意一项所述的制备方法制备的二氧化锰/核酸探针复合纳米材料或上述技术方案所述的成像材料在肿瘤检测领域中的应用。本发明上述步骤提供了一种可信号特异放大的二氧化锰/核酸探针复合纳米探针及其制备方法、应用。本发明通过多重作用,将带负电的单链核酸和双链核酸分别担载在二氧化锰和阳离子聚合物上,形成具有信号特异放大的复合纳米探针。本发明提供的二氧化锰/核酸探针复合纳米探针可以实现肿瘤细胞特异地信号放大,该二氧化锰/核酸探针复合纳米探针可以在肿瘤细胞中高表达的microrna触发下打开双链核酸产生荧光信号;其次,在肿瘤细胞中特异地快速释放单链核酸,实现肿瘤细胞荧光信号特异的放大,这种在肿瘤特异高表达的核酸分子microrna触发下产生放大的核酸信号,与没有肿瘤响应纳米颗粒参与的纳米探针体系相比,进一步降低了正常细胞中的信号。本发明借助纳米颗粒的肿瘤微环境响应性,实现在肿瘤细胞中进行信号放大,在正常细胞中信号不放大,可以大大简化特异性信号放大探针的序列设计,也可以同时满足特异性的要求,而且这种信号特异放大策略,借助于纳米颗粒的优势,增强了核酸检测的特异性。同时本发明提供的复合纳米探针基于非共价键进行复合,而且制备简单,条件温和,可有效降低在正常细胞中的检测信号,具有普适性和良好的应用前景。实验结果表明,与本发明提供的二氧化锰/核酸探针复合纳米探针共孵育的肿瘤细胞具有较强的信号,与本发明提供的二氧化锰/核酸探针复合纳米探针共孵育的正常细胞具有较弱的信号。为了进一步说明本发明,以下结合实施例对本发明提供的一种二氧化锰/核酸探针复合纳米材料及其制备方法、应用进行详细描述,但是应当理解,这些实施例是在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,只是为进一步说明本发明的特征和优点,而不是对本发明权利要求的限制,本发明的保护范围也不限于下述的实施例。实施例1~23二氧化锰/核酸探针复合纳米探针的制备将四水氯化锰溶解在水中,快速加入到30%过氧化氢、25%四甲基氢氧化铵的混合液中,将三种反应物溶液混合,在25℃下反应12h,8000rpm离心15min离心,将离心得到的产物反复用水和甲醇洗,再进行离心,所得离心产物真空抽干,得到二氧化锰纳米片。将二氧化锰纳米片与单链dna以不同质量比(实施例1~7)进行复合,得到二氧化锰/单链dna复合物。参见表1,表1为本发明实施例1~7中二氧化锰纳米片和单链dna的质量比。将阳离子聚合物与双链dna以不同质量比(实施例8~15)进行复合,得到阳离子聚合物/双链dna复合物。参见表2,表2为本发明实施例8~15中二氧化锰纳米片和双链dna的质量比。将二氧化锰与阳离子聚合物以不同质量比(实施例16~23)进行复合,得到最终的二氧化锰/核酸探针复合纳米探针。参见表3,表3为本发明实施例16~23中二氧化锰纳米片与阳离子聚合物的质量比。表1实施例二氧化锰与单链dna的质量比110220340480510061507200表2表3实施例阳离子聚合物二氧化锰与阳离子聚合物的质量比16聚乙烯亚胺4017聚乙烯亚胺8018咪唑改性聚乙烯亚胺4019咪唑改性聚乙烯亚胺8020聚赖氨酸4021聚赖氨酸8022咪唑改性聚赖氨酸4023咪唑改性聚赖氨酸80其中,实施例16~23中,所用二氧化锰纳米片与单链dna的质量比为80,所用阳离子聚合物与双链dna的质量比为2.5。对本发明实施例制备的二氧化锰/核酸探针复合纳米探针进行表征。参见图1,图1为本发明实施例18制备的二氧化锰/核酸探针复合纳米探针的透射电镜图。由图1可知,本发明制备的二氧化锰/核酸探针复合纳米探针呈片状结构,咪唑改性聚乙烯亚胺与二氧化锰配位后,没有影响片状结构。参见图2,图2为本发明实施例18制备的二氧化锰/核酸探针复合纳米探针的紫外可见光谱图。由图2可知,本发明制备的二氧化锰和咪唑改性聚乙烯亚胺之间的作用是配位作用。实施例241)二氧化锰/核酸探针复合纳米探针对不同浓度microrna-21的荧光响应将实施例18制备的二氧化锰/核酸探针复合纳米探针在缓冲液中分散,加入不同浓度的microrna-21,37℃反应4h后测试荧光信号;将实施例18制备的二氧化锰/核酸探针复合纳米探针在缓冲液中分散,加入2mm谷胱甘肽反应5min后,加入不同浓度的microrna-21,37℃反应4h后测试荧光信号,参见图3,图3为本发明提供的二氧化锰/核酸探针复合纳米探针在存在谷胱甘肽条件下,分别与不同浓度microrna反应一段时间后的荧光强度。由图3的实施例18制备的二氧化锰/核酸探针复合纳米探针在有、无2mm谷胱甘肽条件下,不同浓度的microrna-21触发产生的荧光信号强度可知,在相同浓度的microrna-21条件下,高谷胱甘肽可以触发更高的荧光信号。2)细胞的培养以mcf-7肿瘤细胞和cho非肿瘤细胞为例,采用含有10%胎牛血清的培养基中、置于37℃培养箱中进行培养。取对数生长期的细胞,按照每孔5×104细胞的密度接种于六孔板中,置于37℃培养箱中培养过夜。3)二氧化锰/核酸探针复合纳米探针用于细胞中microrna的检测将实施例18制备的二氧化锰/核酸探针复合纳米探针分别加入到mcf-7肿瘤细胞和cho非肿瘤细胞中,置于37℃培养箱中培养4h后,采用流式细胞术分析细胞中的平均荧光强度。对上述过程进行检测。参见图4,图4为本发明提供的二氧化锰/核酸探针复合纳米探针分别与mcf-7肿瘤细胞和cho非肿瘤细胞共培养的的平均荧光强度。由图4可以看出,与纯阳离子聚合物/核酸探针纳米复合探针相比,本发明实施例18制备的二氧化锰/核酸探针复合纳米探针可以触发mcf-7肿瘤细胞产生相当的荧光信号,而在cho正常细胞中产生了明显降低的荧光信号。以上对本发明提供的一种可信号特异放大的二氧化锰/核酸探针复合纳米探针及其制备方法、成像及信号特异放大材料、应用进行了详细的介绍,本文中应用了具体个例对本发明的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本发明的方法及其核心思想,包括最佳方式,并且也使得本领域的任何技术人员都能够实践本发明,包括制造和使用任何装置或系统,和实施任何结合的方法。应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护范围内。本发明专利保护的范围通过权利要求来限定,并可包括本领域技术人员能够想到的其他实施例。如果这些其他实施例具有不是不同于权利要求文字表述的结构要素,或者如果它们包括与权利要求的文字表述无实质差异的等同结构要素,那么这些其他实施例也应包含在权利要求的范围内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1