用于肿瘤浸润性淋巴细胞快速培养的饲养细胞的制备方法与流程
本发明属于细胞培养技术领域,尤其涉及一种用于肿瘤浸润性淋巴细胞快速培养的饲养细胞的制备方法。
背景技术:
肿瘤浸润淋巴细胞(tumorinfiltratedlymphocytes,til)是离开血液循环,迁移到肿瘤附近的淋巴细胞,它们包括t细胞,b细胞,nk细胞等。它们可以起到杀伤癌细胞的作用。肿瘤中til的多少是预测癌症患者预后和对免疫疗法反应的重要指标。til疗法主要是将从患者新鲜肿瘤组织中分离的til在体外细胞的培养环境下进行快速扩增,将til的数目扩增到可以给患者进行回输的数量后再回输到病人体内。
目前已知的til体外扩增的技术用的是将分离的til体外进行预培养1-2周以后按照一定比例(通常为1:200)与经30-50gyγ射线照射过的外周血淋巴细胞(peripheralbloodmononuclearcells,pbmc)进行共培养,主要原理是利用γ射线照射pbmc,使其生长抑制后成为饲养细胞,在与til共培养的过程中,饲养细胞分泌的生长因子将促进til的快速增殖以达到治疗所用的细胞数量。但是这种方法需要专门的照射设备,并且照射成本比较高,而一般的研究机构并不具备此种设备,所以利用此方法进行大量体外扩增til对于一般研究机构来说不经济实惠。
技术实现要素:
本发明的目的在于:针对现有技术中利用γ射线照射pbmc制备饲养细胞,照射成本高,不利于广泛使用的问题,提供一种用于肿瘤浸润性淋巴细胞快速培养的饲养细胞的低成本制备方法。
本发明采用的技术方案如下:
一种用于肿瘤浸润性淋巴细胞快速培养的饲养细胞的制备方法,包括以下步骤:
s1.饲养细胞的制备
1)外周血淋巴细胞的分离与培养:抽取非小细胞肺癌病人自体外周血,用磷酸盐缓冲液稀释后加入淋巴细胞分离液进行淋巴细胞的分离,然后用无血清的x-vivo培养基在5%co2、37℃培养箱进行培养;
2)饲养细胞制备:过夜培养后将上述分离后的淋巴细胞进行细胞计数,调整细胞密度为1.5×106cells/ml,加入丝裂霉素c处理1.5-2小时,离心,弃上清液,然后用x-vivo培养基重悬浮和洗涤细胞,再离心,弃上清液,加入培养基重悬浮细胞,得到饲养细胞;
s2.肿瘤浸润性淋巴细胞的分离与预培养
将临床收集的非小细胞肺癌组织用无菌磷酸盐缓冲液冲洗后切成1-2mm3的组织块,然后加入肿瘤浸润性淋巴细胞培养基,放入5%co2、37℃培养箱培养2-3天后弃组织块,肿瘤浸润性淋巴细胞继续培养,每隔2-3天添加新鲜培养基,培养10-14天后,收集细胞,离心后,弃上清液,然后用培养基重悬浮和洗涤细胞,得到预培养的肿瘤浸润性淋巴细胞;
s3.饲养细胞与肿瘤浸润性淋巴细胞的共培养
将s1制得的饲养细胞与s2制得的预培养的肿瘤浸润性淋巴细胞分别离心后,用培养基重悬浮及洗涤两次,然后加入aim-v/til培养基中,同时添加il-2及cd3/cd28抗体,放入5%co2、37℃培养箱进行培养,每隔2-3天添加新鲜培养基。
本发明利用丝裂霉素c来处理pbmc得到饲养细胞,然后用饲养细胞与预培养的til按比例混合进行共培养。实验结果表明,利用本发明方法制作的饲养细胞扩增til的效率与利用γ射线照射制作的饲养细胞扩增til的效率相比效果更好,同时利用此法的成本显著降低。本发明方法制备方法简单易行,可以广泛推广应用。
传统的方法是用γ射线照射pbmc使其生长受抑制后,再与til共培养,培养的过程中照射过的pbmc通过分泌大量生长因子来促进til的快速生长。但是一般的研究单位没有γ射线照射的条件,并且γ射线照射的成本高。
本发明使用丝裂霉素c来制备饲养细胞,用丝裂霉素c处理pbmc后使pbmc细胞生长受损,但是细胞仍然存活并分泌促使til生长的生长因子。该方法成本低,研究结果显示,用丝裂霉素c处理的pbmc与til共培养后其促进til增殖的效果优于用γ射线照射处理的pbmc的效果。
进一步地,s1中磷酸盐缓冲液与病人自体外周血按照体积比1:1-1.2稀释。
进一步地,s1中x-vivo培养基中还添加40ng/ml的il-2和200ng/ml的cd3/cd28抗体。
进一步地,s1中丝裂霉素c的终浓度为50μg/ml。
进一步地,s2中肿瘤浸润性淋巴细胞培养基包括1640培养基、10wt%人a/b血清、1wt%的青霉素/链霉素溶液、10mm的l-glutamine和10mm的2-mercaptoethanol。
进一步地,s3中按照s1制得的饲养细胞与s2制得的预培养的肿瘤浸润性淋巴细胞的细胞数目为200-230:1的比例加入aim-v/til培养基中。
进一步地,aim-v/til培养基由aim-v培养基与肿瘤浸润性淋巴细胞培养基按照体积比为1:1制得。
进一步地,aim-v/til培养基还添加5000u/mlil-2及200ng/ml的cd3/cd28抗体。
进一步地,s3中待细胞密度达到2×106cells/ml后,进行1:1的细胞传代;同时每周进行细胞计数1-2次。
综上所述,由于采用了上述技术方案,本发明的有益效果是:
1、本发明利用丝裂霉素c处理外周血淋巴细胞来制备饲养细胞用于til的体外快速扩增培养,相比于传统方法利用γ射线照射制作的饲养细胞扩增肿瘤浸润性淋巴细胞的效率相比效果更好,且成本显著降低,应用范围有效增广;
2、本发明用丝裂霉素c处理pbmc后使pbmc细胞生长受损,但是细胞仍然存活并分泌促使til生长的生长因子,用丝裂霉素c处理的pbmc与til共培养后其促进til增殖的效果优于用γ射线照射处理的pbmc的效果。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
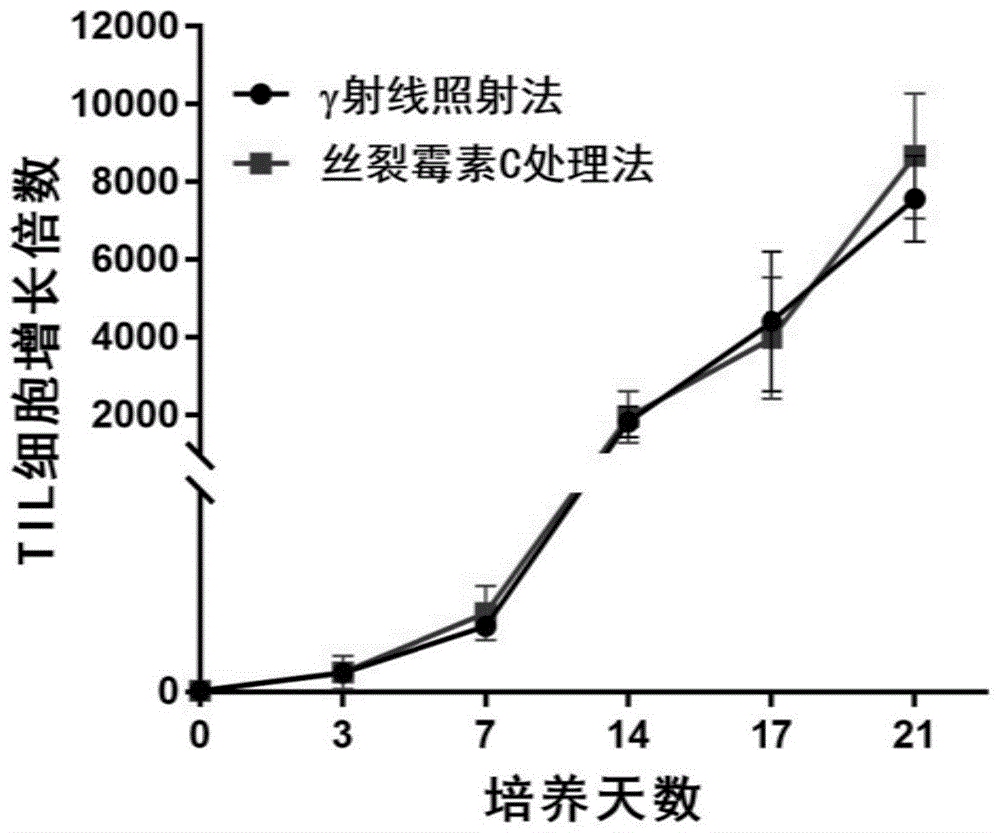
图1为细胞增殖情况图;
图2为γ射线照射法制备的饲养细胞与til共培养14天后杀伤性t细胞(cd3+cd8+)的含量图;
图3为本发明方法制备的饲养细胞与til共培养14天后杀伤性t细胞(cd3+cd8+)的含量图;
图4为t细胞存活率图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明,即所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。通常在此处附图中描述和示出的本发明实施例的组件可以以各种不同的配置来布置和设计。
因此,以下对在附图中提供的本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明的实施例,本领域技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
需要说明的是,术语“第一”和“第二”等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。而且,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。在没有更多限制的情况下,由语句“包括一个……”限定的要素,并不排除在包括所述要素的过程、方法、物品或者设备中还存在另外的相同要素。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例
本发明较佳实施例提供的一种用于肿瘤浸润性淋巴细胞快速培养的饲养细胞的制备方法,具体步骤如下:
1.饲养细胞的制备:
1)病人自体外周血淋巴细胞的分离与培养:抽取病人自体外周血50ml后,用磷酸盐缓冲液按1:1进行稀释,然后加入淋巴细胞分离液进行淋巴细胞的分离,然后用无血清的x-vivo培养基(加入40ng/ml的il-2及200ng/ml的cd3/cd28抗体)在5%、co2,37℃培养箱进行培养。
2)饲养细胞制备:分离好的淋巴细胞过夜培养后进行细胞计数,调整细胞密度为1.5×106cells/ml,加入丝裂霉素c(终浓度为50μg/ml)处理1.5小时后,1000rpm/min离心5min后,丢弃上清液,然后用x-vivo培养基重悬浮和洗涤细胞,1000rpm/min离心5min后,丢弃上清,加入培养基重悬浮细胞用于与til的共培养步骤。
2.til的分离与预培养
在生物安全柜中将临床收集的非小细胞肺癌组织用无菌磷酸盐缓冲液冲洗两遍后切成1-2mm3的组织块,将组织块放入48孔细胞培养板(1块/孔),然后加入til培养基(1640培养基+10wt%人a/b血清+1wt%的青霉素/链霉素溶液+10mml-glutamine+2-mercaptoethanol),放入5%、co2,37℃培养箱进行培养,2-3天后丢弃组织块,孔内til继续培养,每隔2-3天添加新鲜培养基,培养10-14天后,收集细胞,1000rpm/min离心5min后,丢弃上清液,然后用培养基重悬浮和洗涤细胞后用于共培养。
3.饲养细胞与til的共培养
制备好的饲养细胞与预培养的til分别离心后,用培养基重悬浮及洗涤两次,然后按照200:1的细胞数目比例加入到按1:1混合好的aim-v/til培养基中,同时添加5000u/mlil-2及200ng/ml的cd3/cd28抗体,放入5%、co2,37℃培养箱进行培养,每隔2-3天添加新鲜培养基,待细胞密度达到2×106cells/ml后,进行1:1的细胞传代;同时每周进行细胞计数1-2次。
实验例1
分别采用γ射线照射产生的饲养细胞以及本发明实施例的方法制备饲养细胞,将两种方法制得的饲养细胞分别与非小细胞肺癌til共培养,结果如图1所示。
由图可知,细胞的增殖效率差异较小,且本发明实施例方法制备饲养细胞与非小细胞肺癌til共培养21天后细胞的增长倍数更高。
实验例2
分别采用γ射线照射产生的饲养细胞以及本发明实施例的方法制备饲养细胞,采用流式细胞术检测两种方法制备的饲养细胞与til共培养14天后杀伤性t细胞(cd3+cd8+)的含量,结果如图2和3所示;结果显示效果相仿。
实验例3
采用本发明实施例的方法制备饲养细胞,然后与til共培养,检测其细胞存活率,结果如图4所示。由图可知,利用本发明制备的饲养细胞与til共培养后til的细胞存活率在85%以上。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!