一种用于规模化悬浮培养的抗凋亡MDCK宿主细胞株及其建立方法与流程
本发明涉及一种用于规模化悬浮培养的抗凋亡mdck宿主细胞株及其建立方法,特别涉及一种抗凋亡基因bcl-2过表达的mdck细胞株及其建立方法,属生物技术领域。
背景技术:
自20世纪至今,全球流感多次发生,严重危害人类和动物的健康,给全球造成了巨大的经济损失。故利用疫苗免疫进行流感病毒疾病预防显得至关重要。目前的流感疫苗主要是以鸡胚为介质制备的灭活疫苗,但是这种疫苗存在外源因子易污染、培养周期长、生产成本高、操作步骤繁琐、疫苗批次间差异大、鸡胚连续传代病毒时易发生抗原变异且难以大量供应等缺陷。随着国内外大规模细胞培养技术的不断成熟和应用,以细胞为介质的流感病毒疫苗的制备已是必然趋势,其中mdck细胞为首选细胞系。
单细胞mdck细胞悬浮培养不受细胞生长表面基质的限制,易实现大规模生产。然而悬浮驯化的mdck细胞经逐级放大培养后,由于血清的缺乏、有害代谢产物如氨和乳酸的积累、氧自由基或溶氧过低、酸性ph环境、营养缺乏等多种因素的影响,容易诱导悬浮培养细胞发生死亡,而在大规模培养生物反应器中死亡细胞的80%是凋亡所致,可见细胞凋亡成为影响活细胞密度和目的产品质量的重要因素,因此维持细胞在培养时的细胞活性、抑制细胞凋亡发生成为众多研究者提高细胞质量、改进细胞培养工艺研究的热点。
本发明通过对mdck细胞代谢流控制策略的研究,考察了mdck细胞代谢流特征和增殖能力,驯化适应的mdck细胞,应用基因工程原理,结合mdck悬浮细胞的培养特性,在bcl-2基因前使用优化的kozak序列等方法对表达载体进行优化,将基因克隆整合至载体中后,转染mdck细胞,实现bcl-2基因在细胞内的过表达;将改造的抗凋亡细胞株初步应用于mdck细胞的悬浮培养工艺中,降低了培养过程中mdck细胞的凋亡率,提高了其活力,建立了抗凋亡mdck细胞种子库,从而为生产优质的疫苗奠定基础。
技术实现要素:
本发明的目的在于提供一种用于规模化悬浮培养的抗凋亡mdck宿主细胞株及其建立方法,实现mdck细胞在培养过程中低凋亡率、高活率的增殖。
为了达到上述目的,本发明采用了以下技术手段:
本发明采用基因重组技术将可调节细胞凋亡的基因bcl-2通过真核表达载体导入mdck细胞,建立了bcl-2过表达的mdck-b抗凋亡宿主细胞株,将改造的mdck细胞株低血清培养基悬浮培养,72h时活细胞密度达4.5×106cells/ml,细胞活率95%以上,较正常组细胞表达量提高了31%;同时跟踪bcl-2基因过表达的mdck细胞株培养过程中细胞凋亡和细胞周期情况,结果显示较正常组细胞,细胞的凋亡率显著降低,活力显著提高。
本发明获得的一种用于规模化悬浮培养的抗凋亡mdck宿主细胞株,命名为狗肾细胞mdck-b,分类命名为狗肾细胞mdck-b,该细胞保藏在中国典型培养物保藏中心,地址在中国.武汉.武汉大学,保藏号为cctccno:c2019142,保藏时间为2019年7月17日。
进一步的,本发明还提出了所述的抗凋亡mdck宿主细胞株在病毒生产中的应用。
其中,优选的,所述的病毒是用于制备疫苗。
其中,优选的,所述的疫苗为流感病毒疫苗。
其中,优选的,所述的抗凋亡mdck宿主细胞株是通过悬浮培养的方法生产病毒。
与现有技术相比,本发明的有益效果是:
本发明建立了bcl-2过表达的mdck-b抗凋亡宿主细胞株,将改造的mdck细胞株使用低血清培养基悬浮培养,72h时活细胞密度达4.5×106cells/ml,细胞活率95%以上,较正常组细胞表达量提高了31%;同时跟踪bcl-2基因过表达的mdck细胞株培养过程中细胞凋亡和细胞周期情况,结果显示较正常组细胞,细胞的凋亡率显著降低,活力显著提高,本发明的提出为生产优质的产品提供高质量的宿主细胞。
附图说明
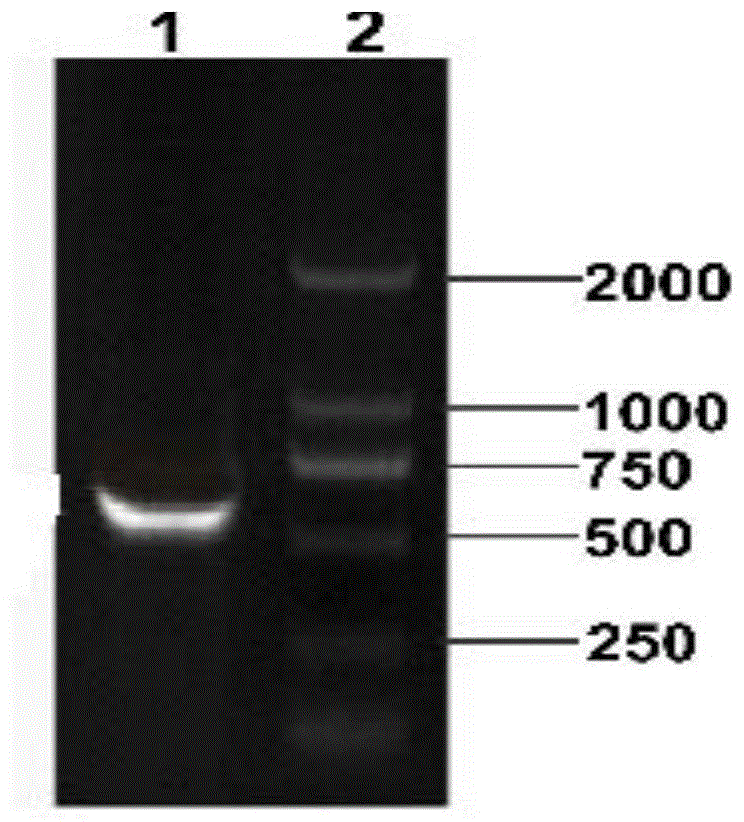
图1为抗凋亡基因bcl-2的pcr扩增产物经1.5%琼脂糖凝胶电泳视图;
其中,1:bcl-2基因pcr产物;2:dnamarkerdl2000;
图2为将阳性重组载体用ecorⅰ/kpnⅰ双酶切,bamhⅰ单酶切鉴定,产物进行琼脂糖凝胶电泳后显示的电泳条带;
其中,1、ecolrⅰ/kpnⅰ酶切pegfp2-bcl;2、aseⅰ/mluⅰ酶切pegfp-bcl;3、bamhⅰ酶切pegfp-bcl;m、dnamarkerdl3000;
图3为利用内引物,以初步酶切鉴定为阳性的重组子为模板,pcr扩增,琼脂糖凝胶电泳后显示的760bp的片段电泳条带;
其中,1:表达质粒中bcl基因的pcr扩增产物;m:dnamarkerdl3000;
图4为流式细胞术检测bcl-2基因的表达;
图5为正常组mdck细胞和mdck-b细胞悬浮培养过程中f5细胞形态观察;
其中,左图为正常组mdck细胞悬浮培养细胞f5,镜下观察,细胞透亮,但分散不均,大小不一;右图为悬浮培养mdck-b细胞f5,镜下观察,细胞圆润,透亮,分散均匀,细胞间营养液清亮;
图6为正常组mdck细胞和mdck-b细胞悬浮培养过程中f20细胞形态观察;
其中,左图为正常组mdck细胞悬浮培养悬浮培养f20,镜下观察,细胞圆润,透亮,界面干净;右图为悬浮培养mdck-b细胞f20,镜下观察,细胞呈单个圆形,分散均匀,细胞间营养液清亮,细胞密度显著增加;
图7为fitc-annexinv/pi双染法检测mdck-b细胞在0.5mol/lnh4cl溶液悬浮培养过程中细胞凋亡情况;
其中,a:mdck-bcl-2细胞;b:mdck细胞;
图8为mdck-bcl-2细胞和mdck细胞培养过程中凋亡率的变化;
图9a-d为mdck-b细胞批式培养过程中细胞周期分布的变化趋势;
其中,a:0h;b:24h;c:48h;d:72h;
图10a-b为正常组mdck细胞和mdck-b细胞培养至48h时gsh含量比较。
具体实施方式
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1:bcl-2过表达的mdck细胞株mdck-bcl-2的构建
1.材料和方法
1.1mdck细胞:购自上海细胞库,经中农威特生物科技股份有限公司由贴壁驯化适应悬浮培养并保存,试验细胞已传15代。
1.2仪器和设备:台式离心机、电热恒温水浴箱(北京市医疗设备总厂);流式细胞仪(bectondickinon);sc645型凝胶成像分析仪(biosens公司);倒置显微镜(日本olympus公司);超净台、co2培养箱(广州净化设备总厂);dyy2iii26b型电泳仪(北京六一仪器厂)。
1.3主要试剂:新生牛血清(兰州民海生物技术公司);吖啶橙、溴化乙啶(美国sigma公司);培养基(清大天一公司);annexinv/pi试剂盒(美国promega公司);胶回收试剂盒、限制性内切酶、总rna提取试剂盒和反转录酶amvrtase(购自promega公司);抗鼠、兔bcl-2单克隆抗体(fitc标记)(gibcol公司);oligod(t)15、4dntp和t4dna连接酶(大连宝生物工程有限公司);脂质体lipofectamine2000(上海生工生物工程技术服务有限公司);质粒小量快速提取试剂盒(北京全式金生物技术公司)。
1.4方法
1.4.1异硫氰酸胍法提取mdck细胞总rna
将mdck悬浮细胞收集于1.5ml离心管,pbs清洗离心,调整细胞密度为3×106~1×107个/ml,吸弃上清液,加入600μl变性液,使细胞充分裂解,并用vortex振荡器振荡,充分混匀,冰浴放置5min;加2mol乙酸钠45μl,混合后将溶液移至一个1.5mleppendorf离心管中;加酚∶氯仿∶异戊醇660μl,室温下用力振荡10s,冰上制冷10min;4℃离心,12000r/min×10min;小心吸出上层含rna水相,移至另一1.5ml离心管中,避免吸取两相之间的蛋白物质;加等体积的用冰预冷的无水乙醇。在-20℃下放置至少30min沉淀rna;4℃离心,12000r/min,15min,弃去乙醇,将离心管倒置于滤纸上以便剩余的乙醇挥发殆尽,加入20μldepc水溶解,对rna样品进行定量。
1.4.2抗凋亡基因bcl-2的扩增及克隆
将所提取rna反转录合成cdna,按rneasyminikit和superscripttmpreamplificationsystemforfirststrandcdnasynthesis说明书操作。在pcr反应管中加入适量模板bcl-2,加入定量的taqbuffer、dntp、taqdna聚合酶、上下游引物、mgcl2及dh2o,混匀后离心。根据已发表相关文献,分别设计一对外引物和一对内引物:
外引物:正向tgtggggcgggagtcagg,
反向gcatattttggggagcaggtc;
内引物:正向tatcccgggccaccatggctcaagctgggagaac,
反向gcgtctagattatcacttgtggcccaggtagg。
在正向引物中引入酶切位点、atg启始密码子及kozak序列,利用新合成的引物进行pcr扩增,获得bcl-2抗凋亡基因克隆产物。pcr扩增条件:第一轮:94℃变性40s,52℃复性50s,72℃延伸50s,用外引物,共20循环;第二轮:94℃变性40s,56℃复性50s,72℃延伸50s,用内引物,共30循环。待反应结束,取8u1pcr产物立即进行1.5%琼脂糖凝胶电泳,当溴酚蓝移动到距离胶板下约1cm时停止电泳,用含有0.5ug/ml的溴化乙啶染色约20min,清水漂洗20min,紫外灯下观察,采用凝胶成像系统拍照保存。回收pcr目的片段,并克隆至pmd18-tvector的t位点中,转化感受态大肠杆菌dh5α,蓝白斑筛选阳性克隆菌落,液体lb培养基摇菌培养,37℃振摇8~12h。提取重组质粒pmd18-bcl2,用bamhⅰ进行酶切鉴定,送大连宝生物工程有限公司测序。
1.4.3pcdna3.1-bcl2真核表达载体的构建
以pmd18-bcl2重组质粒为模版,利用内引物进行pcr扩增,将pcr产物与pcdna3.1载体用ecorⅰ、kpnⅰ双酶切,t4dna连接酶连接过夜,所得产物转化至大肠杆菌dh5α感受态细胞,筛选阳性克隆菌落,提取重组质粒,酶切鉴定,测序,鉴定正确的质粒命名为pcdna3.1-bcl2。
1.4.4细胞转染及bcl-2高表达株的筛选
将已构建的表达载体pcdna3.1-bcl2,通过脂质体转染法转染至mdck细胞,具体操作步骤如下:
1)细胞培养:取6孔培养板,向每孔中加入2ml含1~2×105个细胞培养液,37℃co2培养至40%~60%汇合时(汇合过分,转染后不利筛选细胞),取对数生长期的细胞,沉降,换成无血清的培养液500u1,使细胞密度为3×106cells/ml左右;
2)转染液制备:在聚苯乙稀管中制备以下两液(为转染每一个孔细胞所用的量)a液:用不含血清培养基稀释1-10μg重组质粒pegfp-bcl2,终量100μl,b液:用不含血清培养基稀释2-50μl脂质体lipofectamine2000,终量100μl,轻轻混合a、b液,室温中置10-15min;
3)转染准备:用2ml不含血清培养液漂洗两次,再加入1ml不含血清培养液;
4)转染:把a/b复合物缓缓加入培养液中,摇匀,37℃温箱置6~24小时,吸除无血清转染液,将细胞瓶内培养液换成含400μg/mlg418的gmem培养基,每隔3天换一次培养基,维持g418筛选压力,直至单克隆细胞形成。
5)挑单克隆:制备细胞悬液,细胞计数,用培养基稀释细胞至1个/10ul,在96孔板中加入培养基150ul/孔,加入细胞悬液10ul/孔,再转至48孔中增殖。
6)筛选mdck-bcl-2细胞株:将在g418作用之下产生的bcl-2高表达的一株阳性克隆细胞,命名为mdck-bcl-2,将其分别放大培养。
1.4.5免疫组化法检测mdck细胞中bcl-2基因的表达
将mdck-bcl-2细胞株悬浮培养,收集于1.5ml离心管内,1500rpm离心5min,pbs缓冲液洗涤3次,破膜处理,将bcl-2单抗(fitc标记)溶液20μl加入处理的破膜溶液中,按照单抗使用说明书操作,在常温避光条件下静置15min,1200rpm离心15min,吸弃上清,用pbs缓冲液将沉淀重悬,应用流式细胞仪检测。
2结果
2.1抗凋亡基因bcl-2的pcr扩增产物
抗凋亡基因bcl-2的pcr扩增产物在teb缓冲液中经1.5%琼脂糖凝胶电泳,紫外透射仪下观察电泳条带,可见大小约703bp的片段,与期望值相符,如图1。
2.2pcdna3.1-bcl2真核表达载体的构建和鉴定
将阳性重组载体用ecorⅰ/kpnⅰ双酶切,bamhⅰ单酶切鉴定,酶切产物进行琼脂糖凝胶电泳,如图2。胶体回收,pcr产物送大连宝生物工程有限公司测序。
利用内引物,以初步酶切鉴定为阳性的重组子为模板扩增得到760bp的片段,进一步说明pcdna3.1-bcl2为阳性重组子,如图3。
2.3细胞转染及筛选bcl-2高表达株
将已构建的表达载体pcdna3.1-bcl2,通过脂质体转染法转染至bhk21细胞,各取一定量的已标记的mdck细胞和改造的mdck-bcl-2细胞,分别用流式细胞分析仪进行检测,如图4所示,筛选出的mdck-bcl-2细胞株较对照组阳性表达率显著增高,表明bcl-2基因过表达的mdck细胞株的构建得以实现。
实施例2:bcl-2过表达的mdck细胞株mdck-bcl-2的悬浮培养
1.材料和方法
1.1mdck细胞:经实施例1改造的bcl-2过表达的mdck细胞株。
营养液:购自hyclone公司。新生牛血清购自合格供应商。
1.2仪器和设备:恒温培养振荡器(上海苏坤实业有限公司);细胞分析仪(德国innovatis公司);移液器(eppendorf);倒置显微镜(宁波舜宇仪器有限公司);生物洁净工作台(苏州安泰空气技术有限公司)。
2方法
2.1细胞形态的观察及数目和活力的测定
吸取适量mdck-bcl-2细胞悬液,补加适量细胞营养液至初始密度为0.5×106个/ml,250ml锥形细胞培养瓶悬浮培养。培养参数为温度37.0℃、转速120rpm、ph为6.8~7.4之间,培养时间48h。每传代一次,取样观察及检测细胞生长情况(细胞形态、密度、活率)后,取适量细胞种子补加适量细胞营养液进行细胞批式传代培养。当细胞密度及活率逐渐提高,且趋于稳定,细胞形态正常(圆形、边缘整齐,饱满透亮,大小均匀)时,表明改造的细胞在悬浮培养条件下可依次连续传代培养。同时挑选镜下细胞状态良好,细胞密度3.0×106个细胞/ml,活率92%以上的细胞做为种子,进行细胞冻存,建立可用于规模化悬浮培养的抗凋亡mdck宿主细胞株种子库;
将建立的可用于规模化悬浮培养的抗凋亡mdck宿主细胞株,命名为狗肾细胞mdck-b,分类命名为狗肾细胞mdck-b,该细胞保藏在中国典型培养物保藏中心,地址在中国.武汉.武汉大学,保藏号为cctccno:c2019142,保藏时间为2019年7月17日。
2.2细胞比生长速率(μ)的计算,μ=(㏑x2-㏑x1)/t2-t1,式中:x细胞密度;t为培养时间;
3结果
细胞经抗凋亡改造后,由于对细胞培养液有适应的过程,f1-f4细胞较正常组细胞结团较多,大小不一,分散不均匀;f6-f30代,抗凋亡细胞适应了悬浮培养环境,饱满透亮,大小均匀,细胞液透亮,培养至72h时死细胞少。表明经改造的抗凋亡细胞mdck-b已经适应在悬浮培养条件下生长,如图5-6。培养至48h时细胞倍增数达5倍,细胞活率96%以上,比生长率为3%,说明细胞生长状态较好,生长速度较快,培养至72h时细胞数量达到最大值,细胞密度和活率较正常组mdck细胞和市面上报道的商业化mdck细胞均高,但由于细胞接触抑制现象、培养环境中营养物质的缺乏及代谢副产物的积累限制了细胞的继续增殖,比生长速率和细胞活率较48h时均有所降低,如表1所示。
表1mdck-b细胞和mdck细胞生长情况(×106)、活率(%)、比生长率
实施例3:mdck-b细胞凋亡率的测定
1.材料和方法
1.1mdck细胞:改造的bcl-2过表达的mdck细胞株mdck-b(cctccno:c2019142),试验细胞已传代至f30。
1.2试剂与设备
1.2.1主要试剂:新生牛血清(购自合格供应商);培养基(购自hyclone公司);细胞凋亡试剂盒(invitrogen公司);细胞周期测定试剂盒;谷胱甘肽检测试剂盒;碳酸氢钠、氢氧化钠、盐酸等常用试剂为国产分析纯。
1.2.2主要设备:细胞计数仪(德国innovatis公司);nc3000细胞质量分析仪(brofilenoval公司)。
2方法
2.1细胞凋亡率的测定
将mdck细胞和经改造的mdck-b细胞在同一条件下进行悬浮培养,取对数生长期的细胞,分别在含0.5mol/lnh4cl溶液高的培养基和无血清培养基中培养,建立细胞凋亡模型,跟踪在同一培养条件下,抗凋亡基因过表达的mdck细胞株的细胞凋亡情况,annexinv-pi双染法检测细胞凋亡率。
2.2细胞周期的测定
采用pi染色法,在nc-3000细胞质量分析仪进行细胞周期的测定。
2.3gsh(谷胱甘肽)含量的检测
nc-3000细胞质量分析仪进行还原型谷胱甘肽(gsh)含量测定。
2.4统计学分析
应用spss13.0软件进行统计学处理。
3结果
3.1细胞凋亡率的测定
1)细胞在0.5mol/lnh4cl溶液中细胞凋亡的检测
与正常mdck细胞相比,在培养至48h时,mdck-b细胞发生早期凋亡的细胞数占1.6%左右,而正常组为4.5%,细胞凋亡率显著降低,如图7。
2)细胞在无血清培养基中凋亡的检测
如图8所示,在细胞培养至第3d时,mdck-b细胞凋亡率均明显低于mdck细胞,mdck-b细胞株的凋亡率为3.08%,而正常mdck-细胞株的凋亡率4.82%,差异具有统计学意义(p<0.05),说明mdck-基因过表达有效控制了培养过程中细胞凋亡的发生,达到了实验最终目的。
3.2细胞周期的测定
本试验探索了经改造的抗凋亡细胞株mdck-b批式培养过程中细胞周期分布比例的变化。从图9a-d可见,在培养初期,培养液中营养丰富,细胞在较低密度下接种生长,物质代谢活跃,迅速合成rna和蛋白质,细胞体积显著增大,大部分细胞处于g0/g1和s期,为下阶段s期的dna复制作物质和能量的准备。随着培养时间的延长,细胞逐渐向dna合成期过度,合成dna复制所需要的酶等,最后进入g2/m期,细胞开始分裂增殖,细胞从一代向下一代传递。在批式培养中,由于营养物质缺乏和代谢副产物积累等不利环境因素出现,细胞生长到72h,大部分细胞被阻止在g0/g1期,处于稳定期,此期细胞数量显著增加,细胞不再增殖,最终走向死亡。因此,从细胞周期分布的比例变化可推断细胞生长状态的趋势和增殖情况,为规模化细胞培养中细胞的可持续性培养提供理论参考。
3.3gsh含量的检测
gsh是正常细胞中重要的抗氧化剂,其含量的高低是细胞凋亡与否的早期标志。如图10a、b可见,48h时,细胞进入稳定成熟期,细胞活力达到良好状态,细胞中gsh含量较高,正常组mdck细胞gsh含量高的细胞比例为86%(图10a),mdck-b细胞中gsh含量高的细胞比例为93%(图10b),说明在细胞培养至48h时,较正常组mdck细胞,mdck-b细胞中细胞凋亡率低。
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
- 还没有人留言评论。精彩留言会获得点赞!