一种手性γ-丁内酯衍生物及其合成方法和应用与流程
本发明属于合成医药、化工领域,主要涉及一种光学活性γ-丁内酯衍生物及其合成方法和应用。
背景技术:
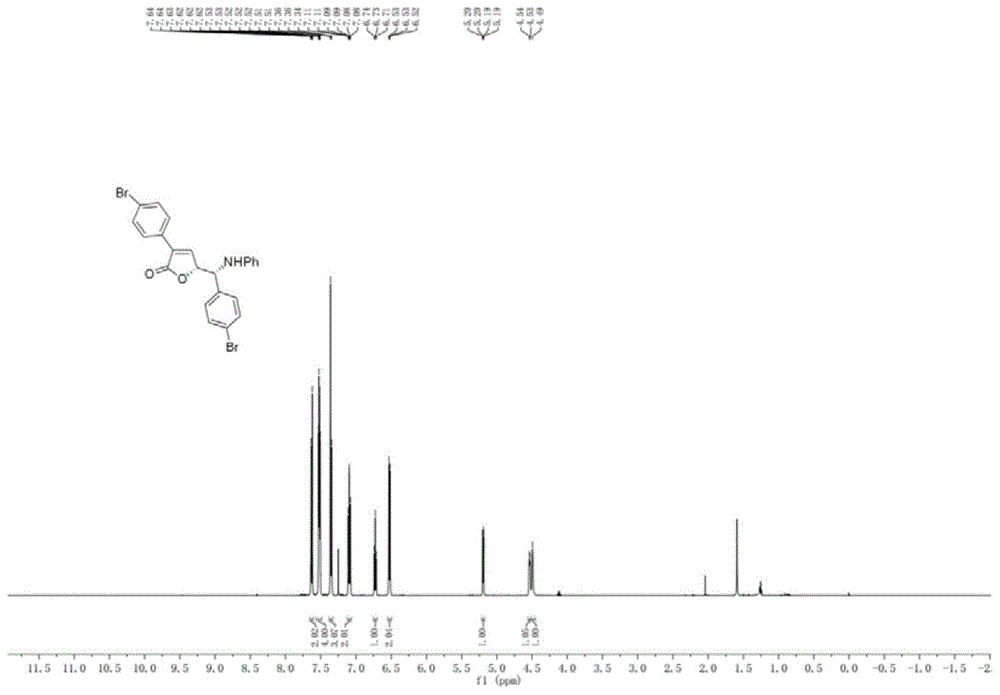
:γ-丁内酯是许多天然产物的基本骨架,超过10%的天然化合物分子包含γ-丁内酯的结构,并被广泛地应用在各个领域,如材料,农业,生物,医药等等。具有光学活性的γ-丁内酯衍生物具有杀菌、抗炎、抗过敏、抗病毒、抗癌、预防风湿、杀虫和除草等作用,同时,通过γ-丁内酯衍生物可方便的合成很多复杂天然产物,有效的合成γ-丁内酯结构一直都是合成方法学和天然产物合成化学的重要研究方向。如今报道的众多光学活性的γ-丁内酯类衍生物合成存在诸多缺点,大多条件苛刻,或是所用原料不稳定或难以获得,合成过程步骤多,收率低,操作极不方便。因此,有必要提供一类结构新颖的光学活性的γ-丁内酯衍生物及其简单、反应条件温和的制备方法,有助于推进γ-丁内酯衍生物的研究和应用。技术实现要素:本发明的目的在于针对现有技术中的不足和缺陷,一种手性γ-丁内酯衍生物。本发明所述手性γ-丁内酯衍生物结构新型,且具有很好的抗癌细胞的作用,尤其是针对人乳腺癌细胞(mcf-7)及人肺腺癌细胞(a549)细胞,具有很好的抑制作用,表现出很好的抗乳腺癌及肺癌细胞的作用,可以制备成为抗乳腺癌及肺癌药物进行应用。本发明的另一目的在于提供所述手性γ-丁内酯衍生物的制备方法。本发明的再一目的在于提供所述手性γ-丁内酯衍生物的应用。本发明的上述目的是通过以下方案予以实现的:一种手性γ-丁内酯衍生物,其结构如式(1)所示:其中,ar1、ar2和ar3各自独立地为苯基、卤代苯基、硝基取代苯基、c1~4烷基取代苯基、c1~4烷氧基取代苯基、c1~4卤代烷基取代苯基、萘基或卤代萘基。优选地,所述ar1、ar2和ar3各自独立地为苯基、卤代苯基、硝基取代苯基、甲基取代苯基、乙基取代苯基、甲氧基取代苯基、乙氧基取代苯基、三氟甲基取代苯基、三氟乙基取代苯基、萘基或卤代萘基。优选地,所述ar1、ar2和ar3各自独立地为苯基、卤代苯基、硝基取代苯基、萘基或卤代萘基。优选地,所述ar1、ar2和ar3各自独立地为苯基、溴苯基、氯苯基、氟苯基、硝基取代苯基或萘基。优选地,所述ar1、ar2和ar3各自独立地为苯基、4-溴苯基、3-溴苯基、2-溴苯基、4-氯苯基、3-氯苯基、2-氯苯基、3,4-二氯苯基、4-氟苯基、3-氟苯基、2-氟苯基、4-硝基-苯基、2-硝基-苯基或萘基。更优选地,所述ar1为苯基或4-溴苯基。更优选地,所述ar2为苯基、4-氟苯基或4-溴苯基。更优选地,所述ar3为苯基、4-氯苯基、4-溴苯基、3,4-二氯苯基、2-硝基-苯基、4-硝基-苯基或萘基。更优选地,所述手性γ-丁内酯衍生物的结构如之一结构式所示:本发明同时还保护所述手性γ-丁内酯衍生物的制备方法,以式(2)所述3-芳基环丙烯羧酸和式(3)所述亚胺为原料,在催化剂的作用下,反应得到式(1)所述手性γ-丁内酯衍生物;其中式(2)和式(3)的结构为:优选地,所述催化剂为双[(α,α,α′,α′-四甲基-1,3-苯二丙酸)铑]和手性磷酸。优选地,所述手性磷酸的结构为:其中,ar为4-cf3c6h4。优选地,所述3-芳基环丙烯羧酸、亚胺、双[(α,α,α′,α′-四甲基-1,3-苯二丙酸)铑]和手性磷酸的反应摩尔比为1.8~2.0:1.0~1.2:0.04~0.1:0.1~0.2;更优选地,反应摩尔比例1.8:1.0:0.04:0.1。优选地,所述反应的温度为-20℃~40℃;更优选地,反应温度为25℃。优选地,所述反应的时间为24~96h;更优选地,反应时间为96h。优选地,所述反应在甲苯、四氢呋喃、氯苯、二氯甲烷、三氯甲烷或乙酸乙酯有机溶剂中进行;更优选地,所述反应在四氢呋喃中进行。所述手性γ-丁内酯衍生物或其药学上可接受的盐在制备抗癌药物中的应用也在本发明的保护范围之内。优选地,所述抗癌药物为抗人乳腺癌细胞及人肺腺癌细胞的药物。与现有技术相比,本发明具有以下有益效果:本发明所述光学活性γ-丁内酯衍生物结构新型,且具有很好的抗癌细胞的作用,尤其是针对人乳腺癌细胞(mcf-7)及人肺腺癌细胞(a549)细胞,具有很好的抑制作用,表现出很好的抗乳腺癌及肺癌细胞的作用,可以制备成为抗乳腺癌及肺癌药物进行应用。同时,本发明化合物的制备方法简单,以廉价易得的化合物为原料,具有反应条件温和、反应步骤少、反应快、产生的废弃物少、操作简单安全、原子经济性高、选择性高、收率高等有益效果。所述化合物制备简单、成本低廉,而且对于乳腺癌及肺癌细胞具有很好的抑制作用,在制备乳腺癌及肺癌治疗药物方面具有极大的应用前景。附图说明图1为实施例1所得产物的1hnmr示意图。图2为实施例1所得产物的13cnmr示意图。图3为实施例2所得产物的1hnmr示意图。图4为实施例2所得产物的13cnmr示意图。图5为实施例3所得产物的1hnmr示意图。图6为实施例3所得产物的13cnmr示意图。图7为实施例4所得产物的1hnmr示意图。图8为实施例4所得产物的13cnmr示意图。图9为实施例5所得产物的1hnmr示意图。图10为实施例5所得产物的13cnmr示意图。图11为实施例6所得产物的1hnmr示意图。图12为实施例6所得产物的13cnmr示意图。图13为实施例7所得产物的1hnmr示意图。图14为实施例7所得产物的13cnmr示意图。图15为实施例8所得产物的1hnmr示意图。图16为实施例8所得产物的13cnmr示意图。图17为实施例9所得产物的1hnmr示意图。图18为实施例9所得产物的13cnmr示意图。图19为实施例10所得产物的1hnmr示意图。图20为实施例10所得产物的13cnmr示意图。具体实施方式下面结合具体实施例对本发明做出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。实施例1化合物3bl的制备将rh2(esp)2(0.008mmol)、手性磷酸(0.02mmol)、3-对溴苯基环丙烯羧酸(0.36mmol)、对溴亚苄基苯胺(0.2mmol)溶解在装有2.5ml四氢呋喃的试管中,于特定温度(25℃)下搅拌,反应96小时,待亚胺反应完毕后,减压旋蒸除去溶剂,得到粗产物。将粗产物进行柱层析(乙酸乙酯:石油醚=1:10-1:3)得到纯产品。产率为91%,dr>95:5,er:93:7。1hnmr(500mhz,cdcl3)δ7.65–7.61(m,2h),7.55–7.49(m,4h),7.38–7.33(m,3h),7.12–7.06(m,2h),6.73(dd,j1=j2=7.4hz,1h),6.55–6.50(m,2h),5.19(dd,j=6.4,1.8hz,1h),5.19(dd,j=6.4,1.8hz,1h),4.53(d,j=6.1hz,1h),4.53(d,j=6.1hz,1h),4.49(s,1h),4.49(s,1h).13cnmr(125mhz,cdcl3)δ170.6,146.2,144.9,137.5,132.4,132.1,132.0,129.3,129.0,128.7,127.8,124.2,122.5,119.1,114.4,82.8,60.9.hrms(esi)m/z:calcd.forc23h17no2br2(m+na)+519.9518,found519.9524.实施例2化合物3aq的制备将rh2(esp)2(0.008mmol)、手性磷酸(0.02mmol)、3-苯基环丙烯羧酸(0.36mmol)、对氟亚苄基对氯苯胺(0.2mmol)溶解在装有2.5ml四氢呋喃的试管中,于特定温度(25℃)下搅拌,反应96小时,待亚胺反应完毕后,减压旋蒸除去溶剂,得到粗产物。将粗产物进行柱层析(乙酸乙酯:石油醚=1:10-1:3)得到纯产品。产率为80%,dr:94:6,er:95:5。1hnmr(500mhz,cdcl3)δ7.76(dd,j1=j2=6.6,3.0hz,2h),7.46–7.37(m,5h),7.32(d,j=1.8hz,1h),7.10(dd,j1=j2=8.5hz,2h),7.05–7.01(m,2h),6.47–6.42(m,2h),5.17(dd,j=6.9,1.7hz,1h),4.57(d,j=3.9hz,1h),4.46(dd,j=6.8,4.2hz,1h).13cnmr(125mhz,cdcl3)δ170.8,162.7(d,j=247.9hz),144.9,144.4,133.8(d,j=3.2hz),133.2,129.9,129.1,129.0,128.92,128.88,128.8,127.1,123.7,116.4,116.2,115.5,82.8,61.2.hrms(esi)m/z:calcd.forc23h17no2fclna(m+na)+416.0824,found416.0814.实施例3化合物3al的制备将rh2(esp)2(0.008mmol)、手性磷酸(0.02mmol)、3-苯基环丙烯羧酸(0.36mmol)、亚苄基对溴苯胺(0.2mmol)溶解在装有2.5ml四氢呋喃的试管中,于特定温度(25℃)下搅拌,反应96小时,待亚胺反应完毕后,减压旋蒸除去溶剂,得到粗产物。将粗产物进行柱层析(乙酸乙酯:石油醚=1:10-1:3)得到纯产品。产率为89%,dr:95:5,er:94.5:5.5。1hnmr(400mhz,cdcl3)δ7.75(dd,j1=j2=6.4,2.7hz,2h),7.49–7.28(m,9h),7.15(d,j=8.7hz,2h),6.41(d,j=8.7hz,2h),5.19(dd,j=7.1,1.2hz,1h),4.61(d,j=3.5hz,1h),4.44(dd,j=6.9,4.1hz,1h).13cnmr(100mhz,cdcl3)δ170.9,145.6,144.8,138.0,133.0,131.9,129.7,129.3,129.1,128.8,127.21,127.15,116.0,110.6,83.0,61.9.hrms(esi)m/z:calcd.forc23h18no2brna(m+na)+442.0413,found442.0408.实施例4化合物3aj的制备将rh2(esp)2(0.008mmol)、手性磷酸(0.02mmol)、3-苯基环丙烯羧酸(0.36mmol)、取代亚胺(0.2mmol)溶解在装有2.5ml四氢呋喃的试管中,于特定温度(25℃)下搅拌,反应96小时,待亚胺反应完毕后,减压旋蒸除去溶剂,得到粗产物。将粗产物进行柱层析(乙酸乙酯:石油醚=1:10-1:3)得到纯产品。产率为91%,dr:88:12,er:94:6。1hnmr(500mhz,cdcl3)δ8.23(d,j=8.5hz,1h),7.94(d,j=8.2hz,1h),7.82(d,j=8.2hz,1h),7.71–7.62(m,4h),7.60–7.54(m,1h),7.45(dd,j1=j2=7.7hz,1h),7.41–7.33(m,4h),7.07(dd,j1=j2=7.8hz,2h),6.69(dd,j1=j2=7.3hz,1h),6.52(d,j=8.0hz,2h),5.83–5.77(m,1h),5.67–5.62(m,1h),4.30(d,j=5.1hz,1h).13cnmr(125mhz,cdcl3)δ170.9,146.1,144.2,134.2,133.3,132.3,130.8,129.7,129.3,129.1,129.0,128.7,127.1,127.0,125.9,125.7,124.7,121.7,118.6,113.9,81.5,55.2.hrms(esi)m/z:calcd.forc27h21no2na(m+na)+414.1465,found414.1468.实施例5化合物3ah的制备将rh2(esp)2(0.008mmol)、手性磷酸(0.02mmol)、3-苯基环丙烯羧酸(0.36mmol)、3,4-二氯亚苄基苯胺(0.2mmol)溶解在装有2.5ml四氢呋喃的试管中,于特定温度(25℃)下搅拌,反应96小时,待亚胺反应完毕后,减压旋蒸除去溶剂,得到粗产物。将粗产物进行柱层析(乙酸乙酯:石油醚=1:10-1:3)得到纯产品。产率为84%,dr:93:7,er:97:3。1hnmr(500mhz,cdcl3)δ7.76(dd,j=6.6,3.0hz,2h),7.61(d,j=1.9hz,1h),7.47(d,j=8.3hz,1h),7.43–7.38(m,3h),7.36(d,j=1.7hz,1h),7.33(dd,j=8.3,2.0hz,1h),7.11(dd,j1=j2=7.9hz,2h),6.75(dd,j1=j2=7.3hz,1h),6.52(d,j=7.8hz,2h),5.21(dd,j=6.2,1.7hz,1h),4.56–4.51(m,1h),4.48(d,j=4.5hz,1h).13cnmr(125mhz,cdcl3)δ170.8,146.0,144.2,139.1,133.44,133.41,132.7,131.1,129.9,129.4,129.2,128.9,128.8,127.2,126.7,119.2,114.3,82.5,60.4.hrms(esi)m/z:calcd.forc23h17no2cl2na(m+na)+432.0529,found432.0525.实施例6化合物3ag的制备将rh2(esp)2(0.008mmol)、手性磷酸(0.02mmol)、3-苯基环丙烯羧酸(0.36mmol)、邻硝基亚苄基苯胺(0.2mmol)溶解在装有2.5ml四氢呋喃的试管中,于特定温度(25℃)下搅拌,反应96小时,待亚胺反应完毕后,减压旋蒸除去溶剂,得到粗产物。将粗产物进行柱层析(乙酸乙酯:石油醚=1:10-1:3)得到纯产品。产率为94%,dr>95:5,er:98:2。1hnmr(500mhz,cdcl3)δ8.09(d,j=8.0hz,1h),7.86–7.79(m,2h),7.77(d,j=7.7hz,1h),7.65(d,j=1.5hz,1h),7.59(dd,j1=j2=7.5hz,1h),7.48(dd,j1=j2=7.7hz,1h),7.45–7.35(m,3h),7.10–7.04(m,2h),6.68(dd,j1=j2=7.3hz,1h),6.46(d,j=8.0hz,2h),5.67(d,j=2.4hz,1h),5.59–5.49(m,1h),4.53(d,j=5.4hz,1h).13cnmr(125mhz,cdcl3)δ171.5,148.7,145.8,145.2,135.3,134.2,133.0,129.8,129.6,129.5,129.1,129.0,128.8,127.2,125.3,119.0,113.7,82.4,53.7.hrms(esi)m/z:calcd.forc23h18no4na(m+na)+409.1159,found409.1159.实施例7化合物3ae的制备将rh2(esp)2(0.008mmol)、手性磷酸(0.02mmol)、3-苯基环丙烯羧酸(0.36mmol)、对硝基亚苄基苯胺(0.2mmol)溶解在装有2.5ml四氢呋喃的试管中,于特定温度(25℃)下搅拌,反应96小时,待亚胺反应完毕后,减压旋蒸除去溶剂,得到粗产物。将粗产物进行柱层析(乙酸乙酯:石油醚=1:10-1:3)得到纯产品。产率为91%,dr:92:8,er:97:3。1hnmr(500mhz,cdcl3)δ8.24(d,j=8.5hz,2h),7.75(dd,j=6.5,2.6hz,2h),7.68(d,j=8.6hz,2h),7.44–7.36(m,4h),7.10(dd,j1=j2=7.8hz,2h),6.74(dd,j1=j2=7.3hz,1h),6.51(d,j=8.4hz,2h),5.30(dd,j=5.8,1.7hz,1h),4.80–4.73(m,1h),4.55(d,j=3.9hz,1h).13cnmr(125mhz,cdcl3)δ170.7,148.0,146.1,145.7,144.0,133.6,130.0,129.4,128.81,128.75,128.3,127.2,124.3,119.4,114.3,82.3,60.4.hrms(esi)m/z:calcd.forc23h18no4na(m+na)+409.1159,found409.1153.实施例8化合物3ac的制备将rh2(esp)2(0.008mmol)、手性磷酸(0.02mmol)、3-苯基环丙烯羧酸(0.36mmol)、对氟亚苄基苯胺(0.2mmol)溶解在装有2.5ml四氢呋喃的试管中,于特定温度(25℃)下搅拌,反应96小时,待亚胺反应完毕后,减压旋蒸除去溶剂,得到粗产物。将粗产物进行柱层析(乙酸乙酯:石油醚=1:10-1:3)得到纯产品。产率为92%,dr:89:11,er:95:5。1hnmr(500mhz,cdcl3)δ7.80–7.73(m,2h),7.48–7.44(m,2h),7.42–7.37(m,3h),7.34(d,j=1.8hz,1h),7.14–7.05(m,4h),6.72(dd,j1=j2=7.3hz,1h),6.54(d,j=7.7hz,2h),5.21(dd,j=6.3,1.6hz,1h),4.60–4.49(m,2h).13cnmr(125mhz,cdcl3)δ170.9,162.7(d,j=247.4hz),146.4,144.7,134.2(d,j=3.2hz),133.1,129.8,129.2,129.04,129.01,128.9,128.8,127.2,119.0,116.2,116.1,114.4,82.9,61.0.hrms(esi)m/z:calcd.forc23h18no2fna(m+na)+382.1214,found382.1205.实施例9化合物3ab的制备将rh2(esp)2(0.008mmol)、手性磷酸(0.02mmol)、3-苯基环丙烯羧酸(0.36mmol)、对氯亚苄基苯胺(0.2mmol)溶解在装有2.5ml四氢呋喃的试管中,于特定温度(25℃)下搅拌,反应96小时,待亚胺反应完毕后,减压旋蒸除去溶剂,得到粗产物。将粗产物进行柱层析(乙酸乙酯:石油醚=1:10-1:3)得到纯产品。产率为87%,dr>95:5,er:96:4。1hnmr(500mhz,cdcl3)δ7.79–7.72(m,2h),7.44–7.33(m,8h),7.12–7.06(m,2h),6.72(dd,j1=j2=7.3hz,1h),6.55–6.50(m,2h),5.19(dd,j=6.4,1.6hz,1h),4.58–4.45(m,2h).13cnmr(125mhz,cdcl3)δ170.9,146.3,144.6,137.1,134.3,133.2,129.8,129.4,129.3,129.0,128.8,128.7,127.2,119.0,114.4,82.8,61.0.hrms(esi)m/z:calcd.forc23h18no2clna(m+na)+398.0918,found398.0913.实施例10化合物3aa的制备将rh2(esp)2(0.008mmol)、手性磷酸(0.02mmol)、3-苯基环丙烯羧酸(0.36mmol)、对氯亚苄基苯胺(0.2mmol)溶解在装有2.5ml四氢呋喃的试管中,于特定温度(25℃)下搅拌,反应96小时,待亚胺反应完毕后,减压旋蒸除去溶剂,得到粗产物。将粗产物进行柱层析(乙酸乙酯:石油醚=1:10-1:3)得到纯产品。产率为90%,dr:90:10,er:95:5。1hnmr(500mhz,cdcl3)δ7.85–7.74(m,2h),7.62–7.50(m,2h),7.46–7.35(m,6h),7.12(dd,j1=j2=7.1hz,2h),6.76(dd,j1=j2=7.3hz,1h),6.55(d,j=7.5hz,2h),5.23(d,j=6.0hz,1h),4.59–4.45(m,2h).13cnmr(125mhz,cdcl3)δ170.9,146.2,144.5,137.6,133.2,132.3,129.8,129.3,129.01,128.98,128.8,127.2,122.5,119.0,114.4,82.7,61.1.hrms(esi)m/z:calcd.forc23h18no2brna(m+na)+442.0413,found442.0415.实施例11活性测试:1、采用cck-8法测定化合物对于人乳腺癌细胞(mcf-7)增殖抑制效果。具体测试过程如下:(1)将mcf-7细胞株制成单细胞悬液,100ul接种于96孔培养板中,单细胞悬液的浓度为6000细胞/孔,co2培养箱(37℃,5%co2,95%空气)过夜培养;(2)化合物分别用dmso溶解,配制成3.3mm的母液,取0.3ul加入到上述每孔细胞中,使终浓度为10um。对照组加入0.3ul的dmso使终浓度为0.3%,co2培养箱中培养48小时;其中,mcf-7细胞采用dmem培养基(10%含新生牛血清、1%双抗)(3)培养48小时后每孔细胞加入10ul的cck-8试剂,37℃孵育2小时后,使用biotek多功能酶标仪测450nm处吸光度a,计算对肿瘤细胞生长的抑制率;(4)抑制率的计算方法为[1-(a药物处理组-a空白对照)/(a无药物处理组-a空白对照)]x100%,a为吸光度。2、采用cck-8法测定化合物对于人肺腺癌细胞(a549)增殖抑制效果。具体测试过程如下:(1)将a549细胞株制成单细胞悬液,100ul接种于96孔培养板中,单细胞悬液的浓度为6000细胞/孔,co2培养箱(37℃,5%co2,95%空气)过夜培养;(2)化合物分别用dmso溶解,配制成3.3mm的母液,取0.3ul加入到上述每孔细胞中,使终浓度为10um。对照组加入0.3ul的dmso使终浓度为0.3%,co2培养箱中培养48小时;其中,a549细胞采用1640培养基(10%含新生牛血清、1%双抗)(3)培养48小时后每孔细胞加入10ul的cck-8试剂,37℃孵育1小时后,使用biotek多功能酶标仪测450nm处吸光度a,计算对肿瘤细胞生长的抑制率;(4)抑制率的计算方法为[1-(a药物处理组-a空白对照)/(a无药物处理组-a空白对照)]x100%,a为吸光度。表1为化合物对于人乳腺癌细胞(mcf-7)和人肺腺癌细胞(a549)增殖抑制结果。表1化合物抑制mcf-7及a549细胞的抑制率测试结果测样序号样品编号mcf-7抑制率%(10um)a549抑制率%(10um)13bl123023aq746733al746643aj355253ah696963ag72173ae81983ac152393ab7269103aa7678从表格中的检测结果来看,上述化合物在10um浓度下,对于人乳腺癌细胞(mcf-7)和人肺腺癌细胞(a549)表现出较好的抑制作用,尤其是化合物3aq、3al、3ah、3ab和3aa对人乳腺癌细胞(mcf-7)和人肺腺癌细胞(a549)同时表现出较好的抑制作用,其抑制率均高于66%。上述结果表明,本发明制备的化合物可以开发制备为治疗乳腺癌及肺癌的药物。最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,对于本领域的普通技术人员来说,在上述说明及思路的基础上还可以做出其它不同形式的变化或变动,这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1