一种用于G-四链体RNA荧光探针的苯并吲哚衍生物及其制备方法和应用与流程
本发明属于g-四链体rna检测技术领域,更具体地,涉及一种用于g-四链体rna荧光探针的苯并吲哚衍生物及其制备方法和应用。
背景技术:
核酸(nucleicacids)是一种通常位于细胞核内的大型生物分子,主要负责生物体遗传信息的携带和传递,是脱氧核糖核酸(dna)和核糖核酸(rna)的总称。核酸存在于所有动植物细胞、微生物和病毒、噬菌体内,是生命的最基本物质之一,对生物的成长、遗传、变异等现象起着重要的决定作用。g-四链体(g-quadruplex)是由富含鸟嘌呤g的dna或rna序列形成的二级结构,包括平行的g4,反平行的g4以及混合结构的g4,因而呈现了多型性。人体中有大量的富g序列,主要分布于端粒和原癌基因启动子区域,这些序列与细胞调控过程紧密相关。
rna作为重要的信息和功能分子,参与基因反转录、基因调控、蛋白质翻译等诸多生物学过程,而g-四链体广泛分布在rna的各个位置,五成以上的信使rna(mrna)带有可形成g-四链体的基因序列,特别是mrna非翻译区(utr)3′-utr及5′-utr。utr区的g-四链体的密度是蛋白编码区的4~5倍,鉴于utr对rna的转录过程、转录后修饰、细胞内转运以及翻译过程的重要作用,推测g-四链体结构可能参与rna表达调控。生物学实验已经发现,由5'和3'-utr形成的g-四链体可以抑制30-70%mrna的翻译。g-四链体可能通过结合一些蛋白质因子和microrna(mirna)抑制核糖体的形成,从而调节蛋白质的表达效率。此外,有研究表明,人体内g-四链体dna的含量为g-四链体rna的含量的千分之一。因此,可以在体内或体外实验中特异性检测g-四链体rna的存在,这对于研究g-四链体rna的生物学功能和开发靶向g四链体rna的抗癌药物等方面都起着非常重要的作用。
当前,对于体内和体外检测g-四链体dna结构的研究已经取得了一定的进展,甚至有一些荧光分子已经能够实现g-四链体dna的体内和体外检测。然而,关于荧光探针在体内或体外能特异性识别g-四链体rna的报道很少,鉴于g-四链体rna的可能存在重要的生物学功能,因此,设计和合成靶向g-四链体rna的荧光探针来追踪g-四链体rna在体内外的动态折叠过程以及对生物体正常生命活动的影响显得尤为重要。
技术实现要素:
为了解决上述现有技术存在的不足和缺点,提供一种用于g-四链体rna荧光探针的苯并吲哚衍生物,该苯并吲哚衍生物可作为在体内外有特异选择性检测g-四链体rna的荧光探针。
本发明另一目的在于提供上述苯并吲哚衍生物的制备方法。
本发明再一目的在于提供上述的苯并吲哚衍生物的应用,该苯并吲哚衍生物可作为荧光探针在体内外特异性地识别g-四链体rna,并不受其它组分的干扰,可以实现对g-四链体rna的实时检测。
本发明的目的通过下述技术方案来实现:
一种用于g-四链体rna荧光探针的苯并吲哚衍生物,所述苯并吲哚衍生物的分子结构如式(ⅰ)所示:
其中,r选自羟基、酰胺基、羧基或磷酸基,所述n为碳原子数,n=1~6。
优选地,所述r为羧基,n=1;r为羧基,n=2;r为酰胺,n=1时,所述苯并吲哚衍生物分别为bybc-1、bybc-2、bybx,其分子结构如式(a)、(b)和(c)所示;
所述的用于g-四链体rna荧光探针的苯并吲哚衍生物的制备方法,包括以下步骤:
s1.将2-甲硫基苯并噻唑和碘甲烷溶于有机溶剂a中,在60~90℃反应8~16h,反应结束后加入乙酸乙酯析出固体,收集析出的固体,得到3-甲基-2-(甲硫基)苯并[d]噻唑碘化物(ⅴ);
s2.将1,1,2-三甲基-1h-苯并[e]吲哚(ⅵ)和溴代酰化物(ⅶ)溶于有机溶剂b中,在80~120℃反应8~16h,反应结束后加入乙酸乙酯析出固体,收集析出的固体,得到1,1,2-三甲基-1h-苯并[e]吲哚衍生物(ⅷ);
s3.将3-甲基-2-(甲硫基)苯并[d]噻唑碘化物(ⅴ)和1,1,2-三甲基-1h-苯并[e]吲哚衍生物(ⅷ)溶解于有机溶剂c中,在催化剂的存在下,在60~90℃反应8~16h,反应结束后加入乙酸乙酯析出固体,收集析出的固体后进行重结晶,得到苯并吲哚衍生物(ⅰ);
优选地,步骤s1中所述有机溶剂a为乙腈、二甲基亚砜、环丁砜或甲苯中的一种以上。
优选地,步骤s2中所述的溴代酰化物(ⅶ)为2-溴乙酸、3-溴乙酸或2-溴乙酰胺;所述有机溶剂b为乙腈、环丁砜或甲苯中的一种以上。
优选地,步骤s3中所述1,1,2-三甲基-1h-苯并[e]吲哚衍生物(ⅷ)为1,1,2-三甲基-3-(羧甲基)-1h-苯并[e]吲哚-3-溴化铵(x)、1,1,2-三甲基-3-(2-羧乙基)-1h-苯并[e]吲哚-3-溴化铵(ⅺ)、1,1,2-三甲基-3-(2-氨基-2-氧代乙基)-1h-苯并[e]吲哚-3-溴化铵(ⅻ);所述有机溶剂c为乙腈或/和二甲基甲酰胺;所述催化剂为三乙胺、哌啶、4-甲基哌啶或吡啶中的一种以上。
更为优选地,所述2-甲硫基苯并噻唑和碘甲烷的摩尔比为1:2;在该反应中,碘甲烷需要过量以保证反应完全,同时碘甲烷具有一定的挥发性,在避免浪费的前提下,摩尔比为1:2能保证节约且反应完全。
优选地,步骤s1中所述2-甲硫基苯并噻唑和碘甲烷的摩尔比为1:(1.2~3);所述碘甲烷和有机溶剂a的体积比为1:(6~10);步骤s2中所述1,1,2-三甲基-1h-苯并[e]吲哚(ⅵ)和溴代酰化物(ⅶ)的摩尔比为1:(1.2~3);所述1,1,2-三甲基-1h-苯并[e]吲哚(ⅵ)和溴代酰化物(ⅶ)的总量和有机溶剂b的摩尔比为1:(10~20)。
更为优选地,所述1,1,2-三甲基-1h-苯并[e]吲哚(ⅵ)和溴代酰化物(ⅶ)的摩尔比为1:2。在该反应中,相对容易处理除去的溴代酰化物(ⅶ)需要过量以保证反应完全,同时溴代酰化物(ⅶ)容易被潮解,在避免浪费的前提下,摩尔比为1:2能保证节约且反应完全。
优选地,步骤s3中所述3-甲基-2-(甲硫基)苯并[d]噻唑碘化物(ⅴ)和1,1,2-三甲基-1h-苯并[e]吲哚衍生物(ⅷ)的摩尔比为(1~2):1;所述3-甲基-2-(甲硫基)苯并[d]噻唑碘化物(ⅴ)和1,1,2-三甲基-1h-苯并[e]吲哚衍生物(ⅷ)的总量和有机溶剂c的摩尔比为1:(20~40);所述催化剂和3-甲基-2-(甲硫基)苯并[d]噻唑碘化物(ⅴ)的摩尔比为1:(1~3)。
更为优选地,所述3-甲基-2-(甲硫基)苯并[d]噻唑碘化物(ⅴ)和1,1,2-三甲基-1h-苯并[e]吲哚衍生物(ⅷ)的摩尔比为1:1;化合物(ⅴ)和(ⅷ)都相对稳定,在摩尔比为1:1的情况下能反应完全,且减轻了后处理的难度。
更为优选地,所述催化剂和3-甲基-2-(甲硫基)苯并[d]噻唑碘化物(ⅴ)的摩尔比为1:3。当催化剂与(ⅴ)的摩尔比低于1:3时,反应时间需要明显加长,同时考虑到tea的毒性,故使用1:3的摩尔比的效果更好。
所述的苯并吲哚衍生物作为荧光探针在体内外特异性检测g-四链体rna中的应用。
优选地,所述g-四链体rna为bcl2、vegf或nras中的一种以上。
本发明的化合物(ⅴ)、化合物(ⅵ)、化合物(ⅶ)、化合物(ⅷ)的分子结构式如下所示:
与现有技术相比,本发明具有以下有益效果:
1.本发明的苯并吲哚衍生物作为荧光探针在体内外可以特异性地检测识别g-四链体rna,而且检测过程不受其他组分的干扰,具有荧光强度高、抗干扰能力强的特点。
2.本发明的苯并吲哚衍生物的制备过程简单、成本低廉,并且结构稳定,便于储存,在g-四链体rna生物学功能研究上具有广阔的应用空间。
附图说明
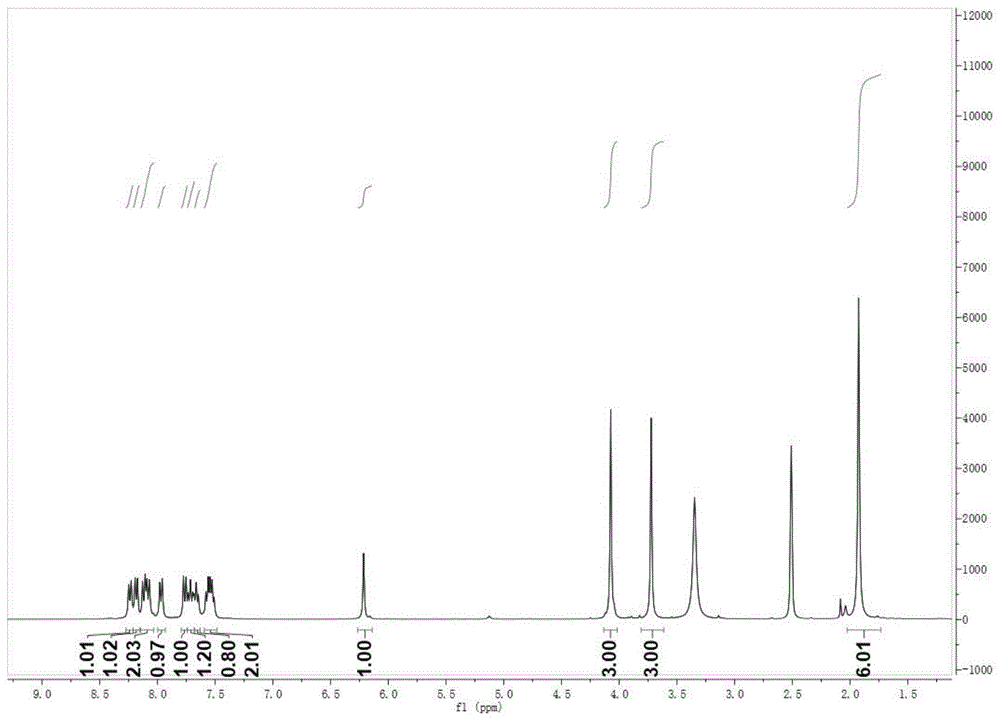
图1为实施例5中化合物bybc-1的氢谱。
图2为实施例6中化合物bybc-2的氢谱。
图3为实施例7中化合物bybx的氢谱。
图4为实施例5-7合成的化合物滴定不同类型核酸的荧光柱状图。
图5为实施例5-7合成的化合物在缓冲液中对不同核酸的荧光效果图。
图6为实施例6中化合物在宫颈癌细胞-海拉细胞(hela)及该化合物在宫颈癌细胞-海拉细胞(hela)中rnase酶解、dnase酶解成像图。
具体实施方式
下面结合具体实施例进一步说明本发明的内容,但不应理解为对本发明的限制。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
实施例1:3-甲基-2-(甲硫基)苯并[d]噻唑碘化物(ⅴ)的合成
称取1g(1.103mmol/l)的2-甲硫基苯并噻唑(ⅸ)置于防爆瓶中,8ml乙腈作为溶剂,超声振荡使两者混合均匀;通风橱条件下,加入碘甲烷(2.206mmol/l),将反应体系置于油浴锅中在90℃并打开磁力搅拌反应8h;反应结束后,体系冷却至室温,再加入10ml乙酸乙酯充分振荡,静置15min,析出固体,真空过滤,并用5ml乙酸乙酯冲洗滤饼,烘干,制得1.07g白色固体3-甲基-2-(甲硫基)苯并[d]噻唑碘化物(ⅴ),反应方程式如式(1)所示,薄板层析显示无副产物,粗产率为60%。
实施例2:1,1,2-三甲基-3-(羧甲基)-1h-苯并[e]吲哚-3-溴化铵(x)的合成
称取0.2g(0.956mmol/l)的1,1,2-三甲基-1h-苯并[e]吲哚(ⅵ)和0.266g(1.292mmol/l)的2-溴乙酸于防爆瓶中,2ml乙腈作为溶剂,超声3min使两者混合均匀,将反应体系置于由于锅中在90℃并打开磁力搅拌反应8h;反应结束后,体系冷却至室温后,加5ml乙酸乙酯充分振荡,静置15min,析出固体,真空过滤,并用3ml乙酸乙酯冲洗滤饼,烘干得到0.252g灰黑色固体1,1,2-三甲基-3-(羧甲基)-1h-苯并[e]吲哚-3-溴化铵(x),反应方程式如式(2)所示,薄板层析显示无副产物,粗产率为76%。
实施例3:1,1,2-三甲基-3-(2-羧乙基)-1h-苯并[e]吲哚-3-溴化铵(ⅺ)的合成
称取0.2g(0.956mmol/l)的1,1,2-三甲基-1h-苯并[e]吲哚(ⅵ)和0.292g(1.292mmol/l)的3-溴丙酸于防爆瓶中,2ml乙腈作为溶剂,超声3min使两者混合均匀,将反应体系置于由于锅中在90℃并打开磁力搅拌反应8h;待反应结束后,体系冷却至室温后,加5ml乙酸乙酯充分振荡,静置15min,析出固体,真空过滤,并用3ml乙酸乙酯冲洗滤饼,烘干得到0.277g灰黑色固体1,1,2-三甲基-3-(2-羧乙基)-1h-苯并[e]吲哚-3-溴化铵(ⅺ),反应方程式如式(3)所示,薄板层析显示无副产物,粗产率为80%。反应方程式如下:
实施例4:1,1,2-三甲基-3-(2-氨基-2-氧代乙基)-1h-苯并[e]吲哚-3-溴化铵(ⅻ)的合成
称取0.2g(0.956mmol/l)的1,1,2-三甲基-1h-苯并[e]吲哚(ⅵ)和0.264g(1.292mmol/l)的2-溴乙酰胺于防爆瓶中,2ml乙腈作为溶剂,超声3min使两者混合均匀,将反应体系置于由于锅中在90℃并打开磁力搅拌反应8h;待反应结束后,体系冷却至室温后,加5ml乙酸乙酯充分振荡,静置15min,析出固体,真空过滤,并用3ml乙酸乙酯冲洗滤饼,烘干得到0.256g灰黑色固体1,1,2-三甲基-3-(2-氨基-2-氧代乙基)-1h-苯并[e]吲哚-3-溴化铵(ⅻ),反应方程式如式(4)所示,薄板层析显示无副产物,粗产率为77%。
实施例5化合物bybc-1(a)的合成
称取0.2g(0.618mmol/l)实施例1所得3-甲基-2-(甲硫基)苯并[d]噻唑碘化物(ⅴ)和0.215g(0.618mmol/l)实施例2所得1,1,2-三甲基-3-(羧甲基)-1h-苯并[e]吲哚-3-溴化铵(x)于防爆瓶中,加入30μl(0.206mmol/l)三乙胺(tea)和3ml二甲基甲酰胺(dmf)溶解,超声3min使之混合均匀,将反应体系置于油浴锅中在75℃并打开磁力搅拌反应8h;待反应结束后,体系冷却至室温后,加入5ml乙酸乙酯充分振荡,静置15min,析出固体,真空过滤,并用3ml乙酸乙酯冲洗滤饼,将得到的固体进行重结晶,得到0.23g红棕色固体1,1-二甲基-3-(羧甲基)-2-((3-甲基苯并[d]噻唑-2(3h)-亚烷基)甲基)-1h-苯并[e]吲哚-3-溴化铵,简写为bybc-1(a),反应方程式如式(5)所示,粗产率为75%。
图1为实施例5中化合物bybc-1的氢谱。从图1可知,氢谱数据为:1hnmr(400mhz,dmso)δ8.24(d,j=8.4hz,1h),8.18(d,j=7.9hz,1h),8.10(dd,j=14.7,8.5hz,2h),7.97(d,j=8.3hz,1h),7.76(d,j=8.7hz,1h),7.71(dd,j=14.0,5.9hz,1h),7.66(d,j=7.7hz,1h),7.59–7.49(m,2h),6.21(s,1h),4.07(s,3h),3.72(s,3h),1.93(s,6h)。
实施例6化合物bybc-2(b)的合成
称取0.2g(0.618mmol/l)实施例1所得3-甲基-2-(甲硫基)苯并[d]噻唑碘化物(ⅴ)和0.217g(0.618mmol/l)实施例3所得1,1,2-三甲基-3-(2-羧乙基)-1h-苯并[e]吲哚-3-溴化铵(ⅺ)于防爆瓶中,加入30μl(0.206mm)三乙胺(tea)和3ml二甲基甲酰胺(dmf)溶解,超声3min使之混合均匀,将反应体系置于油浴锅中正在75℃并打开磁力搅拌反应8h;待反应结束后,体系冷却至室温后,加入5ml乙酸乙酯充分振荡,静置15min,析出固体,真空过滤,并用3ml乙酸乙酯冲洗滤饼,将得到的固体进行重结晶,得到0.25g红棕色固体1,1-二甲基-3-(2-羧乙基)-2-((3-甲基苯并[d]噻唑-2(3h)-亚烷基)甲基)-1h-苯并[e]吲哚-3-溴化铵,简写为bybc-2(b),反应方程式如式(6)所示,粗产率为79%。
图2为实施例6中化合物bybc-2的氢谱。从图2可知,氢谱数据为:1hnmr(400mhz,dmso)δ12.57(s,1h),8.20(t,j=8.0hz,2h),8.07(dd,j=8.4,5.1hz,2h),8.00(d,j=8.4hz,1h),7.73(t,j=8.7hz,2h),7.67(t,j=7.3hz,1h),7.58(t,j=7.7hz,1h),7.52(t,j=7.5hz,1h),6.26(s,1h),4.55(t,j=6.7hz,2h),4.09(s,3h),2.80(t,j=6.7hz,2h),2.05(s,6h)。
实施例7化合物bybx(c)的合成
称取0.2g(0.618mmol/l)实施例1所得3-甲基-2-(甲硫基)苯并[d]噻唑碘化物(ⅴ)和0.215g(0.618mmol/l)实施例4所得1,1,2-三甲基-3-(2-氨基-2-氧代乙基)-1h-苯并[e]吲哚-3-溴化铵(ⅻ)于防爆瓶中,加入30μl(0.206mm)三乙胺(tea)和3ml二甲基甲酰胺(dmf)溶解,超声3min使之混合均匀,将反应体系置于油浴锅中在75℃并打开磁力搅拌反应8h;待反应结束后,体系冷却至室温后,加入5ml乙酸乙酯充分振荡,静置15min,析出固体,真空过滤,并用3ml乙酸乙酯冲洗滤饼,将得到的固体进行重结晶,得到0.236g红棕色固体1,1-二甲基-3-(2-氨基-2-氧代乙基)-2-((3-甲基苯并[d]噻唑-2(3h)-亚烷基)甲基)-1h-苯并[e]吲哚-3-溴化铵,简写为bybx(c),反应方程式如式(7)所示,粗产率为77%。
图3为实施例7中化合物bybx的氢谱。从图3可知,氢谱数据为:1hnmr(400mhz,dmso)δ8.20(s,2h),8.01(d,j=26.3hz,4h),7.70(d,j=23.6hz,2h),7.57(s,4h),6.12(s,1h),4.97(s,2h),4.03(s,3h),2.05(s,6h)。
实施例8实施例5-7合成的化合物作为荧光探针对不同核酸选择性的荧光光谱
将实施例5-7合成的化合物bybc-1、bybc-2和bybx分别稀释成浓度为1μmol/l,再加入不同种类的核酸用荧光分光光度计(狭缝宽度=10,扫描速度=200nm,化合物bybc-1:ex=457nm;化合物bybc-2:ex=457nm;化合物bybcx:ex=457nm)测出其各自的荧光强度。图4为实施例5-7合成的化合物滴定不同类型核酸的荧光柱状图。其中,(a)为bybc-1,(b)为bybc-2,(c)为bybx。不同类型核酸如表1所示,分别为dt21、da21、4a4t、4at、ds12、dnahairpin、rnahairpin、rrna、bcl2、tel22、vegf及nras共12种。从图4可以看出,在体外条件下,化合物bybc-1、bybc-2及bybx在体外实验中对g-四链体rna的选择性大大提高,具有很好的核酸区分性。
实施例9实施例5-7合成的化合物分别在水溶液中对不同核酸进行检测
将实施例5-7合成的化合物bybc-1、bybc-2和bybx分别稀释成浓度为1μmol/l,再加入不同种类的核酸,用紫外灯观察三种化合物使不同核酸的发光程度。图5为实施例5-7合成的化合物在缓冲液中对不同核酸的荧光效果图。其中,不同类型核酸为dt21、ds12、rrna、rnahairpin、rnatel22、rnabcl2、rnavegf及rnanras共8种。从图5可以看出,在水溶液中,化合物bybc-1、bybc-2及bybx对g-四链体rna-bcl2、vegf以及nras的响应程度明显高于其它非g-四链体rna核酸,具有很好的核酸区分性。
表1核酸序列
实施例10化合物bybc-2细胞成像实验
将宫颈癌细胞-海拉细胞(hela)接种在6孔板中的细胞培养液,使细胞的密度约为5000个/ml,然后在37℃、5%co2环境下培养70h。接着弃去上步6孔板中的细胞培养液,用预冷的1×pbs洗3次,然后再加入预冷的纯甲醇1.5ml常温避光放置5min。弃去上步6孔板中的溶液,用预冷的1×pbs洗3次,在上述6孔板中加入1ml5um的化合物bybc-2然后放置30min。弃去上步6孔板中的化合物溶液,用预冷的1×pbs洗3次,在上述6孔板中加入5um的dapi溶液1ml并37℃放置5min,然后再用预冷的1×pbs洗6次,每次浸泡5min,最后在倒置荧光显微镜下观察细胞染色情况。
将宫颈癌细胞-海拉细胞(hela)接种在6孔板中的细胞培养液,使细胞的密度约为5000个/ml,然后在37℃、5%co2环境下培养70h。接着弃去上步6孔板中的细胞培养液,用预冷的1×pbs洗3次,然后再加入预冷的纯甲醇1.5ml常温避光放置5min。弃去上步6孔板中的溶液,用预冷的1×pbs洗3次,在上述6孔板中加入1ml5um的化合物bybc-2然后放置30min。弃去上步6孔板中的化合物溶液,用预冷的1×pbs洗3次,在上述6孔板中加入5um的dapi溶液1ml并37℃放置5min,然后再用预冷的1×pbs洗6次,每次浸泡5min。弃去上步6孔板中的dapi溶液,用预冷的1×pbs洗3次,在上述6孔板中加入dnase溶液1ml并37℃放置1h。弃去上步6孔板中的溶液,用1×pbs洗3次,每次5分钟,最后在倒置荧光显微镜下观察细胞染色情况最后在倒置荧光显微镜下观察细胞染色情况。
将宫颈癌细胞-海拉细胞(hela)接种在6孔板中的细胞培养液,使细胞的密度约为5000个/ml,然后在37℃、5%co2环境下培养70h。接着弃去上步6孔板中的细胞培养液,用预冷的1×pbs洗3次,然后再加入预冷的纯甲醇1.5ml常温避光放置5min。弃去上步6孔板中的溶液,用预冷的1×pbs洗3次,在上述6孔板中加入1ml5um的化合物bybc-2然后放置30min。弃去上步6孔板中的化合物溶液,用预冷的1×pbs洗3次,在上述6孔板中加入5um的dapi溶液1ml并37℃放置5min,然后再用预冷的1×pbs洗6次,每次浸泡5min。弃去上步6孔板中的dapi溶液,用预冷的1×pbs洗3次,在上述6孔板中加入rnase溶液1ml并37℃放置1h。弃去上步6孔板中的溶液,用1×pbs洗3次,每次5分钟,最后在倒置荧光显微镜下观察细胞染色情况最后在倒置荧光显微镜下观察细胞染色情况。
图6为实施例6中化合物在宫颈癌细胞-海拉细胞(hela)及该化合物在宫颈癌细胞-海拉细胞(hela)中rnase酶解、dnase酶解成像图。从图6中可看出,化合物bybc-2在hela细胞中主要染色位置为细胞质,这与g-四链体rna主要分布在细胞质是一致的。当加入dna酶酶解之后,染色并没有消失。相反地,加入rna酶酶解之后,细胞染色消失了,这说明化合物bybc-2染色的是rna,再结合图4的结果,可以得出化合物bybc-2可以在细胞中选择性的结合g-四链体rna,并产生荧光。
本发明的结果说明,苯并吲哚衍生物对g-四链体rna具有较高的特异性,可以在体内外特异性地区分g-四链体rna和非g-四链体rna。因此,可以开发成g-四链体rna荧光探针,在体内外对g-四链体rna的动态折叠过程进行追踪,研究其对生物体生命活动的影响。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合和简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!