一种官能化双嵌段共聚物及其制备方法和用途与流程
本申请涉及有机化学和高分子化学领域,特别是涉及一种官能化双嵌段共聚物及其制备方法和用途,这些用途主要包含肿瘤影像探针试剂和肿瘤治疗药物制剂。
背景技术:
恶性肿瘤(癌症)已经成为威胁人类生命的主要原因之一并且逐年攀升。根据中国国家癌症中心发布的2019年全国癌症报告,在中国,恶性肿瘤已成为严重威胁中国人群健康的主要公共卫生问题之一,最新的统计数据显示,恶性肿瘤死亡占居民全部死因的23.91%,导致医疗花费超过2200亿。2015年全国恶性肿瘤发病约392.9万例,死亡233.8万例。
目前,癌症治疗包括手术切除、化学疗法、放射疗法、免疫疗法等治疗方法。手术切除是治疗中早期实体肿瘤的最有效的手段,通常由外科医生在外科手术过程中,依靠术前的影像诊断、术中的临床经验(包括视觉辨别和触碰感觉等)、及其他临床辅助手段来判断肿瘤的边界并对病灶部位实施切除。但由于肿瘤基本上是非均相分布的组织,且各种不同类型的肿瘤具有不同的边界特征,造成肿瘤边界在手术过程中难以精准判断。因此,外科手术的过度切除可能严重影响病人术后生活质量(例如,乳腺癌的全乳切除;甲状腺癌手术中未能保留健康的甲状旁腺;低位直肠癌手术中引起的肛门保留问题等),切除不足则易复发(例如,非侵犯性膀胱癌电切手术因切除不净引起的高复发率)。因此,在手术过程中精准判断肿瘤病灶部位的边界成为外科手术成功的关键因素。
在肿瘤切除的手术过程中,通常外科医生需要根据术前的影像诊断及病人的病理分期,决定是否需要进行淋巴清扫,切除可能转移的癌组织。通常情况下,医生会选择切取病人的组织,在手术过程中(病人仍处于麻醉的状态下),送病理科对标本进行取材,进行快速的冰冻病理诊断后将结果回馈给手术医师,以便其决定相关组织的清扫范围和程度。一般来说,整个快速冰冻病理检查过程需要大约45分钟到数个小时,在此期间,手术室内的医护团队和医护资源全部处于待命,并且病人在手术室等待的过程中也增加了感染及延长麻醉时间的风险。因此,除了肿瘤的边界判断之外,临床上也需要在手术过程中更快、更准确的肿瘤扩散组织的病理判断手段,缩短手术时间,精确切除癌扩散组织,降低后期复发或扩散,延长病人的术后生存期。
综上所述,针对实体肿瘤及癌转移组织的术中成像技术具有重大的临床意义。但目前针对癌组织的术中特异性成像仍有很大的挑战。主要的难点,以及对应的当前临床开发策略如下:
1)硬件上应满足手术室使用的要求。
目前临床上广为应用的影像技术如x射线扫描,ct(计算机断层扫描成像)、mri(磁共振成像)、超声、pet-ct(正电子发射计算机断层扫描成像)主要应用于术前肿瘤影像诊断,因为实施的硬件要求(如体积)和应用要求(如电磁场等)等众多原因,限制了这些影像技术在手术台上、手术过程中的实时影像诊断。现有技术中,术中超声影像技术因为需要接触才能成像,在开放肿瘤手术情况下应用受到限制,而且其影像技术本身是基于组织形貌的,假阴性和假阳性均较高。在脑瘤手术中,mri术前扫描并构造手术坐标信息也在临床上得到术中的应用,但是此技术因为组织在图像采集时到手术期间,可能因为组织的变形或位移影响手术的导航质量。
与上述影像技术相比,基于荧光成像的技术具有较好的手术实时应用的优势。首先,荧光影像技术通常使用的近红外光源,相对于可见光、紫外光等光源,在组织中具有更强的穿透能力,受组织内部的主要吸收色团如血红蛋白、氧合血红蛋白、和水等的影响较小,可穿透大约1厘米左右的组织,在组织光学检测,尤其是浅体表的组织,具有很重要的应用价值。其次,荧光成像的硬件实施可以比较灵活,可以设计为可移动的白光和荧光的手术台影像系统,也可以设计为小巧的无菌探头配以外部的显像屏,可实现白光和荧光的内窥影像系统,进行体内的微创手术。这两种硬件设计,均已得到fda和ema的批准(如,spyimagingsystem;
2)所使用的技术应具备肿瘤组织的特异性。
取得肿瘤特异性的主要要求是:首先,所针对的肿瘤类型须自身具备一些特异性的特征,目前广为认可的一些特征是:具体肿瘤对应的癌细胞的特异性表面受体(例如叶酸,her2/neu,egfr,psma等受体);肿瘤微环境的特征(特异性的代谢产物、蛋白酶;或者癌细胞内部(phi:5.0-6.0)或者细胞之间的间隙液(phe:6.4-6.9)的酸性特征,源起于癌细胞快速摄取葡萄糖后的有氧酵解产生的乳酸代谢物。其次,针对上述特异性特征,应被所开发的影像技术作为精确定位的靶点,有效实现影像剂在肿瘤部位特异性的聚集,而实现肿瘤部位的聚集通常手段:利用癌细胞的特异性的受体实现影像剂与其特异性的结合;利用肿瘤微环境的酸性或者其它特征,通过化学的手段将影像剂滞留和富集在肿瘤部位;利用肿瘤组织的高通透性和滞留效应(epr)实现一些纳米粒子的选择性局部富集。
3)所使用的影像剂必须安全,使用后可以在较短的时间之内被降解或从体内清除,组织残留应少且不引起不良反应,若发生代谢反应影像剂的代谢产物应对身体无害。
实体肿瘤术中成像技术的主要临床转化使用了以下几类技术手段:
1)叶酸-荧光影像分子的偶合物:ontargetlaboratories公司目前已开展临床,用于肺癌和卵巢癌的肿瘤术中影像,其优点为对于所选肿瘤类型,靶点选择策略清晰(除个别组织外,叶酸受体在正常组织上表达水平很低,而在某些肿瘤细胞表面过表达)。其缺点为适用面比较窄(仅能用于特定的叶酸受体高表达的肿瘤),而且从其成像原理及临床数据来看,肿瘤的特异性显影的质量有些缺陷(背景反差;肿瘤和健康组织的边界未能清晰成像),而原因可能是正常在体内循环(未与肿瘤受体结合)的影像分子可在激发光源照射的情况下发荧光引起背景荧光,或出现非肿瘤部位的假阳性影像(“脱靶”现象,例如在某些健康组织如肾脏,也存在不同程度的叶酸受体),或由于前文所提及的肿瘤的非均一性的特点,肿瘤组织的叶酸表达量也许不能达到完全的均匀从而引起影像质量的缺陷。从临床数据来看,背景的清除与给药剂量有关系,基本上需要24小时-4天的清除时间,肿瘤影像的效果(癌症/正常组织比例,tbr,为2-3倍)一般。
2)抗体(mab)-荧光影像分子的偶合物:目前已有几个临床研究,用于脑胶质瘤(靶向egfr受体的mab,cetuximab)和肠癌、肺癌等(靶向cea受体)的肿瘤术中影像导航。与叶酸-荧光影像分子的偶合物设计相比,用来靶向的抗体分子生物相容性好,体内循环周期超长(3-7天),对于所选肿瘤类型,靶点清楚且结合机理明确。其缺点也很明显,抗体分子超长的循环时间同样也会造成较高的背景荧光,也同样有其它的问题,如适用面比较窄(仅能用于特定的受体高表达的肿瘤),如出现非肿瘤部位的假阳性影像(所选取的靶点可能存在于健康的组织),以及前文所提及的肿瘤的非均一性的特点。从临床和动物研究数据来看,此类技术的肿瘤影像的效果(癌症/正常组织比例,tbr,为2-5倍)尚可,但通常影像伴随着较强的背景荧光。
3)多肽-荧光影像分子的偶合物:针对前文所述的几种肿瘤细胞以及肿瘤微环境的特征,多肽可用以选择性的靶向,将荧光影像分子靶向到肿瘤部位。目前在研发及临床转化的方向有以下几种设计:r.tsien及avelasbiosciences,inc.公司使用特别的u型多肽组合设计,其中一端多肽在生理条件下为带正电荷(此多肽段末端链接荧光影像分子),另一端多肽在生理条件下为带负电荷,这两段多肽中间通过一个连接体连接,该连接体可被肿瘤微环境中存在的蛋白酶切断,断开后的带有荧光影像分子的多肽呈现正电荷,可与癌细胞表面的负电荷发生吸引后吸附在表面,后期通过细胞内吞机理进入癌细胞内部,随之而进入癌细胞的影像剂分子在激发光源照射下可以发出荧光。可以看得到,此类影像剂需要进入体内之后,要在有限的时间之内(即使增加了一段长循环的peg分子之后,半衰期也仅为20多分钟),完成这一系列的动作的时间窗口并不充裕,从而造成影像结果的欠佳(癌症/正常组织比例为2-3倍)。yale大学的donaldm.engelman团队,提出一种不同的设计,将荧光分子与一段多肽形成偶联物,该多肽靶向的信号为肿瘤微环境的酸性特征,正常生理条件下该多肽为负电性,在酸性环境下变成中性,电中性条件下多肽的亲油性增加,驱动多肽在癌细胞表面的沉积、跨膜等行为,实现荧光分子在肿瘤部位的特异性富集。从活体影像结果来看,此技术实现了肿瘤影像质量(tnr约为6),但是所报数据范围过大,效果欠佳。lumicell公司的设计为通过一段多肽将荧光影像分子和另一个可吸收荧光的分子连接在一起,所选用的多肽可以在肿瘤微环境常见的一些蛋白酶(如,cathepsink,l,s)的催化下切断,使得荧光分子和主动吸收荧光的分子分开之后在激发光源存在的情况下发荧光。这样的设计可以降低循环过程中的背景荧光,因为整个影像剂分子未到达肿瘤微环境之前不发荧光。通过连接一段peg可实现循环时间至约24小时,肿瘤影像质量(tnrratio为3-5),质量欠佳。除此以外,此技术另一个缺点是所选用的多肽序列是否可以实现高特异性的肿瘤靶向。
4)纳米粒子-荧光分子的影像剂:在医疗影像领域,纳米粒子得到广泛的应用,主要的类别为脂质体纳米粒子,无机纳米粒子,高分子纳米粒子。definity(r)是lantheusmedical(现bms公司)2001年获批的磷脂脂质体,用于稳定全氟丙烷(c3f8)气泡,做为超声影像剂使用。无机类的纳米粒子种类繁多(二氧化硅;氧化铁;量子点;碳纳米管等),通常无机纳米粒子的临床应用难点为安全性,而且仅通过纳米粒子表面化学修饰的方式引入荧光基团的话,通常很难实现特异性的肿瘤荧光影像。u.wiesner等成功推进了几项早期临床研究,使用小粒径(5-20nm)的sio2纳米粒子使得所用得纳米粒子可以从肾脏清除从而提高安全性,且纳米粒子的内核嵌入荧光分子,并且纳米粒子的表面引入特异性的靶向基团,可实现特异性的肿瘤荧光影像。通过此方法引入的荧光分子,可以克服常规的纳米粒子-荧光分子偶联物可能因为聚集出现的荧光淬灭的可能缺陷,但其报道的半衰期较短(10-30分钟),肿瘤影像效果尚可,其tnr为5-10(所报数据误差范围较大),但肝脏吸收很高(肿瘤/肝脏比例约为2)。笔者认为,尽管小粒径纳米粒子(小于20nm)可以通过肾脏清除,但仍不排除其临床的风险(例如经过bbb扩散至脑部等)。高分子纳米粒子的典型构造是使用两亲性的双嵌段聚合物,例如peg-plga,peg-peg-glutamate,peg-aspartate为几类目前开展工作至临床的可清除(peg)/可降解(另一嵌段)的聚合物。kim等作者在langer等前期关于ph响应(高分子主链上含有ph6.5左右可以质子化的氨基基团)的高分子微球的工作上,引入peg嵌段构建了ph响应的两亲性双嵌段共聚物,实现了肿瘤弱酸性环境下纳米粒子的解散(纳米粒子内核在酸性环境下离子化,产生电荷排斥力后破坏了两亲自组装的能量平衡)。
技术实现要素:
鉴于以上所述现有技术的缺点,本申请的目的在于提供一种官能化双嵌段共聚物及其制备方法和用途,用于解决现有技术中的问题。
为实现上述目的及其他相关目的,本申请一方面提供一种官能化双嵌段共聚物,所述官能化双嵌段共聚物的化学结构式如式i所示:
式i
式i中,m1=22~1136,n1=10~500,o1=0~50,p1=0.5~50,q1=0~500,r1=0~200;
s11=1~10,s12=1~10,s13=1~10,s14=1~10;
t11=1~10,t12=1~10,t13=1~10,t14=1~10;
l11、l12、l13、l14为连接基团;
a1选自可质子化基团;
b1选自降解性调节基团;
c1选自荧光分子基团;
d1选自递送分子基团;
e1选自亲/疏水基团;
t1选自封端基团;
eg1选自封端基团。
本发明另一方面提供一种聚合物颗粒,由上述的官能化双嵌段共聚物制备获得。
本发明另一方面提供上述的官能化双嵌段共聚物、或上述的聚合物颗粒在制备影像探针试剂和药物制剂中的用途。
本发明另一方面提供一种组合物,包括上述的官能化双嵌段共聚物、或上述的聚合物颗粒。
附图说明
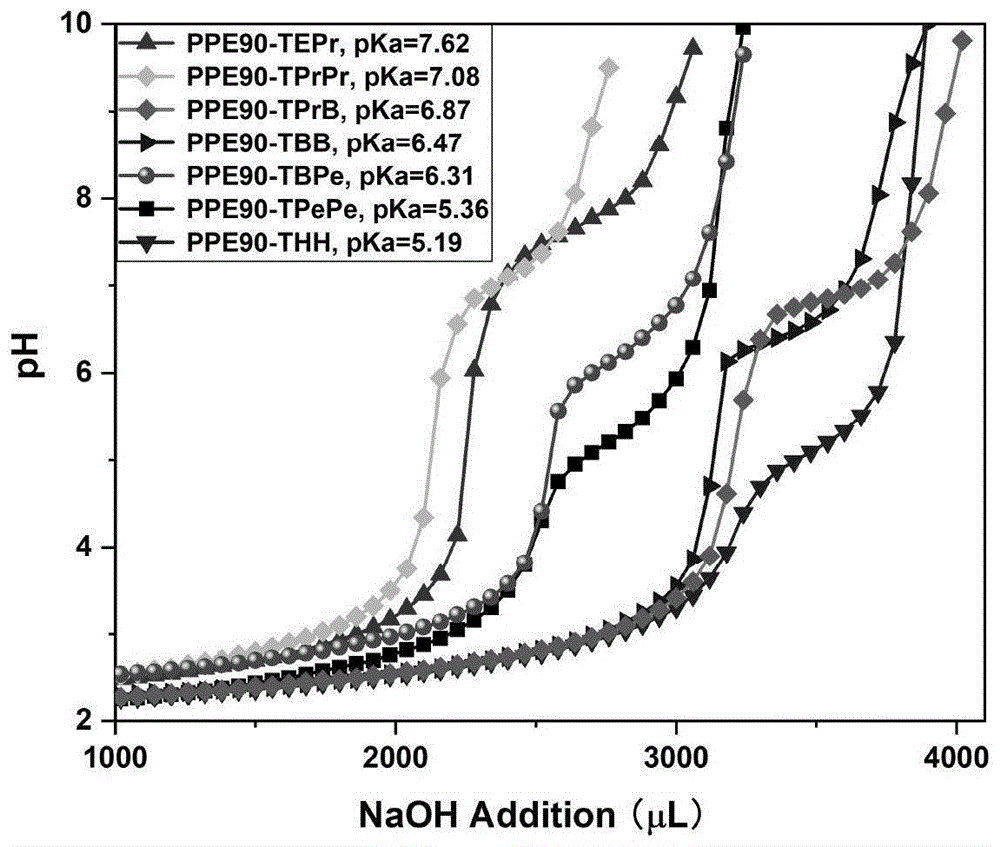
图1显示为本申请实施例2中侧链上连接不同的叔胺mpeg-ppe90的pka测定结果示意图。
图2显示为本申请实施例3中ppe90-tprb(左)与ppe200-tprb(右)的cmc测定结果示意图。
图3显示为本申请实施例4中ppe90-tprb-icg纳米粒子在pbs缓冲溶液中的dls和tem测试结果示意图,其中,(a)和(c)分别为pbs(ph8.0)的dls和tem测试结果,(b)和(d)分别为pbs(ph6.0)的dls和tem测试结果。
图4显示为本申请实施例5中荧光测试结果示意图,其中,a)为不同聚合度(dp)的ppe-tprb-icg3在821nm处的荧光发射强度与ph的关系总结,b)~h)为不同dp的ppe-tprb-icg3在各种pbs缓冲液中的荧光发射谱图,b)dp70,c)dp90,d)dp120,e)dp150,f)dp200,g)dp250,h)dp300。
图5显示本申请实施例5中荧光测试结果示意图,其中,a)-d)分别为ppe-tprb-icg3、ppe-tprb-c520-icg3、ppe-tprb-c940-icg3、ppe-tprb-c980-icg3在各种pbs缓冲液中的荧光发射谱图。
图6显示本申请实施例5中荧光测试结果示意图,其中,a)为侧链连接不同叔胺侧链的ppe90-icg3在821nm处的归一化的荧光强度与溶液ph的关系,b)~e)分别为荧光探针在不同ph的缓冲溶液中的荧光发射谱图,b)tprb,c)tbb,d)tpepe,e)thh。
具体实施方式
为了使本申请的发明目的、技术方案和有益技术效果更加清晰,以下结合实施例对本申请进行进一步详细说明,熟悉此技术的人士可由本说明书所揭露的内容容易地了解本申请的其他优点及功效。
本申请中,“双嵌段共聚物”通常是指将两种性质不同的聚合物链段连在一起所形成的聚合物。
本申请中,“可质子化基团”通常指可以与质子化合的基团,即可以结合至少一个质子,这些基团通常具有孤对电子,从而可以通过可质子化基团结合至少一个质子。
本申请中,“降解性调节基团”通常能够改变化合物体内降解性的一类基团。
本申请中,“荧光分子基团”通常指荧光分子所对应的一类基团,包含这些基团的化合物通常可以在紫外-可见-近红外区具有特征荧光,并且其荧光性质(激发和发射波长、强度、寿命、偏振等)可随所处环境的性质而改变的一类荧光性分子。
本申请中,“递送分子基团”通常指可以通过化学键合的形式通过侧链连接于嵌段共聚物的主链,或通过物理作用力(如氢键、范德华力、疏水性作用力等)与嵌段共聚物的疏水端侧链基团发生作用,且能够通过嵌段聚合物在水溶液中自组装形成的纳米粒子递送的各种分子。
本申请中,“亲/疏水基团”通常指具有一定亲水性、或亲油性的基团。
本申请中,“烷基”通常指饱和的脂肪族基团,可以是有直链或支链的。例如,c1-c20烷基通常指1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个碳原子的烷基基团。具体的烷基基团可以包括但不限于甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、癸基、十一烷基、十二烷基、十三烷基、十四烷基、十五烷基、十六烷基、十七烷基、十八烷基、十九烷基、二十烷基。
本申请中,“烯基”通常指不饱和的脂肪族基团、且包括c=c键(碳-碳双键、烯键),可以是有直链或支链的。例如,c2-c10烯基通常指2个、3个、4个、5个、6个、7个、8个、9个、10个碳原子的烯基基团。具体的烯基基团可以包括但不限于乙烯基、丙烯基、丁烯基、戊烯基、己烯基、庚烯基、辛烯基、壬烯基、癸烯基。
本申请中,“炔基”通常指不饱和的脂肪族基团、且包括c≡c键(碳-碳三键、炔键),可以是有直链或支链的。例如,c2-c10炔基通常指2个、3个、4个、5个、6个、7个、8个、9个、10个碳原子的炔基基团。具体的炔基基团可以包括但不限于乙炔基、丙炔基、丁炔基、戊炔基、己炔基、庚炔基、辛炔基、壬炔基、癸炔基。
本申请中,“环烷基”通常指饱和的与不饱和的(但不是芳族的)环状烃。例如,c3-c10环烷基通常指3个、4个、5个、6个、7个、8个、9个、10个碳原子的环烷基基团。具体的环烷基基团可以包括但不限于环丙基、环丁基、环戊基、环己基、环庚基、环辛基、环壬基、环癸基。对于环烷基,本申请中该术语还包括其中任选地至少一个碳原子可以被杂原子替换的饱和的环烷基,杂原子可以选自s、n、p或o。另外,在环中没有杂原子的单不饱和或多不饱和(优选单不饱和)环烷基,只要其不是芳香族体系,就应该属于术语环烷基。
本申请中,“芳香基”通常指具有至少一个芳香环的环体系、且没有杂原子的基团,所述芳香基可以是取代或未取代的,具体的取代基可以选自c1-c6烷基、c1-c6烷氧基、c3-c10环烷基、羟基、卤素等。具体的芳香基基团可以包括但不限于苯基、苯酚基、苯氨基等。
本申请中,“杂芳基”通常指具有至少一个芳香环以及可任选地含有一个或多个(例如,1个、2个、或3个)选自氮、氧、或硫的杂原子,所述杂芳基可以是取代或未取代的,具体的取代基可以选自c1-c6烷基、c1-c6烷氧基、c3-c10环烷基、羟基、卤素等。具体的杂芳基基团可以包括但不限于呋喃、苯并呋喃、噻吩、苯并噻吩、吡咯、吡啶、嘧啶、哒嗪、吡嗪、喹啉、异喹啉、酞嗪、苯并-1,2,5-噻二唑、苯并噻唑、吲哚、苯并三唑、苯并二噁茂(benzodioxolane)、苯并二噁烷、苯并咪唑、咔唑、或喹唑啉。
本申请中,“靶向制剂”通常指能够将特定的化合物专一性地导向所需发挥作用的部位(靶区)的制剂,这些制剂可以以聚合物颗粒为载体,对非靶组织通常可以具有相对较低、或没有、或几乎没有相互作用。
本申请中,“影像探针”通常指一类在注入(或服用)到人体组织或器官中后,能够增强影像观察效果的一类物质。
本申请中,“个体”通常包括人类、非人类的灵长类,如哺乳动物、狗、猫、马、羊、猪、牛等。
本申请发明人经过大量实践研究,提供了一类官能化双嵌段共聚物,这些双嵌段共聚物可以通过创新的化学修饰策略,使得聚合物具有ph响应且可以在对应ph条件下降解,从而可以作为靶向试剂被应用于各种领域,在此基础上完成了本发明。
本申请第一方面提供一种官能化双嵌段共聚物,所述官能化双嵌段共聚物具有如下所示的化学结构式:
式i;
式i中,m1=22~1136,n1=30~500,o1=0~50,p1=0.5~50,q1=0~500,r1=0~200;
s11=1~10,s12=1~10,s13=1~10,s14=1~10;
t11=1~10,t12=1~10,t13=1~10,t14=1~10;
l11、l12、l13、l14为连接基团;
a1选自可质子化基团;
b1选自降解性调节基团;
c1选自荧光分子基团;
d1选自递送分子基团;
e1选自亲/疏水基团;
t1选自封端基团;
eg1选自封端基团。
所述式i化合物为聚乙二醇-聚磷酸酯的双嵌段共聚物,其中聚磷酸酯嵌段的侧链结构为随机分布,通式中以ran体现。
所述式i化合物中,l11、l12、l13、l14通常为连接基团,其主要是用于连接官能化双嵌段共聚物的主链与其支链。在本申请一具体实施例中,l11、l12、l13、l14可以各自独立地选自-s-,-o-,-oc(o)-,-c(o)o-,-sc(o)-,-c(o)-,-oc(s)-,-c(s)o-,-ss-,-c(r1)=n-,-n=c(r2)-,-c(r3)=n-o-,-o-n=c(r4)-,-n(r5)c(o)-,-c(o)n(r6)-,-n(r7)c(s)-,-c(s)n(r8)-,-n(r9)c(o)n(r10)-,-os(o)o-,-op(o)o-,-op(o)n-,-np(o)o-,-np(o)n-,其中,r1~r10各自独立地选自h,c1-c10烷基,c3-c10环烷基。
在本申请另一具体实施例中,l11、l12、l13、l14可以各自独立地选自s。
所述式i化合物中,a1通常选自可质子化基团,该基团及该基团所在的聚合物的嵌段主要是用于调节聚合物的ph响应。在本申请一具体实施例中,a1可以选自
在本申请另一具体实施例中,a1可以选自
所述式i化合物中,b1通常选自降解性调节基团,该基团及该基团所在的聚合物的嵌段主要是用于调节聚合物的体内降解性能。在本申请一具体实施例中,b1可以选自c1-c18烷基、阳离子等,所述阳离子具体可以是li+,na+,k+,ca2+,zn2+,fe2+,fe3+,mg2+,zn2+,nh4+等。
在本申请另一具体实施例中,b1可以选自甲基。
所述式i化合物中,c1通常选自荧光分子基团,该基团及该基团所在的聚合物的嵌段主要是用于引入荧光分子基团。所述荧光分子基团具体可以包括但不限于有机试剂、金属螯合物等中的一种或多种的组合。在本申请一具体实施例中,c1可以包括icg,methyleneblue,cy3.5,cy5,cy5.5,cy7,cy7.5,bdy630,bdy650,bdy-tmr,tracy645,tracy652等荧光分子。
在本申请另一具体实施例中,c1可以包括吲哚氰绿(icg),icg可以通过酰胺键与嵌段的支链连接。
所述式i化合物中,d1可以选自递送分子基团,该基团及该基团所在的聚合物的嵌段主要是用于引入可以通过嵌段共聚物递送的各种分子基团。这些分子基团可以是包括但不限于荧光淬灭基团、药物分子基团(例如,光动力学疗法的前体分子、化疗药物分子、生物药物分子等)等。在本申请一具体实施例中,所述荧光淬灭基团可以选自bhq-0,bhq-1,bhq-2,bhq-3,bhq-10,qxl-670,qxl-610,qxl-570,qxl520,qxl-490,qsy35,qsy7,qsy21,qxl680,iowablackrq,iowablackfq。在本申请一具体实施例中,所述药物分子基团可以选自化疗药物,具体可以是核酸药物,紫杉醇,顺铂,阿霉素,伊立替康,sn38等药物分子所对应的基团。在本申请另一具体实施例中,所述药物分子基团可以选自光动力学疗法的化学药物,具体可以是5-ala所对应的基团及其衍生结构(脂肪链化等),基团具体的化学结构式如下所示:
所述式i化合物中,e1可以选自亲/疏水基团,该基团及该基团所在的聚合物的嵌段主要是用于调节聚合物疏水嵌段的疏/亲水程度。在本申请一具体实施例中,e1可以选自h,c1-c18烷基,-o-r11,-s-r12,其中,r11~r12各自独立地选自h,c1-c18烷基,c3-c10环烷基,芳香基。
在本申请另一具体实施例中,e1可以选自正戊基或正壬烷基。
所述式i化合物中,t1通常可以是由不同的聚乙二醇(peg)嵌段的引发剂的端基。在本申请一具体实施例中,t1可以选自-ch3,-h。
所述式i化合物中,eg1通常可以由聚合后加入的不同的封端剂所产生。在本申请一具体实施例中,eg1可以选自-y-r13,其中,y选自o、s、n,r13选自h,c1-c20烷基,c3-c10环烷基,芳香基。
在本申请另一具体实施例中,eg1可以选自-oh。
所述式i化合物中,聚乙二醇(peg)嵌段的分子量可以为1000~50000da、1000~2000da、2000~3000da、3000~4000da、4000~5000da、5000~6000da、6000~7000da、7000~8000da、8000~9000da、9000~10000da、10000~12000da、12000~14000da、14000~16000da、16000~18000da、18000~20000da、22000~24000da、24000~26000da、26000~28000da、28000~30000da、30000~32000da、32000~34000da、34000~36000da、36000~38000da、38000~40000da、40000~42000da、42000~44000da、44000~46000da、46000~48000da、或48000~50000da,聚磷酸酯(ppe)嵌段的分子量通常可以为5000~50000da、5000~6000da、6000~7000da、7000~8000da、8000~9000da、9000~10000da、10000~12000da、12000~14000da、14000~16000da、16000~18000da、18000~20000da、22000~24000da、24000~26000da、26000~28000da、28000~30000da、30000~32000da、32000~34000da、34000~36000da、36000~38000da、38000~40000da、40000~42000da、42000~44000da、44000~46000da、46000~48000da、或48000~50000da。本申请中,嵌段的分子量通常指该嵌段中主链分子的分子量,这些分子量通常为数均分子量(mn)。
在本申请一具体实施例中,聚乙二醇嵌段的分子量可以为2000~10000da,聚磷酸酯嵌段的分子量通常可以为6000~37000da。
所述式i化合物中,m1可以为22~1136、22~32、32~42、42~52、52~62、62~72、72~82、82~92、92~102、102~122、122~142、142~162、162~182、182~202、202~242、242~282、282~322、322~362、362~402、402~442、442~482、482~522、522~562、562~602、602~642、642~682、682~722、722~762、762~802、802~842、842~882、882~902、902~942、942~982、或982~1136。
n1可以为10~500、10~15、15~20、20~25、25~30、30~35、35~40、40~45、45~50、45~50、50~60、60~70、70~80、80~90、90~100、100~120、120~140、140~160、160~180、180~200、200~220、220~240、240~260、260~280、280~300、300~320、320~340、340~360、360~380、380~400、400~420、420~440、440~460、460~480、或480~500。
o1可以为0~50、0~1、1~2、2~4、4~6、6~8、8~10、10~12、12~14、14~16、16~18、18~20、20~25、25~30、30~35、35~40、40~45、或45~50。
p1可以为0.5~50、0.5-1、1~2、2~3、3~4、4~5、6~7、6~7、7~8、8~9、9~10、10~12、12~14、14~16、16~18、18~20、20~25、25~30、30~35、35~40、40~45、或45~50。
q1可以为0~500、0~1、1~2、2~4、4~6、6~8、8~10、10~12、12~14、14~16、16~18、18~20、20~25、25~30、30~35、35~40、40~45、45~50、45~50、50~60、60~70、70~80、80~90、90~100、100~120、120~140、140~160、160~180、180~200、200~220、220~240、240~260、260~280、280~300、300~320、320~340、340~360、360~380、380~400、400~420、420~440、440~460、460~480、或480~500。
r1可以为0~200、0~1、1~2、2~4、4~6、6~8、8~10、10~12、12~14、14~16、16~18、18~20、20~25、25~30、30~35、35~40、40~45、45~50、45~50、50~60、60~70、70~80、80~90、90~100、100~120、120~140、140~160、160~180、或180~200。
s11可以为1~10、1~2、2~3、3~4、4~5、6~7、6~7、7~8、8~9、9~10。
s12可以为1~10、1~2、2~3、3~4、4~5、6~7、6~7、7~8、8~9、9~10。
s13可以为1~10、1~2、2~3、3~4、4~5、6~7、6~7、7~8、8~9、9~10。
s14可以为1~10、1~2、2~3、3~4、4~5、6~7、6~7、7~8、8~9、9~10。
t11可以为1~10、1~2、2~3、3~4、4~5、6~7、6~7、7~8、8~9、9~10。
t12可以为1~10、1~2、2~3、3~4、4~5、6~7、6~7、7~8、8~9、9~10。
t13可以为1~10、1~2、2~3、3~4、4~5、6~7、6~7、7~8、8~9、9~10。
t14可以为1~10、1~2、2~3、3~4、4~5、6~7、6~7、7~8、8~9、9~10。
在本申请一具体实施例中,式i中,m1=22~1136,n1=10~500,o1=0,p1=0.5~50,q1=0,r1=0。通过这些聚合物制备获得的产物(例如,聚合物颗粒),分布在疏水内核的荧光分子因为fret(fluorescenceresonanceenergytransfer)效应,在一定的激发条件下(例如,在近红外做为激发光源的情况下)不发光。而在向个体施用后,可以通过肿瘤组织的epr(enhancedpermeationandretention)效应被动靶向(或其它组织摄取方式)富集于靶标部位(例如,肿瘤部位),由于靶标部位具有特殊的ph环境(例如,酸性环境),可质子化基团(即,a1基团)可以在此ph范围内质子化,其质子化产生的电荷排斥力及水溶性变强驱使聚合物颗粒的离散,离散后的单个高分子链段上所带的荧光基团,其fret效应减弱甚至完全消除,富集于靶标部位的离散状态下的聚合物分子可以在一定的激发条件下发出荧光(例如,在近红外做为激发光源的情况下)。
在本申请一优选实施例中,所述官能化双嵌段共聚物的化学结构式如下之一所示:
在本申请另一优选实施例中,m1=44~226,n1=50~300,p1=1~5。
在本申请一具体实施例中,式i中,m1=22~1136,n1=10~500,o1=0,p1=0.5~50,q1=0,r1=1~200。通过这些聚合物制备获得的产物(例如,聚合物颗粒),分布在疏水内核的荧光分子因为fret效应,在一定的激发条件下(例如,在近红外做为激发光源的情况下)不发光,亲/疏水基团的(即e1基团)的加入增加了聚合物颗粒的稳定性,增强了聚合物颗粒的fret效应(荧光淬灭更完全),同时改变了聚合物颗粒的酸度敏感性。而在向个体施用后,可以通过epr被动靶向(或其它组织摄取方式)富集于靶标部位(例如,肿瘤部位),由于靶标部位具有特殊的ph环境(例如,酸性环境),可质子化基团(即,a1基团)可以在此ph范围内质子化,其质子化产生的电荷排斥力及水溶性变强驱使聚合物颗粒的离散,离散后的单个高分子链段上所带的荧光基团,其fret效应减弱甚至完全消除,富集于靶标部位的离散状态下的聚合物分子可以在一定的激发条件下发出荧光(例如,在近红外做为激发光源的情况下)。
在本申请一优选实施例中,所述官能化双嵌段共聚物的化学结构式如下之一所示:
在本申请另一优选实施例中,m1=44~226,n1=70~300,p1=0.5~5,r1=10~100。
在本申请一具体实施例中,式i中,m1=22~1136,n1=10~500,o1=1~50,p1=0.5~50,q1=0,r1=0。通过这些聚合物制备获得的产物(例如,聚合物颗粒),分布在疏水内核的荧光分子因为fret效应,在一定的激发条件下(例如,在近红外做为激发光源的情况下)不发光,降解性调节基团(即b1基团)的加入,可以调节聚合物的体内降解性能。而在向个体施用后,可以通过epr被动靶向(或其它组织摄取方式)富集于靶标部位(例如,肿瘤部位),由于靶标部位具有特殊的ph环境(例如,酸性环境),可质子化基团(即,a1基团)可以在此ph范围内质子化,其质子化产生的电荷排斥力及聚合物的溶解性的提高驱使聚合物颗粒的离散,离散后的单个高分子链段上所带的荧光基团,其fret效应减弱甚至完全消除,富集于靶标部位的离散状态下的聚合物分子可以在一定的激发条件下发出荧光(例如,在近红外做为激发光源的情况下)。
在本申请一优选实施例中,所述官能化双嵌段共聚物的化学结构式如下之一所示:
在本申请另一优选实施例中,m1=44~226,n1=70~300,o1=1~10,p1=0.5~5。
在本申请一具体实施例中,式i中,m1=22~1136,n1=10~500,o1=1~50,p1=0.5~50,q1=0,r1=1~200。通过这些聚合物制备获得的产物(例如,聚合物颗粒),分布在疏水内核的荧光分子因为fret效应,在一定的激发条件下(例如,在近红外做为激发光源的情况下)不发光,亲/疏水基团的(即e1基团)的加入增加了聚合物颗粒的稳定性,增强了聚合物颗粒的fret效应(荧光淬灭更完全),同时改变了聚合物颗粒的酸度敏感性,降解性调节基团(即b1基团)的加入,可以调节聚合物的体内降解性能。而在向个体施用后,可以通过epr被动靶向(或其它组织摄取方式)富集于靶标部位(例如,肿瘤部位),由于靶标部位具有特殊的ph环境(例如,酸性环境),可质子化基团(即,a1基团)可以在此ph范围内质子化,其质子化产生的电荷排斥力及聚合物的溶解性的提高驱使聚合物颗粒的离散,离散后的单个高分子链段上所带的荧光基团,其fret效应减弱甚至完全消除,富集于靶标部位的离散状态下的聚合物分子可以在一定的激发条件下发出荧光(例如,在近红外做为激发光源的情况下)。
在本申请一优选实施例中,所述官能化双嵌段共聚物的化学结构式如下之一所示:
在本申请另一优选实施例中,m1=44~226,n1=50~300,o1=1~10,p1=0.5~5,r1=10~100。
在本申请一具体实施例中,式i中,m1=22~1136,n1=10~500,o1=1~50,p1=0.5~50,q1=1~500,r1=0。通过这些聚合物制备获得的产物(例如,聚合物颗粒),分布在疏水内核的荧光分子因为fret效应,在一定的激发条件下(例如,在近红外做为激发光源的情况下)不发光,降解性调节基团(即b1基团)的加入,可以调节聚合物的体内降解性能,递送分子基团(即d1基团)则被连接于官能化双嵌段聚合物的主链上。而在向个体施用后,可以通过epr被动靶向(或其它组织摄取方式)富集于靶标部位(例如,肿瘤部位),由于靶标部位具有特殊的ph环境(例如,酸性环境),可质子化基团(即,a1基团)可以在此ph范围内质子化,其质子化产生的电荷排斥力及及聚合物的溶解性的提高驱使聚合物颗粒的离散,离散后的单个高分子链段上所带的荧光基团,其fret效应减弱甚至完全消除,富集于靶标部位的离散状态下的聚合物分子可以在一定的激发条件下发出荧光(例如,在近红外做为激发光源的情况下)。除了聚合物颗粒携带的荧光分子基团以外,侧链上连接的递送分子基团,在高分子解散之后,可以继续靶标部位特定的ph条件下,水解为对应的分子。这些分子可以在靶标部位发挥对应的作用,例如,递送分子基团可以为5-ala所对应的基团,其水解后可以提供5-ala分子,5-ala可在几小时之内,高效的富集于新陈代谢加速的癌细胞内部,完成生物合成形成protoporphyrin,此时在近红外激发光的照射下,可以高效的发荧光,在已有的icg荧光分子的基础上,实现肿瘤部位的荧光影像增强或边界确认的效果。并且,5-ala是已经得到证明的光动力学疗法药物的前体,我们在本实施例中创造性的引入并递送5-ala,不但增强了肿瘤特异性成像的效果,而且还在实施肿瘤成像的同时,进行了肿瘤部位的光动力学治疗。除了聚合物颗粒携带的荧光分子基团以外,侧链上连接的难溶于水的抗癌药物,形成水溶性良好、安全稳定的药物注射用制剂,该药物制剂一方面大大增加了疏水药物在血液中的溶解度并减少其与血液的直接接触,降低了药物在体内的毒副作用,提高了药物在体内的稳定性并保留药物本身的高抗肿瘤活性特点。在高分子解散之后,可以继续靶标部位特定的ph条件下,水解为对应的分子。这些分子可以在靶标部位发挥对应的作用,例如,递送分子基团可以为sn-38所对应的基团,其水解后可以提供sn-38,克服了传统疏水性抗肿瘤药物输送系统载药量低和副反应强烈的缺点,提高了药物安全性并实现杀死癌细胞的效果。此外,侧链上也可以化学连接或者通过物理作用递送核酸药物药物,形成核酸药物药物的纳米制剂,能够显著提高核酸药物药物的体内稳定性,在高分子解散之后,可以继续靶标部位特定的ph条件下,水解(对应化学连接)或释放(对应物理作用递送)为对应的核酸药物分子,在病灶部位发挥药效。
在本申请一优选实施例中,所述官能化双嵌段共聚物的化学结构式如下所示:
在本申请另一优选实施例中,m1=44~226,n1=50~300,o1=1~10,p1=0.5~5,q1=10~300。
本申请所提供的官能化双嵌段共聚物,通常具有较低的临界胶束浓度,从而降低高分子自组装颗粒的制备难度,从而保证了制得得高分子颗粒具有很好的溶液稳定性和血液稳定性。例如,所述官能化双嵌段共聚物的临界胶束浓度(cmc)可以为<50μg/ml、<45μg/ml、<40μg/ml、<35μg/ml、<30μg/ml、<25μg/ml、<20μg/ml、<16μg/ml、<14μg/ml、<12μg/ml、<10μg/ml、≤9μg/ml、≤8μg/ml、≤7μg/ml、≤6μg/ml、≤5μg/ml、≤4μg/ml、或更小的临界胶束浓度。
本申请第二方面提供一种聚合物颗粒,由本发明第一方面所提供的官能化双嵌段共聚物制备获得。上述的官能化双嵌段共聚物可以用于形成聚合物颗粒。聚合物颗粒分布在疏水内核的荧光分子因为fret效应,在一定的激发条件下(例如,在近红外做为激发光源的情况下)不发光。而在向个体施用后,可以通过epr被动靶向(或其它组织摄取方式)富集于靶标部位(例如,肿瘤部位),由于靶标部位具有特殊的ph环境(例如,酸性环境),可质子化基团可以在此ph范围内质子化,其质子化产生的电荷排斥力及水溶性变强驱使聚合物颗粒的离散,离散后的单个高分子链段上所带的荧光基团,其fret效应减弱甚至完全消除,富集于靶标部位的离散状态下的聚合物分子可以在一定的激发条件下发出荧光(例如,在近红外做为激发光源的情况下)。例如,上述的ph环境可以为6.5-6.8,该ph环境可以对应于肿瘤细胞的间隙液,至少部分的聚合物颗粒可以到达靶标部位,并处于细胞的间隙液中;再例如,上述的ph环境还可以为4.5-6.5,该ph环境可以对应于肿瘤细胞内的内体或溶酶体,至少部分的聚合物颗粒可以与靶标部位的细胞(例如,肿瘤细胞)发生作用,通过内吞机理,进入到细胞内部,从而达到上述的ph环境中。本申请所提供的官能化双嵌段共聚物所制备的聚合物颗粒,可以充分扩散在靶标部位,实现清晰的荧光边缘,且官能化双嵌段共聚物和/或聚合物颗粒在体内是可以被降解的。实施在个体后,未能通过epr效应循环靶向至肿瘤部位的聚合物颗粒或纳米粒子,可以被身体的免疫系统(主要是巨噬细胞等)吞没后降解(peg虽不能完全在体内降解,但是分子量低于40000da的peg分子(例如,罗氏的长效干扰素,
本申请所提供的聚合物颗粒,可以是纳米尺寸的,例如,聚合物颗粒的粒径可以为10~200nm、10~20nm、20~30nm、30~40nm、40~60nm、60~80nm、80~100nm、100~120nm、120~140nm、140~160nm、160~180nm、或180~200nm。
本申请所提供的聚合物颗粒中,聚合物颗粒还可以修饰有靶向基团,这些靶向基团通常可以修饰于聚合物颗粒的表面。合适的将靶向基团修饰于聚合物颗粒的方法对于本领域技术人员来说应该是已知的,例如,通常来说,靶向基团可以连接于官能化双嵌段共聚物分子结构的t端。这些靶向基团通常可以在epr效应的基础上,增加纳米粒子对肝部肿瘤的靶向效率。这些靶向基团可以是包括但不限于(单克隆)抗体片段(例如,fab等)、小分子靶向基团(例如叶酸,糖类化合物)、多肽分子(例如crgd,gl2p)、核酸适配体(aptamer)等各种功能分子,这些功能因子可以具有靶向功能(例如,靶向于肿瘤组织的功能)。在本申请一具体实施例中,所述靶向基团选自-galnac(n-acetylgalactosamine)。
本申请第三方面提供本申请第二方面提供的聚合物颗粒的制备方法,在知晓官能化双嵌段共聚物化学结构的基础上,合适的形成聚合物颗粒的方法对于本领域技术人员来说应该是已知的,例如,可以包括:将包括上述官能化双嵌段共聚物的有机溶剂分散于水中,自组装以提供所述聚合物颗粒;或反向此过程,将水分散于上述官能团化双嵌段共聚物的有机溶剂中。上述分散过程中可以通过合适的操作以使得体系充分混合,例如,可以在超声条件下进行。再例如,自组装过程中,通常可以通过脱除反应体系中有机溶剂的方法进行,有机溶剂的脱除方法具体可以是溶剂挥发法、超滤法等。再例如,聚合物的cmc与聚合物的疏水嵌段与亲水嵌段的比例相关,疏水嵌段的比例越高,其cmc越小。当e1,e2,e3为长链疏水侧链时,其含量与cmc大小成反比;当e1,e2,e3为亲水侧链时,其含量与cmc大小成正比。再例如,聚合物颗粒的粒径大小通常可用通过挤出仪器(nanoassemblr)来调节。
本申请第四方面提供本申请本申请第一方面所提供的官能化双嵌段共聚物、或本申请第二方面提供的聚合物颗粒在制备药物制剂和/或试剂中的用途,以形成的高分子纳米颗粒作为药物递送系统,可以以聚合物颗粒为载体递送药物或影像探针分子。如上所述,通过本申请所提供的官能化双嵌段共聚物制备获得的产物(例如,聚合物颗粒)具有被动(通过纳米颗粒的通用的epr效应富集于肿瘤部位)或者主动靶向(通过纳米颗粒表面修饰的靶向基团,通过与肿瘤表面特异性受体产生的特异结合作用富集于肿瘤部位)功能,在向个体施用后,由于靶标部位具有特殊的ph环境(例如,酸性环境),可质子化基团可以在此ph范围内质子化,其质子化产生的电荷排斥力及水溶性变强驱使聚合物颗粒的离散,离散后的单个高分子链段上所带的荧光基团,其fret效应减弱甚至完全消除,富集于靶标部位的离散状态下的聚合物分子可以在一定的激发条件下发出荧光(例如,在近红外光做为激发光源的情况下),实现靶标部位(例如,肿瘤部位)特异性特异性发光,从而可以被用于靶向性影像探针。除了影像探针应用以外,这些聚合物颗粒可以用于制备靶向试剂,在本申请一具体实施例中,上述聚合物颗粒可以用于制备基于聚合物颗粒的药物递送系统,递送各种药物分子。
本发明所提供的药物制剂或试剂中,通常可以以以聚合物颗粒为载体递送药物或影像探针分子,所述官能化双嵌段共聚物可以是作为单一有效成分,也可以与其他活性组分进行组合,共同地组成有效成分用于上述用途。
本申请第五方面提供一种组合物,包括本申请第一方面所提供的官能化双嵌段共聚物、或本申请第二方面提供的聚合物颗粒。如上所述,上述组合物可以是靶向试剂,在本申请一具体实施例中,上述组合物可以是影像探针。
本申请所提供的组合物中,还可以包括至少一种药学上可接受的载体,其通常指用于给药的载体,它们本身不诱导产生对接受该组合物的个体有害的抗体,且给药后没有过分的毒性。这些载体是本领域技术人员所熟知的,例如,在remington’spharmaceuticalsciences(mackpub.co.,n.j.1991)中公开了关于药学上可接受的载体的相关内容。具体来说,所述载体可以是包括但不限于盐水、缓冲液、葡萄糖、水、甘油、乙醇、佐剂等中的一种或多种的组合。
本申请所提供的组合物中,所述官能化双嵌段共聚物可以是单一有效成分,也可以与其他活性组分进行组合,联合使用。所述其他活性组分可以是其他各种可以是其他各种药物和/或试剂,其通常可以与上述官能化双嵌段共聚物共同作用于靶标部位。组合物中活性组分的含量通常为安全有效量,所述安全有效量对于本领域技术人员来说应该是可以调整的,例如,所述活性成分的施用量通常依赖于施用对象的体重、应用的类型、疾病的病情和严重程度。
本申请所提供的组合物可以适应于任何形式的施用方式,可以是胃肠外给药,例如,可以是经肺、经鼻、经直肠和/或静脉注射,更具体可以是真皮内、皮下、肌内、关节内、腹膜内、肺部、口腔、舌下含服、经鼻、经皮、阴道、膀胱灌注、子宫灌注、肠道灌注、开颅后局部施用、或胃肠外给药。本领域技术人员可根据给药方式,选择合适的制剂形式,例如,适合于胃肠外给药的制剂形式可以是包括但不限于溶液、悬浮液、可复水的干制剂或喷雾剂等,再例如,可以通过以吸入剂形式通过吸入给药的制剂形式。
本申请第六方面提供一种治疗或诊断方法,包括:向个体施用有效量的本申请第一方面所提供的官能化双嵌段共聚物、或本申请第二方面提供的聚合物颗粒、或本申请第五方面提供的组合物。所述“有效量”通常指一用量在经过适当的给药期间后,能够达到欲求的效果,例如,造影、治疗疾病等。上述具有ph响应且可以在对应ph条件下降解的功能,官能化双嵌段共聚物的进一步延伸化学修饰,还可以带来协调效应的递送分子,通过可降解的化学键接到聚合物分子上,并可以配合独特的末端基团(靶向基团,可改善系统免疫原性的基团),变成独特的(嵌段共聚物-运输物键合体)。在本申请一具体实施例中,使用后,可以实现更好的术中的肿瘤边界辨别,更精切的切除肿瘤病灶及转移组织,同时实施术中影像的过程中,可以通过运输物的局部递送,更好的杀灭癌细胞,降低复发率,提高病人的术后生存率。
本申请所提供的官能化双嵌段共聚物、或聚合物颗粒,能够显著改善肿瘤影像探针试剂和/或肿瘤药物制剂的安全性(肿瘤影像探针试剂多为单次使用;而肿瘤药物制剂通常多次给药)。对于本发明所提供的双嵌段共聚物(式i化合物peg-ppe),其中peg可以安全的从人体清除(临床上批准了adegen(r)、oncaspar(r)等使用分子量为5k的peg进行多位点修饰的治疗性酶,以及分子量为12-40kpeg进行修饰的干扰素、粒细胞集落刺激因子、抗体的fab片段等生物大分子,已安全临床使用超过十年),另外一个嵌段的组份高分子(ppe),本身在生理条件下(水解;酶)的基础上就可以逐渐降解。此外,引入酸性条件下可主动切断ppe主链的设计,可以实现酸性条件下高分子更快的且可调节(通过改变官能基团的数量)的降解和清除。
本申请所提供的官能化双嵌段共聚物、或聚合物颗粒,能够实现实体肿瘤部位特异性的肿瘤影像探针试剂优质影像成像,肿瘤部位ph变化响应灵敏(荧光信号变化δph10–90%只需要约0.2-0.3ph单位),高信噪比,边界清晰,长半衰期,且活体影像数据显示所用影像探针一旦富集进入肿瘤内之后可具有很长的瘤内滞留和持续时间(几天以上),赋予肿瘤影像手术更长的观察窗口,解决荧光成像技术在实时术中导航的难题。
本申请所提供的官能化双嵌段共聚物、聚合物颗粒、或组合物,可以方便的通过局部给药的方式,例如,膀胱灌注、子宫灌注、肠道灌注、开颅后脑部局部施用等,所用的聚合物颗粒在于局部接触的肿瘤组织进行充分的接触以后,可以实现聚合物颗粒被肿瘤组织吸收,从而实现肿瘤组织的影像和治疗。
本申请所提供的官能化双嵌段共聚物、或聚合物颗粒,可以基于纳米粒子可充分扩散至实体肿瘤微环境的特点,在高分子上引入肿瘤微环境(例如,弱酸、微环境特有的蛋白酶等)可切断的前体分子(例如,光动力学治疗药物的前体分子等,更具体可以是5-ala前体分子等),侧链经切断离开高分子主链还原为临床已获批的药物分子(例如,5-ala等),实现术中肿瘤部位的影像增强。影像成像的实施的同时,所设计影像探针试剂利用了实施术中影像的光源,在肿瘤切除手术的过程中实现了对肿瘤组织的光动力学治疗,降低其它光动力学治疗对正常组织的伤害,切除肿瘤组织的过程中杀灭未切净的癌组织,降低术后复发,延长生存时间。
综上所述,本申请所提供的官能化双嵌段共聚物、或聚合物颗粒,可以广泛的应用肿瘤影像、肿瘤治疗等等领域,其不仅具有良好的安全性,实现酸性条件下高分子更快的且可调节(通过改变管能基团的数量)的降解和清除,还在靶向部位具有优良的特异性的优质影像成像效果,具有高信噪比、边界清晰、长半衰期等特点,解决了荧光成像技术在实时术中导航的难题,从而具有良好的产业化前景。
下面通过实施例对本申请的申请予以进一步说明,但并不因此而限制本申请的范围。
实施例中式i系列化合物的制备方法的反应路线如下:
实施例1
mpeg-ppe聚合物的合成
1.1单体合成:
aep的合成(ib001-077-01):
丙烯醇(11.6g,0.2mol)溶于250ml干燥的dcm中,加入干燥的三乙胺(20.2g,0.2mol),冰盐浴冷却到0℃,氩气置换三次,2-氯-2-氧-1,3,2-二氧磷杂环戊烷(28.4g,0.2mol)缓慢滴加到上述反应液中,保持温度在5℃以下,滴加完毕后,反应体系继续在0℃下搅拌3h。浓缩掉大部分的dcm,然后加入200ml干燥的甲基叔丁基醚,有白色固体析出,过滤,用20ml甲基叔丁基醚洗涤,滤液浓缩,最后得到的浓缩物减压蒸馏(0.1torr,92℃)得到13.7g产品,性状为无色透明液体,收率41.7%。产品在-20℃下保存。1hnmr(400mhz,cdcl3)δ5.97(ddt,j=16.4,10.9,5.7hz,1h),5.46–5.36(m,1h),5.29(dd,j=10.4,1.4hz,1h),4.69–4.58(m,2h),4.50–4.33(m,4h).
1.2聚合:
1.2.1聚合的通用方法,ppe70(n=70,ib004-030-01):
在h2o和o2指标小于0.1ppm的手套箱中,称量m-peg-5000(100mg,0.02mol)放入聚合反应管中,加入0.5ml苯,密封,移出手套箱,加热至50℃,搅拌10min,全部溶解后,冷却至室温,重新移入手套箱,加入aep(328mg,2mmol),最后加入tbd(2.78mg,0.02mmol),快速搅拌反应5min。将聚合反应管移出手套箱,加入苯甲酸溶液(30mg溶于1mldcm)终止反应,搅拌5min,然后缓慢加入50ml甲基叔丁基醚,出现白色沉淀,搅拌10min,过滤,得到268mg白色固体聚合物,收率为78.2%。1hnmr(400mhz,cdcl3)δ6.00-5.90(m,70h),5.36(d,j=17.1,1.7hz,70h),5.27(d,j=10.6,1.5hz,70h),4.58(dd,j=8.1,5.8hz,140h),4.32–4.20(m,280h),3.64(s,448h),3.38(s,3h)。mw:18045,mn:12600,pdi:1.432。
1.2.2ppe90(n=90)
ppe90的合成与纯化根据如上实施例1.2.1过程,得到386mg白色固体聚合物,收率为90.2%。1hnmr(400mhz,cdcl3)δ5.99-5.90(m,90h),5.37(d,j=17.1,1.7hz,90h),5.26(d,j=10.6,1.5hz,90h),4.54(dd,j=8.1,5.8hz,180h),4.30–4.20(m,360h),3.64(s,448h),3.38(s,3h)。mw:18945,mn:14127,pdi:1.341。
1.2.3ppe120(n=120)
ppe120的合成与纯化根据如上实施例1.2.1过程,得到479mg白色固体聚合物,收率为89.8%。1hnmr(400mhz,cdcl3)δ5.99-5.91(m,123h),5.35(d,j=17.1,1.7hz,123h),5.25(d,j=10.6,1.5hz,123h),4.54(dd,j=8.1,5.8hz,246h),4.28–4.24(m,492h),3.64(s,448h),3.37(s,3h)。mw:21479,mn:14461,pdi:1.485。
1.2.4ppe150(n=150)
ppe150的合成与纯化根据如上实施例1.2.1过程,得到577mg白色固体聚合物,收率为95.3%。1hnmr(400mhz,cdcl3)δ5.99-5.90(m,146h),5.36(d,j=17.1,1.7hz,146h),5.26(d,j=10.6,1.5hz,146h),4.54(dd,j=8.1,5.8hz,292h),4.27–4.24(m,584h),3.64(s,448h),3.38(s,3h)。mw:33489,mn:22443,pdi:1.492。
1.2.5ppe200(n=200)
ppe200的合成与纯化根据如上实施例1.2.1过程,得到638mg白色固体聚合物,收率为92.4%。1hnmr(400mhz,cdcl3)δ5.94(ddt,j=16.4,10.9,5.7hz,87h),5.38(dd,j=17.1,1.6hz,89h),5.27(dd,j=10.5,1.4hz,88h),4.58(dd,j=8.1,5.9hz,180h),4.36–4.17(m,367h),3.64(s,448h).3.38(s,3h)。mw:39356,mn:21908,pdi:1.796。
1.2.6ppe250(n=250)
ppe250的合成与纯化根据如上实施例1.2.1过程,得到769mg白色固体聚合物,收率为93.6%。1hnmr(400mhz,cdcl3)δ5.99-5.91(m,258h),5.36(d,j=17.1,1.7hz,258h),5.26(d,j=10.6,1.5hz,258h),4.54(dd,j=8.1,5.8hz,516h),4.28–4.25(m,1032h),3.64(s,448h),3.38(s,3h)。mw:39902,mn:22993,pdi:1.735。
1.2.7ppe300(n=300)
ppe300的合成与纯化根据如上实施例1.2.1过程,得到1048mg白色固体聚合物,收率为97.0%。1hnmr(400mhz,cdcl3)δ5.99-5.91(m,290h),5.36(d,j=17.1,1.7hz,290h),5.26(d,j=10.6,1.5hz,290h),4.54(dd,j=8.1,5.8hz,580h),4.27–4.25(m,1160h),3.65(s,448h),3.38(s,3h)。mw:43351,mn:24337,pdi:1.781。
1.2.8ho-ppe90(n=90)
ho-ppen
第一步,bn-ppe90:
bn-ppe90的合成与纯化根据如上实施例1.2.1过程,m-peg-5000替换为等摩尔量bn-peg-5000,得到605mg白色固体聚合物,收率为92.1%。1hnmr(400mhz,cdcl3)δ7.30(m,5h),5.99-5.90(m,90h),5.37(d,j=17.1,1.7hz,90h),5.26(d,j=10.6,1.5hz,90h),4.58(dd,j=8.1,5.8hz,182h),4.31–4.22(m,360h),3.66(s,448h)。mw:19744,mn:15217,pdi:1.297。
第二步,oh-ppe90
25ml高压反应器中加入500mgbn-ppe90,充分溶解于5ml甲醇后,加入50mgpd/c后加压至500psi,升温至50℃,48小时停止反应并过滤,滤液缓慢加入50ml甲基叔丁基醚,出现白色沉淀,搅拌10min,过滤,得到370mg白色固体聚合物,收率为74.4%。1hnmr(400mhz,cdcl3)δ5.99-5.89(m,90h),5.38(d,j=17.1,1.7hz,90h),5.26(d,j=10.6,1.5hz,90h),4.55(dd,j=8.1,5.8hz,182h),4.30–4.19(m,360h),3.64(s,450h),3.38。mw:19046,mn:14088,pdi:1.352。
1.3各侧链合成:
1.3.1tepr的合成:
1l的三口烧瓶中依次加入n-乙基正丙胺(34.8g,0.4mol),500ml二氯甲烷,体系用n2置换三次,然后环硫乙烷(48g,0.8mol)缓慢滴加到上述溶液中,滴加完毕后,反应体系在室温下搅拌反应过夜。终止反应,浓缩掉有机溶剂,最后得到的浓缩物减压蒸馏(0.2torr,38℃)得到24g产品,性状为无色透明液体,收率为40.8%。1hnmr(400mhz,cdcl3)δ4.81(d,j=8.5hz,4h),2.67–2.46(m,6h),2.37(dd,j=8.6,6.5hz,2h),1.51–1.37(m,2h),1.00(t,j=7.1hz,3h),0.87(t,j=7.3hz,3h).
1.3.2tprpr的合成:
1l的三口烧瓶中依次加入二正丙胺(40.4g,0.4mol),500ml二氯甲烷,体系用氮气置换三次,然后环硫乙烷(48g,0.8mol)缓慢滴加到上述溶液中,滴加完毕后,反应体系在室温条件下搅拌并反应过夜。终止反应,浓缩掉有机溶剂,最后得到的浓缩物减压蒸馏(0.2torr,42℃)得到21g产品,性状为无色透明液体,收率为32.6%。1hnmr(400mhz,cdcl3)δ2.69–2.54(m,4h),2.39(dd,j=8.5,6.6hz,4h),1.46(h,j=7.4hz,4h),0.89(t,j=7.4hz,6h).
1.3.3tprb的合成:
第一步:正丁基丙酰胺的合成(ib001-183-01):
正丁胺(40.15g,0.55mol)和et3n(101g,1mol)溶于500mldcm,冰浴冷却至0℃,氮气置换三次,丙酰氯(46.25g,0.5mol)缓慢滴加到上述溶液中,滴加完毕后,室温搅拌过夜。过滤除去et3n的盐,浓缩溶剂,粗产品减压蒸馏(80℃/0.4torr)得到45g产物,性状为无色透明液体,收率为69.7%。
第二步:丁基丙胺的合成(ib001-186-01):
正丁基丙酰胺(38.7g,0.3mol)溶于500mlthf,搅拌下分批次加入lialh4(12.54g,0.33mol),加完后回流反应过夜。冷却,搅拌下缓慢加入98ml1mol/l的naoh溶液,加完后硅藻土过滤,浓缩滤液,然后ea萃取(50ml×3),合并有机相,分别用h2o(50ml×1),nacl(50ml×1)洗涤,无水na2so4干燥,过滤,浓缩,粗产品减压蒸馏(65℃/0.4torr)得到12.5g丁基丙胺,性状为无色透明液体,收率为36.2%。
第一步:2-(丁基丙基氨基)-乙硫醇的合成(ib001-190-01):
丁基丙胺(11.5g,0.1mol)溶于100mldcm,氮气置换三次,然后环硫乙烷(12g,0.2mol)缓慢滴加到上述溶液中,滴加完毕后,室温搅拌反应过夜。浓缩溶剂,粗产品减压蒸馏(73℃/0.4torr)得到2-(丁基丙基氨基)-乙硫醇,性状为无色透明液体,收率为34.2%。1hnmr(400mhz,cdcl3)δ2.69–2.54(m,4h),2.46-2.39(dd,j=8.2,6.6hz,4h),1.63-1.39(m,4h),1.34(h,j=7.4hz,2h),0.91-0.85(m,6h).
1.3.4tbb的合成:
500ml的三口烧瓶中依次加入二正丁胺(25.8g,0.2mol),300ml二氯甲烷,体系用n2置换三次,然后环硫乙烷(24g,0.4mol)缓慢滴加到上述溶液中,滴加完毕后,室温反应过夜。终止反应并浓缩掉有机溶剂,最后得到的浓缩物减压蒸馏(0.2torr,49℃)得到11.4g产品,性状为无色透明液体,收率为30.1%。1hnmr(400mhz,cdcl3)δ2.63(dd,j=16.1,6.2hz,4h),2.45(t,j=7.4hz,4h),1.45(p,j=7.3hz,4h),1.34(p,j=7.2hz,4h),0.93(t,j=7.2hz,6h).
1.3.5tbpe的合成:
第一步:戊酸丁酰胺的合成(ib001-176-01)
正丁胺(16.06g,0.22mol)和et3n(40.4g,0.4mol)溶于2800mldcm,冰浴冷却至0℃,氮气置换三次,戊酰氯(24g,0.2mol)缓慢滴加到上述溶液中,滴加完毕后,室温搅拌过夜。
过滤除去et3n的盐,浓缩溶剂,粗产品减压蒸馏(82℃/0.4torr)得到16.3g产物,性状为无色透明液体,收率为52%。1hnmr(400mhz,cdcl3)δ3.24(td,j=7.2,5.7hz,2h),2.16(t,j=7.7hz,2h),1.61(dq,j=8.9,7.5hz,2h),1.55–1.42(m,2h),1.34(h,j=7.3hz,4h),0.92(td,j=7.3,3.0hz,6h)
第二步:丁基戊胺的合成(ib001-179-01)
戊酸丁酰胺(15.7g,0.1mol)溶于200mlthf,搅拌下分批次加入lialh4(4.18g,0.11mol),加完后回流反应过夜。冷却,搅拌下缓慢加入98ml1mol/l的naoh溶液,加完后硅藻土过滤,浓缩滤液,然后ea萃取(50ml×3),合并有机相,分别用h2o(50ml×1),nacl(50ml×1)洗涤,无水na2so4干燥,过滤,浓缩,粗产品减压蒸馏(68℃/0.4torr)得到5.4g丁基戊胺,性状为无色透明液体,收率为38%。1hnmr(400mhz,cdcl3)δδ2.57(m,4h),1.25-1.55(m,11h),0.89(m,6h)。
第三步:2-(丁基戊基氨基)-乙硫醇的合成(ib001-180-01)
丁基戊胺(10g,0.07mol)溶于50mldcm,氮气置换三次,然后环硫乙烷(8.4g,0.14mol)缓慢滴加到上述溶液中,滴加完毕后,室温搅拌反应过夜。浓缩溶剂,粗产品减压蒸馏(76℃/0.4torr)得到4.4g2-(丁基戊基氨基)-乙硫醇,性状为无色透明液体,收率为31%。1hnmr(400mhz,cdcl3)δ2.70–2.53(m,4h),2.42(td,j=7.5,3.5hz,4h),1.52–1.20(m,10h),0.92(q,j=7.1hz,6h).
1.3.6tpepe的合成(ib001-172-01):
二戊胺(15.7g,0.1mol)溶于200mldcm,氮气置换三次,然后环硫乙烷(12g,0.2mol)缓慢滴加到上述溶液中,滴加完毕后,室温搅拌反应过夜。浓缩溶剂,粗产品减压蒸馏(83℃/0.4torr)得到9.1g2-(二戊基氨基)-乙硫醇,性状为无色透明液体,收率为42%。
1hnmr(400mhzcdcl3)δ2.68–2.54(m,4h),2.49–2.36(m,4h),1.44(p,j=7.3hz,4h),1.39–1.20(m,8h),0.91(t,j=7.0hz,6h)。
1.3.7thh的合成(ib001-172-01):
二戊胺(15.7g,0.1mol)溶于200mldcm,氮气置换三次,然后环硫乙烷(12g,0.2mol)缓慢滴加到上述溶液中,滴加完毕后,室温搅拌反应过夜。浓缩溶剂,粗产品减压蒸馏(83℃/0.4torr)得到9.1g2-(二戊基氨基)-乙硫醇,性状为无色透明液体,收率为42%。
1hnmr(400mhz,cdcl3)δ2.68–2.54(m,4h),2.49–2.36(m,4h),1.44(p,j=7.3hz,4h),1.39–1.20(m,8h),0.91(t,j=7.0hz,6h)。
1.3.85-ala侧链的合成
第一步:合成6-三苯基巯基己烷-1-醇(ib004-045-01)
三苯基甲硫醇(8.29g,0.03mol)溶于30mletoh和30ml水,然后加入k2co3(4.14g,0.03mol),氩气保护,室温下搅拌30min,加入溴己醇(5.43g,0.03mol),升温至80℃搅拌反应过夜。停止反应,过滤,浓缩etoh,加入50ml水,ea萃取(50ml×3),合并有机相,水(50ml×1)洗涤,饱和nacl(50ml×1)洗涤,无水na2so4干燥,过滤,浓缩,油泵拉干,得到10.92g白色固体,收率为96.4%,不再做进一步纯化,直接用于下一步反应。1h-nmr(500mhz,chloroform-d)δ7.49-7.39(m,6h),7.29(t,j=7.7hz,6h),7.25-7.18(m,3h),3.58(t,j=6.6hz,2h),2.16(t,j=7.3hz,2h),1.54(s,1h),1.53-1.45(m,2h),1.45-1.38(m,2h),1.34-1.18(m,4h).
第二步:合成5-fmo-5-氨基-4-氧代戊酸6-三苯基巯基己酯(ib004-055-01)
6-三苯基巯基己烷-1-醇(3.77g,0.01mol)溶于30mlthf,然后加入socl2(1.67g,0.014mol),搅拌10min,加入5-fmoc-5-氨基乙酰丙酸盐酸盐(1.67g,0.01mol),室温搅拌反应过夜。缓慢加入50ml饱和nahco3溶液,所得溶液ea萃取(50ml×3),合并有机相,水(50ml×1)洗涤,饱和nacl(50ml×1)洗涤,无水na2so4干燥,过滤,浓缩,粗产品硅胶柱分离纯化(ea:pe=1:25),共得到4.17g产物,性状为无色透明油状物,收率为58.7%。1h-nmr(500mhz,chloroform-d)δ7.89(m,2h),7.73-7.65(m,4h),7.49-7.39(m,8h),7.29(t,j=7.7hz,6h),7.25-7.18(m,3h),4.07(2h,brs),3.58(t,j=6.6hz,2h),2.87(2h,t,j=6.5hz),2.63(2h,t,j=6.5hz),2.16(t,j=7.3hz,2h),1.53-1.45(m,2h),1.45-1.38(m,2h),1.34-1.18(m,4h).
第三步:合成5-fmoc-5-氨基-4-氧代戊酸6-巯基己酯(ib004-063-01)
5-fmoc-5-氨基-4-氧代戊酸6-三苯基巯基己酯(3.56g,5mmol)溶于50mldcm,然后依次加入et3sih(3.41g,29.4mmol)和tfa(6.7g,58.8mmol),室温搅拌反应1h.浓缩溶剂,加入50ml水,缓慢加入50ml饱和nahco3溶液,所得溶液ea萃取(50ml×3),合并有机相,水(50ml×1)洗涤,饱和nacl(50ml×1)洗涤,无水na2so4干燥,过滤,浓缩,粗产品硅胶柱分离纯化(ea:pe=1:5),共得到1.05g产物,性状为无色透明油状物,收率为44.8%。1h-nmr(500mhz,chloroform-d)δ7.89(m,2h),7.73-7.65(m,4h),7.45(m,2h),4.31-4.25(m,3h),4.07(m,4h),3.57(t,j=6.6hz,2h),2.87(2h,t,j=6.5hz),2.63(2h,t,j=6.5hz),2.16(t,j=7.3hz,2h),1.54(s,1h),1.53-1.45(m,2h),1.45-1.38(m,2h),1.32-1.15(m,4h).
1.4侧链的偶联:
1.4.1ppe70-tprb(ib003-167-01)
在h2o和o2指标小于0.1ppm的手套箱中,称量ppe70(255mg,0.015mmol)溶解于4.5ml二氯甲烷中,加入半胱胺盐酸盐(5.12mg,0.045mmol),再加入dmpa(25mg,10%wt),在365nm紫外灯照射下,室温搅拌反应1h,加入tprb(222.4mg,1.05mmol),再加入dmpa(25mg,10%wt),在365nm紫外灯照射下,室温搅拌反应1h,移出手套箱。旋转蒸发除去溶剂,加入10ml50%乙醇,使用超滤离心管,离心超滤45分钟,重复三次,旋转蒸发浓缩后真空干燥,得到白色固体产物434.6mg,,收率90.6%。1hnmr(400mhz,cdcl3)δ4.31–4.22(m,420h),3.63(s,448h),3.34–3.31(m,143h),3.14-3.08(m,268h),2.89-2.87(m,140h),2.70-2.68(m,140h),2.00-1.97(m,140h),1.61(m,268h),1.29–1.26(m,134h),0.87–0.81(m,402h).
1.4.2ppe90-tprb
ppe90-tprb的合成与纯化根据如上实施例1.4.1过程,其中ppe70替换为等摩尔量的ppe90,并使用对应摩尔比的tprb,得到205mg白色固体聚合物,收率为88.4%。1hnmr(400mhz,cdcl3)δ4.31–4.22(m,540h),3.63(s,448h),3.34–3.30(m,183h),3.15-3.07(m,348h),2.89-2.87(m,180h),2.70-2.67(m,180h),2.00-1.97(m,180h),1.61(m,348h),1.29–1.26(m,174h),0.87-080(m,522h).
1.4.3ppe120-tprb
ppe120-tprb的合成与纯化根据如上实施例1.4.1过程,其中ppe70替换为等摩尔量的ppe120,并使用对应摩尔比的tprb,得到104mg白色固体聚合物,收率为87.8%。1hnmr(400mhz,cdcl3)δ4.32–4.27(m,738h),3.63(s,448h),3.33–3.28(m,255h),3.20-3.14(m,480h),2.89-2.86(m,246h),2.75-2.69(m,246h),2.00-1.96(m,246h),1.63–1.60(m,480h),1.31–1.27(m,240h),0.84–0.79(m,720h)。
1.4.4ppe150-tprb
ppe150-tprb的合成与纯化根据如上实施例1.4.1过程,其中ppe70替换为等摩尔量的ppe150并使用对应摩尔比的tprb,得到205mg白色固体,收率为86.3%。1hnmr(400mhz,cdcl3)δ4.31–4.22(m,876h),3.63(s,448h),3.34–3.30(m,295h),3.14-3.07(m,572h),2.88-2.87(m,292h),2.70-2.67(m,292h),1.99-1.97(m,292h),1.60(m,572h),1.29–1.26(m,286h),0.87-080(m,858h)。
1.4.5ppe200-tprb(ib002-086-01)
ppe200-tprb的合成与纯化根据如上实施例1.4.1过程,其中ppe70替换为等摩尔量的ppe200并使用对应摩尔比的tprb,得到323mg白色固体,收率为84.3%。1hnmr(400mhz,d2o)δ4.14–3.89(m,1244h),3.37(s,448h),3.15–2.36(m,2292h),1.80–0.97(m,1758h),0.83(dt,j=13.9,7.4hz,1273h).
1.4.6ppe250-tprb
ppe250-tprb的合成与纯化根据如上实施例1.4.1过程,其中ppe70替换为等摩尔量的ppe250并使用对应摩尔比的tprb,得到205mg白色固体,收率为86.3%。1hnmr(400mhz,cdcl3)δ4.30–4.21(m,1548h),3.63(s,448h),3.34–3.31(m,519h),3.15-3.07(m,1020h),2.88-2.87(m,516h),2.71-2.68(m,516h),2.00-1.96(m,516h),1.61(m,1020h),1.30–1.26(m,510h),0.87-080(m,1530h)。
1.4.7ppe300-tprb
ppe300-tprb的合成与纯化根据如上实施例1.4.1过程,其中ppe70替换为等摩尔量的ppe300并使用对应摩尔比的tprb,得到526mg白色固体,收率为92.6%。1hnmr(400mhz,cdcl3)δ4.32–4.21(m,1740h),3.63(s,448h),3.34–3.30(m,583h),3.15-3.07(m,1148h),2.89-2.87(m,580h),2.70-2.67(m,580h),1.99-1.97(m,580h),1.60(m,1148h),1.29–1.26(m,574h),0.87-080(m,1722h)。
1.4.8ppe200-tprb-40c5
ppe200-tprb40c5的合成路线如下式所示,合成与纯化根据如上实施例1.4.1过程,其中ppe70替换为等摩尔量的ppe200并使用对应摩尔比的tpr和c5h11sh,得到176mg白色固体,收率为72.6%。1hnmr(400mhz,d2o)δ4.31–4.22(m,1200h),3.68(s,448h),3.35-3.30(m,323h),3.16-3.12(m,628h),2.91-2.88(m,320h),2.70-2.67(m,480h),1.99-1.95(m,400h),1.64(m,628h),1.33–1.28(m,554h),0.86-078(m,1062h)。
1.4.9ppe200-tprb-40c9
ppe200-tprb40c9的合成路线如下式所示,合成与纯化根据如上实施例1.4.1过程,其中ppe70替换为等摩尔量的ppe200并使用对应摩尔比的tpr和c9h19sh,得到191mg白色固体,收率为80.2%。1hnmr(400mhz,d2o)δ4.32–4.20(m,1200h),3.68(s,448h),3.35-3.30(m,320h),3.15-3.07(m,628h),2.89-2.87(m,320h),2.72-2.68(m,480h),2.00-1.96(m,400h),1.60(m,628h),1.29–1.27(m,874h),0.85–0.77(m,1062h)。
1.4.10ppe200-tprb-80c9
ppe200-tprb80c9的合成路线如下式所示,合成与纯化根据如上实施例1.4.1过程,其中ppe70替换为等摩尔量的ppe200并使用对应摩尔比的tpr和c9h19sh,得到202mg白色固体,收率为83.8%。1hnmr(400mhz,d2o)δ4.32–4.20(m,1200h),3.66(s,448h),3.34-3.29(m,。243h),3.13-3.08(m,468h),2.90-2.84(m,240h),2.69(m,560h),2.00-1.95(m,400h),1.61(m,468h),1.29–1.26(m,1354h),0.86–0.78(m,942h)。
1.4.11ppe90-tepr
ppe90-tepr的合成与纯化根据如上实施例1.4.2过程(tprb替换为等摩尔量tepr,具体化学反应如下式所示),得到130mg白色固体,收率为60.5%。1hnmr(400mhz,cdcl3)δ4.33–4.22(m,540h),3.61(s,448h),3.34-3.27(m,183h),3.18-3.09(m,348h),2.90-2.87(m,180h),2.76-2.66(m,180h),2.00-1.97(m,180h),1.62(m,174h),1.26–1.23(m,126h),0.88–0.81(m,261h)。
1.4.12ppe90-tprpr
ppe90-tprpr的合成与纯化根据如上实施例1.4.2过程(tprb替换为等摩尔量tprpr,具体化学反应如下式所示),得到119mg白色固体,收率为65.5%。1hnmr(400mhz,d2o)δ4.32–4.25(m,540h),3.65(s,448h),3.37-3.31(m,183h),3.11-3.08(m,348h),2.90-2.88(m,180h),2.72-2.67(m,180h),2.02-1.99(m,180h),1.64–1.58(m,348h),0.84–0.81,(m,522h)。
1.4.13ppe90-tbb
ppe90-tbb的合成与纯化根据如上实施例1.4.2过程(tprb替换为等摩尔量tbb,具体化学反应如下式所示),得到150mg白色固体,收率为63.6%。1hnmr(400mhz,cdcl3)δ4.33–4.23(m,540h),3.66(s,448h),3.34-3.31(m,183h),3.15-3.08(m,348h),2.90-2.88(m,180h),2.73-2.68(m,180h),2.02-1.94(m,180h),1.59(m,348h),1.26–1.23(m,348h),0.84–0.81(m,522h)。
1.4.14ppe90-tbpe
ppe90-tbpe的合成与纯化根据如上实施例1.4.2过程(tprb替换为等摩尔量tbpe,具体化学反应如下式所示),得到80mg白色固体,收率为63.5%。1hnmr(400mhz,cdcl3)δ4.33–4.23(m,540h),3.66(s,448h),3.34-3.31(m,183h),3.15-3.08(m,348h),2.90-2.88(m,180h),2.73-2.68(m,180h),2.02-1.94(m,180h),1.59(m,348h),1.26–1.23(m,348h),0.84–0.81(m,522h)。
1.4.15ppe90-tpepe
ppe90-tpepe的合成与纯化根据如上实施例1.4.2过程(tprb替换为等摩尔量tpepe,具体化学反应如下式所示),得到165mg白色固体,收率为73.9%。1hnmr(400mhz,cdcl3)δ4.31–4.21(m,540h),3.63(s,448h),3.34-3.31(m,183h),3.14-3.07(m,348h),2.89-2.87(m,180h),2.70-2.67(m,180h),2.00-1.96(m,180h),1.61(m,348h),1.30–1.26(m,696h),0.87–0.80(m,522h)。
1.4.16ppe90-thh
ppe90-thh的合成与纯化根据如上实施例1.4.2过程(tprb替换为等摩尔量thh,具体化学反应如下式所示),得到176mg白色固体,收率为72.6%。1hnmr(400mhz,cdcl3)δ4.32–4.22(m,540h),3.63(s,448h),3.34-3.30(m,183h),3.15-3.07(m,348h),2.88-2.87(m,180h),2.71-2.67(m,180h),2.00-1.97(m,180h),1.60(m,348h),1.29–1.26(m,1044h),0.87-080(m,522h)。
1.4.17oh-ppe90-tprb
oh-ppe90-tprb的合成与纯化根据如上实施例1.4.2过程(ppe90替换为等摩尔量的oh-ppe90并使用等摩尔量tprb,具体化学反应如下式所示),得到176mg白色固体,收率为72.6%。1hnmr(400mhz,cdcl3)δ4.31–4.22(m,540h),3.62(s,448h),3.34–3.31(m,180h),3.12(m,348h),2.88(m,180h),2.70-2.66(m,180h),2.01-1.98(m,180h),1.61(m,348h),1.29–1.26(m,174h)0.87–0.79(m,522h).
1.4.18ppe90-tprb-fmocala10
ppe90-tepr-fmocala10的合成与纯化根据如上实施例1.4.2过程(tprb替换为77摩尔量tepr和10摩尔量的5-fmoc-5-氨基-4-氧代戊酸6-巯基己酯,具体化学反应如下式所示),得到185mg白色固体,收率为71.9%。1hnmr(400mhz,cdcl3)δ7.87(m,20h),7.73-7.63(m,40h),7.44(m,20h),4.31–4.22(m,570h),4.01(br,40h),3.82–3.55(m,488h),3.34–3.31(m,157h),3.12(m,308h),2.87(m,200h),2.70-2.61(m,200h),2.12(t,j=7.2hz,20h),2.01-1.98(m,180h),1.61-1.41(m,338h),1.29–1.14(m,254h),0.87–0.79(m,522h).
1.5荧光分子的偶联:
1.5.1ppe70-tprb-icg3
聚合物ppe70-tprb(125mg,0.0069mmol)溶于2mldmf,依次加入icg-osu(25.8mg,0.031mmol)和diea(51mg,0.396mmol),加完后,室温搅拌过夜。浓缩dmf,残余物溶于100ml无水乙醇,用陶瓷膜(5k)纯化2h,浓缩去除etoh,真空干燥后得到92mg聚合物,性状为深绿色固体,收率为73.1%。1hnmr(400mhz,cdcl3)δ8.12–7.47(m,45h),6.74–6.41(m,12h),4.36–4.23(m,420h),3.64(s,448h),3.38–3.30(m,140h),3.12-3.07(m,268h),2.93-2.88(m,140h),2.72-2.66(m,140h),1.99-1.31(m,632h),0.89–0.80(m,402h)。
1.5.2ppe90-tprb-icg3
ppe90-tprb-icg3的合成与纯化根据如上实施例1.5.1过程(ppe70-tprb替换为等摩尔量ppe90-tprb),得到77.2mg聚合物,性状为深绿色固体,收率为80.9%。1hnmr(400mhz,cdcl3)δ8.12–7.47(m,45h),6.74–6.44(m,12h),4.31–4.22(m,540h),3.63(s,448h),3.34–3.31(m,186h),3.14-3.08(m,348h),2.89-2.87(m,180h),2.70-2.68(m,180h),2.02-1.28(m,792h),0.87-080(m,522h)。
1.5.3ppe120-tprb-icg3
ppe120-tprb-icg3的合成与纯化根据如上实施例1.5.1过程(ppe70-tprb替换为等摩尔量ppe120-tprb),得到45.3mg聚合物,性状为深绿色固体,收率为81.4%。1hnmr(400mhz,cdcl3)δ8.09–7.45(m,45h),6.75–6.47(m,12h),4.35–4.20(m,738h),3.64(s,448h),3.37–3.35(m,252h),3.20-3.04(m,480h),2.92-2.89(m,246h),2.68-2.65(m,246h),2.02-1.26(m,1056h),0.88–0.79(m,720h)。
1.5.4ppe150-tprb-icg3
ppe150-tprb-icg3的合成与纯化根据如上实施例1.5.1过程(ppe70-tprb替换为等摩尔量ppe150-tprb),得到51mg聚合物,性状为深绿色固体,收率为79.8%。1hnmr(400mhz,cdcl3)δ8.10–7.47(m,45h),6.77–6.49(m,12h),4.34–4.20(m,876h),3.61(s,448h),3.35–3.32(m,298h),3.17-3.06(m,572h),2.90-2.86(m,292h),2.72-2.68(m,292h),2.00-1.26(m,1240h),0.85–0.79(m,858h)。
1.5.5ppe200-tprb-icg3(ib002-091-01)
ppe200-tprb-20c5-icg3的合成与纯化根据如上实施例1.5.1过程(ppe70-tprb替换为等摩尔量ppe200-tprb),得到60mg聚合物,性状为深绿色固体,收率为72.6%。1hnmr(400mhz,cdcl3)δ8.09–7.48(m,45h),6.76–6.49(m,12h),4.33–4.25(m,1218h),3.65(s,448h),3.38–3.35(m,415h),3.17-3.04(m,800h),2.92-2.89(m,406h),2.72-2.69(m,406h),2.00-1.27(m,1696h),0.89–0.80(m,1200h)。
1.5.6ppe250-tprb-icg3
ppe250-tprb-icg3的合成与纯化根据如上实施例1.5.1过程(ppe70-tprb替换为等摩尔量ppe250-tprb),得到59.3mg聚合物,性状为深绿色固体,收率为79.6%。1hnmr(400mhz,cdcl3)δ8.10–7.47(m,45h),6.73–6.46(m,12h),4.32–4.23(m,1548h),3.63(s,448h),3.33–3.29(m,5252h),3.19-3.08(m,1020h),2.91-2.87(m,516h),2.70-2.65(m,516h),2.02-1.26(m,2136h),0.87–0.79(m,1530h)。
1.5.7ppe300-tprb-icg3
ppe300-tprb-icg3的合成与纯化根据如上实施例1.5.1过程(ppe70-tprb替换为等摩尔量ppe300-tprb),得到92mg聚合物,性状为深绿色固体,收率为86.7%。1hnmr(400mhz,cdcl3)δ8.12–7.51(m,45h),6.734–6.42(m,12h),4.36–4.22(m,1740h),3.65(s,448h),3.37–3.34(m,589h),3.16-3.11(m,1148h),2.91-2.89(m,580h),2.71-2.69(m,580h),2.02-1.24(m,2392h),0.87–0.83(m,1722h)。
1.5.8ppe200-tprb-40c5-icg3
ppe200-tprb-20c5-icg3的合成与纯化根据如上实施例1.5.1过程(ppe70-tprb替换为等摩尔量ppe200-tprb-40c5,具体化学反应如下式所示),得到60mg聚合物,性状为深绿色固体,收率为72.6%。1hnmr(400mhz,cdcl3)δ8.16–7.47(m,45h),6.74–6.49(m,12h),4.32–4.25(m,1200h),3.63(s,448h),3.35–3.31(m,363h),3.18-3.09(m,708h),2.90-2.87(m,360h),2.72-2.66(m,440h),2.00-1.30(m,1672h),0.88–0.78(m,1122h)。
1.5.9ppe200-tprb-40c9-icg3
ppe200-tprb-40c9-icg3的合成与纯化根据如上实施例1.5.1过程(ppe70-tprb替换为等摩尔量ppe200-tprb-40c9,具体化学反应如下式所示),得到52.1mg聚合物,性状为深绿色固体,收率为88.1%。1hnmr(400mhz,cdcl3)δ8.10–7.46(m,45h),6.78–6.47(m,12h),4.35–4.26(m,1200h),3.63(s,448h),3.39–3.30(m,323h),3.20-3.12(m,628h),2.91-2.86(m,320h),2.72-2.66(m,480h),2.04-1.28(m,1992h),0.87–0.82(m,1062h)。
1.5.10ppe200-tprb-80c9-icg3
ppe200-tprb-80c9-icg3的合成与纯化根据如上实施例1.5.1过程(ppe70-tprb替换为等摩尔量ppe200-tprb-80c9,具体化学反应如下式所示),得到77mg聚合物,性状为深绿色固体,收率为74.2%。1hnmr(400mhz,cdcl3)δ8.13–7.50(m,45h),6.72–6.48(m,12h),4.36–4.27(m,1200h),3.63(s,448h),3.36–3.33(m,243h),3.14-3.04(m,468h),2.90-2.88(m,240h),2.72-2.69(m,560h),2.04-1.29(m,2312h),0.89–0.81(m,942h)。
1.5.11ppe90-tepr-icg3
ppe90-tepr-icg3的合成与纯化根据如上实施例1.5.1过程(ppe70-tprb替换为等摩尔量ppe90-tepr,具体化学反应如下式所示),得到90mg聚合物,性状为深绿色固体,收率为95.4%。1hnmr(400mhz,cdcl3)δ8.11–7.51(m,45h),6.72–6.47(m,12h),4.29–4.20(m,540h),3.61(s,448h),3.33–3.30(m,183h),3.15-3.10(m,348h),2.89-2.87(m,180h),2.70-2.65(m,180h),2.02-1.25(m,705h),0.84–0.79(m,261h)。
1.5.12ppe90-tprpr-icg3
ppe90-tpp-icg3的合成与纯化根据如上实施例1.5.1过程(ppe70-tprb替换为等摩尔量ppe90-tprpr,具体化学反应如下式所示),得到90mg聚合物,性状为深绿色固体,收率为56.9%。1hnmr(400mhz,cdcl3)δ8.16–7.44(m,45h),6.73–6.46(m,12h),4.31–4.25(m,540h),3.63(s,448h),3.36–3.32(m,183h),3.17-3.08(m,348h),2.92-2.90(m,180h),2.71-2.66(m,180h),2.00-1.27(m,618h),0.86–0.79(m,522h)。
1.5.13ppe90-tbb-icg3
ppe90-tbb-icg3的合成与纯化根据如上实施例1.5.1过程(ppe70-tprb替换为等摩尔量ppe90-tbb,具体化学反应如下式所示),得到38.2mg聚合物,性状为深绿色固体,收率为82.5%。1hnmr(400mhz,cdcl3)δ8.14–7.51(m,45h),6.78–6.44(m,12h),4.33–4.19(m,540h),3.61(s,448h),3.39–3.36(m,183h),3.17-3.09(m,348h),2.92-2.89(m,180h),2.70-2.67(m,180h),2.02-1.31(m,996h),0.90–0.82(m,522h)。
1.5.14ppe90-tbpe-icg3
ppe90-tbpe-icg3的合成与纯化根据如上实施例1.5.1过程(ppe70-tprb替换为等摩尔量ppe90-tbpe,具体化学反应如下式所示),得到33.7mg聚合物,性状为深绿色固体,收率为84.7%。1hnmr(400mhz,cdcl3)δ8.16–7.52(m,45h),6.72–6.46(m,12h),4.34–4.24(m,540h),3.66(s,448h),3.31–3.27(m,183h),3.13-3.10(m,348h),2.92-2.87(m,180h),2.70-2.66(m,180h),2.00-1.31(m,1140h),0.90–0.77(m,522h)。
1.5.15ppe90-tpepe-icg3
ppe90-tpepe-icg3的合成与纯化根据如上实施例1.5.1过程(ppe70-tprb替换为等摩尔量ppe90-tpepe,具体化学反应如下式所示),得到35.6mg聚合物,性状为深绿色固体,收率为73.2%。1hnmr(400mhz,cdcl3)δ8.10–7.52(m,45h),6.73–6.45(m,12h),4.33–4.29(m,540h),3.64(s,448h),3.35–3.27(m,183h),3.15-3.10(m,348h),2.89-2.84(m,180h),2.71-2.68(m,180h),2.02-1.28(m,1314h),0.88–0.80(m,522h)。
1.5.16ppe90-thh-icg3
ppe90-thh-icg3的合成与纯化根据如上实施例1.5.1过程(ppe70-tprb替换为等摩尔量ppe90-thh,具体化学反应如下式所示),得到36.8mg聚合物,性状为深绿色固体,收率为75.4%。1hnmr(400mhz,cdcl3)δ8.16–7.48(m,45h),6.73–6.45(m,12h),4.30–4.22(m,540h),3.63(s,448h),3.34–3.30(m,183h),3.14-3.09(m,348h),2.89-2.86(m,180h),2.73-2.71(m,180h),2.04-1.27(m,1662h),0.89–0.80(m,522h)。
1.5.17oh-ppe90-tprb-icg3
oh-ppe90-tepr-icg3的合成与纯化根据如上实施例1.5.1过程(ppe70-tprb替换为等摩尔量oh-ppe90-tprb,具体化学反应如下式所示),得到37.1mg聚合物,性状为深绿色固体,收率为76.5%。1hnmr(400mhz,cdcl3)δ8.17–7.53(m,45h),6.72–6.45(m,12h),4.33–4.23(m,540h),3.66(s,448h),3.31–3.28(m,180h),3.14-3.10(m,348h),2.94-2.88(m,180h),2.68(m,180h),2.01-1.30(m,792h),0.91–0.78(m,522h)。
1.5.18ppe90-tprb-ala10-icg3
ppe90-tepr-ala10-icg3的合成如下式所示,聚合物ppe90-tprb-fmoc-ala10(150mg,0.0039mmol)溶于2mldmf,依次加入icg-osu(5.8mg,0.0069mmol)和diea(25mg,0.2mmol),加完后,室温搅拌过夜后,旋转蒸发除去diea,加入0.2ml哌啶,室温搅拌0.5小时,浓缩dmf,残余物溶于100ml无水乙醇,用陶瓷膜(5k)纯化2h,浓缩去除etoh,真空干燥后得到112mg聚合物,性状为深绿色固体,收率为74.4%。1hnmr(400mhz,cdcl3)δ8.17–7.53(m,45h),6.72–6.45(m,12h),4.32–4.20(m,570h),4.04(br,20h),3.82–3.55(m,488h),3.34–3.31(m,154h),3.13(m,308h),2.87(m,2000h),2.70-2.60(m,200h),2.12(t,j=7.2hz,20h),2.01-1.98(m,180h),1.61-1.41(m,338h),1.29–1.14(m,254h),0.87–0.79(m,522h).
实施例2
pka测试:
精确称取实施例1(1.4.3,1.4.11-1.4.15)所制备的聚合物30mg,溶于30ml0.01mol/l的三氟乙酸溶液中,用0.1mol/l的氢氧化钠溶液在ph计的指示下滴定,记录消耗的氢氧化钠溶液的体积和对应的ph值,以体积对ph值通过origin软件作图,pka值为两条切线与平台切线的两个交点之和的二分之一,具体结果如图1所示。由图1可知,ppe的侧链连接亲水叔胺的pka的大于连接疏水叔胺的pka。
实施例3
典型的ppe纳米荧光探针的cmc测试:
将1×10-5mol/l的尼罗红的二氯甲烷溶液2μl加入到一系列浓度(1×10-6~1×10-1mg/ml)的聚合物(实施例1.4.1与1.4.5)的pbs8.0溶液中,使用涡旋混匀器混合均匀后,静置待其稳定,测试溶液的荧光强度。通过荧光强度对浓度作图,临界胶束浓度确定为的两个切线的交点。所有测试的纳米探针的临界胶束浓度均小于10ng/ml。图2展示了两种典型聚合物的cmc测试结果,左图为ppe90-tprb的测试结果,右图为ppe200-tprb的测试结果。
实施例4
4.1纳米粒子溶液制备及表征:
5mg聚合物溶于0.2mlch3cn,超声条件下加入到5ml去离子水中,在旋转蒸发仪上浓缩ch3cn,补加去离子水至体积为5ml,所得储备液的浓度为1mg/ml。
4.2dls测试:
本实施例中所使用的样品与实施例2相同,使用ppe90-tprb进行纳米粒子溶液制备,此溶液ph值约为8.0,浓度为1mg/ml,室温下(20℃)取样进行dls(使用仪器为:brookhavenomnidynamiclightscattering(dls)particlesizerandzetapetentialanalyzer,其它所有dls测试在malvernzetasizerultra,he-nelaser,λ=633nm上测得)测试,所得数据如图3a所示,纳米粒子为29.9nm,且粒径均一均匀分布。
将实施例4.1的纳米粒子溶液中滴入pbs6.0,摇匀样品2分钟后进行dls测试,所得数据如图3b所示,高分子纳米粒子全部解散。
4.3tem测试:
使用ppe90-tprb-icg进行纳米粒子溶液制备,此溶液浓度为1mg/ml,ph值约为8.0,取样进行tem测试(thermofisherscientific(原fei),型号:talosf200s,产地:荷兰),所得数据结果如图3c所示,纳米粒子约为20-50nm,且粒径均一,均匀分布。
将上述纳米粒子溶液滴入pbs6.0溶液进行tem测试,所得数据结果如图3d所示。与图3c相比,高分子纳米粒子全部解散。
实施例5
5.1荧光测试:
100ul纳米粒子储备液(1mg/ml,制备方法参照实施例4.1)稀释到2.0ml的pbs缓冲液(ph5.5-8.0)中,充分混合均匀并测量发射荧光。激发光波长为730nm,发射光波长检测范围为785-900nm。ppe系列荧光探针性质分别如表1所示,其中:
pka和cmc测量方法参照实施例2和3。
荧光强度比值(fir)的计算,纳米荧光探针在ph6.0缓冲溶液中821nm处的荧光强度与ph8.0缓冲溶液中821nm处的荧光强度的比值,计算方法如下:
fir=i821(ph6.0)/i821(ph8.0)
ph转变点(pht)的计算:取不同ph值821nm处荧光强度,进行数学归一化,以ph对荧光强度作图,所得散点图,用boltzmann函数拟合。最高荧光值的50%荧光强度处的ph值即为pht。
ph50%。ph突变范围计算方法如下:
δph10%~90%=ph10%-ph90%
表1ppe纳米荧光探针的筛选
5.2疏水嵌段(ppe)的聚合度对fir,pht和δph的影响
纳米粒子储备液(1mg/ml,制备方法参照实施例4.1)荧光测试参照实施例5.1。不同聚合度(dp)的ppe-tprb-icg3在821nm处的荧光发射强度与ph的关系总结见表1和图4a,不同dp的ppe-tprb-icg3不同pbs缓冲液中的荧光发射谱图见图4b-4h。
5.3疏水侧链对ppe200-tprb的fir,pht和δph的影响
纳米粒子储备液(1mg/ml,制备方法参照实施例4.1)荧光测试参照实施例5.1。侧链连接20%c5h11,20%c9h19或40%c9h19疏水侧链的ppe200-tprb-icg3荧光探针的荧光发射谱图与ph的关系总结见表1和图5。当ppe200的探针侧链连接20%c5h11时,其pht稍有降低,fir也有所降低;当ppe200的探针侧链连接20%和40%c9h19时,其pht显著降低,20%c9h19的侧链能够提高fir。20%的c5h11和c9h19的疏水侧链显著降低了δph。
5.4侧链叔胺对ppe200-icg3的fir,pht和δph的影响
纳米粒子储备液(1mg/ml,制备方法参照实施例4.1)荧光测试参照实施例5.1。侧链连接tprpr,tprb,tbb,tbpe,tpepe或thh的ppe200-tprb-icg3荧光探针的荧光发射谱图与ph的关系总结见表1和图6。随着侧链叔胺的疏水性的增加,探针的pht随之降低,fir和δph未有规律性的改变。
综上所述,本申请有效克服了现有技术中的种种缺点而具高度产业利用价值。
上述实施例仅例示性说明本申请的原理及其功效,而非用于限制本申请。任何熟悉此技术的人士皆可在不违背本申请的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本申请所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本申请的权利要求所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!