一种同时检测DNA多种甲基转移酶的生物传感器及其检测方法和应用与流程
一种同时检测dna多种甲基转移酶的生物传感器及其检测方法和应用
技术领域
[0001]
本发明属于分子检测技术领域,具体涉及一种同时检测多种dna甲基转移酶的生物传感器及其检测方法和应用。
背景技术:
[0002]
公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
[0003]
dna甲基转移酶(mtases)异常表达与多种疾病密切相关,dna甲基转移酶(mtases)的异常活性可能破坏正常的dna甲基化模式,诱发多种癌症,包括肺癌,乳腺癌,前列腺癌,结肠癌,肝癌,肾癌,宫颈癌,甲状腺癌,成视网膜细胞瘤,和血液系统癌症等。dna甲基转移酶(mtases)成为临床疾病诊断的潜在生物标志物。此外,抑制dna甲基转移酶(mtases)活性可能会阻断dna甲基化,为抗癌药物的研发提供了新途径。因此,dna甲基转移酶(mtases)的灵敏检测在生物医学研究和临床诊断中具有重要意义。
[0004]
dna甲基转移酶(mtases)活性传统的检测方法包括放射性标记法,酶联免疫测定法和高效液相色谱法,但是这些方法通常会产生放射性污染,耗时长且灵敏度低。最近,已经开发出了一系列基于dna探针的新型方法来灵敏地检测dna甲基转移酶(mtases)的活性,包括比色法,化学发光法,电化学法,表面增强拉曼散射法,和荧光法。双链dna(dsdna),发夹dna探针和分子信标通常用作dna甲基转移酶(mtases)的底物。但是,将它们应用于检测多个dna甲基转移酶(mtases)时存在一些限制。例如,同时检测多种dna甲基转移酶(mtases)时需要额外的底物探针和不同标记的荧光团,这使实验过程变得复杂并增加了成本。
[0005]
发明人发现,传统检测方法中,放射性标记法中的放射性元素可能会对人体健康和环境造成危害,酶联免疫测定法步骤繁琐,成本较高。高效液相色谱法耗时较长,且灵敏度不高。新型的检测方法包括比色法,化学发光法,电化学法,表面增强拉曼散射法,和荧光法。但是将它们应用于同时检测多种dna甲基转移酶(mtases)时存在一些限制,这些方法需要额外的底物探针和不同颜色的荧光团,这使实验过程变得复杂并增加了成本。因此开发一种简单灵敏并且可以同时检测多种dna甲基转移酶(mtases)的方法是一个巨大的挑战。
技术实现要素:
[0006]
针对现有技术的不足,本发明提供一种同时检测多种dna甲基转移酶的生物传感器及其检测方法和应用。在生物传感器中通过该设计一种具有双信号放大功能的哑铃探针,其具有两种甲基化酶的识别位点,从而基于哑铃探针的双信号放大技术同时配合环形模板和信号探针从而实现对种甲基化酶的超灵敏检测,因此具有良好的实际应用之价值。
[0007]
为实现上述技术目的,本发明采用的技术方案如下:
[0008]
本发明的第一个方面,提供一种同时检测多种dna甲基转移酶的生物传感器,所述生物传感器至少包括:哑铃式探针、环形模板和信号探针。
[0009]
其中,所述哑铃式探针包括茎区域和位于茎区域两端的两个环区域;其中茎区域包含待测甲基转移酶的识别序列;
[0010]
所述环形模板用于滚环扩增(rca),其至少包括引物结合位点、nb.btsi的切口位点和与信号探针互补的片段;
[0011]
所述信号探针用于触发endo iv辅助信号放大反应,其至少含有一个脱嘌呤/脱嘧啶(ap)位点,所述ap位点两侧分别被荧光基团和猝灭基团修饰。
[0012]
本发明的第二个方面,提供上述生物传感器在dna甲基转移酶中的应用;
[0013]
更具体的,所述dna甲基转移酶至少为两个;
[0014]
所述dna甲基转移酶包括但不限于dna腺嘌呤甲基转移酶(dam)、胞嘧啶甲基转移酶(m.sssi)。
[0015]
本发明的第三个方面,提供一种同时检测多种dna甲基转移酶的方法,所述方法包括:
[0016]
1)将待测样品和哑铃式探针混合反应后高温终止反应;
[0017]
2)将步骤1)产物加入环形模板进行滚环扩增反应后高温终止反应;
[0018]
3)将步骤2)所得rca产物与信号探针混合进行核酸内切酶iv辅助的信号放大反应并高温终止反应。
[0019]
所述检测方法还包括采用荧光检测系统测定荧光信号,从而实现对dna甲基转移酶的定量检测。
[0020]
本发明的第四个方面,提供上述生物传感器和/或检测方法在dna甲基转移酶活性检测和/或筛选dna甲基转移酶药物中的应用。
[0021]
与现有技术相比,上述一个或多个技术方案存在如下有益技术效果:
[0022]
1)上述技术方案设计的哑铃探针将目标识别和信号放大功能集成到一个多功能探针中,简化了探针设计,降低了实验成本。
[0023]
2)rca在实际应用中的一大挑战是由非特异性分子间和分子内交联引起的非特异性扩增,上述技术方案中将哑铃探针与rca整合在一起,来有效消除非特异性扩增引起的高背景信号。
[0024]
3)上述技术方案高效率的双信号放大技术导致荧光信号的增强。
[0025]
4)上述技术方案以均相形式进行,而无需任何洗涤和分离步骤。
[0026]
5)上述技术方案极其灵敏,经试验验证,其对dam的检出限为2.15
×
10-5
单位每毫升,对m.sssi的检出限为3.23
×
10-6
单位每毫升,优于已报道的方法。
[0027]
综上,上述技术方案可用于筛选酶抑制剂,同时测量复杂生物样品中的dam和m.sssi。重要的是,上述技术方案可以通过简单地改变两个识别序列扩展到同时检测多种核酸内切酶,并来筛选相应的抑制剂。因此在生物医学研究,疾病诊断和药物发现中具有巨大的潜力,具有良好的实际应用之价值。
附图说明
[0028]
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示
意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
[0029]
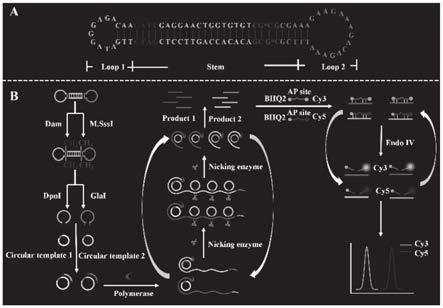
图1为本发明基于哑铃式探针介导的双重信号放大技术的荧光方法用于同时检测dam和m.sssi的示意图;其中,a为哑铃式探针结构示意图;b为检测示意图。
[0030]
图2为采用非变性聚丙烯酰胺凝胶电泳(page),以sybr gold作为指示剂验证本发明实施例可行性结果图。其中,(a)以sybr gold为指示剂对甲基化和裂解反应的非变性聚丙烯酰胺凝胶电泳实验分析。m道,dna maker;通道1,哑铃探针;通道2,dam+哑铃探针;通道3,m.sssi+哑铃探针;通道四,dam+m.sssi+哑铃形探针。(b)以cy3和cy5为指示信号的dam和m.sssi诱导的endo iv辅助信号放大反应的非变性聚丙烯酰胺凝胶电泳实验分析。通道1,dam+cy3标记的信号探针1;通道2,m.sssi+cy5标记的信号探针2;通道3,dam+m.sssi+cy3标记的信号探针1+cy5标记的信号探针2;通道4,cy3标记的信号探针1+cy5标记的信号探针。
[0031]
图3为采用荧光测量验证本发明实施例可行性结果图。其中,(a)存在和不存在dam的情况下cy3的荧光发射光谱。(b)存在和不存在m.sssi的情况下cy5的荧光发射光谱。(c)dam和m.sssi同时存在时的cy3/cy5荧光发射光谱与dam和m.sssi不存在时的cy3/cy5荧光发射光谱。实验中dam和m.sssi的浓度都为40单位每毫升。
[0032]
图4为采用荧光测量验证本发明实施例灵敏度结果图。其中,(a)不同浓度的dam对应的cy3的荧光发射光谱。(b)不同浓度的m.sssi对应的cy5的荧光发射光谱。(c)f-f0值随dam浓度的增加而变化。插图显示了f-f0值与dam浓度的对数之间存在线性关系。(d)f-f0值随m.sssi浓度的增加而变化。插图显示了f-f0值与m.sssi浓度的对数之间存在线性关系。误差棒表示三次独立实验的标准偏差。
[0033]
图5为本发明实施例不同的cy3/cy5的f-f0值分别对应40单位每毫升的dam+40单位每毫升的m.sssi,40单位每毫升的dam,40单位每毫升m.sssi,40单位每毫升的尿嘧啶dna糖基化酶(udg),40单位每毫升的t4多核苷酸激酶(pnk),10微克每毫升免疫球蛋白g(igg)和10微克每毫升的牛血清白蛋白(bsa)。误差棒表示三次独立实验的标准偏差。
[0034]
图6为本发明实施例抑制剂分析效果图。其中,(a)柱子分别表示存在和不存在的15μm的5-氟尿嘧啶情况下测量cy3/cy5的f-f0值的变化。实验中dam和m.sssi的浓度都为40单位每毫升。(b)和(c)分别为dam和m.sssi在不同浓度的5-氟尿嘧啶中的相对活性。实验中dam和m.sssi的浓度都为40单位每毫升。误差棒表示三次独立实验的标准偏差。
具体实施方式
[0035]
应该指出,以下详细说明都是例示性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
[0036]
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。
[0037]
如前所述,现有dna甲基转移酶检测普遍存在操作复杂、成本高、耗时长、灵敏度较
差等缺点。
[0038]
有鉴于此,本发明的一个具体实施方式中,提供一种同时检测多种dna甲基转移酶的生物传感器,所述生物传感器至少包括:哑铃式探针、环形模板和信号探针。
[0039]
其中,所述哑铃式探针包括茎区域和位于茎区域两端的两个环区域;其中茎区域包含待测甲基转移酶的识别序列;
[0040]
所述环形模板用于滚环扩增(rca),其至少包括引物结合位点、nb.btsi的切口位点和与信号探针互补的片段;
[0041]
所述信号探针用于触发endo iv辅助信号放大反应,其至少含有一个脱嘌呤/脱嘧啶(ap)位点,所述ap位点两侧分别被荧光基团和猝灭基团修饰。
[0042]
本发明的又一具体实施方式中,当待测甲基转移酶为两个时,
[0043]
在靠近第一环区域的位置设计第一待测甲基转移酶识别序列;在靠近第二环区域的位置设计第二待测甲基转移酶的识别序列。
[0044]
与之相对应的,所述环形模板和信号探针均为两个;
[0045]
其中,
[0046]
第一环形模板的引物结合位点可以与哑铃式探针在第一待测甲基转移酶识别序列处裂解释放裂解产物结合并引发rca反应得第一dna产物;
[0047]
第二环形模板的引物结合位点可以与哑铃式探针在第二待测甲基转移酶识别序列处裂解释放裂解产物结合并引发rca反应得第二dna产物。
[0048]
第一信号探针可与上述第一dna产物杂交结合形成带有ap位点的第一双链dna,所述第一双链dna可被endo iv裂解从而释放第一产物和第一荧光基团;所述第一产物可以继续结合第一信号探针杂交形成具有ap位点的dna双链体,从而引发endo iv诱导的第一信号探针的循环裂解反应,释放出大量第一荧光基团;
[0049]
第二信号探针可与上述第二dna产物杂交结合形成带有ap位点的第二双链dna,所述第二双链dna可被endo iv裂解从而释放第二产物和第二荧光基团;所述第二产物可以继续结合第二信号探针杂交形成具有ap位点的dna双链体,从而引发endo iv诱导的第二信号探针的循环裂解反应,释放出大量第二荧光基团。
[0050]
同时,为保证反应的顺利进行,本发明的又一具体实施方式中,所述生物传感器还包括酶和缓冲液,所述酶包括但不限于dpni、glai、vent(exo-)dna聚合酶、nb.bbtsi和核酸内切酶iv。
[0051]
所述dna甲基转移酶包括但不限于dna腺嘌呤甲基转移酶(dam)、胞嘧啶甲基转移酶(m.sssi)。
[0052]
当所述第一待测甲基转移酶为dam时,第一待测甲基转移酶识别序列为5'-g-a-t-c-3';
[0053]
当所述第二待测甲基转移酶为m.sssi时,第二待测甲基转移酶识别序列为5'-g-mc-g-c-3'。
[0054]
本发明的又一具体实施方式中,所述荧光基团和猝灭基团均可选自常用的荧光基团和猝灭基团,显然,当同时检测多种不同dna甲基转移酶时,各对应信号探针上修饰的荧光基团不同,从而便于区分检测,如可用cy3或cy5;所述猝灭基团如bhq2。
[0055]
本发明的又一具体实施方式中,提供上述生物传感器在dna甲基转移酶中的应用;
[0056]
本发明的又一具体实施方式中,所述dna甲基转移酶至少为两个;
[0057]
所述dna甲基转移酶包括但不限于dna腺嘌呤甲基转移酶(dam)、胞嘧啶甲基转移酶(m.sssi)。
[0058]
本发明的又一具体实施方式中,提供一种同时检测多种dna甲基转移酶的方法,所述方法包括:
[0059]
1)将待测样品和哑铃式探针混合反应后高温终止反应;
[0060]
2)将步骤1)产物加入环形模板进行滚环扩增反应后高温终止反应;
[0061]
3)将步骤2)所得rca产物与信号探针混合进行核酸内切酶iv辅助的信号放大反应并高温终止反应。
[0062]
所述检测方法还包括采用荧光检测系统测定荧光信号,从而实现对dna甲基转移酶的定量检测。
[0063]
具体的,当同时检测的dna甲基转移酶为dam和m.sssi时,
[0064]
所述步骤1)中,混合反应具体条件为:在35-40℃下反应1-3小时,优选为37℃下反应2小时;高温终止反应具体条件为:在70-90℃下孵育10-30分钟,优选为80℃下孵育20分钟。
[0065]
所述步骤2)中,滚环扩增反应具体条件为:在50-60℃下反应0.5-2小时,优选为55℃下反应1小时;高温终止反应具体条件为:在70-90℃下孵育10-30分钟,优选为80℃下孵育20分钟。
[0066]
所述步骤3)中,核酸内切酶iv辅助的信号放大反应具体条件为:在35-40℃下反应1-3小时,优选为37℃下反应1.5小时;高温终止反应具体条件为:在70-90℃下孵育10-30分钟,优选为80℃下孵育20分钟。
[0067]
本发明的又一具体实施方式中,提供上述生物传感器和/或检测方法在dna甲基转移酶活性检测和/或筛选dna甲基转移酶药物中的应用。
[0068]
所述dna甲基转移酶药物包括但不限于dna甲基转移酶促进剂和dna甲基转移酶药物抑制剂。
[0069]
需要说明的是,基于本发明的发明构思,对其他dna甲基转移酶进行检测亦在本发明的保护范围之内。
[0070]
以下通过实施例对本发明做进一步解释说明,但不构成对本发明的限制。应理解这些实施例仅用于说明本发明而不用于限制本发明的范围。实施例中使用的核苷酸序列如下所示:
[0071][0072]
在哑铃式探针中,字体加黑的部分表示dam的识别序列,斜体部分表示m.sssi的识别序列,而mc表示5-甲基胞嘧啶。在环形模板1和2中,带下划线的区域表示nb.btsi的识别序列。在信号探针1和2中,“x”表示无碱基位点模拟。
[0073]
实施例
[0074]
哑铃探针的制备:10微升的退火反应体系包括2微升的100微摩尔每升的哑铃形探针,1.5微升的10
×
t4 dna连接酶缓冲液(500毫摩尔每升的三羟甲基氨基甲烷-盐酸(tris-hcl),100毫摩尔每升氯化镁(mgcl2)、100毫摩尔每升的二硫苏糖醇(dtt)和6.5微升的水。在95℃下反应5分钟,然后缓慢冷却至室温。100单位的t4 dna连接酶和10微升上述混合物组成15微升反应体系于16℃过夜,进行dna连接酶反应,然后在65℃中灭活10分钟。随后,在含有10单位的exo i(核酸外切酶i),10单位的exo iii(核酸外切酶iii),1
×
nebuffer 1(10毫摩尔每升的1,3-双((三羟甲基)甲基氨基)丙烷-盐酸缓冲液,10毫摩尔每升的氯化镁(mgcl2),1毫摩尔每升的二硫苏糖醇(dtt),ph 7.0),1
×
exo i反应缓冲液(67毫摩尔每升的甘氨酸-氢氧化钾缓冲液,6.7毫摩尔每升的氯化镁(mgcl2),10毫摩尔每升的2-巯基乙醇,ph 9.5)和15微升dna连接酶反应产物的共同组成的20微升反应体系中进行核酸外切酶消化反应,溶液在37℃下反应30分钟,然后在80℃孵育20分钟灭活。得到的哑铃探针可以在4℃保存。
[0075]
哑铃探针的甲基化和裂解反应:在含有500纳摩尔每升的哑铃探针,1
×
sebuffer y(33毫摩尔每升的tris-乙酸缓冲液(tris-ac),10毫摩尔每升的醋酸镁(mgac2)、66毫摩尔每升的醋酸钾(kac),1毫摩尔每升的二硫苏糖醇(dtt),ph 7.9),8单位的dpni,10单位的glai,160微摩尔每升的sam和不同浓度的dam和m.sssi共同组成的20微升反应混合物在37℃下反应2小时,然后在80℃下孵育20分钟来终止反应。
[0076]
滚环扩增反应:在甲基化和裂解反应后,将10微升产物添加到30微升退火反应混合物中,该混合物包含50纳摩尔每升的环形模板1、50纳摩尔每升的环形模板2、5毫摩尔每
升氯化镁(mgcl2)、10毫摩尔每升的三羟甲基氨基甲烷-盐酸(tris-hcl)。将该混合物在95℃加热5分钟,然后缓慢冷却至室温。然后在50微升的反应混合物中进行rca反应,其中包含30微升的退火产物,1单位的vent(exo-)dna聚合酶,10单位的nb.bbtsi和1
×
cutsmart缓冲液(50毫摩尔每升的醋酸钾(kac),20毫摩尔每升的tris-乙酸缓冲液(tris-ac),10毫摩尔每升的醋酸镁(mgac2)、100微克每毫升的牛血清蛋白(bsa),ph 7.9),在55℃下反应1小时。在80℃下加热20分钟来终止反应。
[0077]
核酸内切酶iv(endo iv)辅助的信号放大和荧光检测:30微升的rca产物,500纳摩尔每升的信号探针1、500纳摩尔每升的信号探针2、1
×
nebuffer 3(100毫摩尔每升的氯化钠(nacl),50毫摩尔每升的三羟甲基氨基甲烷-盐酸(tris-hcl),10毫摩尔每升的氯化镁(mgcl2)、1毫摩尔每升的二硫苏糖醇(dtt),ph 7.9)和10单位的endo iv添加至反应溶液中,终体积为50微升,该混合物在37℃下反应90分钟,然后在80℃加热20分钟来终止反应。
[0078]
使用f-7000光谱仪测量了反应产物的荧光强度(体积为50微升)。cy3的发射光谱在550-650纳米的波长范围内,cy5的发射光谱在650-750纳米的波长范围内,检测cy3在567纳米和cy5在668纳米的荧光强度,激发和发射的缝隙宽度均为5纳米。f-f0值用于回归方程式计算mtase的浓度,其中f0和f分别是不存在和存在mtase时的荧光强度。
[0079]
凝胶电泳实验:在1
×
tbe缓冲液(9毫摩尔每升的三羟甲基氨基甲烷-盐酸(tris-hcl),9毫摩尔每升的硼酸,0.2毫摩尔每升乙二胺四乙酸(edta),ph 8.3)中,用110伏恒定电压,通过12%非变性聚丙烯酰胺凝胶电泳(page)进行甲基化和裂解反应产物的分析,使用epi-blue激发光源(460
–
490纳米激发)和516
–
544纳米的滤光片对sybr gold荧光团进行成像,这个电泳实验持续50分钟。在1
×
tbe缓冲液中于110伏恒定电压下进行12%非变性聚丙烯酰胺凝胶电泳(page)分析双重dna扩增反应的产物。使用epi-green的激发光源(520
–
545纳米激发)和577
–
613纳米滤光片对cy3荧光团标记的片段成像,使用epi-red的激发光源(625
–
650纳米激发)和675
–
725纳米滤光片对cy5荧光团标记的片段成像,这个电泳实验持续30分钟。
[0080]
抑制剂分析:将各种浓度的5-氟尿嘧啶与500纳摩尔每升的哑铃探针在1
×
sebuffer y中,于37℃孵育15分钟。然后将40单位每毫升的dam,40单位每毫升的m.sssi,160微摩尔每升的sam,8单位的dpni和10单位的glai添加到混合物中,并在37℃下孵育2小时,然后进行后续实验。
[0081]
细胞培养和提取实验:在含有10%胎牛血清(fbs)和1%青霉素-链霉素的dulbecco改良eagle培养基(dmem)中培养肺腺癌细胞系(a549细胞),细胞在37℃的潮湿环境中培养。收集1
×
106个细胞,并用1
×
磷酸盐缓冲液(pbs)(ph 7.4)洗涤两次。细胞数通过countstar自动细胞计数器测量。通过使用核提取试剂盒,根据说明书提供的方法制备a549细胞的核提取物,对获得的上清液进行回收率实验的测定。
[0082]
检测人血清和细胞提取物中的dna甲基转移酶(mtases)活性:20微升样品中含有5%的人血清(或5微升细胞提取物),500纳摩尔每升的哑铃探针,1
×
sebuffer y,8单位的dpni,10单位的glai,160微摩尔每升的sam和各种浓度的dna甲基转移酶(mtases)。在37℃下反应2小时,然后在80℃下灭活20分,然后进行后续实验。
[0083]
实验原理(如图1):
[0084]
在本发明技术方案中,开发了一种基于哑铃探针的双信号放大技术用于超灵敏的
检测多种dna甲基转移酶(mtases)。选择dam和m.sssi作为模型酶。本方案包括一个哑铃形探针,两个用于滚环扩增(rca)的环形模板和两个用于核酸内切酶iv(endo iv)辅助信号扩增的信号探针。在结构上,设计的哑铃式探针由三个区域组成,包括茎区域和两个环区域。茎包括dam和m.sssi的识别序列,在哑铃探针的茎中接近环1的地方设计了dam的识别序列5'-g-a-t-c-3',在哑铃探针的茎中接近环2的地方设计了m.sssi的识别序列5'-g-mc-g-c-3'。环形模板包含三部分,包括(1)引物结合位点(2)nb.btsi的切口位点和(3)用于触发endo iv辅助信号放大反应的dna信号探针的互补片段。信号探针含有一个脱嘌呤/脱嘧啶(ap)位点,两侧分别被荧光团(cy3或cy5)和黑洞猝灭剂(bhq2)修饰。该原理涉及三个步骤,包括(1)甲基化介导的哑铃探针的裂解反应,(2)rca反应和(3)endo iv辅助的扩增反应。在存在dam的情况下,5'-g-a-t-c-3'被甲基化为5'-g-ma-t-c-3',dpni可以将甲基化的哑铃探针在甲基化位点处裂解从而释放19nt裂解产物。释放的产物可作为与环形模板1杂交的引物,在dntp和vent(exo-)dna聚合酶的存在下引发rca反应,产生一个较长的重复序列,该重复序列可被nb.btsi切断,从而产生大量新的引物。所得的新引物可以接着启动新的循环反应,最终导致指数扩增。扩增得到的dna产物(产物1)可以与cy3标记的信号探针1杂交形成带有ap位点的双链dna。该双链dna被endo iv裂解从而释放产物1和cy3荧光团,其中cy3的荧光信号表明dam的存在。此外,释放的产物1可结合新的信号探针1形成新的双链dna,从而引发endo iv诱导的信号探针1的循环裂解反应,从而释放出大量cy3荧光团。相反,当不存在dam时,不会发生甲基化反应,未甲基化的哑铃探针无法被dpni裂解,最终导致信号探针1没有被裂解,因此没有检测到明显的cy3荧光信号。与之相似的,在m.sssi存在时,可以将5'-g-mc-g-c-3'甲基化为5'-g-mc-g-mc-3',后者可以被glai识别并裂解产生27nt的裂解产物。获得的产物可作为与环形模板2杂交的引物,从而引发rca反应。扩增的dna产物(产物2)可以结合cy5标记的信号探针2杂交形成具有ap位点的dna双链体,从而引发endo iv诱导的信号探针2的循环裂解反应,释放出大量cy5荧光团,而cy5荧光信号表明m.sssi的存在。但是,在缺少m.sssi的情况下,glai无法切割'部分甲基化5'-g-mc-g-c-3序列。因此信号探针2没有被裂解,从而检测不到明显的cy5荧光信号。当dam和m.sssi同时存在时,5'-g-a-t-c-3'和5'-g-mc-g-c-3'都可以被甲基化,生成的甲基化的哑铃探针可以在甲基化位点分别被dpni和glai识别和裂解最终导致哑铃探针断裂成三部分。释放的环可以分别与环形模板1和2杂交,从而触发相应的rca反应。扩增的dna产物可以分别结合信号探针1和2,以启动endo iv诱导的信号探针1和2的循环裂解反应,从而释放cy3和cy5荧光团。然而,在不存在dna甲基转移酶(mtases)的情况下,没有发生甲基化反应,因此不能观察到明显的cy3或cy5荧光信号。
[0085]
1.可行性实验
[0086]
为了验证本方案的可行性,使用非变性聚丙烯酰胺凝胶电泳(page),以sybr gold作为指示剂来验证本方法(图2a)。在没有dam和m.sssi的情况下,仅观察到了哑铃探针的条带(86nt,图2a,泳道1),这表明未甲基化的哑铃探针无法被dpni和glai裂解。相反,在仅存在dam的情况下,观察到两条裂解产物的条带(19nt和67nt)(图2a,泳道2),表明哑铃探针可以被dam甲基化,随后被裂解为两部分。在仅存在m.sssi的情况下,观察到两条裂解产物的条带(27nt和59nt)(图2a,泳道3),表明哑铃探针可以被m.sssi甲基化,随后被glai裂解成两部分。当dam和m.sssi共存时,观察到三个带,包括dpni的裂解产物(19nt),glai的裂解产
物(27nt)和哑铃形探针的茎(20bp)(图2a,泳道4),这表明甲基化的哑铃探针可以被dpni和glai分为三部分。还使用了直接激发cy3和cy5的非变性聚丙烯酰胺凝胶电泳(page)来验证本实验(图2b)。在单独存在dam的情况下(图2b,泳道1)观察到了由裂解的cy3标记的信号探针1产生的明显的7nt条带。在单独存在m.sssi的情况下(图2b,泳道2)观察到了由裂解的cy5标记的信号探2产生的明显的7nt条带。当dam和m.sssi共存时,观察到了一条由裂解的cy3标记的信号探针1和裂解的cy5标记的信号探针2共同定位而产生的条带(图2b,泳道3)。但是,在没有dam和m.sssi的情况下,哑铃探针无法被甲基化从而也无法被dpni和glai裂解,因此无法观察到裂解信号探针1和2产生的条带(图2b,泳道4)。这些结果清楚地表明,本方法可用于同时检测dam和m.sssi.
[0087]
进一步进行了荧光测量以验证本方案。当dam和m.sssi都不存在时,cy3的信号和cy5的信号均未检测到。相反,dam存在时观察到明显的cy3荧光信号(图3a),m.sssi存在时观察到明显的cy5荧光信号(图3b)。此外,当dam和m.sssi同时存在,会同时检测到明显的cy3和cy5的荧光信号(图3c)。这些结果进一步证实了本方案可用于同时检测dam和m.sssi。
[0088]
2.灵敏度检测
[0089]
为了评估本方案检测dna甲基转移酶(mtases)活性的灵敏度,对不同浓度的dna甲基转移酶(mtases)进行分析测定。如图4a所示,随dam浓度从1.0
×
10-4
增加到40单位每毫升,cy3荧光强度也逐渐增强。在1.0
×
10-4
至10单位每毫升的范围内,cy3荧光强度与dam浓度的对数之间存在线性关系(r2=0.995)(图4c的插图)。回归方程为f=3023.94+647.95log10 c,其中f是cy3荧光强度,c是dam浓度。通过计算得出检测限为2.15
×
10-5
单位每毫升。值得注意的是,与基于金属有机骨架的电化学生物传感器方法(0.001单位每毫升)相比,本方法的灵敏度提高了2个数量级,与切口酶辅助信号放大的荧光分析法(0.06单位每毫升)相比,本方法的灵敏度提高了3个数量级。与超支链扩增荧光分析法(0.003单位每毫升)相比,本方法的灵敏度提高了2个数量级。如图4b所示,随m.sssi浓度从1.0
×
10-5
增加到40单位每毫升,cy5荧光强度也逐渐增强。在1.0
×
10-5
至10单位每毫升范围内,cy5的荧光强度与m.sssi浓度的对数之间存在线性关系(r2=0.996)(图4d的插图)。回归方程为f=1425.65+259.66log
10 c,其中f为cy5荧光强度,c为m.sssi浓度。通过计算得出检测限为3.23
×
10-6
单位每毫升。值得注意的是,与基于杂交链反应的荧光共振能量共振转移方法(1.2
×
10-4
单位每毫升)相比,本方法的灵敏度提高了2个数量级,与基于多重滚环扩增反应(0.0024单位每毫升)的荧光方法相比,本方法的灵敏度提高了3个数量级。与基于单个量子点的纳米传感器检测方法(2.1
×
10-4
单位每毫升)相比,本方法的灵敏度提高了2个数量级。
[0090]
3.特异性实验
[0091]
为了验证本方案的特异性,使用牛血清白蛋白(bsa),免疫球蛋白g(igg),尿嘧啶dna糖基化酶(udg)和t4多核苷酸激酶(pnk)作为阴性对照。如图5所示,仅响应于dam就会检测到明显的cy3荧光信号,仅响应于m.sssi而检测到明显的cy5荧光信号。此外,当dam和m.sssi共存时,可以同时检测到明显的cy3和cy5荧光信号。相反,在bsa,igg,udg和pnk存在的情况下,无法观察到cy3和cy5的荧光信号。该现象可以通过以下事实解释:哑铃探针中的5'-g-a-t-c-3'只能被dam甲基化,而哑铃探针中的5'-g-mc-g-c-3'只能被m.sssi甲基化。这些结果证明了本方法对dam和m.sssi具有良好的选择性。
[0092]
4.抑制剂分析
[0093]
为了研究本方案筛选抑制剂的能力,使用了5-氟尿嘧啶作为模型抑制剂。研究了5-氟尿嘧啶对扩增实验的影响(图6a)。在15微摩尔每升5-氟尿嘧啶存在的情况下,cy3/cy5荧光强度与不存在5-氟尿嘧啶存在下检测到的cy3/cy5荧光强度无明显差异。这表明15微摩尔每升的5-氟尿嘧啶对双信号扩增反应的效率没有明显影响。dam和m.sssi的相对活性随着5-氟尿嘧啶浓度的增加而降低。计算得出5-氟尿嘧啶对dam的ic
50
为1.41微摩尔每升,与超支化扩增荧光法(1.29微摩尔每升)的ic
50
获得的结果一致。5-氟尿嘧啶对m.sssi的ic
50
值为1.76微摩尔每升,与光电化学方法(1.0微摩尔每升)获得的结果一致。这些结果清楚地表明,本方法可用于筛选甲基化酶抑制剂。
[0094]
应注意的是,以上实例仅用于说明本发明的技术方案而非对其进行限制。尽管参照所给出的实例对本发明进行了详细说明,但是本领域的普通技术人员可根据需要对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1