纳多西烷缩合物及其制备方法和用途
本发明涉及纳多西烷型倍半萜缩合物,尤其是涉及一种采自于西沙lemnalia属珊瑚中提取的纳多西烷缩合物及其制备方法和用途。
背景技术:
海洋软珊瑚具有美丽的外表,极容易吸引那些掠食者,因此这些生物想要生存就必须拥有有效的自我保护方法,这就促使了一些特征代谢产物的产生。因此,软珊瑚是发现结构多样、具有潜在治疗应用价值的萜类化合物的丰富来源。近年来,从热带到极地的海洋,如台湾和南海海域,许多海洋软珊瑚的潜在生物活性化学成分已被研究。
lemnalia属软珊瑚(lemnaliasp.)属腔肠动物门(coelenterata),八放珊瑚亚纲(octocorallia),海鸡冠目(alcyonacea),棘软珊瑚科(nephtheidae)动物,属于低等原始海洋生物,其种类有30余种,其中大约只有15种的化学成分得到研究。lemnalia属的海洋软珊瑚提供了许多具有不同化学结构的新萜类化合物,包括倍半萜类、降倍半萜类、二萜类、二萜苷类和甾体。倍半萜类化合物是软珊瑚中最显著的代谢产物,常被认为是该属软珊瑚的化学分类学标记物。根据其化学结构的碳骨架,可以对其进行分类,如nardosinane型(纳多西烷型)、neolemnane型、ylangane型和其他类型的倍半萜。
在我们探索海洋生物活性次生代谢产物的过程中,通过水肺潜水技术在西沙群岛海域(7米深)处采集到了一种软珊瑚lemnaliasp.。对丙酮提取物进行了化学成分的研究,获得了2个新的纳多西烷型倍半萜缩合物nardosinoidsa(1)和b(2)。目前,尚未有此2个结构及其功能活性的报道。
技术实现要素:
本发明所要解决的技术问题是提供一种具有抗菌、抗炎活性的纳多西烷缩合物及其制备方法和用途。
本发明解决上述技术问题所采用的技术方案为:一种纳多西烷缩合物,从中国南海的西沙群岛海岸深处采集的lemnalia属软珊瑚(编号xssc201915)所产生的次级代谢产物中分离得到,其化学结构通式如下所示:
上述纳多西烷缩合物的制备方法,包括如下步骤:
(1)粗浸膏的获得:将冷冻软珊瑚切成块冻干,用丙酮超声提取至无色,减压回收丙酮至干,然后用由等体积的水和乙醚组成的混合液重复萃取若干次,合并乙醚萃取液后减压浓缩,获得粗浸膏;
(2)将步骤(1)得到的粗浸膏用正相硅胶色谱分离,采用体积比为(50:1)~(1:1)的石油醚-乙酸乙酯溶液为流动相进行梯度洗脱,逐管收集洗脱液,按流分极性从小到大排列,合并得到5个组分;
(3)将步骤(2)得到的第3个组分进行反相中压柱色谱分离,采用甲醇含量为40wt%至100wt%的甲醇-水溶液为流动相进行洗脱,逐管收集洗脱液,按流分极性从大到小排列,合并得到8个组分;
(4)将步骤(3)得到的第5个组分用正相硅胶色谱分离,采用体积比为(10:1)~(1:1)的石油醚-乙酸乙酯溶液为洗脱液进行梯度洗脱,逐管收集洗脱液,按流分极性从小到大排列,合并得到9个组分;
(5)将步骤(4)得到的第5个组分用反相半制备高效液相色谱进行分离,得到化合物1和化合物2。
步骤(2)中所述的石油醚-乙酸乙酯溶液的洗脱梯度体积比依次为50:1、20:1、10:1、5:1、2:1和1:1。
步骤(3)中所述的甲醇-水溶液的洗脱梯度为甲醇体积含量依次为40%、50%、60%、70%、80%、90%和100%。
步骤(4)中所述的石油醚-乙酸乙酯溶液的洗脱梯度体积比依次为10:1、5:1、2:1和1:1。
步骤(6)中所述的反相半制备高效液相色谱的流动相为质量浓度95%的甲醇-水溶液,流速为2ml/min。
上述纳多西烷缩合物1和缩合物2在制备枯草芽孢杆菌抑制剂方面的用途。
上述纳多西烷缩合物2在制备金色葡萄球菌抑制剂方面的用途。
上述纳多西烷缩合物2在体外抗炎活性方面的用途。
与现有技术相比,本发明的优点在于:本发明纳多西烷缩合物及其制备方法和用途,包括两种纳多西烷缩合物,其制备方法为,将采自于南海西沙群岛lemnalia属软珊瑚冻干,用丙酮超声提取6次至无色,减压回收丙酮至干,再用然后用等体积的水和乙醚重复萃取,合并萃取液后减压浓缩,得粗浸膏,将该粗浸膏经减压硅胶柱层析,中压柱层析和反相半制备高效液相色谱分离纯化得到化合物1和2,其中化合物1和2具有抗枯草芽孢杆菌和金黄色葡萄球菌的作用,为研制新的抗菌药物提供了新的先导化合物。此外,化合物2对lps诱导巨噬细胞的no产生也有中等抑制作用。
附图说明
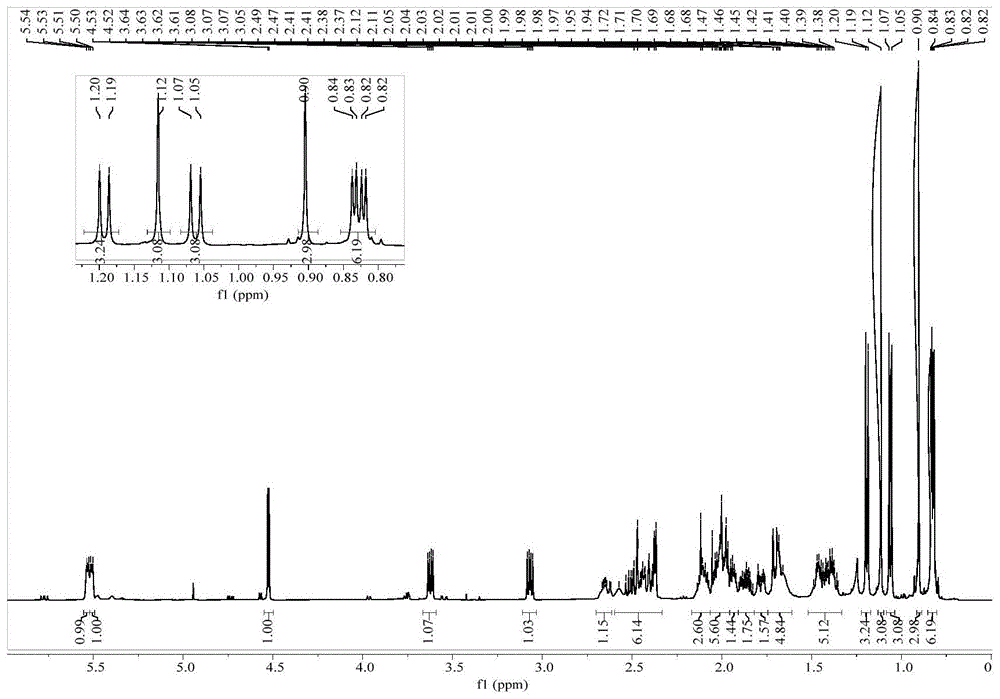
图1为本发明化合物1的核磁共振氢谱;
图2为本发明化合物2的核磁共振氢谱;
图3为本发明化合物1的核磁共振碳谱;
图4为本发明化合物2的核磁共振碳谱。
具体实施方式
以下结合附图实施例对本发明作进一步详细描述。
实施例1
从lemnalia属软珊瑚中提取分离到的2个新的纳多西烷型倍半萜缩合物nardosinoidsa(1)和b(2),其化合物结构式如下所示:
实施例2
纳多西烷缩合物的制备方法,步骤如下:
1、粗浸膏的获得:将冷冻软珊瑚切成块冻干,用丙酮超声提取至无色,减压回收丙酮至干,然后用由等体积的水和乙醚组成的混合液重复萃取若干次,合并乙醚萃取液后减压浓缩,获得粗浸膏;
2、化合物的分离纯化
(1)将上述粗浸膏用正相硅胶色谱(200-300目)分离,采用体积比为(50:1)~(1:1)的石油醚-乙酸乙酯溶液为流动相进行梯度洗脱,根据薄层板监测,按流分极性从小到大排列,依次收集合并得5个组分fr.1~fr.5,其中石油醚-乙酸乙酯溶液的洗脱梯度体积比依次为50:1、20:1、10:1、5:1、2:1和1:1;
(2)再将步骤(1)得到的第3流分进行反相中压柱色谱分离,采用甲醇含量为40wt%至100wt%的甲醇-水溶液为流动相进行洗脱,逐管收集洗脱液,按流分极性从大到小排列,依次收集合并获得8个组分,其中甲醇-水溶液的洗脱梯度依次为40%、50%、60%、70%、80%、90%和100%;
(3)将步骤(2)得到的第5个组分(fr.3.5)经正相硅胶色谱分离,采用体积比为(10:1)~(1:1)的石油醚-乙酸乙酯溶液为洗脱液进行梯度洗脱,逐管收集洗脱液,按流分极性从小到大排列,得到9个组分(fr.3.5.1~fr.3.5.9),其中石油醚-乙酸乙酯溶液的洗脱梯度体积比依次为10:1、5:1、2:1和1:1;
(4)将步骤(3)得到的第5个组分(fr.3.5.5)进行反相半制备高效液相色谱分离(95%甲醇-水溶液,流速2ml/min,等度50min),得化合物1(9.8mg)和化合物2(28.0mg),它们的化学结构通式如下所示:
实施例3
化合物的结构鉴定及核磁信号归属:
nardosinoida(化合物1):无色油状固体;[α]25d=-42(c0.1,meoh);由正离子高分辨质谱(hresims)准分子离子峰提供的精确分子量m/z493.3293[m+na]+(计算值为c30h46o4na,493.3294),给出该化合物的分子式c30h46o4,具有8个不饱和度。该化合物的1h和13cnmr数据见图1和图3、表1。
nardosinoidb(化合物2):无色油状固体;[α]25d=-66(c0.1,meoh);由正离子高分辨质谱(hresims)准分子离子峰提供的精确分子量m/z493.3286[m+na]+(计算值为c30h46o4na,493.3294),给出该化合物的分子式c30h46o4,具有8个不饱和度。该化合物的1h和13cnmr数据见图2和图4、表1。
表1化合物1和2的1hnmr和13cnmr(1h600mhz,13c150mhz,cdcl3)
aoverlappedsignals。
实施例4
化合物nardosinoidsa(1)和b(2)的抗菌活性检测及应用
1、实验样品
被测样品溶液的配制:测试样品为上述实施例1中分离纯化的化合物1和2的单体化合物,精密称取适量样品,分别用dmso配制1.28mg/ml溶液。该实验使用的指示菌为枯草芽孢杆菌,庆大霉素为阳性对照。
2、实验方法
使用96孔微孔板中的培养基微量稀释,对化合物1和2进行体外抗菌实验。将指定的甘油保种菌株分别吸取10μl放入肉汤培养基中,震荡培养活化。在无菌96孔微孔板中每个孔都加入100μl含2,3,5-氯化三苯基四氮唑(ttc)显色剂的mh培养基,第一排孔加入10μl的上述化合物和90μl的含ttc的mh培养基,并依次稀释,对应的测试化合物的最终浓度为256、125、64、32、16、8、4、2、1和0.5μg/ml,再将50ml的mh培养基加入10μl的种子液,充分混匀,分别每孔加入100μl的菌液,37℃培养箱培养,18h,36h后观察颜色。
3、实验结果
表2化合物1和2的抗菌活性筛选结果
由表2可见,化合物1和2对枯草芽孢杆菌具有中等抑制作用,最低抑菌浓度(mic)为4-8μg/ml,其中化合物2对金色葡萄球菌也有抑制作用,最低抑菌浓度(mic)为16μg/ml。
实施例5
化合物nardosinoida(1)和b(2)的抗炎活性检测及应用。
1、实验样品
被测样品溶液的配制:测试样品为上述实施例2中分离纯化的所得化合物1和2纯品,精密称取适量样品,用dmso配制成20mm的母液50μl。该实验使用的阳性药为氢化可的松为阳性药。
2、实验方法
取raw264.7细胞株1×104cells/well(腹腔巨噬细胞1×105cells/well)置96孔培养板中预贴壁成单层,设置alone孔(不用lps刺激,不加待测化合物)、control孔(lps终浓度100ng/ml,不加待测化合物)及检测孔(lps终浓度100ng/ml,加入待测各化合物10µmol/ml),置37℃,5%co2,培养24h,收集上清。
griess法检测no浓度,100µl培养上清加等体积griess试剂(1%sulfanilamide,0.1%n-(1-naphthyl)-ethylenediaminedihydrochloride,2%phosphoricacid)室温反应10min,酶标仪在540nm处测量每个孔的吸光度值,以亚硝酸钠标准曲线计算no浓度。
3、实验结果
表3化合物1和2的抗炎活性筛选结果
由表3可见,化合物2对lps诱导巨噬细胞的no产生具有中等抑制作用,其ic50为13.09μm。
上述说明并非对本发明的限制,本发明也并不限于上述举例。本技术领域的普通技术人员在本发明的实质范围内,做出的变化、改型、添加或替换,也应属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种Ni@C@g-C<sub>3</sub>N<sub>4</sub>纳米复合物及其制备方法和应用
- 一种石墨烯-三聚氰胺泡沫气凝胶及其制备方法
- 制备聚胺的方法
- 一种低温固化三聚氰胺甲醛树脂胶及其制备方法
- 一种生物质改性三聚氰胺甲醛树脂微球泡沫的制备方法
- 一种三羟甲基三聚氰胺的制备方法
- 一种Fe@C@g-C<sub>3</sub>N<sub>4</sub>纳米复合物及其制备方法和应用
- 一种g-C<sub>3</sub>N<sub>4</sub>/Bi<sub>3</sub>TaO<sub>7</sub>表面复合光催化剂的制备方法
- Ag<sub>2</sub>CrO<sub>4</sub>负载的g-C<sub>3</sub>N<sub>4</sub>复合光催化剂及其制备方法和应用
- 一种高聚合度的三聚氰胺聚磷酸盐的制备方法