三特异性抗体及用途的制作方法
synapse.trends cell biol.2017 apr;27(4):241-254.)。tsabs与不同抗原之间的空间距离对于相应的t细胞免疫突触形成以及t细胞信号激活可能也同样重要,只是这一空间距离取决完全不同的结构因素,包括抗原表位的位置以及抗体和t细胞膜之间的连接区域。
5.综上所述,为了实现tsabs介导t细胞对抗原表达肿瘤细胞的最佳杀伤效果,需要对不同的抗体连接方式以及不同的连接位置进行考察,通过结构设计的优化和筛选,建立一种基于介导t细胞靶向肿瘤杀伤的最佳tsabs。
技术实现要素:
6.多靶点抗体药物成为解决上述类似问题的关键,因此,为寻找更有效的治疗手段,本发明提供了一种新型三特异性抗体,这将给患者提供更多的用药选择。
7.本发明第一个方面,提供了一种基于结构优化设计的抗her2/vegfr2/cd3三特异性抗体,所述her2/vegfr2/cd3三特异性抗体包含对her2/cd3具有结合特异性的如seq id no:1或seq id no:2或seq id no:3或seq id no:4所示的重组重链氨基酸序列,和对vegfr2/cd3具有结合特异性的如seq id no:5或seq id no:6或seq id no:7所示的重组轻链氨基酸序列。
8.优选地,所述her2/vegfr2/cd3(so)三特异性抗体具有对her2/cd3具有结合特异性的如seq id no:4所示的重组重链氨基酸序列,和具有对vegfr2/cd3具有结合特异性的如seq id no:6所示的重组轻链氨基酸序列。
9.本发明第二个方面,提供了一种三特异性抗体分子的构建方法。所述三特异性抗体的构建方法是以第一结构域——单克隆抗体的fab作为结构基础,同时增加了靶向2种肿瘤特异性或相关抗原的抗体片段,分别为第二结构域和第三结构域,第二结构域与第三结构域通过连接肽(linker)可连接至fab片段。
10.具体地,所述构建方法包括:
11.(1)将第二结构域连接于第一结构域fab的重链结构域;
12.(2)将第三结构域连接于第一结构域fab的轻链结构域;
13.(3)重链和轻链通过ch1和cl中的二硫键结合形成异源二聚体的三特异性抗体。
14.步骤(1)所述连接方式包括可分别通过刚性连接肽将第二结构域连接于fab重链可变区(vh)结构域n端,可标记为hnt,刚性连接肽可以为he linker和pd linker;或通过卷曲螺旋连接肽(coiled coil linker)将第二结构域连接于fab重链恒定区(ch1)结构域的184s-187l之间,并且缺失185s 186g,可标记为h184-187;或通过柔性连接肽将第二结构域连接于fab重链恒定区(ch1)结构域c末端,可标记为hct。
15.步骤(2)所述连接方式包括可分别通过刚性连接肽将第三结构域连接于在fab轻链可变区(vl)结构域n端,可标记为lnt,刚性连接肽可以为he linker和pd linker;或通过卷曲螺旋连接肽(coiled coil linker)将第三结构域连接于fab轻链恒定区(cl)结构域171s-173d之间,并缺失172k,可标记为l171-173;或通过柔性连接肽第三结构域连接于在fab轻链恒定区(cl)结构域c末端,可标记为lct。
16.本发明所述刚性连接肽he linker具有如seq id no:12所示的氨基酸序列,所述刚性连接肽pd linker具有如seq id no:13所示的氨基酸序列,所述卷曲螺旋连接肽(coiled coil linker)具有如seq id no:14、15所示的氨基酸序列,所述柔性连接肽为
(g4s)3。
17.步骤(1)、步骤(2)所述第一结构域、第二结构域、第三结构域各自独立地具有针对选择her2、vegfr1/2、cd3、cd19、cd22、egfr、egfrviii、her3、her4、igf1r、c-met、muc-1、muc-16、il13r、mesothelin、trop-2、gpc2、gpc3、gd2、cea、psma、psca、epcam、cd79、ror1、axl、cd133、cd171、bcma、cd20、cd123、claudin 6、claudin 18.2、cd38、cd30、cd33、cd138、cd56、cs1、cll1、cd7、cd4、cd8、lewis y、alk、kras突变体、myd88突变体、idh1突变体、p53突变体、ny-eso-1、nkg2d、cd16、cd56、cd64、pd-1、pd-l1、b7-h3、b7-h4、tgf-beta、ctla-4、lag-3、tim-3、tight、vista、icos、gitr、cd28、4-1bb、ox40、cd27、cd24、cd47、cxcr4、dll3、integrin等等相关靶点抗原的结合特异性。
18.步骤(1)与步骤(2)所述第二结构域、第三结构域可以为adnectin(人纤连蛋白)、亲和体、anticalin(抗运载蛋白)、双环肽、darpin(天然锚蛋白重复序列)、fynomer、kunitz型结构域、e7免疫蛋白、淋巴细胞受体可变区、单域抗体、全抗体、抗体片段、单链抗体以及核酸适配体等形式。
19.所述第一结构域fab片段可以来源包括但不局限于抗cd3单克隆抗体。
20.本发明第三个方面,公开了一种靶向免疫效应t细胞抗原cd3的介导t细胞重定位到肿瘤细胞的二聚体型三特异性抗体分子的构建方法。所述三特异性抗体的构建方法是以抗cd3单克隆抗体(克隆sp34)的fab作为结构基础,第二结构域和第三结构域分别为针对her2和vegfr2靶点的纳米抗体(vhh),两者分别通过linker连接至sp34 fab片段。构建方法包括以下步骤:
21.(1)抗her2-vhh连接于sp34 fab结构的重链结构域。
22.(2)抗vegfr2-vhh连接于sp34 fab结构的轻链结构域。
23.(3)本发明中重组重链和重组轻链通过sp34 fab中ch1和cl中的二硫键结合形成异源二聚体,即抗her2/vegfr2/cd3三特异性抗体。
24.优选地,步骤(1)可通过以下方式将抗her2-vhh连接于sp34 fab结构的重链结构域:
25.(a)通过刚性连接肽he linker将抗her2-vhh连接于sp34 fab重链可变区(vh)结构域n端1e;
26.(b)通过刚性连接肽pd linker将抗her2-vhh连接于sp34 fab重链可变区(vh)结构域n端1e;
27.(c)通过螺旋卷曲连接肽coiled coil linker将抗her2-vhh嵌合于sp34 fab重链恒定区(ch1)结构域184s-187l之间,并且缺失185s、186g;
28.(d)通过柔性连接肽(g4s)3 linker将抗her2-vhh连接于sp34 fab重链恒定区(ch1)结构域c端228c。
29.以上(a)-(d)所述方式制备得到的her2/cd3双特异性抗体可以分别标记为her2/cd3 hnt(he linker)、her2/cd3 hnt(pd linker)、her2/cd3 h184-187、her2/cd3 hct。
30.进一步优选地,步骤(1)可通过以下方式将抗her2-vhh连接于sp34 fab结构的重链结构域:
31.(a)通过刚性连接肽he linker将抗her2-vhh连接于sp34 fab重链可变区(vh)结构域n端1e;
32.(b)通过刚性连接肽pd linker将抗her2-vhh连接于sp34 fab重链可变区(vh)结构域n端1e;
33.(c)通过柔性连接肽(g4s)3 linker将抗her2-vhh连接于sp34 fab重链恒定区(ch1)结构域c端228c。
34.更进一步优选地,步骤(1)可通过以下方式将抗her2-vhh连接于sp34 fab结构的重链结构域:
35.(a)通过(g4s)3 linker将抗her2-vhh连接于在sp34 fab重链恒定区(ch1)结构域c端228c。
36.优选地,步骤(2)可通过以下方式将抗vegfr2-vhh连接于sp34 fab结构的轻链结构域:
37.(a)通过刚性连接肽he linker将抗vegfr2-vhh连接于sp34 fab轻链可变区(vl)结构域n端1q;
38.(b)通过刚性连接肽pd linker将抗vegfr2-vhh连接于sp34 fab轻链可变区(vl)结构域n端1q;
39.(c)通过卷曲螺旋连接肽coiled coil linker将抗vegfr2-vhh嵌合于sp34 fab轻链恒定区(cl)结构域171s-173d之间,并缺失172k;
40.(d)通过柔性连接肽(g4s)3 linker将抗vegfr2-vhh连接于sp34 fab轻链恒定区(cl)结构域c端217c。
41.以上(a)-(d)所述方式制备得到的vegfr2/cd3双特异性抗体可以分别标记为vegfr2/cd3 lnt(he linker)、vegfr2/cd3 lnt(pd linker)、vegfr2/cd3 l171-173、vegfr2/cd3 lct。
42.进一步优选地,步骤(2)可通过以下方式将抗vegfr2-vhh连接于sp34 fab结构的轻链结构域:
43.(a)通过刚性连接肽pd linker将抗vegfr2-vhh连接于sp34 fab轻链可变区(vl)结构域n端1q;
44.(b)通过卷曲螺旋连接肽coiled coil linker将抗vegfr2-vhh嵌合于sp34 fab轻链恒定区(cl)结构域171s-173d之间,并缺失172k;
45.(c)通过柔性连接肽(g4s)3 linker将vegfr2-vhh连接于sp34 fab轻链恒定区(cl)结构域c端217c。
46.更进一步优选地,步骤(2)可通过以下方式将抗vegfr2-vhh连接于sp34 fab结构的轻链结构域:
47.(a)通过卷曲螺旋连接肽coiled coil linker将抗vegfr2-vhh嵌合于sp34 fab轻链恒定区(cl)结构域171s-173d之间,并缺失172k。
48.在一个优选实施例中,所述her2/vegfr2/cd3(structural optimization,so)三特异性抗体是以抗cd3 fab结构为基础,通过以下方法进行构建:
49.(1)通过柔性连接肽(g4s)3 linker将抗her2-vhh连接于sp34 fab重链恒定区(ch1)结构域c端228c;
50.(2)通过螺旋卷曲连接肽coiled coil linker将抗vegfr2-vhh嵌合于sp34 fab轻链恒定区(cl)结构域171s-173d之间,并缺失172k;
51.(3)重链(hc)和轻链(lc)通过ch1和cl中的二硫键结合形成异源二聚体的抗cd3 fab(克隆sp34),即优化结构后的her2/vegfr2/cd3三特异性抗体her2/vegfr2/cd3(so)。
52.本发明的第四个方面,还提供了本发明制备所述三特异性抗体的方法。其包括:
53.(1)获得三特异性抗体的融合基因,构建三特异性抗体的表达载体;
54.(2)通过基因工程方法将上述表达载体转染至宿主细胞中;
55.(3)在允许产生所述三特异性抗体的条件下培养上述宿主细胞;
56.(4)分离纯化产生的所述抗体蛋白。
57.步骤(1)所述表达载体可以为真核细胞表达载体pfuse、pseqtag、pcmv、pcdna、pfastbac1、ppic9k等和原核表达载体pet、pgex、pmal、pqe、ptrc、pbv、ptxb,优选真核表达载体。
58.步骤(2)所述宿主细胞可以为大肠杆菌、苏云金芽孢杆菌、毕赤酵母、昆虫细胞、293悬浮细胞以及中国昆虫卵巢细胞,优选293悬浮细胞。
59.本发明的第五个方面,提供了所述抗体在制造用于治疗癌症的药物中的应用。所述癌症包括但不限于乳腺癌、结肠直肠癌、肛门癌、胰腺癌、胆囊癌、胆管癌、头颈癌、鼻咽癌、皮肤癌、黑素瘤、卵巢癌、前列腺癌、尿道癌、肺癌、非小细胞肺癌、小细胞肺癌、脑肿瘤、神经胶质瘤、成神经细胞瘤、食道癌、胃癌、肝癌、肾癌、膀胱癌、宫颈癌、子宫内膜癌、甲状腺癌、眼癌、肉瘤、骨癌、白血病、骨髓瘤或淋巴瘤。所述包括表达her2、vegfr2等的肿瘤细胞。
60.在一个实施例中,可用于治疗同时表达her2/vegfr2阳性肿瘤的用途。her2/vegfr2/cd3三特异性抗体分子在体外能够显著杀伤her2+肿瘤细胞,对同时表达vegfr2的肿瘤细胞杀伤效果更佳,但对her2/vegfr2双阴性细胞没有非特异性杀伤效果。同时体外和体内的肿瘤杀伤效果也显著高于同类型的双特异性抗体及其组合。
61.本发明的第六个方面,提供了用于治疗肿瘤的方法,其包括以有效治疗所述肿瘤的用量,向有此需要的受试者施用本技术的三特异性抗体。
62.本发明的技术方案,取得了有益的技术效果:
63.1、本发明所述三特异性抗体药物,首次实现了同时靶向t细胞、肿瘤细胞以及肿瘤血管的多靶点治疗,基于fab和vhh结构基础的三特异性抗体,相比于带fc区域的抗体表达纯化更加简便,在实体肿瘤微环境中穿透能力更强,基于fab和vhh结构基础的三特异性抗体,相比于普通的单链抗体串联结构,其在体内的半衰期更长,更有利于减少给药次数及剂量。
64.2、将vhh抗体分子通过不同连接肽linker连接于fab的不同位置有着不同的作用效果:在构建本发明中所述三特异性抗体时,将结构域之间的连接和功能区分需经过综合考虑。在fab的n端添加结构域时,需要重视的是fab结构域本身的靶向性,为了有效隔离2个不同结构域,本发明使用的是刚性连接肽linker,保证了2端抗体的靶向性;在fab的c端添加结构域时,需要重视的是添加的结构域能够正常表达,同时保证结构域的独立性,因此本发明使用的是柔性连接肽linker;本发明中也提供了将结构域通过螺旋卷曲连接肽(coiled coil linker)嵌合于轻/重链恒定区内的方法,更能有效保证3个结构域之间的独立性和靶向性。通过在fab不同位置引入vhh,可以有效调整靶向肿瘤细胞和t细胞之间的距离,从而调整形成有效免疫突触,避免免疫抑制信号对t细胞发挥活化杀伤效果的影响。基于此,我们发现了在cd3靶向fab引入her2靶向抗体的最佳位点是fab的c端,而引入vegfr2
靶向抗体的最佳位点是fab的恒定区。
65.3、通过文献总结和前期试验成果,成功选择靶向her2、vegfr2和cd3的抗体克隆,并且通过分子克隆技术在真核表达系统中分别进行了表达,经过体外验证,确认所选抗体均可以和目的抗原具有很好的结合特异性和亲和力。
66.4、选择了合适的表达系统并成功表达了不同结构的双特异性抗体,以抗cd3抗体片段fab为基础支架,分别构建her2/cd3和vegfr2/cd3的双特异性抗体,通过结构优化和活性比较,确认这些双特异性抗体能够表现出良好的结合稳定性以及介导t细胞免疫杀伤靶细胞效果。
67.5、通过结构优化和活性验证,明确her2/vegfr2/cd3(so)三特异性抗体的优化分子结构,进一步通过真核表达体系获得结构稳定的蛋白,在体外展现出稳定的her2、vegfr2和cd3靶点结合特异性和亲和力,同时能够有效介导t细胞对靶细胞的杀伤效果。相比于目前有疗效的双特异性抗体,所述her2/vegfr2/cd3(so)三特异性抗体除了对her2/vegfr2双阳性和单阳性肿瘤可以有效杀伤,还能够有效抑制肿瘤微环境血管的形成,具有有效防止肿瘤抗原免疫逃逸,同时增强对实体肿瘤微环境调控的协同免疫治疗效果。
附图说明
68.图1双特异性抗体结构设计以及基于结构优化活性设计的三特异性抗体示意图。
69.图2不同结构her2/cd3双特异性抗体与her2抗原的结合功能验证。
70.图3不同her2/cd3双特异性抗体对her2阳性mda-mb-231肿瘤细胞的体外杀伤活性验证。
71.图4不同her2/cd3双特异性抗体对her2阳性mda-mb-435肿瘤细胞的体外杀伤活性验证。
72.图5不同her2/cd3双特异性抗体对her2阳性pc3肿瘤细胞的体外杀伤活性验证。
73.图6不同her2/cd3双特异性抗体对her2阴性mda-mb-468肿瘤细胞的体外杀伤活性验证。
74.图7不同结构vegfr2/cd3双特异性抗体与vegfr2抗原的结合功能验证。
75.图8不同vegfr2/cd3双特异性抗体对vegfr2阳性pc3肿瘤细胞的体外杀伤活性验证。
76.图9不同vegfr2/cd3双特异性抗体对vegfr2阳性huvec细胞的体外杀伤活性验证。
77.图10不同vegfr2/cd3双特异性抗体对vegfr2阳性mda-mb-468/vegfr2肿瘤细胞的体外杀伤活性验证。
78.图11不同vegfr2/cd3双特异性抗体对vegfr2阴性mda-mb-468肿瘤细胞的体外杀伤活性验证。
79.图12优化结构的her2/vegfr2/cd3(so)三特异性抗体与her2抗原的结合功能验证。
80.图13优化结构的her2/vegfr2/cd3(so)三特异性抗体与vegfr2抗原的结合功能验证。
81.图14优化结构的her2/vegfr2/cd3(so)三特异性抗体与不同结构her2/cd3双特异性抗体对her2/vegfr2双阳性pc3肿瘤细胞的体外杀伤活性验证。
82.图15优化结构的her2/vegfr2/cd3(so)三特异性抗体与不同结构her2/cd3双特异性抗体对her2/vegfr2双阳性huvec细胞的体外杀伤活性验证。
83.图16优化结构的her2/vegfr2/cd3(so)三特异性抗体与不同结构her2/cd3双特异性抗体对her2/vegfr2双阴性mda-mb-468细胞的体外杀伤活性验证。
84.图17优化结构的her2/vegfr2/cd3(so)三特异性抗体与不同结构vegfr2/cd3双特异性抗体对her2/vegfr2双阳性pc3肿瘤细胞的体外杀伤活性验证。
85.图18优化结构的her2/vegfr2/cd3(so)三特异性抗体与不同结构vegfr2/cd3双特异性抗体对her2/vegfr2双阳性huvec细胞的体外杀伤活性验证。
86.图19优化结构的her2/vegfr2/cd3(so)三特异性抗体与不同结构vegfr2/cd3双特异性抗体对her2/vegfr2双阴性mda-mb-468肿瘤细胞的体外杀伤活性验证。
87.图20优化结构的her2/vegfr2/cd3(so)三特异性抗体与不同双特异性抗体及其组合在pc3前列腺癌负荷小鼠的体内抗肿瘤活性比较。
88.图21优化结构的her2/vegfr2/cd3(so)三特异性抗体与不同双特异性抗体及其组合对小鼠体重的影响。
具体实施方式
89.下面结合实施例对本发明做进一步的解释与说明,应当理解为以下实施例仅用于说明本发明,不用来限制本发明的保护范围。
90.以下各实施例中,实验所用材料均可购买,也可参照现有公开的技术制备;未标明来源和规格的均为市售可得;未详细描述的各种过程和方法是本领域中公知的常规方法。
91.实施例1双/三特异性抗体的构建和真核表达
92.1.1载体构建
93.cd3-hc-her2-vhh与cd3-lc表达载体的构建:
94.her2/cd3双特异性抗体的重链由cd3-hc(sp34)和her2-vhh分别按照以下方式进行连接:通过刚性连接肽he linker将her2-vhh连接于cd3-hc可变区(vh)结构域n端1e;或者通过刚性连接肽pd linker将her2-vhh连接于cd3-hc可变区(vh)结构域n端1e;或者通过螺旋卷曲连接肽coiled coil linker将her2-vhh嵌合于cd3-hc恒定区(ch1)结构域184s-187l之间,同时缺失185s、186g;或者通过柔性连接肽(g4s)3 linker将her2-vhh连接于cd3-hc恒定区(ch1)结构域c端228c;轻链cd3-lc不做任何修饰。按常规分子生物学方法分别合成上述cd3-hc-her2-vhh以及cd3-lc的编码基因,并将获得的合成基因通过同源重组方法插入到具有zeocin抗性的pfuse真核表达载体上。根据连接方式,后期表达的双特异性抗体分别标记为her2/cd3 hnt(he linker)、her2/cd3 hnt(pd linker)、her2/cd3 h184-187、her2/cd3 hct。其中抗her2-vhh除通过本实验选择的he linker、pd linker、coiled coil linker以及(g4s)3 linker连接于在cd3-hc,也可以采用本领域技术人员公知的连接肽linker进行替换连接。相关序列如表1所示:
95.表1
96.名称氨基酸序列编号核苷酸序列编号cd3-hcseq id no:8seq id no:24her2-vhhseq id no:10seq id no:26
he linkerseq id no:12seq id no:28pd linkerseq id no:13seq id no:29coiled coil linkerseq id no:14、15seq id no:30、31(g4s)3 linkerseq id no:16seq id no:32her2/cd3 hnt(he linker)seq id no:1seq id no:17her2/cd3 hnt(pd linker)seq id no:2seq id no:18her2/cd3 h184-187seq id no:3seq id no:19her2/cd3 hctseq id no:4seq id no:20cd3-lcseq id no:9seq id no:25
97.cd3-lc-vegfr2-vhh与cd3-hc表达载体的构建:
98.vegfr2/cd3双特异性抗体的轻链由cd3-lc(sp34)和vegfr2-vhh分别按照以下方式进行连接:通过刚性连接肽pd linker将vegfr2-vhh连接于cd3-lc可变区(vl)结构域n端1q;或者通过螺旋卷曲连接肽coiled coil linker将vegfr2-vhh嵌合于cd3-lc恒定区(cl)结构域171s-173d之间,并且缺失172k;或者通过柔性连接肽(g4s)3 linker将vegfr2-vhh连接于cd3-lc恒定区(cl)结构域c端217c;重链cd3-hc不做任何修饰。按常规分子生物学方法分别合成上述cd3-lc-vegfr2-vhh以及cd3-hc的编码基因,并将获得的合成基因通过同源重组方法插入到具有zeocin抗性的pfuse真核表达载体上。根据连接方式,后期表达的双特异性抗体分别标记为vegfr2/cd3 lnt、vegfr2/cd3 l171-173、vegfr2/cd3 lct。其中抗vegfr2-vhh除通过本实验选择的pd linker、coiled coil linker以及(g4s)3 linker连接于cd3-lc,也可以采用本领域技术人员公知的连接肽linker进行替换连接。相关序列如表2所示:
99.表2
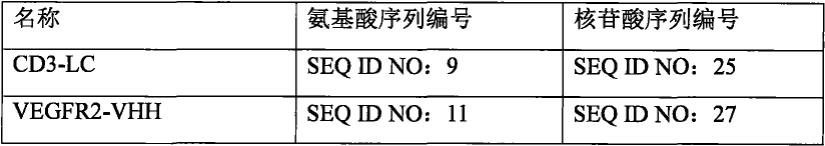
[0100][0101][0102]
her2/vegfr2/cd3(so)表达载体的构建:
[0103]
her2/vegfr2/cd3三特异性抗体的重链由cd3-hc(sp34)和her2-vhh按照以下方式进行连接:通过柔性连接肽(g4s)3 linker将her2-vhh连接于cd3-hc恒定区(ch1)结构域c
端228c;her2/vegfr2/cd3(so)三特异性抗体的轻链由cd3-lc(sp34)和vegfr2-vhh按照以下方式进行连接:通过螺旋卷曲连接肽coiled coil linker将vegfr2-vhh嵌合于cd3-lc恒定区(cl)结构域171s-173d之间,并且缺失172k。并将获得的基因通过同源重组方法插入到具有zeocin抗性的pfuse真核表达载体上。根据连接方式,后期表达的三特异性抗体标记为her2/vegfr2/cd3(so)。其中her2-vhh、vegfr2-vhh除通过本实验选择的(g4s)3 linker和coiled coil linker连接于cd3-hc或者cd3-lc外,也可以采用本领域技术人员公知的连接肽linker进行替换连接。相关序列如表3所示:
[0104]
表3
[0105]
名称氨基酸序列编号核苷酸序列编号cd3-hcseq id no:8seq id no:24cd3-lcseq id no:9seq id no:25her2-vhhseq id no:10seq id no:26vegfr2-vhhseq id no:11seq id no:27coiled coil linkerseq id no:14、15seq id no:30、31(g4s)3 linkerseq id no:16seq id no:32her2/cd3 hctseq id no:4seq id no:20vegfr2/cd3 l171-173seq id no:6seq id no:22
[0106]
本发明双特异性抗体的结构设计以及基于结构优化活性设计的三特异性抗体结构如图1所示。
[0107]
1.2蛋白的真核表达
[0108]
接种1.5
×
106/ml 293悬浮细胞于500ml摇瓶200ml培养基中,37℃,165rpm,5%co2浓度的摇床培养箱中振摇培养24h,24h后进行细胞计数,将细胞密度调整至3
×
106/ml,将上述1.1步骤所构建的轻链与重链质粒于10ml opti-mem混合均匀后室温静置5min,加入500μl(1∶2.5)pei 40000于10ml opti-mem轻柔混匀后室温静置5min,混合质粒和pei混合液,轻柔混匀后室温静置20min。将上述混合液逐滴加入200ml 293悬浮细胞培养液中,滴加的同时轻柔摇晃培养瓶,混合均匀后放入摇床,转染72h。转染结束后,100g离心5min,取上清液,向培养瓶中补加100ml培养基重新悬浮培养48h后3000rpm离心5min,取上清液,将两次收集的293悬浮细胞上清液混合,于-20℃冻存。
[0109]
实施例2三特异性抗体的纯化
[0110]
2.1 protein g亲和纯化
[0111]
取上述实施例1中1.2的细胞上清液400ml,15000rpm,4℃离心30min,收取上清液,0.45μm滤膜过滤,置于冰上备用。取4ml protein g(20%乙醇/protein g 1∶1)于层析柱内,用binding buffer冲洗3次后,使用垫片压住resin表面。用20ml binding buffer平衡protein g柱。每10ml上样一次,使样品匀速(约0.5ml/min)通过protein g柱。40ml binding buffer匀速(约1ml/min)清洗protein g柱。首先在洗脱管收集管中加入10%洗脱液体积的中和缓冲液,柱中加入elution buffer,5ml洗脱一次,直到无法定量蛋白浓度。使用amicon ultra-15离心过滤器对收集的蛋白样品进行浓缩,4℃离心机3000rpm离心20分钟,定量蛋白浓度。
[0112]
实施例3 her2/vegfr2/cd3三特异性抗体的生物学功能评价
linker,没有显示显著的抗原结合差异和肿瘤细胞杀伤差异,因此,接下来的双特异性抗体采用pd linker用于cd3-hc或者cd3-lc的n端融合连接。
[0121]
3.3不同结构vegfr2/cd3双特异性抗体的抗原结合验证
[0122]
将vegfr2 ecd-fc抗原蛋白用pbs稀释至10μg/ml包被于96孔elisa板中,100μl/孔,4℃包被过夜。弃去板中液体,pbst洗板2次后加入5%脱脂奶的pbst溶液200μl/孔,室温封闭2h,将孔内封闭液排干。将待测双特异性抗体vegfr2/cd3 lnt、vegfr2/cd3 l171-173、vegfr2/cd3 lct用封闭液10倍稀释8个梯度,起始抗体浓度为100nm,每个浓度梯度3个复孔,100μl/孔加入孔板内,室温孵育2h。用pbst洗板3次后排干,将hrp标记的抗kappa链抗体用5%脱脂奶的pbst进行1∶5000稀释后加入孔板内,100μl/孔,室温孵育1h。用pbst洗板3次后排干,每孔加入tmb显色液100μl,室温避光显色10min,然后每孔加入50μl 2m h2so4终止显色反应,用酶标仪检测od450nm的吸光度值。以样品浓度数值为横坐标,吸光度值为纵坐标做四参数非线性回归图并计算ec50值。
[0123]
结果如表5和图7所示,相比于对照组cd3-fab,不同结构双特异性抗体均能有效结合vegfr2 ecd-fc抗原蛋白;进一步对ec50值进行分析发现,vegfr2/cd3 lnt和vegfr2/cd3 l171-173的抗原结合能力显著强于vegfr2/cd3 lct;进一步比较发现vegfr2/cd3 l171-173相比于另外2种结构的双特异性抗体,具有良好的抗原结合能力。
[0124]
表5
[0125]
constructsec50(pm)cd3-fabnot determinedvegfr2/cd3 lnt1856vegfr2/cd3 l171-1731492vegfr2/cd3 lct10206
[0126]
3.4不同结构vegfr2/cd3双特异性抗体的体外肿瘤杀伤活性
[0127]
用含300iu/ml浓度il2的rpmi-1640完全培养基培养活化的人t细胞(来自于健康志愿者的pbmc)、前列腺癌细胞pc3(vegfr2+)、人脐静脉内皮细胞huvec(vegfr2+),用含10%胎牛血清的dmem培养基培养乳腺癌细胞mda-mb-468(vegfr2-)和工程化mda-mb-468/vegfr2(vegfr2+)。实验前24h用去除il2的rpmi-1640培养基培养t细胞。调整t细胞密度为2
×
106,肿瘤细胞密度为2
×
105,按照效靶比10∶1混合2种细胞的混合液加入96孔细胞板内100μl/孔。将待测双特异性抗体vegfr2/cd3 lnt、vegfr2/cd3 l171-173、vegfr2/cd3 lct用培养基10倍稀释8个梯度,起始抗体浓度为10nm,每个浓度梯度2个复孔,10μl/孔加入孔板内。实验同时设置阳性对照(肿瘤细胞直接进入细胞裂解液)和阴性对照(肿瘤细胞和t细胞),于37℃,5%co2培养箱培养24h。使用乳酸脱氢酶检测试剂盒检测96孔板内靶细胞裂解程度,多功能酶标仪检测孔内od490读数,并用graphpad prism6软件进行数据分析,以抗体浓度数值为横坐标,吸光度值为纵坐标做四参数非线性回归图并计算ic50值。
[0128]
结果如图8,图9,图10和图11所示,3种结构的vegfr2/cd3双特异性抗体对vegfr2阳性肿瘤细胞pc3(vegfr2+)、huvec(vegfr2+)、mda-mb-468/vegfr2(vegfr2+)均具有抗原特异性细胞毒性,而对不表达vegfr2的肿瘤细胞mda-mb-468(vegfr2-)不具有细胞毒性。通过对ic50的比较发现,vegfr2/cd3 l171-173相比于其他2种结构的双特异性抗体,对不同的vegfr2阳性肿瘤细胞,均表现出显著增强的肿瘤细胞特异性杀伤效果。因此,通过vegfr2
抗原结合活性和vegfr2阳性肿瘤细胞杀伤活性的比较,确定了vegfr2-vhh嵌合于cd3-fab的l171-173为最佳重组抗体结构。
[0129]
3.5优化结构her2/vegfr2/cd3(so)三特异性抗体的抗原结合验证
[0130]
具体实施步骤同3.1,结果如表6和图12所示,通过对ec50的比较发现,优化结构her2/vegfr2/cd3(so)与不同结构的her2/cd3双特异性抗体相比,与her2抗原的结合能力无明显差异,说明her2/vegfr2/cd3(so)保留了其对her2抗原的结合亲和力和特异性;此外,实施步骤同3.3,结果如表7和图13所示,通过对ec50的比较发现,优化结构her2/vegfr2/cd3(so)与不同结构的vegfr2/cd3双特异性抗体相比,与vegfr2抗原的结合能力无明显差异,说明her2/vegfr2/cd3(so)保留了其对vegfr2抗原的结合亲和力和特异性。其中her2/vegfr2/cd3(so)三特异性抗体具有对her2/cd3结合特异性的如seq id no:4所示的重组重链氨基酸序列,和具有对vegfr2/cd3结合特异性的如seq id no:6所示的重组轻链氨基酸序列。
[0131]
表6
[0132]
constructsec50(pm)vegfr2/cd3 l171-173not determinedher2/cd3 hnt(he linker)133.5her2/cd3 hnt(pd linker)254.5her2/cd3 h184-1873499her2/cd3 hct339.4her2/vegfr2/cd3(so)216.8
[0133]
表7
[0134]
constructsec50(pm)her2/cd3 hnt(pd linker)not determinedvegfr2/cd3 lnt300.7vegfr2/cd3 l171-1731140vegfr2/cd3 lct2513her2/vegfr2/cd3(so)276.4
[0135]
3.6优化结构her2/vegfr2/cd3(so)三特异性抗体与不同结构her2/cd3双特异性抗体的体外肿瘤细胞杀伤活性比较
[0136]
具体实施步骤同3.2,结果如图14,图15和图16所示,通过对ic50值的比较发现,与不同结构的her2/cd3双特异性抗体相比,结构优化后的三特异性抗体her2/vegfr2/cd3(so)对her2和vegfr2双阳性细胞系pc-3(her2+/vegfr2+)和huvec(her2+/vegfr2+)具有较好的杀伤效果,同时对her2和vegfr2双阴性细胞系mda-mb-468没有非特异性杀伤效果。
[0137]
3.7优化结构her2/vegfr2/cd3(so)三特异性抗体与不同结构vegfr2/cd3双特异性抗体的体外肿瘤细胞杀伤活性比较
[0138]
具体实施步骤同3.4,结果如图17,图18和图19所示,通过对ic50值的比较发现,与不同结构的vegfr2/cd3双特异性抗体相比,结构优化后的三特异性抗体her2/vegfr2/cd3(so)对her2和vegfr2双阳性细胞系pc-3(her2+/vegfr2+)和huvec(her2+/vegfr2+)具有显著提高的杀伤效果,同时对her2和vegfr2双阴性细胞系mda-mb-468没有非特异性杀伤效
果。
[0139]
3.8优化结构her2/vegfr2/cd3(so)三特异性抗体的体内抗肿瘤活性
[0140]
取25只6周龄ncg雄性小鼠,皮下接种pc3肿瘤细胞。具体地,将基质胶和pc-3肿瘤细胞以1∶1的体积比例混合,每只小鼠接种2
×
106个细胞,剂量为100μl。游标卡尺检测肿瘤体积,当肿瘤体积达到200mm3时,腹腔接种激活的t细胞每只2.5
×
107,剂量为200μl。一天后开始给药处理,具体地,将25只小鼠分成5组,分别尾静脉注射生理盐水、her2/cd3 hct、vegfr2/cd3 l171-172、双抗混合液(her2/cd3 hct+vegfr2/cd3 l171-172)、her2/vegfr2/cd3(so),抗体接种量为15nmol/kg,剂量为100μl,给药间隔为两天,共计给药7次,期间2天检测一次肿瘤体积和小鼠体重。
[0141]
如图20所示,结果表明,相对于生理盐水处理组,双特异性抗体和三特异性抗体都对肿瘤生长起到了抑制作用,而her2/vegfr2/cd3(so)三特异性抗体的抑制作用更加显著,说明该三特异性抗体相比于双特异性抗体,介导了更显著的t细胞对肿瘤细胞和微环境血管的杀伤效果。如图21所示,结果表明,在对肿瘤进行杀伤的同时,5组小鼠体重并无明显变化,说明该三特异性抗体在增加靶点抗性后并没有造成体内毒性的显著增加,安全性有保障。综上所述,通过抗原结合活性和肿瘤细胞杀伤活性的比较,优化结构设计的her2/vegfr2/cd3三特异性抗体具有显著的实体肿瘤协同抑制杀伤功能。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1