用于检测西瓜全缘叶形的SNP位点、紧密连锁分子标记及应用
用于检测西瓜全缘叶形的snp位点、紧密连锁分子标记及应用
技术领域
1.本发明属于基因工程技术领域,具体涉及一对用于定位西瓜全缘叶形基因clll的、与西瓜全缘叶形基因clll紧密连锁的分子标记、用于检测西瓜全缘叶形的snp位点以及应用。
背景技术:
2.选择是育种中最重要的环节之一,它是指在一个群体中选择符合要求的基因型来进行后续的培育。然而在传统的育种过程中,选择的依据往往是通过植株的表现型来判定,这种选择往往耗时较长且可能与基因型有偏差,造成选择不够准确并且效率低下。而利用分子标记辅助育种可以快速检测到目标基因或与目标性状紧密连锁的位点,达到选择目标性状的目的,具有快速、准确、不受环境条件干扰的优点。
3.dcaps(衍生形酶切扩增多态性序列)标记是在caps(酶切扩增多态性序列)标记的基础上改进而来的。其基本原理为:在设计提议性的扩增引物时引入错配的碱基,使其可以产生新的限制性内切酶作用位点,之后用该引物进行pcr扩增,将获得的扩增产物用特定的限制性内切酶进行酶切,最后采用凝胶电泳进行酶切片段检测,根据是否切开来判断样品间的多态性。dcaps标记是共显性标记,可区分杂合和纯合的基因型,可以直接用琼脂糖电泳分析,操作简便快捷。dcaps标记相对于caps标记不需要考虑snp是否在限制性内切酶位点上,可以最大限度的将snp转化成标记,使基因组上的snp的利用率更高。无法转化成dcaps标记的snp位点,可以设计引物通过sanger法测序的方式对其所在dna链上相对位置碱基进行检测判断样品间的多态性。
4.作为一种重要的葫芦科作物,西瓜是人们夏季消暑解渴的重要水果,其在世界园艺作物中占有非常重要的地位。而中国作为世界上西瓜生产和消费第一大国,栽培面积及产量巨大。叶片是开花植物极其重要的光合器官,决定着营养物质的分配、气体交换和水分运输,植物叶片的形状同时影响光合效率和蒸腾速率,是影响植物体内物质积累关键因素,从而影响植株的产量以及果实的品质。
5.叶片是由茎尖分生组织sam周围一团未经分化的细胞经过分裂分化最终发育形成叶片。在整个叶片发育周期中受外界环境(温度、光照等)、体内激素(ck、iaa等)、转录因子(pin1、knox1、wus、clv、arp等)、mirna等多因素影响。
6.叶片形态多样性的主要因素之一即为叶缘形状的变化,植物叶缘的形状多种多样,主要包含波浪、锯齿、全缘、裂刻等,而在传统上将叶分为单叶和复叶两大类,复叶和单叶均可分为浅裂、深裂和全缘,复叶可看作是极端类型的单叶叶缘深裂。叶片的发育机理和模式是目前研究的热点。hd-zipi亚家族转录因子在许多植物中保守以调节叶片形状,lmil最早在拟南芥中被报道为花调节剂,并被发现影响叶片形态建成,拟南芥中组成性表达同源基因产生了裂叶。目前发现在其它物种中类lmi1的基因的功能是相似的,影响植物叶片最终形状。全缘叶形性状是西瓜品种多样性的表现,同时叶片面积大小和叶片形状均会对植物产量和品质造成一定影响,因此关于叶片发育分子机理的研究自然成为国内外科学家
关注的焦点之一。
7.随着西瓜全基因组测序的完成,近年来关于西瓜的相关研究发展迅速,许多优异的性状已经进行了基因定位,开发出的一些连锁标记也已经开始用到分子标记辅助育种过程当中,而目前关于西瓜全缘叶形的紧密连锁的分子标记研究还未见报道。通过对西瓜全缘叶形的研究,开发出和西瓜全缘叶形性状紧密连锁的分子标记,不仅可以为西瓜分子标记辅助选择培育全缘叶形西瓜新品种提供有效的帮助,同时也可以大大缩短育种进程并提高选择的准确性。
技术实现要素:
8.本发明的目的之一是提供两对用于定位西瓜全缘叶基因clll并且与西瓜全缘叶基因clll紧密连锁的分子标记。
9.本发明目的之二在于提供了一个用于检测西瓜全缘叶形的snp位点以及其分子标记引物,所述snp位点为西瓜基因组(http://cucurbitgenomics.org/,vi)4号染色体上,第21233133位核苷酸t缺失。
10.本发明目的之三在于提供一种上述分子标记在西瓜分子育种的应用。
11.本发明的另一目的在于提供一种西瓜全缘叶形品种的判定方法。
12.为实现上述目的,本发明提供如下技术方案:
13.与西瓜植株全缘叶形基因clll紧密连锁的两对分子标记,该分子标记为衍生形酶切扩增多态性标记(dcaps标记),与西瓜全缘叶形紧密连锁的衍生形酶切扩增多态性分子标记是基于clll开发的,两对分子标记命名为dcaps2和dcaps3,扩增所述的dcaps2分子标记的引物对的上游引物序列如seq.id.no.1所示,下游引物序列如seq.id.no.2所示;扩增所述的dcaps3分子标记的引物对的上游引物序列如seq.id.no.3所示,下游引物序列如seq.id.no.4所示。。
14.本发明还公开了与西瓜全缘叶形基因clll紧密连锁的分子标记在西瓜分子育种的应用,该分子标记与西瓜全缘叶形性状紧密连锁,在分子水平上可以辅助鉴定西瓜植株是否为全缘叶形的表型,并且在种子或者苗期即可判定西瓜叶形性状,从而提高选择效率、加快育种进程。本领域技术人员可以理解,比如通过检测是否存在本发明的分子标记来筛选全缘叶形西瓜品种。所述检测可以是pcr检测的方法,具体地,可以使用上述的本发明的分子标记的引物对,所述检测还可以通过测序方法进行。
15.本发明还公开了一种鉴定全缘叶形西瓜性状的方法,采用pcr扩增后酶切的方法进行检测,所述方法包括如下步骤:
16.(1)提取西瓜组织的dna;
17.(2)pcr扩增:利用权利要求1所述的引物对,对步骤(1)所提取样品进行pcr扩增;
18.(3)对步骤(2)中的扩增产物进行酶切处理,之后进行电泳检测;
19.(4)根据步骤(3)的电泳条带结果进行判定,具体标准为:
20.对于分子标记dcaps2,如果酶切产物为长度122bp的特征条带,则待测植株为全缘叶形的西瓜材料;如果酶切扩增产物为146bp的特征条带,该待测植株为纯合裂刻叶形的西瓜材料,如果酶切产物为两条长度分别为146bp、122bp的特征条带,该待测植株为杂合裂刻叶形的西瓜材料;对于分子标记dcaps3,如果酶切产物为长度119bp的特征条带,则待测植
株为全缘叶形的西瓜材料;如果酶切扩增产物为89bp的特征条带,该待测植株为纯合裂刻叶形的西瓜材料,如果酶切产物为两条长度分别为119bp、89bp的特征条带,该待测植株为杂合裂刻叶形的西瓜材料。
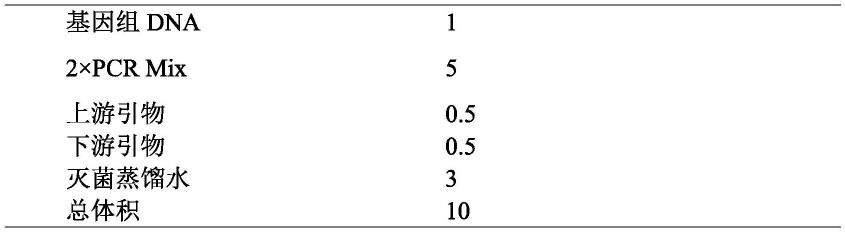
21.具体地,所述pcr扩增的反应体系为:dna 1μl、2
×
pcr mix 5μl、上游引物0.5μl、下游引物0.5μl、灭菌蒸馏水3μl,总体积10μl。pcr扩增条件为:95℃、5min;94℃、30s,57℃、30s,72℃、50s,共35个循环;72℃、10min;4℃保存。
22.酶切反应体系为:pcr产物5μl,10buffer1μl,dde1限制性内切酶0.5μl,灭菌蒸馏水3.5μl,总体积10μl。酶切条件为37℃、4h。
23.另外,根据西瓜基因组(http://cucurbitgenomics.org/,v1)4号染色体上,第21233133位核苷酸t缺失这一碱基突变,设计snp标记。扩增snp2分标记的引物对的上游引物序列如seq.id.no.9所示,下游引物序列如seq.id.no.10所示。
24.针对snp2标记,本发明还提供了另外一种鉴定西瓜全缘叶形性状的方法,所述方法包括如下步骤:
25.(1)提取西瓜植株组织的dna;
26.(2)pcr扩增:利用snp2标记引物对,对步骤(1)所提取样品进行pcr扩增;
27.(3)对产物进行sanger测序
28.(4)根据步骤(3)的测序结果进行判定,具体标准为:
29.若克隆产物第253至258位碱基为gtttcc,其序列如序列表中seq id no.11所示,则待测西瓜植株为全缘叶形的材料;若克隆产物第253至258位碱基为gttttc,其序列如序列表中seq id no.12所示,则待测西瓜植株为纯合裂刻叶形材料;若克隆产物第253至258位碱基为gtttcc或gttttc,待测西瓜植株为杂合裂刻叶形材料。
30.另外,包含上述分子标记dcaps引物对(一对或者两对)或snp2分子标记引物对的试剂盒,可以用来鉴定西瓜材料是否为全缘叶形性状,具体应用时,可以选择含有任何一对引物对做成试剂盒,更加优选地,选择两对引物对,检测更加准确。
31.再者,用于检测dcaps标记或者是否存在的试剂在全缘叶形基因clll定位中的应用,利用本发明的分子标记,可以对全缘叶形基因clll进行定位,上述这些应用均可以按照常规的方法进行。
32.本发明还保护含有上述分子标记的载体。所述重组载体可以是插入有本发明的分子标记的表达载体或者克隆载体。获得上述重组载体后,本领域技术人员可以根据不同的需要,将重组载体转化到合适的细胞中,得到含有该重组载体的重组细胞。因此,本发明还保护含有所述重组载体的重组细胞。
33.本发明的优点:
34.一方面,本发明的分子标记可为最终实现对clll基因的克隆,进而为西瓜叶片形成的分子机制研究奠定基础。另一方面,由于该标记与西瓜全缘叶形基因clll紧密连锁,因此可直接用于西瓜全缘叶形材料的分子标记辅助育种,而由于分子标记在辅助育种体系中具有简便、快速、高通量的优势,因而本发明所提供的分子标记在全缘叶形新品种培育中具有较好的应用价值。
35.另外,利用该分子标记能够在出芽期或子叶期即可准确快速的鉴定出西瓜叶片形态性状,具有检测方便、扩增产物稳定的优点。
36.本技术首次对西瓜全缘叶形性状相关基因进行了详细研究,利用分子标记和染色体步移法等相关研究方法,最终确定一个与西瓜全缘叶基因共分离的snp位点及两对与西瓜全缘叶基因clll紧密连锁的分子标记。定位结果表明,全缘叶形基因clll位于两个分子标记(dcaps2、dcaps3)之间,物理距离仅30kb左右;在其30kb的片段中编码的两个基因(cla018360、cla018361)上,仅在基因cla018360上出现snp突变,其一个碱基的缺失导致翻译提前终止,导致西瓜全缘叶形的出现。这一发现为最终clll基因的克隆、分子标记辅助育种体系的建立奠定基础,同时也有助于最终西瓜叶片发育调控网络的研究奠定基础。总之,由于分子标记对于最终功能基因定位具有十分重要意义,加上分子标记在分子标记育种体系建立中具有简便、快速、高通量的优势,因而使得本技术具有十分重要的应用价值,对于西瓜新品种培育也具有十分重要的保护意义。
附图说明
37.图1为西瓜缺刻叶形材料wt2和全缘叶形材料材料wt20;
38.图2为dcaps2在亲本和f2群体中的酶切电泳图;
39.图中,m为dl1000 marker,图中显示的为200bp和100bp条带;p1代表裂刻叶形材料wt2,p2代表全缘叶形材料wt20。
40.图3为dcaps3在亲本和f2群体中的酶切电泳图;
41.图中,m为dl1000 marker,图中显示的为200bp和100bp条带;p1代表裂刻叶形材料wt2,p2代表全缘叶形材料wt20。
42.图4为利用joinmap4.0软件对西瓜全缘叶形性状所做的连锁图谱,其中clll代表全缘叶形基因;
43.图5为西瓜clll基因结构、序列比较及等位基因多样性。5a为snp位点在基因组中的位置;5b为部分自然材料snp位点cds序列差异;(由于材料较多,但结果一致,因此对于条带对应种质材料不再详细说明)。
具体实施方式
44.下面结合申请做进一步的解释说明,在介绍具体实施例前,就下述实施例中生物材料、实验试剂及相关实验背景情况简要介绍如下。
45.生物材料:
46.西瓜全缘叶形材料wt20(母本),其整个植株所有叶片为全缘叶形且能够稳定遗传;
47.西瓜材料wt2(父本)是由发明人选育的高代自交系,该材料全部叶片为裂刻叶形且能够稳定遗传。
48.上述西瓜材料wt2,与公开号为cn110938706a的中国发明专利“与西瓜植株无卷须基因clnt紧密连锁的分子标记及应用”中采用的正常普通有卷须以及公开号为cn110938706a的中国发明专利“与西瓜果皮覆纹基因c1gs紧密连锁的分子标记及应用”中采用的网状覆纹西瓜材料wt2是一致的。
49.以上材料均可以通过商业的途径或者河南农业大学瓜类作物遗传育种课题组提供。
50.实验过程中,西瓜材料种植于河南农业大学毛庄科教园区日光温室内,种植过程中,催芽后进行穴盘育苗,采用正常的西瓜栽培管理方式,在六叶一心时期对相关表型性状进行调查统计;
51.pcr扩增用引物及基因测序工作,由北京诺赛基因组研究中心有限公司提供完成;
52.实验试剂:
53.pcr扩增用pcr magicmix 3.0,购于北京天恩泽基因科技有限公司;
54.电泳与银染相关试剂如丙烯酰胺、甲叉丙烯酰胺、agno3、naoh和甲醛等试剂,购自北京索莱宝科技有限公司;
55.实验设备:
56.pcr仪,珠海黑马医学仪器有限公司hema9600形基因扩增仪;
57.jy300hc通用形电泳仪,由北京君意东方电泳设备有限公司生产;
58.ht-scz04a高通量垂直电泳槽,由北京鸿涛基业科技发展有限责任公司生产。
59.实施例1与西瓜植株全缘叶形基因共分离的snp标记及紧密连锁的dcaps分子标记的获得
60.本实施例主要介绍一下对于西瓜clll基因的精细定位过程,包括遗传分离群体的构建、初步定位、精细定位等过程(分析流程如图4所示),在此过程中即涉及最终分子标记dcaps、snp2的开发、设计及检验过程,相关实验过程简要介绍如下。
61.一、遗传分离群体的构建
62.以西瓜全缘叶形wt20作为母本,以西瓜裂刻叶形wt2作为父本(需要解释的是,实验期间,从材料易得性及操作方便考虑,发明人以wt2作为父本,在采用其他纯合裂刻叶材料时,同样可以进行相关实验),利用这两个亲本配置了杂交组合,结果表明,获得的f1代植株裂刻叶形。
63.从f1代植株中选择10个单株,自交获得f2代种子,用于遗传分析与基因定位。对这些f2代个体的叶片叶形表型进行鉴定,并用卡方测验进行验证。
64.结果表明:
65.初步定位时,随机选取157株f2群体,其中裂刻叶形表型115株,全缘叶形表型42株,χ2=0.3123<3.84,符合3:1的分离比。
66.精细定位时,最初群体为486株f2群体,其中裂刻叶形表型361株,全缘叶形表型120株,χ2=0.193<3.84,同样符合3:1的分离比。
67.综合分析可知,西瓜全缘叶形性状是由1对隐性核基因控制的,将该基因命名为clll,裂刻叶形(ll)对全缘叶形(ll)为完全显性。
68.二、基因的初步定位
69.采用bsa法进行初步定位,具体实验过程为:
70.(1)首先,制备基因池,具体为:
71.在上述步骤一的f2群体中随机选取20个裂刻叶形单株与20个全缘叶形单株,在六叶一心期从每个单株上面采集未展开的幼嫩叶片,采用ctab法提取其基因组dna,并分别混合制成裂刻叶形基因池和全缘叶形基因池(裂刻叶形与裂刻叶形混合,全缘叶形与全缘叶形混合)。
72.(2)多态性筛选分析,具体为:
73.利用发明人前期从西瓜全基因组开发的1256对ssr引物(具体引物序列参考《genome wide characterization of simple sequence repeats in watermelon genome and their application in comparative mapping and genetic diversity analysis》,zhu et al.,bmc genomics,2016,17:557-573.),筛选在亲本间具有多态性的标记。其中共有272个标记在亲本间表现出多态性。接着通过在亲本间有多态性的272个标记对步骤(1)中所制备的两个基因池进行第二次多态性筛选,获得了5个在两个基因池间具有多态性的标记。根据ssr标记的信息,5个在双亲及混池间都具有多态性的标记均位于第4号染色体的末端。
74.进一步,将筛选出的多态性ssr标记对157株f2群体(步骤一中初步定位时所选择)进行基因型分析,将所获得的与全缘叶形亲本相同带形的记作1,获得与裂刻叶形亲本相同带形的记作2,获得杂合带形的记作3。
75.多态性筛选分析过程中,pcr扩增时,10μl扩增体系设计如下:
76.基因池样品(基因组dna,30ng/μl),1μl(约30ng);
77.f、r引物,各0.5μl(引物浓度均为5μmol/l)
78.pcr magicmix,5.0μl;
79.ddh2o,3.0μl;
80.pcr扩增程序为:94℃、5min;94℃、30s,55℃、30s,72℃、30s,35个循环;72℃5min。
81.需要解释的是,上述pcr扩增体系中的f、r引物分别代表一对引物中的前引物和后引物;1256对ssr引物,由于这些引物与本技术欲保护主题并不直接关联,文本简明起见,不再详细说明。
82.对pcr扩增产物进行8%非变性聚丙烯酰胺凝胶电泳检测。电泳检测时,聚丙烯酰胺凝胶电泳缓冲液为0.6
×
tbe,200v恒压电泳1~1.5h。电泳结束后进行银染,以便观察和检测,银染方法为:
83.a、将带胶的玻璃板放入固定液中,在摇床上轻轻摇动直至指示剂退去颜色,其中固定液的组成为,冰醋酸∶无水乙醇∶蒸馏水的体积比为0.5∶10∶100;
84.b、用超纯水洗1~3min;
85.c、将冲洗后的胶板放入染色液中摇动10min,染色液为0.2%硝酸银水溶液;
86.d、将染色后的胶板放入超纯水中漂洗30s,放入装有显影液的塑料盒中,轻轻摇动直至条带清晰呈现,显影液是在1l蒸馏水中加入15g naoh和3ml甲醛混匀得到的;
87.e、最后放入自来水反复漂洗几次;
88.f、室温下干燥,然后拍照。
89.(3)基因初步定位
90.具体为:结合初步定位群体表型调查数据和步骤(2)中最终ssr标记的分形结果,利用joinmap4.0软件,对西瓜叶形控制性状基因进行初步定位,结果获得2个与clll基因紧密连锁的ssr分子标记:c1ssr11194和clssr11265(相关编码为研究过程中发明人自行编码,并不具有特殊含义),这两个分子标记位于全缘叶形基因clll基因的两端,分别与clll基因相距2.6cm和1.3cm(如图4所示)。
91.三、基因的精细定位
92.在步骤二初步定位基础上,发明人进一步对与叶形控制性状基因clll基因进行了
精细定位,具体过程简要介绍如下。
93.(1)作图群体的扩大:
94.在初步定位的基础上,我们将进一步将f2作图群体增加到486株,然后选用clssr11194、clssr11265、clssr11278、c1ssr11282四个标记进行基因型分析,目的基因确定是定位在clssr11194和c1ssr11265之间。
95.(2)亲本重测序和基因组比对
96.利用illumina hi-seq2000高通量测序平台对两亲本材料进行重测序,控制测序深度>30倍;以已公布的以西瓜全基因组序列在ssr标记clssr11194和clssr11265之间391kb的区段的作为参考序列,用网上公开的免费软件包bwa(http://bio-bwa.sourceforge.net/)分别将两个亲本的重测序序列和候选区段进行比对,找到两个亲本在候选区段的差异位点。
97.(3)精细定位
98.初定位区间内没有更多的多态性ssr标记,我们比较两亲本基因组在初步定位的候选区段内的序列差异,继续开发dcaps标记和indel标记,将这些标记在亲本间进行了多态性筛选,利用clssr11194和clssr11265标记对初步定位群体进行筛选,寻找clssr11194和clssr11265标记基因型(通过分析显隐亲本获得)与性状表现形(全缘叶形/缺刻叶形)不一致的单株,即标记与clll基因的重组单株。然后将筛选到的多态性的标记对clssr11194和clssr11265与clll的重组单株进行了基因型分析,最终将候选基因定位到西瓜4号染色体。如图4所示。精细定位显示分子标记dcaps2和dcaps3与全缘叶形基因clll表现为紧密连锁。这两对标记均可以被限制性内切酶dde1(酶切位点c/tnag)切割,分子标记dcaps2的引物对为:
99.dcaps2-f:5
’‑
aatgggtatgatattgtccatctc-3’(如seq.id.no.1所示)
100.dcaps2-r:5
’‑
aaagtcttgcattggctaaaga-3’;(如seq.id.no.2所示)
101.利用该引物对待测西瓜样本(亲本和f2群体)进行pcr扩增,结果发现,全缘叶形西瓜样品的酶切产物有122bp条带,经测序其序列如序列表中seq id no.5所示,而裂刻叶形品种分为两种情况,当该样品为纯合裂刻叶形品种,酶切扩增产物有146bp的特征条带,经测序其序列如序列表中seq id no.6所示,当该样品为杂合裂刻叶形品种时,其酶切产物为两条长度分别为146bp、122bp的特征条带(如图2)。
102.分子标记dcaps3的引物对为:
103.dcaps3-f:5
’‑
aaaatttgcatgtttggattacaaaactca-3’,(如seq.id.no.3所示)
104.dcaps3-r:5
’‑
tcagattctatttcatgttttcaga-3’;(如seq.id.no.4所示)
105.利用该引物对待测西瓜样本(亲本和f2群体)进行pcr扩增,结果发现,全缘叶形西瓜样品的酶切产物有119bp条带,经测序其序列如序列表中seq id no.7所示,而裂刻叶形品种分为两种情况,当该样品为纯合裂刻叶形品种,酶切扩增产物有89bp的特征条带,经测序其序列如序列表中seq id no.8所示,当该样品为杂合裂刻叶形品种时,其酶切产物为两条长度分别为119bp、89bp的特征条带(如图3)。
106.标记dcaps2与标记dcaps3相距30kb,参照基因组数据(97103)在此30kb的候选区间中包含cla018360、cla018361两个基因。通过双亲材料重测序数据与基因组(97103)比对,发现在基因cla018361上双亲均无核苷酸的突变;全缘叶亲本材料wt20在其基因
cla018360的第1269位出现单个snp(t)的缺失。编号cla018360编码hd-zip家族基因,是拟南芥中已报道的调控叶形发育基因lmil的同源基因。
107.在基因cla018360的dna序列上设计snp2标记,在f2代分离群体中随机挑选10棵单株提取dna,通过snp2引物在每个单株中dna上克隆片段,通过高通量测序发现cla018360的第1269位单snp(t)的缺失与叶形(裂刻/全缘)表型共分离。
108.分子标记snp2的引物对为:
109.snp2-f:5
’‑
ccattttagaatcactcccaaac-3’(如seq.id.no.9所示)
110.snp2-r:5
’‑
aactaagcaagaagacatgtgacc-3’;(如seq.id.no.10所示)
111.利用该引物对待测西瓜样本(亲本和f2群体)进行pcr扩增,产物经sanger法测序结果发现,全缘叶形西瓜样品的克隆产物第253至258位碱基为gtttcc,其序列如序列表中seq id no.11所示,而裂刻叶形品种分为两种情况,当该样品为纯合裂刻叶形品种,克隆产物第253至258位碱基为gttttc,其序列如序列表中seq id no.12所示,当该样品为杂合裂刻叶形品种时,其克隆产物第253至258位碱基为gtttcc、gttttc。
112.实施例2利用dcaps分子标记鉴定西瓜是否为全缘叶形材料
113.1、提取西瓜组织的dna
114.采用常规ctab法提取西瓜样品组织的dna,去除rna,dna样品体积不低于50μl。用紫外分光光度计测定dna样品在260nm、280nm处的od值,计算dna含量以及od260/280的比值。dna样品纯度od260/280值应在1.8-2.0,浓度稀释至100ng/μl。
115.2、引物选择
116.dcaps2采用如下引物序列:
117.dcaps2-f:5
’‑
aatgggtatgatattgtccatctc-3’(如seq.id.no.1所示)
118.dcaps2-r:5
’‑
aaagtcttgcattggctaaaga-3’(如seq.id.no.2所示)
119.dcaps3采用如下引物序列:
120.dcaps3-f:5
’‑
aaaatttgcatgtttggattacaaaactca-3’(如seq.id.no.3所示)
121.dcaps3-r:5
’‑
tcagattctatttcatgttttcaga-3’(如seq.id.no.4所示)
122.引物由生物技术公司合成后,稀释至10μm后备用。
123.3、pcr反应体系
124.按照标准流程进行pcr反应程序,pcr反应体系如表1所示。
125.表1 pcr反应体系
[0126][0127][0128]
pcr扩增程序为:95℃、5min;94℃、30s,57℃、30s,72℃、50s,共35个循环;72℃、10min;4℃保存。
[0129]
4、酶切
[0130]
酶切反应体系如表2所示:
[0131]
表2酶切反应体系
[0132][0133]
样品混匀后,在为37℃酶切4h。
[0134]
5、琼脂糖凝胶电泳检测
[0135]
配制1%的琼脂糖凝胶电泳进行条带分别对f2代群体以及其他西瓜品种进行检测,可以快速的鉴定西瓜品种是否属于全缘叶形,具体地:
[0136]
对于分子标记dcaps2,若酶切产物长度为122bp(序列如seq.id.no.5所示)的特征条带,则待测品种为全缘叶形的西瓜品种;如果酶切扩增产物为146bp(序列如seq.id.no.6所示)的特征条带,该品种为纯合裂刻叶形品种,如果酶切产物为两条长度分别为146bp、122bp的特征条带,该品种为杂合裂刻叶形品种。对于分子标记dcaps3,若酶切产物长度为119bp(序列如seq.id.no.7所示)的特征条带,则待测品种为全缘叶形的西瓜品种;如果酶切扩增产物为89bp(序列如seq.id.no.8所示)的特征条带,该品种为纯合裂刻叶形品种,如果酶切产物为两条长度分别为119bp、89bp的特征条带,该品种为杂合裂刻叶形品种。通过对扩增的特征条带进行分析,就可以判断出西瓜是否属于全缘叶形品种。
[0137]
综上所述,本发明的衍生形酶切扩增序列多态性标记能够对西瓜植株全缘叶形性状进行大规模鉴定,可以在生产中大规模应用。
[0138]
实施例3利用snp分子标记鉴定西瓜是否为全缘叶形材料
[0139]
1、提取西瓜组织的dna
[0140]
采用常规ctab法提取西瓜样品组织的dna,去除rna,dna样品体积不低于50μl。用紫外分光光度计测定dna样品在260nm、280nm处的od值,计算dna含量以及od260/280的比值。dna样品纯度od260/280值应在1.8-2.0,浓度稀释至100ng/μl。
[0141]
2、引物选择
[0142]
snp2采用如下引物序列:
[0143]
snp2-f:5
’‑
ccattttagaatcactcccaaac-3’(如seq.id.no.9所示)
[0144]
snp2-r:5
’‑
aactaagcaagaagacatgtgacc-3’(如seq.id.no.10所示)
[0145]
引物由生物技术公司合成后,稀释至10μm后备用。
[0146]
3、pcr反应体系
[0147]
按照标准流程进行pcr反应程序,pcr反应体系如表1所示。
[0148]
pcr扩增程序为:95℃、5min;94℃、30s,57℃、30s,72℃、50s,共35个循环;72℃、10min;4℃保存。
[0149]
4、sanger测序
[0150]
吸取全部pcr产物进行sanger测序,若碱基序列如seq.id.no.11所示第253至258
位碱基为gtttcc,则待测西瓜植株为全缘叶形的材料;若碱基序列如seq.id.no.12所示第253至258位碱基为gttttc,则待测西瓜植株为纯合裂刻叶形材料;若该样品为杂合裂刻叶形品种时,其克隆产物第253至258位碱基为gtttcc或gttttc,待测西瓜植株为杂合裂刻叶形材料,通过对待测材料进行sanger测序,根据序列对比就可以判断出西瓜是否属于全缘叶形品种。
[0151]
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1