澜沧黄杉中八环五萜类化合物及其制备和应用
541)。天然产物是经自然法则长时间选择进化而产生的,往往能与生物大分子有效结合,可以被认为是与人类蛋白高度相关生物系统长年累月筛选淘汰后剩下的精英化合物库。同时,单一靶点的药物往往疗效不佳,而中药/植物药及其组分具有结构新颖(化学成分)、多靶点、多途径的作用特点,在治疗复杂疾病过程中具有独特优势。因此从天然来源(特别是植物来源)化学成分中寻找开发新型、高效、低毒副作用的acc1抑制剂具有重要的研究价值。
6.具有独特来源和结构特征的天然产物可能在目前糖脂代谢紊乱疾病新药研发领域的激烈竞争中获得先机。对药物分子天然来源进行统计分析,结果显示:源于陆生植物的药物分子是集中分布于一些特定科中(活性天然产物来源于自然界6763科中的792科,占比仅为11.7%),且上市药物和处于临床期候选化药则集中分布于其中的144科,而绝大多数稀有濒危植物明显处于这些能够产生药物的植物科属中(zhu et al.,proc.natl.acad.sci.u.s.a.2011,108,12943
–
12948.;mohamed et al.,proc.natl.acad.sci.2013,110:16832-16837.),这表明稀有濒危植物中的天然产物的新颖性成药性远高于一般的植物平均水平。
7.有意义的是,松科(pinaceae)处于最能产生药物分子的生物科属前20名之列(zhu et al.,proc.natl.acad.sci.u.s.a.2011,108,12943
–
12948.)。澜沧黄杉(pseudotsuga forrestii craib)属于松科黄杉属(pseudotsuga)植物,为我国特有种。其为常绿乔木,分布于横断山脉中南部中山上部至高山中部,于1992年被《中国植物红皮书—稀有濒危植物》收录,列为“渐危种”。如果能保护性地去采集少许澜沧黄杉植物样品(如可再生枝叶)进行系统的化学成分研究,将会积极促进科学认识、积极保护和综合开发利用这一珍稀植物资源,使之持续为人类服务。
技术实现要素:
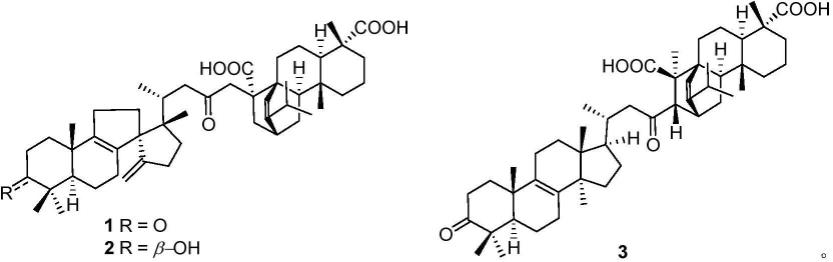
8.本技术涉及的化合物为澜沧黄杉分离得到的重排螺环羊毛脂烷型三萜或常规羊毛脂烷型三萜(亲双烯体)与松香烷二萜(二烯)分子间diels-alder反应类型的加合物,在体外药理活性筛选中发现具有显著的acc1抑制作用,由此可能对高脂血症、非酒精性脂肪肝炎、ii型糖尿病、癌症及其它acc1所介导的疾病具有治疗作用,从而在制药领域有巨大的潜在用途。
9.本技术首次从澜沧黄杉枝叶的甲醇提取物中分离鉴定出3个重排螺环羊毛脂烷型三萜或常规羊毛脂烷型三萜与松香烷二萜分子间通过diels-alder[4+2]环加成反应而产生的具有新骨架的化合物,其结构特征是:重排螺环羊毛脂烷型三萜或常规羊毛脂烷型三萜(亲双烯体)与松香烷二萜(二烯)骈合(结构如式1~式3所示),其中,式1和式2为重排螺环羊毛脂烷型三萜与松香烷二萜骈合的骨架;式3为常规羊毛脂烷型三萜与松香烷二萜骈合的骨架。经多次药理试验研究表明,该类化合物具有显著的acc1抑制活性。
[0010]
一方面,本技术提供澜沧黄杉中八环五萜类化合物,其结构式为如下所示结构之一:
[0011][0012]
另一方面,基于该该类化合物具有显著的acc1抑制活性:
[0013]
本技术还提供一种所述澜沧黄杉中八环五萜类化合物在制备乙酰辅酶a羧化酶1(acetyl-coa carboxylase 1,acc1)抑制剂中的用途。
[0014]
本技术还提供一种所述澜沧黄杉中八环五萜类化合物在制备预防、延缓或治疗由乙酰辅酶a羧化酶1介导疾病的药物中的用途。
[0015]
可选的,所述由乙酰辅酶a羧化酶1介导疾病包括高脂血症、非酒精性脂肪肝、ii型糖尿病或肥胖症。
[0016]
本技术还提供一种乙酰辅酶a羧化酶1抑制剂,以结构如式1~式3所示的澜沧黄杉中八环五萜类化合物中的一种或几种为活性成分。
[0017]
本技术还提供一种药物组合物,包含治疗有效量的选自如结构如式1~式3所述澜沧黄杉中八环五萜类化合物中的一种或多种作为活性成分。
[0018]
本技术的药物组合采用上述diels-alder型加合物中的一种或多种作为原料,包含治疗有效量的选自上述化合物中的一种或多种作为活性成分,该组合物可以进一步包括药剂学上可接受的药物辅料,例如载体、赋形剂、佐剂或稀释剂等。所述药物组合可于制备预防、延缓或治疗由acc1介导的糖脂紊乱相关疾病(特别是高血脂症及其相关的心血管疾病的药物)或是作为该类药物的先导化合物。
[0019]
基于该类化合物在化学结构新颖性、生物活性显著等方面的优点,使其具有很好的开发前景,有望发展成为结构新颖的针对acc1所介导疾病的治疗药物或先导化合物。
[0020]
本发明所述的化合物可通过从植物中分离纯化得到;也可经本领域技术人员熟知的化学方法合成获得。
[0021]
其中,从植物中分离纯化的方法包括以下步骤:
[0022]
本发明所述的化合物由澜沧黄杉(pseudotsuga forrestii craib)枝叶经由本领域所涉常规的提取分离方法制备而得,其步骤如下:晾干粉碎的澜沧黄杉枝叶用甲醇/水溶液室温浸泡提取,提取液减压浓缩回收溶剂,合并后得浸膏;浸膏用水分散后依次用石油醚、乙酸乙酯和正丁醇萃取,得石油醚部位、乙酸乙酯部位、正丁醇部位和水溶性部位;乙酸乙酯部位经硅胶、微孔树脂(mci)、sephadex lh-20及反相半制备高效液相(semi-preparative rp-hplc)反复分离纯化,得化合物1~3。
[0023]
上述方法中,所述的甲醇/水溶液可以为70%以上的甲醇-水溶液(v/v),优选90%的甲醇-水溶液(v/v);室温提取的时间没有特殊限制,可以为12小时/次以上;提取次数可以进行一次或多次,优选3次以上,例如3~8次;进一步优选提取7次。
[0024]
可选的,所述乙酸乙酯提取液减压浓缩后经硅胶柱色谱并以体积比30:1
→
0:1的石油醚-乙酸乙酯梯度洗脱,收集洗脱液得8个组分fr.1~fr.8;
[0025]
对体积比8:1石油醚-乙酸乙酯洗脱组分fr.4进行mci柱色谱进行分离,并以体积比70:30
→
80:20
→
90:10
→
100:0的meoh-h2o梯度洗脱,根据流动相条件以及tlc点板显色合并后分为3个亚组分fr.4a~fr.4c;
[0026]
对体积比80:20meoh-h2o洗脱组分fr.4a进行100~200目硅胶柱层析并以体积比10:1
→
0:1石油醚-乙酸乙酯梯度洗脱,然后对体积比3:1与2:1石油醚-乙酸乙酯洗脱组分经半制备hplc纯化后得化合物1;
[0027]
对体积比80:20的meoh-h2o洗脱组分fr.4b经半制备hplc分段后得组分fr.4b1(tr=8~14min)和fr.4b2(tr=15~30min),其中fr.4b2为tr=15~30min内收集得到的洗脱液组分,fr.4b2再次经半制备hplc纯化后得到化合物3;
[0028]
对体积比3:1石油醚-乙酸乙酯洗脱组分fr.6经mci柱色谱进行分离,并以体积比70:30
→
80:20
→
90:10
→
100:0的meoh~h2o梯度洗脱,得到5个亚组分fr.6a~fr.6e;对体积比90:10meoh:h2o洗脱组分fr.6d经sephadex lh-20柱层析并用meoh洗脱后再用半制备hplc纯化得到化合物2;
[0029]
可选的,分离化合物1时半制备hplc纯化的条件为:x-bridge,流动相:meoh-h2o;95:5;v/v;流速:3ml/min;柱温:25℃,于205nm波长下检测。
[0030]
可选的,分离化合物2时半制备hplc纯化的条件为:x-bridge,流动相:meoh-h2o,85:15,v/v;流速:3ml/min;柱温:25℃,于205nm波长下检测。
[0031]
可选的,分离化合物3时半制备hplc纯化的条件为:x-bridge,流动相:meoh-h2o,98:2,v/v;流速:3ml/min;柱温:25℃,于205nm波长下检测。
[0032]
本技术的两种类型加合物在acc1抑制活性实验中,显示出较强的抑制作用,且活性与阳性对照nd630相当。
[0033]
本发明具有如下显著优点:
[0034]
所述化合物均为首次从自然界分离得到的新颖化合物,是具有独特环化结构的diels-alder[4+2]-型加合物(重排螺环羊毛脂烷型三萜或常规羊毛脂烷型三萜为亲双烯体,松香烷二萜为二烯);同时首次发现该类化合物具有显著的acc1抑制活性。这对现代人群中高发的糖脂代谢紊乱相关疾病如高脂血症、非酒精性脂肪肝炎、ii型糖尿病等疾病将具有重要应用前景。
附图说明
[0035]
图1为化合物1的hr-esims图;
[0036]
图2为化合物2的hr-esims图;
[0037]
图3为化合物3的hr-esims图。
具体实施方式
[0038]
下面将结合实施例对本技术的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本技术一部分实施例,而不是全部的实施例。基于本技术中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本技术保护的范围。
[0039]
除非另有定义,本文所使用的所有的技术和科学术语与属于本技术的技术领域的
技术人员通常理解的含义相同。本文中在本技术的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本技术。
[0040]
澜沧黄杉(pseudotsuga forrestii craib)属于松科黄杉属(pseudotsuga)植物,本技术保护性地采集少许澜沧黄杉植物样品(如可再生枝叶)进行系统的化学成分研究,提取其活性物质并研发其在制药中的新用途。本技术首次从澜沧黄杉枝叶的甲醇提取物中分离得到一系列具有新颖结构的不同萜类分子间(重排螺环羊毛脂烷型三萜或常规羊毛脂烷型三萜与松香烷二萜)通过diels-alder加成方式得到的加合物(结构如式1~式3所示)。经多次药理试验研究表明,该类化合物具有显著的acc1抑制活性。
[0041]
获得所述化合物的其中一种途径:晾干粉碎的澜沧黄杉枝叶用甲醇/水溶液室温浸泡提取,提取液减压浓缩回收溶剂,合并后得浸膏。浸膏用水分散后依次用石油醚、乙酸乙酯和正丁醇萃取,得石油醚部位、乙酸乙酯部位、正丁醇部位和水溶性部位。乙酸乙酯部位经硅胶、微孔树脂(mci)、sephadex lh-20及反相半制备高效液相(semi-preparative rp-hplc)反复分离纯化,得化合物1-3。
[0042][0043]
澜沧黄杉(pseudotsuga forrestii craib)枝叶采自云南大理,经阴干后粉碎制成粉末;比旋光测试通过rudolf autopol iv旋光仪于25℃下完成;hitachi u-2900e型紫外光谱仪;thermo scientific nicolet is5 ft-ir型红外光谱仪;ecd光谱由jasco-810cd光谱仪测定;单晶衍射实验所用仪器为bruker d8 venture衍射仪(镓靶);esi-ms由agilent 1100型lc-ms仪测定,hr-esims由ab sciex tripletof 5600型仪测定;所使用的硅胶为青岛海洋化工公司生产;硅胶薄层板为烟台江友硅胶开发有限公司生产,规格为gf254/0.25mm;mci gel chp20p为日本三菱公司生产,规格为75-150μm;sephadex lh-20凝胶为瑞士ge healthcare bio-sciences公司生产;半制备hplc为shimadzu lc-20at,配备spd-m20a pda检测器以及waters xbridge ods和cosmosil半制备柱(250
×
10mm,5μm);所有分析纯试剂均为上海国药集团化学试剂有限公司生产;色谱级溶剂由上海星可高纯溶剂有限公司生产;氘代试剂为sigma-aldrich生产。
[0044]
以下以具体实施例进行详细说明:
[0045]
实施例1化合物的制备
[0046]
(1)将采集自云南大理的澜沧黄杉枝叶(2019年6月采集,干重15kg)干燥粉碎后,室温下使用90%甲醇(6l)溶液提取7次,每次24小时。提取液合并,减压浓缩除去甲醇后得到浸膏3.9kg(semi-dry)。用水3l分散浸膏,依次使用等体积的石油醚、乙酸乙酯以及正丁醇各萃取三次,各萃取液经减压浓缩后分别得到石油醚部分、乙酸乙酯部分、正丁醇部分和水4个组分。其中,乙酸乙酯部分粗浸膏经硅胶柱色谱(以石油醚-乙酸乙酯梯度洗,30:1
→
0:1,v/v)分离后得到8个组分,fr.1~fr.8。
[0047]
(2)选择将步骤(1)中的组分fr.4(35g,步骤(1)中经石油醚:乙酸乙酯8:1洗脱得到)经mci柱色谱进行分离,以meoh-h2o梯度洗脱(70:30
→
80:20
→
90:10
→
100:0,v/v)后根据流动相条件以及tlc点板显色得到3个亚组分fr.4a~fr.4c。fr.4a(6.6g,经meoh:h2o-80:20洗脱得到)经硅胶(100
–
200目,以石油醚-乙酸乙酯梯度洗,10:1
→
0:1,v/v)柱层析,合并体积比3:1与2:1石油醚-乙酸乙酯洗脱组分经半制备hplc(x-bridge,流动相:meoh-h2o,95:5,v/v;流速:3ml/min;柱温:25℃,于205nm波长下检测)纯化后得化合物1(70.0mg,tr=30.1min)。
[0048]
fr.4b(2g,经meoh:h2o-80:20洗脱得到)经半制备hplc分段(x-bridge,流动相:meoh-h2o,95:5,v/v;流速:3ml/min;柱温:25℃,于205nm波长下检测)后得组分fr.4b1(tr=8~14min)和fr.4b2(tr=15~30min),fr.4b2再次经半制备hplc以色谱条件(x-bridge,流动相:meoh-h2o,85:15,v/v;流速:3ml/min;柱温:25℃,于205nm波长下检测)纯化后得到化合物3(4.5mg,tr=34.0min)。
[0049]
(3)选择将步骤(1)中的组分fr.6(22g,步骤(1)中经石油醚:乙酸乙酯3:1洗脱得到)经mci柱色谱进行分离,以meoh-h2o梯度洗脱(70:30
→
80:20
→
90:10
→
100:0,v/v)得到5个亚组分fr.6a~fr.6e。fr.6d(1.6g,经meoh:h2o-90:10洗脱得到)经sephadex lh-20(meoh)柱层析后用半制备hplc(x-bridge,流动相:meoh-h2o,98:2,v/v;流速:3ml/min;柱温:25℃,于205nm波长下检测)纯化得到化合物2(9.8mg,tr=17.7min)。
[0050]
化合物1的hr-esims图如图1所示,其核磁及理化数据如下:
[0051]
针状单晶(chcl3),(c 0.34,meoh);uv(meoh)λ
max
(logε)206(3.67)nm;ecd(c 7.94
×
10-5
m,mecn)λ
max
(δε)225(-1.20),252(-0.04),281(-0.14),343(+0.05)nm;ir(kbr)v
max 2960,2922,2870,1693,1462,1382,1270,1110,928,878,754,686,569cm-1
;1h-nmr(cdcl3,600mhz):δ1.70(1h,m,h-1a),1.92(1h,m,h-1b),2.49(1h,ddd,j=16.2,7.4,3.2hz,h-2a),2.62(1h,ddd,j=16.2,10.6,7.7hz,h-2b),1.65(1h,br d,j=10.4hz,h-5),1.68(1h,m,h-6a),1.56(1h,m,h-6b),2.02(1h,m,h-7a),2.14(1h,m,h-7b),2.15(1h,m,h-11a),1.95(1h,m,h-11b),2.04(1h,m,h-12a),1.44(1h,m,h-12b),2.42(1h,ddd,j=17.6,10.0,1.8 hz,h-15a),2.34(1h,m,h-15b),1.53(1h,m,h-16a),1.44(1h,m,h-16b),0.83(3h,s,h-18),1.05(3h,s,h-19),2.31(1h,m,h-20),0.77(3h,d,j=6.5 hz,h-21),2.55(1h,dd,j=14.4,2.6 hz,h-22a),2.02(1h,dd,overlapped,h-22b),3.16(1h,d,j=18.5 hz,h-24a),2.23(1h,d,j=18.5 hz,h-24b),2.71(1h,dd,j=14.0,3.4 hz,h-26a),0.82(1h,dd,overlapped,h-26b),1.09(3h,s,h-28),1.12(3h,s,h-29),4.75(1h,br s,h-30a),4.50(1h,br s,h-30b),0.83(1h,m,h-1'a),1.40(1h,m,h-1'b),1.51(1h,m,h-2'a),1.39(1h,m,h-2'b),1.64(1h,m,h-3'a),1.57(1h,m,h-3'b),1.57(1h,br d,j=11.2 hz,h-5'),1.48(1h,m,h-6'a),1.36(1h,m,h-6'b),1.81(1h,m,h-7'a),1.77(1h,m,h-7'b),1.62(1h,dd,overlapped,h-9'),1.74(1h,m,h-11'a),1.11(1h,m,h-11'b),2.47(1h,br s,h-12'),5.32(1h,br s,h-14'),2.31(1h,m,h-15'),1.01(3h,d,j=6.5 hz,h-16’),1.00(3h,d,j=6.5 hz,h-17’),1.15(3h,s,h-19’),0.60(3h,s,h-20');
13
c-nmr(cdcl3,150mhz):δ35.6(c-1),34.5(c-2),218.0(c-3),47.2(c-4),51.0(c-5),20.6(c-6),26.3(c-7),136.1(c-8),147.8(c-9),35.9(c-10),26.7(c-11),32.8(c-12),68.1(c-13),155.8(c-14),27.3(c-15),37.8(c-16),49.3(c-17),18.6(c-18),18.5(c-19),35.2(c-20),16.1(c-21),44.9
(c-22),210.4(c-23),51.5(c-24),53.3(c-25),39.4(c-26),180.5(c-27),26.6(c-28),21.1(c-29),104.1(c-30),38.0(c-1'),17.1(c-2'),37.2(c-3'),46.5(c-4'),48.6(c-5'),22.0(c-6'),31.2(c-7'),43.4(c-8'),49.9(c-9'),37.8(c-10'),26.6(c-11'),33.1(c-12'),150.5(c-13'),124.3(c-14'),32.6(c-15'),20.3(c-16'),20.5(c-17'),184.3(c-18'),16.7(c-19'),16.6(c-20');esims m/z 769[m+h]
+
;hresims m/z 769.5415[m+h]
+
(calcd for c
50h73
o6,769.5402,δ=+1.7ppm).
[0052]
化合物2的hr-esims图如图2所示,其核磁及理化数据如下:
[0053]
white powder,(c 0.50,meoh);uv(meoh)λ
max
(logε)206(3.59)nm;ecd(c 7.27
×
10-5
m,mecn)λ
max
(δε)192(+7.68),225(-1.63),253(-0.05),283(-0.34)nm;ir(kbr)v
max 2935,2873,1691,1467,1382,1372,1272,1207,1187,1025,913,883,731cm-1
;1h-nmr(cdcl3,600mhz):δ1.29(1h,ddd,j=13.0,11.6,4.1hz,h-1a),1.65(1h,m,h-1b),1.72(1h,m,h-2a),1.65(1h,m,h-2b),3.30(1h,dd,j=10.8,4.5hz,h-3),1.09(1h,br d,j=10.8hz,h-5),1.72(1h,m,h-6a),1.51(1h,m,h-6b),1.90(1h,m,h-7a),2.08(1h,m,h-7b),2.10(1h,m,h-11a),1.99(1h,m,h-11b),1.98(1h,m,h-12a),1.37(1h,m,h-12b),2.38(1h,br dd,j=17.7,10.2hz,h-15a),2.30(1h,m,h-15b),1.54(1h,m,h-16a),1.43(1h,m,h-16b),0.82(3h,s,h-18),0.96(3h,s,h-19),2.28(1h,m,h-20),0.76(3h,d,j=6.5hz,h-21),2.59(1h,br d,j=14.3hz,h-22a),1.98(1h,dd,overlapped,h-22b),3.14(1h,d,j=18.4hz,h-24a),2.20(1h,d,j=18.4hz,h-24b),2.68(1h,br d,j=14.0hz,h-26a),0.83(1h,dd,overlapped,h-26b),1.02(3h,s,h-28),0.84(3h,s,h-29),4.73(1h,br s,h-30a),4.50(1h,br s,h-30b),0.83(1h,m,h-1'a),1.39(1h,m,h-1'b),1.54(1h,m,h-2'a),1.40(1h,m,h-2'b),1.61(1h,m,h-3'a),1.60(1h,m,h-3'b),1.58(1h,br d,j=12.0hz,h-5'),1.33(1h,m,h-6'a),1.50(1h,m,h-6'b),1.79(1h,m,h-7'a),1.77(1h,m,h-7'b),1.64(1h,dd,overlapped,h-9'),1.73(1h,m,h-11'a),1.09(1h,br d,j=11.8hz,h-11'b),2.46(1h,br s,h-12'),5.31(1h,br s,h-14'),2.31(1h,m,h-15'),1.01(3h,d,j=6.5hz,h-16’),1.01(3h,d,j=6.5hz,h-17’),1.14(3h,s,h-19’),0.59(3h,s,h-20');
13
c-nmr(cdcl3,150mhz):δ35.4(c-1),27.5(c-2),79.2(c-3),38.7(c-4),50.7(c-5),19.2(c-6),26.7(c-7),134.9(c-8),149.6(c-9),36.0(c-10),26.4(c-11),32.5(c-12),68.1(c-13),155.8(c-14),27.2(c-15),38.0(c-16),49.1(c-17),18.6(c-18),19.2(c-19),35.1(c-20),16.0(c-21),44.7(c-22),210.6(c-23),51.4(c-24),53.3(c-25),39.4(c-26),180.6(c-27),28.0(c-28),15.5(c-29),103.9(c-30),38.0(c-1'),17.1(c-2'),37.2(c-3'),46.5(c-4'),48.6(c-5'),22.0(c-6'),31.2(c-7'),43.4(c-8'),49.8(c-9'),37.8(c-10'),26.5(c-11'),33.1(c-12'),150.4(c-13'),124.3(c-14'),32.6(c-15'),20.3(c-16'),20.5(c-17'),184.2(c-18'),16.7(c-19'),16.7(c-20');hresims m/z 793.5378[m+na]
+
(calcd for c
50h74
o6na,793.5378,δ=+0.1ppm).
[0054]
化合物3的hr-esims图如图3所示,其核磁及理化数据如下:
[0055]
white powder,(c 0.015,meoh);uv(meoh)λ
max
(logε)204(3.98)nm;ecd(c 6.49
×
10-5
m,mecn)λ
max
(δε)193(-4.19),214(+4.20),269(+0.11),298(+0.27)nm;1h-nmr(cdcl3,600mhz):δ1.67(1h,m,h-1a),1.98(1h,m,h-1b),2.40(1h,ddd,j=16.0,6.7,3.2hz,h-2a),2.60(1h,ddd,j=16.0,11.2,7.0hz,h-2b),1.60(1h,dd,overlapped,h-5),
1.66(1h,m,h-6a),1.59(1h,m,h-6b),2.08(2h,m,h-7),1.61(1h,m,h-11a),2.04(1h,m,h-11b),1.74(1h,m,h-12a),1.62(1h,m,h-12b),1.22(1h,m,h-15a),1.64(1h,m,h-15b),1.85(1h,m,h-16a),1.29(1h,m,h-16b),1.47(1h,m,h-17),0.73(3h,s,h-18),1.12(3h,s,h-19),1.95(1h,m,h-20),0.90(3h,d,j=6.5hz,h-21),2.33(1h,br d,j=14.4hz,h-22a),1.98(1h,dd,overlapped,h-22b),2.81(1h,br s,h-24),1.21(3h,s,h-26),1.10(3h,s,h-28),1.07(3h,s,h-29),0.87(3h,s,h-30),0.85(1h,m,h-1'a),1.43(1h,m,h-1'b),1.57(1h,m,h-2'a),1.46(1h,m,h-2'b),1.60(1h,m,h-3'a),1.65(1h,m,h-3'b),1.67(1h,dd,overlapped,h-5'),1.57(1h,m,h-6'a),1.28(1h,m,h-6'b),1.56(1h,m,h-7'a),1.67(1h,m,h-7'b),1.67(1h,dd,overlapped,h-9'),2.19(1h,br dd,j=13.0,10.3hz,h-11'a),1.00(1h,br d,j=13.0hz,,h-11'b),2.71(1h,br s,h-12'),5.38(1h,br s,h-14'),2.34(1h,sep t,j=6.5hz,h-15'),1.04(3h,d,j=6.5hz,h-16’),1.04(3h,d,j=6.5hz,h-17’),1.16(3h,s,h-19’),0.62(3h,s,h-20');
13
c-nmr(cdcl3,150mhz):δ36.0(c-1),34.6(c-2),217.8(c-3),47.4(c-4),51.2(c-5),19.4(c-6),26.3(c-7),135.1(c-8),133.2(c-9),36.9(c-10),21.0(c-11),30.8(c-12),44.5(c-13),50.2(c-14),30.7(c-15),28.4(c-16),50.0(c-17),15.8(c-18),18.7(c-19),34.3(c-20),19.9(c-21),51.5(c-22),213.6(c-23),59.7(c-24),50.3(c-25),17.7(c-26),183.7(c-27),26.1(c-28),21.3(c-29),24.2(c-30),37.9(c-1'),17.1(c-2'),37.0(c-3'),47.0(c-4'),49.0(c-5'),21.9(c-6'),30.8(c-7'),45.8(c-8'),48.1(c-9'),37.6(c-10'),20.9(c-11'),35.2(c-12'),148.6(c-13'),125.7(c-14'),32.3(c-15'),20.2(c-16'),20.2(c-17'),186.3(c-18'),16.2(c-19'),17.3(c-20');hresims m/z 793.5372[m+na]
+
(calcd for c
50h74
o6na,793.5378,δ=-0.7ppm).
[0056]
实施例2化合物的活性测定
[0057]
acc1位于肝和脂肪细胞,是脂肪酸合成的关键酶,需要生物素作为辅酶并依赖于atp提供的能量将乙酰辅酶a羧化后,催化产生丙二酰辅酶a进而调节脂类代谢。该反应伴随着atp的消耗,因此使用adp-glo激酶检测试剂检测atp的变化,以此间接反应化合物对acc1酶的抑制作用。
[0058]
具体表现为:样品临用前溶于dmso配成合适浓度,3倍稀释,7个梯度,三复孔,取1μl样品溶液加入到标准的测活体系(40mm tris,ph 8.0,10mm mgcl2,5mm dtt,atp,coa,柠檬酸钠和acc1),室温孵育0.5小时。之后加入2.5μl试剂盒中的adp-glo室温孵育1小时,将未反应的底物atp消耗掉,并使反应终止。再加入激酶检测试剂,孵育0.5h。将adp转换成atp。之后用envision仪器检测读值。同时该反应设以dmso替代待测化合物的溶剂对照组、阳性对照组和空白对照组,每个样品每个浓度设3个复孔。反应终体积为12.5μl,其数据处理以浓度的对数值对活性百分数作图,然后采用非线性回归算出拟和曲线,利用软件graphpad prism 5公式log(inhibitor)vs.response
‑‑
variable slope计算得到ic
50
值,实验重复三次,结果取三次的平均值。阳性对照为nd630,其ic
50
值为8.12
±
1.49nm。
[0059]
表1.澜沧黄杉中八环五萜类化合物的acc1抑制活性数据
[0060][0061]
所述八环五萜类化合物的acc1抑制活性数据(ic
50
值)见表1。测试结果表明本技术中所述3个化合物均对acc1表现出显著的抑制活性,表明本发明所述化合物可用于制备治疗糖脂代谢紊乱相关疾病的药物或是作为该类药物的先导化合物。
[0062]
综上,该类化合物经多次体外活性测试表明其具有显著的乙酰辅酶a羧化酶1(acetyl-coenzyme a carboxylase 1,acc1)抑制活性,可在制备预防、延缓或治疗由acc1所介导的糖脂代谢紊乱及其他相关疾病药物中应用。本发明亦可为研发糖脂代谢紊乱相关疾病的新型药物提供先导化合物。
[0063]
以上所述实施例仅表达了本技术的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本技术构思的前提下,还可以做出若干变形和改进,这些都属于本技术的保护范围。因此,本技术专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1