一种高效的细胞系基因敲除方法与流程
本发明涉及基因工程,尤其涉及一种高效的细胞系基因敲除方法。
背景技术:
1、crispr/cas9基因编辑技术是第三代基因编辑技术,有着编辑效率高、操作简便、成本低的优势,是当今最主流的基因编辑系统。目前,该技术在模式动物领域的应用规模已经非常庞大,构建流程也基本实现了标准化、规范化,项目的成功率也较高。crispr/cas9基因编辑技术在模式动物领域成功率高的原因主要在于以下两方面:一方面是由于模式动物使用的品系种类很少,操作流程基本一致,加上使用的基本都是近交品系(如c57bl/6和balb/c),遗传背景高度一致,基因编辑难度相对较低;另一方面,模式动物作为独立个体,对其进行基因敲除时,可以不用“一步到位”,即不需要一次编辑就获得纯合子,只需要获得带有敲除基因型的杂合f0,再通过与wt(野生型)杂交后自交就可以筛选到纯合个体。
2、相对于模式动物领域,细胞系基因敲除则复杂得多,常用细胞系有上百种,不同细胞系特性差异较大,需要摸索最佳实验方法和积累参数,其中单克隆形成能力和制备方法尤为重要,是细胞基因敲除的技术瓶颈;另外细胞的核型也是影响成功率的关键因素,细胞系不能像小鼠一样先拿到杂合再交配,必须一次性筛到纯合,因此如果核型复杂(比如超三倍体)的细胞,基因编辑获得纯合的难度更大。
3、现有技术在进行细胞系基因敲除时,存在以下几个问题:
4、(1)基因敲除效率较低,通常需要培养和鉴定上百个单克隆才能筛到纯合子;
5、(2)基因型鉴定可实施时间太晚,因为现有方法需要较多的细胞数量用于提取基因组,导致单克隆细胞需要从96孔传代至48/24孔再传代至6孔,方可获得足够的细胞,导致周期长、效率低和工作量大。
6、(3)基因型鉴定策略有局限性,移码的dna碱基变换(通常<10bp),需要通过测序来进行初筛,样本量大,测序成本高,看测序结果费时费力。
技术实现思路
1、针对背景技术提出的问题,本发明的目的在于提出一种高效的细胞系基因敲除方法,具有基因敲除效率高、周期短、测序费用低和读取测序结果简单的作用,解决了现有技术在进行细胞系基因敲除时,存在的基因敲除效率较低、周期长、测序成本高和看测序结果费时费力的问题。
2、为达此目的,本发明采用以下技术方案:
3、一种高效的细胞系基因敲除方法,包括以下步骤:
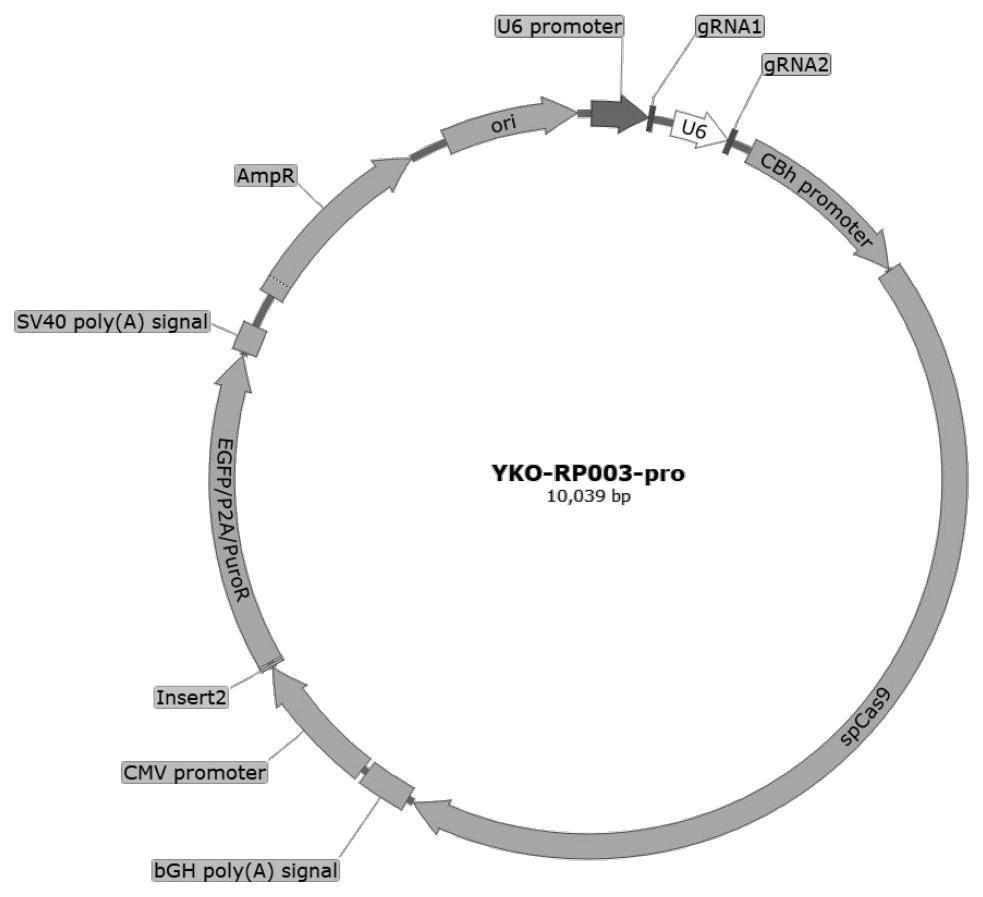
4、(1)载体构建与质粒制备:载体构建与质粒制备依次包括grna引物合成、pcr扩增、骨架线性化、载体拼接反应、热激转化、菌落pcr鉴定和测序鉴定、质粒提取和测序、质粒大提八个步骤,制得敲除质粒;所述敲除质粒采用yko-rp003作为载体骨架,删除载体骨架中如seq id no:1所示的序列;在载体骨架的cmv启动子和标签之间加入insert序列,所述insert序列为:tctgtttaactaga;将双grna装在同一载体骨架,得到敲除质粒;
5、(2)细胞转染与药筛:将敲除质粒递送到待敲除细胞内进行转染,转染完成后进行药筛;
6、(3)pool基因编辑效率检测:使用单克隆鉴定试剂盒对步骤(2)收取的pool细胞进行裂解,裂解产物进行pcr扩增和测序,测序结果通过红棉基因型分析系统进行分析,获得pool细胞切割效率数值、pool细胞中包含的基因型以及各基因型的占比;
7、(4)制备单克隆:将药筛后的细胞制成单细胞悬液,接种至多孔板中,加入培养液,将细胞放入培养箱中静置培养;在培养过程中进行观察,标记并计数含有单克隆的孔以及成功存活的单克隆;
8、(5)单克隆基因型鉴定:使用单克隆鉴定试剂盒对步骤(4)得到的单克隆进行裂解,裂解产物进行pcr扩增,对扩增产物进行电泳检测,根据电泳条带进行初筛,将初筛阳性的克隆进行测序,测序结果通过红棉基因型分析系统进行分析,判断基因型是否符合敲除标准。
9、进一步的,所述高效的细胞系基因敲除方法在步骤(1)载体构建与质粒制备之前,还包括项目难度评估步骤,所述项目难度评估步骤包括基因评估(基因评估包括基因致死性评估和基因表达量评估)、基因打靶方案设计和细胞预实验与难度评估。
10、进一步的,结合红棉基因风险评估系统和表达量评估系统,确定待敲除基因是否具有致死风险及在目的细胞系中表达情况,若评估通过,则正常进行方案设计;
11、所述基因打靶方案设计的方法如下:在红棉crispr基因编辑系统进行敲除方案设计,筛选出敲除片段大小为50~500bp的grna;
12、所述细胞预实验与难度评估为通过进行预实验,了解待敲除细胞的倍增时间、传代比例、最佳转染方法、转染效率、药物耐受情况、药物筛选浓度、单克隆增殖能力以及最佳铺板梯度;当转染效率和单克隆增殖能力符合要求时,则项目可以正常进行,否则需要更换细胞或调整目标产物。
13、进一步的,在所述步骤(1)中,grna引物合成的方法如下:靶序列的第一个碱基为g,在靶序列头部添加额外的碱基,正向引物头部添加cacc,反向引物头部添加aaac,得到引物f和引物r;
14、pcr扩增为对引物f和引物r进行扩增,得到双grna扩增片段。
15、进一步的,在所述步骤(1)中,骨架线性化的操作流程如下:将配置好的骨架线性化体系放入恒温金属浴进行酶切,酶切完全后加入上样缓冲液,进行电泳,切胶回收,得到线性化骨架yko-rp003;其中,所述骨架线性化体系包括骨架质粒4μg、酶1.5~3.0μl、反应缓冲液5μl、ddh2o补充至50μl;
16、所述载体拼接反应的操作流程如下:从-20℃冰箱取出hifi dnaassembly cloning kit试剂置冰上溶解待用;采用双grna扩增片段、线性化骨架yko-rp003、hifi dna assembly cloning kit试剂和ddh2o配制载体拼接反应体系;将载体拼接反应体系置于pcr仪中,于50℃反应1h,得到拼接产物。
17、进一步的,在所述步骤(1)中,所述热激转化的操作流程如下:将感受态细胞进行解冻,解冻完成后,将拼接产物加入到感受态细胞中,冰浴30min;冰浴完成后置于42℃的水浴锅中,热激60s;热激后冰浴2min;加入350μl soc,放于恒温摇床37℃、250rpm培养1h;取上述得到的菌液进行涂板,平板放置37℃生化培养箱中倒置培养,得到转化后的感受态细胞;
18、菌落pcr鉴定和测序鉴定步骤的操作流程如下:取2x taq master mix插入冰面中冻融,取引物在室温溶解;在超净台中,向pcr 8联管加入50μl lb培养基,用镊子夹取10μl枪头,挑取转化后的感受态细胞中的单菌落;配制菌落pcr鉴定反应体系以及设置菌落pcr鉴定反应程序后,置于pcr仪进行反应,pcr产物进行电泳,得到含目的质粒的阳性菌液。
19、进一步的,在所述步骤(1)中,质粒提取和测序的操作流程如下:在培养基中接种5ml上述制得的含目的质粒的阳性菌液,37℃摇菌过夜培养;使用天根dp103-3质粒小提试剂盒提取质粒;用jp-ori-f进行测序,序列结果与理论序列相符即合格;
20、质粒大提的操作流程如下:在培养基中接种5ml菌液,37℃培养6~8h;吸取200μl上述菌液接种于含200ml lb培养基的锥形瓶中,37℃,过夜培养;使用大提试剂盒,根据说明书进行质粒大提操作,得到敲除质粒。
21、进一步的,在所述步骤(4)制备单克隆的操作流程如下:
22、(4.1)将步骤(3)得到的细胞制成单细胞悬液,根据预实验所得的最佳单克隆接种量稀释细胞悬液,倒入加样槽中,使用多道移液器接种至96孔板中间的60个孔,每孔培养液总体积为100μl,最外一圈使用150μl培养基进行液封,细胞放入培养箱中静置培养;
23、(4.2)培养7天后,观察细胞是否有增殖趋势并且形成细胞簇,标记含有单克隆的孔,随后每2~3天继续观察,标记成功存活的单克隆;
24、(4.3)继续培养,根据细胞增殖情况,每7~10天进行一次半换液,直至96孔板内的细胞汇合度达到20~25%;
25、(4.4)吸出每个含单克隆的孔的培养基,加入100μl pbs润洗后吸出,再加入20μltrypletmexpress将细胞消化成单细胞悬液,随后加入200μl完全培养基,吹打混匀后平均分到2块96孔板的孔,使其位置一一对应;
26、(4.5)继续培养,直至一分为二的单克隆增殖至25%汇合度以上,选择一块板送检初筛,设需要一分为二送检克隆的数量为x,x=所需纯合克隆数量/(pool有效基因型占比^该细胞染色体核型最高拷贝数×该细胞复检通过率)。
27、进一步的,在所述步骤(3)和所述步骤(5)中,使用的单克隆鉴定试剂盒选自源井生物、货号为yk-mv-1000的单克隆鉴定试剂盒。
28、进一步的,所述高效的细胞系基因敲除方法适用于对可无限传代的哺乳动物的细胞系进行基因敲除,可无限传代的哺乳动物的细胞系包括肿瘤细胞系、永生化细胞系和干细胞。
29、上述技术方案具有以下有益效果:本技术方案在步骤(1)中通过优化载体骨架,更容易实现转染和更利于筛选阳性克隆,以及能够显著提高片段敲除的效率,减少单克隆培养和鉴定的数量;在步骤(3)中,通过对pool细胞的编辑效率进行有效分析,精准定量,根据不同编辑效率确定需要进行培养和鉴定的单克隆数量,能够节省人力物力,降低成本,减少物料浪费;在步骤(5)中优化基因型鉴定方案,通过pcr凝胶电泳进行阳性克隆初筛,减少测序费用和读取测序结果的精力;同时本技术方案通过各步骤的优化措施,能够缩短项目周期,将基因型鉴定的时间提前2~3周,缩短项目周期,提前筛选阳性克隆,减少非必要的阴性克隆培养和传代工作。因此,采用本技术方案的细胞系基因敲除方法解决了现有技术在进行细胞系基因敲除时,存在的基因敲除效率较低、周期长、测序成本高和看测序结果费时费力的问题。
- 还没有人留言评论。精彩留言会获得点赞!