多苯乙烯取代吡啶化合物作为G-四链体核酸荧光探针的制作方法
本发明涉及一种荧光探针及其制备方法,以及其在水溶液中、凝胶中和细胞中检测核酸G-四链体二级结构的用途。
背景技术:
核酸不但是一切生物细胞的基本成分,还对生物体的生长、发育、繁殖、遗传及变异等重大生命现象起主宰作用。核酸大分子分为两类:脱氧核糖核酸(DNA)和核糖核酸(RNA),在蛋白质的复制和合成中起着储存和传递遗传信息的作用。
G-四链体(G-quadruplex)是一种特殊的核酸二级结构。人类基因组中很多富鸟嘌呤区域具有形成这一结构的能力,包括端粒末端鸟嘌呤重复序列,以及多种基因的启动子区域,如c-kit、c-myc、c-myb、bcl-2、PDGF、kRAS、VEGF、Rb和胰岛素基因等。G-四链体结构具有多态性,链的数量和取向、loop的连接方式以及鸟嘌呤的糖苷扭转角以及与羰基负电中心配位的金属离子等多方面决定了G-四链体的类型和构象,这些差异性也为蛋白和小分子化合物提供了多个识别位点。根据链的取向不同,G-四链体分为正平行,反平行与混合型三种构象。
G-四链体结构的形成对于体内的一系列生理过程都存在调控作用。研究证明,某些启动子区域的G-四链体结构会显著影响基因的转录和翻译水平,因此G-四链体结构被认为是起到分子开关的功能,其形成和拆散可能涉及到信号传导、细胞凋亡和细胞增殖等一系列体内重要的生理过程。所以,在体内或者体外试验中,能够特异性地检测出G-四链体结构的存在或者形成,对于研究G-四链体结构的相关生物学功能以及开发以G-四链体结构为靶点的抗癌药物等方面都具有非常重要的作用。
随着生物技术的发展,对于核酸标记的要求越来越高,以往通过同位素效应来进行DNA分子测序的方法已经无法满足需求,而荧光标记作为一种具有检测速度快、重复性好、用样量少、无辐射等优点的标记技术受到广泛重视,并取得迅速发展。最近Feng课题研究组利用2,6-二甲基吡啶作为原料合成出了吡啶二乙烯衍生物C61,选择性地在活细胞核染色,使细胞核发出绿色荧光,是优良的活细胞DNA荧光探针。但是,C61不能从其他形式的核酸分子中有效地识别G-四链体二级结构,因而选择性较差限制了C61的应用。为了改良TO的选择性,我们设计得到了一类结构新颖的,且对核酸G-四链体结构专一性强的的荧光探针。
技术实现要素:
本发明的目的在于针对现有技术的不足,提供一种荧光探针。
本发明的另一个目的在于提供上述探针的制备方法。
本发明的再一个目的在于提供上述探针在检测水溶液中、凝胶中和细胞中G-四链体结构的应用。
本发明通过以下技术方案实现上述目的:
本发明提供了一种荧光探针,其结构式为下式I所示:
式中R1选自-----H、
本发明同时提供了上述探针的制备方法,表示如下:
或者
具体步骤为:
先用环丁砜、碘甲烷反应,得到化合物(或);再将在正丁醇中,与4-甲基哌啶,不同侧链反应,得到对应产物最终产物
本发明还提供了上述探针在检测水溶液中、凝胶中和细胞中G-四链体结构的应用。
本发明提供的探针由于具有较大的电子共轭体系和平面,探针分子内的电荷转移效应的强弱可以影响分子的荧光发射强度。当与G-四链体结构发生特异性的作用后,分子内的可转动的双键的柔性受到限制,使分子内电荷转移效应增强,荧光也有明显增强。同时,该类探针的分子结构的柔性的共轭平面,具有可以转动的键,使其可以比较容易堆积在G四分体的平面上,进而与G-四链体具有较强的作用力,同时与其他二级结构的核酸作用较弱。所以,将该探针与不同二级结构的核酸混合时,如果该核酸是G-四链体结构时,其与探针分子间的特异性作用,产生荧光光谱的改变。当核酸的二级结构为其他结构时,则不会产生明显的信号变化。
与现有技术相比,本发明具有以下优点:
(1)该类探针制备简单,易得,并且结构稳定,便于储存。
(2)本发明提供的探针具有较低的生物毒性、光毒性和光漂白性,且光稳定性佳。
(3)本发明提供的探针具有良好的水溶性和良好的细胞膜通透性。
(4)本发明提供的探针的光谱范围与生物样品的光谱范围有足够大的差异,在非G-四链体存在的溶液及细胞内具有较低的荧光背景。
(5)本发明提供的探针可以特异性地检测识别G-四链体结构,实现了G-四链体结
构与其他二级结构的区分,用简单的荧光光谱仪,甚至只需普通紫外灯照射下,肉眼观察就可以识别出核酸样品的二级结构,快捷,操作简便,成本低廉,并且可以实现实地检测。
附图说明
图1为探针3c与random,4A4T,LQ1,telo2四种核酸在1∶1浓度下的荧光谱。
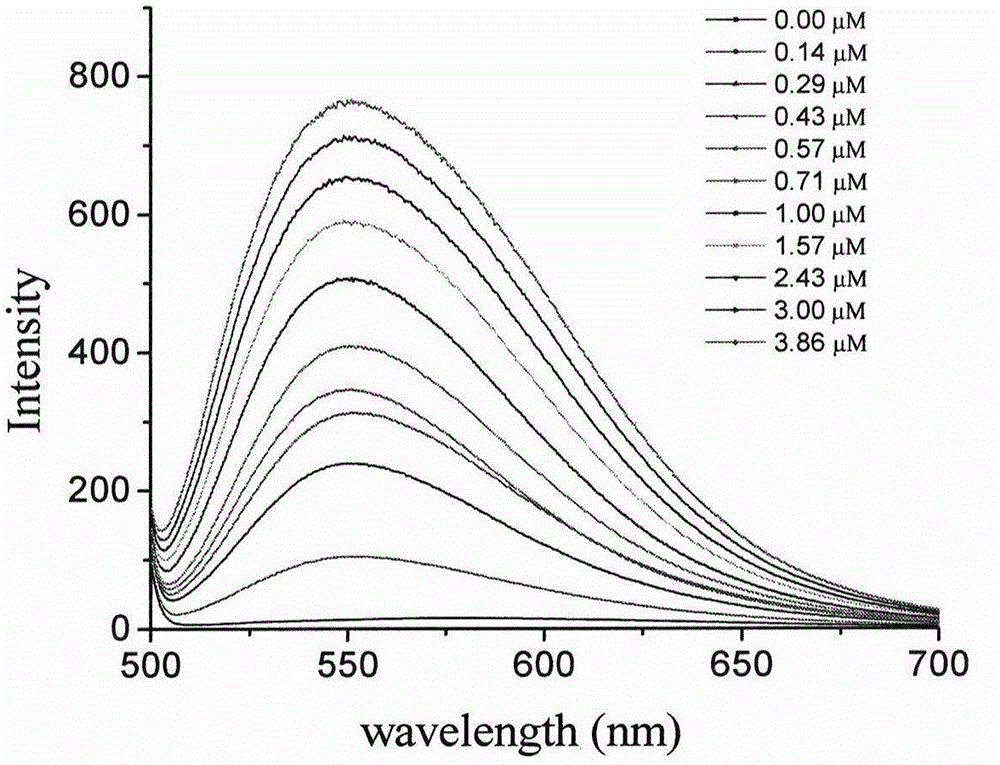
图2为探针3c滴定G-四链体DNA(telo21)的荧光光谱。
图3为探针3c滴定G-四链体DNA(telo21)的荧光光谱中DNA浓度c与(F-F0)/F0的拟合曲线。
图4为探针3c浸染双链DNA(ds26)和G-四链体DNA(telo21)的聚丙酰胺凝胶电泳图。
图5为探针3c和染料DAPI染PC3细胞的细胞成像图。
具体实施方式
以下通过具体的实施例进一步说明本发明的技术方案。通过荧光光谱实验证明,本发明涉及的化合物6a由于具有较大的电子共轭体系和平面,与G-四链体结构发生特异性的堆积作用后,荧光光谱发生明显变化,荧光强度增加,甚至只需普通紫外灯照射下,肉眼观察,同时与其他二级结构的核酸作用较弱,没有明显的荧光信号响应,使该类探针具有很好的特异性识别作用。所以,我们将该探针与不同二级结构的DNA混合时,当该DNA为G-四链体结构时,其与探针分子间的特异性作用,产生荧光光谱的改变。当DNA的二级结构为其他结构时,则不会产生明显的信号变化。以其中化合物3c为例来说明本发明的荧光探针在荧光法(包括荧光显微镜和荧光凝胶成像仪)检测水溶液中、凝胶中和细胞中G-四链体核酸二级结构的应用。
实施例一:化合物3c的合成
在通风橱用天平分别称取2,6-二甲基吡啶1.10g、环丁砜5.00g、碘甲烷2.50g,置于50mL圆底烧瓶并加入搅拌子,50℃油浴,开启磁力搅拌。反应体系无明显变化,无回流。4h后停止反应,圆底烧瓶内有白色固体。冷却至室温后,加入15mL乙酸乙酯,有白色固体析出。继续磁力搅拌0.5h,抽滤,滤渣用乙酸乙酯淋洗。干燥后称重,得1,2,6-三甲基吡啶鎓碘盐M-DP 2.44g,产率95.31%。产品为白色固体颗粒。然后分别称取M-DP 0.51g、吲哚-3-甲醛ID 1.00g,正丁醇15mL、4-甲基哌啶15滴,先后置于50mL圆底烧瓶,120℃油浴,开启冷凝水和磁力搅拌,。随着体系温度升高,固体开始溶解,体系颜色由无色向棕红色变化并逐渐加深。体系轻微回流。1.5h后停止反应,圆底烧瓶内固液相共存,液相呈现棕红色,固相呈现暗红色。冷却至室温后,冰浴降温析出固体,趁冷抽滤,滤渣用正丁醇淋洗。干燥滤渣后称重,得0.75g化合物3c。产率72.82%。产品为棕红色细粉固体颗粒。总产率:69.4%。1HNMR(300MHz,DMSO-d6)δ(ppm):11.92(s,2H),8.24(t,J=12.0Hz,1H),8.10(m,J=18.0Hz,6H),8.03(d,J=12.0Hz,2H),7.52(m,J=8.0Hz,2H),7.33(d,J=12.0Hz,2H),7.24(m,J=18.0Hz,4H),4.27(s,3H)。
实施例二:化合物6a的合成
在通风橱分别称取2,4,6-三甲基吡啶1.10g、环丁砜5.00g、碘甲烷2.20g,置于50mL 圆底烧瓶并加入搅拌子,放入70℃油浴,开启冷凝水与磁力搅拌。2h后反应停止,圆底烧瓶内有白色固体,溶液呈淡黄绿色。冷却至室温后,往烧瓶内加入15mL乙酸乙酯,有白色固体析出。磁力搅拌0.5h,抽滤,滤渣用适量乙酸乙酯淋洗。干燥滤渣后称重,得1,2,4,6-四甲基吡啶鎓碘盐M-TP 2.25g。产率85.50%。然后分别称取M-TP 0.54g、4-甲硫基苯甲醛1.66g、正丁醇15mL、4-甲基哌啶15滴,先后置于50mL圆底烧瓶,95℃油浴,开启冷凝水和磁力搅拌。随着温度升高,固体开始溶解,体系颜色由淡黄绿色变为橙红色。随着反应的进行红色逐渐加深。1.5h后停止反应,圆底烧瓶内固液相共存,液相呈现酒红色,固相呈现橙红色。将圆底烧瓶移出加热装置,冷却至室温后,抽滤,滤渣用正丁醇淋洗。干燥滤渣后称重,得化合物6a 1.31g。产率97.31%。产品为橙红色细粉固体颗粒。总产率83.2%。1HNMR(300MHz,DMSO-d6)δ(ppm):8.36(s,2H),8.08(p,J=9Hz,2H),7.83~7.60(m,J=69Hz,12H),7.46~7.37(m,J=27Hz,6H),2.55(s,9H)。
实施例三:化合物6b的合成
在通风橱分别称取2,4,6-三甲基吡啶1.10g、环丁砜5.00g、碘甲烷2.20g,置于50mL圆底烧瓶并加入搅拌子,放入70℃油浴,开启冷凝水与磁力搅拌。2h后反应停止,圆底烧瓶内有白色固体,溶液呈淡黄绿色。冷却至室温后,往烧瓶内加入15mL乙酸乙酯,有白色固体析出。磁力搅拌0.5h,抽滤,滤渣用适量乙酸乙酯淋洗。干燥滤渣后称重,得1,2,4,6-四甲基吡啶鎓碘盐M-TP 2.25g。产率85.50%。然后分别称取M-TP 0.54g、吲哚-3-甲醛1.45g,正丁醇15mL、4-甲基哌啶15滴,先后置于50mL圆底烧瓶,110℃油浴,开启冷凝水和磁力搅拌。随着温度升高,固体开始溶解,体系颜色由无色向棕红色变化并逐渐加深。1.5h后停止反应,圆底烧瓶内固液相共存,液相呈现棕红色,固相呈现暗红色。冷却至室温后,大量固体析出,用正丁醇淋洗。干燥滤渣后称重,得化合物6c,1-甲基-2,4,6-三(吲哚-3-乙烯)吡啶0.85g。产率65.38%。产品为棕红色细粉固体颗粒。总产率:55.93%.1HNMR(300MHz,DMSO-d6)δ(ppm):11.86(s,3H),8.23(s,2H),8.30~7.91(m,9H),7.52(d,J=6Hz,4H),7.33~7.19(m,J=42Hz,8H),4.16(s,3H)。
实施例四:化合物6b的核酸选择性
DNA配置:DNA样品购自英骏生物技术有限公司。将DNA适量溶于Tris-HCl的缓冲液中(pH 7.4,100mM Tris,60mM KCl)或者Tris-醋酸缓冲中(pH 5.5,100mM Tris,60mM KCl),超微量紫外定浓,在95℃下加热5min后缓慢冷却退火到室温作为储存液,4℃储存。
将5mM的化合物储备液稀释成5μM的浓度,再加入不同种类的核酸用荧光分光光度计(狭缝宽度=10mm,扫描速度=200,λex=486nm)测出其各自的荧光强度,发现这一系类化 合物与G-四链体DNA结合之后荧光强度最强。
表1 本专利所用DNA种类及序列表
实施例五:检测限的测定
将5mM的化合物储备液稀释成5μM的浓度,再在荧光分光光度计(狭缝宽度=10mm,扫描速度=200,λex=486nm)扫描,再往其中慢慢加入Telo21的DNA做到使其饱和。检测限的计算公式
LOD=K×Sb/m
LOD(化合物的结合常数),m是浓度C与(F-F0)/F0的所做直线的斜率,Sb为用仪器空白多次测量的标准偏差,K值按照国际纯粹和应用化学联合会建议通常取为3。
由此计算出化合物6b对Telo21DNA的检测限为33nM.
实施例六:核酸凝胶电泳实验
配制20%聚丙烯酰胺凝胶,灌制凝胶,待凝胶冷却之后取出梳子和隔板,放入电泳槽中,缓冲液淹没过胶1-2mm为止,DNA浓度为5μM,上样量为15μL,接通电泳仪电源,20V恒压1h,然后100V恒压2h,关闭电源。取出凝胶块,用化合物和SYBR Green I分别浸染,最后用凝胶成像仪成像。
实施例七:细胞成像实验
先将细胞接种于6孔板中,使细胞的密度约为2×103个/mL,然后在37℃、5%CO2培养箱中培养24h。弃去6孔板中的细胞培养液,用预冷的1×PBS洗3次,然后再加入预冷的纯甲醇1.5mL/孔,常温避光放置1min,弃去纯甲醇并再用预冷的1×PBS洗3次,加入1mL/孔5μM的化合物放置15min。弃去上步6孔板中的化合物溶液,用预冷的1×PBS洗3次,在上述6孔板中加入1μM的DAPI溶液1mL/孔,37℃放置2min,然后再用预冷的1×PBS洗6次,每次浸泡5min。在荧光倒置显微镜下观察细胞染色情况。
- 还没有人留言评论。精彩留言会获得点赞!
- 噻唑橙苯乙烯类化合物作为G-四链体核酸荧光探针的制作方法与工艺
- 一种氟原子取代的氰基异佛尔酮苯乙烯化合物、晶体化合物及制备方法与流程
- 一种制备反式二苯基乙烯类化合物的方法与流程
- 一种二苯乙烯和二苯乙烷类化合物的磷酰氨基酸及其衍生物的制备与用途的制造方法与工艺
- 制备具有较少丙烯酸的酰胺化合物的手段和方法与流程
- 酸存在下丙烯酸系化合物的SET‑LRP聚合的制造方法与工艺
- 一种二官能烯基苯氧基化合物及其制备方法和利用其改性的可溶性双马来酰亚胺树脂与流程
- 二苯乙烯型化合物、其中间体、制备方法和应用与流程
- 一种基于四苯乙烯的荧光化合物及其制备方法和应用与制造工艺
- 基于二苯乙烯单元的树枝状化合物及有机电致发光器件的制造方法与工艺