制备具有较少丙烯酸的酰胺化合物的手段和方法与流程
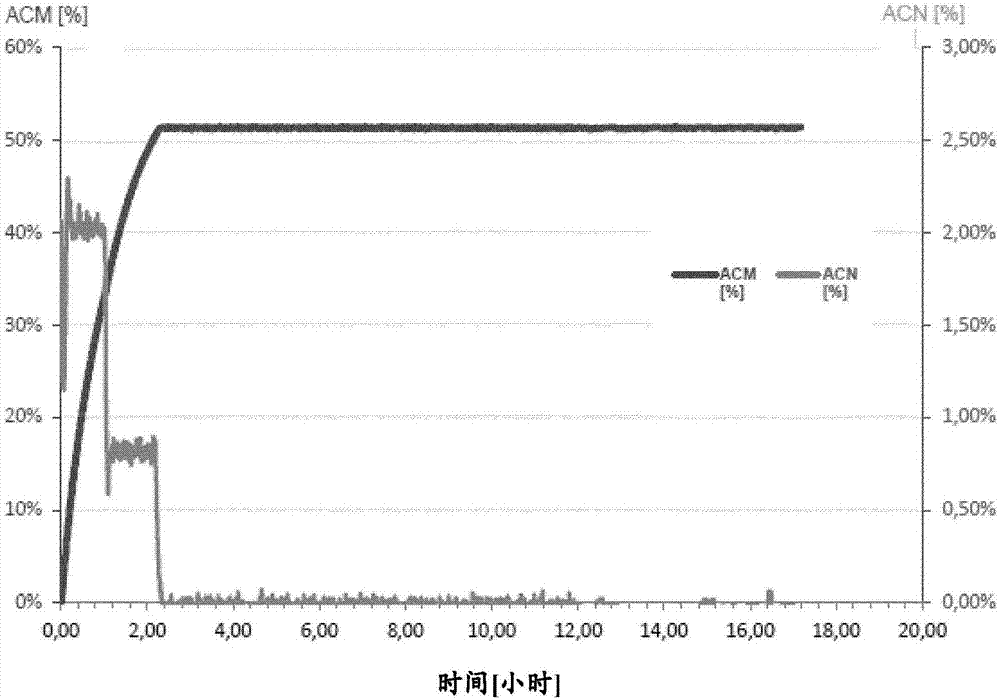
本发明涉及使用产生腈水合酶(nhase)和酰胺酶的微生物作为生物催化剂从腈化合物制备酰胺化合物的方法,所述微生物在与所述腈化合物接触之前通过干燥步骤预处理,并涉及所述微生物用于从腈化合物制备酰胺化合物的用途。此外,本发明涉及当利用产生腈水合酶和酰胺酶的微生物从腈化合物制备酰胺化合物时减少丙烯酸副产物形成的方法,以及干燥方法用于增加所述微生物的腈水合酶/酰胺酶或降低酰胺酶活性的用途。还提供了通过本发明的方法获得的酰胺化合物水溶液,以及包含丙烯酰胺或聚丙烯酰胺和干燥微生物的组合物,所述干燥微生物与腈化合物接触以便将腈化合物转化为酰胺化合物时表现出至少400的腈水合酶/酰胺酶活性比。丙烯酰胺用作单体以形成丙烯酰胺的聚合物和共聚物。对于这些聚合和共聚反应,可以使用通过生物转化制备的丙烯酰胺水溶液。然而,已经发现,丙烯酰胺溶液中的高丙烯酸含量导致所得丙烯酰胺聚合物和共聚物的性能降低。更具体地,丙烯酸的存在可以显著损害丙烯酰胺聚合物和共聚物材料的物理性能,这导致在各种应用如水处理、造纸、油回收或采矿中降低的溶解性和性能。由于发现腈水合酶(nhase),一种将腈水解为酰胺的微生物酶,具有腈水合酶活性的微生物已广泛用于酰胺化合物的工业生产。由于与酰胺的化学合成相比更温和的反应条件,产生腈水合酶的微生物作为生物催化剂的用途越来越多地增加。事实上,通过产生腈水合酶的微生物的腈生物转化的最知名的商业实例之一是从丙烯腈制造丙烯酰胺。然而,在使用产生腈水合酶的微生物作为生物催化剂时,一个具有挑战性的问题是由酰胺酶介导的副反应的发生。当腈水合酶将腈化合物水解成相应的酰胺化合物时,酰胺酶进一步将酰胺化合物转化为相应的羧酸,具体地讲是转化为丙烯酸。本发明的技术问题是解决由于在使用产生腈水合酶和酰胺酶的微生物作为生物催化剂从腈化合物制备酰胺化合物中丙烯酸作为副产物形成所产生的问题。通过提供在权利要求中反映的、在说明书中描述的并且在下面的实施例和附图中阐明的实施方案来解决该技术问题。令人惊讶的是,发明人发现,当产生腈水合酶(nhase)和酰胺酶并且在生物转化中用作生物催化剂的微生物在与腈化合物接触之前通过干燥步骤预处理,则在腈化合物至酰胺化合物的生物转化中,作为副产物的羧酸的产生,具体地讲是丙烯酸的产生大大减少。不受理论的束缚,看起来由于这种微生物所经历的干燥步骤可以降低酰胺酶活性,从而减少由酰胺(该酰胺通过腈水合酶的活性产生)产生的丙烯酸。换句话讲,这种干燥的微生物似乎具有的腈水合酶活性和酰胺酶活性之间的比率更有利于腈水合酶活性,即,腈水合酶活性与酰胺酶活性的比率>1.0,例如至少>10、>50、>100、>200、>300或>400。事实上,如在所附实施例中所证实的,显然在与腈化合物接触之前,通过干燥步骤预处理的微生物具有腈水合酶/酰胺酶活性的最高值,腈化合物随后通过所述微生物进行生物转化。考虑到设置包含几乎相等量的生物催化剂(由“设置中的腈水合酶活性”反映,参见表1和2)的事实,显然干燥步骤,即在生物催化剂与腈化合物接触之前进行干燥步骤,能显著影响副产物丙烯酸的量。这意味着由于干燥步骤,酰胺酶活性降低到这样的程度,即这种干燥的微生物产生具有较少丙烯酸副产物的酰胺化合物,这从最右边的栏中可见。总之,由于在不同设置之间的反应参数保持相同,显然减少丙烯酸的量的改进可以归因于干燥步骤。因此,本发明涉及一种由腈化合物制备酰胺化合物的方法,包括使腈化合物与产生腈水合酶(nhase)和酰胺酶的微生物接触,其中所述微生物在与所述腈化合物接触之前通过干燥步骤预处理。本发明还提供了一种由腈化合物制备酰胺化合物的方法,包含以下步骤:(a)干燥产生腈水合酶和酰胺酶的微生物;和(b)使腈化合物与所述微生物接触。此外,根据本发明的令人惊讶的发现,本文提供了一种当由腈化合物制备酰胺化合物时减少丙烯酸形成的方法,其包含使丙烯腈与产生腈水合酶和酰胺酶的微生物接触,其中所述微生物是如本文所定义的那些。还提供了一种用于产生具有增加的腈水合酶/酰胺酶活性比的微生物的方法,其包含干燥产生腈水合酶和酰胺酶的微生物。同样,本文提供了一种用于产生具有降低的酰胺酶活性的微生物的方法,其包含干燥产生腈水合酶和酰胺酶的微生物。此外,本发明提供了本文所定义的产生腈水合酶和酰胺酶的微生物用于从腈化合物产生酰胺化合物的用途。类似地,本发明提供了干燥方法用于提高产生腈水合酶和酰胺酶的微生物的腈水合酶/酰胺酶活性比的用途,或者替代地或另外地,提供了干燥方法用于降低产生腈水合酶和酰胺酶的微生物的酰胺酶活性的用途。根据发明人的发现,由于该酰胺溶液包含较少的作为腈化合物转化为酰胺化合物的副产物的丙烯酸,本发明提供了通过本发明的方法获得的酰胺化合物水溶液。还根据发明人的发现,本文提供了包含丙烯酰胺或聚丙烯酰胺和产生腈水合酶和酰胺酶的微生物的组合物,所述微生物优选表现出至少400的腈水合酶/酰胺酶活性比。下面将参照几个示例性实施方案详细描述本发明。将阐述许多具体细节以便提供对本发明实施方案的透彻理解。当进一步限定和说明本发明的方法、组合物或用途的单一特征时,这些定义和说明适用于本文所描述和提供的所有的本发明的方法、本发明的组合物和本发明的用途。此外,对于本领域技术人员显而易见的是,可以在没有下面阐述的一些或全部具体细节的情况下实行实施方案。在其他情况下,没有详细描述众所周知的方法步骤,以免不必要地使本发明难以理解。如根据本发明的发现所证实的,产生腈水合酶和酰胺酶的微生物能够将腈化合物转化成酰胺化合物,但是当所述微生物与将要进行生物转化为酰胺化合物的腈化合物接触之前通过干燥步骤预处理时,与其它这类产生腈水合酶和酰胺酶的微生物相比,产生较少的羧酸,具体地讲是丙烯酸。干燥微生物的这种性质是有利的,因为特别是丙烯酸在随后从酰胺到聚丙烯酰胺的聚合反应中引起问题。因此,发明人提供了一种具有低酰胺酶活性的微生物形式的生物催化剂,同时其腈水合酶活性基本上不改变,使得微生物产生具有低的羧酸、特别是丙烯酸的量/浓度的酰胺化合物,这是一项杰出的成就。值得注意的是,发明人在没有用基因工程改造产生腈水合酶和酰胺酶的微生物或使所述微生物经受诱变剂等、或者没有过多筛选这类(偶然的)天然存在的微生物,而是通过深思的观察的情况下达到这一成就,所述的观察是在使所述微生物与腈化合物在其生物转化成酰胺化合物的过程中接触之前,对产生腈水合酶和酰胺酶的微生物进行干燥步骤。因此,本发明提供了一种由腈化合物制备酰胺化合物的方法,其包含使腈化合物与产生腈水合酶(nhase)和酰胺酶的微生物接触,其中所述微生物在与所述腈化合物接触之前通过干燥步骤预处理。另外,本发明提供一种由腈化合物制备酰胺化合物的方法,其包括以下步骤:(a)干燥产生腈水合酶和酰胺酶的微生物;和(b)使腈化合物与所述微生物接触。此外,本发明提供了能够产生腈水合酶和酰胺酶的干燥的微生物,其中腈水合酶和酰胺酶活性之间的比例>1.0,例如至少>10、>50、>100、>200、>300或>400,当与在与应该(生物)转化为酰胺化合物的腈化合物接触之前未被干燥的相同微生物相比时,所述干燥的微生物能够产生具有少得多的丙烯酸副产物的酰胺化合物。术语“在接触之前通过干燥步骤预处理”是指在将微生物用于本发明的任何方法和用途之前,通过用于干燥所述微生物的手段和/或方法处理微生物。具体地讲,微生物在与应该通过所述微生物(生物)转化的腈化合物接触之前被干燥。因此,在本发明的优选微生物与腈化合物接触(或使其接触)之前将其干燥(进行干燥步骤),所述腈化合物应该被所述干燥的微生物(生物)转化成酰胺化合物。优选地,所述干燥步骤导致具有残余水含量的微生物,其残余水含量至多为微生物总质量的30、25、15、14、13、12、11、10、9、8、7、6或5重量百分比(%w/w)。因此,“微生物的总质量”不必限于微生物本身的质量(尽管这当然是可能的,例如当微生物在干燥步骤之前已经用水洗涤时),而是可以进一步包括那些其存在可以归因于微生物的培养和/或洗涤步骤等的成分。所述“微生物的总质量”可以进一步包括(除了微生物以外的)储存缓冲液的组分/盐、例如基于tris的缓冲液、盐水缓冲液等的残余量和/或培养基、生长培养基、营养液、发酵液、例如用于培养微生物等的发酵液、稳定剂、添加剂(例如干燥添加剂)等的残余量。当在本文中使用时,术语“微生物”涵盖“产生腈水合酶和酰胺酶的微生物”或者“产生nhase和酰胺酶的微生物”。在本发明的上下文中的微生物优选是细菌、真菌或酵母。本发明的微生物优选在与腈化合物接触之前通过干燥步骤进行预处理,所述腈化合物通过所述微生物进行生物转化为酰胺化合物。本发明的微生物优选在干燥前不固定化。如本文所用的“固定”是指本领域技术人员已知的任何固定技术,包括但不限于将微生物结合或吸附到支持基质上、将微生物包埋或包封在支持基质中。在本发明中,“产生腈水合酶和酰胺酶的微生物”用作将腈化合物转化成相应的酰胺化合物的生物催化剂。如上所述,这样的微生物优选在与腈化合物接触之前通过干燥步骤预处理,所述腈化合物进行生物转化为酰胺化合物。因此,与在接触将要转化为酰胺化合物的腈化合物之前不被干燥的相同微生物相比,这样的微生物能够产生具有少得多的丙烯酸副产物的酰胺化合物。“腈化合物”由本发明的微生物通过腈水合酶的作用转化为酰胺化合物。腈化合物是任何具有-c≡n官能团的有机化合物。优选的腈化合物是丙烯腈。还包括在本文公开的方法中使用甲基丙烯腈、乙腈或3-氰基吡啶。“酰胺化合物”通过酰胺酶转化为酰胺化合物。酰胺化合物具有官能团rnc(o)xnr'2,,其中r和r'指h或有机基团。对于有机酰胺n=1,x=1。酰胺化合物的实例是丙烯酰胺。本发明的方法包括的酰胺化合物的其它实例是甲基丙烯酰胺、乙酰胺或烟酰胺。在本发明中,“产生腈水合酶和酰胺酶的微生物”可以是能够产生腈水合酶和酰胺酶的任何微生物。在这方面,本发明不关心微生物是否天然编码腈水合酶和酰胺酶或其是否已经被基因修饰以编码所述酶。此外,生物催化剂可以是天然编码腈水合酶和酰胺酶的微生物,并且其进一步被基因工程改造,例如,以增加腈水合酶的产生,或增加腈水合酶的稳定性和/或输出,或降低酰胺酶的产生,或增加酰胺酶的稳定性和/或输出。在本发明的上下文中,非天然编码腈水合酶的“产生腈水合酶和酰胺酶的微生物”可以是基因工程改造的微生物,其天然不含编码腈水合酶的基因,但是已被操作以含有例如编码腈水合酶的多核苷酸(例如,通过转化、转导、转染、接合或本领域已知的适合于将多核苷酸转移或插入细胞中的其它方法;参见sambrook和russell2001,分子克隆:实验室手册(molecularcloning:alaboratorymanual),cshpress,coldspringharbor,ny,usa),从而使得微生物能够产生并稳定保持腈水合酶。为此目的,可能进一步需要插入额外的多核苷酸,其可能是分别允许腈水合酶基因或mrna的转录和翻译所必需的。此类额外的多核苷酸可以尤其包含启动子序列、或复制起点或其他质粒控制序列。在本文中,这种经过基因工程改造的微生物,其天然不含有编码腈水合酶的基因、但已被操作以含有编码腈水合酶的多核苷酸,可以是原核或真核微生物。此类原核微生物的实例包括,例如大肠杆菌(escherichiacoli)物种的代表。此类真核微生物的实例包括,例如酵母(例如,酿酒酵母(saccharomycescerevisiae))。同样,非天然编码酰胺酶的“产生腈水合酶和酰胺酶的微生物”可以是基因工程改造的微生物,其天然不含有编码酰胺酶的基因,但是已被操作以含有编码酰胺酶的多核苷酸(例如,通过转化、转导、转染、接合或适合于将多核苷酸转移或插入细胞中的其它方法;参见sambrook和russell2001,分子克隆:实验室手册(molecularcloning:alaboratorymanual),cshpress,coldspringharbor,ny,usa),从而使微生物能够产生并稳定保持酰胺酶。为此目的,可能进一步需要插入额外的多核苷酸,其可能是分别允许酰胺酶基因或mrna的转录和翻译所必需的。此类额外的多核苷酸可以尤其包含启动子序列、或复制起点或其他质粒控制序列。在本文中,这样的基因工程改造的微生物天然不含有编码酰胺酶的基因,但已被操作以包含编码酰胺酶的多核苷酸,可以是原核或真核微生物。此类原核微生物的实例包括,例如大肠杆菌物种的代表。此类真核微生物的实例包括,例如酵母(例如,酿酒酵母)。(天然或非天然地)编码腈水合酶的“产生腈水合酶和酰胺酶的微生物”通常还能够产生并稳定地保持腈水合酶。然而,根据本发明,这样的微生物也可能仅在微生物的培养(或发酵)期间产生腈水合酶,因此在干燥和/或与腈化合物接触时含有腈水合酶。在这种情况下,微生物可能在本文所描述和提供的方法期间不再产生腈水合酶,但它们仅通过在它们干燥之前产生的并且在它们干燥后仍含有的腈水合酶单元起作用。如本领域技术人员容易理解的,也可能一些腈水合酶分子可以离开微生物(例如,由于微生物的裂解)并且作为生物催化剂在溶液中自由地起作用。同样,(天然或非天然地)编码酰胺酶的“产生腈水合酶和酰胺酶微生物”通常也能够产生并稳定保持酰胺酶。然而,根据本发明,这样的微生物也可能仅在微生物的培养(或发酵)期间产生酰胺酶,因此在干燥和/或与腈化合物接触时含有酰胺酶。在这种情况下,微生物可能在本文所述和提供的方法期间不再产生酰胺酶,但它们仅通过在它们干燥之前产生的并且在它们干燥后仍然含有的酰胺酶单元起作用。在本发明的上下文中,天然编码腈水合酶和酰胺酶的“产生腈水合酶和酰胺酶的微生物”尤其包括以下属的细菌:红球菌属(rhodococcus)、曲霉属(aspergillus)、食酸菌属(acidovorax)、土壤杆菌属(agrobacterium)、芽孢杆菌属(bacillus)、短根瘤菌属(bradyrhizobium)、短杆菌属(brevibacterium)、伯克霍尔德菌属(burkholderia)、埃希氏菌属(escherichia)、土芽孢杆菌属(geobacillus)、克雷伯菌属(klebsiella)、中慢生根瘤菌属(mesorhizobium)、莫拉菌属(moraxella)、泛菌属(pantoea)、假单胞菌属(pseudomonas)、根瘤菌属(rhizobium)、红假单胞菌属(rhodopseudomonas)、沙雷氏菌属(serratia)、拟无枝酸菌属(amycolatopsis)、节杆菌属(arthrobacter)、短杆菌属(brevibacterium)、棒状杆菌属(corynebacterium)、微杆菌属(microbacterium)、微球菌属(micrococcus)、诺卡菌属(nocardia)、假诺卡菌属(pseudonocardia)、木霉属(trichoderma)、漆斑菌属(myrothecium)、短梗霉菌属(aureobasidium)、假丝酵母属(candida)、隐球菌属(cryptococcus)、德巴利酵母属(debaryomyces)、地霉属(geotrichum)、有孢汉逊酵母属(hanseniaspora)、克鲁维酵母属(kluyveromyces)、毕赤酵母属(pichia)、红酵母属(rhodotorula)、丛毛单胞菌属(comomonas)和火球菌属(pyrococcus)。在本发明的优选实施方案中,微生物选自红球菌属、假单胞菌属、埃希氏菌属和土芽孢杆菌属的细菌。具体地讲,“产生腈水合酶和酰胺酶的微生物”尤其包括以下物种:玫瑰色红球菌(rhodococcusrhodochrous)、嗜吡啶红球菌(rhodococcuspyridinovorans)、红串红球菌(rhodococcuserythropolis)、马红球菌(rhodococcusequi)、赤红球菌(rhodococcusruber)、不透明红球菌(rhodococcusopacus)、黑曲霉(aspergillusniger)、燕麦食酸菌(acidovoraxavenae)、敏捷食酸菌(acidovoraxfacilis)、根癌土壤杆菌(agrobacteriumtumefaciens)、放射形土壤杆菌(agrobacteriumradiobacter)、枯草芽孢杆菌(bacillussubtilis)、苍白芽孢杆菌(bacilluspallidus)、史氏芽孢杆菌(bacillussmithii)、芽孢杆菌属物种br449(bacillusspbr449)、bradyrhizobiumoligotrophicum、高效固氮慢生根瘤菌(bradyrhizobiumdiazoefficiens)、大豆慢生根瘤菌(bradyrhizobiumjaponicum)、burkholderiacenocepacia、唐菖蒲伯克霍尔德菌(burkholderiagladioli)、大肠杆菌、土芽孢杆菌属物种rapc8(geobacillussp.rapc8)、产酸克雷伯菌(klebsiellaoxytoca)、肺炎克雷伯菌(klebsiellapneumonia)、变栖克雷伯菌(klebsiellavariicola)、鹰嘴豆中慢生根瘤菌(mesorhizobiumciceri)、mesorhizobiumopportunistum、中慢生根瘤菌属物种f28、莫拉菌属(moraxella)、pantoeaendophytica、凝聚成团泛菌(pantoeaagglomerans)、绿针假单胞菌(pseudomonaschlororaphis)、恶臭假单孢菌(pseudomonasputida)、根瘤菌属(rhizobium)、沼泽红假单孢菌(rhodopseudomonaspalustris)、液化沙雷氏菌(serratialiquefaciens)、粘质沙雷氏菌(serratiamarcescens)、拟无枝酸菌属(amycolatopsis)、节杆菌属(arthrobacter)、短杆菌属物种ch1(brevibacteriumspch1)、短杆菌属物种ch2(brevibacteriumspch2)、短杆菌属物种r312(brevibacteriumspr312)、brevibacteriumimperiale、corynebacteriumnitrilophilu、假白喉棒状杆菌(corynebacteriumpseudodiphteriticum)、谷氨酸棒状杆菌(corynebacteriumglutamicum)、霍夫曼棒状杆菌(corynebacteriumhoffmanii)、蛾微杆菌(microbacteriumimperial)、microbacteriumsmegmatis、藤黄微球菌(micrococcusluteus)、球形诺卡菌(nocardiagloberula)、玫瑰色诺卡菌(nocardiarhodochrous)、嗜热假诺卡菌(pseudonocardiathermophile)、木霉属(trichoderma)、疣孢漆斑菌(myrotheciumverrucaria)、出芽短梗霉菌(aureobasidiumpullulans)、无名假丝酵母(candidafamata)、吉利蒙假丝酵母(candidaguilliermondii)、热带假丝酵母(candidatropicalis)、黄隐球菌(cryptococcusflavus)、隐球菌属物种ufmg-y28(cryptococcusspufmg-y28)、汉逊德巴利酵母(debaryomyceshanseii)、白地霉(geotrichumcandidum)、地霉属物种jr1(geotrichumspjr1)、有孢汉逊酵母属(hanseniaspora)、耐热克鲁维酵母(kluyveromycesthermotolerans)、克鲁维毕赤酵母(pichiakluyveri)、胶红类酵母菌(rhodotorulaglutinis)、睾丸酮丛毛单胞菌(comomonastestosteroni)、pyrococcusabyssi、激烈火球菌(pyrococcusfuriosus)和堀越氏火球菌(pyrococcushorikoshii)、乳酪短杆菌(brevibacteriumcasei)或诺卡菌属物种163(nocardiasp163)。在本发明的优选实施方案中,“产生腈水合酶和酰胺酶的微生物”是玫瑰色红球菌、嗜吡啶红球菌物种的细菌。这些物种的优选代表是玫瑰色红球菌(ncimb41164)、玫瑰色红球菌(fermbp-1478)、玫瑰色红球菌m8和玫瑰色红球菌m33。在本发明的上下文中,“腈水合酶”(“nhase”)是指催化腈水合成其相应酰胺的微生物酶(iubmb酶命名法(iubmbenzymenomenclature)ec4.2.1.84)。然而,如本文所用的术语“腈水合酶”和“nhase”还包含修饰的或增强的酶,其例如能够更快地将腈化合物(例如丙烯腈)转化为酰胺化合物(例如丙烯酰胺),或者其可以以更高的产量/时间比产生,或者它们更稳定,只要它们能够催化腈化合物(例如丙烯腈)转化(即水合)成酰胺化合物(例如丙烯酰胺)。测定给定的生物催化剂(例如“产生腈水合酶和酰胺酶的微生物”)将丙烯腈转化为丙烯酰胺的能力的方法是本领域熟知的。例如,在本发明的上下文中,在本发明意义上,能够将丙烯腈转化为丙烯酰胺的给定生物催化剂的活性可以如下测定:首先将100μl细胞悬浮液、细胞裂解物、溶解的酶粉末或含有假定的腈水合酶的任何其它制剂与875μl50mm磷酸钾缓冲液和25μl丙烯腈在25℃下在eppendorf管振荡器上以1,000rpm反应10分钟。在10分钟的反应时间后,可以抽取样品,并通过加入相同体积的1.4%盐酸立即淬灭。混合样品后,可以通过在10,000rpm离心1分钟除去细胞,并通过hplc分析澄清上清液来测定形成的丙烯酰胺的量。为了在本发明背景下确认酶是腈水合酶,丙烯酰胺浓度应当在0.25和1.25mmol/l之间,在必要时,样品必须相应地稀释,并且必须重复转化。然后可以通过将来自hplc分析的丙烯酰胺浓度除以反应时间(其为10分钟),并通过将该值与hplc样品和原始样品之间的稀释因子相乘,从丙烯酰胺的浓度推导出酶活性。活性>5u/mg干细胞重量,优选>25u/mg干细胞重量,更优选>50u/mg干细胞重量,最优选>100u/mg干细胞重量,表明存在功能性表达的腈水合酶,并且在本发明的背景下被认为是腈水合酶。在本发明的上下文中,腈水合酶可以是由多核苷酸编码的多肽,所述多核苷酸包含或由一段核苷酸序列组成,其与以下的核苷酸序列具有至少70%,优选至少75%,更优选至少80%,更优选至少85%,更优选至少90%,更优选至少95%,更优选至少96%,更优选至少97%,更优选至少98%,更优选至少99%,更优选至少99.5%,并且最优选100%的同一性:seqidno:1的核苷酸序列(玫瑰色红球菌的腈水合酶的α-亚基:gtgagcgagcacgtcaataagtacacggagtacgaggcacgtaccaaggcgatcgaaaccttgctgtacgagcgagggctcatcacgcccgccgcggtcgaccgagtcgtttcgtactacgagaacgagatcggcccgatgggcggtgccaaggtcgtggccaagtcctgggtggaccctgagtaccgcaagtggctcgaagaggacgcgacggccgcgatggcgtcattgggctatgccggtgagcaggcacaccaaatttcggcggtcttcaacgactcccaaacgcatcacgtggtggtgtgcactctgtgttcgtgctatccgtggccggtgcttggtctcccgcccgcctggtacaagagcatggagtaccggtcccgagtggtagcggaccctcgtggagtgctcaagcgcgatttcggtttcgacatccccgatgaggtggaggtcagggtttgggacagcagctccgaaatccgctacatcgtcatcccggaacggccggccggcaccgacggttggtccgaggaggagctgacgaagctggtgagccgggactcgatgatcggtgtcagtaatgcgctcacaccgcaggaagtgatcgtatga)和/或seqidno:3的核苷酸序列(玫瑰色红球菌的腈水合酶的β-亚基:atggatggtatccacgacacaggcggcatgaccggatacggaccggtcccctatcagaaggacgagcccttcttccactacgagtgggagggtcggaccctgtcaattctgacttggatgcatctcaagggcatatcgtggtgggacaagtcgcggttcttccgggagtcgatggggaacgaaaactacgtcaacgagattcgcaactcgtactacacccactggctgagtgcggcagaacgtatcctcgtcgccgacaagatcatcaccgaagaagagcgaaagcaccgtgtgcaagagatccttgagggtcggtacacggacaggaagccgtcgcggaagttcgatccggcccagatcgagaaggcgatcgaacggcttcacgagccccactccctagcgcttccaggagcggagccgagtttctctctcggtgacaagatcaaagtgaagagtatgaacccgctgggacacacacggtgcccgaaatatgtgcggaacaagatcggggaaatcgtcgcctaccacggctgccagatctatcccgagagcagctccgccggcctcggcgacgatcctcgcccgctctacacggtcgcgttttccgcccaggaactgtggggcgacgacggaaacgggaaagacgtagtgtgcgtcgatctctgggaaccgtacctgatctctgcgtga),条件是所述多核苷酸编码的多肽能够如本文所述和例举的催化丙烯腈水合成丙烯酰胺(即具有腈水合酶活性)。同样在本发明的背景下,腈水合酶可以是多肽,所述多肽包含或由一段氨基酸序列组成,其与以下的氨基酸序列具有至少70%,优选至少75%,更优选至少80%,更优选至少85%,更优选至少90%,更优选至少95%,更优选至少96%,更优选至少97%,更优选至少98%,更优选至少99%,更优选至少99.5%,并且最优选100%的同一性:seqidno:2的氨基酸序列(玫瑰色红球菌的腈水合酶的α-亚基:和/或seqidno:4的氨基酸序列(玫瑰色红球菌的腈水合酶的β-亚基:条件是所述多肽能够如本文所述和例举的催化丙烯腈水合成丙烯酰胺。两个或更多个序列(例如,核酸序列或氨基酸序列)之间的同一性水平可以通过本领域已知的方法容易地确定,例如通过blast分析。通常,在本发明的上下文中,如果通过例如序列比对来进行比较的两个序列(例如,多核苷酸序列或氨基酸序列)的同一性不同,则术语“同一性”可以指较短的序列以及与所述较短序列匹配的较长序列的那部分。因此,当比较的序列不具有相同的长度时,同一性程度优选地可以指较短序列中与较长序列中的核苷酸残基相同的核苷酸残基的百分比,或者指较长序列中与较短序列中的核苷酸序列相同的核苷酸的百分比。在本文中,技术人员容易确定与较短序列匹配的较长序列的那部分。此外,如本文所使用的,核酸序列或氨基酸序列的同一性水平可以基于相应序列的整个长度,并且优选成对评估,其中每个空位计为一个错配。序列比对的这些定义(例如,“同一性”值的建立)适用于本文所描述和公开的所有序列。此外,如本文所使用的术语“同一性”是指在相应序列之间存在功能和/或结构等同物。与本文所述的特定核酸/氨基酸序列具有给定同一性水平的核酸/氨基酸序列可以表示这些序列的衍生物/变体,其优选具有相同的生物学功能。它们可以是天然存在的变异,例如来自其他变种、物种等的序列,或突变,并且所述突变可以是天然形成的或可以通过有意诱变产生。此外,变异可以是合成产生的序列。变体可以是天然存在的变体或合成产生的变体或通过重组dna技术产生的变体。与上述核酸序列的偏差可以通过例如缺失、替代、添加、插入和/或重组产生。术语“添加”是指在给定序列的末端添加至少一个核酸残基/氨基酸,而“插入”是指在给定序列中插入至少一个核酸残基/氨基酸。术语“缺失”是指删除或去除给定序列中的至少一个核酸残基或氨基酸残基。术语“替代”是指替换给定序列中的至少一个核酸残基/氨基酸残基。同样,这里使用的这些定义经必要修改后适用于本文所提供和描述的所有序列。通常,如本文所用,术语“多核苷酸”和“核酸”或“核酸分子”应当同义地解释。通常,核酸分子尤其可以包含dna分子、rna分子、寡核苷酸硫代磷酸酯、取代的核糖寡核苷酸或pna分子。此外,术语“核酸分子”可以指本领域已知的dna或rna或其杂交物或其任何修饰(参见例如us5525711、us4711955、us5792608或ep302175中的修饰的实例)。多核苷酸序列可以是单链或双链、线性或环状、天然或合成的,并且没有任何大小限制。例如,多核苷酸序列可以是基因组dna、cdna、线粒体dna、mrna、反义rna、核酶rna或编码此类rna或嵌合体的dna(gamper,核酸研究(nucleicacidsresearch),2000,28,4332-4339)。所述多核苷酸序列可以是载体、质粒或病毒dna或rna的形式。本文还描述了与上述核酸分子互补的核酸分子和能够与本文所述的核酸分子杂交的核酸分子。本文所述的核酸分子还可以是本发明上下文中的核酸分子的片段。具体地讲,这样的片段是功能片段。这种功能片段的实例是可以用作引物的核酸分子。“酰胺酶”是指催化酰胺水解成其相应羧酸的微生物酶(iubmb酶命名法ec3.5.1.4,“酰胺酶”)。在本文中酰胺酶优选是指与腈水合酶共表达的酰胺酶,并且其将由腈水合酶产生的酰胺进一步转化为相应的羧酸。本文所用的术语“酰胺酶”还包含修饰或受损的酶,只要这些酶仍具有酰胺酶活性。不受理论的束缚,据信生物催化剂(即微生物)的干燥降低了酰胺酶的活性,由此认为腈水合酶活性降低到较低程度或保持不变。事实上,发明人观察到,当产生腈水合酶和酰胺酶的微生物与腈化合物(该腈化合物应该通过所述的微生物进行生物转化(腈化合物转化成酰胺化合物))接触之前通过干燥步骤预处理时,腈水合酶的活性高于酰胺酶的活性。如上所述,发明人观察到,在与将要被所述微生物转化为酰胺化合物的腈化合物接触之前通过干燥步骤预处理的微生物,当与在与所述腈化合物接触之前不通过干燥步骤预处理的相同微生物相比时,所述微生物能够产生具有更少丙烯酸的酰胺化合物。因此,本发明的微生物优选具有至少400单位的腈水合酶/酰胺酶活性比。优选如上文所述测定腈水合酶活性。还根据本发明的发现,本发明方法中涉及的接触步骤是用干燥的微生物进行的。根据一个实施方案,在本发明的方法中提及的接触步骤用重配的微生物进行。重配的微生物是悬浮的干燥微生物,即以浆体存在或溶解在水溶液如水或具有生理ph的缓冲溶液或水性组合物中。后者可以含有一种或多种其它成分,例如葡萄糖。在本文中重配是指在微生物与腈化合物接触之前将水性组合物加入到干燥的微生物中。因此,在本文所述的任何一种方法中,接触步骤可以用悬浮在水性组合物中的干燥微生物进行。这样的水性组合物包括但不限于,水(例如去离子水)和缓冲液(例如磷酸盐缓冲液)。考虑到上述情况,优选本发明方法中涉及的接触步骤用粉末、颗粒和/或悬浮液形式的微生物进行。也可以使用基质结合的微生物进行接触步骤。如上所述,当与参照微生物相比时,也用于本文所述的方法和用途中的本发明微生物的腈水合酶活性与酰胺酶活性的比率增加。事实上,如所附实施例所示,显然,与未通过干燥步骤预处理的微生物相比,在与腈化合物接触之前通过干燥步骤预处理的微生物(所述腈化合物然后经所述微生物生物转化)具有最低的丙烯酸值。该发现意味着干燥的微生物的酰胺酶活性似乎降低或受损,因为未干燥的微生物产生更多的丙烯酸作为副产物,所述丙烯酸来自于酰胺化合物向丙烯酸的转化。结果,相对于(降低的)酰胺酶活性,腈水合酶活性增加。实际上,由于干燥步骤,酰胺酶活性降低到这样的程度,使这种干燥的微生物产生具有较少丙烯酸副产物的酰胺化合物,这从表1和2的最右边的栏中可见。总之,由于在实施例1和2中应用的反应参数在不同设置之间保持相同,显然减少丙烯酸量的改进可归因于干燥步骤。作为“参照微生物”,当在本文中提及时,可以使用非干燥的生物催化剂(即微生物)。因此,参考微生物是在与腈化合物接触之前未通过干燥步骤预处理的微生物,所述腈化合物应该通过本发明微生物转化为酰胺化合物,所述本发明微生物在与所述腈化合物接触之前通过干燥步骤预处理。合适的“参照微生物”是例如与本发明方法中用作生物催化剂的微生物相同菌株的非干燥的微生物。此外,“参考微生物”可以对应于在干燥之前用于本发明方法的生物催化剂(即微生物)。在这种情况下,可以在该方法的干燥步骤a)之前和之后确定用作生物催化剂的微生物的腈水合酶/酰胺酶活性,并比较腈水合酶/酰胺酶活性以确定干燥是否增加微生物的腈水合酶/酰胺酶活性。此外,玫瑰色红球菌(ncimb41164)可以用作“参照微生物”。为了确定步骤a)中进行的干燥过程是否提高了所用微生物的腈水合酶/酰胺酶活性比,可另外或可选地使用玫瑰色红球菌(ncimb41164)进行步骤a)中的干燥过程。在通过步骤a)中进行的干燥来增加玫瑰色红球菌(ncimb41164)的腈水合酶/酰胺酶活性比的情况下,必须假定通过步骤a)中进行的干燥,在本发明方法中用作生物催化剂的微生物的腈水合酶/酰胺酶活性比同样地减少。在本发明中,微生物优选不在微生物干燥和干燥的微生物与腈化合物接触之间进行培养。如本文所用,“培养”是指将微生物悬浮在培养基中并保持在允许微生物生长的条件下。在微生物干燥和干燥的微生物与腈化合物接触之间,优选将微生物保持在抑制微生物在干燥前恢复其腈水合酶/酰胺酶活性比率的条件下。腈水合酶活性与酰胺酶活性的比率的增加优选至少1.4倍或更多倍,例如1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4或2.5或甚至更高的因子。类似地,酰胺酶活性与腈水合酶活性比率的降低优选至少0.7倍或更低倍,例如0.6、0.5、0.4、0.3、0.2或0.1或甚至更低的因子。本发明发现一种由腈化合物制备酰胺化合物的方法,其包含以下步骤:(a)干燥产腈水合酶和酰胺酶的微生物;和(b)使腈化合物与所述微生物接触。不受理论限制,假定步骤(a)增加腈水合酶活性与酰胺酶活性的比率根据本领域技术人员的普通知识测量和测定腈水合酶活性,例如上文所述。类似地,根据本领域技术人员的普通知识测量和测定酰胺酶活性。例如酰胺酶活性可以在室温下通过测量630nm处丙烯酰胺降解释放的氨来测定。因此,如本文所述,用作生物催化剂的微生物的干燥提高了所述微生物的腈水合酶/酰胺酶活性比。优选地,干燥通过喷雾干燥、冷冻干燥、加热干燥、空气干燥、真空干燥、流化床干燥和/或喷雾造粒来介导。在这方面,优选喷雾干燥和冷冻干燥,因为通常通过使用已经进行喷雾或冷冻干燥的生物催化剂,与使用其它方法已经干燥的微生物相比,实现了在由腈化合物制备酰胺化合物期间丙烯酸形成的更多降低。在本文所述的任何一种方法中,微生物的干燥可以在干燥的微生物与腈化合物接触之前立即进行。或者,微生物可以在干燥和干燥的微生物与腈化合物接触之间储存。为了在干燥和接触步骤之间储存微生物,干燥的微生物可以保持在干燥状态(即,微生物不重配),可以冷冻、可以防止受热、可以防止受潮和/或可以不培养。对干燥的微生物与腈化合物接触时的干燥微生物的形式没有特别限制。干燥的微生物可以是干燥的和/或以通过本文所述的任何干燥方法例如喷雾干燥或冷冻干燥可实现的干燥产物的形式。因此,在本文所述的任何一种方法和进一步的实施方案中,接触步骤可以用具有残余水含量的微生物进行,其残余水含量至多为微生物总质量的30、25、15、14、13、12、11、10、9、8、7、6或5重量百分比(%w/w)。确定残余水含量的方法是本领域技术人员熟悉的。例如,在本发明的上下文中,干燥微生物的样品的残余水含量可以通过热重分析来确定。在热重分析开始时,确定样品的初始重量。然后加热样品,水分蒸发。继续加热直到样品重量保持恒定。分析结束时的恒定重量和初始重量之间的差表示在分析期间蒸发的水量,其能够计算样品的残余水含量。为了通过热重分析测定残余水含量,可以例如在“mettlertoledohb43-s卤素水分分析仪”上在130℃操作分析微生物样品,直到样品重量保持恒定至少30秒。因此,“微生物的总质量”不必限于微生物本身的质量(尽管这当然是可能的,例如当微生物在干燥步骤之前已经用水洗涤时),而是可以进一步包括其存在可以归因于微生物的培养和/或洗涤步骤等的成分。所述“微生物的总质量”可以进一步包括(除了微生物以外的)储存缓冲液的组分/盐、例如基于tris的缓冲液、盐水缓冲液等的残余量和/或培养基、生长培养基、营养液、发酵液、例如用于培养微生物等的发酵液、稳定剂、添加剂(例如干燥添加剂)等的残余量。本发明进一步根据发明人的发现提供了制备具有增加的腈水合酶/酰胺酶活性比的微生物的方法,其包括干燥产生腈水合酶和酰胺酶的微生物,以及制备具有降低的酰胺酶活性的微生物的方法,其包括干燥产生腈水合酶和酰胺酶的微生物。如上所述,通过本发明实现的主要目标是生物转化的酰胺化合物(由腈化合物生物转化),具有较少或减少的作为副产物的丙烯酸,因为已知丙烯酸引起随后酰胺化合物的聚合困难。因此,通过提供一种用于在由腈化合物制备酰胺化合物时减少丙烯酸形成的方法,这种成就得到了体现,所述方法包含使丙烯腈与产生腈水合酶和酰胺酶的微生物接触,其中所述微生物在与所述腈化合物接触之前通过干燥步骤预处理。具体地讲,发明人已经发现,通过使用在与如本文所述的腈化合物接触之前已经通过干燥步骤预处理的微生物,与参考方法相比,丙烯酸的形成可以降低至少15%,优选至少20%,更优选至少25%,甚至更优选至少30%,还更优选至少40%,并且最优选至少50%。发明人进一步认为,生物转化反应,特别是工业规模的反应,应优选以相对简单的方式进行。具体地讲,关于使用本发明的包含腈水合酶的生物催化剂进行的腈化合物向酰胺化合物的生物转化,发明人已经考虑将反应混合物中的缓冲液的摩尔浓度保持相当低,优选尽可能低,其对于生物转化过程具有几个优点。例如,如果在反应混合物中存在相当大量的缓冲液,则其将以相当大的量存在于废水中。这意味着缓冲液必须再次从废水中除去,将导致额外的技术努力和成本。此外,在产物(即酰胺溶液)中存在相当大量的缓冲液可能不利地影响随后的反应步骤,例如聚合或共聚反应。因此,如果将相当大量的缓冲液加入到生物转化的反应混合物中,则在进一步的反应步骤之前必须将其与酰胺溶液分离,这将伴随额外的技术努力和成本,或者缓冲液可能导致产品质量的降低。因此,腈化合物向酰胺化合物的生物转化优选在相对低量的缓冲液存在下在水溶液中进行。为了制备用于将腈化合物生物转化为酰胺化合物的反应混合物,通过本发明的方法(例如,通过喷雾干燥或冷冻干燥)获得的干燥的生物催化剂通常可以悬浮在水中,然后可以将含有生物催化剂的所述含水混合物转移到进行生物转化的反应器中,其中生物催化剂与含水混合物和要转化为相应酰胺的腈化合物接触。然而,发明人惊奇地发现,如果本发明的干燥生物催化剂与非缓冲的水溶液混合,含有生物催化剂的水性混合物的ph将处于弱酸性范围内(例如ph5至6.5)。这是令人惊讶的,因为在干燥例如喷雾干燥或冷冻干燥之前,在介质中潮湿的生物催化剂通常具有中性ph(例如ph6.7至7.5)。此外,在生物转化期间的反应混合物是相当弱的碱性。不希望受理论束缚,据信在干燥步骤期间,氨(nh3)从介质中剥离,这在生物转化前与水溶液混合时导致干燥的生物催化剂的弱酸性ph。在这方面,发明人惊奇地发现,干燥的生物催化剂的含水混合物的酸性ph导致腈水合酶的活性降低,并且这种降低可能是不可逆的,这意味着即使生物转化在具有中性或微碱性ph的反应混合物中进行,腈水合酶的活性将保持降低。发明人进行了各种实验,并且发现如果干燥的生物催化剂在生物转化之前通过悬浮在缓冲的水溶液中而被活化,其中该溶液具有中性或微碱性ph(例如ph6.6至9),则生物催化剂将具有显著增加的腈水合酶活性。即使将活化混合物(即包含生物催化剂的缓冲的水性混合物)转移到非缓冲的水溶液中以得到反应混合物,这种高的腈水合酶活性得以保持。通过这种增加的腈水合酶活性,当与在喷雾干燥后相同量的生物催化剂悬浮在没有缓冲液的水中的生物转化的反应时间相比,生物转化的总反应时间显著降低。此外,简单地向反应混合物中加入缓冲液,不会产生与在加入反应混合物之前干燥的生物催化剂已经重新悬浮在缓冲液中作为活化物时相同的效果。根据发明人进行的进一步实验,当在发酵后将缓冲液加入到细胞悬浮液中并且生物催化剂用缓冲液干燥、然后再悬浮于水或缓冲液中时,生物催化剂也具有显著增加的腈水合酶活性。如上所述,生物催化剂的活化可以通过将干燥的生物催化剂悬浮在含有缓冲液的水溶液中进行。这种活化可以小规模进行,即活化所需的反应体积相当小。另一方面,进行腈化合物至酰胺化合物的生物转化的反应混合物通常具有相当大的体积。由于与反应混合物的体积相比,活化混合物的体积较小,当活化混合物转移到反应器中用于腈化合物至酰胺化合物的生物转化时,在反应混合物中的缓冲液组分被稀释。尽管如此,在生物转化中保留了活化期间缓冲液的有益效果。如前所述,作为增强的腈水合酶活性的结果,如果使用相同量的生物催化剂,则使用该生物催化剂的将腈化合物生物转化为酰胺化合物显示更高的反应速率。此外,可以降低生物催化剂的量,同时实现了与使用未经历活化步骤(即在干燥后仅在水中重新悬浮的生物催化剂)的未减少量的生物催化剂的反应速率相比,甚至更高的反应速率。因此,本发明还涉及一种在含水混合物中由腈化合物制备酰胺化合物的方法,所述方法包含:(a)通过干燥步骤对生物催化剂进行预处理;(b)活化步骤,其包括将本发明的干燥的生物催化剂与水溶液混合以产生活化混合物,其中所述活化混合物包含缓冲液;和(c)使用本发明的生物催化剂在反应混合物中将腈化合物转化为酰胺化合物,其中所述反应混合物包含步骤(b)的所述缓冲液,并且其中活化混合物中的缓冲液摩尔浓度与反应混合物中所述缓冲液的摩尔浓度的比率约为2:1或更高。具体地讲,在转化结束之前,活化混合物中缓冲液的摩尔浓度与反应混合物中所述缓冲液的摩尔浓度的比率约为2:1或更高。在本文公开的任何一种方法中不需要在转化期间保持该比率恒定。相反,该比率可以在转化期间变化,只要该比率约为2:1或更高。例如,该比率可以在转化期间增加。可能是这种情况,如果在转化期间将反应物加入到反应混合物中,其稀释反应混合物,从而降低反应混合物中的缓冲液浓度。例如,腈化合物和/或水可以在转化期间作为反应物进料到反应混合物中。这增加了反应混合物的体积,并且因此降低了反应混合物中缓冲液的摩尔浓度。由于反应混合物中缓冲液的摩尔浓度降低,活化混合物中缓冲液的摩尔浓度与反应混合物中缓冲液的摩尔浓度的比例增加。因此,从该实例可以看出,所述摩尔比可以在转化反应过程中变化。进一步考虑,活化混合物中缓冲液的摩尔浓度与反应混合物中所述缓冲液的摩尔浓度的比率可以约为3:1或更高,优选约4:1或更高,更优选约5:1或更高,甚至更优选约7:1或更高,还更优选约10:1或更高,还更优选约20:1或更高,还更优选约50:1或更高,最优选约100:1或更高。具体地讲,这些比率存在于转化结束之前。关于活化混合物中缓冲液的摩尔浓度和反应混合物中缓冲液的摩尔浓度,这些浓度均以mol/l(摩尔每升)表示。当计算活化混合物中缓冲液的摩尔浓度与反应混合物中缓冲液的摩尔浓度的比率时,活化混合物中缓冲液的摩尔浓度和反应混合物中缓冲液的摩尔浓度均以mol/l计。本发明还包括,在活化步骤后和在生物催化剂与腈化合物接触之前,活化混合物的缓冲液可以至少部分除去。作为说明性实例,这可以通过离心活化混合物,然后丢弃上清液,任选地随后使生物催化剂与另一种水溶液接触,或者作为另一个说明性实例,通过过滤来完成。在这种情况下,当生物催化剂与腈化合物接触时,生物催化剂(悬浮液)通常仍然含有残余的缓冲液。本领域技术人员应当理解,生物催化剂中存在的残余缓冲液越少,活化混合物中缓冲液的摩尔浓度与反应混合物中所述缓冲液的摩尔浓度的比率越高。本文在干燥的生物催化剂的上下文中使用的术语“活化”,通常是指将干燥的生物催化剂与水溶液混合,以得到包含生物催化剂和缓冲液的水性混合物。所述混合物在本文中也称为“活化混合物”。根据本文所述的任何一种方法,活化混合物可以通过将缓冲液与水溶液混合以得到缓冲的水溶液,然后将干燥的生物催化剂溶解或悬浮在缓冲的水溶液中来制备。活化混合物也可以通过将干燥的生物催化剂与缓冲液组分、特别是干燥的缓冲液组分混合,然后向混合物中加入水或将混合物加入水中,以及溶解缓冲液组分并且溶解或再悬浮干燥的生物催化剂来制备。本文所用的术语“反应混合物”是指包含生物催化剂和腈化合物和/或酰胺化合物的含水混合物。在一些实施方案中,根据本文公开的任何一种方法的反应混合物,可以通过合并已经经历活化步骤的生物催化剂、水溶液和腈化合物来产生。通常,生物催化剂催化反应混合物中腈化合物向酰胺化合物的转化。因此,术语“反应混合物”通常是指在转化过程的任何时间的包括水、生物催化剂和腈和/或酰胺化合物的混合物,包括在反应开始时、在水溶液中首先使生物催化剂与腈化合物接触时、以及在转化停止或结束后但是水溶液、生物催化剂和酰胺或腈化合物仍然存在于混合物中时。本文所用的术语“在转化结束之前”是指反应混合物中腈向酰胺的转化仍在进行的任何时间。通常其是指存在反应混合物并且其中转化还没有结束或停止的任何时间。在本文公开的方法中还预期,在将生物催化剂进行本发明的干燥步骤以得到干燥的生物催化剂之前,可以将缓冲液加入到生物催化剂悬浮液或溶液中。也可以在加入缓冲液之前洗涤生物催化剂。通过在干燥步骤之前添加缓冲液,干燥后的生物催化剂包含在干燥步骤之前已经加入的干燥的缓冲液组分。因此,当使包含缓冲液的干燥的生物催化剂与水溶液接触时,缓冲液组分溶解,其与生物催化剂一起产生活化混合物。此外,在本文公开的方法中还包括,用缓冲液处理生物催化剂,随后将生物催化剂进行干燥步骤以产生干燥的生物催化剂,其随后可以溶解或重悬浮在缓冲溶液中以得到活化混合物。当根据本文公开的方法用缓冲液活化生物催化剂时,所述活化不需要长的时间段。优选地,所述生物催化剂的活化进行约1分钟或更长,更优选约5分钟或更长,甚至更优选约10分钟至约10小时,还更优选约20分钟至约5小时,最优选约30分钟至约2小时。当干燥的生物催化剂用缓冲的水溶液处理以得到活化混合物时,所述活化混合物通常直接用于生物转化,即直接与水溶液和腈化合物混合以得到反应混合物。另一方面,如果在干燥步骤之前用缓冲溶液或缓冲盐活化生物催化剂,则干燥的生物催化剂可以随后储存几个月,然后将所述活化的生物催化剂与水溶液混合以得到活化混合物,并且进一步将所述活化混合物与水溶液和腈化合物混合以得到反应混合物。如发明人所发现的,所述生物催化剂在储存期间没有显著丢失活性。这可以被看作所述活化变体的另一优点。本文所公开的方法还包括,包含在活化混合物中的缓冲液具有在约6至约9,优选约6.5至约8范围内的pka。在这里,缓冲液可包含单一组分,或可以是多于一种缓冲液组分的混合物。还应当理解,一种单一组分可以具有多于一种pka值。如果缓冲液包含pka在约6至约9范围内的缓冲液组分,则缓冲液通常具有在约6至约9范围内的pka。例如,磷酸盐具有三个pka值,2.1、7.2和12.7。由于磷酸盐的pka值之一在约6至约9的范围内,所以包含磷酸盐的缓冲液可以理解为具有pka在约6至约9范围内的缓冲液。还包括活化混合物具有的ph值约6.6至约9,优选约6.6至约8.8,更优选约6.7至约8.6,甚至更优选约6.8至约8.4,还更优选约6.9至约8.2,最优选约7至约8。本发明还预期了不同的缓冲液非常适合用于本文所公开的方法中,即增加生物催化剂的腈水合酶活性。所述缓冲液包含无机缓冲液或有机缓冲液。进一步考虑,缓冲液可以包含非磺酸缓冲液或羧酸缓冲液。可用于本发明的合适的缓冲液可以包含选自下述的化合物:磷酸盐、柠檬酸盐、碳酸盐、2-[(2-羟基-1,1-双(羟甲基)乙基)氨基]乙磺酸(tes)、1,4-哌嗪二乙磺酸(pipes)、n-(2-乙酰氨基)-2-氨基乙磺酸(aces)和三(羟甲基)氨基甲烷(tris)及其任何组合。具体地讲,缓冲液包含磷酸盐缓冲液或柠檬酸盐缓冲液或其组合。优选地,缓冲液是磷酸盐缓冲液。进一步涉及在活化混合物中缓冲液的浓度为约10mm至约1m,优选约20mm至约500mm,更优选约50mm至约200mm,甚至更优选约70mm至约130mm,最优选约80mm至约120mm。进一步涉及反应混合物中的缓冲液浓度为约100mm或更低,优选约50mm或更低,更优选约20mm或更低,甚至更优选约10mm或更低,还更优选约5mm约1pm,还更优选约4mm至约1pm,还更优选约3mm至约1pm,还更优选约2mm至约1pm,还更优选约1mm至约1pm,还更优选约0.8mm至约1pm,还更优选约0.5mm至约1pm,还更优选约0.4mm至约1pm,还更优选约0.3mm至约1pm,还更优选约0.2mm至约1pm,最优选约0.1mm至约1pm。还包括活化的温度在约0℃至约50℃,优选约10℃至约40℃,更优选约20℃至约37℃的范围内。然而,本发明不仅包括方法,还包括以下用途。如本文所述的产生腈水合酶和酰胺酶的微生物用于从腈化合物生产酰胺化合物的用途。干燥方法用于提高产生腈水合酶和酰胺酶的微生物的腈水合酶/酰胺酶活性比的用途。干燥方法用于降低产生腈水合酶和酰胺酶的微生物的酰胺酶活性的用途。本文在本发明方法的上下文中描述的实施方案和定义在适当的变更下同样适用于本发明的用途。在另一方面,本发明提供通过本发明的方法获得的酰胺化合物水溶液。这种酰胺化合物水溶液优选特征在于,与从相同生物体(在与腈化合物接触之前,所述相同生物体不通过干燥步骤预处理)获得的酰胺化合物水溶液相比,具有降低的丙烯酸含量。具体地讲,这种酰胺化合物水溶液的丙烯酸浓度为1500ppm或更低,优选为1200ppm或更低,更优选为1000ppm或更低,进一步优选为750ppm或更低,甚至更优选为500ppm或更低,还更优选为300ppm或更低,还更优选为200ppm或更低,并且最优选为100ppm或更低,其中ppm的指示各自涉及重量份数,并且各自基于酰胺化合物水溶液的总重量。此外,本发明提供了包含丙烯酰胺或聚丙烯酰胺和产生腈水合酶和酰胺酶的微生物的组合物,所述微生物当与参照微生物相比时,表现出至少400单位的腈水合酶/酰胺酶活性比率,和/或腈水合酶活性与酰胺酶活性的比率增加至少1.7倍。除非上下文另有要求,单数术语应包括复数并且复数术语应包括单数。如本文和所附权利要求中所使用的,单数形式“一种”、“一个”和“该”包括复数指示物,除非上下文另有明确指示。因此,例如提及“一种试剂”包括一种或多种这样的不同试剂,并且提及“该方法”包括提及本领域普通技术人员已知的等价步骤和方法,其可以被本文所述的方法修饰或代替。如本文所使用的,多个所述要素之间的连接词“和/或”被理解为包含单独和组合的选项。例如,当两个要素通过“和/或”连接时,第一个选项指的是采用没有第二个要素的第一个要素。第二个选项指的是采用没有第一个要素的第二个要素。第三种选项是指采用第一和第二要素一起。这些选项中的任一个被理解为落入该含义内,并且因此满足本文所使用的术语“和/或”的要求。多于一个选项的同时采用也被理解为落入该含义内,并且因此满足本文所使用的术语“和/或”的要求。除非另有说明,在一系列要素之前的术语“至少”应理解为是指该系列中的每个要素。本领域技术人员仅使用不超出常规的实验就可确定或能够确定本文所述的本发明的具体实施方案的许多等同物。本发明旨在包含这样的等同物。在本说明书和随后的权利要求书中,除非上下文另有要求,否则词语“包含”及其变体如“包括”将被理解为暗示包括所述整体或步骤或整体或步骤的组,但不排除任何其它整体或步骤或整体或步骤的组。在本文中使用时,术语“包含”可以用术语“含有”替代或有时在本文中用术语“具有”替代。如本文所述,“优选实施方案”或“优选方面”是指“本发明的优选实施方案”或“本发明的优选方面”。同样,如本文所述,“实施方案”、“另一个实施方案”、“一个方面”、“另一方面”分别是指“本发明的实施方案”、“本发明的另一个实施方案”、“本发明的一方面”和“本发明的另一方面”。除非本文另有定义,本发明使用的科学和技术术语具有本领域普通技术人员通常理解的含义。本发明的方法和技术通常根据本领域熟知的常规方法进行。本领域技术人员使用不超出常规的实验就可确认或能够确定本文所述的本发明的具体实施方案的许多等同物。本发明旨在包含这样的等同物。在本说明书的整个文本中引用了几个文献。无论是上文还是下文,本文引用的每篇文献(包括所有专利、专利申请、科学出版物、制造商的说明书、说明书等)都以引用整体的方式并入本文。本文中的任何内容不应被解释为承认本发明由于引用以前的发明而没有资格早于此类公开物。附图说明图1:在使用喷雾干燥的玫瑰色红球菌ncimb41164作为生物催化剂将丙烯腈生物转化为丙烯酰胺的生物转化中,以w/w%计的丙烯酰胺(acm,以深灰色描绘)[%]和丙烯腈(acn,以浅灰色描绘)[%]浓度的时间过程。在喷雾干燥后,干燥的生物催化剂已经重新悬浮在水中。使用总量为3.36g的干燥生物催化剂(批次ch10),其在生物转化开始之前具有测量为116ku/g的腈水合酶活性。反应在26℃下以4l规模(l=升)进行。在反应开始时,将对应于2.4g干燥生物催化剂的重悬生物催化剂加入到反应器中。通过向反应器中加入acn,在生物转化开始0h至1h后,将acn浓度保持在2w/w%。在生物转化开始1h后,将对应于0.96g干燥生物催化剂的重悬生物催化剂加入到反应器中。在生物转化开始1h后,将acn浓度保持在0.8w/w%,直到将总量为1553g的丙烯腈加入到反应器中。直到完全转化(残余acn<100ppm)的总反应时间为13.78h。图2:在使用喷雾干燥的玫瑰色红球菌ncimb41164作为生物催化剂将丙烯腈转化为丙烯酰胺的生物转化中,以w/w%计的丙烯酰胺(acm,以深灰色描绘)[%]和丙烯腈(acn,以浅灰色描绘)[%]浓度的时间过程。在喷雾干燥后,干燥的生物催化剂已经重新悬浮在33ml的100mm磷酸盐缓冲液(ph7.0)中,其对应于本文公开的活化步骤。活化步骤进行1.0h。使用总量为3.36g的干燥生物催化剂(批次ch10),其在生物转化开始之前具有测量为116ku/g的腈水合酶活性。反应在26℃下以4l规模(l=升)进行。在反应开始时,将对应于2.4g干燥生物催化剂的重悬生物催化剂加入到反应器中。通过向反应器中加入acn,在生物转化开始0h至1h后,将acn浓度保持在2w/w%。在生物转化开始1h后,将对应于0.96g干燥生物催化剂的重悬生物催化剂加入到反应器中。在生物转化开始1h后,将acn浓度保持在0.8w/w%,直到将总量为1553g的丙烯腈加入到反应器中。直到完全转化(残余acn<100ppm)的总反应时间为2.31h。图3:在使用喷雾干燥的玫瑰色红球菌ncimb41164作为生物催化剂将丙烯腈转化为丙烯酰胺的生物转化中,以w/w%计的丙烯酰胺(acm,以深灰色描绘)[%]和丙烯腈(acn,以浅灰色描绘)[%]浓度的时间过程。在喷雾干燥后,干燥的生物催化剂已经重新悬浮在水中。使用总量为3.36g的干燥生物催化剂(批次ch10),其在生物转化开始之前具有测量为116ku/g的腈水合酶活性。反应在26℃下以4l规模(l=升)进行。在生物催化剂直接添加之前,将33ml的100mm磷酸盐缓冲液(ph7.0)加入到反应器中,其对应于在图2所示实验的活化步骤中使用的缓冲液的量。在反应开始时,将对应于2.4g干燥生物催化剂的重悬生物催化剂加入到反应器中。通过向反应器中加入acn,在生物转化开始0h至1h后,将acn浓度保持在2w/w%。在生物转化开始1h后,将对应于0.96g干燥生物催化剂的重悬生物催化剂加入到反应器中。在生物转化开始1h后,将acn浓度保持在0.8w/w%,直到将总量为1553g的丙烯腈加入到反应器中。直到完全转化(残余acn<100ppm)的总反应时间为11.98h。图4:在使用喷雾干燥的玫瑰色红球菌ncimb41164作为生物催化剂将丙烯腈转化为丙烯酰胺的生物转化中,以w/w%计的丙烯酰胺(acm,以深灰色描绘)[%]和丙烯腈(acn,以浅灰色描绘)[%]浓度的时间过程。干燥的生物催化剂已经重新悬浮在30ml的100mm磷酸盐缓冲液(ph7.0)中,其对应于本文公开的活化步骤。活化步骤进行0.5h。使用总量为1.8g的干燥生物催化剂(批次ch10),其在生物转化开始之前具有测量为116ku/g的腈水合酶活性。反应在23℃下以4l规模(l=升)进行。在反应开始时,将对应于1.8g干燥生物催化剂的重悬生物催化剂加入到反应器中。通过向反应器中加入acn,在生物转化开始后,将acn浓度保持在1w/w%,直到将总量为1553g的丙烯腈加入到反应器中。直到完全转化(残余acn<100ppm)的总反应时间为7.13h。图5:在使用喷雾干燥的玫瑰色红球菌ncimb41164作为生物催化剂将丙烯腈转化为丙烯酰胺的生物转化中,以w/w%计的丙烯酰胺(acm,以深灰色描绘)[%]和丙烯腈(acn,以浅灰色描绘)[%]浓度的时间过程。干燥的生物催化剂已经重新悬浮在水中。使用总量为1.29g的干燥生物催化剂(批次v3),其在生物转化开始之前具有测量为172ku/g的腈水合酶活性。反应在26℃下以4l规模(l=升)进行。在反应开始时,将对应于0.92g干燥生物催化剂的重悬生物催化剂加入到反应器中。通过向反应器中加入acn,在生物转化开始0h至1h后,将acn浓度保持在2w/w%。在生物转化开始1h后,将对应于0.37g干燥生物催化剂的重悬生物催化剂加入到反应器中。在生物转化开始1h后,将acn浓度保持在0.8w/w%,直到将总量为1553g的丙烯腈加入到反应器中。20h后没有达到完全转化(残余acn<100ppm)。图6:在使用喷雾干燥的玫瑰色红球菌ncimb41164作为生物催化剂将丙烯腈转化为丙烯酰胺的生物转化中,以w/w%计的丙烯酰胺(acm,以深灰色描绘)[%]和丙烯腈(acn,以浅灰色描绘)[%]浓度的时间过程。干燥的生物催化剂已经重新悬浮在30ml的100mm磷酸盐缓冲液(ph8.0)中,其对应于本文公开的活化步骤。活化步骤进行0.5h。使用总量为1.29g的干燥生物催化剂(批次v3),其在生物转化开始之前具有测量为172ku/g的腈水合酶活性。反应在26℃下以4l规模(l=升)进行。在反应开始时,将对应于0.92g干燥生物催化剂的重悬生物催化剂加入到反应器中。通过向反应器中加入acn,在生物转化开始0h至1h后,将acn浓度保持在2w/w%。在生物转化开始1h后,将对应于0.37g干燥生物催化剂的重悬生物催化剂加入到反应器中。在生物转化开始1h后,将acn浓度保持在0.8w/w%,直到将总量为1553g的丙烯腈加入到反应器中。直到完全转化(残余acn<100ppm)的总反应时间为4.4h。图7:在使用喷雾干燥的玫瑰色红球菌ncimb41164作为生物催化剂将丙烯腈转化为丙烯酰胺的生物转化中,以w/w%计的丙烯酰胺(acm,以深灰色描绘)[%]和丙烯腈(acn,以浅灰色描绘)[%]浓度的时间过程。干燥的生物催化剂已经重新悬浮在30ml的100mm磷酸盐缓冲液(ph7.0)中,其对应于本文公开的活化步骤。活化步骤进行0.5h。使用总量为1.29g的干燥生物催化剂(批次v3),其在生物转化开始之前具有测量为172ku/g的腈水合酶活性。反应在26℃下以4l规模(l=升)进行。在反应开始时,将对应于0.92g干燥生物催化剂的重悬生物催化剂加入到反应器中。通过向反应器中加入acn,在生物转化开始0h至1h后,将acn浓度保持在2w/w%。在生物转化开始1h后,将对应于0.37g干燥生物催化剂的重悬生物催化剂加入到反应器中。在生物转化开始1h后,将acn浓度保持在0.8w/w%,直到将总量为1553g的丙烯腈加入到反应器中。直到完全转化(残余acn<100ppm)的总反应时间为7.25h。实施例以下实施例进一步描述和举例说明了本文提供的本发明,但不将本发明限制于其中限定的任何说明或实施方案。进行了由腈化合物制备酰胺化合物的三个实验。用于生产的培养液是含有生物催化剂的发酵液、所述生物催化剂的浓缩物、喷雾干燥的生物催化剂或冷冻干燥的生物催化剂。浓缩物是在与将要转化为酰胺化合物的所述腈化合物接触之前通过干燥步骤进行预处理前的生物催化剂形式。浓缩物是指通过减少液体发酵液进行浓缩的发酵液,例如通过离心。因此,实施例中使用的发酵液、浓缩物和干粉含有相同的生物催化剂。根据通常已知的方法测定腈水合酶和酰胺酶之间的活性比率以及腈水合酶活性。在设置中的腈水合酶活性意味着所有设置包含相同量的生物催化剂,这是由几乎相同的腈水合酶活性反映的。因此,发酵液、浓缩物和干粉的条件相同。此外,测定丙烯酸的浓度。这些数据总结在下表1中,以及生物转化反应的结束。实施例1:将水和20gacn置于反应器中。调节水的量,使水+生物催化剂的总量为2447g。在独立运行中使用三种不同形式的生物催化剂:(i)含有玫瑰色红球菌ncimb41164的发酵液。水含量:88.2%(w/w)。(ii)浓缩物,其来自(i)已通过离心浓缩的发酵液。水含量:83.5%(w/w)。(iii)通过喷雾干燥来自(ii)的浓缩物获得的干粉。干粉的残余水含量:8.05%(w/w)。喷雾干燥在115℃气体入口温度和65℃气体出口温度下操作。将生物催化剂加入到反应器中,由此开始反应。在反应期间,加入1533g额外的丙烯腈,使得最终的总反应批料大小为4000g。在反应期间温度保持恒定在26℃。通过在线ftir测量acn浓度,并调节acn的添加速率,使得反应混合物中的acn浓度保持恒定在0.8±0.1%(w/w),直到全部acn已经加入到反应中。由于转化,当acn浓度已降至<100ppm后停止反应。在反应结束时,每次运行中的丙烯酰胺(acm)浓度为≥51%(w/w)。实施例2:将水和60gacn置于反应器中。调节水的量,使水+生物催化剂的总量为2447g。在独立运行中使用三种不同形式的生物催化剂:(i)含有玫瑰色红球菌ncimb41164的发酵液。水含量:91.8%(w/w)。(ii)浓缩物,其来自(i)已通过离心浓缩的发酵液。水含量:85.3%(w/w)。(iii)通过喷雾干燥来自(ii)的浓缩物获得的干粉。干粉的残余水含量:6.8%(w/w)。喷雾干燥在115℃气体入口温度和60℃气体出口温度下操作。将生物催化剂加入到反应器中,由此开始反应。在反应期间,加入1493g额外的丙烯腈,使得最终的总反应批料大小为4000g。在反应期间温度保持恒定在26℃。通过在线ftir测量acn浓度,并调节acn的加入速率以控制反应混合物中的acn浓度。在反应的第一个小时期间,acn浓度保持恒定在2.0%±0.15%(w/w),此后,保持恒定在0.8%±0.15%(w/w)直到全部acn已经加入到反应中。由于转化,当acn浓度已降至<100ppm后停止反应。在反应结束时,每次运行中的acm浓度为≥50%(w/w)。实施例3:将水和60gacn置于反应器中。调节水的量,使水+生物催化剂的总量为2447g。在独立运行中使用两种不同形式的生物催化剂:(i)浓缩物,其含有已通过离心浓缩的玫瑰色红球菌ncimb41164的发酵液。水含量:81%(w/w)。(ii)通过冷冻干燥来自(i)的浓缩物获得的干粉。干粉的残余水含量:6.8%(w/w)。将生物催化剂加入到反应器中,由此开始反应。在反应期间,加入1493g额外的丙烯腈,使得最终的总反应批料大小为4000g。在反应期间温度保持恒定在26℃。通过在线ftir测量acn浓度,并调节acn的加入速率以控制反应混合物中的acn浓度。在反应的第一个小时期间,acn浓度保持恒定在2.0%±0.15%(w/w),此后,保持恒定在0.8%±0.15%(w/w)直到全部acn已经加入到反应中。由于转化,当acn浓度已降至<100ppm后停止反应。在反应结束时,每次运行中的acm浓度为≥50%(w/w)。表1显然,在与腈化合物接触之前通过干燥步骤预处理的微生物具有腈水合酶/酰胺酶活性的最高值,所述腈化合物随后由所述微生物进行生物转化。考虑到在每个反应(设置)中使用几乎相同量的生物催化剂(通过使用的每种生物催化剂形式、即发酵液/浓缩物/喷雾干燥/冷冻干燥的腈水合酶活性而测定)的事实,显然干燥步骤,即在将生物催化剂与腈化合物接触之前使生物催化剂进行干燥步骤,可显著影响副产物丙烯酸的量。这意味着由于干燥步骤,酰胺酶活性降低到这种干燥的微生物产生具有较少丙烯酸副产物的酰胺化合物的程度,这从最右侧栏中可见。总之,由于在不同设置之间的反应参数保持相同,显然减少丙烯酸量的改进可归因于干燥步骤。实施例4:通过在christalpha2-4lscplus实验室冷冻干燥器中冷冻干燥浓缩的发酵液得到冻干粉末。浓缩物首先在-20℃下冷冻过夜,随后干燥。在干燥过程中,搁板温度为-25℃,冷凝器温度为-82℃,并且腔压力为0.25mbar。将水和18gacn置于反应器中。调节水的量使得水+生物催化剂的总量为1835g。在独立运行中使用两种不同形式的生物催化剂:(i)含有玫瑰色红球菌j1的发酵液。水含量:96.1%(w/w)。(ii)将(i)通过离心浓缩至含水量为83.6%(w/w)并冷冻干燥浓缩物而获得的干粉。将生物催化剂加入到反应器中,由此开始反应。在反应期间,加入1147g额外的丙烯腈,使得最终的总反应批量大小为3000g。在反应期间温度保持恒定在23℃。通过在线ftir测量acn浓度,并且调节acn的添加速率,使得反应混合物中的acn浓度保持恒定在1.0±0.1%(w/w),直到将全部acn加入到反应中。由于转化,当acn浓度已降至<100ppm后停止反应。在反应结束时,每次运行中的acm浓度为≥51%(w/w)。实施例5:按照上述实施例4进行实验,除了在反应期间反应混合物中的acn浓度控制在0.3±0.1%(w/w)。实施例4-5的结果如下表2中所示。表2实施例6:喷雾干燥的生物催化剂的活化在离心管中称出喷雾干燥的生物催化剂并悬浮在30ml缓冲液中用于本文公开的活化步骤。除非另有说明,所述缓冲液是100mm磷酸盐缓冲液,ph7.0。生物催化剂在室温下缓冲处理0.5h。然后将生物质(生物催化剂)悬浮液转移到反应器中并进一步温育1h。在将该生物质悬浮液加入到反应器中后,用水冲洗离心管,并将溶剂也转移到反应器中。该水的量被认为是称重到反应器中的水。实施例7:生物转化的一般方案丙烯腈的水合通常在搅拌釜反应器(rpm=250,体积v=4l)中进行,其具有用于冷却的外部循环回路。为此目的,将2.4l水填充在反应器以及生物催化剂中。将生物质作为喷雾干燥的玫瑰色红球菌细胞加入,其已经预先悬浮在水中。如本文所述,根据本文公开的活化步骤,喷雾干燥的细胞也可以直接悬浮在缓冲液中。为了开始反应,使用过程控制系统将丙烯腈加入搅拌釜反应器中。通过使用在线傅里叶变换红外(ftir)分析来调节丙烯腈浓度恒定在0.5至5w/w%,所述ftir直接与过程控制单元(labview)相通。反应温度恒定保持在20~29℃。在加入1553g丙烯腈之后停止丙烯腈的用量。在残余丙烯腈完全转化之后,即当达到<100ppm的残余acn浓度并获得52w/w%丙烯酰胺时,反应完成。实施例8:通过hplc测定所得丙烯酰胺水溶液中的丙烯酸、丙烯酰胺、丙烯酸和丙烯腈的浓度应用以下条件以测定丙烯酰胺、丙烯酸和丙烯腈的含量:梯度:时间[min]a[%]b[%]流速[ml/min]0.090.010.01.008.090.010.01.00基质:发酵液,生物转化混合物样品通过0.22μm过滤分析:保留时间[min]丙烯酰胺3.29丙烯酸3.91丙烯腈4.35实施例9喷雾干燥的批次ch10的玫瑰色红球菌(ncimb41164)用于丙烯腈到丙烯酰胺的生物转化反应。生物转化反应根据实施例7的方法进行。在运行1(图1所示)中,使用3.36g重悬于水中的生物催化剂(在生物转化开始时加入2.4g生物催化剂,1h后加入0.96g生物催化剂)。在运行2(图2所示)中,使用3.36g根据本发明的用100mm磷酸盐缓冲液(ph7.0)活化的生物催化剂(在生物转化开始时加入2.4g生物催化剂,在1h后加入0.96g生物催化剂)。根据实施例6进行活化。在运行3(图3所示)中,使用3.36g重悬于水中的生物催化剂(在生物转化开始时加入2.4g生物催化剂,在1h后加入0.96g生物催化剂),但是在加入生物催化剂之前,将在运行2的活化步骤中使用的相同量的磷酸盐缓冲液直接加入到反应器中。在运行4(图4所示)中,使用1.8g生物催化剂(在生物转化开始时加入1.8g生物催化剂),其已经根据实施例6用100mm磷酸盐缓冲液(ph7.0)缓冲处理。结果概述于下表中。从运行2(图2)可以看出,使用磷酸盐缓冲液的干燥生物催化剂的活化将总反应时间从13.78h(运行1,图1)降低至2.31h。运行3(图3)显示,与运行1相比,向反应混合物中加入磷酸盐缓冲液而不活化干燥的生物催化剂,对反应时间几乎没有影响。运行4(图4)表明,如果干燥的生物催化剂使用磷酸盐缓冲液活化,生物催化剂的量可以从3.36g降低至1.8g,而总反应时间仍小于在运行1中使用3.36g非缓冲液处理的生物催化剂。实施例10:喷雾干燥的批次v3的玫瑰色红球菌(ncimb41164)用于丙烯腈到丙烯酰胺的生物转化反应。生物转化反应根据实施例7的方法进行。在运行5(如图5所示)中,使用1.29g重悬于水中的生物催化剂(在生物转化开始时加入0.92g生物催化剂,1h后加入0.37g生物催化剂)。在运行6(图6所示)中,使用1.29g生物催化剂(在生物转化开始时加入0.92g生物催化剂,在1h后加入0.37g生物催化剂),其如本文公开的用100mm磷酸盐缓冲液(ph8.0)活化。在运行7(图7所示)中,使用1.29g生物催化剂(在生物转化开始时加入0.92g生物催化剂,在1h后加入0.37g生物催化剂),其用100mm柠檬酸盐缓冲液(ph7.0)活化。结果概述于下表中。从运行6和7(图6和7)可以看出,分别用磷酸盐缓冲液(100mm,ph8.0)和柠檬酸盐缓冲液(100mm,ph7.0)对批次v3的玫瑰色红球菌(ncimb41164)进行活化步骤,导致总反应时间从20h后仍未完全转化显著减少到4.39h和7.25h后完全转化。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 噻唑橙苯乙烯类化合物作为G-四链体核酸荧光探针的制作方法与工艺
- 一种氟原子取代的氰基异佛尔酮苯乙烯化合物、晶体化合物及制备方法与流程
- 一种制备反式二苯基乙烯类化合物的方法与流程
- 一种二苯乙烯和二苯乙烷类化合物的磷酰氨基酸及其衍生物的制备与用途的制造方法与工艺
- 制备具有较少丙烯酸的酰胺化合物的手段和方法与流程
- 酸存在下丙烯酸系化合物的SET‑LRP聚合的制造方法与工艺
- 一种二官能烯基苯氧基化合物及其制备方法和利用其改性的可溶性双马来酰亚胺树脂与流程
- 二苯乙烯型化合物、其中间体、制备方法和应用与流程
- 一种基于四苯乙烯的荧光化合物及其制备方法和应用与制造工艺
- 基于二苯乙烯单元的树枝状化合物及有机电致发光器件的制造方法与工艺