苯并菲癸烷氧基桥连异辛烷氧基苯基卟啉二元化合物盘状液晶材料的合成方法与流程
本发明涉及一种苯并菲癸烷氧基桥连异辛烷氧基苯基卟啉二元化合物盘状液晶材料的合成方法。
背景技术:
盘状液晶主要有以苯环、苯并菲、六苯并蔻为盘状液晶中心核等种类。以单一的苯环为盘状中心核的盘状液晶,其自组装成的柱状相的电荷载流子迁移率会比较低。因此,自组装高度有序的柱状相盘状液晶并且具有较高的载流子迁移率的盘状液晶分子成为了研究热点。苯并菲是由三个苯环对称并环而形成的分子,该分子的所有原子共面,而且具有较高的自组装性,其和其衍生物有着易合成和易加工的特点,因此是目前较瞩目的材料之一。
苯并菲化合物最早是在苯的热裂解产物中被发现并且被分离出来的,而且由schultz首先称其为“苯并菲”(Triphenylene)。在1907年的时候,由Mannich第一次合成了苯并菲,并且确定了其化学结构式。直至1960年的时候,Buess和Lawsons在他们的综述里说明了苯并菲的各种合成方法,并且说明苯并菲可能存在的特殊光学和电学性能。此后,苯并菲类衍生物以及类似稠环类衍生物的合成方法、性质和结构特征的报道不断出现,因此,苯并菲类衍生物的研究将会一直备受研究者们关注。
在盘状液晶中,苯并菲作为一种常见的材料,因其具有良好的光化学及热稳定性、原料易得、产品易于提纯、结构丰富多变以及在纵轴具有较高的电荷传输速率等优点,因此是首选的给体单元;而卟啉在可见光区有强吸收、光化学及热稳定性好、且合成方法成熟,具有良好的液晶性质,因此可作为良好的受体单元。卟啉在可见光区有强吸收、光化学及热稳定性好、且合成方法成熟,具有良好的液晶性质可作为良好的电子給体单元,本发明通过设计并合成含有电子给体(D)-桥(B)-受体(A)结构的盘状液晶二元化合物,这类化合物可以应用在有机光伏材料、液晶材料、有机太阳能电池、有机发光二极管等分子器件。
技术实现要素:
本发明的目的是提供一种苯并菲癸烷氧基桥连异辛烷氧基苯基卟啉二元化合物盘状液晶材料的合成方法。
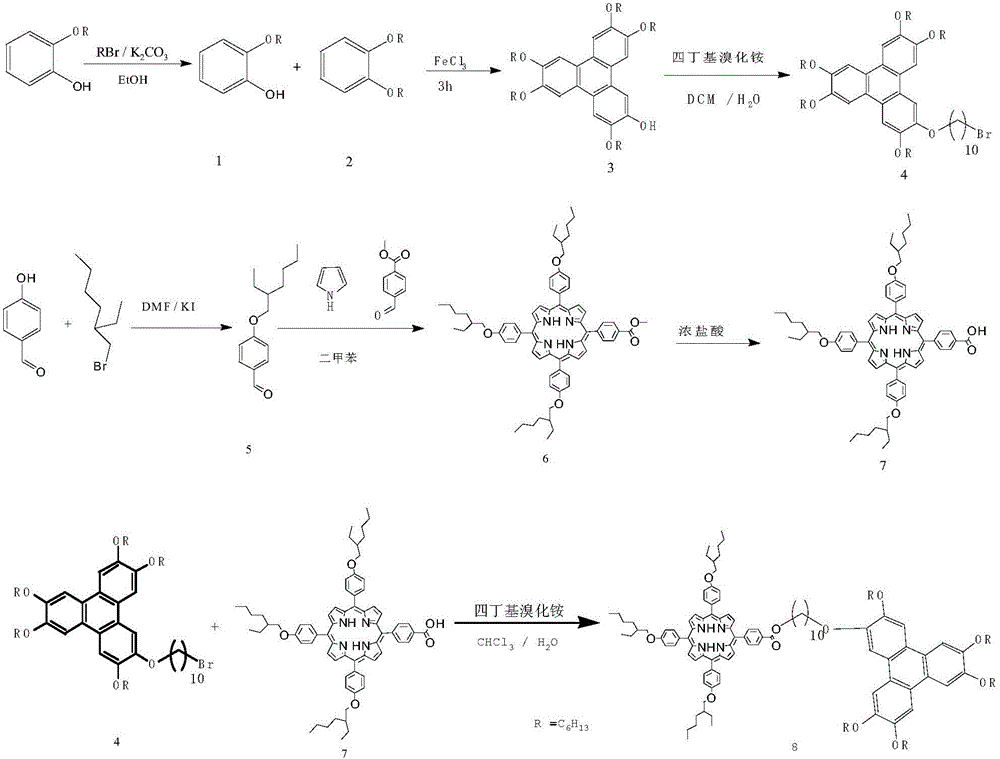
本发明合成路线分为以下三个部分:第一部分,首先将邻二己氧基苯和2-己氧基苯酚在三氯化铁的氧化作用下发生偶联反应生成单羟基五己氧基苯并菲;其次,以单羟基五己氧基苯并菲、1,10-二溴癸烷为主要原料合成含一个ω-溴支链的烷氧基苯并菲;第二部分是以对羟基苯甲醛、1-溴代异辛烷为主要原料合成对异辛烷氧基苯甲醛,然后与对甲酰基苯甲酸甲酯、吡咯在二甲苯中合成卟啉酯。最后,将得到的卟啉酯水解、酸化得到卟啉酸;第三部分是将上述两部分得到的中间体通过相转移反应合成一系列烷氧基桥连卟啉-苯并菲二元化合物。
苯并菲作为一种常见的材料,因其具有良好的光化学及热稳定性、原料易得、产品易于提纯、结构丰富多变以及在纵轴具有较高的电荷传输速率等优点,而卟啉在可见光区有强吸收、光化学及热稳定性好、且合成方法成熟,具有良好的液晶性质,本发明通过设计并合成含有电子给体(D)-桥(B)-受体(A)结构的盘状液晶二元化合物,这类化合物可以应用在有机光伏材料、液晶材料、有机太阳能电池、有机发光二极管等分子器件。
附图说明
图1为本发明苯并菲癸烷氧基桥连异辛烷氧基苯基卟啉二元化合物盘状液晶材料结构式。
图2为本发明合成路线的化学反应方程式。
图中:R=C6H13。
具体实施方式
实施例:
实施例中所使用的化学试剂和溶剂均为分析纯。
(1)邻己烷氧基苯酚(化合物1)的合成:
取20克邻苯二酚、89.9克1-溴代正己烷、73.5克无水碳酸钾、6.0克碘化钾和250毫升无水乙醇,85℃下回流反应60小时后,室温下抽滤,滤液经旋转蒸发仪除去溶剂之后,在0.5mmHg的减压蒸馏情况下收集84℃的馏分,得到48克无色油状液体即化合物1,产率为96%。Bp:106±3℃,IR(KBr)νmax(cm-1):1260,930;1H NMR(300MHz,CDCl3)δ:6.89(s,4H),3.99(t,J=6.9Hz,4H),1.83-1.76(m,J=6.9Hz,4H),1.49-1.31(m,12H),0.9(t,J=6.9Hz,6H)。
(2)邻二己烷氧基苯(化合物2)的合成:
取50克邻苯二酚、75克1-溴代正己烷、100克无水碳酸钾、3.8克碘化钾和500毫升无水乙醇,85℃回流反应12小时后,室温下抽滤,滤液经旋转蒸发仪除去溶剂之后,0.5mmHg的减压蒸馏情况下收集140-143℃的馏分,得到25.5克无色油状液体即化合物2,产率为29%。Bp 255±3℃,IR(KBr)νmax(cm-1):1250,939;1H NMR(300MHz,CDCl3)δ:6.95-6.82(m,4H),5.68(s,1H),4.02(t,J=6.9Hz,2H),1.83-1.76(m,2H),1.48-1.31(m,6H),0.91(t,J=6.9Hz,3H)。
(3)单羟基-五己氧基苯并菲(化合物3)的合成:
取4.44克化合物1和1.56克化合物2溶于60毫升二氯甲烷溶液中经恒压滴液漏斗滴加至80毫升含有12.96克无水三氯化铁和8毫升硝基甲烷的二氯甲烷溶液中,30分钟滴加完毕;然后将反应的温度保持在0℃-3℃范围内恒温反应3小时后,加入50毫升无水甲醇和25毫升水终止反应,反应的混合物用15毫升浓度为2mol/L稀盐酸洗涤两次,用15毫升饱和食盐水洗涤一次,分出有机层,加入无水硫酸钠干燥除水后,经旋转蒸发仪除去溶剂,得到的粗产物用200-300目硅胶柱层析提纯(淋洗液是乙酸乙酯/石油醚体积比为1:30-1:15),得到2.14克棕黄固体即化合物3,产率为36%。Mp 47.7-50.1℃,IR(KBr)νmax(cm-1):3040,1240,837;1H NMR(400MHz,CDCl3)δ:7.96(s,1H),7.83(s,3H),7.82(s,1H),7.77(s,1H),5.91(s,1H),4.31-4.19(m,10H),1.98-1.90(m,10H),1.59-1.40(m,30H),0.96-0.92(m,15H)。
(4)溴代癸氧基-五己氧基苯并菲(化合物4)的合成:
取1.23克化合物3、2.97克1,10-二溴癸烷、0.43克氢氧化钾和0.16克四丁基溴化铵,加入到10毫升二氯甲烷和6.5毫升水的混合物中,氮气氛围下室温搅拌24小时,用30毫升水洗涤两次,用15毫升饱和食盐水洗涤一次,分出有机层,加入无水硫酸钠干燥除水后,经旋转蒸发仪除去溶剂,用200-300目硅胶柱层析提纯(淋洗液是乙酸乙酯/石油醚,体积比为1:30-1:20),得到无色固体(1.41克)即化合物4,产率为89%。Bp>300℃,IR(KBr)νmax(cm-1):1260,837;1H NMR(400MHz,CDCl3)δ:7.84(s,6H),4.23(t,J=6.8Hz,12H),3.40(t,J=6.8Hz,2H),1.98-1.91(m,12H),1.85(t,J=6.8Hz,2H),1.62-1.54(m,12H),1.42-1.35(m,30H),0.94(t,J=6.8Hz,15H)。
(5)对异辛烷氧基苯甲醛(化合物5)的合成:
将2.44克对羟基苯甲醛、6.725克溴代异辛烷、5.52克无水碳酸钾和20毫升经CaH2干燥的N,N-二甲基甲酰胺,在氮气氛围中80℃下反应12小时后反应结束,用200毫升水和20毫升二氯甲烷萃取三次分出有机层,用无水硫酸钠进行干燥除水,经旋转蒸发仪除去溶剂,粗产物用200-300目硅胶柱层析提纯(洗脱剂为二氯甲烷:石油醚体积比=1:5-1:2),得到5.75克淡黄色液体即化合物5,产率为98%;Bp>300℃,IR(KBr)νmax(cm-1):1610,1380,1260,841;1H NMR(300MHz,CDCl3)δ:9.87(s,H),7.68(t,J=6.8Hz,2H),6.89(d,J=8.6Hz,2H),3.99(t,J=6.9Hz,2H),1.83-1.76(m,J=6.9Hz,4H),0.96-1.31(m,J=5.6Hz,10H)。
(6)5-对苯甲酸甲酯基-10,15,20-三对异辛烷氧基苯基卟啉(化合物6)的合成:
取5.88克化合物5、1.198克对酰基苯甲酸甲酯和1.8495克间硝基苯甲酸,用32毫升二甲苯溶液充分溶解后,通过恒压滴液漏斗滴加32毫升二甲苯溶液稀释的1.91克吡咯10分钟,140℃下回流反应3.5小时后反应结束,通过蒸馏除去二甲苯溶剂,得到黑色粘稠物,用200-300目硅胶柱层析提纯(淋洗液是二氯甲烷/石油醚体积比为1:2-1:1),最后用二氯甲烷/无水甲醇体积比为1:1进行重结晶,得紫色固体即化合物6,产率为32.3%;Mp 125.1-126.2℃,IR(KBr)νmax(cm-1):1720,1350,1240,803;1H NMR(400MHz,CDCl3)δ8.90(d,J=6.2Hz,6H),8.76(d,J=4.7Hz,2H),8.44(d,J=8.2Hz,2H),8.30(d,J=8.1Hz,2H),8.16-8.05(m,6H),7.29(d,J=8.5Hz,6H),4.15(d,J=5.6Hz,6H),4.11(s,3H),1.93(dt,J=6.1Hz,3H),1.77-1.54(m,12H),1.51-1.35(m,12H),1.06(dd,9H),1.00(t,J=6.8Hz,9H),-2.74(s,2H)。
(7)5-对苯甲酸基-10,15,20-三对异辛烷氧基苯基卟啉(化合物7)的合成:
取1.4克化合物6和5毫升的1.79克氢氧化钾水溶液在25毫升的四氢呋喃溶液中充分溶解后,加入5毫升的无水甲醇,70℃下回流反应3小时,冷却至室温后加入浓盐酸调节pH至2-3之间,抽滤得到绿色固体5-对苯甲酸基-10,15,20-三对异辛烷氧基苯基卟啉即化合物7,产率为65%;Mp 176.3-177.5℃;IR(KBr)νmax(cm-1):1710,1490,1260,801.1H NMR(400MHz,CDCl3)δ8.90(d,J=6.2Hz,6H),8.76(d,J=4.7Hz,2H),8.44(d,J=8.2Hz,2H),8.30(d,J=8.1Hz,2H),8.16-8.05(m,6H),7.29(d,J=8.5Hz,6H),4.15(d,J=5.6Hz,6H),4.11(s,1H),1.93(dt,J=6.1Hz,3H),1.77-1.54(m,12H),1.51-1.35(m,12H),1.06(dd,9H),1.00(t,J=6.8Hz,9H),-2.72(s,2H)。
(8)苯并菲癸烷氧基桥连异辛烷氧基苯基卟啉(化合物8)的合成:
取0.108克取化合物7、0.127克化合物4、0.0027克碳酸钾和0.16克四丁基溴化铵,加入到6毫升三氯甲烷和12毫升水的混合物中,氮气氛围下80℃回流反应36小时;用三氯甲烷萃取分出水层和有机层,有机层经无水硫酸钠干燥后旋干,用200-300目硅胶柱层析提纯(淋洗液是乙酸乙酯/石油醚体积比为1:10-1:5),得到0.372克紫红色固体即化合物8,产率88%;Mp 50.8±3℃,IR(KBr)νmax(cm-1):1360,1240,803;1H NMR(400MHz,CDCl3)δ8.89(s,8H),8.77(s,2H),8.44(d,J=7.6Hz,2H),8.30(d,J=7.5Hz,2H),8.10(d,J=8.1Hz,6H),7.82(s,6H),7.28(d,J=7.5Hz,6H),4.51(s,2H),4.18(dd,J=34.2,5.8Hz,18H),1.92(s,22H),1.42(d,J=21.3Hz,44H),1.27-0.76(m,36H),-2.75(s,2H).Elemental analysis calcd for C127H168N4O11(1925):C,79.18,H,8.81,N,2.89,Found:C,79.17,H,8.79,N,2.91。
- 还没有人留言评论。精彩留言会获得点赞!
- 苯并菲己烷氧基桥连异辛烷氧基苯基卟啉金属Zn配合物的合成方法
- 苯并菲十二烷氧基桥连十二烷氧基苯基卟啉金属Zn配合物的合成方法
- 苯并菲己烷氧基桥连十二烷氧基苯基卟啉金属Zn配合物的合成方法
- 一种Meso-四(3,4-二羟基苯基)卟啉锌的制备方法
- 碱性氨基酸修饰氨基四苯基卟啉化合物的新用图
- 使用除草4-氨基-3-氯-6-(4-氯-2-氟-3-甲氧基苯基)吡啶-2-羧酸防治水生杂草的方法
- 苯并菲己烷氧基桥连十二烷氧基苯基卟啉金属Ni配合物的合成方法
- 一种Meso-四(3,4-二羟基苯基)卟啉钴的制备方法
- 沙格雷酯中间体2-[2-(3-甲氧基苯基)乙基]苯酚的合成方法
- 一种基于一氨基苯基取代卟啉纳米材料的二氧化氮气敏传感器的制造方法
- 取代甲氧基烷氧基苯基烷基衍生物作为防腐剂的用途、保藏方法、化合物和组合物与流程
- 苯并菲己烷氧基桥连异辛烷氧基苯基卟啉二元化合物盘状液晶材料的合成方法与流程
- 苯并菲癸烷氧基桥连异辛烷氧基苯基卟啉二元化合物盘状液晶材料的合成方法与流程
- 苯并菲癸烷氧基桥连异辛烷氧基苯基卟啉金属Ni配合物的合成方法与流程
- 苯并菲癸烷氧基桥连十二烷氧基苯基卟啉二元化合物盘状液晶材料的合成方法与流程
- 苯并菲癸烷氧基桥连十二烷氧基苯基卟啉金属Zn配合物的合成方法与流程
- 苯并菲癸烷氧基桥连异辛烷氧基苯基卟啉金属Zn配合物的合成方法与流程
- 苯并菲十二烷氧基桥连十二烷氧基苯基卟啉二元化合物盘状液晶材料的合成方法与流程
- 苯并菲十二烷氧基桥连异辛烷氧基苯基卟啉金属Ni配合物的合成方法与流程
- 苯并菲十二烷氧基桥连异辛烷氧基苯基卟啉二元化合物盘状液晶材料合成方法与流程
- 沙格雷酯中间体2-[2-(3-甲氧基苯基)乙基]苯酚的合成方法
- 一种4,5,6-三氯-n-(2,3-二氟苯基)-2-(3-(三氟甲基)苯氧基)烟酰胺合成方法
- 一种甲基苯基乙烯基乙氧基硅烷的制备方法
- (2e, 6e)-2-(3,5-二甲氧基苯基亚甲基)-6-(4-氯苯基亚甲基)环己酮及其衍生物的新应用
- 一种基于3,4-二甲氧基苯基的取代苯甲酰胺新化合物、制备方法及用图
- 一种n-{[2,5-二乙氧基-4-[3-(3-甲氧基-苯基)-脲基甲基]-苯基}-甲磺酰胺新化合物 ...的制作方法
- 一种n-{[2,5-二乙氧基-4-[3-(4-甲氧基-苯基)-脲基甲基]-苯基}-甲磺酰胺新化合物 ...的制作方法
- 杀真菌的3-{苯基[(杂环基甲氧基)亚氨基]甲基}-杂环衍生物的制作方法
- 一种3-(2-硝基苯甲氧基)-1-(4-氯苯基)-1h-吡唑的绿色合成工艺的制作方法
- 杀真菌的3-{苯基[(杂环基甲氧基)亚氨基]甲基}-杂环衍生物的制作方法
- 苯并菲癸烷氧基桥连异辛烷氧基苯基卟啉金属Zn配合物的合成方法与流程
- 苯并菲十二烷氧基桥连十二烷氧基苯基卟啉二元化合物盘状液晶材料的合成方法与流程
- 苯并菲十二烷氧基桥连异辛烷氧基苯基卟啉金属Ni配合物的合成方法与流程
- 苯并菲十二烷氧基桥连异辛烷氧基苯基卟啉二元化合物盘状液晶材料合成方法与流程
- 苯并菲己烷氧基桥连异辛烷氧基苯基卟啉金属Ni配合物的合成方法与流程
- 苯并菲十二烷氧基桥连异辛烷氧基苯基卟啉金属Zn配合物的合成方法与流程
- 苯并菲十二烷氧基桥连十二烷氧基苯基卟啉金属Ni配合物的合成方法与流程
- 苯并菲癸烷氧基桥连十二烷氧基苯基卟啉金属Ni配合物的合成方法与流程
- 苯并菲癸烷氧基桥连异辛烷氧基苯基卟啉金属Zn配合物的合成方法与流程
- N‑[4‑(烷氧基)‑苯磺酰基]‑5‑芳基‑恶唑‑2‑硫酮类神经氨酸酶抑制剂的制造方法与工艺
- 苯并菲十二烷氧基桥连异辛烷氧基苯基卟啉金属Ni配合物的合成方法与流程
- 苯并菲十二烷氧基桥连异辛烷氧基苯基卟啉二元化合物盘状液晶材料合成方法与流程
- 苯并菲己烷氧基桥连异辛烷氧基苯基卟啉金属Ni配合物的合成方法与流程
- 苯并菲十二烷氧基桥连异辛烷氧基苯基卟啉金属Zn配合物的合成方法与流程
- 苯并菲十二烷氧基桥连十二烷氧基苯基卟啉金属Ni配合物的合成方法与流程
- 苯并菲癸烷氧基桥连十二烷氧基苯基卟啉金属Ni配合物的合成方法与流程
- 苯并菲癸烷氧基桥连异辛烷氧基苯基卟啉金属Zn配合物的合成方法与流程
- 苯并菲十二烷氧基桥连异辛烷氧基苯基卟啉金属Zn配合物的合成方法与流程
- 苯并菲己烷氧基桥连异辛烷氧基苯基卟啉金属Zn配合物的合成方法与流程
- 苯并菲癸烷氧基桥连异辛烷氧基苯基卟啉金属Zn配合物的合成方法与流程
- 苯并菲十二烷氧基桥连十二烷氧基苯基卟啉二元化合物盘状液晶材料的合成方法与流程
- 苯并菲十二烷氧基桥连异辛烷氧基苯基卟啉金属Ni配合物的合成方法与流程
- 苯并菲十二烷氧基桥连异辛烷氧基苯基卟啉二元化合物盘状液晶材料合成方法与流程
- 苯并菲己烷氧基桥连异辛烷氧基苯基卟啉金属Ni配合物的合成方法与流程
- 苯并菲十二烷氧基桥连异辛烷氧基苯基卟啉金属Zn配合物的合成方法与流程
- 苯并菲十二烷氧基桥连十二烷氧基苯基卟啉金属Ni配合物的合成方法与流程
- 苯并菲癸烷氧基桥连十二烷氧基苯基卟啉金属Ni配合物的合成方法与流程
- 苯并菲癸烷氧基桥连异辛烷氧基苯基卟啉金属Zn配合物的合成方法与流程
- 苯并菲十二烷氧基桥连异辛烷氧基苯基卟啉金属Zn配合物的合成方法与流程
- 苯并菲癸烷氧基桥连十二烷氧基苯基卟啉二元化合物盘状液晶材料的合成方法与流程
- 苯并菲癸烷氧基桥连十二烷氧基苯基卟啉金属Zn配合物的合成方法与流程
- 苯并菲癸烷氧基桥连异辛烷氧基苯基卟啉金属Zn配合物的合成方法与流程
- 苯并菲十二烷氧基桥连十二烷氧基苯基卟啉二元化合物盘状液晶材料的合成方法与流程
- 苯并菲十二烷氧基桥连异辛烷氧基苯基卟啉金属Ni配合物的合成方法与流程
- 苯并菲十二烷氧基桥连异辛烷氧基苯基卟啉二元化合物盘状液晶材料合成方法与流程
- 苯并菲己烷氧基桥连异辛烷氧基苯基卟啉金属Ni配合物的合成方法与流程
- 苯并菲十二烷氧基桥连异辛烷氧基苯基卟啉金属Zn配合物的合成方法与流程
- 苯并菲十二烷氧基桥连十二烷氧基苯基卟啉金属Ni配合物的合成方法与流程
- 苯并菲癸烷氧基桥连十二烷氧基苯基卟啉金属Ni配合物的合成方法与流程