一种以2,3‑二巯基丙磺酸钠同时作为稳定剂和硫源制备CdTe/CdS量子点的方法与流程
本发明涉及纳米材料制备技术领域,具体涉及一种以2,3-二巯基丙磺酸钠同时作为稳定剂和硫源制备CdTe/CdS量子点的方法。
背景技术:
量子点是一种直径在1-100nm之间的准零维纳米材料,具有特异的荧光性能。含镉量子点是最为常用的量子点之一,其量子产率高、光化学稳定性好,在光电材料、分子生物学及生物医学分析等领域显示出非常诱人的应用前景。CdTe QDs的量子产率高、吸收光谱宽、发射光谱窄且可调,是生物医学及光电信息中常用的纳米材料。但是CdTe QDs依然存在着抗光漂能力差且易受环境杂质干扰的问题,限制其在生化检测、生物成像及生物效应等生物医学领域的研究。
我们课题组以NAC为配体先后合成了NAC修饰的CdTe QDs与Zn2+:CdTe QDs(Zhao D et al,J.Mater.Chem.,2011,21,13365),在量子产率、抗光漂能力及减小生物毒性方面取得了一定的进展,但是仍然很难满足生物医学应用的要求;我们也曾以NAC为硫源和稳定剂,采用一步法合成了CdTe/CdS QDs(Zhao D et al,J.Phys.Chem.C,2009,113,1293-1300),具有很好的抗光漂能力,但是其反应时间长、具有较宽的半峰宽且在可见光范围内难以实现包壳。有课题组以2,3-二巯基丁二酸同时作为硫源与稳定剂先后合成了CdS QDs与AgS QDs(Sevinc E et al,J.Mater.Chem.,2012,22,5137;Hocaoglu I et al,Nanoscale,2014,6,11921-11931)。许多研究工作表明,相比于单巯基配体,双巯基配体作为稳定剂合成的量子点具有更好的稳定性。Susumu等对单基配体与多巯基配体修饰合成的量子点性能进行了系统的比较,证明多巯基配体修饰的量子点具有更好的抗光漂能力(Susumu K et al,J.Am.Chem.Soc.,2011,133,9480-9496)。但Hyeon等人认为双巯基修饰的量子点在性能上并没有绝对的优势(Ling D et al,Nano Today,2014,9,457-477)。
技术实现要素:
针对上述现有技术存在的问题,本发明提供了一种以2,3-二巯基丙磺酸钠同时作为稳定剂和硫源制备CdTe/CdS量子点的方法,该方法使用DMPS做修饰配体和硫源,无需氮气氛围,简化了合成操作步骤,缩短了反应时间,且可得到稳定性更好的CdTe/CdS QDs。
实现本发明上述目的所采用的技术方案为:
一种以2,3-二巯基丙磺酸钠同时作为稳定剂和硫源制备CdTe/CdS量子点的方法,包括如下步骤:
1)将氯化镉和N-乙酰-L-半胱氨酸溶解于去离子水中,得到混合溶液A,用氢氧化钠溶液调节混合溶液A的pH值至9.0,再加入亚碲酸钠与还原剂硼氢化钠,其中氯化镉、N-乙酰-L-半胱氨酸、亚碲酸钠和硼氢化钠的摩尔比为1:2.4:0.2:1.8,搅拌均匀后转移至水热反应釜中,在200℃下反应15min-30min,得到CdTe量子点粗品;
2)将CdTe量子点粗品加入到足量的异丙醇中,搅拌均匀,得到量子点浑浊液,将量子点浑浊液离心、洗涤4次,将所得固体物进行真空干燥,得到纯化、干燥的CdTe量子点,置于4℃下保存备用;
3)将氯化镉和2,3-二巯基丙磺酸钠溶解于去离子水中,得混合溶液B,用氢氧化钠溶液调节混合溶液B的pH值至9.0,再加入CdTe量子点溶液,其中CdTe量子点、氯化镉与2,3-二巯基丙磺酸钠的摩尔比为1:500:1200,搅拌均匀后转移至水热反应釜中,在200℃下反应15min-30min,将反应后所得的混合物用超滤离心管超滤4次,即得到CdTe/CdS量子点。
优选的,步骤1)和步骤3)中所用的氢氧化钠溶液的浓度均为1mol/L。
优选的,步骤2)中,每次离心时的转速为8000r/min,离心时间为10min。
优选的,步骤2)中,真空干燥的温度为60℃,时间为24h。
优选的,步骤2)中,CdTe量子点粗品与异丙醇的体积比为1:3。
本发明与现有技术相比,其有益效果和优点在于:
1、该方法简单易操作,通过两步水热合成就可以得到CdTe/CdS QDs,且合成过程中不需要充氮气进行保护,合成条件变得简单易控制,从而大大简化了操作步骤,节省了人力和物力(即节省了成本),提高了合成效率。
2、该方法所需的原料便宜易得,所需的设备均为常规设备,价格低廉。
3、与常规的CdTe QDs相比,该方法制备的CdTe/CdS QDs具有以下优点:1)更好的抗光漂能力;2)更好的抗盐稳定性;3)更宽的pH适用范围;4)高温下荧光基本不会自猝灭;5)有更长的荧光寿命。稳定性的提高对于量子点在生物成像及生物传感方面有着重要的作用;更宽的pH适用范围也会拓宽量子点在细胞或活体中的应用范围,在生物医学分析与成像方面,特别是在癌变等较低pH环境中具有重大意义;对温度的稳定性会使得量子点在生物传感方面有着更好的应用,而更长的荧光寿命能减少组织自发荧光的干扰。
4、该方法合成的CdTe/CdS QDs粒径小且均一,生物相容性较好,可广泛应用于生化检测、细胞及活体成像、靶向示踪等生物医学领域,也可用作光电转换和发光显示材料。
附图说明
图1为DMPS-CdTe/CdS QDs的透射电镜图(TEM图)。
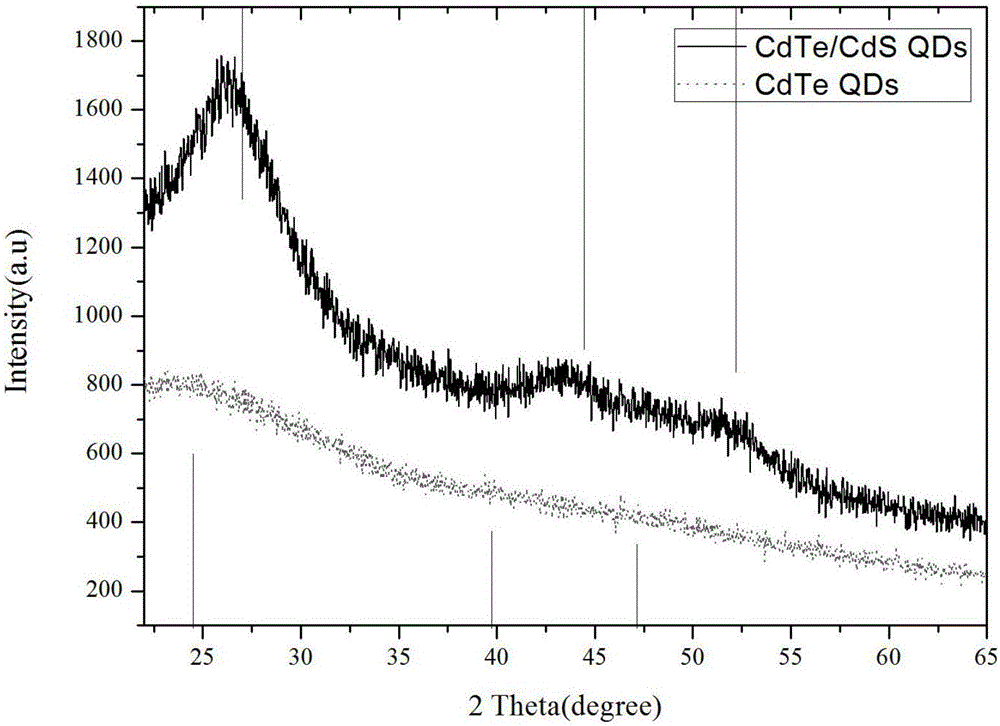
图2为DMPS-CdTe/CdS QDs的X射线衍射图谱(XRD图)。
图3为实施例1-4中不同反应时间合成的DMPS-CdTe/CdS QD的紫外-可见吸收光谱图。
图4为实施例1-4中不同反应时间合成的DMPS-CdTe/CdS QDs的荧光光谱图。
图5为DMPS-CdTe/CdS QDs、NAC-CdTe/CdS QDs、MSA-CdTe/CdS QDs、DMSA-CdTe/CdS QDs和NAC-CdTe QDs的抗光漂能力图。
图6为DMPS-CdTe/CdS QDs、NAC-CdTe/CdS QDs、MSA-CdTe/CdS QDs、DMSA-CdTe/CdS QDs和NAC-CdTe QDs的抗盐稳定性图。
图7为NAC-CdTe QDs与DMPS-CdTe/CdS QDs的热稳定性图。
图8为DMPS-CdTe/CdS QDs和NAC-CdTe/CdS QDs的pH稳定性图。
图9为不同发射波长下DMPS-CdTe/CdS QDs的荧光寿命表征图。
具体实施方式
下面结合具体实施例对本发明进行具体说明,具体实施例仅为优化的最佳合成条件。
实施例1
1、称取171mg氯化镉2.5水合物和294mgN-乙酰-L-半胱氨酸于三口烧瓶中,加入40ml去离子水,搅拌至完全溶解,得到混合溶液A,用1mol/L的氢氧化钠溶液调节混合溶液A的pH值至9.0,再加入33.2mg亚碲酸钠和51mg还原剂硼氢化钠,搅拌均匀后转移至水热反应釜中,在200℃下反应20min,得到CdTe量子点粗品;
2、将CdTe量子点粗品置于烧杯中,向烧杯中加入3倍体积的异丙醇,搅拌均匀,得到量子点浑浊液,将量子点浑浊液离心(离心条件:8000r/min,10min)、洗涤4次,将所得固体物转入真空干燥箱中,在60℃下真空干燥24h,得到纯化、干燥的CdTe量子点(CdTe QDs),标记为NAC-CdTe QDs,置于4℃下保存备用;
3、称取57mg氯化镉2.5水合物和127mg 2,3-二巯基丙磺酸钠(DMPS)于三口烧瓶中,得混合溶液B,加入40ml去离子水,搅拌至完全溶解,用1mol/L的氢氧化钠溶液调节混合溶液B的pH值至9.0,再取0.4mL混合溶液B,加入2.5mL 2×10-6mol/L CdTe量子点溶液,搅拌均匀后转移至水热反应釜中,在200℃下反应30min,将反应后所得的混合物用截留分子量为30KD的超滤离心管超滤4次,即得到CdTe/CdS量子点(CdTe/CdS QDs),标记为DMPS-CdTe/CdS QDs。
对本实施例制备的DMPS-CdTe/CdS QDs进行透射电镜扫描,其透射电镜图(TEM图)如图1所示,从图1中可以看出,DMPS-CdTe/CdS QDs具有较好的分散性,且粒径均一。
对本实施例制备的DMPS-CdTe/CdS QDs进行X射线衍射分析,其XRD图如图2所示,从图2中可以看出,CdTe/CdS QDs的2θ向大角方向移动,且显示有CdS的晶面结构出现,从而证明CdS壳的生成。
实施例2
1、同实施例1;
2、同实施例1;
3、称取57mg氯化镉2.5水合物和127mg 2,3-二巯基丙磺酸钠(DMPS)于三口烧瓶中,得混合溶液B,加入40ml去离子水,搅拌至完全溶解,用1mol/L的氢氧化钠溶液调节混合溶液B的pH值至9.0,再取0.4mL混合溶液B,加入2.5mL 2×10-6mol/L CdTe量子点溶液,搅拌均匀后转移至水热反应釜中,在200℃下反应15min,将反应后所得的混合物用截留分子量为30KD的超滤离心管超滤4次,即得到CdTe/CdS量子点(CdTe/CdS QDs)。
实施例3
1、同实施例1;
2、同实施例1;
3、称取57mg氯化镉2.5水合物和127mg 2,3-二巯基丙磺酸钠(DMPS)于三口烧瓶中,得混合溶液B,加入40ml去离子水,搅拌至完全溶解,用1mol/L的氢氧化钠溶液调节混合溶液B的pH值至9.0,再取0.4mL混合溶液B,加入2.5mL 2×10-6mol/L CdTe量子点溶液,搅拌均匀后转移至水热反应釜中,在200℃下反应20min,将反应后所得的混合物用截留分子量为30KD的超滤离心管超滤4次,即得到CdTe/CdS量子点(CdTe/CdS QDs)。
实施例4
1、同实施例1;
2、同实施例1;
3、称取57mg氯化镉2.5水合物和127mg 2,3-二巯基丙磺酸钠(DMPS)于三口烧瓶中,得混合溶液B,加入40ml去离子水,搅拌至完全溶解,用1mol/L的氢氧化钠溶液调节混合溶液B的pH值至9.0,再取0.4mL混合溶液B,加入2.5mL 2×10-6mol/L CdTe量子点溶液,搅拌均匀后转移至水热反应釜中,在200℃下反应25min,将反应后所得的混合物用截留分子量为30KD的超滤离心管超滤4次,即得到CdTe/CdS量子点(CdTe/CdS QDs)。
对实施例1-4合成的CdTe/CdS QDs(配制成溶液后分析)进行紫外-可见吸收光谱分析,所得的紫外-可见吸收光谱图如图3所示,从图3中可以看出,随着反应时间的增加,紫外吸收不断红移,说明量子点的粒径增大,量子点的壳在生长。
对实施例1-4合成的CdTe/CdS QDs(配制成溶液后分析)的荧光光谱分析,所得的荧光光谱图如图4所示,从图4中可以看出,随着反应时间的增加,量子点的荧光不断红移,说明该核壳结构量子点的波长在一定范围内可调。
对比例1
1、称取171mg氯化镉2.5水合物和294mgN-乙酰-L-半胱氨酸于三口烧瓶中,加入40ml去离子水,搅拌至完全溶解,得到混合溶液A,用1mol/L的氢氧化钠溶液调节混合溶液A的pH值至9.0,再加入33.2mg亚碲酸钠和51mg还原剂硼氢化钠,搅拌均匀后转移至水热反应釜中,在200℃下反应20min,得到CdTe量子点粗品;
2、将CdTe量子点粗品置于烧杯中,向烧杯中加入3倍体积的异丙醇,搅拌均匀,得到量子点浑浊液,将量子点浑浊液离心(离心条件:8000r/min,10min)、洗涤4次,将所得固体物转入真空干燥箱中,在60℃下真空干燥24h,得到纯化、干燥的CdTe量子点(CdTe QDs),置于4℃下保存备用;
3、称取57mg氯化镉2.5水合物和98mg N-乙酰-L-半胱氨酸(NAC)于三口烧瓶中,得混合溶液B,加入40ml去离子水,搅拌至完全溶解,用1mol/L的氢氧化钠溶液调节混合溶液B的pH值至9.0,再取0.4mL混合溶液B,加入2.5mL 2×10-6mol/L CdTe量子点,搅拌均匀后转移至水热反应釜中,在200℃下反应30min,即得到CdTe/CdS量子点(CdTe/CdS QDs),标记为NAC-CdTe/CdS QDs。
对比例2
1、称取171mg氯化镉2.5水合物和294mgN-乙酰-L-半胱氨酸于三口烧瓶中,加入40ml去离子水,搅拌至完全溶解,得到混合溶液A,用1mol/L的氢氧化钠溶液调节混合溶液A的pH值至9.0,再加入33.2mg亚碲酸钠和51mg还原剂硼氢化钠,搅拌均匀后转移至水热反应釜中,在200℃下反应20min,得到CdTe量子点粗品;
2、将CdTe量子点粗品置于烧杯中,向烧杯中加入3倍体积的异丙醇,搅拌均匀,得到量子点浑浊液,将量子点浑浊液离心(离心条件:8000r/min,10min)、洗涤4次,将所得固体物转入真空干燥箱中,在60℃下真空干燥24h,得到纯化、干燥的CdTe量子点(CdTe QDs),置于4℃下保存备用;
3、称取57mg氯化镉2.5水合物和0.2mL 3mol/L的2-巯基乙磺酸(MSA)溶液于三口烧瓶中,得混合溶液B,加40ml去离子水,搅拌至完全溶解,用1mol/L的氢氧化钠溶液调节混合溶液B的pH值至9.0,再取0.4mL混合溶液B,加入2.5mL 2×10-6mol/L CdTe量子点,搅拌均匀后转移至水热反应釜中,在200℃下反应30min,即得到CdTe/CdS量子点(CdTe/CdS QDs),标记为MSA-CdTe/CdS QDs。
对比例3
1、称取171mg氯化镉2.5水合物和294mgN-乙酰-L-半胱氨酸于三口烧瓶中,加入40ml去离子水,搅拌至完全溶解,得到混合溶液A,用1mol/L的氢氧化钠溶液调节混合溶液A的pH值至9.0,再加入33.2mg亚碲酸钠和51mg还原剂硼氢化钠,搅拌均匀后转移至水热反应釜中,加热至200℃后,反应20min,得到CdTe量子点粗品;
2、将CdTe量子点粗品置于烧杯中,向烧杯中加入3倍体积的异丙醇,搅拌均匀,得到量子点浑浊液,将量子点浑浊液离心(离心条件:8000r/min,10min)、洗涤4次,将所得固体物转入真空干燥箱中,在60℃下真空干燥24h,得到纯化、干燥的CdTe量子点(CdTe QDs),置于4℃下保存备用;
3、称取57mg氯化镉2.5水合物和108mg 2,3-二巯基丁二酸(DMSA)于三口烧瓶中,得混合溶液B,加入40ml去离子水,搅拌至完全溶解,用1mol/L的氢氧化钠溶液调节混合溶液B调节pH值为9.0,再取0.4mL混合溶液B,加入2.5mL 2×10-6mol/L CdTe量子点,搅拌均匀后转移至水热反应釜中,加热至200℃后,反应30min,即得到CdTe/CdS量子点(CdTe/CdS QDs),标记为DMSA-CdTe/CdS QDs。
对DMPS-CdTe/CdS QDs、NAC-CdTe/CdS QDs、MSA-CdTe/CdS QDs、DMSA-CdTe/CdS QDs、NAC-CdTe QDs进行能谱分析(发射波长一致),其结果如下表1所示:
从表1可以看出,与NAC-CdTe QDs相比,DMPS-CdTe/CdS QDs中S的含量增多而Te的含量明显减少,与XRD结构相结合,进一步说明生成了CdS壳。
试验一、本发明的CdTe/CdS量子点(DMPS-CdTe/CdS QDs)的抗光漂能力试验
试验方法:分别取16管DMPS-CdTe/CdS QDs(实施例1制备)溶液、16管NAC-CdTe/CdS QDs溶液、16管MSA-CdTe/CdS QDs溶液、16管DMSA-CdTe/CdS QDs和16管NAC-CdTe QDs(实施例1制备)溶液,先将各管中的溶液用20mM三(羟甲基)氨基甲烷(Tris-HCl)缓冲液稀释至相同浓度(约为80nM),再将各管置于356nm波长的紫外灯下(U=32V)照射90min,在0、5、10、15、20、25、30、35、40、45、50、60、70、80、90min时测量各管中的溶液的荧光强度,从而得到DMPS-CdTe/CdS QDs、NAC-CdTe/CdS QDs、MSA-CdTe/CdS QDs、DMSA-CdTe/CdS QDs和NAC-CdTe QDs在紫外灯下照射下的荧光强度(平均荧光强度)随时间的变化图。
试验结果:
DMPS-CdTe/CdS QDs、NAC-CdTe/CdS QDs、MSA-CdTe/CdS QDs、DMSA-CdTe/CdS QDs和NAC-CdTe QDs在紫外灯下照射下的的荧光强度(平均荧光强度)随时间的变化图(即抗光漂能力图)如图5所示,从图5可以看出,DMPS-CdTe/CdS QDs、NAC-CdTe/CdS QDs、MSA-CdTe/CdS QDs和DMSA-CdTe/CdS QDs的荧光强度基本不减弱,而NAC-CdTe QDs的荧光降低60%左右,说明DMPS-CdTe/CdS QDs、NAC-CdTe/CdS QDs、MSA-CdTe/CdS QDs和DMSA-CdTe/CdS QDs具有很好的抗光漂能力。
试验二、本发明的CdTe/CdS量子点(DMPS-CdTe/CdS QDs)的抗盐稳定性试验
试验方法:将DMPS-CdTe/CdS QDs(实施例1制备)溶液、NAC-CdTe/CdS QDs溶液、MSA-CdTe/CdS QDs溶液、DMSA-CdTe/CdS QDs和NAC-CdTe QDs(实施例1制备)溶液用20mM三(羟甲基)氨基甲烷(Tris-HCl)+600mM NaCl的高盐缓冲液稀释至相同浓度(约为80nM),再分别置于黑暗处放置24小时,测量DMPS-CdTe/CdS QDs、NAC-CdTe/CdS QDs、MSA-CdTe/CdS QDs、DMSA-CdTe/CdS QDs和NAC-CdTe QDs溶液在0、24小时的荧光强度,从而得到DMPS-CdTe/CdS QDs、NAC-CdTe/CdS QDs、MSA-CdTe/CdS QDs、DMSA-CdTe/CdS QDs和NAC-CdTe QDs在高盐下的荧光强度随时间的变化图(即抗盐稳定图)。
试验结果:
DMPS-CdTe/CdS QDs、NAC-CdTe/CdS QDs、MSA-CdTe/CdS QDs、DMSA-CdTe/CdS QDs和NAC-CdTe QDs在高盐下的荧光强度随时间的变化图(即抗盐稳定图)如图6所示,从图6可以看出,DMPS-CdTe/CdS QDs、NAC-CdTe/CdS QDs、MSA-CdTe/CdS QDs和DMSA-CdTe/CdS QDs的抗盐稳定性要好于NAC-CdTe QDs。
试验三、本发明的CdTe/CdS量子点(DMPS-CdTe/CdS QDs)的热稳定性试验
试验方法:取1管DMPS-CdTe/CdS QDs(实施例1制备)溶液和1管NAC-CdTe QDs(实施例1制备)溶液,作为对照组,另取1管DMPS-CdTe/CdS QDs溶液和1管NAC-CdTe QDs溶液,作为实验组,先将各管中的溶液用20mM三(羟甲基)氨基甲烷(Tris-HCl)缓冲液稀释至相同浓度(约为80nM),再将实验组置于90℃的水浴中加热10min,对照组置于室温(20-30℃)中10min,分别测量各管中的溶液的荧光光谱,得到NAC-CdTe/CdS QDs和NAC-CdTe QDs的在不同温度下的荧光光谱图(即热稳定性图)。
试验结果:
DMPS-CdTe/CdS QDs和NAC-CdTe QDs的在不同温度下的荧光光谱图(即热稳定图)如图7所示,从图7可以看出,DMPS-CdTe/CdS QDs在高温条件下不会发生自猝灭,而NAC-CdTe QDs在高温条件下会发生严重的自猝灭现象,说明DMPS-CdTe/CdS QDs具有更好的热稳定性。
试验四、本发明的CdTe/CdS量子点(DMPS-CdTe/CdS QDs)的pH稳定性试验
试验方法:取9管DMPS-CdTe/CdS QDs(实施例1制备)溶液和9管NAC-CdTe/CdS QDs溶液,先将9管DMPS-CdTe/CdS QDs溶液分别用pH值为4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0的三(羟甲基)氨基甲烷(Tris-HCl)缓冲液稀释至相同浓度(约为80nM),9管NAC-CdTe/CdS QDs溶液分别用pH值为4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0的三(羟甲基)氨基甲烷(Tris-HCl)缓冲液稀释至相同浓度(约为80nM),再分别测量各管中的溶液的荧光强度,得到DMPS-CdTe/CdS QDs和NAC-CdTe/CdS QDs的在不同pH值下的荧光强度变化图(即pH稳定性图)。
试验结果:
DMPS-CdTe/CdS QDs和NAC-CdTe/CdS QDs的在不同pH值下的荧光强度变化图(即pH稳定性图)如图8所示,从图8可以看出,NAC-CdTe/CdS QDs在pH小于6.0时,基本无荧光;而DMPS-CdTe/CdS QDs在pH等于4时,仍然有较强的荧光,说明DMPS-CdTe/CdS QDs具有更宽的pH适用范围,这对于量子点在细胞及活体中的应用有着重要的作用。
试验五、本发明的CdTe/CdS量子点(DMPS-CdTe/CdS QDs)的荧光寿命试验
试验方法:
将4管发射波长分别为538、558、584和614nm的DMPS-CdTe/CdS QDs(实施例1-4制备)溶液,用20mM三(羟甲基)氨基甲烷(Tris-HCl)缓冲液分别稀释至相同浓度(约为80nM),再测量其的荧光寿命,从而得到不同发射波长的DMPS-CdTe/CdS QDs的荧光寿命表征图。
试验结果:
不同发射波长的DMPS-CdTe/CdS QDs的荧光寿命表征图如图9所示,从图9可以看出,随着发射波长红移,DMPS-CdTe/CdS QDs的荧光寿命逐渐增长,当发射波长为614nm时,其寿命可达60ns,更长的寿命能减少组织的自发荧光,对于活体应用非常重要。
- 还没有人留言评论。精彩留言会获得点赞!