一种量子点荧光探针及其在检测植物细胞中葡萄糖的应用的制作方法
本发明属于生物传感器及分子识别领域,特别涉及一种量子点荧光探针及其在检测植物细胞中葡萄糖的应用。
背景技术:
葡萄糖(Glucose,C6H12O6)是一种多羟基醛,在植物的生命周期中具有重要作用。在植物体内,细胞吸收二氧化碳,经光合作用转化为葡萄糖,作为活细胞的能量来源。此外,葡萄糖还具有信号功能,是植物生长发育和基因表达的重要调节因子。
目前葡萄糖的检测方法主要是高效液相色谱法。但该法存在耗时、需前处理、需用化学试剂、要求检测人员具有较高专业技能等缺点,存在很大局限性,且无法用于植物体内检测。为了深入研究葡萄糖在植物体内的生理学作用,迫切需要开发一种经济、快速、简单、实用且选择性高的方法在植物细胞内检测葡萄糖。而荧光探针检测技术所具有的高灵敏度、无损探伤特点使其可克服高效液相色谱法在检测植物体内葡萄糖的不足。不过目前检测葡萄糖的荧光探针都是有机小分子,存在光稳定性差、合成步骤复杂、水溶性差等问题和缺点。
量子点作为一种新型的荧光纳米探针,由于具有光稳定性好、制备简单、水溶性好、表面易修饰等优点而引起广泛关注。有报道将近红外量子点用于检测动物细胞葡萄糖,不过由于植物细胞与动物细胞结构不同,且对于绿色植物而言,葡萄糖主要存在于叶片细胞中,需要纳米颗粒小于10nm以便于通过细胞壁进入植物细胞,而近红外量子点粒径往往大于10nm,所以该近红外量子点不能用于检测植物细胞中葡萄糖。因此,开发一种选择性好、灵敏度高、不破坏植物细胞、检测迅速且具有靶向检测植物叶片细胞内葡萄糖的量子点荧光探针,将对绿色植物的研究发展具有至关重要的作用。
技术实现要素:
基于此,本发明提供一种量子点荧光探针及其在检测植物细胞中葡萄糖的应用,所述量子点荧光探针不需要对植物细胞进行破坏即可检测出植物细胞中的葡萄糖浓度,且准确率高。
本发明所述量子点荧光探针的制备方法包括以下步骤,
a)将NaHTe与CdCl2、巯基乙酸混合反应,得到TGA-CdTe量子点;
b)将TGA-CdTe量子点溶于CdCl2和Na2S2O3的混合溶液中,得到量子点荧光探针前体;
c)将量子点荧光探针前体加入EDC与NHS的混合溶液中,再加入3-氨基苯硼酸反应得到量子点荧光探针。
与现有技术相比,本发明在CdTe量子点表面修饰上TGA,使表面具有-COOH活性基团;再通过-COOH与APBA上的-NH2相互作用,使荧光物质APBA修饰到量子点表面,形成具有荧光效应的量子点荧光探针。该量子点荧光探针具有选择性好、灵敏度高、检测迅速且具有靶向检测植物叶片细胞内葡萄糖的特点。
进一步,所述量子点荧光探针粒径为5-10nm,内核为CdTe量子点、表面修饰有3-氨基苯硼酸和巯基乙酸。
本发明所述量子点荧光探针的粒径为5-10nm,易于通过细胞壁进入植物细胞,便于检测植物细胞中葡萄糖。
进一步,步骤a)中所述CdCl2、巯基乙酸和NaHTe的摩尔比为1:3:2。
进一步,步骤a)所述反应的温度为100℃,pH为10。
进一步,步骤b)中所述TGA-CdTe量子点与CdCl2的摩尔比为1:1。
进一步,步骤b)中所述混合溶液中CdCl2的浓度为1mmol/L,Na2S2O3的浓度为4mmol/L。
进一步,步骤c)中所述量子点荧光探针前体、EDC、NHS和3-氨基苯硼酸的摩尔比为1:0.5:0.5:1。
进一步,步骤c)中反应温度为20℃。
本发明还提供了一种量子点荧光探针在检测植物细胞中葡萄糖的应用,具体包括以下步骤:
S1:配制系列具有浓度梯度的葡萄糖溶液,分别加入量子点荧光探针后检测荧光强度,得到荧光强度的比值与葡萄糖浓度的关系曲线;
S2:使量子点探针进入植物的叶片细胞中,检测荧光强度,将该荧光强度值代入步骤S1所得关系曲线中,得到葡萄糖浓度。
与现有技术相比,本发明所述量子点荧光探针穿过植物细胞壁进入植物细胞中,与细胞中的葡萄糖相互作用发生团聚,导致荧光强度降低;且荧光强度降低程度与葡萄糖浓度之间具有一定的关系,从而可以根据该关系来检测绿色植物细胞中的葡萄糖浓度,且具有很高的准确率。
进一步,步骤S1所述关系曲线方程为:y=0.0005x+1.0263,其中x表示葡萄糖浓度,y表示葡萄糖浓度为0时与x时的荧光强度比值。
进一步,步骤S1所述系列具有浓度梯度的葡萄糖溶液的浓度范围为0~1000μM。
附图说明
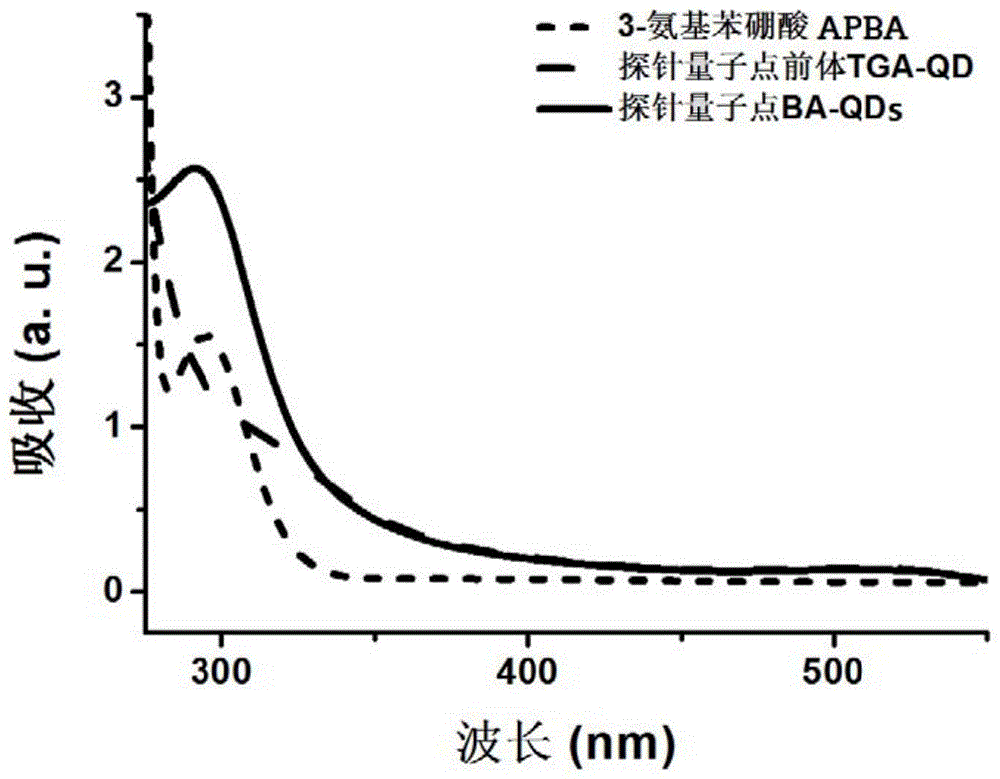
图1是本发明中3-氨基苯硼酸APBA、量子点荧光探针前体TGA-DQ和量子点荧光探针BA-QDs的紫外吸收光谱图;
图2是本发明中量子点荧光探针BA-QDs的荧光发射光谱图;
图3是本发明中量子点荧光探针BA-QDs检测不同浓度葡萄糖的荧光发射光谱图;
图4是本发明中量子点荧光探针BA-QDs和不同浓度葡萄糖孵育后荧光强度前后变化的比值与葡萄糖浓度的关系图及拟合曲线;
图5是发明实施例1中量子点荧光探针BA-QDs和不同浓度葡萄糖孵育不同时间后的荧光强度变化图;
图6是发明实施例1中量子点荧光探针BA-QDs和葡萄糖溶液(1000μM)混合孵育前和孵育后粒径小变化及透射电镜图;
图7是发明实施例1中量子点荧光探针BA-QDs和绿藻孵育不同时间后激光共聚焦显微镜荧光成像图及荧光强度变化;
图8是发明实施例2中量子点荧光探针BA-QDs注射到拟南芥叶片后孵育不同时间进行激光共聚焦显微镜成像图及荧光强度变化。
具体实施方式
本发明先制备量子点荧光探针,再将量子点荧光探针注入植物细胞中,利用量子点荧光探针荧光猝灭程度检测出植物细胞中葡萄糖浓度。以下通过具体实施例详细说明本发明的技术方案。
本发明所使用的量子点荧光探针的制备方法为:制备TGA-CdTe量子点,并将TGA-CdTe量子点溶于CdCl2和Na2S2O3的混合水溶液中,然后与EDC、NHS和APBA混合反应,得到量子点荧光探针。具体如下:
(1)制备TGA-CdTe量子点
具体地,首先在15mL小烧杯中,在磁力搅拌下,将127.5mg Te粉和80mg NaBH4溶于5mL双蒸水中,搅拌2小时后使Te粉消失,将反应产物马上用冰浴冷却,然后在4℃,5000r/min下离心10min,取上清液得到0.2mmol/L的NaHTe水溶液。
另将91.3mg CdCl2·5H2O溶于100mL水中,加入44μl TGA(巯基乙酸),通氩气搅拌,用0.5mol/L的NaOH调节pH至10。接着加入2.5mL上述NaHTe水溶液,加热至100℃,回流30min取样。样品加入异丙醇,沉淀、离心、弃去上清液。再加异丙醇洗一次,沉淀在室温下真空烘干,得到TGA-CdTe量子点。
(2)制备量子点荧光探针前体(TGA-DQ)
称取30mg上述TGA-CdTe量子点干粉溶于30ml包含1mmol/L CdCl2、4mmol/L Na2S2O3、pH=8的溶液A中,加热到100℃,回流30min得到核壳结构量子点荧光探针前体,标记为TGA-DQ。
(3)制备量子点荧光探针(BA-QDs)
最后取20mg上述TGA-DQ加入到溶液B(0.3mL EDC,0.025mM;0.2mL NHS,0.015mM,pH=7)中,在20℃反应2小时。反应结束后加入0.5mL APBA(3-氨基苯硼酸,0.025mM),继续反应4小时。反应结束后加入异丙醇,离心,弃去上清。再加异丙醇洗一次,将沉淀在室温下真空烘干得到量子点荧光探针,标记为BA-QDs。
请参照图1,该图是3-氨基苯硼酸APBA、量子点荧光探针前体TGA-DQ和量子点荧光探针BA-QDs的紫外吸收光谱。从图1可知,APBA在290nm~340nm存在紫外吸收;而TGA-DQ的紫外吸收光谱在350nm~550nm之间;BA-QDs除了在350nm~550nm之间存在紫外吸收外,还存在290nm~340nm之间的APBA相关官能团的紫外吸收,可见在制备过程中APBA通过其-NH2与TGA-DQ上的-COOH结合被修饰到TGA-DQ上从而形成具有荧光效应的量子点荧光探针BA-QDs,使。请同时参照图2,该图是BA-QDs的荧光发射光谱。从图2可以看出BA-QDs最大发射波长为592nm。通过上述表征证明通过上述制备方法成功合成出具有较强的荧光特性的量子点荧光探针BA-QDs。
本发明还提供了一种量子点荧光探针在检测植物细胞中葡萄糖的应用,具体包括以下步骤:
S1:配制系列具有浓度梯度的葡萄糖溶液,分别加入量子点荧光探针后检测荧光强度,得到荧光强度的比值与葡萄糖浓度的标准曲线。
S2:使量子点探针进入植物的叶片细胞中,检测荧光强度,将该荧光强度值代入步骤S1所得标准曲线中,得到葡萄糖浓度。
请参照图3,图3是本发明量子点荧光探针BA-QDs检测不同浓度葡萄糖的荧光发射光谱图。具体地,配制一系列1mL浓度依次为0/100/200/500/1000μM、pH为7.4的葡萄糖溶液,然后将BA-QDs分别加入到上述不同浓度葡萄糖溶液中,控制BA-QDs终浓度为100nM。充分搅拌均匀孵育60min后采集荧光光谱。从图3可以明显的看到,和葡萄糖相互作用后,BA-QDs荧光强度逐渐下降;葡萄糖的浓度越高,荧光强度下降越大。由此,可以判断出本发明所制备的BA-QDs与葡萄糖有很好的相互作用,葡萄糖可以引起BA-QDs的聚集,导致BA-QDs荧光猝灭。
根据图3可以拟合出如图4的标准曲线y=0.0005x+1.0263,其中y为荧光强度的比值,即葡萄糖浓度为0时荧光强度F0/葡萄糖浓度为100/200/500/1000μM时荧光强度/F100/200/500/1000μM,x为样品中葡萄糖的浓度(单位:μM),R2=0.9873。
实施例1
本实施例1利用上述量子点荧光探针BA-QDs检测单细胞藻类植物绿藻细胞中葡萄糖。
具体地,将单细胞藻类植物绿藻与1mL 100nM的BA-QDs共孵育20min,用1×TES(三乙基氯硅烷)清洗3遍后将绿藻制作成片在激光共聚焦显微镜下观察,拍照记录绿藻细胞内3个不同地方0/20/40/60min时间点的荧光强度,荧光成像图用软件Image J统计出60min时的第一相对荧光强度值。
另取绿藻,先与1000μM葡萄糖溶液共孵育60min,用1×TES清洗3遍去除绿藻表面的葡萄糖;再与1mL 100nM的BA-QDs共孵育20min,用1×TES清洗3遍后将绿藻制作成片在激光共聚焦显微镜下观察,拍照记录绿藻细胞内3个不同地方0/20/40/60min时间点的荧光强度,荧光成像图用软件Image J统计出60min时的第二相对荧光强度值,将第一相对荧光强度值与第二相对荧光强度值的比值代入步骤S1的标准曲线方程中,得到绿藻细胞中的葡萄糖浓度。
请参照图5,图5是发明实施例1中量子点荧光探针BA-QDs和不同浓度葡萄糖孵育不同时间后的荧光强度变化图。从图5中可以看出,葡萄糖浓度为0μM时,随着孵育时间的增加,量子点荧光探针BA-QDs荧光强度基本保持不变;而当溶液中有葡萄糖存在时,随着孵育时间的增加,量子点荧光探针BA-QDs荧光强度则逐渐下降,葡萄糖的浓度越高,孵育时间越长,荧光强度下降越大。当孵育时间为60min,葡萄糖浓度为1000μM时,量子点荧光探针BA-QDs荧光强度下降达到最大值。
请参照图6,图6是是发明实施例1中量子点荧光探针BA-QDs和葡萄糖溶液(1000μM)混合孵育前和孵育后粒径小变化及透射电镜图。该图反映了BA-QDs在1000μM葡萄糖溶液中孵育不同时间(0/10/20/40/60/90/120min)后的粒径变化。从图6A中可以看出,BA-QDs在葡萄糖溶液中孵育时间越长,粒径越大。图6B和图6C分别为BA-QDs和葡萄糖溶液(1000μM)混合孵育前(0min)和混合孵育60min后的TEM图;0min时,BA-QDs为量子点原本的样貌,颗粒分散均匀,粒径大小5nm左右;孵育60min后,BA-QDs与葡萄糖发生反应,相互作用聚集在一起。结果说明BA-QDs可以和葡萄糖发生相互作用,葡萄糖BA-QDs发生聚集而导致其荧光猝灭,导致荧光强度下降,进一步证明可根据荧光强度的变化进行葡萄糖的定量检测。
请参照图7,图7是发明实施例1中量子点荧光探针BA-QDs和绿藻孵育不同时间后激光共聚焦显微镜荧光成像图及荧光强度变化。步骤S2中,绿藻只和BA-QDs共孵育时,随着孵育时间的增加,量子点荧光探针BA-QDs的荧光强度在绿藻细胞内保持不变,如图7A、B所示;而绿藻先与葡萄糖共孵育,后再与BA-QDs共孵育时,BA-QDs的荧光强度在绿藻细胞内则逐渐下降,如图7A、C所示,表明BA-QDs在绿藻细胞内与葡萄糖发生相互作用产生聚集而导致荧光猝灭,荧光强度减弱。根据图7B得到第一对荧光强度值,根据图7C得到第二相对荧光强度值,代入标准曲线y=0.0005x+1.0263计算出孵育60min后绿藻细胞内葡萄糖浓度为约为993.55μM,与1000μM理论浓度相近,表明利用BA-QDs可用于绿藻植物细胞内葡萄糖浓度的检测,并且具有很高的准确率。
实施例2
本实施例2利用上述量子点荧光探针BA-QDs检测拟南芥叶片细胞中葡萄糖,检测方法如下:
具体地,在4周龄拟南芥叶片上注射100μL 100nM的BA-QDs后将拟南芥叶片制作成片进行激光共聚焦显微镜观察,拍照记录拟南芥叶片细胞内580~610nm处不同时间点(0/5/10/20/30/45/60min)的荧光强度,拍摄的荧光成像图用软件Image J计算出拟南芥叶片细胞内3个不同地方各时间点的相对荧光强度值,得到60min时的第一相对荧光强度值。
另取4周龄拟南芥,先将100μL 1000μM的葡萄糖溶液注射到拟南芥叶片中。10min后在叶片同一位置注射100μL 100nM的BA-QDs,然后制作成片进行激光共聚焦显微镜观察,拍照记录拟南芥叶片细胞内580~610nm处不同时间点(0/5/10/20/30/45/60min)的荧光强度(图8A),拍摄的荧光成像图用软件Image J计算出拟南芥叶片细胞内3个不同地方各时间点的相对荧光强度值,得到60min时的第二相对荧光强度值。
请参照图8,图8是发明实施例2中量子点荧光探针BA-QDs注射到拟南芥叶片后孵育不同时间进行激光共聚焦显微镜成像图及荧光强度变化。在步骤S2中,没有葡萄糖的情况下,BA-QDs的荧光强度随时间的变化在拟南芥叶片细胞内保持不变,如图8A、B所示;加入葡萄糖后,BA-QDs的荧光强度随时间的变化在拟南芥叶片细胞内则逐渐下降,如图8A、C所示,表明BA-QDs在拟南芥叶片细胞内与葡萄糖发生相互作用而聚集,导致荧光猝灭、荧光强度下降。根据图8B得到第一对荧光强度值,根据图8C得到第二相对荧光强度值,代入标准曲线y=0.0005x+1.0263计算出孵育60min后绿藻细胞内葡萄糖浓度为约为987.70μM,与1000μM理论浓度相近,表明利用BA-QDs可用于绿色植物叶片细胞内葡萄糖浓度的检测,并且具有很高的准确率。
相对于现有技术,本发明在CdTe量子点表面修饰上TGA使表面具有-COOH活性基团,再通过-COOH与APBA上的-NH2相互作用使荧光物质APBA修饰到量子点表面,形成具有荧光效应的量子点荧光探针。该量子点荧光探针可以穿过植物细胞壁进入植物细胞中,进而与细胞中的葡萄糖相互作用发生团聚,导致荧光强度降低;且荧光强度降低程度与葡萄糖浓度之间具有一定的关系,从而可以根据该关系来检测绿色植物细胞中的葡萄糖浓度,且具有很高的准确率。本发明所述量子点荧光探针具有选择性好、灵敏度高、不破坏植物细胞、检测迅速且具有靶向检测植物叶片细胞内葡萄糖的特点,将对绿色植物的研究发展具有至关重要的作用。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!