一种利用微藻培养净化豆腐废水的优化方法与流程
本发明涉及微藻生物处理技术领域,具体涉及一种利用微藻培养净化豆腐废水的优化方法。
背景技术:
将一吨大豆加工成豆腐产生约7-10吨废水,废水的化学需氧量(cod)为10-20g/l。对豆腐废水(spw)处理的研究都集中在厌氧过滤器af(anaerobicfilters),上流式厌氧污泥流化床(uasb),序批式反应器(sbr)等工艺。尽管厌氧处理适合于能量回收的高浓度废水的处理,但是方法有几个不足,厌氧处理无法去除生物氮和磷,并且需要不断调节处理过程中液体的碱度。好氧处理过程需要满足cod生物转化要求、脱氮除磷目标以及污泥浓缩要求,而且过程不仅浪费有机碳和养分资源,还会产生co2和污泥。一个最佳的处理过程应该能够利用有用生物的生产,同时去除有机物,氮和磷的污染物。
豆腐废水(spw)包含单糖、低聚糖、维生素、有机酸、氨基酸、脂类、乳清蛋白、异黄酮、皂甙、p、ca、fe、和其他营养物质[1-2]。一些研究已经探讨了利用膜技术回收寡糖,蛋白质或异黄酮,但这种方法只能回收废水中的一些成分,并留下可能需要进一步处理的废水。
一些研究人员探索了与废水处理相结合的微藻培养方式。这些微藻不仅能够去除污染物,而且产生的脂质,可以被转化成生物柴油[3-5]。由于spw含有明显的可用的营养物质一般无有毒有害,不能抑制微藻生长,在这样的介质中的油脂微藻培养基可以降低微藻生物柴油的成本。
微藻相对于其他可转化为生物质产品的农植物来说,具有生长率高,适应性强(即使在极其艰苦的条件下仍然可以生长),并且不会与其他产品竞争,占用土地面积少,产油量高的优点引发人们关注。在光生物反应器中,可以通过微藻利用太阳能固定二氧化碳作为碳源,用自养异养或混合培养方法将机化合物(即葡萄糖和乙酸盐)转化成能量用于生物量生长。混合培养操作具有几个优点,包括消光需求,更高的微藻生长,成本效益的生物质收获,和底物降解在混合条件下,微藻可以通过呼吸和光合作用,同时吸收无机和有机底物,这是自养和异养生长之和。
将微藻生长与废水处理联系在一起,即利用了豆腐废水中丰富的营养物质,而且促进了生物质生产力,达到了双重优化的效果。在光生物反应器中微藻的培养方式有4种,分别为批次培养、批次补料培养、半连续培养、连续培养。批次培养是指在反应器中一次性投入培养液及接种微藻液并在无菌条件下培养一定时间后,一次性放出培养液进行后处理的培养方法。批次补料培养培养是指先将一定量的培养液装入反应器,在无菌条件下接种微藻液,进行培养,使细胞不断生长,产物不断形成,而此过程中随着营养物质的不断消耗,像系统中补充新的营养成分使细胞进一步生长代谢,直到整个培养结束后取出产物。本发明只采用了批次补料培养和批次培养两种培养方式。
技术实现要素:
本发明的目的在于克服上述背景技术存在的缺陷,提供一种利用微藻培养净化豆腐废水的优化方法。
本发明的技术方案:一种利用微藻培养净化豆腐废水的优化方法,包括如下步骤:
1)、微藻培养:将c.pyrenoidosa在无菌的条件下接种,在250ml锥形瓶中用100ml高压灭菌的se培养基对c.pyrenoidosa进行培养,然后置于光培养箱中进行培养;
微藻培养条件:光强=25-30μmolphotonm-2s-1、光暗比=14:10-15、温度=25±1℃,培养时间24h,并且在培养期间间歇式震荡;
2)、豆腐废水处理:收集豆腐废水包括平衡池sw1废水和厌氧水解反应器sw2废水,在高速冷冻离心机中离心,调节上清液的ph6-7,在100-121℃高压灭菌20分钟,并在1-4℃保存,获得豆腐废水培养基;
其中:sw1废水培养基来自平衡池sw1的豆腐废水,sw2废水培养基来自厌氧水解反应器sw2的豆腐废水;
3)、批次补料培养实验:使用光生物反应器,先加入100ml的c.pyrenoidosa接种物,再添加50ml的sw1或sw2废水培养基,用磁力搅拌器将混合溶液混合,在光强=27μmolphotonm-2s-1、光暗比=14:10、温度=25±1℃下进行培养24h;
在接下来的四天内,每天在同一时间给微藻添加不同剂量的sw1或sw2废水培养基进行培养,四天的剂量分别为75ml、100ml、0ml、50ml。
所述步骤2)中高速冷冻离心机以10355rpm的转速,离心10分钟。
与现有技术相比,本发明具有的优点:
1)本发明利用微藻培养净化豆腐废水的优化方法,经过120h的批次补料培养之后,微藻可分别去除77.8±5.7%的可溶性化学需氧量(scodcr)、88.8±1%的总氮(tn)、89.1±0.6%的铵态氮(nh4+-n)和70.3±11.4%的总磷(tp)。同时c.pyrenoidosa的平均生物量生产率达到0.64gl-1d-1,平均脂质含量为37.00±9.34%,脂质生产率高达0.40gl-1d-1,高于批次培养的脂质生产率,从而得知批次补料培养最适合豆腐废水培养c.pyrenoidosa。
2)本发明将废水处理与生物质生产耦合一起,不需要额外补充营养,成为具有同步废水利用和具有成本效益的生物质生产的双重战略。
附图说明
图1是c.pyrenoidosa批次补料培养处理大豆加工废水中scodcr示意图:
r代表sw2培养基批次补料培养的scodcr去除率;
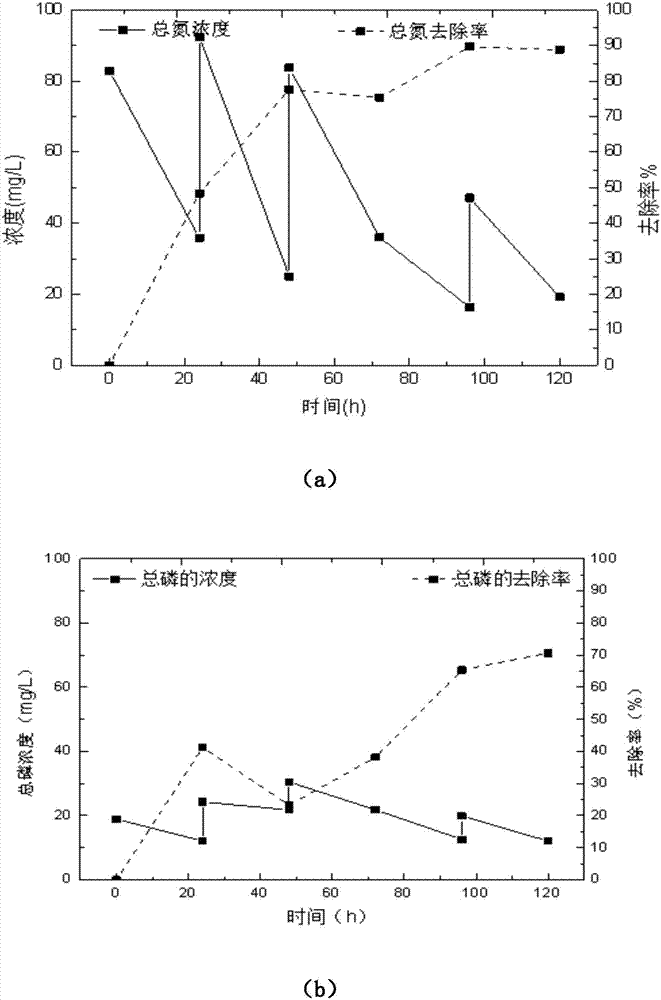
图2是c.pyrenoidosa批次补料培养中tn、tp去除率示意图:
(a)为tn随时间变化图;
(b)为tp随时间变化图。
图3是c.pyrenoidosa批次补料培养中的vfas、sc去除率示意图。
图4是c.pyrenoidosa在豆腐废水批次补料培养生长示意图。
具体实施方式
下面通过具体实施例和附图对本发明作进一步的说明。本发明的实施例是为了更好地使本领域的技术人员更好地理解本发明,并不对本发明作任何的限制。
实施例1:
1)、微藻的培养:将c.pyrenoidosa在无菌的条件下接种,在250ml锥形瓶中用100ml高压灭菌的se培养基对c.pyrenoidosa进行培养,然后置于光培养箱中进行培养,se培养基的成分:nano30.25(g/l)、k2hpo4·3h2o0.075(g/l)、mgso4·7h2o0.075(g/l)、cacl2·2h2o0.025(g/l)、kh2po40.175(g/l)、nacl0.025(g/l)、soilextract40(ml/l)、fecl3·6h2o0.005(g/l)、fe-edta1(ml/l)、a5solution1(ml/l)、distilledwater958(ml/l);
其中a5solution的配置方法为:在100ml的去离子水中溶入h3bo3286mg、znso4·7h2o22mg、mncl2·4h2o181mg、cuso4·5h2o7.9mg、(nh4)6mo7o24·4h2o3.9mg;fe-edta的配置方法:a液na2edta1g、distilledwater50ml,b液fecl3·6h2o81mg、hcl(0.1n)(0.1mol/l)50ml,分别配置a液、b液,充分搅拌后溶解后,将a液,b液混合搅拌均匀即可。
c.pyrenoidosa微藻是一种绿藻,微藻的培养条件:光强=27μmolphotonm-2s-1、光暗比=14:10、温度=25℃,培养时间24h并且在培养期间间歇式震荡;2)、豆腐废水处理:为了获得c.pyrenoidosa的废水培养基,分别收集平衡池(sw1)和厌氧水解反应器(sw2)的豆腐废水,豆腐废水的cod=13215mg/l、tn=267.1mg/l、nh4+-n=52.1mg/l、tp=56.3mg/l,还包括含量为na=1387mg/l、cu=0.55mg/l、mg=173.5mg/l、mn=0.21mg/l的盐,所含营养物质高于se培养基相应浓度,在高速冷冻离心机中以10,355的转速,离心10分钟,取上清液,调节上清液的ph6.5,在121℃高压灭菌20分钟,并在1℃保存;来自平衡池(sw1)和厌氧水解反应器(sw2)的离心上清液分别含有10160和8087mg/l的cod;
3)、批次补料培养实验:一个500毫升的锥形烧瓶作为光生物反应器,先加入100ml的c.pyrenoidosa接种物与50ml的sw2培养基,用磁力搅拌器将混合溶液混合,在光强=27μmolphotonm-2s-1、光暗比=14:10、温度=26℃下进行培养24h;在接下来的四天内,每天在同一时间给微藻添加不同剂量的sw2进行培养,四天添加的微藻剂量分别为75ml、100ml、0ml、50ml。
实施例2:
1)、微藻的培养:将c.pyrenoidosa在无菌的条件下接种,在250ml锥形瓶中用100ml高压灭菌的se培养基对c.pyrenoidosa进行培养,然后置于光培养箱中进行培养,se培养基的成分:nano30.25(g/l)、k2hpo4·3h2o0.075(g/l)、mgso4·7h2o0.075(g/l)、cacl2·2h2o0.025(g/l)、kh2po40.175(g/l)、nacl0.025(g/l)、soilextract40(ml/l)、fecl3·6h2o0.005(g/l)、fe-edta1(ml/l)、a5solution1(ml/l)、distilledwater958(ml/l);其中a5solution的配置方法为:在100ml的去离子水中溶入h3bo3286mg、znso4·7h2o22mg、mncl2·4h2o181mg、cuso4·5h2o7.9mg、(nh4)6mo7o24·4h2o3.9mg。
fe-edta的配置方法:a液na2edta1g、distilledwater50ml,b液fecl3·6h2o81mg、hcl(0.1n)(0.1mol/l)50ml,分别配置a液、b液,充分搅拌后溶解后,将a液,b液混合搅拌均匀即可。
c.pyrenoidosa微藻是一种绿藻,微藻的培养条件:光强=25μmolphotonm-2s-1、光暗比=14:15、温度=24℃,培养24h,并且在培养期间间歇式震荡;
2)、豆腐废水处理:为了获得c.pyrenoidosa的废水培养基,分别收集平衡池(sw1)和厌氧水解反应器(sw2)的豆腐废水,豆腐废水的cod=13215mg/l、
tn=267.1mg/l、nh4+-n=52.1mg/l、tp=56.3mg/l,还包括含量为na=1387mg/l、cu=0.55mg/l、mg=173.5mg/l、mn=0.21mg/l的盐,所含营养物质高于se培养基相应浓度,在高速冷冻离心机中以10,355的转速,离心10分钟,取上清液,调节上清液的ph6.0,在100℃高压灭菌20分钟,并在4℃保存;来自平衡池(sw1)和厌氧水解反应器(sw2)的离心上清液分别含有10160和8087mg/l的cod;
3)、批次补料培养实验:一个500毫升的锥形烧瓶作为光生物反应器,先加入100ml的c.pyrenoidosa接种物与50ml的sw1培养基,用磁力搅拌器将混合溶液混合,在光强=27μmolphotonm-2s-1、光暗比=14:10、温度=25℃下进行培养;在接下来的四天内,每天在同一时间给微藻添加不同剂量的sw2进行培养,四天添加的微藻剂量分别为75ml、100ml、0ml、50ml。
实施例3:水质检测
为测量水质,微藻培养离心(10355转,4℃,10分钟),上清液通过0.45μm的醋酸纤维滤膜。滤液测定分析可溶性化学需氧量(scodcr)、总氮(tn)、总磷(tp),化学需氧量按照gb11914-89标准来检测(国家环境保护总局中国,2002)[6]。使用元素分析仪来检测c.pyrenoidosa中碳(c)、氢(h)、氧(o)、氮(n)的含量。用葡萄糖作为标准,通过苯酚-硫酸法测量碳水化合物[7]。
如图1所示,在批次补料培养过程中,添加spw后,批次补料培养过程中scodcr浓度升高至较高值,但是浓度迅速下降到一个较低的浓度,这是因为c.pyrenoidosa的吸收和有机化合物的消耗。分批和批次补料培养的scodcr去除效率逐渐增加。在补料分批实验中,用sw2培养的微藻的scodcr达到了77.8±5.7%。
如图2所示,在加入spw废水之后,tn、和tp逐渐增加到一个较高的浓度,但是因为微藻对营养物的吸收和消化使浓度快速降低。在混合营养期结束,tn、和tp的浓度分别降低到19.1±0.7和11.7±4.7mgl-1。相对的,tn、和tp的去除率分别为88.8±1.0%和70.3±11.4%。
c、分析生物量中的挥发性脂肪酸含量(vfas),滤液收集在1.5毫升气相色谱(gc)瓶,加入3%磷酸调节ph约为4。使用装备有火焰离子化检测器(fid)和分析柱cpwax52cb(30m×0.53mm×1μm)的气相色谱仪来测定vfa(c2-c5)的浓度,进样量为1ml。注射器和fid的温度分别为200和220℃。使用氮气作为载气,流速为50毫升/分钟。gc柱温箱的程序设定为110℃,开始保持2分钟,然后以10℃/分钟的速率升至220℃,并在220℃保持2分钟。
如图3所示,显示了在批次补料培养期间预处理后的spw中vfas的去除效果。经过120h的培养后,豆腐废水中中vfas的浓度降到162.4±68.6mgl-1,相应的去除率为96.7±1.4%,豆腐废水中碳水化合物(sc)浓度为59.8±12.1mgl-1,相应的去除率为41.1±1.9%。
在批次补料培养中,微藻c.pyrenoidosa能够有效去除豆腐废水的营养物,并且产生很大的生物质生产力。
实施例4:生物量检测
收集藻类悬浮液1ml测定c.pyrenoidosa生物量,在转速为5074转,4℃的条件下离心10分钟,在65℃下将颗粒干燥至恒重。每个样品一式三份,空白样品也用相同的方法处理,不含藻类的样品作为对照。
补料批次培养120小时的生物量示意图,如图4所示,分析图4,可以看出在sw1和sw2培养基中培养120h的c.pyrenoidosa微藻的生物量总体趋势上升。废水处理与生物质生产耦合,无需额外补充营养,可以成为具有同步废水利用和具有成本效益的生物质生产的长期战略。
应当理解的是,这里所讨论的实施方案及实例只是为了说明,对本领域技术人员来说,可以加以改进或变换,而所有这些改进和变换都应属于本发明所附权利要求的保护范围。
相关文献:
[1].lopesbarbosa,a.c.,lajolo,f.m.,genovese,m.i.,2006.influenceoftemperature,phandionicstrengthontheproductionof
isoflavone-richsoyproteinisolates.foodchem.98,757–766.
[2].tang,c.-h.,ma,c.-y.,2009.effectofhighpressuretreatmentonaggregationandstructuralpropertiesofsoyproteinisolate.lwt–foodsci.technol.42,606–611.
[3].li,q.,du,w.,liu,d.,2008a.perspectivesofmicrobialoilsforbiodieselproduction.appl.microbiol.biotechnol.80,749–756.
[4].bhatnagar,a.,bhatnagar,m.,chinnasamy,s.,das,k.,2010.
chlorellaminutissimaapromisingfuelalgaforcultivationinmunicipalwastewaters.appl.biochem.biotechnol.161,523–536
[5].perez-garcia,o.,escalante,f.m.e.,de-bashan,l.e.,bashan,y.,2011.heterotrophicculturesofmicroalgae:metabolismandpotentialproducts.waterres.45,11–36.
[6].stateenvironmentalprotectionadministrationofchina,2002.waterandwastewateranalyzingmethods,fourthed.chinaenvironmentalscience.[7].herbert,d.,philipps,p.j.,strange,r.e.,1971.methodsenzymol.5b,265–277.
- 还没有人留言评论。精彩留言会获得点赞!