一种组氨酸标签蛋白亲和纯化材料及其应用的制作方法
本发明属于功能性生物材料制备及其在蛋白质识别及纯化中的应用,具体的说是一种新型的基于金属螯合作用的分子印迹材料制备及其作为亲和纯化材料用于组氨酸标签蛋白的识别及纯化。
背景技术:
重组蛋白技术是一种非常重要的、可获得大量目标蛋白的技术,在蛋白质结晶、蛋白质药物、蛋白质相互作用及结构蛋白质组学研究中具有非常重要的作用(T.Hyeon,et al.Adv.Mater.,2010,22,57–60;A.S.Robinson,et al.Biotechnol.J.,2012,7,620–634)。从蛋白质结构与功能的基础研究到功能性蛋白质表达与纯化工艺的开发,亲和标签已经成为重组蛋白纯化的一个重要且有效的工具,其中组氨酸标签具有标签短小、不影响蛋白构象及功能、表达暴露于蛋白表面、亲和力强、易于纯化等优点,是目前重组蛋白纯化中使用最广泛亲和标签。
目前组氨酸标签蛋白一般采用固定化金属离子亲和色谱(IMAC)进行分离纯化,即通过IMAC材料上的金属离子与组氨酸标签之间的螯合作用实现组氨酸标签蛋白的捕获,随后利用竞争性螯合试剂或低pH洗脱液洗脱,使组氨酸标签蛋白特异性洗脱,实现其纯化。然而,由于IMAC材料上金属离子暴露在材料表面,任何可与金属离子产生螯合作用的蛋白质均可被捕获在IMAC上,如表面富含组氨酸、半胱氨酸、赖氨酸的蛋白质。另外,含有金属离子的蛋白质也可被IMAC捕获(A.S.Robinson,et al.Biotechnol.J.,2012,7,620–634)。这些蛋白质的吸附会导致组氨酸标签纯化纯度大幅降低,为达到所需纯度必须进行后期的二次甚至三次纯化(J.K.Shea,etal.J.Am.Chem.Soc.,2014,136,1194-1197),纯化步骤越多,纯化回收率越低,相对应的纯化成本也大幅增加。因此,开发新型的组氨酸标签蛋白亲和纯化材料意义重大。
分子印迹技术是通过人工合成方法制备对目标分子进行特异性识别材料的技术(M.J.Whitcombe,et al.Chem.Soc.Rev.,2011,40,1547–1571;J.K.Shea,et al.Angew.Chem.Int.Ed.,2006,45,2392–2396)。以目标分子或者目标分子上特异性区域为模板进行印迹,去除模板后形成的印迹位点具有与目标分子匹配的形状及互补的相互作用力,可以对目标分子进行特异性识别。与天然的分子识别系统相比,如抗体,分子印迹材料不仅选择性高,还具有环境耐受性强,重复利用性好等优势。
因此,我们选择IMAC材料作为基质材料,以组氨酸标签为模板,通过分子印迹技术在IMAC材料表面形成组氨酸标签的分子印迹层。由于分子印迹层的阻挡作用,不含组氨酸标签的蛋白质无法靠近IMAC材料上的螯合位点;而组氨酸标签与印迹位点具有匹配的形状及相互作用力,因此可以进入印迹位点, 进而被螯合位点底部的金属离子螯合捕获。通过结合金属螯合的强亲和力及分子印迹的高选择性,制备得到了新型的组氨酸标签蛋白亲和纯化材料,并实现了组氨酸标签蛋白的高纯度纯化。
技术实现要素:
选择表面固载了金属离子的基质材料,以组氨酸标签为模板分子,利用金属螯合作用将模板分子固载于基质材料表面,通过功能单体的聚合形成分子印迹层,去除组氨酸标签模板后形成基于金属螯合作用的组氨酸标签分子印迹材料;并且将该材料用于组氨酸标签蛋白的亲和纯化中,该材料可对组氨酸标签蛋白进行特异性捕获、释放及纯化。为实现上述目的,本发明采用的技术方案为:
将组氨酸标签模板通过金属螯合作用固载于表面固载了金属离子的基质材料表面,通过功能单体的聚合反应在基质材料表面形成聚合物层;随后利用竞争性螯合试剂或低pH洗脱液进行洗脱,使模板分子得以洗脱,形成印迹位点,得到分子印迹材料。
具体步骤为:
(1)在基质材料表面通过化学修饰引入金属螯合配基,如IDA、NTA、DPA、OPS、多巴胺等,利用金属螯合配基与金属离子的螯合作用,将金属离子(如Cu2+,Ni2+,Co2+)固载于基质材料表面。
(2)在室温条件下,在上述基质材料中加入组氨酸标签模板溶液,室温下反应,使模板固载于基质材料表面。
(3)随后将上述固载了模板的基质材料与功能单体分散于聚合溶剂中,加入引发剂,搅拌情况下进行聚合;聚合溶剂可以是甲醇、乙醇、乙腈、甲苯、二甲基亚砜(DMSO)、N,N-二甲基甲酰胺(DMF)、N-甲基甲酰胺(NMP)、水及上述溶剂以任意比例混合所得的混合溶剂。
(4)聚合完成后,反复用20mM-2000mM的竞争性螯合试剂或者pH为0-7的洗脱液清洗聚合物材料,使其中的模板分子洗脱出来,直至洗脱液中检测不出模板分子,进而得到基于金属螯合作用的分子印迹材料(MIP);竞争性螯合试剂可以是咪唑、组氨酸、半胱氨酸、赖氨酸及含有上述基团的化合物等。
(5)在基质材料上不固载模板分子,通过上述相同的步骤制备得到非印迹微球1(NIP1)。
(6)在基质材料上只固载金属离子,不进行后续印迹过程,制备得到非印迹材料2(NIP2)。
(7)将该分子印迹材料用于生物分析、生物化工、生物技术领域内组氨酸标签蛋白的选择性捕获、释放及纯化。
所述金属螯合作用,是指:固载于基质材料表面的金属离子与组氨酸或组氨酸残基之间的螯合作用;所述的金属离子是指可提供金属螯合相互作用的离子,包括Cu2+,Ni2+,Zn2+,Fe2+,Ca2+,Co2+,Fe3+,Al3+,Yb3+或Ga3+ 中的一种或二种以上;所述的金属离子通过螯合基团固载于基质材料表面,螯合基团包括亚氨基二乙酸基团(IDA)、次氨基三乙酸基团(NTA)、二甲基吡啶胺基团(DPA)、磷酸化丝氨酸基团(OPS),三(2-胺乙基)胺基团、多巴胺基团或磷酸基团中的一种或二种以上。
所述组氨酸标签模板,是指:由2-50个连续的组氨酸残基构成的肽段,该肽段可通过化学合成、重组表达获得,也可从天然蛋白中提取。
所述的基质材料是指表面可固载金属离子的无机或有机高分子材料,包括琼脂糖、磁性颗粒、硅基质、金属氧化物基质或丙烯酸酯基质中的一种或二种以上;所述的功能单体是指可以聚合形成高分子聚合物的单体,包括丙烯酰胺类、硅氧烷类、多巴胺、乙烯基类、丙烯基类或苯乙烯基类中的一种或二种以上。
所述的组氨酸标签模板的固载方法为:将组氨酸标签模板按模板:基质材料的质量比1:1000-3000:1000加入基质材料的悬浮液中,室温下反应,使组氨酸标签模板固载于基质材料上。
所述的功能单体聚合是指:按功能单体:基质材料的质量比1:1000-100000:1000将功能单体加入固载了模板的基质材料悬浮液中,加入引发剂,随后在0℃-200℃下聚合1分钟-72小时;上述引发剂为包括过硫酸盐引发剂、偶氮二异丁腈、偶氮二异庚腈、过硫酸铵/亚硫酸氢钠氧化还原引发剂或过硫酸钾/亚硫酸氢钠氧化还原引发剂中的一种或二种以上。
所述的竞争性螯合试剂,是指可与基质材料上的金属离子产生金属螯合相互作用的任何试剂,包括咪唑、组氨酸、半胱氨酸、赖氨酸及含有咪唑及吲哚基团的化合物、多巴胺、乙二胺四乙酸(EDTA)、IDA、NTA或DPA中的一种或二种以上。所用的竞争性螯合试剂浓度为20mM-5000mM。
所述的低pH洗脱是指在pH为0-7条件下洗脱金属离子。洗脱过程中,可单独使用竞争性螯合试剂和低pH洗脱液,也可二者共同使用。
上述组氨酸标签蛋白亲和纯化材料在生物分析、生物化工、生物技术领域内组氨酸标签蛋白的选择性捕获、释放及纯化中可以得到广泛应用。
本发明具有如下优点:
(1)本发明以IMAC材料为基质,利用分子印迹技术制备得到了可用于组氨酸标签蛋白亲和纯化的新型亲和纯化材料。通过表面分子印迹技术形成组氨酸标签的表面印迹位点,充分结合了印迹位点高选择性及IMAC材料的亲和性,降低了组氨酸标签蛋白纯化时强非特异性吸附的干扰,提高了纯化纯度。
(2)本发明中所得的亲和纯化材料对组氨酸标签蛋白识别时,分子印迹位点与IMAC同时起作用,识别时的亲和力是印迹位点的亲和性与IMAC的金属螯合作用的叠加,因此对组氨酸标签蛋白有更高的亲和力。
(3)本发明中IMAC材料外包被一层分子印迹聚合物层,这会阻碍IMAC 材料上金属离子向外扩散,降低了金属离子泄露的可能。
(4)本发明中金属离子可以被竞争螯合试剂如乙二胺四乙酸(EDTA)洗脱,随后可用其他种类的金属离子进行再生以适用于不同需求的纯化。
(5)本发明基质材料、金属螯合臂、金属离子及分子印迹聚合物层都具有很好的稳定性,因此所制备得到的材料可以重复利用。
附图说明:
图1实施例1制备的基于金属螯合作用的分子印迹材料(MIP1)的透射电镜图。
图2实施例1、2、3制备的印记材料和非印记材料对组氨酸标签蛋白纯化效果图。
图3实施例1制备的基于金属螯合作用的分子印迹材料(MIP2)的透射电镜图。
图4MIP2对组氨酸标签蛋白纯化效果图。
图5MIP3对组氨酸标签蛋白纯化效果图。
实施例1
基于IDA及Ni2+螯合作用的组氨酸标签分子印迹二氧化硅材料(MIP1)的制备
采用法制备单分散性的二氧化硅纳米颗粒,参考文献方法制备表面修饰IDA及Ni2+的基质材料(L.Zhang,et al.Chem.Commun.,2011,47,3969-3971;L.Zhang,et al.Anal.Chem.,DOI:10.1021/ac5047246):5g二氧化硅纳米颗粒加入100mL GLYMO-IDA溶液中,65℃下反应24小时,将IDA基团修饰于二氧化硅材料表面。将5g上述材料加入150mL甲醇中,随后加入10mLγ-MAPS,于90℃下回流15小时,在该基质材料表面修饰γ-MAPS,以便作为基质材料进行印迹。随后将100mg上述材料重新分散于1mL 12mg/mL模板分子组氨酸标签(HHHHHH)的水溶液中(模板分子与上述基质材料质量比为120:1000),室温下孵育2h。4500rpm离心5min收集材料,弃去上清,用水冲洗所得固体,重悬所得固体于20mL乙腈中,加入15mg丙烯酰胺(AAm),15mg亚甲基双丙烯酰胺(MBA),0.7mg AIBN(功能单体AAm和MBA与基质材料的比为300:1000),通N220min后,65℃磁力搅拌反应12h,4500rpm离心5min收集材料,弃去上清,收集固体,随后用250mM咪唑水溶液反复清洗所得材料,直至高效液相色谱(日立高新chromaster,10×4.6mm,C18柱)检测不出洗脱液中的模板分子,真空干燥,得到基于金属螯合作用的组氨酸标签分子印迹材料(MIP1)。如图1,所制得印迹材料大小均匀、分散性好,粒径300-400nm。同时,DLS粒径表征及热重表征均显示基质材料外表面形成了聚合物分子印迹层,层厚约2-3nm,这既保证可形成完整的印迹位点,又降低了印迹位点的传质阻力,使目标蛋白能够在短时间内进入识别位点,达到吸附平衡。
实施例2
与实施例1用相同的方法,但不加模板分子组氨酸标签(HHHHHH),制备 得到非印迹材料1(NIP1)。
实施例3
与实施例1用相同的方法,在基质材料上只固载金属离子,不进行后续印迹过程,制备得到非印迹材料2(NIP2)。
实施例4
基于IDA及Ni2+螯合作用的组氨酸标签分子印迹材料用于组氨酸标签蛋白的纯化
4mg MIP1用80μL含10mM咪唑的磷酸盐缓冲液作为上样缓冲液于4℃下清洗两次,使MIP1处于上样环境。将重组蛋白提取液用上样缓冲液稀释至4mg/mL,加200μL于上述预平衡的MIP1中,4℃下振荡孵育30min。4800rpm离心10min收集材料,100μL上样缓冲液洗涤一次,去除未结合蛋白。30μL含25mM咪唑的磷酸盐缓冲液作为洗涤缓冲液洗涤2次,30min/次,以去除弱结合的杂蛋白。30μL含250mM咪唑的磷酸盐缓冲液洗脱缓冲液洗脱4次,30min/次,洗脱组氨酸标签蛋白,SDS-PAGE分析纯化产物。
作为参照组,与上述步骤相同的操作条件下,分别用NIP1、NIP2代替MIP1对组氨酸标签蛋白进行纯化,SDS-PAGE分析。
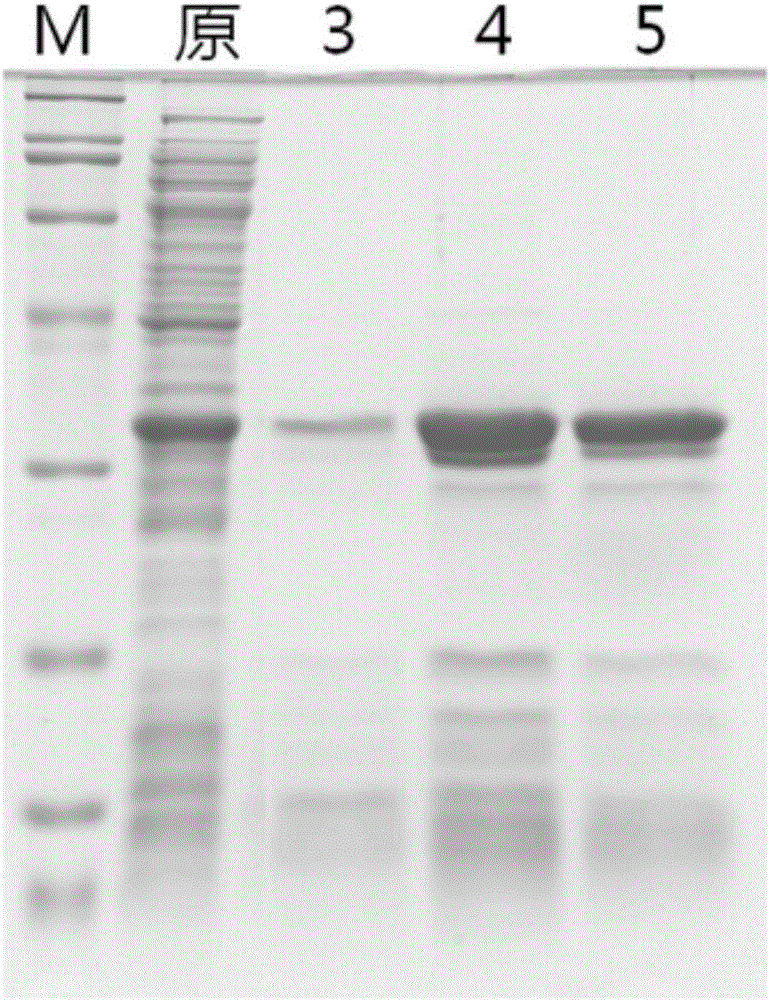
如图2,其中1号泳道(lane1)为标准蛋白Marker,泳道2(lane2)为含有组氨酸标签蛋白的细胞裂解液,泳道3、4、5分别为NIP1、NIP2、MIP1纯化后的组氨酸标签蛋白。由于NIP1表面包被了聚合物层,而没有分子印迹位点,因此目标蛋白很难进入金属螯合位点被捕获,因此捕获的目标蛋白很少,纯度仅为19%(lane 3);而NIP2表面没有聚合物层,金属螯合位点裸露在外,因此可大量捕获目标蛋白组氨酸标签蛋白,但是同时也吸附了大量的干扰蛋白,纯度为38%(lane 4);而MIP表面存在分子印迹层,可阻碍干扰蛋白接近螯合位点,降低了非特异性吸附,同时表面上存在的印迹位点可选择性地使组氨酸标签蛋白进入印迹位点进而被捕获,因此MIP对目标蛋白吸附量较高,而对非特异性吸附明显降低,纯化纯度可提高至65%(lane 5)。
实施例5
基于IDA及Ni2+螯合作用的组氨酸标签分子印迹磁性材料(MIP2)的制备及应用
采用溶剂热法制备包被有硅层的磁性纳米颗粒,参考文献方法制备表面修饰IDA及Ni2+的基质材料(L.Zhang,et al.Chem.Commun.,2011,47,3969-3971;L.Zhang,et al.Anal.Chem.,DOI:10.1021/ac5047246):5g二氧化硅包被的Fe3O4纳米颗粒加入100mL GLYMO-IDA溶液中,65℃下反应24小时,将IDA基团修饰于二氧化硅材料表面。将5g该材料加入150mL甲醇中,随后加入10mLγ-MAPS,于90℃下回流15小时,在该基质材料表面修饰γ-MAPS,以便作为基质材料进行印迹。随后通过甲醇回流的方法,在该基质材料表面修饰γ-甲基丙烯酰氧基丙基三甲氧基硅烷(γ-MAPS),以便后续进行印迹。同实施例1印迹方法,以1.2mg 过硫酸铵和10ul四乙基二乙胺作为引发剂,可制得基于IDA及Ni2+螯合作用的组氨酸标签分子印迹磁性材料(MIP2),如图3所示。同实施例1,用MIP2代替其中的MIP1纯化组氨酸标签蛋白,纯化结果如图4示,其中1号泳道(lane1)为标准蛋白Marker,泳道2(lane2)为含有组氨酸标签蛋白的细胞裂解液,泳道3为MIP2纯化后的组氨酸标签蛋白。如图所示,含有组氨酸标签蛋白的细胞裂解液(lane2)中组氨酸标签蛋白的含量仅为15%,经过MIP2纯化(lane3),纯化组分中组氨酸标签蛋白的纯度可达到80%,体现了MIP2良好的纯化效果。
实施例6
基于NTA及Ni2+螯合作用的组氨酸标签分子印迹二氧化硅材料(MIP3)的制备及应用
采用法制备单分散性的氨基二氧化硅纳米粒子:2g二氧化硅纳米颗粒加入100mL甲苯中,随后加入2mL APTES于120℃下回流36小时,将氨基修饰于二氧化硅材料表面。2g上述材料分散于40mL甲苯中,于120℃下加入4mLγ-MAPS后回流24小时。3600rpm下离心10分钟,收集材料。将上述材料重悬于磷酸盐缓冲液中,加入5mL戊二醛,于50℃下反应5小时,3600rpm下离心10分钟,收集沉淀。用水清洗沉淀3次,随后将沉淀重悬于50mL磷酸盐缓冲液中,加入100mg NTA,60℃下反应5小时。3600rpm下离心10分钟,收集沉淀,用水清洗三次后,将该材料重悬于200mL 1mg/mL NiSO4水溶液中,室温下反应4小时,得到表面固载了Ni2+的基质材料。用得到的基质材料代替实施例1中的基质材料,可制得基于NTA及Ni2+螯合作用的组氨酸标签分子印迹磁性材料(MIP3),其纯化结果如图5所示,其中1号泳道(lane1)为标准蛋白Marker,泳道2(lane2)为含有组氨酸标签蛋白的细胞裂解液,泳道3为MIP3纯化后的组氨酸标签蛋白。如图所示,含有组氨酸标签蛋白的细胞裂解液(lane2)中组氨酸标签蛋白的含量仅为15%,由于MIP3上金属螯合相互作用与表面印迹层的作用,经过MIP3纯化(lane3),纯化组分中组氨酸标签蛋白的纯度可高达90%,充分说明了MIP3良好的性能。
实施例7
基于多巴胺单体的组氨酸标签分子印迹二氧化硅材料(MIP4)的制备
其他条件同实施例6,制备表面修饰NTA及γ-MAPS的基质材料。以多巴胺为功能单体进行印迹,聚合1小时,可制备得到基于多巴胺单体的组氨酸标签分子印迹二氧化硅材料(MIP4)。
实施例8
基于NIPAAm单体的组氨酸标签分子印迹二氧化硅材料(MIP5)的制备
其他条件同实施例6,制备表面修饰NTA及γ-MAPS的基质材料。以N-异丙基丙烯酰胺(NIPAAm)为功能单体进行印迹,聚合48小时,可制备得到 基于NIPAAm单体的组氨酸标签分子印迹二氧化硅材料(MIP5)。
实施例9
其他条件同实施例1及实施例6,用CoSO4处理表面固载有IDA或NTA的基质材料,可将Co2+螯合在该材料表面,随后进行后续印迹过程,可制备得到基于Co2+螯合的组氨酸标签分子印迹亲和纯化材料(MIP6)。
实施例10
其他条件同实施例1,模板固载时将100mg基质材料分散于1mL 1mg/mL HHHHHH溶液中(模板与基质材料质量比为10:1000),经过后续印迹过程,制备得到亲和纯化材料(MIP7)。
实施例11
其他条件同实施例1,模板固载时将100mg基质材料分散于10mL 20mg/mL HHHHHH溶液中(模板与基质材料质量比为2000:1000),经过后续印迹过程,制备得到亲和纯化材料(MIP8)。
实施例12
其他条件同实施例1,在100mg固载了模板的基质材料中加入0.5mg AAm及0.5mg MBA,经过后续操作,制备得到基质材料与功能单体比例为10:1000的亲和纯化材料(MIP9)。
实施例13
其他条件同实施例1,将100mg固载了模板的基质材料重悬与200mL乙腈中,随后在其中加入2000mg AAm及2000mg MBA,经过后续操作,制备得到基质材料与功能单体比例为40000:1000的亲和纯化材料(MIP10)。
- 还没有人留言评论。精彩留言会获得点赞!