(R)-1-(1-(2-萘基)乙基)硫脲修饰的Cr-Anderson型杂多酸催化剂、制备方法及其应用与流程
本发明属于催化化学技术领域,尤其涉及不对称选择催化,具体来说,是一种(R)-1-(1-(2-萘基)乙基)硫脲修饰的Cr-Anderson型杂多酸催化剂、制备方法及其应用。
背景技术:
2001年诺贝尔奖获得者Noyori教授指出:“未来的合成化学必须是经济的、安全的、环境友好的以及节省资源和能源的化学,化学家需要为实现‘完美的反应化学’而努力,即以100%的选择性和100%的收率只生成需要的产物而没有废物产生”。手性催化合成作为实现“完美合成化学”的重要途径之一,其中,手性催化剂是手性催化研究中的最核心科学问题。从反应原理上看,手性有机小分子催化是通过和反应底物以不稳定的共价键可逆地形成活性中间体或通过若相互作用,如氧键、范德华力或离子对等活化反应底物。
催化是多金属氧酸盐应用中最有前途且最具实用价值的研究方向。多金属氧酸盐同时集酸碱催化剂、氧化还原催化剂、金属氧化物纳米催化剂等的优良特性于一身,被认为是一种应用广泛的绿色的多功能催化剂。早在20世纪初,人们就开始对多酸的催化性能进行了研究。到目前为,已有8个多酸催化工业化项目被成功开发。
自从1993年Zubieta等人在《Nature》上报道采用水热技术成功制备了类似DNA的手性双螺旋结构的化合物(Me2NH2)K4[V10O10(H2O)4(OH)4(PO4)7]·H2O后,人们便开始了手性多酸在不对称催化领域的探索。中国科学院化学所的罗三中教授等人在以有机胺小分子催化剂作为抗衡阳离子,多酸作为催化剂负载载体的领域做出了出色的工作(Organic letters,2007,9(18):3675-3678.)。他们合成了一系列的仲胺-叔胺型脯氨酸衍生物,采用强酸性多阴离子的[PW12O40]3-替代传统酸-碱协同催化中的矿物酸,合成了一系列手性有机胺-多酸杂化材料。这些材料对醛酮的直接Aldol反应,不对称Michael加成反应等都表现出很高的催化活性和手性选择性。有机胺小分子作为抗衡阳离子与多酸通过静电作用组装,但这些材料没有明确的分子结构,不能进一步探究催化机理,不能解释手性胺与多酸的协同作用。大连物化所段春迎课题组利用多金属氧酸盐(POMs)的组成、结构的多样性以及电荷的可调变性,设计组装一系列具有催化功能的多孔性的POMOFs,实现了它们在多相催化中的应用(Journal of the American Chemical Society,2013,135(28):10186-10189.),但这些材料同样没有明确的分子结构,不能进一步探究催化机理,不能解释MOFs与POMs的协同作用。
此外,目前,手性有机小分子催化剂很难实现用于工业化生产,主要由于催化剂活性较低、用量高且不易回收利用。要实现这些催化反应在工业上的应用,必须解决昂贵催化剂的回收利用是个严重的问题。
技术实现要素:
针对现有技术中的上述技术问题,本发明的目的在于提供一种(R)-1-(1-(2-萘基)乙基)硫脲修饰的Cr-Anderson型杂多酸催化剂、制备方法及其应用。本发明制备方法简单,得到的催化剂可用于对映选择性催化,催化活性高,用量少,易于回收利用。
本发明从有机小分子催化剂的设计思路出发,创新性地提出利用“酸-碱”协同催化策略,其以具有潜在催化活性的手性有机小分子作为前躯体,通过有机修饰等方法,巧妙地使有机小分子与高Bronsted酸性的缺位多阴离子结合,构筑手性多酸材料;本发明的手性多酸材料不但保留了多酸原有的结构,而且拓展了多酸的研究领域,使其在催化、药物和功能材料方面具有潜在应用价值。此外,多酸具有亲水性,可用绿色、廉价的水作溶剂进行催化反应,反应结束可向体系中加入有机溶剂(乙醇、甲醇等)后,多酸极易析出,可进行回收利用。
本发明技术方案具体如下。
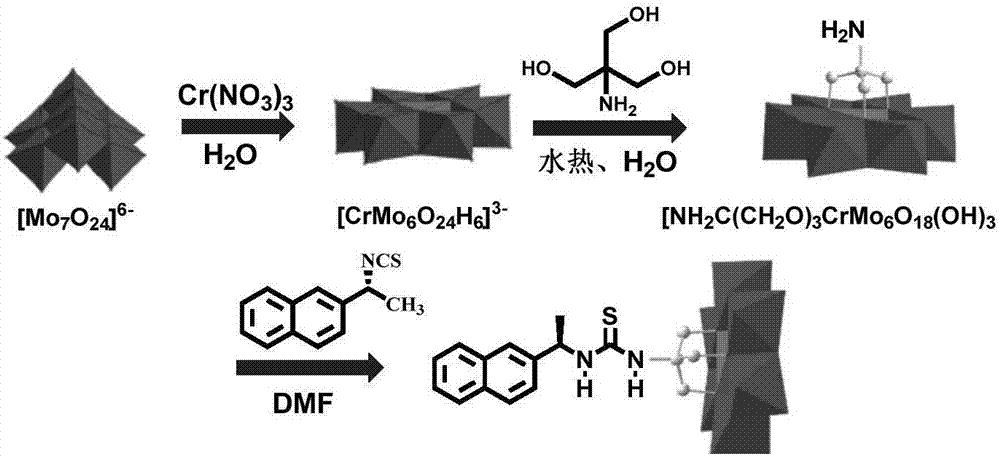
本发明提供了一种(R)-1-(1-(2-萘基)乙基)硫脲修饰的Cr-Anderson型杂多酸催化剂(结构见图1)的制备方法,其合成路线如图2所示,具体步骤如下:
1)以钼酸铵和硝酸铬为原料制备Cr-Anderson型杂多酸母体(NH4)3[Cr(OH)6Mo6O18];
2)将上述得到的Cr-Anderson型杂多酸母体(NH4)3[Cr(OH)6Mo6O18]与三羟基氨基甲烷在水热釜中进行水热反应后得到有机单侧氨基修饰的Cr-Anderson型多金属氧酸盐;
3)以(R)-(+)-1-(2-萘基)乙胺为原料合成(R)-1-(1-(2-萘基)乙基)异硫氰酸酯;
4)将步骤(2)合成的有机单侧氨基修饰的Cr-Anderson型多金属氧酸盐与步骤(3)合成的(R)-1-(1-(2-萘基)乙基)异硫氰酸反应得到(R)-1-(1-(2-萘基)乙基)硫脲修饰的Cr-Anderson型杂多酸催化剂。
上述步骤1)中,将钼酸铵和硝酸铬按照摩尔比为1:1~1:2比例混合,将体系的pH调到4~5,在80℃~100℃温度下反应制备Cr-Anderson型杂多酸母体(NH4)3[Cr(OH)6Mo6O18]。
上述步骤2)中,(NH4)3[Cr(OH)6Mo6O18]与三羟基氨基甲烷的摩尔比为1:2~1:5;水热反应温度为135~145℃;水热反应时间为20~30h。
上述步骤2)中,所述有机单侧氨基修饰的Cr-Anderson型多金属氧酸盐为[TBA]3{[NH2C(CH2O)3]CrMo6O18(OH)3}。其通过在水热反应后产物中,在80℃~90℃温度条件下,加入四丁基溴化铵制备得到,四丁基溴化铵和(NH4)3[Cr(OH)6Mo6O18]的投料摩尔比为3:1~5:1。
上述步骤4)中,将有机单侧氨基修饰的Cr-Anderson型多金属氧酸盐和(R)-1-(1-(2-萘基)乙基)异硫氰酸酯用有机溶剂在45~55℃温度下溶解后,搅拌下反应时间2~3天,反应结束后,将得到的澄清液放置乙醚氛围中结晶,即获得(R)-1-(1-(2-萘基)乙基)硫脲修饰的Cr-Anderson型杂多酸催化剂。所述有机单侧氨基修饰的Cr-Anderson型多金属氧酸盐和(R)-1-(1-(2-萘基)乙基)异硫氰酸的摩尔比为1:3~1:5,有机溶剂选自DMF、DMSO或者NMP中的任意一种或几种。体系反应结束后,若反应液不澄清,应用针头过滤器处理,得到澄清液后放置乙醚氛围中结晶。
本发明还提供一种上述制备方法得到的(R)-1-(1-(2-萘基)乙基)硫脲修饰的Cr-Anderson型杂多酸催化剂。
进一步的,本发明提供上述(R)-1-(1-(2-萘基)乙基)硫脲修饰的Cr-Anderson型杂多酸催化剂在烯烃的不对称双羟基化反应领域的应用。优选的,应用方法如下:将烯烃和(R)-1-(1-(2-萘基)乙基)硫脲修饰的Cr-Anderson型杂多酸催化剂在水和乙腈组成的混合溶剂中混合,30~50℃下反应,得到邻二醇化合物。进一步优选的,水和乙腈的摩尔比为1:1~3:1,过氧化氢为氧源,其使用量为1-3当量(以烯烃为参考),(R)-1-(1-(2-萘基)乙基)硫脲修饰的Cr-Anderson型杂多酸催化剂的量为烯烃的0.5mol%~5mol%。
进一步的,本发明的催化剂用于烯烃的不对称双羟基化反应后,通过向相体系中加入有机溶剂(乙醇、甲醇等)后,多酸析出,过滤,真空干燥,可将回收的多酸再用于烯烃的不对称双羟基化反应。
本发明的有益效果在于:其不仅可以利用手性有机小分子的共价修饰作用打破多酸的高对称性,引入手性,提高其在催化反应中的立体选择性,而且也能将有机手性小分子的不对称催化或生物医药活性等功能特性引入多酸,并使有机部分与无机的多阴离子有机地结合为一个整体,从而产生协同作用获得更多新颖的性质。本发明制备方法反应条件温和、环境友好;本发明的催化剂催化活性高、对映选择性高,并且可回收利用,适用于工业化生产。
附图说明
图1是本发明目标催化剂的结构图示。
图2是本发明的合成路线图示。
图3是母体(NH4)3[Cr(OH)6Mo6O18]的红外谱图。
图4是(R)-1-(1-(2-萘基)乙基)异硫氰酸酯的1HNMR图。
图5是单侧氨基修饰的Cr-Anderson型多金属氧酸盐的红外谱图。
图6是(R)-1-(1-(2-萘基)乙基)硫脲修饰的Cr-Anderson型杂多酸催化剂的1HNMR图。
具体实施方式
以下采用实施例来详细说明本发明的实施方式,借此对本发明如何应用技术手段来解决技术问题,并达成技术效果的实现过程能充分理解并据以实施。
实施例1
Cr-Anderson型杂多酸母体(NH4)3[Cr(OH)6Mo6O18]的制备
取7.41g(6mmol)钼酸铵加入到20mL去离子水中,充分搅拌得到澄清液,之后滴加浓硝酸,将体系的pH调到4~5。加热到沸腾,维持强力搅拌,开始缓慢加入1.66g(7mmol)硝酸铬固体,搅拌至有大量粉红色固体产生,停止搅拌,静置15~30分钟。抽滤,得到5.26g粉红色晶状固体原料,收率82%。
母体(NH4)3[Cr(OH)6Mo6O18]的红外谱图如图3所示。
实施例2
(R)-1-(1-(2-萘基)乙基)异硫氰酸酯的制备
在干燥的反应容器中加入(R)-(+)-1-(2-萘基)乙胺(0.8562g,5mmol),用20mL乙醇溶解,随后分别缓慢加入加CS2(0.1142g,15mmol)和三乙胺(0.506mg,5mmol),在室温搅拌反应1h后,随后在0℃条件下加入二碳酸二叔丁酯(Boc2O)(1.091mg,5mmol)和4-二甲氨基吡啶(DMAP)(18mg,0.15mmol),在室温搅拌反应2h后(在搅拌的过程有气体产生,应注意放气减压),可获得0.8448g(R)-1-(2-(萘基)乙基)异硫氰酸酯。收率为79.6%。
(R)-1-(1-(2-萘基)乙基)异硫氰酸酯的核磁谱图如图4所示;其核磁数据如下:
1H NMR(501MHz,CDCl3)δ7.94–7.77(m,4H),7.50(ddd,J=10.0,7.1,1.8Hz,3H),5.12(d,J=6.8Hz,1H),1.79(d,J=6.8Hz,3H).
实施例3
单侧氨基修饰的Cr-Anderson型多金属氧酸盐的制备
将上述得到的Anderson母体(NH4)3[Cr(OH)6Mo6O18]1.071g(1mmol)用10mL去离子水中溶解,得到浅红色清液后,缓慢加入三羟基氨基甲烷0.402g(3mmol)。之后将上述体系加入水热釜中,加热到140℃,反应进行24h后,在85℃条件下将4.83g四丁基溴化铵加入上述的溶液中,产生大量粉红色沉淀即粗产物,抽滤即可得到红色液体,放置得到结晶,即为有机单侧氨基饰修的Cr-Anderson型多酸[TBA]3{[NH2C(CH2O)3]CrMo6O18(OH)3}。
单侧氨基修饰的Cr-Anderson型多金属氧酸盐的红外谱图如图5所示。
实施例4
(R)-1-(1-(2-萘基)乙基)硫脲修饰的Cr-Anderson型杂多酸催化剂的制备
将有机单侧氨基修饰[TBA]3{[NH2C(CH2O)3]CrMo6O18(OH)3}0.5g(0.275mmol)用5mL的DMF在50℃条件下溶解后,加入(R)-1-(1-(2-萘基)乙基)异硫氰酸酯0.213g(1mmol),维持50℃搅拌条件下,反应时间2~3天,反应结束后将水红澄清液放置乙醚氛围中结晶,若干天后可得到红色晶体,即获得(R)-1-(1-(2-萘基)乙基)硫脲修饰的Cr-Anderson型杂多酸催化剂。
(R)-1-(1-(2-萘基)乙基)硫脲修饰的Cr-Anderson型杂多酸催化剂的核磁谱图如图6所示,核磁数据如下:
1H NMR(501MHz,DMSO)δ7.64–6.93(m,5H),3.17(s,24H),1.98(s,2H),1.57(s,24H),1.32(s,24H),1.24(s,3H),0.94(s,36H).
实施例5
(R)-1-(1-(2-萘基)乙基)硫脲修饰的Cr-Anderson型多酸催化烯烃的不对称双羟基化反应
在干净的反应瓶中加入1.0415g(0.01mol)苯乙烯,再加入10ml混合溶剂(水和乙腈的摩尔比为1:1~3:1),最后加入1.7g 30%过氧化氢和0.0220g(R)-1-(1-(2-萘基)乙基)硫脲修饰的Cr-Anderson型多酸催化剂,反应24h,取5ml乙醇加入反应体系,离心使催化剂沉降,再加入3ml乙醇再次分离催化剂,过滤,得到催化剂,真空干燥。用乙酸乙酯将反应体系萃取3次,所得到的产品减压除去溶剂,柱层析分离得到邻二醇化合物,得到产品1.3611g,收率为99%。产品的对映体过量由手性高效液相色谱测得,ee值达99%。该催化剂都能够不同程度的催化反应的进行,并且具有较好的立体选择性。
使用催化剂对不同烯烃进行双羟基化反应的方程式如下所示,所得到的实验结果见表1。
将实施例5回收得到的催化剂直接循环应用于苯乙烯的双羟基化反应,所得到产品的对映体过量值由HPLC测定(手性AS-H柱,异丙醇:正己烷=3:7,254nm,20℃,0.5mL/min)。催化剂回收利用所得到的结果见表2。
表1多酸催化烯烃的不对称双羟基化反应实验结果
表2催化剂回收利用的实验结果
所有上述的实施方式,并没有设定限制其他形式的实施这种新产品和/或新方法。本领域技术人员将利用这一重要信息,上述内容修改,以实现类似的执行情况。但是,基于本发明的修改或改造基于属于本发明保留的权利。
以上所述,仅是本发明的较佳实施例而已,并非是对本发明作其它形式的限制,任何熟悉本专业的技术人员可能利用上述揭示的技术内容加以变更或改型为等同变化的等效实施例。但是凡是未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与改型,仍属于本发明技术方案的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!