用于整合的样品制备、反应和检测的器械和方法与流程
与相关申请的相交参考
本申请要求于2010年2月23日提交的名称为“CASSETTE AND INSTRUMENT FOR INTEGRATED NUCLEIC ACID ISOLATION AND AMPLIFICATION”的美国临时申请序列号61/307,281的优先权,其通过引用整体合并入本文。
本申请是于2010年5月28日提交的名称为“CASSETTE FOR SAMPLE PREPARATION”的美国专利申请序列号12/789,831的部分继续申请,其是于2006年10月17日提交的名称为“CASSETTE FOR SAMPLE PREPARATION”的美国申请号11/582,651的继续,其要求于2005年10月19日提交的名称为“METHOD AND APPARATUS FOR ISOLATING NUCLEIC ACID”的美国临时申请号60/728,569;于2005年12月22日提交的名称为“CASSETTE FOR SAMPLE PREPARATION”的美国临时申请号60/753,622;和于2005年12月22日提交的名称为“CASSETTE FOR SAMPLE PREPARATION”的美国临时申请号60/753,618的利益,其各自通过引用整体合并入本文。本申请还是于2010年6月23日提交的名称为“INSTRUMENT FOR CASSETTE FOR SAMPLE PREPARATION”的美国专利申请序列号12/821,446的部分继续申请,其是于2007年12月27日提交的名称为“INSTRUMENT FOR CASSETTE FOR SAMPLE PREPARATION”的美国专利申请序列号12/005,860的继续,其要求于2006年12月27日提交的名称为“INSTRUMENT FOR CASSETTE FOR SAMPLE PREPARATION”的美国临时申请序列号60/882,150的优先权,其各自通过引用整体合并入本文。
技术领域
本文描述的实施方案涉及用于样品制备、反应和分析的器械和方法。更特别地,本文描述的实施方案涉及药筒和仪器,在其内可以执行在整合过程中的核酸分离、扩增和分析。
背景技术:
某些已知的诊断程序包括核酸例如DNA或RNA的分离和分析。用于分离样品内的核酸的已知方法通常包括几个步骤,例如:(1)通过加入蛋白酶(例如蛋白酶K)去除样品内的蛋白质;(2)分解剩余大块样品以暴露其中含有的核酸(也称为细胞裂解);(3)沉淀来自样品的核酸;和(4)洗涤和/或以其他方式制备核酸用于进一步分析。
在特定情况下,经分离的核酸的扩增(例如核酸的复制以增加其体积)是用于进一步分析所需的。聚合酶链反应(PCR)过程是用于扩增核酸分子的部分的已知技术。在PCR中,将含有靶DNA的输入样品与试剂混合,所述试剂包括DNA聚合酶(例如Taq聚合酶)。输入样品可以是例如通过上述程序产生的经分离的核酸样品。随后将样品在分离室内热循环多次,以完成反应。小心控制热循环的温度和时间段,以确保准确结果。在DNA序列充分扩增后,它可以使用多种光学技术进行分析。
用于执行核酸分离和扩增的某些已知系统包含不同部分(例如分离部分和扩增部分),样品必须使用可以损害样品的完整性的人为干预和/或过程在其间转移。用于执行核酸分离和扩增的某些已知系统包括要求通过富有经验的实验室技术员的大量准备和/或校正的复杂控制系统。相应地,此类已知系统并非充分适合于“工作台(bench top)”应用、高容量诊断程序和/或在品种多样的实验室设置中使用。
在特定应用中,可能需要反应的多个阶段,其中一个或多个后期阶段要求在反应的阶段之间添加试剂。例如,在逆转录PCR中,逆转录反应一般在执行PCR过程前完成,其中PCR过程需要另外试剂。在某些已知系统中,反应的稍后阶段所需的另外试剂通常由可以损害样品的完整性的人为干预和/或过程转移到反应室内。相应地,此类已知过程可以诱导错误和污染,并且还可以是对于高容量应用昂贵和/或难以实现的。
尽管某些已知系统包括含有试剂的室,但此类室通常整合至药筒和/或反应室。相应地,当此类系统和/或药筒与不同反应和/或测定法结合使用时,通常使用完全不同的药筒、盒或其他器械,以促进使用试剂的特定组合进行所需反应过程。因此,此类已知系统和/或药筒通常对于不同反应过程和/或测定法是不可互换使用的。
尽管某些已知系统包括光学检测系统以检测在测试样品内的一种或多种不同试剂和/或靶,但此类已知系统通常包括在相对于反应室可移动的装置部分中的激发光来源和/或发射光检测器。例如,某些已知系统配置为经由可移动的盖对反应室供应激发光束。因此,此类已知系统对检测变动是敏感的,所述检测变动可以起因于激发和/或检测光程的位置中的变动。
因此,存在关于用于执行核酸分离和扩增的改良器械和方法的需要。
技术实现要素:
用于执行样品分离和下游反应的药筒和仪器在本文中描述。在某些实施方案中,器械包括例如可以用于分离核酸样品的分离模块,和例如可以用于扩增核酸样品的反应模块。分离模块包括第一个外壳和第二个外壳。第一个外壳限定第一个室和第二个室。至少第一个室配置为含有样品,例如含有核酸的样品。第二个外壳包括侧壁和可穿透构件,其共同限定配置为含有第一种物质的第一个容积。第一种物质可以是例如待加入样品中的试剂、洗涤缓冲溶液、矿物油和/或任何其他物质。第二个外壳的至少一部分配置为安置在第一个外壳内,从而使得当可穿透构件的一部分被穿透时,第一个容积与第一个室液体连通。反应模块限定反应室和配置为含有第二种物质的第二个容积。反应模块配置为联接至分离模块,从而使得反应室和第二个容积各自与第一个外壳的第二个室液体连通。
在某些实施方案中,在本文提供的药筒和/或仪器中进行PCR。在一个进一步的实施方案中,借助于荧光探针实时监控反应,所述荧光探针例如包含在5′末端的小沟结合剂(MGB)和荧光团和在其3′末端的非荧光猝灭剂的单链DNA分子。在一个实施方案中,对多重靶进行PCR,并且实时监控反应的过程。在某些实施方案中,靶是来自下述病毒中的一种或多种的基因序列:甲型流行性感冒、乙型流行性感冒、呼吸道合胞病毒(RSV)、单纯疱疹病毒1型(HSV1)或单纯疱疹病毒2型(HSV 2)。在某些实施方案中,在PCR前,在本文提供的药筒和/或仪器中进行逆转录反应。
附图说明
图1和2分别是根据一个实施方案,以第一种配置和第二种配置的药筒的示意图。
图3是根据一个实施方案,具有第一个模块、第二个模块和第三个模块的药筒的示意图。
图4是根据一个实施方案,具有第一个模块、第二个模块和第三个模块的药筒的示意图。
图5是根据一个实施方案,具有第一个模块和第二个模块的药筒的示意图。
图6和7分别是根据一个实施方案,以第一种配置和第二种配置的药筒的一部分的示意图。
图8是根据一个实施方案的药筒的侧面透视图。
图9是图8中所示药筒的顶部透视图。
图10是图8中所示药筒的侧面横断面视图。
图11是图8中所示药筒的一部分的侧面分解图。
图12和13是图8中所示药筒的试剂模块的透视图。
图14是图12和13中所示试剂模块的一部分的透视图。
图15-18分别是以第一种配置、第二种配置、第三种配置和第四种配置的图8中所示药筒的分离模块的侧面横断面视图。
图19是图8中所示药筒的分离模块的侧面横断面视图。
图20是沿着图19中的线X1-X1获得的,图19中所示分离模块的活门组件的一部分的横断面视图。
图21是图19中所示分离模块的活门组件的一部分的透视图。
图22是图8中所示药筒的透视横断面视图。
图23是图8中所示药筒的PCR模块的透视图。
图24是图8中所示药筒的透视横断面视图。
图25是根据一个实施方案的药筒的侧面透视图。
图26是以第一种配置的图25中所示药筒的分离模块的侧面透视图。
图27是以第一种配置的图26中所示分离模块的侧面横断面视图。
图28是以第二种配置的图26中所示分离模块的侧面横断面视图。
图29是以第一种配置的图25中所示药筒的PCR模块的侧面透视图。
图30是以第一种配置的图29中所示PCR模块的侧面横断面视图。
图31是以第二种配置的图29中所示PCR模块的侧面横断面视图。
图32和33分别是以第一种配置和第二种配置的图25中所示药筒的侧面横断面视图。
图34是根据一个实施方案的仪器的一部分的示意图。
图35是根据一个实施方案的仪器的透视、横断面示意图。
图36是根据一个实施方案的仪器的透视图。
图37是图36中所示仪器的第一个驱动器组件的透视图。
图38是图37中所示第一个驱动器组件的分解透视图。
图39是图37中所示第一个驱动器组件的背面透视图。
图40是图37中所示第一个驱动器组件的一部分的透视图。
图41是图36中所示仪器的转移驱动器组件的顶部透视图。
图42是图41中所示转移驱动器组件的底部透视图。
图43是图41中所示转移驱动器组件的背面透视图。
图44是图41中所示转移驱动器组件的一部分的透视图。
图45是图41中所示转移驱动器组件的一部分的透视图。
图46是图41中所示转移驱动器组件的蜗杆传动轴的透视图。
图47是图36中所示仪器的第二个驱动器组件的顶部透视图。
图48是图47中所示第二个驱动器组件的侧面透视图。
图49-51是图47中所示第二个驱动器组件的一部分的透视图。
图52是图36中所示仪器的加热器组件的侧面透视图。
图53是图52中所示加热器组件的接受块的透视图。
图54和55分别是图52中所示加热器组件的接受块的前视图和顶视图。
图56是沿着图54中的线X2-X2获得的,图52中所示加热器组件的接受块的横断面视图。
图57是图52中所示加热器组件的夹具的透视图。
图58是图52中所示加热器组件的安装块的透视图。
图59是图52中所示加热器组件的散热片的透视图。
图60是图52中所示加热器组件的安装板的透视图。
图61和62分别是图52中所示加热器组件的第一个绝缘构件和第二个绝缘构件的透视图。
图63是图52中所示加热器组件的加热块的透视图。
图64和66分别是图36中所示仪器的光学组件的正面透视图和背面透视图。
图65是图64和66中所示光学组件的分解透视图。
图67是图64和66中所示光学组件的安装构件的透视图。
图68是图64和66中所示光学组件的滑块的透视图。
图69是图64和66中所示光学组件的滑轨的透视图。
图70是图64和66中所示光学组件的纤维光学模块的一部分的透视图。
图71-73是图36中所示仪器的电子控制系统的方框图。
图74-76分别是根据一个实施方案,以第一种配置、第二种配置和第三种配置的光学组件的示意图。
图77-80是根据实施方案检测含有核酸的样品中的靶分析物的方法的流程图。
图81是通过使用根据一个实施方案的系统和方法产生的分子标记。
图82是配置为接受声能的根据一个实施方案的分离模块的一部分的横断面透视图。
图83是配置为接受声能的根据一个实施方案的分离模块的一部分的横断面透视图。
图84是图26中所示药筒的一部分和声换能器的横断面透视图。
图85是根据一个实施方案的药筒的透视图。
图86是没有罩(cover)的图85中所示药筒的透视图。
图87是图85中所示药筒的PCR模块的透视图。
图88是根据一个实施方案的PCR模块的横断面视图。
图89是根据一个实施方案的药筒的透视图。
图90是根据一个实施方案的药筒的透视图。
图91是根据一个实施方案的药筒的透视图。
图92是根据一个实施方案的药筒的透视图。
图93是图92中所示药筒的分解透视图。
图94是根据一个实施方案,具有多个PCR小瓶的药筒的透视图。
具体实施方式
用于执行样品分离和反应的药筒和仪器在本文中描述。在某些实施方案中,器械包括例如可以用于分离核酸样品或分析物样品的分离模块,和例如可以用于扩增核酸样品或测试分析物与其他化合物的结合的反应模块。分离模块包括第一个外壳和第二个外壳。第一个外壳限定第一个室和第二个室。至少第一个室配置为含有样品,例如含有核酸的样品。第二个外壳包括侧壁和可穿透构件,其共同限定配置为含有第一种物质的第一个容积。第一种物质可以是例如待加入样品中的试剂、洗涤缓冲溶液、矿物油和/或任何其他物质。第二个外壳的至少一部分配置为安置在第一个外壳内,从而使得当可穿透构件的一部分被穿透时,第一个容积与第一个室流体连通。反应模块限定反应室和配置为含有第二种物质的第二个容积。反应模块配置为联接至分离模块,从而使得反应室和第二个容积各自与第一个外壳的第二个室流体连通。
在某些实施方案中,器械包括第一个模块、第二个模块和第三个模块。第一个模块限定第一个室和第二个室。至少第一个室配置为含有样品。第二个模块限定配置为含有第一种物质的第一个容积。第一种物质可以是例如待加入样品中的试剂、洗涤缓冲溶液、矿物油和/或任何其他物质。当第二个模块联接至第一个模块时,第二个模块的一部分配置为安置在第一个模块的第一个室内,从而使得第一个容积配置为选择性置于与第一个室流体连通。第三个模块限定反应室和第二个容积。第二个容积配置为含有第二种物质。当第三个模块联接至第一个模块时,第三个模块的一部分安置在第一个模块的第二个室内,从而使得反应室和第二个容积各自与第一个模块的第二个室流体连通。
在某些实施方案中,器械包括第一个模块、第二个模块和第三个模块。第一个模块限定第一个室和第二个室。第一个模块包括第一种转移机构,其配置为在第一个室和第二个室之间转移样品,同时维持在第一个室和第二个室之间的流体分离。第二个模块限定配置为含有物质例如试剂等的容积。当第二个模块联接至第一个模块时,第二个模块的一部分配置为安置在第一个模块的第一个室内,从而使得容积配置为选择性置于与第一个室流体连通。第三个模块限定反应室。第三个模块配置为联接至第一个模块,从而使得反应室与第二个室流体连通。第三个模块包括配置为在第二个室和反应室之间转移样品的一部分的第二种转移机构。
在某些实施方案中,器械包括第一个模块和第二个模块。第一个模块包括反应小瓶、基底和第一种转移机构。反应小瓶限定反应室,并且可以是例如PCR小瓶。第一种转移机构包括可移动地安置在外壳内的栓塞,从而使得外壳和栓塞限定含有第一种物质的第一个容积。栓塞可以在第一个位置和第二个位置之间移动。第一种物质可以是例如试剂、矿物油等。基底限定第一个流动路径和第二个流动路径的至少一部分。第一个流动路径配置为与反应室、第一个容积和分离模块的分离室流体连通。第二个流动路径配置为与分离室流体连通。栓塞的一部分地安置在第一个流动途径内,从而使得当栓塞处于第一个位置时,第一个容积与反应室是流体分离的。将栓塞的一部分安置远离第一个流动途径,从而使得当栓塞处于第二个位置时,第一个容积与反应室液体连通。栓塞配置为在反应室内产生真空,以在栓塞从第一个位置移动到第二个位置时,将样品从分离室转移到反应室。第二个模块包括第二种转移机构,并且限定配置为含有第二种物质的第二个容积。第二个模块配置为联接至第一个模块,从而使得第二个容积可以选择性置于经由第二个流动路径与分离室液体连通。第二种转移机构配置为当第二种转移机构被驱动时,将第二种物质从第二个容积转移到分离室。
在某些实施方案中,用于操作和/或驱动含有样品的药筒的仪器包括块、第一个光学构件、第二个光学构件和光学组件。块限定配置为接受反应容器的至少一部分的反应容积。块可以包括和/或附着至用于促进、产生、支持和/或推动与样品相关的反应的机构。在某些实施方案中,例如,块可以联接至配置为热循环样品的加热元件。第一个光学构件至少部分地安置在块内,从而使得第一个光学构件与反应容积光连通。第二个光学构件至少部分地安置在块内,从而使得第二个光学构件与反应容积光连通。光学组件包括配置为产生多个激发光束的激发模块和配置为接受多个发射光束的检测模块。光学组件联接至第一个光学构件和第二个光学构件,从而使得多个激发光束各自可以传送到反应容积内,并且多个发射光束各自可以由反应容积接受。
在某些实施方案中,用于操作和/或驱动药筒的仪器包括底盘、声换能器和驱动机构。底盘配置为含有具有限定容积的外壳的药筒。容积可以接受样品例如含有核酸的样品的部分。声换能器配置为产生声能。驱动机构配置为将声换能器的至少一部分移动到与药筒的一部分接触。驱动机构进一步配置为调整声换能器的一部分施加给药筒的一部分的力。
术语“光束”在本文中用于描述电磁能的任何投射,无论是否在可见光谱中。例如,光束可以包括在可见光谱中电磁辐射的瞄准投射,所述可见光谱由激光器、发光二极管(LED)、闪光灯等产生。光束可以是在所需时间段内连续的或在所需时间段内不连续的(例如脉冲或间断的)。在特定情况下,光束可以包括信息和/或与信息相关(即光束可以是光信号),所述信息例如样品中存在的分析物的量。
术语“平行的”在本文中用于描述在两个几何结构(例如两条线、两个平面、线和平面等)之间的关系,其中两个几何结构在它们基本上延长至无限时是基本上不相交的。例如,如本文使用的,当第一条线和第二条线在它们延长至无限时不相交时,第一条线被说成与第二条线平行。类似地,当平面表面(即二维表面)被说成与线平行时,沿着线的每一个点通过基本上相等的距离间隔远离表面的最近部分。当两个几何结构名义上彼此平行时,例如当它们在公差内彼此平行时,它们在本文中描述为彼此“平行的”或“基本上平行的”。此类公差可以包括例如制造公差、测量公差等。
术语“垂直的”在本文中用于描述在两个几何结构(例如两条线、两个平面、线和平面等)之间的关系,其中两个几何结构在至少一个平面内以约90度的角相交。例如,如本文使用的,当线和平面在平面内以约90度的角相交时,第一条线被说成与平面是垂直的。当两个几何结构名义上彼此垂直时,例如当它们在公差内彼此垂直时,它们在本文中描述为彼此“垂直的”或“基本上垂直的”。此类公差可以包括例如制造公差、测量公差等。
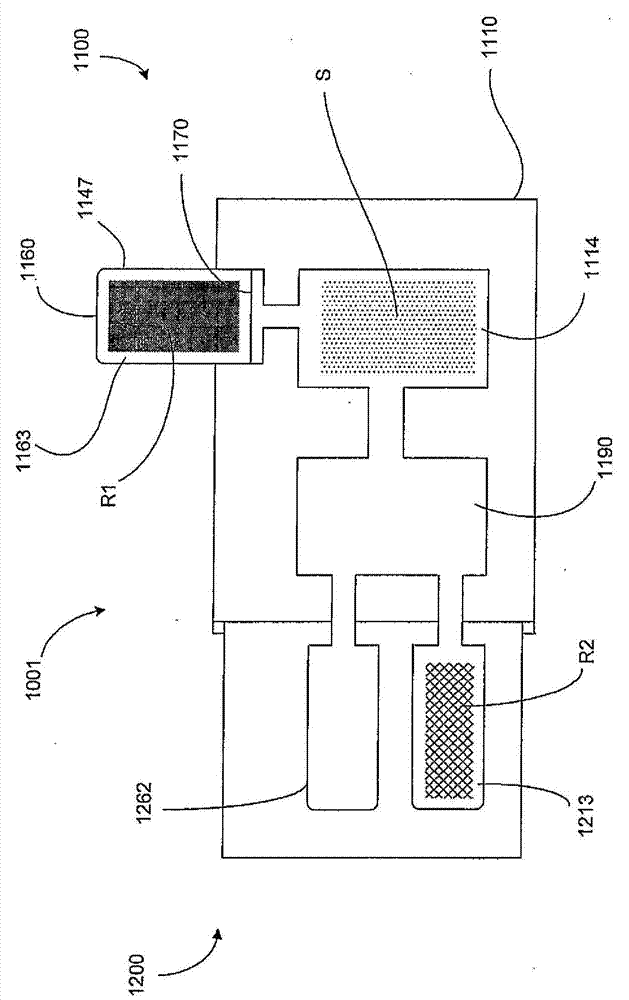
图1和2分别是根据一个实施方案,以第一种配置和第二种配置的药筒1001的示意图,所述药筒1001包括分离模块1100和反应模块1200。分离模块1100和反应模块1200彼此联接,从而使得分离模块1100和反应模块1200可以置于彼此液体连通。如本文描述的,分离模块1100和反应模块1200可以以任何合适的方式联接在一起。在某些实施方案中,例如,分离模块1100和反应模块1200可以分开构造且联接在一起,以形成药筒1001。在分离模块1100和反应模块1200之间的这种安排允许分离模块1100的多种不同配置与反应模块1200的多种不同配置一起使用。分离模块1100和/或反应模块1200的不同配置可以包括在分离模块1100和/或反应模块1200内的不同试剂和/或不同结构。
药筒1001可以通过本文描述的任何仪器进行操作和/或驱动。在某些实施方案中,药筒1001可以用于对样品执行样品制备、核酸分离和/或聚合酶链反应(PCR)。在此类实施方案中,分离模块1100可以从其中含有的样品中分离靶核酸。经分离的核酸随后可以在反应模块1200中扩增(例如使用PCR),如下文进一步描述的。药筒1001的模块安排允许任何数目的不同反应模块1200与分离模块1100一起使用,所述反应模块1200各自含有例如不同试剂和/或各自配置为扩增不同类型的样品,且反之亦然。
分离模块1100包括第一个外壳1110和第二个外壳1160。如本文更详细地描述的,第二个外壳1160联接至第一个外壳1110,从而使得第二个外壳1160可以置于与第一个外壳1110液体连通。在某些实施方案中,第一个外壳1110和第二个外壳1160是这样模块安排的,从而使得第一个外壳1110和第二个外壳1160的不同配置可以彼此一起使用。第一个外壳1110和第二个外壳1160的不同配置可以包括例如不同化学制品、试剂、样品和/或不同内部结构。
第一个外壳1110限定第一个室1114和第二个室1190。第一个室1114或第二个室1190中的至少一个可以含有样品S。样品S可以是任何生物学样品,例如含有一种或多种靶核酸的生物学样品,例如尿、血液、含有组织样品的其他材料等。样品S可以经由任何合适的机构引入第一个室1114或第二个室1190内,包括例如通过经由第一个外壳1110(未显示)中的孔或可穿透构件将样品S吸取或注射到第一个室1114和/或第二个室1190内。尽管第一个室1114显示为与第二个室1190处于液体连通,但在其他实施方案中,第一个室1114可以选择性置于与第二个室1190液体连通。换言之,在某些实施方案中,第一个外壳1110可以包括任何合适机构例如活门(图1和2中未显示),其可以将第一个室1114选择性置于与第二个室1190液体连通。此外,在其他实施方案中,第一个外壳1110可以具有任何合适的流动控制和/或转移机构(图1和2中未显示),以促进和/或控制在第一个室1114和第二个室1190之间的物质转移,包括例如活门、毛细管流动控制装置、泵等。在另外其他实施方案中,第一个室1114可以是与第二个室1190流体分离的。
第二个外壳1160包括侧壁1147和可穿透构件1170。侧壁1147和可穿透构件1170限定第一个容积1163。第一个容积1163可以完全或部分充满物质R1。物质R1可以是任何生物学或化学物质例如矿物油、洗涤缓冲液、荧光染料、试剂等。如图1和2中所示,第二个外壳1160的一部分安置在第一个外壳1110内,从而使得当可穿透构件1170被穿透、破坏、切断和/或破裂时,第一个容积1163如图2中所示的与第一个室1114液体连通。类似地陈述,当可穿透构件1170被穿透时,分离模块1110可以从第一种配置(图1)移动到第二种配置(图2)。当第一个容积1163如图2中所示的与第一个室1114液体连通时(即当分离模块在第二种配置中时),物质R1可以从第一个容积1163转移到第一个室1114。物质R1可以通过任何合适机构,例如通过引力、毛细力或通过作用于第一个容积1163的某些驱动机构(图1和2中未显示),从第一个容积1163转移到第一个室1114内。
可穿透构件1170可以由对于物质R1基本上不可渗透的和/或基本上化学惰性的材料进行构造。以这种方式,物质R1可以贮存于第一个容积1163内延长时间段,而不损害在任何所需应用例如本文描述的任何实施方案中使用第二个外壳1160的能力。此外,在某些实施方案中,可穿透构件1170可以由具有特定温度特征的材料进行构造,从而使得可穿透构件1170的所需性质和完整性维持经过特定温度范围。例如,在某些实施方案中,可以希望将含有物质R1的第二个外壳1160贮存于致冷条件,或可以希望通过热层压可穿透构件1170制造第二个外壳1160。在此类实施方案中,可穿透构件1170可以这样选择,从而使得致冷条件和/或热层压条件基本上不降解可穿透构件1170对于预期应用的所需性质和完整性。在某些实施方案中,可穿透构件1170可以由聚合物薄膜例如任何形式的聚丙烯进行构造。在某些实施方案中,可穿透构件1170可以由双向拉伸聚丙烯(BOP)进行构造。
尽管图1-2将第二个外壳1160的至少一部分显示为安置在第一个外壳1110内,但在其他实施方案中,第一个外壳1110和第二个外壳1160可以通过将第一个外壳1110的至少一部分安置在第二个外壳1160内而联接在一起,或通过将第一个外壳1110和第二个外壳1160经由界面联接在一起或配合而不安置在彼此内。第二个外壳1160可以通过任何合适机构联接至第一个外壳1110,例如通过粘结结合;焊接接头;搭扣配合(例如其中安置在第一个外壳上的匹配凸起在由第二个外壳限定的相应孔内接受和/或保留的安排,或反之亦然);干涉配合,其中两个部分在推挤在一起后通过摩擦扣紧(例如);螺纹联接,包括可移去的联接例如或凸缘联接。在第一个外壳1110和第二个外壳1160之间的联接可以是不漏流体的,从而使得当可穿透构件1170已如图2中所示破坏或破裂时,在第一个容积1163和第一个室1114之间的流体转移不导致渗漏和/或污染。在第一个外壳1110和第二个外壳1160之间的不漏流体联接可以通过使用匹配部件、0形环、垫圈等的锥形配合(tapered fit)来实现。
反应模块1200限定反应室1262和第二个容积1213。第二个容积1213含有物质R2。物质R2可以是任何生物学或化学物质例如矿物油、洗涤缓冲液、试剂等,其参与或以其他方式支持在药筒1001的反应室1262和/或其他部分内的反应。反应模块1200联接至分离模块1100,从而使得反应室1262和第二个容积1213可以各自置于与分离模块1100的第二个室1190液体连通。反应模块1200可以通过任何合适机构联接至分离模块1100,例如通过粘结结合;焊接接头;搭扣配合(例如其中安置在第一个外壳上的匹配凸起在由第二个外壳限定的相应孔内接受和/或保留的安排,或反之亦然);干涉配合,其中两个部分在推挤在一起后通过摩擦扣紧(例如);螺纹联接,包括可移去的联接例如或凸缘联接。在第一个外壳1110和反应模块1200之间的联接可以是不漏流体的,从而使得在分离模块1100和反应模块1200之间的流体转移不导致渗漏和/或污染。在反应模块1200和分离模块1100之间的不漏流体联接可以使用匹配部件、0形环、垫圈等的锥形配合来实现。在某些实施方案中,在分离模块1100和反应模块1200之间的联接是可移去的。
这种安排允许物质从反应室1262和/或第二个容积1213转移到第二个室1190,或反之亦然。例如,在使用中,样品、试剂和/或其他支持材料例如样品S、物质R1或物质R2中的一种或多种可以与所需反应结合转移入或转移出反应室1262。在第二个室1190、反应室1262和/或第二个容积1213之间的流体转移可以通过引力、毛细力、水压等实现。在某些实施方案中,水压可以通过活塞泵、挡板泵或任何其他合适的转移机构而应用。在某些实施方案中,此类流体转移机构可以是对于药筒1001外部的或对于药筒1001内部的(例如至少部分地安置在分离模块1100和/或反应模块1200内)。
在某些实施方案中,物质R1和样品S或其部分可以与逆转录过程结合从第一个容积1163和第一个室1114通过第二个室1190转移到反应室1262,通过使用逆转录酶由核糖核酸(RNA)模板产生单链互补脱氧核糖核酸(cDNA)。在逆转录过程完成后,物质R2可以从第二个容积1213通过第二个室1190转移到反应室1262,以对新近合成的cDNA或样品S中存在的DNA执行PCR过程。在此类实施方案中,物质R2可以包括一种或多种PCR试剂,包括Taq聚合酶。在某些实施方案中,物质R1和/或物质R2可以包括DNA结合染料(例如小沟结合剂(MGB)、偶联至DNA探针的5′末端的MGB和荧光团,其中DNA探针与靶序列特异性杂交),因此可以通过使用本文描述的任何仪器和/或方法检测反应室1262中来自荧光报道分子的荧光而实时监控PCR过程的进展。
在某些实施方案中,药筒1001(图1和2)用于分离且扩增核酸样品。例如,分离可以在第一个室1114或第二个室1190中发生。在一个实施方案中,物质R1包括用于核酸分离的试剂。DNA、RNA及其组合可以通过本文提供的药筒分离。例如,在一个实施方案中,物质R1包含由试剂衍生的磁珠,以分离DNA或RNA。
个别核酸和总核酸可以在本文提供的药筒中分离。例如,在一个实施方案中,物质R1包括由设计为分离样品中存在的信使RNA总库的polyA序列衍生的珠。在另一个实施方案中,物质R1包括由设计为仅分离样品中的一部分核酸的特异性核酸序列衍生的珠。
一旦核酸被分离,它就可以进行扩增。在一个实施方案中,扩增是通过PCR。为了本发明的目的,提及对核酸样品的“PCR”包括逆转录-PCR(RT-PCR)。特别地,当核酸样品是一种或多种靶RNA或RNA群体(例如总mRNA)时,将对靶RNA进行RT-PCR。本文提供的PCR主要混合物(master mix)因此可以包括用于逆转录的试剂。逆转录步骤可以在与PCR相同的室或模块或者不同的室或模块中发生。在一个实施方案中,通过提供RT-PCR主要混合物,逆转录和PCR在相同室中进行。本领域普通技术人员将容易地了解需要RT-PCR还是PCR,基于最初分离的核酸样品。本文提供的任何药筒都可以用于分离DNA和/或RNA,且执行RT-PCR和/或PCR。
例如,在一个实施方案中,如果RNA被首先分离,那么例如在第二个室1190或反应室1262中,对经分离的样品进行逆转录酶反应。如果分离DNA,那么它可以例如在反应室1262中通过PCR扩增。类似地,如果首先从样品S中分离RNA,那么例如在反应室1262中对它实施逆转录反应,并且这个反应的产物用于例如在反应室1262中的下游PCR反应中。在某些实施方案中,多重靶核酸在PCR中扩增,并且实时监控PCR反应。在一个实施方案中,通过采用对于每种靶特异性的个别DNA杂交探针监控多重靶的扩增,其中每种探针包括在不同波长发光或可以在独特波长激发的荧光团。在一个实施方案中,DNA杂交探针在第二个容积1213中作为物质R2(或其部分)提供。
在一个实施方案中,用于监控PCR的探针是与目的DNA靶特异性杂交的DNA寡核苷酸,并且包括在3′末端的非荧光猝灭剂和在5′末端的荧光团。另外,在这个实施方案中,DNA寡核苷酸包括与寡核苷酸直接结合或与荧光团结合的在5′末端的MGB(参见Lukhtanov等人(2007).Nucleic Acids Research 35,第e30页)。当与靶结合但不是在溶液中时,DNA寡核苷酸探针发荧光。因此,在PCR中的产物合成后,将发生更多杂交,并且生成更多荧光。荧光的量因此与生成的靶量成比例。
PCR反应的实时监控并不限于图1和2中所示的药筒。相反,本文提供的任何药筒都可以采用实时PCR,例如伴随上文描述的DNA杂交探针。
在某些实施方案中,药筒1001可以通过本文描述的任何仪器和/或方法进行操作,以促进PCR过程在反应室1262内发生。在此类实施方案中,反应模块1200可以联接至热转移器械和/或置于与热转移器械接触,以允许反应室1262的内容物与PCR过程结合而进行热循环。在此类实施方案中,反应模块1200可以进一步可操作地联接至光学器械,以允许PCR过程的实时监控。在其他实施方案中,反应模块1200和/或分离模块1100可以可操作地联接至其他能源,例如光能、超声能、磁能、液压能量等,以促进在其中发生的反应和/或分离过程。
尽管图1-2显示反应室1262和第二个容积1213各自与第二个室1190液体连通,但在其他实施方案中,在分离模块的反应室1262、第二个容积1213和/或第二个室1190之间的液体连通可以是选择性的。换言之,在某些实施方案中,反应模块1200和/或分离模块1100可以包括机构,例如活门或可穿透膜,其可以将第二个室1190选择性置于与第二个容积1213和/或反应室1262液体连通。尽管分离模块1100显示为限定一个第一个容积1163,但在某些实施方案中,分离模块1100可以限定任何数目的容积和/或可以含有任何数目的不同物质。类似地,尽管反应模块1200显示为限定一个第二个容积1213,但在某些实施方案中,反应模块1200可以限定任何数目的容积且可以含有任何数目的不同物质。
图3是根据一个实施方案的药筒2001的示意图,所述药筒2001包括第一个模块2110、第二个模块2160和第三个模块2200。第一个模块2110限定第一个室2114和第二个室2190。第一个室2114和/或第二个室2190可以包含含有靶核酸的任何生物学样品,例如尿、血液、含有组织样品的其他材料等。尽管第一个室2114显示为与第二个室2190液体连通,但在其他实施方案中,第一个室2114可以选择性置于与第二个室2190液体连通。换言之,在某些实施方案中,第一个模块2110可以包括任何合适机构,例如活门(图3中未显示),其可以将第一个室2114选择性置于与第二个室2190液体连通。此外,在其他实施方案中,第一个模块2110可以具有任何合适的流动控制和/或转移机构(图3中未显示),以促进和/或控制在第一个室2114和第二个室2190之间的物质转移,包括例如活门、毛细管流动控制装置、泵等。
第二个模块2160限定可以完全或部分含有任何生物学或化学物质的第一个容积2163。该物质可以是例如矿物油、洗涤缓冲液、试剂等,其可以参与或以其他方式支持在药筒2001的第一个室2114和/或任何其他部分内的反应。在一个实施方案中,在第一个室2114中的反应是分离反应,例如核酸或肽分离。第二个模块2160可以以如本文描述的任何合适方式联接至第一个模块2110。在某些实施方案中,例如,第一个模块2110和第二个模块2160可以分开构造且联接在一起,从而使得第一个模块2110和第二个模块2160是模块安排的。在此类模块安排中,第一个模块2110和第二个模块2160的多种不同配置可以彼此一起使用。第一个模块2110和/或第二个模块2160的不同配置可以包括在第一个模块2110和/或第二个模块2160内的不同试剂和/或不同结构。如图3中所示,第二个模块2160的一部分安置在第一个模块2110的第一个室2114内,从而使得第一个容积2163可以置于与第一个室2114液体连通。在其他实施方案中,第一个容积2163可以选择性置于与第一个室2114液体连通。在某些实施方案中,例如,第一个模块2110和/或第二个模块2160可以包括任何合适机构,例如活门和/或如本文描述的任何合适的流体控制和/或转移机构,当第二个模块2160联接至第一个模块2110时,其可以将第一个容积2163选择性置于与第一个室2114液体连通。在某些实施方案中,物质和/或样品可以使用如本文描述的任何合适的流体转移机构在第一个容积2163和第一个室2114之间转移。例如,在使用中,样品、经分离的样品(例如经分离的DNA、经分离的RNA、经分离的肽、经分离的蛋白质)、试剂(例如分离试剂)和/或其他支持物质可以与所需反应结合转移入和/或转移出第一个室2114。在另外其他实施方案中,例如通过活门、可穿透构件或如本文描述的选择性转移机构(图3中未显示),第一个容积2163可以与第一个室2114流体分离。
第三个模块2200限定反应室2262和第二个容积2213。反应室2262和/或第二个容积2213可以完全或部分含有一种或多种生物学或化学物质例如矿物油、洗涤缓冲液、一种或多种PCR试剂、试剂等,其参与或以其他方式支持在药筒2001的反应室2262和/或任何其他部分内的反应。第三个模块2200可以以如本文描述的任何合适方式联接至第一个模块2110。在某些实施方案中,第一个模块2110是分离模块2110,例如以从生物学样品中分离一种或多种靶核酸。在某些实施方案中,第一个模块2110用于RNA分离和第一链cDNA合成。在这个实施方案中,第一个容积2163包括分离试剂和用于逆转录(RT)反应的试剂。在某些实施方案中,例如,第一个模块2110和第三个模块2200可以分开构造且联接在一起,从而使得第一个模块2110和第三个模块2200是模块安排的。在此类模块安排中,第一个模块2110和第三个模块2200的不同配置可以彼此一起使用。第一个模块2110和/或第三个模块2200的不同配置可以包括在第一个模块2110和/或第三个模块2200内的不同试剂和/或不同结构。如图3中所示,第三个模块2200的一部分安置在第一个模块2110的第二个室2190内,从而使得反应室2262和第二个容积2213各自与第二个室2190液体连通。在其他实施方案中,反应室2262和/或第二个容积2213可以选择性置于与第二个室2190液体连通。换言之,在某些实施方案中,第一个模块2110和/或第三个模块2200可以包括任何合适的机构,例如活门和/或如本文描述的任何合适的流动控制和/或转移机构,其可以将反应室2262和/或第二个容积2213置于与第二个室2190选择性液体连通。在某些实施方案中,物质和/或样品可以使用如本文描述的任何合适的流体转移机构在第二个室2190、和反应室2262和/或第二个容积2213之间转移。例如,在使用中,样品、试剂和/或其他支持材料可以与所需反应结合转移入或转移出反应室2262。在另外其他实施方案中,例如通过可穿透构件或如本文描述的选择性转移机构(未显示),反应室2262和/或第二个容积2213可以与第二个室2190流体分离。
在某些实施方案中,药筒2001可以用于对样品执行样品制备、核酸分离和/或聚合酶链反应(PCRs)。在此类实施方案中,靶核酸可以在第一个模块2110内从样品中分离。经分离的核酸可以是RNA、DNA或其组合。如上所述,如果是分离的是RNA,那么在PCR前,在药筒2001例如在第一个室2114或第二个室2190中进行逆转录反应。经分离的核酸(或如果分离的是RNA,那么是新合成的cDNA)随后可以在第三个模块2200中扩增(例如使用PCR),如本文描述的,例如用包含在5′末端的荧光团和MGB和在3′末端的非荧光猝灭剂的DNA寡核苷酸探针的实时PCR。药筒2001的模块安排允许任何数目的不同第三个模块2200与第一个模块2110一起使用,所述第三个模块2200各自含有例如不同试剂和/或各自配置为扩增不同类型的样品,或反之亦然。在某些实施方案中,药筒2001可以通过本文描述的任何仪器和/或方法进行操作,以促进在反应室2262内PCR过程的发生。在此类实施方案中,第三个模块2200可以联接至热转移器械和/或置于与热转移器械接触,以允许反应室2262的内容物与PCR过程结合而进行热循环。在此类实施方案中,第三个模块2200可以进一步可操作地联接至光学器械,以监控PCR过程。在其他实施方案中,第三个模块2200和/或第一个模块2110可以可操作地联接至其他能源,例如光能、超声能、磁能、液压能量等的来源,以促进在其中发生的反应和/或分离过程。
尽管图3将整合的药筒2001显示为限定一个第一个容积2163和一个第二个容积2213,但在某些实施方案中,整合的药筒2001可以限定任何数目的第一个容积2163和/或第二个容积2213,以含有任何数目的不同物质和/或执行不同功能性。例如,第一个容积2163和/或第二个容积2213可以含有分开的洗涤缓冲液、洗脱缓冲液、用于逆转录反应的试剂、PCR试剂、裂解缓冲液。
如上所述,在某些实施方案中,本文描述的任何药筒可以包括配置为在药筒内限定的不同室之间转移样品的一种或多种转移机构。例如,图4是根据一个实施方案的药筒3001的示意图,所述药筒3001包括第一个模块3110、第二个模块3160和第三个模块3200。第一个模块3110限定第一个室3114和第二个室3190。在某些实施方案中,第一个模块3110充当分离模块,例如以从生物学样品中分离一种或多种靶核酸、核酸群体(例如总RNA、总DNA、mRNA)、或靶肽或蛋白质。第一个室3114和/或第二个室3190可以含有任何生物学样品,例如含有靶核酸的生物学样品,例如尿、血液、含有组织样品的其他材料等。将第一种转移机构3140安置在第一个室3114和第二个室3190之间。
在某些实施方案中,第一种转移机构3140可以是选择性转移机构,以在第一个室3114和第二个室3190之间选择性转移样品和/或物质。在此类实施方案中,例如,第一种转移机构3140可以在第一个室3114和第二个室3190之间转移具有特定性质的样品和/或物质,同时限制和/或防止在第一个室3114和/或第二个室3190之间转移具有不同性质的样品和/或物质。在某些实施方案中,第一种转移机构3140可以是使用磁性部件的器械,以基于样品和/或物质的磁性性质转移样品和/或物质。在其他实施方案中,第一种转移机构3140可以基于样品和/或物质的表面电荷例如通过使用电泳转移样品和/或物质。在另外其他实施方案中,第一种转移机构3140可以基于样品和/或物质内的分子或离子的大小转移样品和/或物质。在此类实施方案中,第一种转移机构3140可以包括用于选择性转移样品和/或物质的反渗透机构。换言之,在某些实施方案中,第一种转移机构3140可以依赖和/或产生力,包括例如磁力、静电力、压力等,以作用于其中的靶向样品和/或物质和/或分子和/或离子。第一种转移机构3140还可以包括任何合适的结构和/或可以组合多种选择性转移机构(例如以赋予另外的物理运动和/或提供另外的选择性)。在某些实施方案中,第一种转移机构3140可以在第一个室3114和第二个室3190之间选择性转移特定分子或离子,同时维持在第一个室3114和第二个室3190之间基本的流体分离。在某些实施方案中,第一种转移机构3140可以是如公开于2006年10月17日提交的名称为“CASSETTE FOR SAMPLE PREPARATION”美国专利号7,727,473中的磁性活门,所述专利整体引入本文作为参考。在另外其他实施方案中,第一种转移机构3140可以在第一个室3114和第二个室3190之间非选择性转移物质和/或样品。
第二个模块3160限定可以完全或部分含有任何生物学或化学物质的第一个容积3163,所述物质例如矿物油、核酸分离试剂、逆转录试剂、洗脱缓冲液、裂解缓冲液、洗涤缓冲液、试剂等,其可以参与或以其他方式支持在药筒3001的第一个室3114和/或任何其他部分内的反应。第二个模块3160可以以如本文描述的任何合适方式联接至第一个模块3110。在某些实施方案中,例如,第一个模块3110和第二个模块3160可以分开构造且联接在一起,从而使得第一个模块3110和第二个模块3160是模块安排的。在此类模块安排中,第一个模块3110和第二个模块3160的不同配置可以彼此一起使用。第一个模块3110和/或第二个模块3160的不同配置可以包括在模块内的不同试剂和/或不同结构。如图4中所示,第二个模块3160的一部分安置在第一个模块3110的第一个室3114内,从而使得第一个容积3163与第一个室3114液体连通。在其他实施方案中,第一个容积3163可以选择性置于与第一个室3114液体连通。换言之,在某些实施方案中,第一个模块3110和/或第二个模块3160可以包括任何合适机构,例如活门和/或如本文描述的任何合适的流体控制和/或转移机构,其可以将第一个容积3163选择性置于与第一个室3114液体连通。在某些实施方案中,物质和/或样品可以使用如本文描述的任何合适的流体转移机构在第一个容积3163和第一个室3114之间转移。例如,在使用中,样品、试剂和/或其他支持材料可以与所需反应结合转移入或转移出第一个室3114。在另外其他实施方案中,例如通过可穿透构件或如本文描述的选择性转移机构(未显示),第一个容积3163可以与第一个室3114流体分离。
第三个模块3200限定反应室3262。反应室3262可以完全或部分含有任何生物学或化学物质例如矿物油、逆转录试剂、洗脱缓冲液、裂解缓冲液、PCR试剂(例如Taq聚合酶、引物、用于监控反应的DNA寡核苷酸探针、Mg2+)、洗涤缓冲液、试剂等,其参与或以其他方式支持在药筒3001的反应室3262和/或任何其他部分内的反应。第三个模块3200可以以如本文描述的任何合适方式联接至第一个模块3110。在某些实施方案中,例如,第一个模块3110和第三个模块3200可以分开构造且联接在一起,从而使得第一个模块3110和第三个模块3200是模块安排的。在此类模块安排中,第一个模块3110和第三个模块3200的不同配置可以彼此一起使用。第一个模块3110和/或第三个模块3200的不同配置可以包括在模块内的不同试剂和/或不同结构。如图4中所示,第三个模块3200的一部分安置在第一个模块3110的第二个室3190内,从而使得反应室3262可以各自与第二个室3190液体连通,实施对于第二种转移机构3240的控制。
第二种转移机构3240可以将物质和/或试剂从第二个室3190转移到反应室3262或反之亦然。在某些实施方案中,例如,第二种转移机构可以在第二个室3190和反应室3262之间转移预定容积的物质和/或试剂。类似地陈述,在某些实施方案中,第二种转移机构3240可以以预定体积流量在第二个室3190和反应室3262之间转移物质和/或试剂。在某些实施方案中,例如,第二种转移机构3240可以是配置为对第二个室3190和/或反应室3262应用正压或真空的泵。在此类实施方案中,第二种转移机构3240可以是使用本文描述的任何仪器和/或方法由栓塞驱动的泵。在某些实施方案中,第二种转移机构3240可以具有如本文描述的可穿透构件,从而使得第二种转移机构3240可以穿透、破坏、切断和/或破裂可穿透构件,以将反应室3262中含有的物质和/或样品转移到第二个室3190内或反之亦然。在其他实施方案中,例如,第二种转移机构3240可以是毛细管流动控制装置。在另外其他实施方案中,第二种转移机构3240可以是如本文描述的任何其他选择性或非转移性转移机构。
在某些实施方案中,药筒3001可以用于对样品执行样品制备、核酸分离、逆转录(如RNA被首先分离)和/或聚合酶链反应(PCR)。在此类实施方案中,靶核酸可以在第一个模块3110内从样品中分离。经分离的核酸随后可以在第三个模块3200中进行扩增(例如使用PCR),如下文进一步描述的。如本文描述的,对多重靶的PCR可以用本发明的药筒例如药筒3001进行实时监控。在一个实施方案中,多重靶的扩增用由Lukhtanov等人(Nucleic Acids Research 35,第e30页,2007)公开的DNA寡核苷酸探针发生。药筒3001的模块安排允许任何数目的不同第三个模块3200与第一个模块3110一起使用,所述第三个模块3200各自含有例如不同试剂和/或各自配置为扩增不同类型的样品,且反之亦然。在某些实施方案中,药筒3001可以通过本文描述的任何仪器和/或方法进行操作,以促进PCR过程在反应室3262内发生。在此类实施方案中,第三个模块3200可以联接至热转移器械和/或置于与热转移器械接触,以允许反应室3262的内容物与PCR过程结合进行热循环。在此类实施方案中,第三个模块3200可以进一步可操作地联接至光学器械,以监控PCR过程。在其他实施方案中,第三个模块3200和/或第一个模块3110可以可操作地联接至其他能源,例如光能、超声能、磁能、液压能量等,以促进在其中发生的反应和/或分离过程。
尽管在一个实施方案中,与图4有关显示且描述的药筒3001包括第一个模块、第二个模块和第三个模块,但在其他实施方案中,药筒可以包括联接在一起的两个模块。例如,图5是根据一个实施方案,包括第一个模块4200和第二个模块4160的药筒4001的一部分的示意图。药筒4001的一部分可以联接至分离模块4110,如图5中所示。第一个模块4200可以包括反应小瓶4260、基底4220和第一种转移机构4140。反应小瓶4260限定反应室4262,其可以完全或部分包含含有靶核酸的任何生物学或化学样品和/或物质,例如尿、血液、含有组织样品的其他材料等,和/或矿物油、洗涤缓冲液、裂解缓冲液、逆转录试剂、PCR试剂、试剂等,其参与或以其他方式支持在药筒4001的反应室4262和/或任何其他部分内的反应。
反应小瓶4260可以是任何合适的容器,用于含有经分离的或以允许与样品结合的反应发生的另外方式的样品,例如核酸样品。在某些实施方案中,反应小瓶4260可以具有配置为在加热元件和/或块(参见例如,下文描述的块1710)内接受和/或针对加热元件和/或块安置的薄壁。反应小瓶4260可以由具有与所需反应和/或过程相容的特定性质的任何合适材料进行构造。在某些实施方案中,反应小瓶4260可以由基本上导热的材料进行构造,以允许在反应小瓶4260内的物质和/或样品的热循环。在某些实施方案中,反应小瓶4260可以由基本上机械坚固的材料进行构造,从而使得当正压或真空作用于在反应小瓶4260内的容积时,反应小瓶4260的侧壁基本上保留其形状和/或大小。在某些实施方案中,反应小瓶4260可以由对于反应小瓶4260内的反应基本上化学惰性的材料进行构造,从而使得形成反应小瓶4260的材料将不污染或以其他方式影响在反应小瓶4260内的反应。
反应小瓶4260还可以是以允许监控此类反应(例如检测在样品内起因于反应或与反应结合的分析物)的方式用于含有样品的任何合适容器。在某些实施方案中,例如,反应小瓶4260可以是PCR小瓶、试管、微量离心管等。此外,在某些实施方案中,反应小瓶4260的至少一部分可以是基本上透明的,以允许在其中发生的反应的光学监控。
在某些实施方案中,反应小瓶4260可以完全由基底4220进行构造。在其他实施方案中,反应小瓶4260可以通过如本文描述的任何合适机构联接至基底4220。
基底4220限定第一个流动路径4221和第二个流动路径4222的至少一部分。第一个流动路径4221配置为与分离模块4110的反应室4262和分离室4114液体连通。当第一种转移机构4140被驱动时,第一种转移机构4140配置为将样品S(或其部分)从分离室4114转移到反应室4262(如由箭头AA所示)。基底4220可以使用任何合适的结构、材料和/或制造过程限定第一个流动路径4221和第二个流动路径4222的一部分。在某些实施方案中,基底4220可以是单层。在其他实施方案中,基底4220可以由焊接且联接在一起的分开的多层材料进行构造,以限定结构和流动路径。在某些实施方案中,基底4220可以使用过程进行构造,所述过程包括例如化学蚀刻、机械和/或离子研磨、浮雕、层压和/或硅键合。在某些实施方案中,基底4220的至少一部分可以在其上配置加热元件,安置在加热元件内和/或与加热元件接触,从而使得在使用中,限定第一个流动路径和/或第二个流动路径的基底的一部分可以被加热。例如,在某些实施方案中,基底4220可以安置在本文公开的任何仪器内,并且可以加热第一个流动路径4221和第二个流动路径4222,从而使得其中含有的物质(例如待在分离室4114和反应室4262之间转移的样品的一部分)可以被加热和/或维持在大约大于50℃的温度。如本文更详细地描述的,这种安排促进物质和或与PCR过程相关的试剂的“热启动”转移。
第一种转移机构4140至少部分包含在第一个模块4200内,并且配置为促进样品S从分离室4114到反应室的转移。在某些实施方案中,第一种转移机构4140可以促进样品S的转移,同时维持在第一个流动路径4221和第一个模块4200外的区域之间的流动分离。例如,在某些实施方案中,第一种转移机构4140可以是产生力和/或促进样品S的转移的任何机构,无需来自第一个模块4200外的区域的物质添加(例如无需压缩气体等的添加)。这种安排减少潜在污染,改善过程自动化和/或以其他方式改善样品S转移的速度和/或准确度。例如,样品S的转移可以按程序工作,以在不同时间步骤进行,在每个时间步骤转移不同数量的样品S。改善样品S的转移准确度还可以改善PCR分析的质量。第一种转移机构可以是如本文描述的任何合适机构。例如,在某些实施方案中,第一种转移机构4140可以是选择性转移机构,以在分离室4114和反应室4262之间选择性转移样品S。在某些实施方案中,第一种转移机构4140可以应用磁、静电和/或压力,以实现样品S的转移。
第一个模块4200可以以如本文描述的任何合适方式联接至分离模块4110,以允许在第一个模块4200和分离模块4110之间的液体连通。在某些实施方案中,例如,第一个模块4200和分离模块4110可以分开构造且联接在一起,从而使得第一个模块4200和分离模块4110是模块安排的。在此类模块安排中,第一个模块4200和分离模块4110的不同配置可以彼此一起使用。第一个模块4200和/或分离模块4110的不同配置可以包括在模块内的不同试剂和/或不同结构。
第二个模块4160包括第二种转移机构4240且限定配置为含有物质R1的容积4163。如本文使用的,物质R1和物质R2可以指一种或多种试剂。物质R1可以是任何生物学或化学物质,例如矿物油、洗涤缓冲液、荧光染料、裂解缓冲液、洗涤缓冲液、洗脱缓冲液、逆转录试剂、PCR试剂(例如Taq聚合酶、引物、DNA杂交探针例如由Lukhtanov等人(2007).Nucleic Acids Research 35,第e30页描述的探针中的一种或多种)、试剂等。尽管图5显示了包括一个容积4163的第二个模块4160,但在其他实施方案中,第二个模块4160可以包括任何数目的容积4163和/或容器,在其内可以贮存多种物质(包括物质R1和/或不同物质)。第二个模块4160配置为联接至第一个模块4200,从而使得容积4163可以选择性置于经由第二个流动路径4222与反应室4262流动连通。当第二种转移机构4240被驱动时,第二种转移机构4240配置为将物质R1的至少一部分从容积4163转移到反应室4262(如由箭头BB所示)。
第二种转移机构4240可以将物质R1从第二个容积4163转移到反应室4262或反之亦然。在某些实施方案中,例如,第二种转移机构可以在第二个容积4163和反应室4262之间转移预定容积的物质R1。在某些实施方案中,例如,第二种转移机构可以以预定体积流量在第二个室4163和反应室4262之间转移物质R1。在某些实施方案中,例如,第二种转移机构4240可以是配置为对第二个容积4163和/或反应室4262应用正压或真空的泵。在此类实施方案中,第二种转移机构4240可以是使用本文描述的任何仪器和/或方法由栓塞驱动的泵。在某些实施方案中,第二种转移机构4240可以具有如本文描述的可穿透构件,从而使得在使用同时,第二种转移机构4240可以穿透、破坏、切断和/或破裂可穿透构件,且将反应室4262中含有的物质和/或样品转移到第二个容积4163内或反之亦然。在某些其他实施方案中,例如,第二种转移机构4240可以是毛细管流动控制装置。在另外其他实施方案中,第二种转移机构4240可以是如本文描述的任何其他选择性或非转移性转移机构。
在某些实施方案中,药筒4001可以用于对样品或其经分离的部分(例如经分离的核酸样品)执行样品制备、核酸分离和/或聚合酶链反应(PCR)。在此类实施方案中,分离模块4110可以从其中含有的样品中分离靶核酸。经分离的核酸随后可以在反应室4262中扩增(例如使用PCR),如下文进一步描述的。备选地或另外地,如果分离的是RNA,那么可以在反应室4262中进行逆转录反应。在另一个实施方案中,如果分离的是RNA,那么在反应室之一例如反应室4262中进行整合的逆转录-PCR反应。药筒4001的模块安排允许任何数目的不同第二个模块4160与第一个模块4200一起使用,所述第二个模块4160各自含有例如不同试剂和/或各自配置为扩增不同类型的样品,或分离不同类型的样品,且反之亦然。在某些实施方案中,药筒4001可以通过本文描述的任何仪器和/或方法进行操作,以促进在反应室4262内扩增过程例如PCR过程的发生。在此类实施方案中,反应小瓶4260可以联接至热转移器械和/或置于与热转移器械接触,以允许反应室4262的内容物与PCR过程结合而进行热循环。在此类实施方案中,反应小瓶4260可以进一步可操作地联接至光学器械,以监控PCR过程。在其他实施方案中,反应小瓶4260和/或分离模块4110可以可操作地联接至其他能源,例如光能、超声能、磁能、液压能量等,以促进在其中发生的反应和/或分离过程。
图6和7分别是根据一个实施方案,以第一种配置和第二种配置的药筒5001的一部分的示意图。药筒5001的一部分包括第一个模块5200和第二个模块5100。第一个模块5200包括反应小瓶5260、基底5220和第一种转移机构5235。反应小瓶5260限定以允许与样品S结合的反应发生的方式含有样品的反应室5262。反应小瓶5260可以具有任何合适的形状和/或大小,并且可以使用任何合适的材料进行构造,如本文描述的。在某些实施方案中,例如,反应小瓶5260可以是PCR小瓶、试管等。
第一种转移机构5235包括可移动地安置在外壳5230内的栓塞5240,从而使得外壳5230和栓塞5235限定第一个容积5213。第一个容积5213含有第一种物质R1。第一种物质R1可以是例如试剂(例如PCR试剂,例如Taq聚合酶、引物、DNA杂交探针例如上文描述的探针或其组合)、逆转录试剂、矿物油等。栓塞5240可以通过任何合适机构例如本文描述的任何仪器驱动。
基底5220限定第一个流动路径5221和第二个流动路径5222的至少一部分。第一个流动路径5221配置为与分离模块5110(图6中以虚线形式显示)的反应室5262、第一个容积5213和分离室5114液体连通。第二个流动路径5222配置为与分离室5114流动连通。分离室5114可以是本文显示且描述类型的任何合适的分离室和/或分离模块。此外,分离室5114可以以如本文描述的任何合适方式联接至第一个模块5200。在某些实施方案中,分离室5114可以联接至第一个模块5200且如本文描述的模块安排。在分离室5114和第一个模块5200之间的可移去联接可以是使用如本文描述的任何合适机构不漏流体的。
第二个模块5100包括第二种转移机构5150且限定配置为含有第二种物质R2的第二个容积5163。第二个模块5100配置为联接至第一个模块5200,从而使得第二个容积5163可以选择性置于经由第二个流动路径5222与分离室5114液体连通。第二个模块5100可以包括任何机构和/或装置,其配置为将第二个容积5163选择性置于与分离室5114和/或第二个流动路径5222液体连通。例如,在某些实施方案中,第二个模块5100可以包括可穿透构件,其限定第二个容积5163的边界的一部分,且将第二个容积5163与分离室5114和/或第二个流动路径5222流体分离。在其他实施方案中,第二个模块5100可以包括配置为将第二个容积5163置于与分离室5114和/或第二流动路径5222液体连通的活门。
当第二种转移机构5150被驱动时,第二种转移机构5150配置为将第二种物质R2的至少一部分从第二个容积5163转移到分离室5114内。第二种转移机构5150可以是如本文描述的任何合适转移机构。例如,在某些实施方案中,第二种转移机构5150可以应用磁、静电和/或压力,以实现物质R2从第二个容积5163到分离室5114的转移。在某些实施方案中,例如,第二种转移机构5250可以是使用本文描述的任何仪器和/或方法由栓塞驱动的泵。在某些其他实施方案中,例如,第二种转移机构5250可以是毛细管流动控制装置。
药筒5001可以在至少第一种配置(图6)和第二种配置(图7)之间移动,以促进涉及样品S的反应和/或测定法,所述样品S最初安置在分离室5114内。当药筒5001处于第一种配置时,栓塞5240处于外壳5230内的第一个位置中,从而使得栓塞5240的一部分5246安置在第一个流动路径5221内。因此,当药筒5001处于第一种配置时,第一个容积5213与反应室5262流体分离。以这种方式,当药筒5001处于第一种配置时,第一种物质R1维持在第一个容积5213内,并且被阻止传送到反应室5262内(例如通过渗漏、重力供给、毛细管作用等)。此外,当药筒5001处于第一种配置时,第二个容积5163与第二个流动路径5222和分离室5114流体分离。以这种方式,当药筒5001处于第一种配置时,第二种物质R2维持在第二个容积5163内,并且被阻止传送到分离室5114内(例如通过渗漏、重力供给、毛细管作用等)。
通过将第二个容积5163置于经由第二个流动路径5222与分离室5114液体连通,驱动第二种转移机构5150以将第二种物质R2的至少一部分传送到分离室5114内(如由图7中的箭头CC所示),且驱动第一种转移机构5235,将药筒5001移动到第二种配置(图7)。更具体而言,第二个容积5163可以通过任何合适机构例如通过穿透可穿透构件,驱动活门等,置于经由第二个流动路径5222与分离室5114液体连通。在某些实施方案中,通过驱动第二种转移机构5150,第二个容积5163可以置于与分离室5114流动连通。以这种方式,第二个容积5163可以置于与分离室5114液体连通,并且第二种物质R2的一部分可以在一次操作中和/或响应单个驱动事件传送到分离室5114内。
第一种转移机构5235通过如图7中的箭头DD所示移动在外壳5230内的栓塞5240而驱动。类似地陈述,当第一种转移机构5235被驱动时,栓塞5240在外壳5230内从第一个位置(如图6中所示)移动到第二个位置(如图7中所示)。因此,当第一种转移机构5235被驱动时,栓塞5240的一部分5246至少部分地从第一个流动路径5221去除,从而将第一个容积5213置于经由第一个流动路径5221与反应室5262液体连通。以这种方式,第一种物质R1的一部分可以从第一个容积5213传送到反应室5262内,如由图7中的箭头EE所示。
此外,当栓塞5240从第一个位置移动到第二个位置时,在反应室5262内产生真空。在药筒5001内(即,在反应室5262和分离室5114之间)的这种压力差导致分离室5114的内容物的至少一部分(即,样品S和/或第二种物质R2)经由第一个流动路径5221传送到反应室5262内,如由图7中的箭头FF和GG所示。以这种方式,可以将物质和/或样品加入,混合和/或通过驱动第一种转移机构5235和/或第二种转移机构5150,在分离室5114和反应室5262之间传送。通过在分离室5114内执行样品S和物质R2的混合代替将样品S和物质R2分开转移到反应室5262内,可以消除另外的转移步骤。此外,这种安排和/或方法可以改善样品S和物质R2的混合,从而改善在反应室5262中的反应准确度和效率。
尽管描述为以特定次序发生,但在其他实施方案中,与药筒5001从第一种配置移动到第二种配置结合的操作可以以任何次序发生。此外,在其他实施方案中,药筒5001可以置于涉及操作的任何所需组合的任何数目的不同配置。
在某些实施方案中,药筒5001可以用于对样品S的至少一部分(其可以是例如一种或多种经分离的靶核酸)执行聚合酶链反应(PCR)。在此类实施方案中,经分离的核酸可以在反应室5262中扩增(例如使用PCR),如本文描述的。在某些实施方案中,药筒5001可以通过本文描述的任何仪器和/或方法进行操作,以促进在反应室5262内PCR过程的发生。在此类实施方案中,反应小瓶5260可以联接至热转移器械和/或置于与热转移器械接触,以允许反应室5262的内容物与PCR过程结合而进行热循环。在此类实施方案中,反应小瓶5260可以进一步可操作地联接至光学器械,以允许PCR过程的实时监控。在其他实施方案中,反应小瓶5260和/或第二个模块5100可以可操作地联接至其他能源,例如光能、超声能、磁能、液压能量等,以促进在其中发生的反应和/或分离过程。
在某些实施方案中,第一种物质R1可以包括矿物油、蜡等,从而使得在第一种物质R1转移到反应室5262内后,第一种物质R1可以在反应室5262中的流体混合物(即,样品S和第二种物质R1)的表面上形成层。第一种物质R1的表面层可以减少在反应过程期间(例如,在热循环期间)在反应室5262中流体混合物的蒸发,从而改善在其中的反应的效率、准确度和/或控制。更具体而言,通过减少在反应室5262中的流体混合物的蒸发,可以更准确地控制反应混合物中不同组成成分的相对浓度或比例。另外,减少在反应室5262中的流体混合物的蒸发还可以将在反应小瓶5260的壁上的冷凝降到最低,从而改善反应的光学监控或分析的准确度。
矿物油可以是具有合适性质的任何矿物油,所述合适性质例如所需物理性质,包括例如密度和/或表面张力。矿物油等还可以这样进行选择,从而使得当暴露于在反应室5262内的条件时,它是化学惰性和物理稳定的。
图8-24是根据一个实施方案的药筒6001的多个视图。在特定视图中,例如图8和9,药筒6001的一部分显示为半透明的,从而使得在药筒6001内的部件和/或零件(features)可以更明确地显示。药筒6001包括样品制备(或分离)模块6100和扩增(或PCR)模块6200,其可以联接在一起以形成整合的药筒6001。一个或多个药筒6001可以安置在本文公开类型的任何合适仪器(参见例如下文描述的仪器3002)内,其配置为操作药筒6001,驱动药筒6001和/或与药筒6001相互作用,以对药筒6001内含有的测试样品执行核酸分离、转录和/或扩增。通过限制在分离、转录和/或PCR扩增过程过程中以及之间的样品处理量,药筒6001允许样品的有效和准确诊断测试。此外,分离模块6100和扩增(或PCR)模块6200的模块安排允许任何数目的不同PCR模块6200与任何数目的不同分离模块6100一起使用,所述PCR模块6200各自含有不同试剂和/或配置为扩增不同类型的核酸,所述分离模块6100各自含有不同试剂和/或配置为分离不同类型的核酸,且反之亦然。这种安排还允许分离模块6100和扩增模块6200分开贮存。分开贮存可以是有用的,例如如果在分离模块6100内包括的试剂具有与扩增模块6200内包括的试剂不同的贮存需求(例如有效期、冻干需求、贮存温度限制等)。
如图11中所示,分离模块6100包括第一个(或分离)外壳6110和第二个(或试剂)外壳6160,其联接至第一个外壳6110和/或至少部分地在第一个外壳6110内。为了清晰的目的,第二个外壳6160在图10和22中未显示。图11-14显示了第二个外壳6160和其中含有的特定部件,并且图15-18显示了处于驱动的多个不同阶段中的第二个外壳6160。第二个外壳6160包括第一个末端部分6161和第二个末端部分6162,并且限定一系列容纳室6163a、6163b、6163c和6163d,其含有在分离过程中使用的试剂和/或其他物质。如本文更详细地描述的,容纳室可以含有蛋白酶(例如蛋白酶K),溶解大量材料的裂解溶液,对裂解室6114内驻留的核酸样品进行磁荷的结合溶液,和结合磁荷核酸以帮助分离模块6100和/或第一个外壳6110内的核酸传送的磁珠溶液。
容纳室6163a、6163b、6163c和6163d各自包括在其中可移动地安置的驱动器6166(参见例如图14)。更具体而言,如图18中所示,驱动器6166a安置在容纳室6163a内,驱动器6166b安置在容纳室6163b内,驱动器6166c安置在容纳室6163c内,并且驱动器6166d安置在容纳室6163d内。如图15中所示,可穿透构件6170安置在第二个外壳6160的第二个末端部分6162周围,从而使得第二个外壳6160的内部部分、可穿透构件6170以及驱动器6166a、6166b、6166c和6166d共同封闭和/或限定容纳室6163a、6163b、6163c和6163d。类似地陈述,第二个外壳6160的内部部分、可穿透构件6170以及驱动器6166a、6166b、6166c和6166d共同限定试剂和/或物质可以贮存于其内的流体分离室6163a、6163b、6163c和6163d。可穿透构件6170可以由本文描述类型的任何合适的材料例如任何形式的聚丙烯进行构造。在某些实施方案中,可穿透构件6170可以由双向拉伸聚丙烯(BOP)进行构造。
如图14中所示,驱动器6166各自包括栓塞部分6167、穿孔部分6168和一个或多个驱动器孔6169。驱动器孔6169配置为接受驱动器组件的部分,以促进驱动器6166在室(例如室6163a)内的移动,如本文描述的。特别地,驱动器孔6169可以接受凸起,例如驱动器组件3400的凸起3446a,如下文就图37-40而言描述的。这种安排允许栓塞6166由第二个外壳6160的第一个末端部分6161驱动。在某些实施方案中,驱动器6166可以包括配置为保留驱动器组件(例如驱动器组件3400)的凸起的保留机构(例如凸起、卡环等),以促进驱动器6166通过驱动器组件的相互移动。
驱动器6166的栓塞部分6167配置为衔接第二个外壳6160的一部分,其限定驱动器6166安置在其内的室(例如室6163a),从而使得栓塞部分6167和第二个外壳6160的一部分形成基本上不漏流体的密封和/或气密封。因此,当驱动器6166安置在室(例如室6163a)内时,室内含有的物质的渗漏和/或传送降到最低和/或得到消除。以这种方式,栓塞部分6167的端面限定室(例如室6163a)的边界的一部分。栓塞部分6167还这样进行配置,从而使得当对驱动器6166施加力时(例如通过下文显示且描述的驱动器组件3400),驱动器6166将在室(例如室6163a)内移动,以将室内含有的物质传送到裂解室6114内,如下文描述的。以这种方式,驱动器6166可以充当转移机构,以将物质从分离模块6100的室(例如室6163a)传送到另一个部分内。
当驱动器6166在室(例如室6163a)内移动,以将室置于与室外的区域液体连通时,驱动器6166的穿孔部分6168配置为穿透、破坏、切断和/或破裂可穿透构件6170的一部分。以这种方式,室6163a、6163b、6163c和6163d各自可以选择性置于与分离模块6100的另一个部分(例如裂解室6114)液体连通,以当驱动器6166a、6166b、6166c和6166d各自驱动时,允许在室6163a、6163b、6163c和6163d各自内含有的物质转移,如下所述。
第二个外壳6160包括混合泵6181,其可以被驱动(例如通过仪器3002的驱动器组件3400),以在分离模块6100的一部分(例如裂解室6114)内含有的样品、试剂和/或其他物质内搅动、混合和/或产生湍动。如图12中所示,泵6181包括喷嘴6186,其可以指导流动,增加流动的压力和/或增加在分离模块6100的一部分内的湍流,以增强其中的混合。尽管混合泵6181显示为风箱型泵,但在其他实施方案中,混合泵6181可以是用于将能量转移到裂解室6114内的溶液的任何合适机构。此类机构可以包括例如活塞泵、旋转构件等。在某些实施方案中,第二个外壳6160可以包括任何合适的机构用于混合在分离室6114内的物质,以推动其中含有的样品的细胞裂解和/或其中含有的核酸的分离。在某些实施方案中,第二个外壳6160可以包括超声混合机构、热混合机构等。
如图11中所示,第二个外壳6160安置在由第一个外壳6110的第一个末端部分6111限定的孔6115内。因此,当第二个外壳6160安置在第一个外壳6110内时,第二个外壳6160的一部分限定裂解室6114的边界的至少一部分。更具体而言,当第二个外壳6160安置在第一个外壳6110内时,可穿透构件6170限定裂解室6114的边界的一部分。这种安排允许当可穿透构件6170的一部分被穿透、破坏、切断和/或破裂时,在第二个外壳6160内含有的物质传送到裂解室6114内(参见例如图15)。尽管第二个外壳6160的至少一部分显示为安置在第一个外壳6110和/或裂解室6114内时,但在其他实施方案中,第二个外壳6160可以联接至第一个外壳6110,而无第二个外壳的任何部分安置在第一个外壳内。在另外其他实施方案中,当第一个外壳和第二个外壳联接在一起时,第一个外壳的一部分可以安置在第二个外壳内。
如图12和13中所示,第二个外壳6160包括安置在第二个末端部分6162周围的密封6172,从而使得当第二个外壳6160联接至第一个外壳6110时,密封6172和第一个外壳6110的侧壁的一部分在第一个外壳6110和第二个外壳6160之间共同形成基本上不漏流体的密封和/或气密封。换言之,密封6172使裂解室6114与药筒6001外的区域流体分离。在某些实施方案中,密封6172还可以使第二个外壳6160与第一个外壳6110声学分离。
第二个外壳6160的第一个末端部分6161包括凸起6171,其配置为在由第一个外壳6110限定的相应孔6119(参见例如图10)内接受。因此,当第二个外壳6160安置在第一个外壳6110内时,凸起6171和孔6119将第二个外壳6160共同保留在第一个外壳6110内。类似地陈述,凸起6171和孔6119共同限制第二个外壳6160相对于第一个外壳6110的移动。
第一个外壳6110和第二个外壳6160的模块安排允许任何数目的第二个外壳6160(或试剂外壳)(其各自含有不同试剂和/或物质以推动核酸分离)与第一个外壳6110一起使用,以形成分离模块6100。这种安排还允许第一个外壳6110和第二个外壳6160分开贮存。分开贮存可以是有用的,例如如果在第二个外壳6160内包括的试剂具有与第一个外壳6110内含有的物质不同的贮存需求(例如有效期、冻干需求、贮存温度限制等)。
在使用中,在第二个外壳6160内含有的物质可以传送到第一个外壳6110内,以促进分离过程。图15-18显示了在驱动的不同阶段中分离模块6100的一部分的横断面视图。例如,蛋白酶K可以贮存于室6163d中,且转移到裂解室6114内,如图15中所示。更具体而言,当通过任何合适的外力例如由本文描述的仪器3002的驱动器组件3400应用的力驱动时,驱动器6166d可以在室6163d内移动,如由箭头HH所示。当驱动器6166d朝向裂解室6114移动时,穿孔部分6168d接触且穿透可穿透构件6170的一部分。在某些实施方案中,可穿透构件6170可以包括穿孔、应力集中提升管或其他结构不连续性,以确保可穿透构件6170容易地穿透可穿透构件6170的所需部分。以这种方式,驱动器6166d的移动将室6163d置于与裂解室6114液体连通。驱动器6166d的连续移动将室6163d的内容物(例如蛋白酶K)转移到裂解室6114内。以这种方式,驱动器6166d充当活门和转移机构。
在另一个实施方案中,室6163d的内容物可以包括蛋白酶K(例如10mg/mL、15mg/mL或20mg/mL、甘露醇、水和牛血清白蛋白。在一个进一步的实施方案中,将珠用蛋白酶K包被或衍生。在另一个实施方案中,室6163d的内容物可以包括蛋白酶K、甘露醇、水和明胶。在一个进一步的实施方案中,将珠用蛋白酶K包被或衍生。在另一个实施方案中,将室6163d的内容物冻干为例如50μL团块。
在另一个实施方案中,室6163d还提供阳性对照试剂。在一个实施方案中,阳性对照试剂是由内部对照核酸序列衍生的多个珠。在一个进一步的实施方案中,珠在甘露醇、BSA和水的溶液中提供。在甚至进一步的实施方案中,珠和溶液作为冻干的团块例如作为50μL团块提供。
尽管对于室6163d特别描述,但在其他实施方案中,蛋白酶K、包含蛋白酶K和/或阳性对照试剂的溶液作为物质R1或R2存在。
以类似方式,裂解溶液可以贮存于室6163c中,且转移到裂解室6114内,如图16中所示。更具体而言,当通过任何合适的外力例如由本文描述的仪器3002的驱动器组件3400应用的力驱动时,驱动器6166c可以在室6163c内移动,如由箭头II所示。当驱动器6166c朝向裂解室6114移动时,穿孔部分6168c接触且穿透可穿透构件6170的一部分。以这种方式,驱动器6166c的移动将室6163c置于与裂解室6114液体连通。驱动器6166c的连续移动将室6163c的内容物(例如裂解溶液)转移到裂解室6114内。以这种方式,驱动器6166c充当活门和转移机构。在一个实施方案中,室6163c或另一个室中贮存的裂解溶液包含胍HCl(例如3M、4M、5M、6M、7M或8M)、Tris HCl(例如5mM、10mM、15mM、20mM、25mM或30mM)、triton-X-100(例如1.5%、2%、2.5%、3%、3.5%、4%、4.5%或5%)、NP-40(例如1.5%、2%、2.5%、3%、3.5%、4%、4.5%或5%)、Tween-20(例如5%、10%、15%或20%)、CaCl2(例如1mM、1.5mM、2mM、2.5mM、3mM、3.5mM、4mM、4.5mM或5mM)、分子级别水的过滤溶液。尽管对于室6163c特别描述,但在其他实施方案中,裂解溶液作为物质R1或R2存在。
以类似方式,结合溶液可以贮存于室6163b中,且转移到裂解室6114内,如图17中所示。更具体而言,当通过任何合适的外力例如由本文描述的仪器3002的驱动器组件3400应用的力驱动时,驱动器6166b可以在室6163b内移动,如由箭头JJ所示。当驱动器6166b朝向裂解室6114移动时,穿孔部分6168b接触且穿透可穿透构件6170的一部分。以这种方式,驱动器6166b的移动将室6163b置于与裂解室6114液体连通。驱动器6166b的连续移动将室6163b的内容物(例如结合溶液)转移到裂解室6114内。以这种方式,驱动器6166b充当活门和转移机构。在一个实施方案中,结合溶液包含以约50μL、约100μL、约125μL、约150μL、约175μL或约200μL体积的异丙醇,例如100%异丙醇、90%异丙醇、80%异丙醇、70%异丙醇。尽管对于室6163b特别描述,但在其他实施方案中,结合溶液作为物质R1或R2存在。
以类似方式,一组磁珠可以贮存于室6163a中,且转移到裂解室6114内,如图18中所示。更具体而言,当通过任何合适的外力例如由本文描述的仪器3002的驱动器组件3400应用的力驱动时,驱动器6166a可以在室6163a内移动,如由箭头KK所示。当驱动器6166a朝向裂解室6114移动时,穿孔部分6168a接触且穿透可穿透构件6170的一部分。以这种方式,驱动器6166a的移动将室6163a置于与裂解室6114液体连通。驱动器6166a的连续移动将室6163a的内容物(例如磁珠)转移到裂解室6114内。以这种方式,驱动器6166a充当活门和转移机构。在一个实施方案中,磁珠是顺磁的。在一个实施方案中,珠是磁性硅珠,并且以1.0mg/mL或1.5mg/mL、2.0mg/mL、2.5mg/mL、3.0mg/mL或3.5mg/mL的浓度提供。在一个进一步的实施方案中,磁性硅珠贮存于异丙醇中,例如约50%异丙醇、约55%异丙醇、约60%异丙醇、约61%异丙醇、约62%异丙醇、约63%异丙醇、约64%异丙醇、约65%异丙醇、约66%异丙醇、约67%异丙醇、约68%异丙醇、约69%异丙醇、约70%异丙醇、约75%异丙醇、约80%异丙醇或约85%异丙醇。在一个实施方案中,珠作为约50μL、约100μL、约125μL、约150μL、约175μL或约200μL的体积提供。尽管对于室6163a特别描述,但在其他实施方案中,珠作为物质R1或R2存在。
如图10中所示,第一个外壳6110包括第一个末端部分6111和第二个末端部分6112,并且限定裂解室6114,两个洗涤室6121和6122,三个转移组件管腔6123、6124和6125,和洗脱室6190。第一个外壳6110还限定分离室6114邻近的孔6115。如图11中显示和上文描述的,第二个外壳6160安置在孔6115内,从而使得第二个外壳6160的一部分(例如可穿透构件6170)限定分离室6114的边界的至少一部分。
第一个末端部分6111还限定填充孔6116,通过其裂解室6114可以置于与分离模块6100外的区域液体连通。如图8-10中所示,分离模块6100包括可移除地联接至填充孔6116周围的盖子6118。在使用中,含有靶核酸的样品例如尿、血液和/或含有组织样品的其他材料可以经由填充孔6116传送到裂解室6114内。经由任何合适机构,包括例如通过经由填充孔6116将样品吸取或注射到第一个室6114内,可以将样品引入裂解室6114内。在某些实施方案中,样品过滤器可以安置在填充孔6116和/或装料盖子6118内。过滤器可以是例如疏水过滤器。
在样品安置在裂解室6114内后,促进细胞裂解的试剂和/或物质可以加入裂解室6114内,如上所述。此外,样品可以经由泵6181搅动和/或混合,以促进裂解过程,如上所述。在某些实施方案中,裂解室6144的内容物可以被加热(例如通过第三个加热模块3780,如下文就仪器3002而言显示且描述的)。
分离模块6100包括一系列转移组件(也称为转移机构),图15-19中显示为转移组件6140a、转移组件6140b和转移组件6140c。如本文描述的,转移组件配置为在裂解室6114、洗涤室6121、洗涤室6122和洗脱室6190之间转移物质(例如样品的一部分包括磁荷颗粒和与之附着的经分离的核酸)。更具体而言,转移组件6140配置为在裂解室6114、洗涤室6121、洗涤室6122和洗脱室6190之间转移物质,同时维持分离室6114、洗涤室6121、洗涤室6122和洗脱室6190与由第一个外壳6110限定的其他室(例如邻近洗涤室)基本上流体分离。
转移组件6140a安置在转移组件管腔6123内,从而使得转移组件6140a在裂解室6114和洗涤室6121之间。相应地,转移组件6140a配置为在裂解室6114和洗涤室6121之间转移物质。
转移组件6140b安置在转移组件管腔6124内,从而使得转移组件6140b在洗涤室6121和洗涤室6122之间。相应地,转移组件6140b配置为在洗涤室6121和洗涤室6122之间转移物质。
转移组件6140c安置在转移组件管腔6125内,从而使得转移组件6140c在洗涤室6122和洗脱室6190之间。相应地,转移组件6140c配置为在洗涤室6122和洗脱室6190之间转移物质。
转移组件各自就图20和21而言进行描述,所述图20和21显示了代表性转移组件6140。转移组件6140包括外壳6141和可移动构件6146,其可旋转地安置在外壳6141内。外壳6141限定第一个孔6142和第二个孔6143。当转移组件6140安置在转移组件管腔(例如转移组件管腔6123)内时,外壳6141这样对齐,从而使得第一个孔6142与第一个室(例如裂解室6114)对齐和/或液体连通,并且第二个孔6143与第二个室(例如洗涤室6121)对齐和/或液体连通。通过任何合适机构,例如通过机械扣件或护圈、化学键或粘合剂、干涉配合、焊接接头等,可以确保外壳6141在转移组件管腔(例如转移组件管腔6123)内。此外,外壳6141可以包括一个或多个密封(图20和21中未显示),从而使得第一个室(例如裂解室6114)和第二个室(例如洗涤室6121)维持彼此流体分离。类似地陈述,外壳6141和第一个外壳6110可以共同形成基本上不漏流体的密封和/或气密封,以消除和/或减少在第一个室(例如裂解室6114)和第二个室(例如洗涤室6121)之间的物质渗漏。
可移动构件6146包括限定凹槽或空腔6148的外表面6147。可移动构件6146安置在外壳6141内,从而使得可移动构件6146可以如由图20和21中的箭头MM所示的旋转。为了清晰的目的,可移动构件6146的外表面6147显示为与图20中的外壳6141的内表面6145分隔开。外表面6147与外壳6141的内表面6145滑动接触,从而使得外表面6147和内表面6145产生基本上不漏流体的密封和/或气密封。以这种方式,经由外壳6141和可移动构件6146之间的界面在第一个室(例如裂解室6114)和第二个室(例如洗涤室6121)之间的物质渗漏得到消除和/或减少。
可移动构件6146进一步限定配置为接受驱动器510的一部分的管腔6149。驱动器510可以是任何合适的驱动器,例如下文就图41-46而言显示且描述的仪器3002的转移驱动器组件3500的轴3510。如图20中所示,驱动器510的形状可以对应于由可移动构件6146限定的管腔6149的形状,从而使得驱动器510的旋转导致可移动构件6146的旋转。类似地陈述,驱动器510可以匹配地安置在管腔6149内,从而使得在驱动器510和可移动构件6146之间的相对旋转移动是受限的。在某些实施方案中,驱动器510和管腔6149可以具有基本上相似的六边形和/或八边形形状。
在使用中,通过如由箭头MM所示的旋转可移动构件6146,可移动构件6146可以在第一个位置(未显示)和第二个位置(图20)之间移动。当可移动构件6146处于第一个位置时,凹槽或空腔6148与第一个室(例如裂解室6114)对齐和/或液体连通。当可移动构件6146处于第二个位置时,凹槽或空腔6148与第二个室(例如洗涤室6121)对齐和/或液体连通。相应地,通过当可移动构件6146处于第一个位置时,在空腔6148内捕获或安置物质的一部分,将可移动构件旋转到第二个位置且从空腔6148内取出物质,第一个室(例如裂解室6114)内含有的一种或多种物质可以转移至第二个室(例如洗涤室6121)。
在某些实施方案中,物质可以通过磁力捕获、安置和/或维持在空腔6148内。例如,在某些实施方案中,驱动器510可以包括磁性部分。在使用中,驱动器510与所需转移组件6140对齐且移动到管腔6149内,如由图19中的箭头LL所示。因为如上所述,驱动器510的形状可以对应于管腔6149的形状,所以对齐操作可以在某些实施方案中执行,以确保驱动器510将在管腔6149内配合。当驱动器510的磁性部分在管腔6149内时,并且当可移动构件6146处于第一个位置时,样品的磁性部分(例如磁珠和与之附着的核酸)从第一个室(例如裂解室6114)移动到空腔6148内。驱动器510随后如由图20和21中的箭头MM所示的旋转。当可移动构件6146处于第二个位置时,驱动器510可以从管腔6149中取出,从而去除将样品的磁性部分保留在空腔6148内的磁力。相应地,样品的一部分随后可以从空腔6148中移出且进入第二个室(例如洗涤室6121)内。通过任何合适的机构,例如通过重力、流体运动等,样品的一部分可以从空腔6148中移出且进入第二个室(例如洗涤室6121)内。例如,如下所述,在某些实施方案中,混合机构6130a可以包括喷嘴(例如喷嘴6131a),以将压力喷射导入空腔6148内和/或邻近,以将样品的一部分从空腔6148中移出且进入第二个室(例如洗涤室6121)内。
如本文描述的转移机构6140的使用可以消除对在第一个外壳6110内的分开废物室和/或用于传送废物的流动路径的需要。相反,如上所述,样品的靶部分在多个室之间移动(例如从洗涤室6121到洗涤室6122),而样品的其他部分维持在先前室(例如洗涤室6122)中。此外,因为转移机构6140维持在两个室(例如洗涤室6121和洗涤室6122)之间的流体分离,所以废液被阻止连同样品的靶部分一起进入室(例如洗涤室6122)。因此,这种安排还消除关于在第一个外壳6110内,在其中描述的室之间和/或在由分离模块6100限定的流动路径内的过滤机构的需要。
如本文描述的转移机构6140的使用还允许样品的靶部分在分离模块6100内传送,同时维持分离模块内的压力在或接近环境压力。类似地陈述,如本文描述的转移机构6140转移样品的靶部分,而不产生在分离模块6100内的大量压力差。因此,这种安排可以减少来自分离模块的样品渗漏。
分离模块6100包括两个混合机构6130a和6130b(也称为洗涤泵)。如本文描述的,混合机构6130a和6130b分别配置为产生在洗涤室6121和洗涤室6122内的流体流动,以推动在其中含有的样品的一部分的洗涤和或混合。类似地陈述,混合机构6130a和6130b分别配置为将能量转移到洗涤室6121和洗涤室6122内。
混合机构6130a包括驱动器6132a和喷嘴6131a。混合机构6130a联接至第一个外壳6110,从而使得喷嘴6131a的至少一部分安置在洗涤室6121内。特别地,混合机构6130a包括联接部分6133a,其配置为联接至第一个外壳6110的相应联接部分6134a。尽管联接部分6133a和6134a显示为限定螺纹接口,但在其他实施方案中,通过任何合适方法,例如通过机械扣件或护圈、化学键或粘合剂、干涉配合、焊接接头等,混合机构6130a可以联接至第一个外壳6110。
类似地,混合机构6130b包括驱动器6132b和喷嘴6131b。混合机构6130b联接至第一个外壳6110,从而使得喷嘴6131b的至少一部分安置在洗涤室6122内。特别地,混合机构6130b包括联接部分6133b,其配置为联接至第一个外壳6110的相应联接部分6134b。尽管联接部分6133b和6134b显示为限定螺纹接口,但在其他实施方案中,通过任何合适方法,例如通过机械扣件或护圈、化学键或粘合剂、干涉配合、焊接接头等,混合机构6130b可以联接至第一个外壳6110。
驱动器6132a和6132b各自分别包括顶面6136a和6136b,其配置为由仪器的驱动器组件例如本文描述的仪器3002的驱动器组件3600接触和/或驱动。在使用中,驱动器组件可以压下和/或移动每种驱动器6132a和6132b的顶面6136a和6136b,以在每个混合机构6130a和6130b内产生压力。将压力传送到洗涤室6121和6122内,以促进在其中安置的样品之间和之内的洗涤、混合和/或其他相互作用。如上所述,在某些实施方案中,喷嘴中的至少一个(例如喷嘴6131a)可以包括尖端部分,其成角度、弯曲和/或以其他方式成形,以将由驱动器(例如驱动器6132a)产生的压力能和/或流动导向洗涤室(例如洗涤室6121)内的特定区域。例如,在某些实施方案中,喷嘴6131a可以成形,以将由驱动器6132a产生的压力能和/或流动导向转移机构6140的空腔6148。
尽管驱动器6132a和6132b各自显示为风箱型泵,但在其他实施方案中,混合机构6130a和/或混合机构6130b可以包括任何合适机构用于产生能量和/或将能量转移到洗涤室6121和6122内。此类机构可以包括例如活塞泵、旋转构件等。在某些实施方案中,混合机构可以包括超声能源、热能源等。
尽管混合机构6130a和6130b分别显示且描述为产生能量和/或将能量转移到洗涤室6121和6122内,但在其他实施方案中,混合机构还可以限定与洗涤室流体分离的物质(例如洗涤缓冲溶液)可以贮存于其内的容积。因此,当驱动混合机构时,物质可以转移到洗涤室内。以这种方式,在某些实施方案中,混合机构还可以充当转移机构。
扩增(或PCR)模块包括外壳6210(具有第一个末端部分6211和第二个末端部分6212)、PCR小瓶6260和转移管6250。PCR小瓶6260联接至外壳6210的第一个末端部分6211且限定样品可以安置在其内的容积6262,以促进与样品结合的反应。PCR小瓶6260可以是以允许与样品结合的反应发生的方式用于含有样品的任何合适容器。PCR小瓶6260还可以是以允许监控此类反应(例如检测在样品内起因于反应或与反应结合的分析物)的方式用于含有样品的任何合适容器。在某些实施方案中,PCR小瓶6260的至少一部分可以是基本上透明的,以允许在其中发生的反应的光学监控是光学系统(例如本文描述的仪器3002的光学组件3800)。
如图8、9、10和22中所示,扩增模块6200联接至分离模块6100的第一个外壳6110的第二个末端部分6112,从而使得转移管6250的至少一部分安置在分离模块6100的洗脱室6190内。以这种方式,如本文描述的,在洗脱室6190内安置的经分离的核酸、任何物质和/或任何PCR试剂可以经由转移管6250从洗脱室6190传送到PCR小瓶6260。
外壳6210限定一系列试剂室6213a、6213b、6213c(参见例如,图22)和泵空腔6241。试剂室6213a、6213b、6213c可以含有与PCR小瓶6260中发生的反应和/或过程结合的任何合适物质。试剂室6213a、6213b、6213c可以包括例如洗脱流体、主要混合物、探针和/或引物,以促进PCR过程。如图24中所示,外壳6210限定一系列通道6221a、6221b、6221c,其配置为将试剂室6213a、6213b、6213c各自置于与分离模块6100的洗脱室6190液体连通。尽管图22中未显示,但在某些实施方案中,可穿透构件可以安置在试剂室6213a、6213b、6213c中的任何一个内和/或在通道6221a、6221b、6221c中的任何一个内,以使各自的试剂室与洗脱室6190流体分离。以与上文就可穿透构件6170而言描述的那种类似的方式,在此类实施方案中,可穿透构件可以通过试剂栓塞穿孔,以将试剂室选择性置于与洗脱室液体连通。
试剂栓塞6214a可移动地安置在试剂室6213a内,试剂栓塞6214b可移动地安置在试剂室6213b内,并且试剂栓塞6214c可移动地安置在试剂室6213c内。以这种方式,当试剂栓塞(例如试剂栓塞6214a)移动时,如由图22中的箭头NN所示,试剂栓塞经由结合的通道(例如通道6221a)将试剂室(例如试剂室6213a)的内容物转移到洗脱室6190内。以这种方式,试剂栓塞充当转移机构。
试剂栓塞6214a、6214b、6214c可以由仪器的驱动器组件例如本文描述的仪器3002的驱动器组件3600接触和/或驱动。在某些实施方案中,试剂栓塞6214a、6214b、6214c可以包括配置为保留驱动器组件(例如驱动器组件3400)的一部分的保留机构(例如凸起、卡环等),以促进试剂栓塞6214a、6214b、6214c通过驱动器组件的相互移动。
PCR模块包括转移机构6235,其配置为转移来自分离模块6100的洗脱室6190和PCR模块6200的PCR小瓶6260的物质,和/或在分离模块6100的洗脱室6190和PCR模块6200的PCR小瓶6260之间转移物质。转移机构6235包括在泵空腔6241内安置的转移活塞6240。当转移活塞6240在泵空腔6241内移动时,如由图22中的箭头OO所示,在PCR容积6262内产生真空和/或正压。在PCR容积6262和洗脱室6190之间的这个压力差导致洗脱室6190的内容物的至少一部分经由转移管6250和通道6222被转移到(或自)PCR容积6262(参见例如,图24)。以这种方式,可以将物质和/或样品加入,混合和/或通过驱动转移机构6235在洗脱室6190和PCR容积6262之间传送。转移机构6235可以通过任何合适机构例如本文描述的仪器3002的驱动器组件3600驱动。
转移活塞6240和泵空腔6241可以在PCR模块6200内的任何合适位置中。例如,尽管转移活塞6240显示为基本上安置在PCR小瓶6260上,但在其他实施方案中,转移活塞6240可以基本上安置在洗脱室6190上。
在某些实施方案中,外壳6210限定一个或多个通风通道,以将洗脱室6190和/或PCR小瓶6260流体联接至大气。在某些实施方案中,此类通风孔中的任何可以包括熔块,以使来自洗脱室6190和/或PCR小瓶6260的样品和/或试剂的丧失降到最低,和/或阻止洗脱室6190和/或PCR小瓶6260的样品和/或试剂的丧失。
在使用中,如上所述,在分离模块6100内分离且加工核酸后,经由转移组件6140c将它转移到洗脱室6190内。磁珠随后通过洗脱缓冲液从核酸中去除(或“洗涤”),并且从洗脱室6190中去除。因此,洗脱室6190含有经分离的和/或经纯化的核酸。在某些实施方案中,洗脱缓冲液包含在洗脱室6190内。在其他实施方案中,洗脱缓冲液包含在PCR模块6200的试剂室之一(例如试剂室6213c)中,且转移到洗脱室6190内,如上所述。在一个实施方案中,洗脱缓冲液包含分子级别水、tris HCl(例如约10mM、约15mM、约20mM、约25mM、约30mM、约35mM或约40mM)、氯化镁(例如约1mM、约2mM、约3mM、约4mM、约5mM、约6mM、约7mM、约8mM、约9mM、约10mM或约20mM)、甘油(例如约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约12%、约14%、约16%、约18%、约20%或约25%)的过滤溶液。在一个实施方案中,洗脱缓冲液的pH是约7.5、约7.6、约7.7、约7.8、约7.9、约8.0、约8.1、约8.2、约8.3、约8.4、约8.5、约8.6、约8.7、约8.8、约8.9或约9.0)。在另一个实施方案中,洗脱缓冲液包含杀菌剂,例如上文提供的洗脱缓冲液进一步包含杀菌剂。在一个实施方案中,洗脱缓冲液还充当洗涤缓冲液。尽管对于洗脱室6190特别描述,但在其他实施方案中,上述洗脱缓冲液作为物质R1或R2存在。
在某些实施方案中,PCR试剂随后从PCR模块6200转移到洗脱室6190内。更具体而言,将试剂栓塞6214a、6214b和/或6214c驱动(例如通过仪器3002),以将试剂经由通道6221a、6221b、6221c引入洗脱室6190内。PCR样品随后经由转移管6250和通道6222从洗脱室6190传送到PCR小瓶6260内。特别地,可以将转移活塞6240驱动,以在PCR模块6200内产生压力差,以将PCR样品从洗脱室6190传送PCR小瓶6260内,如上所述。以这种方式,在洗脱室6190中制备PCR样品(经分离的核酸和PCR试剂)。通过在洗脱室642内执行试剂和核酸样品的混合(而不是将经分离的核酸传送到PCR小瓶6260内且在其中执行混合),避免核酸的另外转移。这种安排可以导致PCR后分析的改善准确度,从而使得在某些情况下,分析在性质中可以是半定量的。
在其他实施方案中,然而,可以在PCR小瓶6260中制备PCR样品(经分离的核酸和PCR试剂)。在此类实施方案中,例如,PCR试剂可以例如以冻干形式贮存于PCR小瓶6260中。经分离的核酸可以传送到PCR小瓶6260内且与冻干的PCR试剂混合,以在PCR小瓶6260内重构试剂。
在PCR样品处于PCR小瓶6260后,PCR样品可以进行热循环(例如经由仪器3002的加热器组件3700),以执行所需扩增。在热循环完成后和/或在热循环过程中,PCR样品可以任选进行分析(例如经由仪器3002的光学组件3800),以分析样品。仪器3002的描述在下文提供。
图25-33是根据一个实施方案的药筒7001的多个视图。药筒7001的特定零件类似于药筒6001的相应零件,并且因此在下文不描述。当可应用时,将上文对于药筒6001呈现的讨论引入药筒7001的讨论内。例如,尽管在第二个外壳7160内的驱动器(例如驱动器7163a)具有与第二个外壳6160内的驱动器(例如驱动器6163a)不同的大小和/或形状,但在第二个外壳6160内的驱动器的结构和功能的许多方面类似于在外壳7160内的驱动器的那种。相应地,上文对于驱动器(例如驱动器6160a)呈现的描述可应用于下文描述的驱动器(例如驱动器7160a)。
药筒7001包括样品制备(或分离)模块7100和扩增(或PCR)模块7200,其联接在一起以形成整合的药筒7001。罩7005安置在分离模块7100和PCR模块7200的一部分周围。一个或多个药筒7001可以安置在本文公开的任何合适仪器类型(例如下文描述的仪器3002)内,其配置为操作药筒7001,驱动药筒7001和/或与药筒7001相互作用,以对药筒7001内含有的测试样品执行核酸分离、转录和/或扩增。
如图26-28中所示,分离模块7100包括第一个(或分离)外壳7110和第二个(或试剂)外壳7160,其联接至第一个外壳7110和/或至少部分在第一个外壳7110内。第二个外壳7160限定一系列容纳室7163a、7163b、7163c和7163d,其含有在分离过程中使用的试剂和/或其他物质。如本文描述的,容纳室可以含有蛋白酶(例如蛋白酶K),溶解大量材料的裂解溶液,对裂解室7114内驻留的核酸样品进行磁荷的结合溶液,和结合磁荷核酸以帮助分离模块7100和/或第一个外壳7110内的核酸传送的磁珠溶液。在一个实施方案中,上文提供的前述溶液用于图26-28中提供的药筒中。
容纳室7163a、7163b、7163c和7163d各自包括在其中可移动地安置的驱动器。更具体而言,如图27和28中所示,驱动器7166a安置在容纳室7163a内,驱动器7166b安置在容纳室7163b内,驱动器7166c安置在容纳室7163c内,并且驱动器7166d安置在容纳室7163d内。驱动器7166a、7166b、7166c和7166d各自类似于上文显示且描述的驱动器6166(参见例如图14)。特别地,驱动器7166a、7166b、7166c和7166d各自可以充当转移机构,以当通过由图28中的箭头PP所示的方向移动时,将物质从室(例如室7163a)传送到分离模块7100的另一个部分内。
如图27中所示,可穿透构件7170安置在第二个外壳7160的一部分的周围,从而使得第二个外壳7160的内部部分、可穿透构件7170以及驱动器7166a、7166b、7166c和7166d共同封闭和/或限定容纳室7163a、7163b、7163c和7163d。类似地陈述,第二个外壳7160的内部部分、可穿透构件7170以及驱动器7166a、7166b、7166c和7166d共同限定试剂和/或物质可以贮存于其内的流体分离室7163a、7163b、7163c和7163d。可穿透构件7170可以由本文描述类型的任何合适的材料例如任何形式的聚丙烯进行构造。在某些实施方案中,可穿透构件7170可以由双向拉伸聚丙烯(BOP)进行构造。
第二个外壳7160包括混合泵7181,其可以驱动(例如通过仪器3002的驱动器组件3400),以在分离模块7100的一部分(例如裂解室7114)内含有的样品、试剂和/或其他物质内搅动、混合和/或产生湍动。
如图26-28中所示,第二个外壳7160安置在由第一个外壳7110限定的孔内。因此,当第二个外壳7160安置在第一个外壳7110内时,第二个外壳7160的一部分限定裂解室7114的边界的至少一部分。更具体而言,当第二个外壳7160安置在第一个外壳7110内时,可穿透构件7170限定裂解室7114的边界的一部分。这种安排允许当可穿透构件7170的一部分被穿透、破坏、切断和/或破裂时,在第二个外壳7160内含有的物质传送到裂解室7114内。以上文就分离模块6100而言描述的相似方式,当驱动驱动器7166a、7166b、7166c和7166d时,在第二个外壳7160内含有的物质可以传送到第一个外壳7110内。
如图27和28中所示,第一个外壳7110包括第一个(或顶端)部分7112和第二个(或底部)部分7111。在某些实施方案中,顶端部分7112可以与底部部分7111分开进行构造,并且随后可以联接至底部部分7111,以形成第一个外壳7110。第一个外壳限定裂解室7114,两个洗涤室7121和7122,三个转移组件管腔(图27和28中未显示)和洗脱室7190。第一个外壳7110还限定第二个外壳7160的一部分安置在其内的分离室7114邻近的孔。
如图26-28中所示,分离模块7100包括可移除地联接至外壳7110的盖子7118。在使用中,在去除盖子7118后,含有靶核酸的样品例如尿、血液和/或含有组织样品的其他材料可以经由填充孔7116传送到裂解室7114内。经由任何合适机构,包括例如通过经由填充孔7116将样品吸取或注射到第一个室7114内,可以将样品引入裂解室7114内。
在样品安置在裂解室7114内后,促进细胞裂解的试剂和/或物质可以加入裂解室7114内,如上所述。此外,样品可以经由泵7181搅动和/或混合,以促进裂解过程,如上所述。在某些实施方案中,裂解室7144的内容物可以被加热(例如通过第三个加热模块3780,如下文就仪器3002而言显示且描述的)。此外,第一个外壳7110的第二个部分7111包括声联接部分7182。相应地,在某些实施方案中,声换能器的至少一部分(未显示)可以安置与声联接部分7182接触。以这种方式,由换能器产生的声能和/或超声能可以传送通过声联接部分7182和第一个外壳7110的侧壁,并且进入裂解室7114内的溶液内。
分离模块7100包括一系列转移组件(也称为转移机构),图26-28中显示为转移组件7140a、转移组件7140b和转移组件7140c。如本文描述的,转移组件配置为在裂解室7114、洗涤室7121、洗涤室7122和洗脱室7190之间转移物质(例如样品的一部分包括磁荷颗粒和与之附着的经分离的核酸)。更具体而言,转移组件7140配置为在裂解室7114、洗涤室7121、洗涤室7122和洗脱室7190之间转移物质,同时维持分离室7114、洗涤室7121、洗涤室7122和洗脱室7190与由第一个外壳7110限定的其他室(例如邻近洗涤室)基本上流体分离。转移组件7140a、7140b和7140c在结构和功能方面类似于上文就分离模块6100而言显示且描述的转移组件6140,并且因此在下文不详细描述。
分离模块7100包括两个洗涤缓冲液模块7130a和7130b,其各自联接至第一个外壳7110的上层部分7112。如本文描述的,每个洗涤缓冲液模块7130a和7130b含有物质(例如待加入样品中的试剂、洗涤缓冲溶液、矿物油和/或任何其他物质),并且配置为当驱动时各自将物质转移到洗涤室7121和洗涤室7122内。此外,每个洗涤缓冲液模块7130a和7130b分别配置为产生在洗涤室7121和洗涤室7122内的流体流动,以推动在其中含有的样品的部分的洗涤和或混合。类似地陈述,每个洗涤缓冲液模块7130a和7130b分别配置为将能量转移到洗涤室7121和洗涤室7122内。在一个实施方案中,洗涤缓冲液模块7130a和/或7130b包含洗涤缓冲液,其包含分子级别水、tris HCl(例如约10mM、约15mM、约20mM、约25mM、约30mM、约35mM或约40mM)、氯化镁(例如约1mM、约2mM、约3mM、约4mM、约5mM、约6mM、约7mM、约8mM、约9mM、约10mM或约20mM)、甘油(例如约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约12%、约14%、约16%、约18%、约20%或约25%)的过滤溶液。在一个实施方案中,洗涤缓冲液的pH是约7.5、约7.6、约7.7、约7.8、约7.9、约8.0、约8.1、约8.2、约8.3、约8.4、约8.5、约8.6、约8.7、约8.8、约8.9或约9.0)。在另一个实施方案中,洗脱缓冲液包含杀菌剂,例如上文提供的洗脱缓冲液进一步包含杀菌剂。
尽管对于室7130a和/或7130b特别描述,但在其他实施方案中,上文立即描述的洗涤缓冲液作为物质R1和/或R2存在。
在另一个实施方案中,洗涤缓冲液模块7130a和/或7130b包含洗涤缓冲液,其包含分子级别水、胍HCl(例如约0.7mM、约0.8mM、约0.81mM、约0.82mM、约0.83mM、约0.84mM、约0.85mM、约0.9mM、约1.0mM)、tris HCl(例如约10mM、约15mM、约20mM、约25mM、约30mM、约35mM或约40mM,并且可以具有约7.5、约8或约8.5的pH),triton-X-100(例如约0.25%、约0.5%、约0.75%、约1%)、Tween-20(例如约0.25%、约0.5%、约0.75%、约1%)、EDTA(例如约0.1mM、约0.2mM、约0.3mM、约0.5mM、约0.75mM、约1mM、约2mM、约3mM、约4mM、约5mM、约6mM、约7mM、约8mM、约9mM、约10mM或约20mM)、异丙醇(例如约10%、约20%、约30%、约40%、约50%、约60%)的过滤溶液。在一个实施方案中,洗涤缓冲液的pH是约7.5、约7.6、约7.7、约7.8、约7.9、约8.0、约8.1、约8.2、约8.3、约8.4、约8.5、约8.6、约8.7、约8.8、约8.9或约9.0)。尽管对于室7130a和/或7130b特别描述,但在其他实施方案中,上文立即描述的洗涤缓冲液作为物质R1和/或R2存在。
洗涤缓冲液模块7130a包括可移动地安置在外壳7137a内的驱动器7150a。外壳7137a联接至第一个外壳7110的上层部分7112,从而使得洗涤缓冲液模块7130a与洗涤室7121基本上对齐。特别地,外壳7137a包括一对凸起7133a,其配置为安置在由第一个外壳7110的上层部分7112的联接部分7134a限定的相应孔内。尽管洗涤缓冲液模块7130a显示为通过“搭扣配合”联接至第一个外壳7110,但在其他实施方案中,通过任何合适方法,例如通过螺纹接口、机械扣件或护圈、化学键或粘合剂、干涉配合、焊接接头等,洗涤缓冲液模块7130a可以联接至第一个外壳7110。
驱动器7150a包括栓塞部分7151a、穿孔部分7152a和衔接部分7153a。衔接部分7153a配置为与驱动器组件的一部分衔接,可移除地联接至驱动器组件的一部分和/或在驱动器组件的一部分内接受,以促进驱动器7150a在外壳7137a内的移动,如本文描述的。驱动器7150a可以通过任何合适仪器例如下文就图47-51而言描述的驱动器组件3600进行操作和/或驱动。
驱动器7150a的栓塞部分7151a安置在外壳7137a内。可穿透构件7135a安置在外壳7137a的末端部分周围,从而使得栓塞部分7151a的端面、外壳7137a和可穿透构件7135a共同限定物质安置在其内的容积。栓塞部分7151a和外壳7137a的内表面配置为形成基本上不漏流体的密封和/或气密封。在某些实施方案中,栓塞部分7151a可以包括密封构件、o形环等。
当驱动器7150a通过由图28中的箭头QQ所示的方向在外壳7137a内移动时,驱动器7150a的穿孔部分7152a配置为穿透、破坏、切断和/或破裂可穿透构件7135a的一部分。以这种方式,驱动器7150的移动将室置于与洗涤室7121液体连通。类似地陈述,当驱动器7150a被驱动时,洗涤缓冲液模块7130a可以选择性置于与洗涤室7121液体连通。在洗涤缓冲液模块7130a内的物质传送到洗涤室7121内后,驱动器7150a可以在外壳7137a内往复以产生压力,所述压力传送到洗涤室7121内,以推动在其中安置的样品之间和之内的洗涤、混合和/或其他相互作用。第一个外壳7110的顶端部分7112包括喷嘴7131a,其配置为将由驱动器7150a产生的压力能和/或流动导向洗涤室7121内的特定区域。
洗涤缓冲液模块7130b包括可移动地安置在外壳7137b内的驱动器7150b。外壳7137b联接至第一个外壳7110的上层部分7112,从而使得洗涤缓冲液模块7130b与洗涤室7122基本上对齐。特别地,外壳7137b包括一对凸起7133b,其配置为安置在由第一个外壳7110的上层部分7112的联接部分7134b限定的相应孔内。尽管洗涤缓冲液模块7130b显示为通过“搭扣配合”联接至第一个外壳7110,但在其他实施方案中,通过任何合适方法,例如通过螺纹接口、机械扣件或护圈、化学键或粘合剂、干涉配合、焊接接头等,洗涤缓冲液模块7130b可以联接至第一个外壳7110。
驱动器7150b包括栓塞部分7151b、穿孔部分7152b和衔接部分7153b。衔接部分7153b配置为与驱动器组件的一部分衔接,可移除地联接至驱动器组件的一部分和/或在驱动器组件的一部分内接受,以促进驱动器7150b在外壳7137b内的移动,如本文描述的。驱动器7150b可以通过任何合适仪器例如下文就图47-51而言描述的驱动器组件3600进行操作和/或驱动。
驱动器7150b的栓塞部分7151b安置在外壳7137b内。可穿透构件7135b安置在外壳7137b的末端部分周围,从而使得栓塞部分7151b的端面、外壳7137b和可穿透构件7135b共同限定物质安置在其内的容积。栓塞部分7151b和外壳7137b的内表面配置为形成基本上不漏流体的密封和/或气密封。在某些实施方案中,栓塞部分7151b可以包括密封构件、o形环等。
当驱动器7150b通过由图28中的箭头QQ所示的方向在外壳7137b内移动时,驱动器7150b的穿孔部分7152b配置为穿透、破坏、切断和/或破裂可穿透构件7135b的一部分。以这种方式,驱动器7150b的移动将室置于与洗涤室7122液体连通。类似地陈述,当驱动器7150b被驱动时,洗涤缓冲液模块7130b可以选择性置于与洗涤室7122液体连通。在洗涤缓冲液模块7130b内的物质传送到洗涤室7122内后,驱动器7150b可以在外壳7137b内往复以产生压力,所述压力传送到洗涤室7122内,以推动在其中安置的样品之间和之内的洗涤、混合和/或其他相互作用。第一个外壳7110的顶端部分7112包括喷嘴7131b,其配置为将由驱动器7150b产生的压力能和/或流动导向洗涤室7122内的特定区域。
如图29-31中所示,扩增(或PCR)模块7200包括基底7220,其由第一(或上)层7227和第二(或下)层7228进行构造。PCR模块7200包括联接至第二层7228的PCR小瓶7260、转移机构7235、第一个试剂模块7270a和第二个试剂模块7270b。PCR小瓶7260联接至外壳7210的第一个末端部分7211且限定样品可以安置在其内的容积7262,以促进与样品结合的反应。PCR小瓶7260可以是以允许与样品结合的反应发生的方式用于含有样品的任何合适容器。PCR小瓶7260还可以是以允许监控此类反应(例如检测在样品内起因于反应或与反应结合的分析物)的方式用于含有样品的任何合适容器。在某些实施方案中,PCR小瓶7260的至少一部分可以是基本上透明的,以允许在其中发生的反应的光学监控是光学系统(例如本文描述的仪器3002的光学组件3800)。
如图32和33中所示,扩增模块7200联接至分离模块7100的第一个外壳7110,从而使得转移管7250的至少一部分安置在分离模块7100的洗脱室7190内。以这种方式,如本文描述的,在洗脱室7190内安置的经分离的核酸、任何物质和/或任何PCR试剂可以经由转移管7250从洗脱室7190传送到PCR小瓶7260。更具体而言,基底7220限定流动通道7222,当PCR模块7200联接至分离模块7100时,其将PCR小瓶7260置于与洗脱室7190液体连通。如图30和31中所示,流动通道7222的一部分限定在转移管7250和基底7220的第二层7228的转移端口7229中。尽管流动通道7222显示为主要由基底7220的第二层7228限定,但在其他实施方案中,流动通道7222可以由第一层7227或在第一层7227和第二层7228的一部分中限定。
基底7220还限定流动通道7223、流动通道7221a和流动通道7221b。如本文更详细地描述的,流动通道7223配置为经由转移端口7229将转移机构7235内限定的容积7237置于与PCR小瓶7260液体连通。流动通道7221a配置为经由转移管7250将由试剂模块7270a限定的容积置于与洗脱室7190液体连通。流动通道7221b配置为经由转移端口7229和/或通道7222的一部分将由试剂模块7270b限定的容积置于与PCR小瓶7260液体连通。流动通道7223、流动通道7221a和/或流动通道7221b中的任何可以由第一层7227、第二层7228或在第一层7227和第二层7228的一部分中限定。
PCR模块7200包括两个试剂模块7270a和7270b,其各自联接至基底7220的上层7227。如本文描述的,每个试剂模块7270a和7270b分别含有物质R1和R2。试剂模块7270a配置为经由流动通道7221a将物质R1传送到洗脱室7190内,如本文描述的。试剂模块7270b配置为经由流动通道7221b将物质R2传送到PCR小瓶7260内,如本文描述的。以这种方式,每个试剂模块7270a和7270b充当试剂贮存装置和转移机构。
物质R1和R2可以是例如待加入样品中的试剂、洗脱缓冲溶液、洗涤缓冲溶液、矿物油和/或任何其他物质,如本文描述的。在某些实施方案中,物质R1可以包括洗脱缓冲液和矿物油。在某些实施方案中,物质R2可以包括促进在PCR小瓶7260内的PCR过程的反应试剂。在某些实施方案中,PCR主要混合物可以以冻干状态安置在PCR小瓶7260内,从而使得物质R2的添加和/或物质R1和靶样品的混合物重构冻干的主要混合物,以促进PCR过程。
例如,在其中HSV经由PCR扩增的一个实施方案中,主要混合物是冻干团块,其包含对于HSV1和/或HSV2序列特异性的HSV1和HSV2引物、检测探针(例如包含在5′末端的荧光团和MGB和在3′末端的非荧光猝灭剂的杂交寡核苷酸探针)、以及内部对照引物和探针、KCl(例如约40mM、约50mM、约60mM、约70mM)、甘露醇(例如约70mM、约80mM、约90mM、约100mM、约110mM、约120mM)、BSA(例如约0.1mg/mL、约0.5mg/mL、约1mg/mL)、dNTPs(例如约0.2mM、约0.3mM、约0.4mM、约0.5mM、约1mM)、Taq聚合酶(例如约0.1U/μL、约0.2U/μL、约0.3U/μL)。
在另一个实施方案中,主要混合物包含冻干试剂,以对三种靶和内部对照执行多重PCR。在一个进一步的实施方案中,靶核酸是对于甲型流行性感冒特异性的核酸、对于乙型流行性感冒特异性的核酸和对于RSV特异性的核酸。在甚至进一步的实施方案中,通过提供对于每种靶序列特异性的杂交寡核苷酸探针实时监控多重反应,每种探针包含在5′末端的荧光团和MGB和在3′末端的非荧光猝灭剂。
在另一个实施方案中,冻干的主要混合物包含用于PCR和逆转录酶反应的试剂。例如,在一个实施方案中,冻干的主要混合物包括逆转录酶和Taq聚合酶、dNTP、RNA酶抑制剂、KCl、BSA和引物,以进行第一链cDNA合成和PCR。
主要混合物包含不同引物和探针,取决于待扩增的靶。每种靶将具有与之结合的特异性引物和探针组,并且引物和探针组可以与上文提及的其他PCR试剂一起冻干,以形成冻干的主要混合物。组分的浓度还将依赖于待扩增的特定靶和是否扩增多个靶而改变。
试剂模块7270a包括可移动地安置在外壳7277a内的驱动器7280a。外壳7277a联接至基底7220的上层部分7227,从而使得试剂模块7270a与通道7221a、转移管7250和/或洗脱室7190基本上对齐。如图29中所示,外壳7277a包括一对凸起7273a,其配置为安置在由基底7220的上层部分7227的联接部分7234a限定的相应孔内。尽管试剂模块7270a显示为通过“搭扣配合”联接至基底7220,但在其他实施方案中,通过任何合适方法,例如通过螺纹接口、机械扣件或护圈、化学键或粘合剂、干涉配合、焊接接头等,试剂模块7270a可以联接至基底7220。
驱动器7280a包括栓塞部分7281a、穿孔部分7282a和衔接部分7283a。衔接部分7283a配置为与驱动器组件的一部分衔接,可移除地联接至驱动器组件的一部分和/或在驱动器组件的一部分内接受,以促进驱动器7280a在外壳7277a内的移动,如本文描述的。驱动器7280a可以通过任何合适仪器例如下文就图47-51而言描述的驱动器组件3600进行操作和/或驱动。
驱动器7280a的栓塞部分7281a安置在外壳7277a内。可穿透构件7175a安置在外壳7277a的末端部分周围,从而使得栓塞部分7281a的端面、外壳7277a和可穿透构件7275a共同限定物质R1安置在其内的容积。栓塞部分7281a和外壳7277a的内表面配置为形成基本上不漏流体的密封和/或气密封。在某些实施方案中,栓塞部分7281a可以包括密封构件、o形环等。
当驱动器7280a通过由图31中的箭头SS所示的方向在外壳7277a内移动时,驱动器7280a的穿孔部分7282a配置为穿透、破坏、切断和/或破裂可穿透构件7275a的一部分。以这种方式,驱动器7280a的移动将室置于与通道7221a和因此洗脱室7190液体连通。类似地陈述,当驱动器7280a被驱动时,试剂模块7270a可以选择性置于与洗脱室7190液体连通。
试剂模块7270b包括可移动地安置在外壳7277b内的驱动器7280b。外壳7277b联接至基底7220的上层部分7227,从而使得试剂模块7270b与通道7221b基本上对齐。如图29中所示,外壳7277b包括一对凸起7273b,其配置为安置在由基底7220的上层部分7227的联接部分7234b限定的相应孔内。尽管试剂模块7270b显示为通过“搭扣配合”联接至基底7220,但在其他实施方案中,通过任何合适方法,例如通过螺纹接口、机械扣件或护圈、化学键或粘合剂、干涉配合、焊接接头等,试剂模块7270b可以联接至基底7220。
驱动器7280b包括栓塞部分7281b、穿孔部分7282b和衔接部分7283b。衔接部分7283b配置为与驱动器组件的一部分衔接,可移除地联接至驱动器组件的一部分和/或在驱动器组件的一部分内接受,以促进驱动器7280b在外壳7277b内的移动,如本文描述的。驱动器7280b可以通过任何合适仪器例如下文就图47-51而言描述的驱动器组件3600进行操作和/或驱动。
驱动器7280b的栓塞部分7281b安置在外壳7277b内。可穿透构件7275b安置在外壳7277b的末端部分周围,从而使得栓塞部分7281b的端面、外壳7277b和可穿透构件7275b共同限定物质R2安置在其内的容积。栓塞部分7281b和外壳7277b的内表面配置为形成基本上不漏流体的密封和/或气密封。在某些实施方案中,栓塞部分7281a可以包括密封构件、o形环等。
当驱动器7280b通过由图31中的箭头SS所示的方向在外壳7277b内移动时,驱动器7280b的穿孔部分7282b配置为穿透、破坏、切断和/或破裂可穿透构件7275b的一部分。以这种方式,驱动器7280b的移动将室置于与通道7221b和因此PCR室7260液体连通。
PCR模块包括7200转移机构7235,其配置为转移来自分离模块7100的洗脱室7190和PCR模块7200的PCR小瓶7260的物质,和/或在分离模块7100的洗脱室7190和PCR模块7200的PCR小瓶7260之间转移物质。如本文描述的,转移机构7235还配置为限定物质可以包含在其内的容积7237,并且将容积7237选择性置于与PCR小瓶7260液体连通。以这种方式,转移机构7235还充当流动控制机构。
转移机构7235包括在外壳7236内安置的驱动器7240。外壳7236联接至基底7220的上层7227和/或是基底7220的上层7227的一部分。外壳7236限定物质例如矿物油可以贮存于其内的容积7237。尽管未显示为包括可穿透构件,但在其他实施方案中,容积7237的一部分可以由可穿透构件包围和/或通过可穿透构件流体分离,如本文描述的。
驱动器7240包括栓塞部分7241、活门部分7242和衔接部分7243。衔接部分7243配置为与驱动器组件的一部分衔接,可移除地联接至驱动器组件的一部分和/或在驱动器组件的一部分内接受,以促进驱动器7240在外壳7236内的移动,如本文描述的。驱动器7240可以通过任何合适仪器例如下文就图47-51而言描述的驱动器组件3600进行操作和/或驱动。
驱动器7240的栓塞部分7241安置在外壳7236内。栓塞部分7241和外壳7236的内表面配置为形成基本上不漏流体的密封和/或气密封。在某些实施方案中,栓塞部分7241可以包括密封构件、o形环等。另外,密封7244安置在外壳7236的顶端部分上。
驱动器7240配置为在第一个位置(图30)和第二个位置(图31)之间在外壳7236内移动。当驱动器7240处于第一个位置时,驱动器7240的活门部分7242至少部分地安置在通道7223内,从而使得容积7237与流动通道7223和/或PCR小瓶7260基本上流体分离。类似地陈述,当驱动器7240处于第一个位置时,活门部分7242的一部分与上层7227接触,以产生基本上不漏流体的密封和/或气密封。当驱动器7250通过由图31中的箭头RR所示的方向在外壳7236内移动时,活门部分7242与上层7227分隔开和/或从流动通道7223中取出,从而将容积7237置于与通道7223和因此PCR室7260液体连通。以这种方式,当驱动器7240移动时,在容积7237内的物质可以传送到由PCR小瓶7260限定的PCR容积7262内。
此外,当驱动器7240在外壳7236内移动时,如由图31中的箭头RR所示,在PCR小瓶7260的PCR容积7262内产生真空。在PCR容积7262和洗脱室7190之间的这个压力差导致洗脱室7190的内容物的至少一部分经由转移管7250和通道7222转移到PCR容积7262内(参见例如,图24)。以这种方式,可以将物质和/或样品加入,混合和/或通过驱动转移机构7235在洗脱室7190和PCR容积7262之间传送。转移机构7235可以通过任何合适机构例如本文描述的仪器3002的驱动器组件3600驱动。
在使用中,如上所述,在分离模块7100内分离且加工一种或多种核酸或核酸群体后,经由转移组件7140c将它转移到洗脱室7190内。随后可以驱动试剂模块7270a,以将物质R1传送到洗脱室7190内。例如,在某些实施方案中,可以驱动试剂模块7270a,以将含有洗脱缓冲液和矿物油的溶液传送到洗脱室7190内。磁珠随后通过洗脱缓冲液从核酸中去除(或“洗涤”),并且从洗脱室7190中去除(例如通过转移组件7140c)。因此,洗脱室7190含有经分离的和/或经纯化的核酸。
可以驱动试剂模块7270b,以将物质R2传送到PCR容积7262内。例如,在某些实施方案中,可以驱动试剂模块7270b,以将含有多种反应试剂的溶液传送到PCR小瓶7260内。在某些实施方案中,PCR小瓶7260可以含有以冻干状态的另外试剂和/或物质,例如PCR主要混合物。优选地,当物质R2传送到PCR小瓶7260内时,冻干的内容物可以在制备中重构用于反应。
靶样品S可以(在上文描述的试剂模块7270b驱动前或后)经由转移管7250和通道7222从洗脱室7190传送到PCR小瓶7260内。特别地,可以驱动转移机构7235的驱动器7240,以在PCR模块7200内产生压力差,以将PCR样品经由通道7222从洗脱室7190传送到PCR小瓶7260内,如上所述。以这种方式,PCR样品(经分离的核酸和PCR试剂)可以部分在洗脱室7190中制备。此外,当转移机构7235被驱动时,将其中限定的容积7237经由通道7223置于与PCR容积7262液体连通,如上所述。因此,在某些实施方案中,另外的物质(例如矿物油)可以经由与样品转移操作相同的操作加入PCR小瓶。
在PCR样品处于PCR小瓶7260后,PCR样品S的至少一部分可以进行热循环(例如经由仪器3002的加热器组件3700),以执行所需扩增。在热循环完成后和/或在热循环过程中,PCR样品可以任选进行分析(例如经由仪器3002的光学组件3800),以分析样品。可替代地,如自始至终描述的,PCR样品可以任选在PCR过程中例如用各自缀合至MGB和荧光团的DNA杂交探针进行分析。仪器3002和用于操作药筒的其他合适仪器的描述在下文提供。
本文描述的任何药筒都可以通过任何合适仪器进行操作和/或驱动,以对药筒内含有的样品执行分离过程和/或反应。例如,在某些实施方案中,本文描述的任何药筒都可以通过仪器进行操作和/或驱动,以对药筒内的测试样品执行实时核酸分离和扩增。以这种方式,系统(例如药筒或一系列药筒和仪器)可以用于许多不同测定法,例如来自鼻咽试样的甲型流行性感冒(流感)、乙型流感和呼吸道合胞病毒(RSV)的快速检测。
在某些实施方案中,仪器可以配置为促进、产生、支持和/或推动由本文显示且描述类型的药筒限定的反应室中含有的样品中的反应。此类仪器还可以包括光学组件,以在反应前、过程中和/或后检测样品内的一种或多种不同物质和/或分析物。例如,图34根据一个实施方案的仪器1002的示意图。仪器1002包括块1710、第一个光学构件1831、第二个光学构件1832和光学组件1800。块1710限定反应容积1713,其配置为接受含有样品S的反应容器260的至少一部分261。反应容器260可以是以允许与样品S结合的反应发生的方式用于含有样品S的任何合适容器。反应容器260还可以是以允许监控此类反应(例如检测在样品S内起因于反应或与反应结合的分析物)的方式用于含有样品S的任何合适容器。在某些实施方案中,例如,反应容器260可以是PCR小瓶、试管等。此外,在某些实施方案中,反应容器260的至少一部分261可以是基本上透明的,以允许在其中发生的反应的光学监控。
块1710可以是任何合适结构和/或可以联接至任何合适机构,用于促进、产生、支持和/或推动与反应容器260中的样品S结合的反应。例如,在某些实施方案中,块1710可以联接至和/或可以包括机构用于循环加热反应容器260中的样品S。以这种方式,块1710可以产生样品S的热诱导反应,例如PCR过程。在其他实施方案中,块1710可以联接至和/或可以包括机构用于将一种或多种物质引入反应容器260内,以产生与样品S结合的化学反应。
反应容积1713可以具有任何合适大小和/或形状用于含有反应室260的部分261。在某些实施方案中,例如,反应容积1713的形状可以基本上对应于反应室260的部分261的形状(例如,如图34中所示)。然而,在其他实施方案中,反应容积1713的形状可以不同于反应室260的部分261的形状。尽管反应室260的部分261在图34中显示为与限定反应容积1713的块1710的侧壁分隔开,但在其他实施方案中,反应室260的部分261可以与块1710的一部分接触。在另外其他实施方案中,反应容积1713可以含有安置在反应室260的部分261和块1710的一部分(例如侧壁)之间的物质(例如盐水溶液、导热凝胶等)。
尽管块1710在图34中显示为仅含有在反应容积1713内的反应室260的部分261,但在其他实施方案中,块1710可以这样进行配置,从而使得整个反应室260在反应容积1713内接受。在某些实施方案中,例如,块1710可以包括罩或其他机构(图34中未显示),其将整个反应室260基本上保留在反应容积1713内。此外,在某些实施方案中,块1710可以基本上包围整个反应室260。在其他实施方案中,块1710可以基本上包围安置在反应容积1713内的反应室260的部分261。
如图34中所示,第一个光学构件1831至少部分地安置在块1710内,从而使得第一个光学构件1831与反应容积1713光连通。以这种方式,光束(和/或光信号)可以经由第一个光学构件1831在反应容积1713和块1710外的区域之间传送。第一个光学构件1831可以是任何合适结构、装置和/或机构,通过其或由其可以传送光束。在某些实施方案中,第一个光学构件1831可以是传送光束的任何合适的光学纤维,例如多模纤维或单模纤维。在其他实施方案中,第一个光学构件1831可以包括配置为修饰和/或转化光束的机构,例如光放大器、光信号转换器、透镜、滤光器等。在另外其他实施方案中,第二个光学构件1832可以包括发光二极管(LED)、激光器或配置为产生光束的其他装置。
第二个光学构件1832至少部分地安置在块1710内,从而使得第二个光学构件1832与反应容积1713光连通。以这种方式,光束(和/或光信号)可以经由第二个光学构件1832在反应容积1713和块1710外的区域之间传送。第二个光学构件1832可以是任何合适结构、装置和/或机构,通过其或由其可以传送光束。在某些实施方案中,第二个光学构件1832可以是传送光束的任何合适的光学纤维,例如多模纤维或单模纤维。在其他实施方案中,第二个光学构件1832可以包括配置为修饰和/或转化光束的机构,例如光放大器、光信号转换器、透镜、滤光器等。在另外其他实施方案中,第二个光学构件1832可以包括光电二极管或配置为接受和/或检测光束的其他装置。
光学组件1800包括激发模块1860和检测模块1850。激发模块1860配置为产生一系列激发光束(和/或光信号,图34中未显示)。相应地,激发模块1860可以包括用于产生一系列激发光束的任何合适装置和/或机构,例如激光器、一个或多个发光二极管(LED)、闪光灯等。在某些实施方案中,由激发模块1860产生的每个光束可以具有与由激发模块1860产生的其他光束各自基本上相同的特征(例如波长、波幅和/或能量)。然而,在其他实施方案中,由激发模块1860产生的第一个光束可以具有与由激发模块1860产生的其他光束之一不同的特征(例如波长、波幅和/或能量)。在某些实施方案中,例如,激发模块1860可以包括一系列LED,各自配置为产生具有与由其他LEDs产生的光束不同波长的光束。
检测模块1850配置为接受一系列发射光束(和/或光信号,图34中未显示)。相应地,检测模块1850可以包括任何合适的光检测器,例如光学检测器、光敏电阻器、光生伏打电池、光敏二极管、光电管、CCD相机等。发射光束可以由任何合适来源例如通过样品S的组成成分的激发产生。在某些实施方案中,检测模块1850可以配置为选择性接受每个发射光束,与每个光束是否具有与其他发射光束各自相同的特征(例如波长、波幅和/或能量)无关。然而,在其他实施方案中,基于光束的特定特征(例如波长、波幅和/或能量),检测模块1850可以配置为选择性接受每个发射光束。在某些实施方案中,例如,检测模块1850可以包括一系列光检测器,各自配置为接受具有与由其他光检测器接受的光束不同波长的光束。
如图34中所示,第一个光学构件1831和第二个光学构件1832联接至光学组件1800。以这种方式,一系列激发光束各自可以传送到反应容积1713和/或反应容器260的部分261内,并且一系列发射光束各自可以由反应容积1713和/或反应容器260的部分261接受。更具体而言,第一个光学构件1831联接至激发模块1860,从而使得由激发模块1860产生的一系列激发光束可以传送到反应容积1713和/或反应容器260的部分261内。类似地,第二个光学构件1832联接至检测模块1850,从而使得多个发射光束各自可以由反应容积1713和/或反应容器260的部分261接受。
由激发模块1860产生的一系列光束通过第一个光学构件1831且沿着第一个光程1806传送到反应容积1713和/或反应容器260的部分261内。因此,由激发模块1860产生的一系列光束各自在基本上恒定的位置传送到反应容积1713和/或反应容器260的部分261内。类似地,由检测模块1850接受的一系列光束通过第二个光学构件1832且沿着第二个光程1807由反应容积1713和/或反应容器260的部分261接受。因此,由检测模块1850接受的一系列光束各自在基本上恒定的位置由反应容积1713和/或反应容器260的部分261接受。通过在反应容积1713内的恒定位置分别传送且接受激发光束和发射光束,可以减少与传送来自多个不同位置的激发光束和/或接受来自多个不同位置的发射光束结合的在多通道分析内的检测变动。
此外,通过在块1710内包括第一个光学构件1831和第二个光学构件1832,第一个光学构件1831(和第一个光程1806)的位置和/或第二个光学构件1832(和第二个光程1807)的位置相对于反应容积1713是恒定的。通过使在第一个光学构件1831、第二个光学构件1832和/或反应容积1713之间的相对移动降到最低和/或消除,这种安排还可以减少与光程和/或光学构件相关的测试间检测变动。
在某些实施方案中,一系列激发光束可以顺次传送到反应容积1713内,并且一系列发射光束可以由反应容积1713顺次接受。例如,在某些实施方案中,激发模块1860可以以顺次(或时程化)方式产生各自具有不同波长的一系列光束。每个光束传送到反应容积1713内,在其中光束可以例如激发反应容器260内含有的样品S。类似地,在此类实施方案中,发射光束以顺次(或时程化)方式产生(由于样品S内的特定分析物和/或靶的激发)。因此,检测模块1850可以以顺次(或时程化)方式接受各自具有不同波长的一系列光束。以这种方式,仪器1802可以用于检测样品S内的多重不同分析物和/或靶。
尽管安置在块1710内的第一个光学构件1831的一部分和安置在块1710内的第二个光学构件1832的一部分在图34中显示为基本上平行和/或在相同平面内,但在其他实施方案中,块可以包括相对于第二个光学构件处于任何位置和/或方向的第一个光学构件。类似地陈述,尽管第一个光程1806在图34中显示为与第二个光程1807基本上平行和/或在相同平面内,但在其他实施方案中,仪器可以配置为产生相对于第二个光程处于任何位置和/或方向的第一个光程。
例如,图35显示了根据一个实施方案的仪器2002一部分的部分横断面示意图。仪器2002包括块2710、第一个光学构件2831、第二个光学构件2832和光学组件(图35中未显示)。块2710限定反应容积2713,其配置为接受含有样品S的反应容器260的至少一部分261。反应容器260可以是以允许与样品S结合的反应发生且允许监控此类反应的方式用于含有样品S的任何合适容器,如本文描述的。在某些实施方案中,例如,反应容器260可以是PCR小瓶、试管等。此外,在某些实施方案中,反应容器260的至少一部分261可以是基本上透明的,以允许在其中发生的反应的光学监控。
块2710可以是任何合适结构和/或可以联接至任何合适机构,用于促进、产生、支持和/或推动与反应容器260中的样品S结合的反应。例如,在某些实施方案中,块2710可以联接至和/或可以包括机构用于循环加热反应容器260中的样品S。以这种方式,块2710可以产生样品S的热诱导反应,例如PCR过程。在其他实施方案中,块2710可以联接至和/或可以包括机构用于将一种或多种物质引入反应容器260内,以产生与样品S结合的化学反应。
反应容积2713可以具有任何合适大小和/或形状用于含有反应室260的部分261。如图35中所示,当部分261安置在反应容积2713内时,反应容积2713限定纵轴LA且基本上包围反应室260的部分261。以这种方式,由块2710或与之附着的机构对样品S提供的任何刺激(例如加热或冷却)可以以基本上空间一致的方式提供。
如图35中所示,第一个光学构件2831至少部分地安置在块2710内,从而使得第一个光学构件2831限定第一个光程2806且与反应容积2713光连通。以这种方式,光束(和/或光信号)可以经由第一个光学构件2831在反应容积2713和块2710外的区域之间传送。第一个光学构件2831可以是本文显示且描述类型的任何合适结构、装置和/或机构,通过其或由其可以传送光束。在某些实施方案中,第一个光学构件2831可以是传送光束的任何合适的光学纤维,例如多模纤维或单模纤维。
第二个光学构件2832至少部分地安置在块2710内,从而使得第二个光学构件2832限定第二个光程2807且与反应容积2713光连通。以这种方式,光束(和/或光信号)可以经由第二个光学构件2832在反应容积2713和块2710外的区域之间传送。第二个光学构件2832可以是本文显示且描述类型的任何合适结构、装置和/或机构,通过其或由其可以传送光束。在某些实施方案中,第二个光学构件2832可以是传送光束的任何合适的光学纤维,例如多模纤维或单模纤维。
如上所述,第一个光学构件2831和第二个光学构件2832联接至光学组件(图35中未显示)。光学组件可以产生一个或多个激发光束,并且可以检测一个或多个发射光束。因此,一个或多个激发光束可以传送到反应容积2713和/或反应容器260内,并且一个或多个发射光束可以由反应容积2713和/或反应容器260的部分261接受。更具体而言,第一个光学构件2831可以将来自光学组件的激发光束传送到反应容积2713内,以激发反应容器260内含有的样品S的一部分。类似地,第二个光学构件2832可以将由来自反应容积2713的样品S内的分析物或其他靶产生的发射光束传送到光学组件。以这种方式,光学组件可以监控在反应容器260内发生的反应。
如图35中所示,第一个光学构件2831的一部分和第一个光程2806基本上安置在第一个平面PXY内。第一个平面PxY与反应容积2713的纵轴LA基本上平行和/或包括反应容积2713的纵轴LA。然而,在其他实施方案中,第一个平面PxY无需与反应容积2713的纵轴LA基本上平行和/或包括反应容积2713的纵轴LA。第二个光学构件2832的一部分和第二个光程2807基本上安置在第二个平面PYz内。第二个平面PYz与反应容积2713的纵轴LA基本上平行和/或包括反应容积2713的纵轴LA。然而,在其他实施方案中,第二个平面PYz无需与反应容积2713的纵轴LA基本上平行和/或包括反应容积2713的纵轴LA。此外,如图35中所示,第一个光程2806和第二个光程2807限定大于约75度的偏斜角Θ。更具体而言,当以与反应容积2713的纵轴LA基本上平行的方向(即在与第一个平面PxY和第二个平面PYz基本上垂直的平面内)观察时,第一个光程2806和第二个光程2807限定大于约75度的偏斜角Θ。以相似方式,第一个光学构件2831和第二个光学构件2832限定大于约75度的偏斜角Θ。这种安排使由第二个光学构件2832(即“检测”光学构件)接受的激发光束量降到最低,从而改善光学检测和/或监控的准确度和/或灵敏度。
在某些实施方案中,仪器2002的一部分可以产生在反应容积2713内的第一个光程2806和第二个光程2807,从而使得偏斜角Θ在约75度和约105度之间。在某些实施方案中,仪器2002的一部分可以产生在反应容积2713内的第一个光程2806和第二个光程2807,从而使得偏斜角Θ是约90度。
尽管仪器2002的一部分显示为产生第一个光程2806和第二个光程2807,其是基本上平行的且在点PT上在反应容积2713中相交,但在其他实施方案中,块2713、第一个光学构件2831和/或第二个光学构件2832可以这样进行配置,从而使得第一个光程2806与第二个光程2807不平行和/或不相交。例如,在某些实施方案中,第一个光程2806和/或第一个光学构件2831可以与第二个光程2807和/或第二个光学构件2831平行且偏离(即倾斜)。类似地陈述,在某些实施方案中,第一个光学构件2831和第二个光学构件1832可以分别通过距离Y1和Y2与由块2710限定的参考平面分隔开,其中Y1不同于Y2。因此,沿着纵轴LA在其上第一个光学构件2831和/或第一个光程2806相交反应容积2713的位置不同于沿着纵轴LA在其上第二个光学构件2832和/或第二个光程2807相交反应容积2713的位置。以这种方式,第一个光程2806和/或第一个光学构件2831可以与第二个光程2807和/或第二个光学构件2831倾斜。
在其他实施方案中,由纵轴LA和第一个光程2806和/或第一个光学构件2831限定的角度γ1可以不同于由纵轴LA和第二个光程2807和/或第二个光学构件2832限定的角度γ2(即第一个光程2806可以与第二个光程2807不平行)。在另外其他实施方案中,块2713、第一个光学构件2831和/或第二个光学构件2832可以这样进行配置,从而使得第一个光程2806在反应容积2713外的位置相交第二个光程2807。
距离Y1和距离Y2可以是任何合适距离,从而使得第一个光学构件2831和第二个光学构件1832配置为分别在反应容器260的所需部分中产生和/或限定第一个光程2806和第二个光程2807。例如,在某些实施方案中,距离Y1可以是这样的,从而使得当反应容器260安置在块2710内时,第一个光学构件2831和/或第一个光程2806在样品S的填充管线FL的位置下的位置进入和/或相交反应容积2713。以这种方式,由第一个光学构件2831传送的激发光束将进入在填充管线下的样品S。通过减少通过经由反应容器的顶空传递激发光束可能发生的激发光束减弱(即基本上缺乏样品S的在填充管线LF上的反应容器260的一部分),这种安排可以改善样品内的分析物的光学检测。然而,在其他实施方案中,距离Y1可以是这样的,从而使得当反应容器260安置在块2710内时,第一个光学构件2831和/或第一个光程2806在样品S的填充管线FL的位置上的位置进入反应容积2713。
类似地,在某些实施方案中,距离Y2可以是这样的,从而使得当反应容器260安置在块2710内时,第二个光学构件2832和/或第二个光程2807在样品S的填充管线FL的位置下的位置进入和/或相交反应容积2713。以这种方式,由第二个光学构件2832接受的发射光束将离开在填充管线下的样品S。通过减少通过经由反应容器的顶空接受发射光束可能发生的发射光束减弱,这种安排可以改善样品内的分析物的光学检测。然而,在其他实施方案中,距离Y2可以是这样的,从而使得当反应容器260安置在块2710内时,第二个光学构件2832和/或第二个光程2807在样品S的填充管线FL的位置上的位置进入和/或相交反应容积2713。
图36-70显示仪器3002和/或仪器的一部分的多个视图,所述仪器配置为操作一系列药筒,驱动一系列药筒和/或与一系列药筒相互作用,以对药筒内的测试样品执行核酸分离和扩增过程。药筒可以包括本文显示且描述的任何药筒,例如药筒6001。这种系统可以用于许多不同测定法,例如来自鼻咽试样的甲型流行性感冒(流感)、乙型流感和呼吸道合胞病毒(RSV)的快速检测。显示不含机壳3002和/或仪器3002的特定部分的仪器3002,以更明确地显示其中的部件。例如,图47显示不含光学组件3800的仪器3002。
如图36中所示,仪器3002包括底盘和/或框架3300、第一个驱动器组件3400、样品转移组件3500、第二个驱动器组件3600、加热器组件3700和光学组件3800。框架3300配置为容纳、含有和/或提供用于仪器3002的每个部件和/或组件的安装,如本文描述的。第一个驱动器组件3400配置为驱动药筒的分离模块(分离模块6100)的驱动器或转移机构(例如驱动器或转移机构6166),以将一种或多种试剂和/或物质传送到分离模块内的裂解室内。转移驱动器组件3500配置为驱动转移组件(例如转移组件6140a),以在分离模块(例如分离模块7100)内的多个室和/或容积之间转移样品的一部分。第二个驱动器组件3600配置为驱动分离模块(例如分离模块6100)和/或PCR模块(例如PCR模块6200)的混合机构(例如混合机构6130a)和/或洗涤缓冲液模块(例如洗涤缓冲液模块7130a),以传送到和/或混合在分离模块和/或PCR模块内的室内的一种或多种试剂和/或物质。加热器组件3700配置为加热药筒的一个或多个部分(例如PCR小瓶7260、基底7220和/或邻近裂解室7114的外壳7110区域),以推动和/或促进在药筒内的过程(例如以推动、促进和/或产生“热启动”过程、加热裂解过程和/或PCR过程)。光学组件3800配置为监控在药筒内发生的反应。更具体而言,光学组件3800配置为检测药筒中的测试样品内的一种或多种不同分析物和/或靶。这些组件各自在下文分开讨论,随后为可以由仪器3002执行的多种方法的描述。
如图36中所示,框架3300包括基底框架3310、前构件3312、两个侧构件3314和后构件3320。基底构件3310支持本文描述的功能组件,并且包括六个安装或支持支架。在某些实施方案中,支持支架可以是可调整的,以允许当安装和/或安装在实验室工作台上时仪器3302是水平齐平的。后构件3320联接至基底构件3310且配置为支持和或保留电源组件3361。后构件3320还可以提供安装支架用于与仪器3302的操作有关的任何其他部件,例如处理器、控制元件(例如电动机控制器、加热系统控制器等)、通信接口、冷却系统等。图71-73是仪器3002的控制和计算机系统的方框图。
侧构件3314各自包括上层部分3316和下层部分3315。前构件3312联接至每个侧构件3314,且限定含有多个测定法药筒的盒3350可以安置在其内用于加工的孔。在某些实施方案中,盒3350可以配置为含有本文显示且描述类型的六个药筒(图36中显示为例如药筒6001)。在使用中,含有多个药筒的盒3350安置在仪器3002内,且在分离和/或扩增过程期间维持在相对于底盘3300的固定位置中。因此,含有样品的药筒不在多个工作站之间移动以进行分析。相反,如本文描述的,样品、试剂和/或其他物质通过仪器3002在药筒的多个部分内传送、加工和/或操作,如本文描述的。尽管仪器3002显示为配置为接受含有六个药筒的盒3350,但在其他实施方案中,仪器可以配置为接受含有任何数目的药筒的任何数目的盒3350。
图37-40显示仪器3002的第一个驱动器组件3400的多个视图。第一个驱动器组件3400配置为驱动和/或操作药筒的分离模块(例如分离模块6100)的转移机构和/或试剂驱动器(例如试剂驱动器6166a、6166b、6166c和6166d),以将一种或多种试剂和/或物质传送到分离模块内的裂解室内。特别地,第一个驱动器组件3400可以驱动来自安置在盒3350内的药筒各自的试剂驱动器中的第一个(例如试剂驱动器6166d),并且随后在不同时间,驱动来自药筒各自的试剂驱动器中的第二个(例如试剂驱动器6166c)。
第一个驱动器组件包括由框架组件3410支持的衔接杆3445、第一个(或x轴)电动机3440和第二个(或y轴)电动机3441。如图38和40中所示,衔接杆3445包括一系列凸起3346a、3346b、3346c、3346d、3346e和3346f。凸起各自配置为衔接分离模块(例如分离模块6100)的一个或多个试剂驱动器(例如试剂驱动器6166a),安置在分离模块(例如分离模块6100)的一个或多个试剂驱动器(例如试剂驱动器6166a)内,和/或驱动分离模块(例如分离模块6100)的一个或多个试剂驱动器(例如试剂驱动器6166a),所述分离模块安置在仪器3002内。在某些实施方案中,衔接杆3445和/或凸起(例如凸起3346a)可以包括保留机构(例如凸起、卡环等),其配置为保留驱动器(例如试剂驱动器6166a)的凸起和/或孔,以促进在分离模块内试剂驱动器的相互移动。
框架组件3410包括第一个轴(或x轴)安装框架3420,其可移除地联接至第二个轴(或y轴)安装框架3430。特别地,第一个轴安装框架3420可以沿着y轴相对于第二个轴安装框架3430移动,如由图37中的箭头AAA所示。类似地陈述,第一个轴安装框架3420可以以“对齐方向”(即沿着y轴)相对于第二个轴安装框架3430移动,以促进衔接杆3445和/或凸起(例如凸起3346a)与所需系列的驱动器和/或转移机构的对齐。
第一个轴安装框架3420提供用于第一个轴(或x轴)电动机3440的支持,其配置为沿着x轴移动衔接条3445和/或凸起(例如凸起3346a),如由图37中的箭头BBB所示。类似地陈述,第一个轴电动机3440联接至第一个轴安装框架3420,并且配置为以“驱动方向”(即沿着x轴)移动衔接杆3445和/或凸起(例如凸起3346a),以驱动所需系列的驱动器和/或转移机构。衔接条3445的移动由两个x轴导轴3421引导,所述导轴各自可移动地安置在相应轴承3422内。轴承3422通过轴承安装构件3423相对于第一个轴安装框架3420和/或第一个电动机3440放置。
第二个轴安装框架3430联接至框架组件3300且在框架组件3300的两个侧框架构件3314之间。第二个轴安装框架3430提供用于第二个(或y轴)电动机3441和第一个轴安装框架3420的支持。第二个电动机3441配置为移动第一个轴安装框架3420,并且因此沿着y轴(或以对齐方向)移动衔接杆3445,如由图37中的箭头BBB所示。以这种方式,在驱动器和/或转移机构的驱动前,衔接杆3445和/或凸起(例如凸起3346a)可以与所需系列的驱动器和/或转移机构对齐。第一个轴安装框架3420通过一对轴承座3432联接至第二个轴安装框架3430,所述轴承座可滑动地安置在相应y轴导轴3431对周围。
在使用中,第一个驱动器组件3400可以顺次驱动安置在仪器3001内的一组药筒(例如药筒6001)的一系列转移机构和/或试剂驱动器(例如驱动器6166a、6166b、6166c和6166d)。首先,通过以对齐方向(即沿着y轴)移动第一个轴安装框架3420,衔接杆3445可以与所需转移机构和/或试剂驱动器(例如驱动器6166d)对齐。衔接杆3445随后可以以驱动方向(即沿着x轴)移动,以驱动来自每个药筒的所需转移机构和/或试剂驱动器(例如驱动器6166d)。以这种方式,第一个驱动器组件3400可以驱动和/或操作来自以平行(或同时)方式安置在仪器3002内的药筒各自的试剂驱动器。然而,在其他实施方案中,驱动器组件3400和/或衔接杆3445可以配置为顺次驱动来自以顺次(或系列)方式安置在仪器3002内的药筒各自的相应试剂驱动器。
第一个驱动器组件3400可以通过沿着x轴以第一个方向移动衔接杆3445驱动所需转移机构和/或试剂驱动器。然而,在其他实施方案中,第一个驱动器组件3400可以通过沿着x轴往复衔接杆3445(即备选地以第一个方向和第二个方向移动衔接杆3445)驱动所需转移机构和/或试剂驱动器。当所需转移机构和/或试剂驱动器已驱动时,第一个驱动器组件3400可以以与上文描述相似的方式驱动另一种转移机构和/或试剂驱动器(例如驱动器6166c)。
尽管第一个驱动器组件3400显示且描述为驱动转移机构和/或试剂驱动器,但在其他实施方案中,第一个驱动器组件3400可以驱动本文描述的任何药筒的任何合适部分。例如,在某些实施方案中,第一个驱动器组件3400可以驱动、操作和或移动超声换能器,以促进超声裂解。
图41-46显示了仪器3002的转移驱动器组件3500的多个视图。转移驱动器组件3500配置为驱动和/或操作转移组件或机构,例如上文就图20和21而言显示且描述的转移组件6140。特别地,转移驱动器组件3500可以驱动来自安置在盒3350内的药筒各自的转移组件中的第一个(例如转移组件6140a),并且随后在不同时间,驱动来自药筒各自的转移组件中的第二个(例如转移组件6140b)。
转移驱动器组件3500包括一系列驱动器轴3510。尽管转移驱动器组件3500包括六个驱动器轴,仅一个在图41-46中鉴定。驱动器轴3510各自配置为衔接分离模块(例如分离模块6100)的一个或多个转移组件(例如转移组件6140a),安置在分离模块(例如分离模块6100)的一个或多个转移组件(例如转移组件6140a)内,和/或驱动分离模块(例如分离模块6100)的一个或多个转移组件(例如转移组件6140a),所述分离模块安置在仪器3002内。如图44中所示,每个驱动器轴3510具有第一个末端部分3511和第二个末端部分3512。第一个末端部分3511联接至传动齿轮3513(参见图41-42),其进而由蜗轮传动轴3541驱动。如图41和42中所示,旋转位置指示器3542联接至驱动器轴3510之一的第一个末端部分3511。旋转位置指示器3542限定槽和/或孔3543,其旋转位置可以进行传感(例如经由光学传感机构),以提供关于驱动器轴3510的旋转位置的反馈。
每个轴3510的第二个末端部分3512包括衔接部分3514,其配置为在药筒(例如药筒6001)的转移组件(例如转移组件6140a)内接受,和/或衔接药筒(例如药筒6001)的转移组件(例如转移组件6140a),所述药筒安置在仪器3002内。以这种方式,衔接部分3514可以操作和/或驱动转移组件,以促进样品的一部分在药筒内的转移,如上所述。衔接部分3514具有这样的形状,其对应于转移组件的一部分(例如由可移动构件6146限定的管腔6149)的形状,从而使得驱动器轴3510的旋转导致转移组件的一部分的旋转。特别地,如图44中所示,衔接部分具有八边形形状。在某些实施方案中,衔接部分3514可以包括配置为保留转移组件的凸起和/或孔的保留机构(例如凸起、卡环等),以促进转移组件的一部分在分离模块内的往复移动。
衔接部分3514限定磁体(未显示)可以安置在其内的管腔3515。以这种方式,驱动器轴3510可以对安置在药筒(例如药筒6001)内的内容物的一部分(即磁珠)产生和/或施加力(即磁力),以促进样品的一部分经由转移组件的转移,如上所述。
驱动器轴3510通过第一个(或x轴)电动机3580、第二个(或y轴)电动机3560和第三个(或旋转)电动机3540移动。如下文更详细地描述的,x轴电动机3580由支持框架3571支持,y轴电动机3560由衔接框架组件3550支持,并且旋转电动机3540由旋转框架组件3530支持。
旋转框架组件3530提供用于旋转电动机3540的支持,其配置为在y轴周围旋转驱动器轴3510,如由图41中的箭头CCC所示。类似地陈述,旋转电动机3540联接至旋转框架组件3530,并且配置为以“驱动方向”(即在y轴周围)旋转驱动器轴3510,以驱动所需系列的转移组件。旋转框架组件3530包括旋转板3531、一对蜗轮传动轴承座3533和蜗轮传动轴3541。蜗轮传动轴3541通过滑轮组件联接至旋转电动机3540,且由两个蜗轮传动轴承座3533支持。蜗轮传动轴3541衔接每个驱动器轴3510的传动齿轮3513。相应地,当蜗轮传动轴3541以第一个方向(即在z轴周围)旋转时,每个驱动器轴3510以第二个方向(即在y轴周围,如由图41中的箭头CCC所示)旋转。
旋转框架组件3530还包括y轴位置指示器3534,其可以可滑动地安置在衔接框架组件3550上的一对相应滑动构件3553内。以这种方式,当旋转框架组件3530沿着y轴(例如以“衔接方向”)平移时,如由图41中的箭头DDD所示,y轴位置指示器3534和相应滑动构件3553可以引导线性移动和/或提供关于旋转框架组件3530的位置的反馈。
衔接框架组件3550提供用于y轴电动机3560的支持,其配置为沿着y轴移动旋转框架组件3530,且因此移动驱动器轴3510,如由图41中的箭头DDD所示。类似地陈述,y轴电动机3560联接至衔接框架组件3550,并且配置为以“衔接方向”(即沿着y轴)移动驱动器轴3510,以驱动所需系列的转移机构。衔接框架组件3550包括支持框架3551,其提供关于传动连杆3561(其将y轴电动机的旋转运动转化为旋转框架组件3530的线性运动)的支持。衔接框架组件3530的移动由两个y轴导轴3552引导,所述导轴各自可移动地安置在相应轴承3554内。轴承3554联接至旋转板3531,如图43中所示。
支持框架3571联接至框架组件3300且在框架组件3300的两个侧框架构件3314的下层末端部分3315之间。支持框架3571提供用于x轴电动机3580和衔接框架组件3550的支持。x轴电动机3580配置为移动衔接框架组件3550,并且因此沿着x轴(或以对齐方向)移动驱动器轴3510,如由图41中的箭头EEE所示。以这种方式,在转移机构驱动前,驱动器轴3510可以与所需系列的转移机构对齐。支持框架3571通过一对轴承座3573联接至衔接框架组件3550,所述轴承座可滑动地安置在相应x轴导轴3572对周围。
在使用中,转移驱动器组件3500可以顺次驱动安置在仪器3001内的一组药筒(例如药筒6001)的一系列转移机构(例如转移机构6140a、6140b和6166c)。首先,通过以对齐方向(即沿着x轴)移动衔接框架组件3550,驱动器轴3510可以与所需转移机构对齐。驱动器轴3510随后可以以衔接方向(即沿着y轴)移动,以衔接来自每个药筒的所需转移机构(例如转移机构6140a)。驱动器轴3510随后可以以驱动方向(即在y轴周围旋转)移动,以驱动来自每个药筒的所需转移机构(例如转移机构6140a)。以这种方式,转移驱动器组件3500可以驱动和/或操作来自以平行(或同时)方式安置在仪器3002内的药筒各自的转移机构。然而,在其他实施方案中,转移驱动器组件3500和/或驱动器轴3510可以配置为顺次驱动来自以顺次(或系列)方式安置在仪器3002内的药筒各自的相应转移机构。
图47-51显示了仪器3002的第二个驱动器组件3600的多个视图。第二个驱动器组件3600配置为驱动和/或操作本文显示或描述的任何药筒的转移机构(例如转移机构7235)、洗涤缓冲液模块(例如洗涤缓冲液模块7130a)、混合机构(例如混合机构6130a)和/或试剂模块(例如试剂模块7270a)。特别地,第二个驱动器组件3600可以驱动来自安置在盒3350内的药筒各自的转移机构、混合机构等中的第一个(例如混合机构6130a),并且随后在不同时间,驱动来自药筒各自的转移机构、混合机构等中的第二个(例如混合机构6130b)。
第二个驱动器组件3600包括由框架组件3610支持的衔接杆3645、第一个(或x轴)电动机3640和第二个(或y轴)电动机3641。如图48中所示,衔接杆3645包括一系列凸起3346。尽管衔接杆3645包括六个凸起(一个对应于在盒3350内的每个药筒),仅一个凸起3346是标示的。凸起各自配置为衔接药筒的一个或多种转移机构(例如转移机构7235)、洗涤缓冲液模块(例如洗涤缓冲液模块7130a)、混合机构(例如混合机构6130a)和/或试剂模块(例如试剂模块7270a),安置在药筒的一个或多种转移机构(例如转移机构7235)、洗涤缓冲液模块(例如洗涤缓冲液模块7130a)、混合机构(例如混合机构6130a)和/或试剂模块(例如试剂模块7270a)内,操作药筒的一个或多种转移机构(例如转移机构7235)、洗涤缓冲液模块(例如洗涤缓冲液模块7130a)、混合机构(例如混合机构6130a)和/或试剂模块(例如试剂模块7270a),和/或驱动药筒的一个或多种转移机构(例如转移机构7235)、洗涤缓冲液模块(例如洗涤缓冲液模块7130a)、混合机构(例如混合机构6130a)和/或试剂模块(例如试剂模块7270a),所述药筒安置在仪器3002内。在某些实施方案中,衔接杆3645和/或凸起3346可以包括保留机构(例如凸起、卡环等),其配置为保留驱动器的一部分(例如驱动器7150a的结合部分7153a,上文就图27和28而言显示且描述的),以促进驱动器在药筒的一部分内的相互移动。
框架组件3610包括第二个轴(或y轴)安装框架3630,其可移除地联接至第一个轴(或x轴)安装框架3620。特别地,第二个轴安装框架3630可以沿着x轴相对于第一个轴安装框架3620移动,如由图37中的箭头GGG所示。类似地陈述,第二个轴安装框架3630可以以“对齐方向”(即沿着x轴)相对于第一个轴安装框架3620移动,以促进衔接杆3645和/或凸起3346与所需系列的转移机构、混合机构、试剂模块等的对齐。
第二个轴安装框架3620提供用于第二个轴(或y轴)电动机3641的支持,其配置为沿着y轴移动衔接条3645和/或凸起3346,如由图37中的箭头FFF所示。类似地陈述,第二个轴电动机3641联接至第二个轴安装框架3620,并且配置为以“驱动方向”(即沿着y轴)移动衔接杆3645和/或凸起3346,以驱动所需系列的转移机构、混合机构、试剂模块等。衔接条3645的移动由两个y轴导轴3631引导,所述导轴各自可移动地安置在联接至第二个轴安装框架3620的相应轴承内。
第一个轴安装框架3630联接至框架组件3300且在框架组件3300的两个侧框架构件3314的下层部分3316之间。第一个轴安装框架3630提供用于第一个(或x轴)电动机3640和第二个轴安装框架3620的支持。第一个电动机3640配置为移动第二个轴安装框架3620,并且因此沿着x轴(或以对齐方向)移动衔接杆3645,如由图47中的箭头GGG所示。以这种方式,在此类机构驱动前,衔接杆3645和/或凸起3346a可以与所需系列的转移机构、混合机构、试剂模块等对齐。第二个轴安装框架3620通过一对轴承座3622联接至第一个轴安装框架3630,所述轴承座可滑动地安置在相应x轴导轴3631对周围。第一个(或x轴)电动机3640经由安装构件3624联接至第二个轴安装框架3620(参见例如图51)。
在使用中,第二个驱动器组件3600可以顺次驱动安置在仪器3001内的一组药筒(例如药筒6001)的一系列转移机构(例如转移机构7235)、洗涤缓冲液模块(例如洗涤缓冲液模块7130a)、混合机构(例如混合机构6130a)和/或试剂模块(例如试剂模块7270a)。首先,通过以对齐方向(即沿着x轴)移动第二个轴安装框架3630,衔接杆3645可以与所需机构(例如混合机构6130a)对齐。衔接杆3645随后可以以驱动方向(即沿着y轴)移动,以驱动来自每个药筒的所需机构(例如混合机构6130a)。以这种方式,第二个驱动器组件3600可以驱动和/或操作来自以平行(或同时)方式安置在仪器3002内的药筒各自的转移机构、洗涤缓冲液模块、混合机构和/或试剂模块。然而,在其他实施方案中,第二个驱动器组件3600和/或衔接杆3645可以配置为顺次驱动来自以顺次(或系列)方式安置在仪器3002内的药筒各自的相应机构。
第二个驱动器组件3600可以通过沿着y轴以第一个方向移动衔接杆3645驱动所需机构。然而,在其他实施方案中,第二个驱动器组件3600可以通过沿着y轴往复衔接杆3645(即备选地以第二个方向和第二个方向移动衔接杆3645)驱动所需转移机构和/或试剂驱动器。当所需机构已驱动时,第二个驱动器组件3600可以以与上文描述相似的方式驱动另一个机构和/或驱动器(例如混合机构6130b)。
尽管第二个驱动器组件3600显示且描述为驱动转移机构和/或试剂驱动器,但在其他实施方案中,第二个驱动器组件3600可以驱动本文描述的任何药筒的任何合适部分。例如,在某些实施方案中,第二个驱动器组件3600可以驱动、操作和或移动超声换能器,以促进声能传递到药筒的一部分内。
图52-63显示了仪器3002的加热器组件3700的多个视图。加热器组件3700配置为加热药筒的一个或多个部分(例如PCR小瓶7260、基底7220和/或邻近裂解室7114的外壳7110区域),以推动和/或促进在药筒内的过程(例如以推动、促进和/或产生“热启动”过程、加热裂解过程和/或用于PCR的热循环过程)。特别地,加热器组件3700可以驱动和/或加热安置在盒3350内的药筒各自的第一个部分(例如PCR小瓶6260),且随后在不同时间,驱动和/或加热来自药筒各自的第二个部分(例如邻近裂解室6114的分离模块6100部分)。
加热器组件3700包括一系列接受块3710(一个对应于在盒3350内的每个药筒)、定位组件3770、第一个加热模块3730、第二个加热模块3750和第三个加热模块3780。接受块3710配置为接受药筒的反应室的至少一部分,例如药筒6001的PCR小瓶6260。如图53-56中所示,接受块3710包括安装表面3714且限定反应容积3713。反应容积3713具有这样的大小和/或形状,其基本上对应于药筒6001的PCR小瓶6260的大小和/或形状。如图54和56中所示,当PCR小瓶6260安置在反应容积3713内时,反应容积3713限定纵轴LA且基本上包围PCR小瓶6260的一部分。以这种方式,由加热器组件3700对PCR小瓶6260内的样品提供的任何刺激(例如加热或冷却)可以以基本上空间一致的方式提供。此外,如图56中所示,限定反应容积3713的接受块3710的一部分的侧壁具有基本上一致的壁厚度。这种安排允许在加热器组件3700的反应容积3713和剩余部分之间的热转移以基本上空间一致的方式发生。
接受块3710通过夹具块3733(参见例如图57)联接至安装块3734(参见例如图58),从而使得热电装置3731与安装表面3714接触。以这种方式,反应容积3713和其中含有的样品可以循环加热,以产生热诱导的样品S的反应,例如PCR过程。
每个接受块3710限定第一个(或激发)管腔3711、第二个(或发射)管腔3712和第三个(或温度监测)管腔3715。热电偶或其他合适的温度测量装置可以经由第三个管腔3715安置邻近PCR小瓶。如图52中所示,激发纤维3831至少部分地安置在第一个管腔3711内,从而使得激发纤维3831和/或第一个管腔3711限定第一个光程3806且与反应容积3713光连通。以这种方式,光束(和/或光信号)可以经由激发纤维3831和/或第一个管腔3711在反应容积3713和块3710外的区域之间传送。激发纤维3831可以是本文显示且描述类型的任何合适结构、装置和/或机构,通过其或由其可以传送光束。在某些实施方案中,激发纤维3831可以是传送光束的任何合适的光学纤维,例如多模纤维或单模纤维。
检测纤维3832至少部分地安置在第二个管腔3712内,从而使得检测纤维3832和/或第二个管腔3712限定第二个光程3807且与反应容积3713光连通。以这种方式,光束(和/或光信号)可以经由检测纤维3832和/或第二个管腔3712在反应容积3713和块3710外的区域之间传送。检测纤维3832可以是本文显示且描述类型的任何合适结构、装置和/或机构,通过其或由其可以传送光束。在某些实施方案中,检测纤维3832可以是传送光束的任何合适的光学纤维,例如多模纤维或单模纤维。
如下所述,激发纤维3831和检测纤维3832联接至光学组件3800。光学组件3800可以产生一个或多个激发光束,并且可以检测一个或多个发射光束。因此,激发纤维3831可以将来自光学组件的激发光束传送到反应容积3713内,以激发PCR小瓶6260内含有的样品S的部分。类似地,检测纤维3832可以将由来自PCR小瓶6260的样品S内的分析物或其他靶产生的发射光束传送到光学组件3800。
如图55中所示,第一个管腔3711和第二个管腔3712限定约90度的偏斜角Θ。类似地陈述,第一个光程3806和第二个光程3807限定约90度的偏斜角Θ。更具体而言,当以与反应容积3713的纵轴LA基本上平行的方向观察时,第一个光程3806和第二个光程3807限定约90度的偏斜角Θ。以相似方式,分别安置在第一个管腔3711和第二个管腔3712内的激发纤维3831和检测纤维3832限定约90度的偏斜角Θ。这种安排使由检测纤维3832接受的激发光束量降到最低,从而改善光学检测和/或监控的准确度和/或灵敏度。
在某些实施方案中,第一个管腔3711和第二个管腔3712可以这样放置,从而使得偏斜角Θ是大于约75度。在其他实施方案中,第一个管腔3711和第二个管腔3712可以这样放置,从而使得偏斜角Θ在约75度和约105度之间。
如图54中所示,第一个管腔3711的中心线与第二个管腔3712的中心线基本上平行且偏离(即倾斜)。类似地陈述,激发纤维3831(和因此第一个光程3806)与检测纤维3832(和因此第二个光程3807)倾斜。换言之,第一个管腔3711(和/或激发纤维3831)和第二个管腔3712(和/或检测纤维3832)分别通过距离Y1和Y2与由接受块3710限定的参考平面分隔开,其中Y1不同于Y2。因此,沿着纵轴LA在其上激发纤维3831和/或第一个光程3806相交反应容积3713的位置不同于沿着纵轴LA在其上检测纤维3832和/或第二个光程3807相交反应容积3713的位置。以这种方式,第一个光程3806和/或激发纤维3831可以与第二个光程3807和/或第二个光学构件3831倾斜。
距离Y1和距离Y2可以是任何合适距离,从而使得激发纤维3831和检测纤维3832配置为分别在PCR小瓶6260的所需部分中产生和/或限定第一个光程3806和第二个光程3807。例如,在某些实施方案中,距离Y1可以是这样的,从而使得第一个管腔3711、激发纤维3831和/或第一个光程3806在接受块3710内安置的PCR小瓶6260内样品的填充管线的位置下的位置进入和/或相交反应容积3713。以这种方式,由激发纤维3831传送的激发光束将进入在填充管线下的样品。然而,在其他实施方案中,距离Y1可以是这样的,从而使得第一个管腔3711、激发纤维3831和/或第一个光程3806在PCR小瓶6260内样品的填充管线的位置上的位置进入反应容积3713。
类似地,在某些实施方案中,距离Y2可以是这样的,从而使得第二个管腔3712、检测纤维3832和/或第二个光程3807在接受块3710内安置的PCR小瓶6260内样品的填充管线的位置下的位置进入和/或相交反应容积3713。然而,在其他实施方案中,距离Y2可以是这样的,从而使得第二个管腔3712、检测纤维3832和/或第二个光程3807在PCR小瓶6260内样品的填充管线的位置上的位置进入和/或相交反应容积3713。
第一个加热模块3730包括一系列热电装置3731(一个对应于每个药筒和/或每个接受块3710)、安装块3734、一系列夹具块3733和散热片3732。如图58中所示,安装块3734包括第一个部分3735和第二个部分3737。第一个部分3735包括热电装置3731各自与之联接的成角度表面3736。以这种方式,每个接受块3710通过相应夹具块3733联接至安装块3734,从而使得热电装置3731与接受块3710的安装表面3714接触。
安装块3734的第二个部分3737联接至散热片3732。散热片(参见例如图59)可以是任何合适装置用于促进在接受块3710和对于仪器3002外部的区域之间的热转移。在某些实施方案中,散热片3732可以包括装置和/或机构以主动冷却安装块3734(即去除来自安装块3734的热)。
定位组件3770联接至散热片3732和框架组件3300的一部分,并且配置为以沿着y轴的方向线性移动加热器组件3700。因此,当驱动时,定位组件3770可以相对于盒3350和/或其中的药筒移动加热器组件3700,从而使得PCR小瓶(例如PCR小瓶6260)安置在接受块3710内,如上所述。定位组件3770包括电动机3771和连杆组件3772,其配置为将电动机3771的旋转运动转化成线性运动。加热器组件3700的移动由y轴导轴3773引导。
在使用中,第一个加热模块3730可以循环加热在仪器3001内安置的药筒各自的PCR小瓶,以推动PCR过程和/或其中含有的内容物的混合。此外,因为药筒各自经由分开的接受块3710通过分开的热电装置3731加热,所以在某些实施方案中,第一个药筒的热循环可以在与第二个药筒的热循环不同的时间进行。此外,因为每个药筒可以是与仪器中的其他药筒独立地热循环的,所以在某些实施方案中,关于第一个药筒的热循环方案(例如热循环事件的时间和温度)可以不同于关于第二个药筒的热循环方案。在某些实施方案中,第一个加热模块3730不用于热循环,而是维持在恒定温度,例如对RNA样品进行逆转录的温度。
第二个加热模块3750包括一系列电阻加热器3751(一个对应于每个药筒和/或每个接受块3710)、安装板3754、第一个绝缘构件3752和第二个绝缘构件3753。如图60中所示,安装板3754包括第一个部分3755和第二个部分3760。第一个部分3755提供用于电阻加热器3751各自的安装支持。类似地陈述,电阻加热器3731各自联接至安装板3754。
安装板3754联接至第一个加热模块3730的安装块3734,从而使得第一个绝缘构件3752安置在安装块3734和安装板3754的第一个部分3755之间,并且第二个绝缘构件3753安置在安装块3734和安装板3754的第二个部分3760之间。以这种方式,第二个加热模块3750可以基本上不依赖第一个加热模块3730起作用。类似地陈述,这种安排减少和/或限制在安装板3754和安装块3734之间的热转移。
安装板3754的第一个部分3755包括顶面3758,并且限定凹槽3756和一系列管腔3757(一个对应于在盒3350内的每个药筒)。在使用中,当加热器组件3700移动到仪器3002内的每个药筒周围的位置内时,每个PCR小瓶安置通过相应管腔3757且进入由相应接受块3710限定的反应容积3713内。因此,在某些实施方案中,当加热器组件3700放置在每个药筒周围时,限定管腔3757的安装板3754的侧壁放置在每个PCR小瓶6260的一部分周围和/或基本上围绕每个PCR小瓶6260的一部分。然而,在其他实施方案中,PCR小瓶6260可以与管腔3757分隔开和/或不驻留在管腔3757内。例如,在某些实施方案中,当加热器组件3700放置在每个药筒周围时,仅转移端口(例如PCR模块7200的转移端口7229,上文就图30和31而言显示且描述的)可以安置在安装板3754的管腔3737内。
如图60中所示,安装板3754的第二个部分3760限定一系列凹槽和/或空腔3761(一个对应于在盒3350内的每个药筒)。在使用中,当加热器组件3700移动到仪器3002内的每个药筒周围的位置内时,药筒的一部分安置在安装板3754的相应凹槽3761内。更具体而言,如图52中所示,对应于洗脱室6190(图52中未鉴定)的分离模块(例如分离模块6100)的一部分安置在相应凹槽3761内。因此,当加热器组件3700放置在每个药筒周围时,限定凹槽3761的安装板3754的第二个部分3760的侧壁放置在洗脱室6190的一部分周围和/或基本上围绕洗脱室6190的一部分。以这种方式,第二个加热模块3750可以加热和/或热循环在每个药筒的洗脱室6190内含有的样品的一部分。
在使用中,第二个加热模块3750可以加热安置在仪器3001内的每个药筒的一部分,以推动、改善和/或促进在药筒内发生的反应过程。例如,在某些实施方案中,第二个加热模块3750可以加热PCR模块的基底的一部分(例如上文就图29-31而言显示且描述的PCR模块7200的基底7220)。在一个实施方案中,完成通过第二个加热模块3750的加热,促进逆转录反应,或用于“热启动”PCR。
更具体而言,在某些实施方案中,第二个加热模块3750可以促进与PCR过程相关的“热启动”方法。热启动方法涉及“热启动酶”(聚合酶)的使用,以减少扩增反应中核酸的非特异性引发。更具体而言,当酶维持在环境温度(例如低于约50℃)时,可以发生非特异性杂交,其可以导致在聚合酶的存在下的非特异性引发。因此,热启动酶是在环境温度失活,并且直到加热至预定温度才变得活跃的酶。此类预定温度可以是超过约40℃、50℃、70℃或95℃的温度。为了促进“热启动”方法,在主要混合物加入PCR小瓶(例如PCR小瓶7260)内的扩增反应前,第二个加热模块3750可以加热洗脱室(例如洗脱室7190),以使洗脱的核酸样品维持在升高温度(例如在超过约40℃、50℃、70℃或95℃的温度)。在某些实施方案中,例如,第二个加热模块3750可以使洗脱室7190内的样品的温度维持在约50℃和约95℃之间的温度。通过以这种方式加热洗脱的核酸,可以消除和/或减少在聚合酶的存在下的非特异性杂交和/或假引发。
反应试剂(例如在上文图30和31中所示的试剂模块7270b内含有的物质R2)随后可以加入PCR小瓶(例如PCR小瓶7260)至其中含有的冻干的主要混合物。来自洗脱室(例如洗脱室7190)的加热的核酸样品随后可以转移到PCR小瓶内,如上所述。此外,第二个加热模块7250还可以加热在洗脱室和PCR小瓶之间的流动路径(例如通道7222),从而使得其中的内容物(例如从洗脱室转移到PCR小瓶的洗脱的核酸样品)可以维持在高温度(例如在超过约40℃、50℃、70℃或95℃的温度)。在某些实施方案中,例如,第二个加热模块3750可以使在流动路径内的样品的温度维持在约50℃和约95℃之间的温度。在加热的洗脱样品传送到PCR小瓶内后,通过温度循环(由第一个加热模块3730产生的)混合溶液,并且随后起始PCR反应。
第三个加热器组件3780包括至少一个加热器(未显示)和加热块3784。图63中所示,加热块3784限定一系列凹槽和/或空腔3786a、3786b、3786c、3786d、3786e、3786f,其各自对应于在盒3350内的每个药筒)。在使用中,当加热器组件3700移动到仪器3002内的每个药筒周围的位置时,药筒的一部分安置在加热块3784的相应凹槽(例如凹槽3786a)内。更具体而言,如图52中所示,对应于裂解室6114(图52中未鉴定)的分离模块(例如分离模块6100)的一部分安置在相应凹槽内。因此,当加热器组件3700放置在每个药筒周围时,限定凹槽3786的加热块3784的侧壁放置在裂解室6114的一部分周围和/或基本上围绕裂解室6114的一部分。以这种方式,第三个加热器组件3780可以加热和/或热循环在每个药筒的裂解室6114内含有的样品的一部分。在一个实施方案中,通过第三个加热器组件3780的加热在逆转录和/或PCR反应过程中发生。
图64-70显示了仪器3002的光学组件3800的多个视图。光学组件3800配置为监控对于在仪器3002内安置的药筒发生的反应。更具体而言,光学组件3800配置为在药筒的PCR小瓶(例如PCR小瓶6260)内发生的PCR反应前、过程中和/或后,检测在测试样品内的一种或多种不同分析物和/或靶。如本文描述的,光学组件3800可以以顺次和/或时程化方式和/或实时分析样品。光学组件3800包括激发模块3860、检测模块3850、滑动组件3870和光学纤维组件3830。
例如,在一个实施方案中,光学组件用于实时监控核酸扩增反应。在一个进一步的实施方案中,扩增反应是PCR。在另一个实施方案中,光学组件用于测量来自结合测定法的结果,例如在酶和底物或配体和受体之间的结合。
光学纤维组件3830包括一系列激发光学纤维(在图64中鉴定为激发纤维3831a、3831b、3831c、3831d、3831e、3831f、3831g)。激发纤维3831a、3831b、3831c、3831d、3831e和3831f各自配置为将来自激发模块3860的光束和/或光信号传送到相应接受块3710。相应地,每个激发纤维3831a、3831b、3831c、3831d、3831e和3831f的第一个末端部分安置在接受块3710的管腔3711内,如上所述。激发纤维3831g是校正纤维,且配置为将来自激发模块3860的光束和/或光信号传送到光学校正模块(未显示)。激发光学纤维3831可以是传送光束的任何合适的光学纤维,例如多模纤维或单模纤维。
光学纤维组件3830包括一系列检测光学纤维(在图64中鉴定为检测纤维3832a、3832b、3832c、3832d、3832e、3832f、3832g)。检测纤维3832a、3832b、3832c、3832d、3832e和3832f各自配置为将来自接受块3710的光束和/或光信号传送到检测模块3850。相应地,每个检测纤维3832a、3832b、3832c、3832d、3832e和3832f的第一个末端部分安置在接受块3710的管腔3712内,如上所述。检测纤维3832g是校正纤维,且配置为接受来自光学校正模块(未显示)的光束和/或光信号。检测光学纤维3832可以是传送光束的任何合适的光学纤维,例如多模纤维或单模纤维。
光学纤维组件3830还包括纤维安装块3820。如图70中所示,纤维安装块3820限定一系列管腔3825a-3825g和一系列管腔3824a-3824g。管腔3824各自配置为接受相应激发光学纤维(例如如图65中鉴定的激发纤维3831a)的第二个末端部分。类似地,管腔3825各自配置为接受相应检测光学纤维(例如如图65中鉴定的检测纤维3832a)的第二个末端部分。纤维安装块3820联接至滑动组件3870的滑轨3890,以将激发纤维3831光学联接至激发模块3860,并且将检测纤维3832光学联接至检测模块3850,如下文更详细地描述的。
如图65中所示,光学纤维组件3830包括一系列隔离物、透镜和密封构件,以促进本文描述的光学联接,和/或修饰、条件化和/或转化由光学纤维组件3830传送的光束。更具体而言,光学纤维组件3830包括一系列激发间隔物3833和检测间隔物3834,其配置为安置在纤维安装块3820和/或滑板3890内。光学纤维组件3830还包括一系列激发透镜3835和检测透镜3836,其配置为安置在纤维安装块3820和/或滑板3890内。光学纤维组件3830还包括一系列激发密封构件3837和检测密封构件3838,其配置为安置在纤维安装块3820和/或滑板3890内。激发密封构件3837和检测密封构件3838配置为密封和/或阻止污染进入由光学组件3800限定的光程内。
如图64-66中所示,光学组件3800包括配置为产生一系列激发光束(和/或光信号,未显示)的激发模块3860。激发模块3860包括一系列激发光源3862安装在其上的激发线路板3861。光源3862可以是用于产生一系列激发光束的任何合适装置和/或机构,例如激光器、发光二极管(LED)、闪光灯等。在某些实施方案中,由每个光源3862产生的光束可以具有与由其他光源3862产生的光束基本上相同的特征(例如波长、波幅和/或能量)。然而,在其他实施方案中,第一个光源3862可以产生具有第一组特征(例如与红色光束结合的波长)的光束,并且第二个光源3862可以产生具有第二组不同特征(例如与绿色光束结合的波长)的光束。这种安排允许每个不同光束(即具有不同特征的光束)以顺次方式传送到每个接受块3710,如本文更详细地描述的。如图65中所示,激发模块3860包括一系列隔离物3863、滤光器3864和透镜3865,以促进本文描述的光学联接,和/或修饰、条件化和/或转化由激发模块3860产生且由激发纤维3831传送的光束。
如图64-66中所示,光学组件3800包括配置为接受和/或检测一系列发射光束(和/或光信号,未显示)的检测模块3850。检测模块3850包括一系列发射光检测器3852安装在其上的检测线路板3851。发射光检测器3852可以是用于检测一系列发射光束的任何合适装置和/或机构,例如光学检测器、光敏电阻器、光生伏打电池、光敏二极管、光电管、CCD相机等。在某些实施方案中,每个检测器3852可以配置为选择性接受发射光束,与发射光束的特征(例如波长、波幅和/或能量)无关。然而,在其他实施方案中,检测器3852可以配置(或“调谐”)为对应于具有特定组特征(例如与红色光束结合的波长)的发射光束。在某些实施方案中,例如,检测器3852各自可以配置为当由激发模块3860的相应光源3862激发时,接受由样品的一部分的激发产生的发射光。这种安排允许每个不同发射光束(即具有不同特征的光束)以顺次方式由每个接受块3710接受,如本文更详细地描述的。如图65中所示,检测模块3850包括一系列隔离物3853、滤光器3854和透镜3855,以促进本文描述的光学联接,和/或修饰、条件化和/或转化由检测模块3850接受的发射光束。
滑动组件3870包括安装构件3840、滑块3880和滑轨3890。滑块3880联接至安装构件3840,并且可滑动地安装至滑轨3890。如下文更详细地描述的,在使用中,由步进电动机3873旋转的传动螺杆3872可以在滑块3880的一部分内旋转,以引起滑块3880(和因此安装构件3840)相对于滑轨3890移动,如由图64和66中的箭头HHH所示。以这种方式,安装构件3840可以相对于滑轨3890移动,以将激发光源3862和发射光检测器3852各自顺次移动到分别与每个激发纤维3831和发射纤维3832的第二个末端光连通。滑动组件3870和光学组件3800的操作的进一步细节在下文提供。
如图67中所示,安装构件3840限定一系列激发管腔3844a-3844f和一系列发射管腔3845a-3845f。如图65中所示,每个激发光源3862安置在相应激发管腔3844内,并且每个发射光检测器3852安置在相应发射管腔3845内。安装构件3840联接至滑块3880,从而使得滑块3880的移动引起安装构件3840(和因此激发光源3862和发射光检测器3852)的移动。
如图68中所示,滑块3880包括第一个部分3881和第二个部分3882。第一个部分3881包括引导凸起3886,且限定一系列激发管腔3884a-3884f和一系列发射管腔3855a-3855f。当滑块3880联接至安装构件3840时,滑块3880的激发管腔3884各自与安装构件3840的相应激发管腔3844对齐。类似地,滑块3880的发射管腔3885各自与安装构件3840的相应发射管腔3845对齐。引导凸起配置为可滑动地安置在滑轨3890上的相应沟槽3896内。
滑块3880的第二个部分3882限定一对引导管腔3887和导向螺杆管腔3888。在使用中,传动螺杆3872在导向螺杆管腔3888内旋转,以相对于滑轨3890移动滑块3880。滑块3880的移动由导轨3871引导,所述导轨3871可滑动地安置在相应引导管腔3887内。
如图69中所示,滑轨3890限定七个激发孔3894a、3894b、3894c、3894d、3894e、3894f和3894g,以及七个检测孔3895a、3895b、3895c、3895d、3895e、3895f和3895g。纤维安装块3820联接至滑轨3890,从而使得激发纤维3831与每个相应激发孔光连通,并且检测纤维3832与每个相应激发孔光连通。以这种方式,当滑块3880和安装构件3840相对于滑轨3890共同移动时,滑块3880和安装构件3840的激发孔和检测孔各自分别与滑轨3890的激发孔3894和检测孔3895各自顺次对齐。
在使用中,在扩增过程期间或后,滑动组件3870可以可控制地移动滑块3880,从而使得每个光源3862和光学检测器3852对顺次经过每对激发纤维3831和检测纤维3832。以这种方式,光学组件3800可以以时程化和/或多重形式分析在六个PCR小瓶(例如PCR小瓶6260)各自内的样品。
图71-73是关于仪器3002的电子控制和计算机系统的示意性方框图。
尽管光学组件3800显示为包括邻近激发模块3860的检测模块3850,但在其他实施方案中,仪器的光学组件可以包括位于相对于激发模块的位置中的检测模块。例如,图74-76是配置为执行一系列样品的时程化光学检测的光学组件4800的示意图,如上文就光学组件3800而言描述的。光学组件4800是配置为含有六个反应小瓶260的仪器的一部分(例如本文显示且描述的任何仪器)。光学组件4800包括激发模块4860、检测模块4850和纤维组件4830。激发模块4860包括四个激发光源4862a、4862b、4862c和4862d。激发光源各自配置为产生具有不同波长的激发光束。例如,光源4862a配置为产生具有颜色#1(例如红色)的光束,光源4862b配置为产生具有颜色#2(例如绿色)的光束,光源4862c配置为产生具有颜色#3(例如蓝色)的光束,并且光源4862d配置为产生具有颜色#4(例如黄色)的光束。
检测模块4850包括四个检测器4852a、4852b、4852c和4865d。检测器各自配置为接受具有不同波长的发射光束。例如,检测器4852a配置为接受起因于具有激发颜色#1的分析物激发的光束,检测器4852b配置为接受起因于具有激发颜色#2的分析物激发的光束,检测器4852cv配置为接受起因于具有激发颜色#3的分析物激发的光束,并且检测器4852d配置为接受起因于具有激发颜色#4的分析物激发的光束。
纤维组件4830包括一系列激发纤维4831和一系列检测纤维4832。特别地,一个激发纤维用于将每个反应小瓶260光学联接至激发模块4860,并且一个检测纤维4832用于将每个反应小瓶260光学联接至检测模块4850。激发模块4860和检测模块4850配置为相对于纤维组件4830移动。以这种方式,光源及其相应检测器(例如光源4862a和检测器4852a)各自可以与关于特定反应小瓶260的激发和检测纤维顺次对齐。
在使用中,当光学组件4800处于第一种配置时,如图74中所示,光源4862a和检测器4852a与第一个反应小瓶260光连通。因此,第一个反应小瓶内含有的样品可以用具有颜色#1的激发光进行分析。激发模块4860和检测模块4850随后如由图75中的箭头III所示移动,以将光学组件置于第二种配置。当光学组件4800处于第二种配置时,如图75中所示,光源4862a和检测器4852a与第二个反应小瓶260光连通,并且光源4862b和检测器4852b与第一个反应小瓶260光连通。因此,第一个反应小瓶内含有的样品可以用具有颜色#2的激发光进行分析,并且第二个反应小瓶内含有的样品可以用具有颜色#1的激发光进行分析。激发模块4860和检测模块4850随后如由图76中的箭头JJJ所示移动,以将光学组件置于第三种配置。当光学组件4800处于第三种配置时,如图76中所示,光源4862a和检测器4852a与第三个反应小瓶260光连通,光源4862b和检测器4852b与第二个反应小瓶260光连通,并且光源4862c和检测器4852c与第一个反应小瓶260光连通。因此,第一个反应小瓶内含有的样品可以用具有颜色#3的激发光进行分析,第二个反应小瓶内含有的样品可以用具有颜色#2的激发光进行分析,并且第三个反应小瓶内含有的样品可以用具有颜色#1的激发光进行分析。
图75是根据一个实施方案检测生物学样品中的核酸的方法100的流程图。特别地,举例说明的方法是“单阶段靶检测”方法,其可以使用本文显示且描述的任何药筒以及本文显示且描述的任何仪器执行。更具体而言,下文描述的方法100的操作可以在药筒中执行,而无需打开药筒和/或以其他方式使样品、试剂和/或PCR混合物暴露于外部条件。类似地陈述,下文描述的方法100的操作可以在药筒中执行,而无需人为干预以转移样品和/或试剂。为了描述的目的,方法100描述为用上文就图25-33而言显示且描述的药筒7001的分离模块7100和PCR模块7200执行。
该方法包括从在洗脱室内的磁捕获珠中洗脱核酸,102。这个过程可以例如在分离模块7100的洗脱室7190内发生。更具体而言,参考图29-31,洗脱缓冲液可以贮存于试剂模块7270a内,并且如上所述可以转移到洗脱室7190内,以完成洗脱操作。洗脱缓冲液可以是本文描述的任何合适的洗脱缓冲液和/或与核酸扩增(例如经由PCR和逆转录)相容的那种。
随后将洗脱的核酸从洗脱室转移到PCR室,104。PCR室可以是例如图29-31中所示的PCR小瓶7260。尽管洗脱室7190和PCR小瓶7260在上文显示为在不同模块和/或外壳内,但在其他实施方案中,洗脱室和PCR室可以位于整体构造的外壳或机构内。如上所述,在某些实施方案中,PCR室可以包括冻干的扩增试剂,从而使得在核酸转移后,试剂是重构的。随后如上所述,使用转移机构7235或任何合适的机构,将洗脱的核酸转移到PCR小瓶7260内。
PCR混合物随后在PCR室内热循环和/或加热,106。PCR混合物可以使用仪器3002在任何合适的温度范围之间循环,如上所示。在某些实施方案中,PCR混合物可以升高至恒定温度,以激活用于扩增的酶。
实时监控扩增反应,108。在某些实施方案中,扩增反应可以通过结合产物(即扩增)的具有荧光标记的小沟结合剂(MGB)和/或任何其他基于亲和力的杂交相互作用)进行监控。监控可以使用上文显示且描述的仪器3002的光学组件3800执行。
在扩增完成后,检测探针(例如MGB)可以结合靶扩增子,110。这提供了终点检测。
在某些实施方案中,该方法包括执行解链分析和/或退火分析,112。可以执行这个操作以鉴定或证实特异性或错配序列的分子靶。
图76是根据一个实施方案检测生物学样品中的核酸的方法200的流程图。特别地,举例说明的方法是“两阶段靶检测”方法,其可以使用本文显示且描述的任何药筒以及本文显示且描述的任何仪器执行。更具体而言,下文描述的方法200的操作可以在药筒中执行,而无需打开药筒和/或以其他方式使样品、试剂和/或PCR混合物暴露于外部条件。类似地陈述,下文描述的方法200的操作可以在药筒中执行,而无需人为干预以转移样品和/或试剂。为了描述的目的,方法200描述为用上文就图8-24而言显示且描述的分离模块6100和PCR模块6200执行。
该方法包括从在洗脱室内的磁捕获珠中洗脱核酸,202。这个过程可以例如在分离模块6100的洗脱室6190内发生。更具体而言,参考图8-10,洗脱缓冲液可以贮存于试剂室6213c内,并且如上所述可以转移到洗脱室内,以完成洗脱操作。洗脱缓冲液可以是本文描述的任何合适的洗脱缓冲液和/或与核酸扩增(例如经由PCR和逆转录)相容的那种。
随后将洗脱的核酸从洗脱室转移到PCR室,204。PCR室可以是例如图8中所示的PCR小瓶6260。如上所述,在某些实施方案中,PCR室可以包括冻干的扩增试剂,从而使得在核酸转移后,试剂是重构的。随后如上所述,使用转移机构6235或任何合适的机构转移洗脱的核酸。
PCR混合物随后在PCR室内热循环和/或加热,206。PCR混合物可以使用仪器3002在任何合适的温度范围之间循环,如上所示。在某些实施方案中,PCR混合物可以升高至恒定温度,以激活用于扩增的酶。
实时监控扩增反应,208。在某些实施方案中,扩增反应可以通过结合产物(即扩增)的具有荧光标记的小沟结合剂(MGB)和/或任何其他基于亲和力的杂交相互作用)进行监控。监控可以使用上文显示且描述的仪器3002的光学组件3800执行。
在扩增完成后,检测探针(例如MGB)可以结合靶扩增子,210。这提供了终点检测。该方法包括执行解链分析和/或退火分析,212。可以执行这个操作以鉴定或证实特异性或错配序列的分子靶。如本文使用的,MGB本身可以用作探针,或可以缀合至另一种分子并用作探针。例如,在一个实施方案中,MGB连同荧光染料一起缀合至特异性DNA寡核苷酸探针的5′末端。在这个实施方案中,探针包含在3′末端的非荧光猝灭剂。当探针在溶液中时,5′荧光染料的荧光被猝灭。然而,当探针结合其互补体时,荧光不再被猝灭。相应地,由探针生成的荧光量与生成的靶量成正比。通过将不同荧光染料(即当激发时,每种荧光染料将发出不同波长的光,或可以以独特波长被激发)缀合至每种探针,这些探针在反应中可以是“多重的”。
随后将第二组探针递送至PCR室,214。在某些实施方案中,第二组探针可以包括配制为结合特异性或错配靶序列的第二组MGB探针或其他一般探针,所述序列在超过约70摄氏度的温度解链(破坏亲和作用的解离能)。在某些实施方案中,第二组MGB探针配制为结合特异性或错配靶序列,所述序列在超过约75摄氏度的温度解链。在其他实施方案中,第二组MGB探针配制为结合特异性或错配靶序列,所述序列在超过约80摄氏度的温度解链。在另外其他实施方案中,第二组MGB探针配制为结合特异性或错配靶序列,所述序列在超过约85摄氏度的温度解链。
在某些实施方案中,第二组探针可以贮存于试剂室6213b内,并且可以直接或经由洗脱室6190转移到PCR小瓶6260内,如上所述。以这种方式,第二组探针可以加入PCR混合物中,而无需打开药筒或PCR小瓶或以其他方式使PCR混合物暴露于污染物。
该方法随后包括执行第二次解链分析和/或退火分析,216。可以执行这个操作以鉴定或证实特异性或错配序列的分子靶。
图77是根据一个实施方案检测生物学样品中的核酸的方法300的流程图。特别地,举例说明的方法是“两步逆转录PCR(RT-PCR),伴随单阶段靶检测”方法,其可以使用本文显示且描述的任何药筒以及本文显示且描述的任何仪器执行。更具体而言,下文描述的方法300的操作可以在药筒中执行,而无需打开药筒和/或以其他方式使样品、试剂和/或PCR混合物暴露于外部条件。类似地陈述,下文描述的方法300的操作可以在药筒中执行,而无需人为干预以转移样品和/或试剂。为了描述的目的,方法200描述为用上文就图8-24而言显示且描述的分离模块6100和PCR模块6200执行。
该方法包括从在洗脱室内的磁捕获珠中洗脱核酸,302。这个过程可以例如在分离模块600的洗脱室6190内发生。更具体而言,参考图8-10,洗脱缓冲液可以贮存于试剂室6213c内,并且如上所述可以转移到洗脱室内,以完成洗脱操作。洗脱缓冲液可以是本文描述的任何合适的洗脱缓冲液和/或与核酸扩增(例如经由PCR和逆转录)相容的那种。
随后将洗脱的核酸从洗脱室转移到PCR室,304。PCR室可以是例如图8中所示的PCR小瓶6260。如上所述,在某些实施方案中,PCR室可以包括冻干的扩增试剂,从而使得在核酸转移后,试剂是重构的。随后如上所述,使用注射泵或任何合适的机构转移洗脱的核酸。
混合物随后在PCR室内加热至基本上恒定温度,306。以这种方式,可以激活用于逆转录的酶。
在逆转录完成后,将PCR试剂递送至PCR室,308。PCR试剂可以贮存于试剂室6213b和/或6213a,并且可以直接或经由洗脱室6190转移到PCR小瓶6260内,如上所述。以这种方式,在逆转录完成后PCR试剂可以加入PCR混合物中,而无需打开药筒或PCR小瓶或以其他方式使PCR混合物暴露于污染物。
实时监控扩增反应,310。在某些实施方案中,扩增反应可以通过结合产物(即扩增)的具有荧光标记的小沟结合剂(MGB)和/或任何其他基于亲和力的杂交相互作用)进行监控。然而,任何DNA结合试剂可以用于实时监控PCR反应。监控可以使用上文显示且描述的仪器3002的光学组件3800执行。
如本文使用的,“DNA结合试剂”指能够结合双链或单链DNA,例如可通过荧光检测的任何可检测分子。在一个实施方案中,DNA结合试剂是当结合双链或单链DNA时,能够直接或间接产生信号的荧光染料或其他生色团、酶或试剂。试剂可以间接结合,即DNA结合试剂可以附着至直接结合DNA的另一种试剂。仅需要试剂当结合双链核酸或单链DNA时能够产生可检测信号,其可区分于当相同试剂在溶液中时产生的信号。
在一个实施方案中,DNA结合试剂是插入试剂。插入试剂例如溴化乙啶和SYBR绿,当插入双链DNA内时比当结合单链DNA,RNA或在溶液中时更强烈地发荧光。当结合双链DNA时,其他插入试剂显示出荧光光谱中的变化。例如,当结合单链核酸时,放线菌素D发红色荧光,并且当结合双链模板时,发绿色荧光。无论可检测信号增加、减少还是转变,如关于放线菌素D的情况,当试剂结合双链DNA或未结合时提供可区分的可检测信号的任何插入试剂都适合于实践本发明。
在另一个实施方案中,DNA结合试剂是采用荧光共振能量转移的外切核酸酶探针。例如,在一个实施方案中,DNA结合试剂是在5′和3′末端分别具有报道分子和猝灭染料的寡核苷酸探针,并且特异性结合靶核酸分子。在溶液中且当完整时,报道染料的荧光被猝灭。然而,特定Taq聚合酶的外切核酸酶活性作用于在PCR过程中切割探针,并且报道分子不再被猝灭。因此,荧光发射与生成的靶量成正比。
在另一个实施方案中,DNA结合试剂采用缀合至寡核苷酸探针的5′末端的MGB。除在5′末端的MGB外,报道染料还缀合至探针的5′末端,并且猝灭染料放置在3′末端。例如,在一个实施方案中,采用由Lukhtanov描述的DNA探针(Lukhtavon(2007).Nucleic Acids Research 35,第e30页)。在一个实施方案中,MGB直接缀合至寡核苷酸探针。在另一个实施方案中,MGB缀合至报道染料。当探针在溶液中时,5′荧光染料的荧光被猝灭。然而,当探针结合其互补体时,荧光不再被猝灭。相应地,由探针生成的荧光量与生成的靶量成正比。通过将不同荧光染料(即当激发时,每种荧光染料将发出不同波长的光,或可以以独特波长被激发)缀合至每种探针,这些探针在反应中可以是“多重的”。
在另外其他实施方案中,小沟结合剂用于实时监控PCR反应。例如,Hoechst 33258(Searle&Embrey,1990,Nuc.Acids Res.18(13):3753-3762)显示出伴随增加的靶量改变的荧光。用于与本发明一起使用的其他MGB包括偏端霉素和纺锤菌素。
根据本文描述的实施方案,DNA结合试剂直接或间接产生可检测信号。信号是例如可通过荧光或吸光度直接检测的,或可经由附着至DNA结合试剂的取代标记部分或结合配体间接检测的。
根据本文描述的实施方案,DNA结合试剂直接或间接产生可检测信号。信号是例如可通过荧光或吸光度直接检测的,或可经由附着至DNA结合试剂的取代标记部分或结合配体间接检测的。例如,在一个实施方案中,采用缀合至荧光报道染料的DNA探针。DNA探针具有在报道染料的相反末端上的猝灭染料,并且仅在结合其互补序列时发荧光。在一个进一步的实施方案中,DNA探针具有在5′末端的MGB和荧光染料。
用于与本发明一起使用的其他非限制性DNA结合试剂包括但不限于Molecular Beacons、Scorpions和FRET探针。
在扩增完成后,检测探针(例如MGB)可以结合靶扩增子,312。这提供了终点检测。该方法包括执行解链分析和/或退火分析,314。可以执行这个操作以鉴定或证实特异性或错配序列的分子靶。
图78是根据一个实施方案检测生物学样品中的核酸的方法400的流程图。特别地,举例说明的方法是关于上文显示且描述的方法100的备选“单阶段靶检测”方法。方法400可以使用本文显示且描述的任何药筒以及本文显示且描述的任何仪器执行。更具体而言,下文描述的方法400的操作可以在药筒中执行,而无需打开药筒和/或以其他方式使样品、试剂和/或PCR混合物暴露于外部条件。类似地陈述,下文描述的方法400的操作可以在药筒中执行,而无需人为干预以转移样品和/或试剂。为了描述的目的,方法400描述为用本文就图85-87而言显示且描述的分离模块10100和PCR模块10200执行。
方法400与方法100的不同之处在于洗脱缓冲液贮存于外壳的洗脱室内而不是如对于方法100描述的试剂室6213c中。因此,该方法包括从在洗脱室内的磁捕获珠中洗脱核酸,402。这个过程在分离模块10100的洗脱室内发生。洗脱缓冲液可以是与核酸扩增(例如经由PCR和逆转录)相容的任何合适的洗脱缓冲液。
随后将洗脱的核酸从洗脱室转移到PCR室,404。PCR室可以是例如图85-87中所示的PCR小瓶10260。尽管洗脱室10190和PCR小瓶10260显示为在不同模块和/或外壳内,但在其他实施方案中,洗脱室和PCR室可以位于整体构造的外壳或机构内。如上所述,在某些实施方案中,PCR室可以包括冻干的扩增试剂,从而使得在核酸转移后,试剂是重构的。随后如上所述,使用注射泵或任何合适的机构转移洗脱的核酸。
PCR混合物随后在PCR室内热循环和/或加热,406。PCR混合物可以使用仪器3002在任何合适的温度范围之间循环,如上所示。在某些实施方案中,PCR混合物可以升高至恒定温度,以激活用于扩增的酶。
实时监控扩增反应,408。在某些实施方案中,扩增反应可以通过结合产物(即扩增)的具有荧光标记的小沟结合剂(MGB)和/或任何其他基于亲和力的杂交相互作用)进行监控。监控可以使用上文显示且描述的仪器3002的光学组件3800执行。
在扩增完成后,检测探针(例如MGB)可以结合靶扩增子,410。这提供了终点检测。在某些实施方案中,该方法包括执行解链分析和/或退火分析,412。可以执行这个操作以鉴定或证实特异性或错配序列的分子靶。
使用本文描述的系统和方法产生的数据可以使用任何数目的不同方法进行分析。例如,数据可以使用亲和探针经由解链或退火分析就扩增核酸的序列鉴定进行分析。用独特“亲和探针”或分子靶的解链/退火概况分析-分子概况分析(由经修饰的碱基和具有指向结合靶核酸的亲和力的MGB-荧光-亲和常数-Kd组成)指示/生成一种或多种特异性遗传状态谱。例如,图81是指示由结合源于生物学样品的扩增核酸的一组探针生成的分子标记的谱图。分子标记代表与生物学样品回复相关的患病状态(或独特核酸序列的存在)。分子标记或概况取决于分子靶与靶核酸的特异性相互作用,其仅可由药筒内的分子靶生成。换言之,该谱是指纹痕迹(即指示一种或多种患病状态(肿瘤学、传染病)或遗传状态的峰或“光谱响应”的独特序列)。
在光谱内的多重-超过一种患病状态-(多重标记)-对于温度和时间(在特定波长内)、独特“探针”或多探针(独特分子实体-分子反应物、指示剂、标志)的多重。
多通道方法:超过一种指纹痕迹(指纹组)可以用于鉴定过程中。多面板指纹-指纹的谱阵列可以用于测定结果。生成多通道或阵列数据的变量是使用的波长差异荧光、关于退火或解离(解链)的温度范围、和数据采集率(数据依赖性域)。
可以使用亲和探针和扩增靶的加热和冷却控制,获得患病的指纹所需鉴定。对于数据生成(退火和解链),温度范围可以在70-100摄氏度的范围内。
尽管上文的分离模块6001显示为包括分离模块6100与混合泵6181用于促进裂解过程,但在其他实施方案中,可以使用用于将能量转移到溶液内以推动和/或增强细胞裂解的任何合适机构。例如,在某些实施方案中,可以使用声能。
例如,图82显示了根据一个实施方案的分离模块的第二个外壳8160,其配置为将超声能传递到分离模块(例如分离模块6100、分离模块7100等)的分离室(未显示)内含有的样品内,以推动细胞裂解和/或其中含有的核酸分离。第二个外壳8160可以联接至和/或安置在相应第一个外壳(图82中未显示)内,以类似于上文就图11而言描述的那种的方式。更具体而言,第二个外壳8160包括类似于上文显示且描述的密封6172的密封(未显示),其使第二个外壳8160与第一个外壳基本上声学分离。
第二个外壳8160限定一系列容纳室8163a、8163b、8163c和8163d,其含有在分离过程中使用的试剂和/或其他物质。特别地,容纳室可以含有蛋白酶(例如蛋白酶K),溶解大量材料的裂解溶液,对核酸进行的结合溶液,和结合磁荷核酸以帮助分离模块和/或第一个外壳内的核酸转运的磁珠溶液。
第二个外壳8160还限定超声换能器8195的一部分可以安置在其内的孔8185。声联接构件8182在孔8185内联接至第二个外壳8160的侧壁的一部分。相应地,在使用中,声换能器8195的至少一部分可以安置在孔8185内且与声联接构件8182接触。以这种方式,由换能器8195产生的声能和/或超声能可以传送通过声联接构件8182和第二个外壳8160的侧壁且进入分离室内的溶液内。声换能器8195可以是任何合适的声换能器,并且可以配置为在20kHz和300kHz之间共振。
超声换能器8195可以通过仪器例如本文描述的仪器3002的驱动器移动到孔8185内。此类驱动器可以包括例如配置为移动超声换能器8195通过预定距离与声联接构件8182接触的步进电动机。在某些实施方案中,例如,仪器可以包括驱动器组件,其类似于上文就图37-40而言显示且描述的第一个驱动器组件3400。在此类实施方案中,第一个驱动器组件可以包括一系列超声换能器,其经由类似于衔接杆3445的衔接杆移动到孔内。
在某些实施方案中,驱动器可以配置为改变由超声换能器8195对声联接构件8182施加的力。这可以在超声换能器驱动时,例如通过相对于联接构件8182移动超声换能器8195来完成。这种安排可以允许动态调整通过声联接构件8182的超声能传递和/或由通过声联接构件8182的超声能传递生成的热。
在某些实施方案中,声联接构件8182由导热材料进行构造。以这种方式,从声联接构件8182到第二个外壳8160的邻近侧壁的热转移可以降到最低。当声换能器8195驱动时,当与侧壁接触时,这种安排可以使第二个外壳8160的侧壁的变形和/或熔化降到最低,和/或防止第二个外壳8160的侧壁的变形和/或熔化。另外,在某些实施方案中,声联接构件8182可以配置和/或构造为具有声阻抗,以推动通过声联接构件8182的超声能转移和进入分离室内。
图83显示了根据一个实施方案的分离模块的第二个外壳9160,其配置为将超声能传递到分离模块的分离室(未显示)内含有的样品内,以推动细胞裂解和/或其中含有的核酸分离。第二个外壳9160可以联接至和/或安置在相应第一个外壳(图83中未显示)内,以如上所述的相似方式。更具体而言,第二个外壳9160包括类似于上文显示且描述的密封6172的密封(未显示),其使第二个外壳9160与第一个外壳基本上声学分离。
第二个外壳9160限定一系列容纳室9163a、9163b、9163c和9163d,其含有在分离过程中使用的试剂和/或其他物质。第二个外壳9160还限定超声换能器9195的一部分可以安置在其内的孔9185。与上文描述的孔8185形成对比,孔9185可以经由第二个外壳9160的侧壁中的孔与分离室液体连通。
声联接构件9183安置在孔9185内且通过第二个外壳9160的侧壁的一部分。更具体而言,声联接构件9183联接至侧壁,从而使得声联接构件9183的第一个部分9186在孔9185内,并且声联接构件9183的第二个部分9187在分离室内。密封9184安置在第二个外壳9160的侧壁和声联接构件9183之间,以使分离室和/或声联接构件9183与第二个外壳基本上流体分离。
在使用中,声换能器8195的至少一部分可以安置在孔9185内且与声联接构件9183的第一个部分9186接触。以这种方式,由换能器9195产生的声能和/或超声能可以传送通过声联接构件9183且进入分离室内的溶液内。
超声换能器8195可以通过仪器例如本文描述的仪器3002的驱动器移动到孔9185内。此类驱动器可以包括例如配置为移动超声换能器9195通过预定距离与声联接构件9183接触的步进电动机。在某些实施方案中,例如,仪器可以包括驱动器组件,其类似于上文就图37-40而言显示且描述的第一个驱动器组件3400。在此类实施方案中,第一个驱动器组件可以包括一系列超声换能器,其经由类似于衔接杆3445的衔接杆移动到孔内。
在某些实施方案中,驱动器可以配置为改变由超声换能器5195对声联接构件5183施加的力。这可以在超声换能器驱动时,例如通过相对于联接构件9183移动超声换能器8195来完成。这种安排可以允许动态调整通过声联接构件9183的超声能传递和/或由通过声联接构件9183的超声能传递生成的热。
如上所述,在某些实施方案中,声联接构件5183可以配置和/或构造为具有声阻抗,以推动通过声联接构件9183的超声能转移和进入分离室内。
尽管图82和83显示了配置为将超声能传递到分离模块内含有的样品内的分离模块的第二个外壳,但在其他实施方案中,药筒的任何部分可以配置为将超声能传递到样品内。例如,图84显示了分离模块7100(参见例如图26-28)和超声换能器7195。特别地,如上所述,外壳7110包括声联接部分7182。在使用中,超声换能器7195的至少一部分可以安置与声联接部分7182接触。以这种方式,由换能器产生的声能和/或超声能可以传送通过声联接部分7182和第一个外壳7110的侧壁,并且进入分离室7114内的溶液内。
超声换能器7195可以通过仪器例如本文描述的仪器3002的驱动器移动到与声联接部分7182接触。此类驱动器可以包括例如配置为移动超声换能器7195通过预定距离与声联接部分7182接触的步进电动机。在某些实施方案中,例如,仪器可以包括驱动器组件,其类似于上文就图37-40而言显示且描述的第一个驱动器组件3400。在此类实施方案中,第一个驱动器组件可以包括一系列超声换能器,其经由类似于衔接杆3445的衔接杆移动到与声联接部分7182接触。
在某些实施方案中,驱动器可以配置为改变由超声换能器7195对声联接部分7182施加的力。这可以在超声换能器驱动时,例如通过相对于声联接部分7182移动超声换能器7195来完成。这种安排可以允许动态调整通过声联接部分7182的超声能传递和/或由通过声联接部分7182的超声能传递生成的热。如图83中所示,超声换能器7195可以包括弹簧7196或其他偏压构件,其配置为相对于仪器的驱动器组件维持和/或偏向超声换能器。
尽管PCR模块6200在上文显示且描述为包括PCR试剂、洗脱缓冲液等可以贮存于其内的三个试剂室6213a、6213b和1213c,但在其他实施方案中,PCR模块可以包括任何数目的试剂室。在某些实施方案中,PCR模块可以没有任何试剂室。例如,图85-87显示了根据一个实施方案的药筒10001。药筒10001包括核酸分离模块10100和扩增(或PCR)模块10200,其联接在一起以形成整合的药筒10001。整合的药筒10001在许多方面类似于上文显示且描述的药筒6001和/或药筒7001,并且因此在本文中未详细描述。如显示了不含罩10005的药筒的图86中所示,PCR模块10200包括外壳10210、PCR小瓶10260和转移管10250。扩增模块10200联接至分离模块10100,从而使得转移管的至少一部分安置在分离模块10100的洗脱室内。
外壳10210包括转移端口10270。转移端口10270限定一个或多个管腔和/或通道,通过其经分离的核酸和/或其他物质或试剂可以传送到PCR小瓶10260内。外壳10210和/或转移端口10270可以限定一个或多个通风通道,以使洗脱室和/或PCR小瓶10260流体联接至大气。在某些实施方案中,此类通风孔中的任何可以包括熔块、活门和/或其他合适机构,以使从洗脱室和/或PCR小瓶10260的样品和/或试剂的丧失降到最低,和/或阻止洗脱室和/或PCR小瓶10260的样品和/或试剂的丧失。
转移端口10270的第一个末端部分10271安置在PCR小瓶10260外,并且转移端口10270的第二个末端部分10272安置在PCR小瓶内。更具体而言,第二个末端部分10272安置在PCR小瓶10260内,从而使得样品可以安置在其内的PCR小瓶10260的容积V不超过预定量级。以这种方式,因为在PCR小瓶10260内的样品上存在有限的“顶空”,所以在热循环过程中可以在PCR小瓶10260的壁上形成的冷凝可以降到最低和/或得到消除。
PCR模块10200包括配置为在洗脱室和/或PCR小瓶10260内产生压力和/或真空的转移活塞10240,以将洗脱室内的样品和/或试剂的至少一部分转移到PCR小瓶10260内,如上所述。
对于药筒10001使用的洗脱缓冲液贮存于分离模块10100的洗脱室(图85-87中未显示)中。PCR试剂如上所述以冻干形式贮存于PCR小瓶10260中。在使用中,经分离的核酸从洗脱室中的捕获珠中洗脱。洗脱的核酸随后如上所述转移到PCR小瓶10260内,且与在PCR小瓶10260内的PCR试剂混合。
尽管PCR模块6200显示且描述为包括三个试剂室6213a、6213b和6213c,其安置邻近外壳6210的第一个末端部分6211(参见例如图8),但在其他实施方案中,PCR模块可以包括以任何位置和/或方向安置的任何数目的试剂室或模块。此外,在某些实施方案中,试剂栓塞(例如栓塞6214a)和/或本文描述的任何转移机构可以是偏向的。例如,图88是联接至分离模块6100’的PCR模块11200的横断面视图。PCR模块11200包括限定本文描述类型的物质和/或试剂可以贮存于其内的三个试剂室11213的外壳11210。栓塞11214和弹簧11215(仅一个在图88中显示且标记)安置在每个试剂室11213内。以这种方式,栓塞(或转移机构)在非驱动位置中偏向。然而,在其他实施方案中,栓塞可以在驱动位置中偏向且可以通过锁蝶片(lock tab)等保持在合适位置。以这种方式,栓塞的驱动可以通过弹簧力得到帮助。
PCR模块还包括混合机构(或转移机构)11130,其经由喷嘴11131与洗脱室6190’液体连通。吸管11250使洗脱室6190置于与PCR小瓶11260液体连通。
在某些实施方案中,PCR模块可以包括PCR小瓶或反应室,其安置邻近分离模块的洗脱室。例如,图89显示了具有联接至PCR模块12200的分离模块6100’的药筒12001。PCR模块12200包括邻近洗脱室6190’的PCR室12260。类似地陈述,当PCR模块12200联接至分离模块6100’时,PCR小瓶12260安置在PCR室12231和分离模块6100’之间。
尽管本文显示且描述的药筒包括分离模块,其包括联接至PCR模块的洗脱室(例如洗脱室7190),从而使得在使用中,经分离的样品的一部分转移到PCR小瓶(例如PCR小瓶7260)内,但在其他实施方案中,PCR模块无需包括PCR小瓶。例如,在某些实施方案中,药筒可以包括也配置为在其中发生PCR的反应容积的洗脱室。例如,图90显示了根据一个实施方案的药筒13001,其包括分离模块6100’和PCR模块13200。PCR模块13200包括基底13220和一系列试剂模块13270。在使用中,试剂模块13270配置为经由流动管13229将本文显示且描述类型的一种或多种试剂和/或物质转移到分离模块6100’的洗脱室6190’内。以这种方式,PCR可以在洗脱室6190’中发生。在此类实施方案中,类似于仪器3002的仪器可以配置为热循环洗脱室6190’,以促进PCR。此外,该仪器可以包括配置为光学监控在洗脱室6190’内的反应的光学组件。在某些实施方案中,外壳6110’可以包括在邻近洗脱室6190’的位置中在其中安置的激发光学构件(未显示)和/或检测光学构件(未显示)。
尽管本文显示且描述的药筒一般包括与分离模块串联联接的PCR模块,但在其他实施方案中,药筒可以包括以任何方向、位置和/或定位联接至分离模块的PCR模块。类似地陈述,尽管药筒在本文中显示且描述为包括联接至分离模块的末端部分的PCR模块,但在其他实施方案中,PCR模块可以以任何方式整合至和/或联接至分离模块。例如,图91显示了包括分离模块14100和PCR模块14200的药筒14001。分离模块14100包括类似于上文描述那些的一系列洗涤机构14130。PCR模块包括一系列试剂模块14270。试剂模块14270安置邻近洗涤机构14130和/或在洗涤机构14130之间。
在使用中,试剂模块14270配置为经由流动管14229将本文显示且描述类型的一种或多种试剂和/或物质转移到分离模块14100的洗脱室14190内。以这种方式,PCR可以在洗脱室14190中发生。
图92和93显示了另一个实施方案,其中PCR模块15200的试剂模块15270安置邻近分离模块15100的洗涤机构15130和/或在分离模块15100的洗涤机构15130之间。药筒15001与药筒14001的不同之处在于在试剂模块15270内含有的物质经由一系列内部流动路径15228转移到PCR小瓶15260内。PCR模块包括转移机构15235,以将经分离的样品的一部分从洗脱室15190转移到PCR小瓶15260内。
尽管本文显示且描述的PCR模块包括单个PCR小瓶,但在其他实施方案中,PCR模块可以包括任何数目的PCR小瓶。一个例子显示于图94中,其显示了具有四个PCR小瓶16260的PCR模块16200。
虽然上文已描述了多个实施方案,但应当理解它们仅作为例子呈现并且不是限制性的。当上文描述的方法和/或图表指示以特定次序发生的特定事件和/或流动模式时,可以修改特定事件和/或流动模式的排序。另外的特定事件可以在可能时在平行过程中同时执行,以及顺次执行。虽然实施方案已特别显示且描述,但应当理解可以作出在形式和细节中的各种变化。
尽管本文描述的室例如室6163a、洗涤缓冲液模块7130a和试剂模块7270a中的许多描述为含有物质、样品和/或试剂,其通过可穿透构件(例如可穿透构件6170、可穿透构件7135a和可穿透构件7275)维持流体分离,但在某些实施方案中,本文的任何室可以仅部分充满所需物质、样品和/或试剂。更具体而言,本文描述的任何室可以包括所需物质(其一般处于液态状态)的第一个容积,和气体例如空气、氧、氮等的第二个容积。这种安排减少在破裂可穿透构件前,用于在室内移动转移机构或穿孔构件(例如驱动器6166的穿孔部分6168)的力。更具体而言,通过包括室容积的一部分作为气体,当转移机构在室内移动时,气体压缩以减少室的体积,从而允许穿孔构件接触可穿透构件。在某些实施方案中,本文描述的任何室都可以包括其中容积的约10%作为气体。
尽管分离模块6100在上文显示且描述为包括转移组件6140a,其配置为在裂解室6114和洗涤室6121之间转移物质,同时维持裂解室6114与洗涤室6121基本上流体分离,但在其他实施方案中,本文描述的任何模块可以包括转移机构,其在室之间转移物质,同时允许在这些室之间的液体连通。例如,在某些实施方案中,模块可以包括配置为选择性控制在第一个室和第二个室之间的物质流动的转移机构。此类转移机构可以包括例如活门。
尽管药筒在本文中显示且描述为包括多个模块(例如分离模块和反应模块),其在操作药筒的仪器内安置前联接在一起,但在其他实施方案中,药筒可以包括多个模块,其中至少一个配置为联接至在仪器内的另一个模块和/或通过仪器联接至另一个模块。类似地,在某些实施方案中,仪器可以配置为将一个模块(例如试剂模块)联接至另一个模块(例如反应模块、分离模块等)作为药筒加工的一部分。
尽管转移机构例如转移机构6140在本文中显示且描述为使用磁力以促进样品的靶部分在药筒内的移动,但在其他实施方案中,本文显示且描述的任何转移机构可以采用任何合适类型的力,以促进样品的靶部分在药筒内的移动。例如,在某些实施方案中,转移机构可以包括泵。在其他实施方案中,转移机构可以产生样品的靶部分的蠕动。
尽管药筒和/或其部分已描述主要用于与核酸分离和扩增反应一起使用,且用于与本文描述的特定仪器一起使用,但药筒并不限于此。尽管仪器和/或其部分已描述主要用于与核酸分离和扩增反应一起使用,且用于与本文描述的特定药筒一起使用,但仪器并不限于此。
例如,本文提供的药筒、仪器和/或其部分可以在下一代测序(NGS)平台中使用。NGS技术已报道为生成比Sanger方法多三至四个数量级的序列,并且运行是更不昂贵的(Harismendy等人(2009).Genome Biology 10,第R32.1-R32.13页)。NGS应用包括但不限于基因组鸟枪测序、细菌人工染色体(BAC)末端测序、单核苷酸多态性发现和再测序、其他突变发现、染色质免疫沉淀(ChIP)、微小RNA发现、大规模表达的序列标志测序、引物步移、或基因表达系列分析(SAGE)。
在一个实施方案中,模块用于使本发明的药筒适应于NGS平台仪器,用于核酸序列分析。备选地,样品转移模块(例如自动化液体处理仪器)可以将核酸扩增产物转移到NGS仪器的流动池。
在一个实施方案中,这样提供了模块,从而使得本发明的药筒可顺应与下述NGS平台之一一起使用:Roche 454GS-FLX平台、Illumina Seq uencing Platforms(例如HiSeq 2000、HiSeq 1000、MiSeq、Genome Analyzer IIx)、Illumina Solexa IG Genome Analyzer、Applied Biosystems 3730xl平台、ABI SOLiDTM(例如5500xl或5500SOLiDTMSystem)。模块可以适应于上述装置之一,或可以是样品转移模块,其将核酸扩增反应的产物转移到NGS仪器。
在一个实施方案中,本发明的药筒用于基因组鸟枪测序、细菌人工染色体(BAC)末端测序、单核苷酸多态性发现和再测序、其他突变发现、染色质免疫沉淀(ChIP)、微小RNA发现、大规模表达的序列标志测序、引物步移、或基因表达系列分析(SAGE)。
在一个实施方案中,如本文描述的,在本发明的药筒和仪器中进行核酸分离和/或扩增(例如PCR)。在一个进一步的实施方案中,在扩增反应完成后,样品转移模块将扩增产物转移到各自NGS仪器的流动池,用于文库制备和后续测序。
在另一个实施方案中,如本文描述的,在本发明的药筒和/或仪器中进行核酸分离和/或扩增(例如PCR)。在一个进一步的实施方案中,在扩增反应完成后,将药筒转移到可顺应与上文提供的NGS仪器之一一起使用的模块。核酸扩增产物随后转移到各自NGS仪器的流动池,用于文库制备和后续测序。
在某些实施方案中,器械包括第一个模块、第二个模块和第三个模块。第一个模块限定第一个室和第二个室,至少第一个室配置为含有样品。第二个模块限定配置为含有第一种物质的第一个容积。当第二个模块联接至第一个模块时,第二个模块的一部分配置为安置在第一个模块的第一个室内,从而使得第一个容积配置为选择性置于与第一个室液体连通。第三个模块限定反应室和配置为含有第二种物质的第二个容积。当第三个模块联接至第一个模块时,第三个模块的一部分安置在第一个模块的第二个室内,从而使得反应室和第二个容积各自与第一个模块的第二个室液体连通。
在某些实施方案中,本文描述的任何模块可以包括配置为将声能传送到由模块限定的室的声联接构件。
在某些实施方案中,本文描述的任何模块可以包括配置为在模块内的第一个室和在模块内的第二个室之间转移样品的转移机构。此类转移机构可以使用用于转移物质的任何合适机构,包括溶液的流动、磁力等。
在某些实施方案中,本文描述的任何模块可以包括配置为在模块内的第一个室和在模块内的第二个室之间转移样品的活门。在某些实施方案中,此类活门可以配置为维持在第一个室和第二个室之间的流体分离。
在某些实施方案中,器械包括第一个模块、第二个模块和第三个模块。第一个模块限定第一个室和第二个室。第一个模块包括第一种转移机构,其配置为在第一个室和第二个室之间转移样品,同时维持在第一个室和第二个室之间的流体分离。第二个模块限定配置为含有物质的容积。当第二个模块联接至第一个模块时,第二个模块的一部分配置为安置在第一个模块的第一个室内,从而使得容积配置为选择性置于与第一个室液体连通。第三个模块限定反应室,第三个模块配置为联接至第一个模块,从而使得反应室与第二个室液体连通。第三个模块包括配置为在第二个室和反应室之间转移样品的一部分的第二种转移机构。
在某些实施方案中,器械包括第一个模块和第二个模块。第一个模块包括反应小瓶、基底和第一种转移机构。反应小瓶限定反应室。第一种转移机构包括可移动地安置在外壳内的栓塞,从而使得外壳和栓塞限定第一个容积,所述第一个容积含有第一种物质。基底限定第一个流动路径和第二个流动路径的至少一部分。第一个流动路径配置为与反应室液体连通。分离模块的第一个容积和分离室、第二个流动路径配置为与分离室液体连通。栓塞的一部分安置在第一个流动途径内,从而使得当栓塞处于外壳内的第一个位置时,第一个容积与反应室是流体分离的。将栓塞的一部分安置远离第一个流动途径,从而使得当栓塞处于外壳内的第二个位置时,第一个容积与反应室液体连通。栓塞配置为在反应室内产生真空,以在栓塞从第一个位置移动到第二个位置时,将样品从分离室转移到反应室。第二个模块包括第二种转移机构,并且限定配置为含有第二种物质的第二个容积。第二个模块配置为联接至第一个模块,从而使得第二个容积可以选择性置于经由第二个流动路径与分离室液体连通。第二种转移机构配置为当第二种转移机构被驱动时,将第二种物质从第二个容积转移到分离室。
在某些实施方案中,仪器包括块、第一个光学构件、第二个光学构件和光学组件。块限定配置为接受反应容器的至少一部分的反应容积。第一个光学构件至少部分地安置在块内,从而使得第一个光学构件限定第一个光程且与反应容积光连通。第二个光学构件至少部分地安置在块内,从而使得第二个光学构件限定第二个光程且与反应容积光连通。包括第一个光程的第一个平面和包括第二个光程的第二个平面限定大于约75度的角度。光学组件联接至第一个光学构件和第二个光学构件,从而使得激发光束可以传送到反应容积内,并且发射光束可以由反应容积接受。
尽管多个实施方案已描述为具有特定零件和/或部件的组合,但具有来自如上讨论的任何实施方案的任何零件和/或部件的组合的其他实施方案是可能的。
以下实施方案内容对应于原申请的权利要求书:
1.一种器械,其包含:
包括第一个外壳和第二个外壳的分离模块,所述第一个外壳限定第一个室和第二个室,至少所述第一个室配置为含有样品,所述第二个外壳包括侧壁和可穿透构件,所述侧壁和可穿透构件共同限定配置为含有第一种物质的第一个容积,所述第二个外壳的一部分配置为安置在所述第一个外壳内,从而使得当所述可穿透构件的一部分被穿透时,所述第一个容积与所述第一个室液体连通;和
限定反应室和配置为含有第二种物质的第二个容积的反应模块,所述反应模块配置为联接至所述分离模块,从而使得所述反应室和所述第二个容积各自与所述第一个外壳的第二个室液体连通。
2.实施方案1的器械,其中所述反应模块配置为可移除地联接至所述分离模块。
3.实施方案1的器械,其中当所述反应模块联接至所述分离模块时,所述反应模块的一部分安置在所述第一个外壳的第二个室内。
4.实施方案1的器械,其中:
所述反应模块包括至少部分地限定第一个流动路径和第二个流动路径的基底,所述第一个流动路径配置为与反应室和所述第一个外壳的第二个室液体连通,所述第二个流动路径配置为与第二个容积和所述第一个外壳的第二个室液体连通。
5.实施方案1的器械,其中所述分离模块包括配置为在所述第一个室和所述第二个室之间转移样品的转移机构。
6.实施方案1的器械,其中所述分离模块包括至少部分地安置在所述第一个外壳内的活门,所述活门配置为在所述第一个室和所述第二个室之间转移样品,同时维持在所述第一个室和所述第二个室之间的流体分离。
7.实施方案1的器械,其中所述分离模块包括至少部分地安置在所述第二个外壳的所述第一个容积内的栓塞,所述栓塞配置为当在所述第一个容积内移动时,穿透所述可穿透构件的所述部分。
8.实施方案1的器械,其中所述反应模块包括至少部分地安置在所述第二个容积内的栓塞,所述栓塞配置为当所述栓塞在所述第二个容积内移动时,对所述第二种物质施加力,以将所述第二种物质从所述第二个容积转移到所述反应室或所述第二个室中的至少一个内。
9.实施方案1的器械,其中所述分离模块包括配置为将超声能传送到所述第一个室内的声联接构件。
10.实施方案1的器械,其中所述第一个容积含有第一种物质,其包含裂解缓冲液、核酸分离试剂或其组合。
11.实施方案1的器械,其中所述第二个容积包含第二种物质,其包含执行PCR的试剂。
12.实施方案11的器械,其中所述第二种物质进一步包含逆转录酶。
13.实施方案1的器械,其中所述反应室包含冻干的PCR主要混合物。
14.实施方案13的器械,其中所述反应室进一步包含逆转录酶。
15.一种器械,其包含:
限定第一个室和第二个室的第一个模块,所述第一个模块包括第一种转移机构,其配置为在所述第一个室和所述第二个室之间转移样品,同时维持在所述第一个室和所述第二个室之间的流体分离;
限定配置为含有物质的容积的第二个模块,当所述第二个模块联接至所述第一个模块时,所述第二个模块的一部分配置为安置在所述第一个模块的第一个室内,从而使得所述容积配置为选择性置于与所述第一个室液体连通;和
限定反应室的第三个模块,所述第三个模块配置为联接至所述第一个模块,从而使得所述反应室与所述第二个室液体连通,所述第三个模块包括配置为在所述第二个室和所述反应室之间转移样品的一部分的第二种转移机构。
16.实施方案15的器械,其中当所述第三个模块联接至所述第一个模块时,所述第三个模块的一部分安置在所述第一个模块的第二个室内。
17.实施方案15的器械,其中:
所述容积是第一个容积;
所述物质是第一种物质;和
所述第三个模块限定配置为含有第二种物质的第二个容积,所述第三个模块配置为联接至所述第一个模块,从而使得所述第二个容积与所述第二个室液体连通,所述第三个模块包括配置为在所述第二个容积和所述第二个室之间转移所述第二种物质的一部分的第三种转移机构。
18.实施方案15的器械,其中所述第二个模块包括至少部分限定所述容积的可穿透构件,当所述第二个模块联接至所述第一个模块时,所述可穿透构件进一步限定所述第一个模块的第一个室的边界的一部分。
19.实施方案15的器械,其中所述第二个模块包括至少部分地安置在所述容积内的第三种转移机构,所述第三种转移机构配置为当所述第三种转移机构被驱动时,将所述第一种物质从所述容积转移到所述第一个室内。
20.实施方案15的器械,其中:
所述第一个模块限定在所述第一个室和所述第二个室之间的第三个室;和
所述第一种转移机构包括活门外壳和活门构件,所述活门外壳限定与所述第一个室液体连通的第一个孔,和与所述第三个室液体连通的第二个孔,当所述活门构件处于第一个位置时,所述活门构件限定与所述第一个孔液体连通的空腔,当所述活门构件处于第二个位置时,所述活门构件限定与所述第二个孔液体连通的空腔。
21.实施方案15的器械,其中所述第二种转移机构包括安置在与所述反应室液体连通的圆柱体内的栓塞,所述栓塞配置为当所述栓塞在所述圆柱体内移动时,在所述反应室内产生真空。
22.一种器械,其包含:
包括反应小瓶、基底和第一种转移机构的第一个模块,所述反应小瓶限定反应室,所述基底限定第一个流动路径和第二个流动路径的至少一部分,所述第一个流动路径配置为与反应室和分离模块的分离室液体连通,所述第一种转移机构配置为当所述第一种转移机构被驱动时,将样品从所述分离室转移到所述反应室;和
包括第二种转移机构并且限定配置为含有物质的容积的第二个模块,所述第二个模块配置为联接至所述第一个模块,从而使得所述容积选择性置于经由所述第二个流动路径与所述反应室液体连通,所述第二种转移机构配置为当第二种转移机构被驱动时,将所述物质从所述容积转移到所述反应室
23.实施方案22的器械,其中:
当所述第一个模块联接至所述分离模块时,所述第一个模块的一部分安置在所述分离模块的分离室内。
24.实施方案22的器械,其中所述第一种转移机构配置为在所述反应室中产生真空,以产生从所述分离室到所述反应室的样品流动。
25.实施方案22的器械,其中所述第一种转移机构包括安置在与所述反应室液体连通的外壳内的栓塞,所述栓塞配置为当所述栓塞在所述圆柱体内移动时,在所述反应室内产生真空。
26.实施方案22的器械,其中:
所述容积是第一个容积;
所述物质是第一种物质;和
所述第一种转移机构包括可移除地安置在外壳内的栓塞,从而使得所述外壳所述栓塞限定第二个容积,所述第二个容积含有第二种物质,所述栓塞的一部分安置在第一个流动途径内,从而使得当所述栓塞处于在所述外壳内的第一个位置时,所述第二个容积与所述反应室是流体分离的,所述栓塞的一部分安置远离第一个流动途径,从而使得当所述栓塞处于在所述外壳内的第二个位置时,所述第二个容积与所述反应室液体连通,
所述栓塞配置为当所述栓塞从第一个位置移动到第二个位置时,在所述反应室内产生真空。
27.实施方案22的器械,其中所述第二个模块包括至少部分限定所述容积的可穿透构件,当所述可穿透构件的一部分被穿透时,所述容积置于与所述反应室液体连通。
28.实施方案22的器械,其中所述第二种转移机构包括安置在所述第二个模块的容积内的栓塞,所述栓塞配置为当所述栓塞在所述容积内移动时,对所述物质施加力,以将所述物质从所述容积转移到所述反应室内。
- 还没有人留言评论。精彩留言会获得点赞!