柱前衍生化法和发酵乳制品中组胺的检测方法与流程
本发明涉及柱前衍生化法和发酵乳制品中组胺的检测方法。
背景技术:
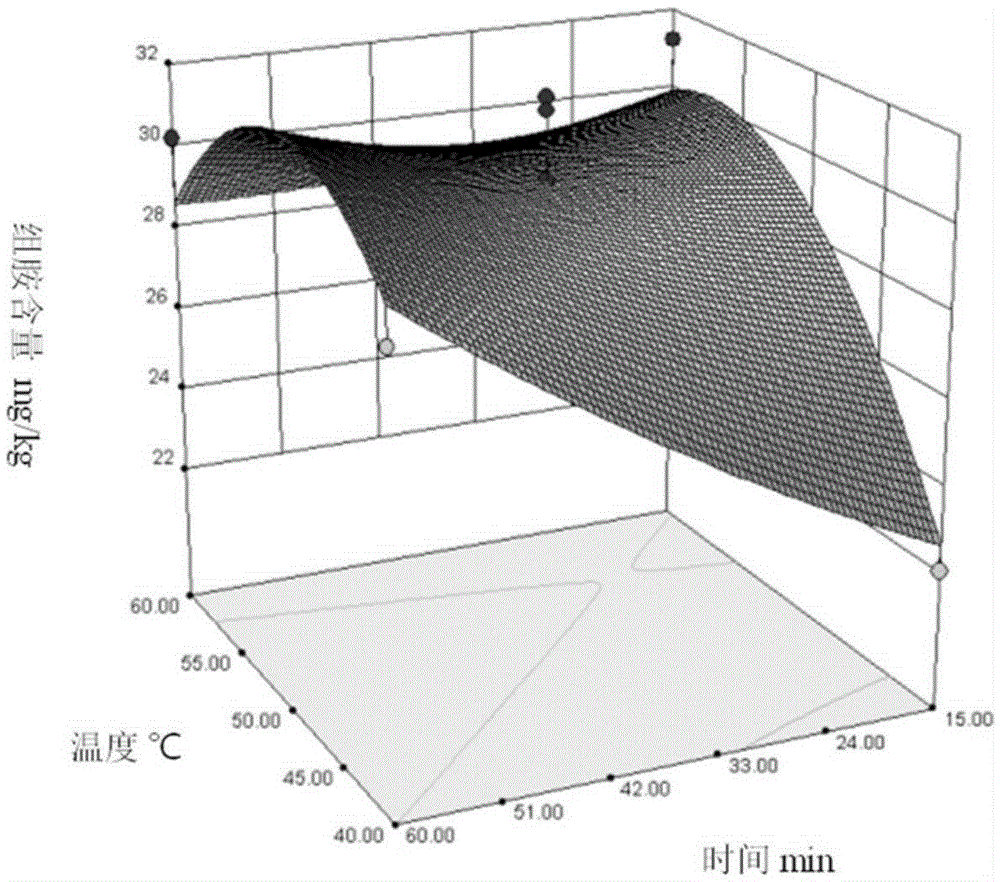
:组胺是存在于食品中含量最多、也是对人类健康影响最大的一种生物胺,由组氨酸经过脱羧酶的脱羧作用而形成。许多现代食品的成分中都含有组胺,这是由于生产原料中富含组氨酸和相应的脱羧酶,在合适的工艺条件下,发生脱羧反应而形成的。其中,鱼类食品中组胺含量最多,乳制品(特别是发酵乳制品)中组胺含量仅次于鱼类食品。适量的组胺在人体内有释放激素、刺激神经等生理作用,只有在体内积聚达到高水平或摄入量过高时才具有毒性。毒理学研究显示,人口服组胺8-40mg即产生轻微中毒症状,超过40mg产生中等中毒症状,超过100mg产生严重中毒症状。因此,为保障人类健康和食品安全,准确检测乳制品中组胺含量是控制组胺摄入危害、制定科学高效的风险管理措施、降低组胺膳食摄入风险的前提基础。常见的组胺检测分析方法包括高效液相色谱法(HPLC)、薄层液相色谱(TLC)和酶联免疫分析等等。其中,HPLC方法因其简便、快速、灵敏、稳定及高通量等优点,是国内外检测组胺的主要方法。由于组胺没有满意的可见和紫外吸收,也没有荧光成分,所以在使用HPLC方法测定时,需要对样品进行衍生化前处理。衍生化分为柱前衍生和柱后衍生。柱后衍生重复性好、耗时少,但所需仪器价格昂贵,难以推广;因此,柱前衍生成为使用最广泛的前处理方法。常见的柱前衍生剂有丹磺酰氯、邻苯二甲醛、苯甲酰氯、二硝基甲酰氯等。丹磺酰氯(Dansylchloride,Dns-Cl)与其他衍生剂相比,可定量完成磺酰化反应,且衍生物稳定性好、灵敏度高、操作简单、干扰不明显,是检测组胺一种较为理想的柱前衍生化试剂。尽管丹磺酰氯作为柱前衍生剂广泛应用于胺类的检测中,但关于使用该方法对食品中常见生物胺(包括组胺)专项检测的研究中对柱前衍生化条件的分析却相对较少,而且均集中于单因素条件(如衍生试剂用量、衍生反应时间等)。单因素分析是只改变一个可控因素,其他因素保持不变的研究;该方法简单、直观,但是只考察了单个因素的变化对结果的单独影响。综合考虑多因素的影响常使用正交试验设计方法,可同时考虑几种因素,从中寻找最佳因素水平组合;但正交试验方法不能在给出的区域里找到因素和响应值之间一个明确的回归方程,从而无法找到指定区域里因素的最佳组合以及响应值的最优值。该现象亟待解决。技术实现要素:本发明所要解决的技术问题是克服现有技术对发酵乳制品中组胺的含量进行检测时,不存在对柱前衍生化过程中诸多因素的优化研究,以及在影响检测结果的诸多因素中无法找到因素的最佳组合和最优值的缺陷,提供了一种柱前衍生化法和发酵乳制品中组胺的检测方法。本发明确定的柱前衍生化法能够处理成分相对复杂的发酵乳制品,在使用高效液相色谱-柱前衍生方法对乳制品中组胺含量检测的过程中,柱前衍生化条件简便、高效、准确性和精度均较高,能够满足实验室、工厂等需要精确检测乳制品中组胺含量的要求。本发明通过以下技术方案解决上述技术问题。本发明提供了一种柱前衍生化法,其包括下述步骤:(1)将待测样品进行预处理:待测样品在浓度为0.4~0.8mol/L高氯酸水溶液中混合反应20~45分钟后,1000~2500G离心8~15分钟,取上清液,再用所述高氯酸水溶液配制成浓度为50~250g/L的预处理后的待测样品;其中,所述待测样品为发酵乳制品;(2)将预处理后的待测样品中加入内标溶液后,在衍生化条件下进行衍生化反应后,除去衍生化反应过程中的丙酮,再用溶剂萃取,取萃取相, 即得柱前衍生化反应后的待测样品;其中,所述溶剂为能溶解组胺但不溶于水的有机溶剂;所述预处理后的待测样品和内标溶液的体积比为30:1~70:1;所述的衍生化条件为在pH值在8-12的取值范围内,通过对以下2次7项回归方程取值获得:Y=29.92+2.62X1+1.48X2+1.52X3-2.19X2X3-3.39X12-2.64X22其中,Y为组胺含量,单位mg/kg;X1为丹磺酰氯溶液中丹磺酰氯的浓度,丹磺酰氯溶液中的溶剂为丙酮,取值范围为1.0-10.0g/L;X2为衍生化反应温度,取值范围为40-60℃;X3为衍生化反应时间,取值范围为15-60分钟。步骤(1)中,所述高氯酸水溶液的浓度较佳地为0.55~0.65mol/L,更佳地为0.6mol/L。步骤(1)中,所述混合反应的时间较佳地为25~35分钟,更佳地为30分钟。步骤(1)中,所述离心的条件较佳地为1800~2200G,8~12分钟,更佳地为2000G,10分钟。步骤(1)中,所述预处理后的待测样品的浓度较佳地为100~250g/L,更佳地为100~200g/L。步骤(1)中,所述发酵乳制品一般是指乳在发酵剂(菌种)作用下发酵而成的乳制品,较佳地选自为干酪、发酵乳和发酵稀奶油中的一种或多种,更佳地选自干酪和/或发酵乳。所述干酪为天然干酪和/或再制干酪。按照本领域常规,所述发酵乳在进行预处理前,一般先搅拌均匀;所述干酪为片状或块状时,在预处理前一般先进行绞碎。步骤(1)中,所述的混合反应的操作较佳地为通过恒温震荡器进行震荡。步骤(1)中,较佳地,在预处理过程中使用高氯酸水溶液进行多次混合反应,更佳地使用高氯酸水溶液进行3次混合反应。根据本领域常识,将 多次混合反应后的产物再进行上述离心过程,取上清液进行合并。步骤(1)中,所述预处理过程较佳地按下述步骤进行:将4~6g的所述待测样品在15~50mL、0.4~0.8mol/L高氯酸水溶液中混匀,震荡20~45min后,1000~2500G离心8~15min,取上清液,采用0.4~0.8mol/L高氯酸水溶液稀释至50mL即可;更佳地按下述步骤进行:将5g所述待测样品溶于15mL,0.6mol/L高氯酸水溶液,振荡30min后,2000G离心10min,取上清液,采用0.6mol/L的高氯酸水溶液将滤液稀释至50mL即可。步骤(2)中,所述内标溶液为采用丹磺酰氯作为柱前衍生化法的衍生剂时,本领域内常用的内标溶液,较佳地为浓度为100mg/L的1,7-庚二胺的盐酸标准溶液。所述内标溶液较佳地通过下述步骤制的:①称取1,7-庚二胺(1,7-heptanediamine)标准品适量溶于0.1mol/L盐酸中,配制成1000mg/L的母液;②使用0.1mol/L盐酸将所述母液稀释成100mg/L的标准溶液即可。所述1,7-庚二胺较佳地为色谱级。步骤(2)中,所述丙酮较佳地通过35~45℃的氮气吹除去,更佳地通过40℃的氮气吹除去。步骤(2)中,所述溶剂较佳地为正戊烷、己烷和正庚烷中的一种或多种,更佳地为正庚烷。步骤(2)中,所述预处理后的待测样品和所述溶剂的体积比较佳地为1:10~1:4。步骤(2)中,进一步优选,所述X1为7.08~7.48g/L,所述pH值为10.0,所述X2为48.02-49.47℃,所述X3为60分钟;更优选,所述X1为7.25g/L,所述pH值为10.0,所述X2为49.0℃,所述X3为60分钟。本发明还提供了一种发酵乳制品中组胺的检测方法,其包括下述步骤:(1)将按照所述柱前衍生化反应处理后的待测样品先去除溶剂后,加入甲醇溶解,再经0.22μm或0.45μm膜过滤,得进料样品;(2)将步骤(1)中所述进料样品再进行高效液相色谱法(HPLC)进行检测,即可。高效液相色谱法(HPLC)是色谱法的重要分支,是以液体(不同极性的单一溶剂或不同比例的混合溶剂、缓冲液等)为流动相,采用高压输液系统,将流动相泵入装有固定相的色谱柱,在柱内各成分被分离后,进入检测器(最常用的是紫外检测器或荧光检测器)进行检测,从而实现对样品的分析。步骤(1)中,所述去除溶剂的方式较佳地为氮气吹干。步骤(2)中,所述的高效液相色谱法(HPLC)中,较佳地色谱柱为C18反相色谱柱;更佳地色谱柱为型号AgilentZORBAXEclipseXDB-C18柱,其中,内径250mm×4.6mm,粒径5μm。步骤(2)中,所述检测较佳地采用高效液相色谱-荧光检测器进行检测。其中,所述荧光检测器的激发波长较佳地为330~380nm,更佳地为350nm。所述荧光检测器的发射波长较佳地为470~560nm,更佳地为520nm。步骤(2)中,所述的检测较佳地使用梯度洗脱的方法,流动相A为超纯水,流动相B为甲醇。所述梯度洗脱的方法为本领域常规。其中,较佳地,所述流动相A或所述流动相B的洗脱的梯度条件如下,时间min0714202730353645流动相A%4535303010004545流动相B%55657070901001005555步骤(2)中,较佳地,所述进料样品的流速为0.5~1.5mL/min,更佳地为1.0mL/min。步骤(2)中,较佳地,检测时的柱温为20~30℃,更佳地为25℃。步骤(2)中,较佳地,检测时的进样体积为15~25μL,更佳地为20μL。步骤(2)中,较佳地,所述高效液相色谱法检测后,待测样品中组胺含量的按照式(1)进行计算:式(1)其中,c为待测样品中组胺含量,单位为毫克每千克(mg/kg);A为待测样品中组胺的峰面积;A’为组胺标样的峰面积;A’i为标准样中内标的峰面积;Ai为待测样品中内标的峰面积;20为转换系数。在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。本发明所用试剂和原料均市售可得。本发明的积极进步效果在于:本发明确定的柱前衍生化法能够处理成分相对复杂的发酵乳制品,衍生化条件简便、高效、准确性和精密度均较高,具有更好的预测性能够满足实验室、工厂等需要精确检测乳制品中组胺含量的要求。附图说明图1为实施例1组胺含量(Y)-丹磺酰氯浓度(X1)和pH值(X4)的响应曲面图。图2为实施例1组胺含量(Y)-衍生化反应温度(X2)和衍生化反应时间(X3)的响应曲面图,其中,圆点为响应面方法拟合误差大于5%的实验数据,实心点数据代表高于拟合值,空心点数据代表低于拟合值。具体实施方式下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。实施例1响应面法优化的衍生化条件通过下述步骤制得:1、配制溶液(1)组胺标准溶液准确称取组胺标准品(色谱级)适量溶于0.1mol/L盐酸中,配制成1000mg/L的母液,置4℃冰箱保存。使用0.1mol/L盐酸将母液稀释成100mg/L标准溶液待用。(2)内标溶液准确称取1,7-庚二胺(1,7-heptanediamine,色谱级)标准品适量溶于0.1mol/L盐酸中,配制成1000mg/L的母液,置4℃冰箱保存。使用0.1mol/L盐酸将母液稀释成100mg/L的标准溶液待用。2、待测样品的预处理取称重5g绞碎的天然干酪X(市售产品,瑞士大孔天然干酪,生产厂家为德国多美鲜公司),加入15ml,0.6mol/L高氯酸水溶液混匀、振荡30min后2000G离心10min,取上清液。按以上步骤使用高氯酸提取样品3次,合并上清液并过滤至容量瓶。用0.6mol/L的高氯酸水溶液将滤液稀释至50ml,摇匀待用。预处理后待测样品的浓度为100.25g/L。3、响应面方法优化前处理条件待优化的衍生化条件为:pH值、衍生化试剂(丹磺酰氯)浓度、衍生化反应温度及时间。使用响应面方法中的Box-Behnken设计条件优化方案,见表1。表1优化衍生化条件的Box-Behnken设计方案注:A:-1(1)表示衍生化实验条件的设定,其中-1为因素的水平(各因素分别为-1、0、1三个水平),1为因素的实际数据,即丹磺酰氯浓度为1mg/L。B:中心试验点。4、样品的衍生化反应(1)待测样品的衍生化反应取上述预处理后的待测样品0.5mL加入10μL内标溶液后,采用上述步骤3中响应面方法所得的实验编号1~29所得条件进行衍生化反应后,在40℃下氮气吹除去丙酮,加入3mL正庚烷萃取,吸取上清液,氮气吹干后加入 1mL甲醇完全溶解。经0.45μm滤膜过滤后待测。其中,加入1.5mL碳酸盐缓冲液(碳酸盐缓冲液的pH值即为体系中所需pH)加入2mL丹磺酰氯溶液(溶剂为丙酮,溶液浓度为步骤3中表1中的浓度)。(2)组胺标准溶液的衍生化反应取组胺标准溶液0.5mL,加入10μL内标后,进行衍生化反应。衍生化反应的步骤同上述(1)待测样品的衍生化反应。5、液相色谱测定使用高效液相色谱(HPLC)及荧光检测器检测衍生化处理后的样品。色谱柱为C18反相色谱柱(型号为AgilentZORBAXEclipseXDB-C18柱,内径250mm×4.6mm,粒径5μm),荧光检测器的激发波长和发射波长分别为350nm和520nm。流动相A为超纯水,流动相B为甲醇,梯度洗脱程序按表2进行:表2高效液相色谱检测组胺的梯度洗脱程序时间min0714202730353645流动相A%4535303010004545流动相B%55657070901001005555柱前衍生化法反应后的待测样品的流速:1.0mL/min;柱温:25℃;进样体积:20μL。6、计算根据经优化后的衍生化条件反应,测得数据如下:待测样品中组胺的峰面积为34009,组胺标样的峰面积为17820,标准样品中内标的峰面积为4047,待测样品中内标的峰面积为4344。按式(1)计算样品中组胺的含量为35.56mg/kg:式(1) 其中,c为待测样品中组胺含量,单位为毫克每千克(mg/kg);A为待测样品中组胺的峰面积;A’为组胺标样的峰面积;A’i为标准样中内标的峰面积;Ai为待测样品中内标的峰面积;20为转换系数。7、结果分析根据表2中检测组胺的梯度洗脱程序对同一干酪样品进行试验并测定其组胺含量,得到的试验结果使用专业分析软件Design-Expert分析,结果如图1、图2所示,图1为实施例1组胺含量(Y)-丹磺酰氯浓度(X1)和pH值(X4)的响应曲面图;图2为实施例1组胺含量(Y)-衍生化反应温度(X2)和衍生化反应时间(X3)的响应曲面图,图2中的圆点为响应面方法拟合误差大于5%的实验数据(其中,实心点数据代表高于拟合值,空心点数据代表低于拟合值)。响应面法设定的变量参数在pH值在8-12的取值范围内,通过对以下2次7项回归方程分析获得:Y=29.92+2.62X1+1.48X2+1.52X3-2.19X2X3-3.39X12-2.64X22其中,Y为组胺含量,单位mg/kg;X1为丹磺酰氯溶液中丹磺酰氯的浓度,丹磺酰氯溶液中的溶剂为丙酮,取值范围为1.0-10.0g/L;X2为衍生化反应温度,取值范围为40-60℃;X3为衍生化反应时间,取值范围为15-60分钟。根据分析结果,响应面方法优化的衍生化条件为:丹磺酰氯浓度为7.08~7.48g/L,pH值为10.0,衍生反应温度为48.02-49.47℃,衍生反应时间为60min。最优化衍生化条件为:丹磺酰氯浓度7.25g/L,pH值10.0,衍生反应温度49.0℃,衍生反应时间60min。实施例2(1)样品预处理取称重5g已搅拌均匀的发酵乳样品A(市售产品,内蒙古老酸奶,生产厂家为蒙牛公司),加入15mL,0.6mol/L高氯酸水溶液混匀、振荡30min后2000G离心10min,取上清液。按以上步骤使用高氯酸提取样品3次,合并上清液并过滤至容量瓶。用0.6mol/L的高氯酸水溶液将滤液稀释至50mL,摇匀待用。预处理后待测样品的浓度为100.10g/L。(2)衍生化反应取上述样液0.5mL加入实施例1制得的10μL内标溶液后,再加入1.5mL,pH10.0的碳酸盐缓冲液和2mL,7.25g/L丹磺酰氯溶液(溶剂为丙酮),在49.0℃下反应60min,在40℃下氮吹除去丙酮,加入3mL正庚烷萃取,吸取上清液,氮气吹干后加入1mL甲醇完全溶解。经0.45μm滤膜过滤后待测。取实施例1制得的组胺标准溶液0.5mL,加入10μL内标后,同上述衍生化步骤。(3)高效液相色谱测定使用高效液相色谱(HPLC)及荧光检测器测定衍生化处理后的样品。色谱柱为C18反相色谱柱(型号为AgilentZORBAXEclipseXDB-C18柱,内径250mm×4.6mm,粒径5μm),荧光检测器的激发波长和发射波长分别为350nm和520nm。流动相A为超纯水,流动相B为甲醇,梯度洗脱程序按实施例1表2进行。(4)计算待测样品中组胺的峰面积为2545,组胺标样的峰面积为17820,标准样品中内标的峰面积为4047,待测样品中内标的峰面积为3918。按实施例1式(1)计算得到发酵乳样品A组胺含量为2.95mg/kg。实施例3(1)样品预处理取称重5g已绞碎的天然干酪B(市售产品,切达干酪,生产厂家为英 国库姆城堡公司),加入15mL,0.6mol/L高氯酸水溶液混匀、振荡30min后2000G离心10min,取上清液。按以上步骤使用高氯酸提取样品3次,合并上清液并过滤至容量瓶。用0.6mol/L的高氯酸水溶液将滤液稀释至50mL,摇匀待用。预处理后待测样品的浓度为104.77g/L。(2)衍生化反应取上述样液0.5mL加入实施例1制得的10μL内标溶液后,再加入1.5mL,pH10.0的碳酸盐缓冲液和2mL,7.25g/L丹磺酰氯溶液(溶剂为丙酮),在49.0℃下反应60min,在40℃下氮吹除去丙酮,加入3mL正庚烷萃取,吸取上清液,氮气吹干后加入1mL甲醇完全溶解。经0.45μm滤膜过滤后待测。取实施例1制得的组胺标准溶液0.5mL,加入10μL内标后,同上述衍生化步骤。(3)高效液相色谱测定使用高效液相色谱(HPLC)及荧光检测器测定衍生化处理后的样品。色谱柱为C18反相色谱柱(型号为AgilentZORBAXEclipseXDB-C18柱,内径250mm×4.6mm,粒径5μm),荧光检测器的激发波长和发射波长分别为350nm和520nm。流动相A为超纯水,流动相B为甲醇,梯度洗脱程序按实施例1表2进行。(4)计算待测样品中组胺的峰面积为56644,组胺标样的峰面积为17820,标准样品中内标的峰面积为4047,待测样品中内标的峰面积为4151。按实施例1式(1)计算得到天然干酪B组胺含量为61.98mg/kg。实施例4(1)样品预处理取称重5g已绞碎的再制干酪C(市售产品,圣茉莉奶酪,生产厂家为法国博格瑞公司),加入15mL,0.6mol/L高氯酸水溶液混匀、振荡30min后2000G离心10min,取上清液。按以上步骤使用高氯酸提取样品3次,合并 上清液并过滤至容量瓶。用0.6mol/L的高氯酸水溶液将滤液稀释至50mL,摇匀待用。预处理后待测样品的浓度为102.52g/L。(2)衍生化反应取上述样液0.5mL加入实施例1制得的10μL内标溶液后,再加入1.5mL,pH10.0的碳酸盐缓冲液和2mL,7.25g/L丹磺酰氯溶液(溶剂为丙酮),在49.0℃下反应60min,在40℃下氮吹除去丙酮,加入3mL正庚烷萃取,吸取上清液,氮气吹干后加入1mL甲醇完全溶解。经0.45μm滤膜过滤后待测。取实施例1制得的组胺标准溶液0.5mL,加入10μL内标后,同上述衍生化步骤。(3)高效液相色谱测定使用高效液相色谱(HPLC)及荧光检测器测定衍生化处理后的样品。色谱柱为C18反相色谱柱(型号为AgilentZORBAXEclipseXDB-C18柱,内径250mm×4.6mm,粒径5μm),荧光检测器的激发波长和发射波长分别为350nm和520nm。流动相A为超纯水,流动相B为甲醇,梯度洗脱程序按实施例1表2进行。(4)计算待测样品中组胺的峰面积为18780,组胺标样的峰面积为17820,标准样品中内标的峰面积为4047,待测样品中内标的峰面积为4135。按实施例1式(1)计算得到再制干酪C组胺含量为20.63mg/kg。实施例5(1)样品预处理取称重5g已搅拌均匀的发酵乳样品D(市售产品,牦牛酸奶,生产厂家为青海西宁大美公司),加入15mL,0.6mol/L高氯酸水溶液混匀、振荡30min后2000G离心10min,取上清液。按以上步骤使用高氯酸提取样品3次,合并上清液并过滤至容量瓶。用0.6mol/L的高氯酸水溶液将滤液稀释至50mL,摇匀待用。预处理后待测样品的浓度为100.46g/L。(2)衍生化反应取上述样液0.5mL加入实施例1制得的10μL内标溶液后,再加入1.5mL,pH10.0的碳酸盐缓冲液和2mL,7.25g/L丹磺酰氯溶液(溶剂为丙酮),在49.0℃下反应60min,在40℃下氮吹除去丙酮,加入3mL正庚烷萃取,吸取上清液,氮气吹干后加入1mL甲醇完全溶解。经0.45μm滤膜过滤后待测。取实施例1制得的组胺标准溶液0.5mL,加入10μL内标后,同上述衍生化步骤。(3)高效液相色谱测定使用高效液相色谱(HPLC)及荧光检测器测定衍生化处理后的样品。色谱柱为C18反相色谱柱(型号为AgilentZORBAXEclipseXDB-C18柱,内径250mm×4.6mm,粒径5μm),荧光检测器的激发波长和发射波长分别为350nm和520nm。流动相A为超纯水,流动相B为甲醇,梯度洗脱程序按实施例1表2进行。(4)计算待测样品中组胺的峰面积为3829,组胺标样的峰面积为17820,标准样品中内标的峰面积为4047,待测样品中内标的峰面积为4219。按实施例1式(1)计算得到发酵乳样品D组胺含量为4.12mg/kg。实施例6本实施例6采用的衍生化条件为实施例1得出的最优化衍生化条件。(1)样品预处理取称重5g绞碎的天然干酪X(市售产品,瑞士大孔天然干酪,生产厂家为德国多美鲜公司),分别加入15mL,0.6mol/L高氯酸水溶液混匀、振荡30min后2000G离心10min,取上清液。按以上步骤分别使用高氯酸提取样品3次,合并上清液并过滤至容量瓶。用0.6mol/L的高氯酸水溶液将滤液稀释至50mL并摇匀。预处理后待测样品的浓度为100.25g/L。(2)衍生化反应取上述样液0.5mL加入实施例1制得的10μL内标溶液后,再加入1.5mL,pH10.0的碳酸盐缓冲液和2mL,7.25g/L丹磺酰氯溶液(溶剂为丙酮),在49.0℃下反应60min,在40℃下氮吹除去丙酮,加入3mL正庚烷萃取,吸取上清液,氮气吹干后加入1mL甲醇完全溶解。经0.45μm滤膜过滤后待测。取实施例1制得的组胺标准溶液0.5mL,加入10μL内标后,同上述衍生化步骤。(3)高效液相色谱测定使用高效液相色谱(HPLC)及荧光检测器测定衍生化处理后的样品。色谱柱为C18反相色谱柱(型号为AgilentZORBAXEclipseXDB-C18柱,内径250mm×4.6mm,粒径5μm),荧光检测器的激发波长和发射波长分别为350nm和520nm。流动相A为超纯水,流动相B为甲醇,梯度洗脱程序按实施例1表2进行。(4)计算待测样品中组胺的峰面积为34009,组胺标样的峰面积为17820,标准样品中内标的峰面积为4047,待测样品中内标的峰面积为4344。按实施例1式(1)计算得到发酵乳样品X组胺含量为35.56mg/kg。实施例7(1)重新称重5g绞碎的天然干酪X(市售产品,瑞士大孔天然干酪,生产厂家为德国多美鲜公司),按照实施例6的步骤进行样品预处理,样品预处理后加入实施例1中的组胺标准母液50μL摇匀,作为干酪样品的加标样液待用。(2)将步骤(1)所得的干酪样品的加标样液按照实施例6的步骤进行衍生化反应、高效液相色谱测定、计算得到天然干酪X组胺含量为44.88mg/kg。实施例8(1)重新称重5g已搅拌均匀的发酵乳样品A(市售产品,内蒙古老酸 奶,生产厂家为蒙牛公司),按照实施例2的步骤进行样品预处理,样品预处理后加入实施例1中的组胺标准母液5μL摇匀,作为发酵乳样品的加标样液待用。(2)将步骤(1)所得的发酵乳样品的加标样液按照实施例2的步骤进行衍生化反应、高效液相色谱测定、计算得到发酵乳样品A组胺含量为3.84mg/kg。效果实施例1本效果实施例证明在实施例1获得的最优化衍生条件下,测得的组胺的衍生化转化率最高。采用Box-Behnken设计的衍生化条件(如表3),其余实验条件与实施例6检测方法相同,经实验测得表3中实验编号为1~29的组胺的浓度。由上述实验编号为1~29的实验可知,实施例6中在最优化衍生化条件下测得的组胺的含量最高。表3优化衍生化条件的试验结果注:1为中心试验点。效果实施例2本效果实施例用于证明最优化衍生化条件检测发酵乳中组胺数据的准确性,结果如表4所述。其中,实施例7、8加标样液中组胺标准含量为换算成乳制品的加标样液中组胺的含量。由表4可知,以实施例6、7为一组,测定天然干酪X的回收率为93.17%;以实施例2、8为一组,测定发酵乳样品A的回收率为88.59%。表4效果实施例3以实施例6为例,检测使用最优化条件检测发酵乳中所得组胺数据的精密度。在实施例6步骤(3)中,将衍生化处理后的待测样品重复进样6次,结果如表5所述。其中,平行样品是指的将在实施例6同等条件下,检测6次所得的检测值;RSD为相对标准偏差(relativestandarddeviation),指标准偏差与计算结果算术平均值的比值。表5当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1