一种液体中组分的检测方法与流程
本发明属于微量检测领域,更具体地,涉及一种液体中组分的检测方法。
背景技术:
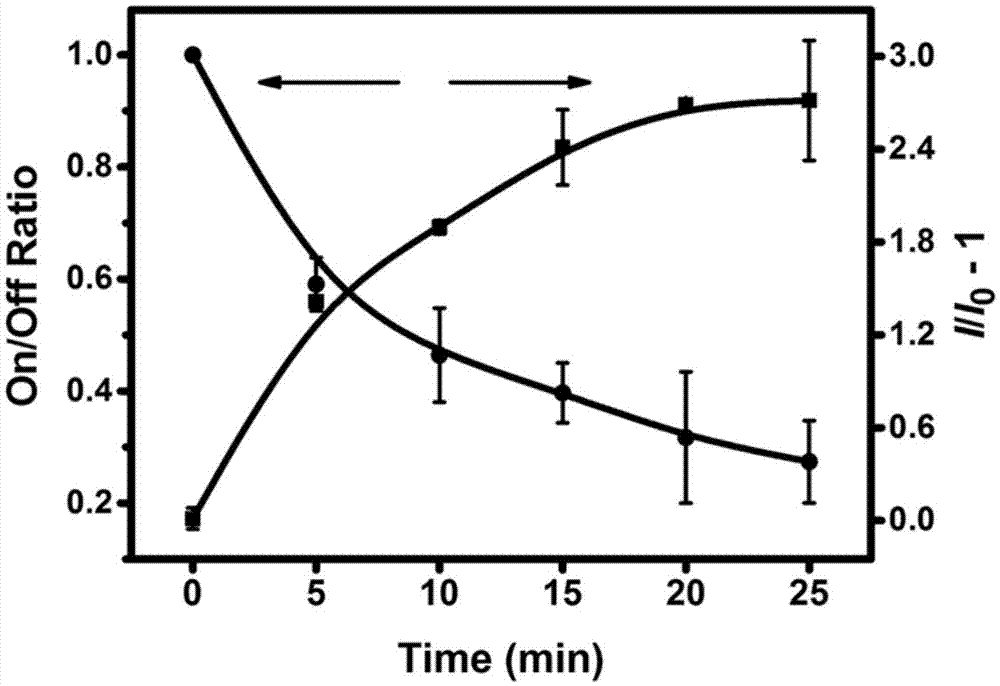
:纳米通道技术为一种低能耗、操作简单、灵敏度高、无污染的检测技术,可应用于dna的测序研究以及小分子的检测。现有技术中通常利用纳米通道上的捕获探针检测半胱氨酸等小分子(advmater.volume26,issue3,january22,2014pages455-460.)由于该方法仅在纳米通道周围吸附一层半胱氨酸分子及一层捕获探针分子,因此检测灵敏度有限。而使用dna作为捕获探针,由于dna的分子量较大,则可以将检测灵敏度增加到10-6m,然而,由于该方法需要dna与待测组分能够进行互相互补配对,仅能检测atp或核酸等物质。同时,当待测组分的浓度进一步减小时,由于探针或待测组分吸附于纳米通道的边缘,使得电化学信号的检测结果发生偏差。且纳米通道膜吸附了探针和待测分子后,无法再生,造成了材料的浪费。而采用其它手段进行小分子或离子的检测,则灵敏度有限。非专利文献中公开了一种利用纳米金检测葡萄糖的方法(advmater.2013feb6;25(5):749-54.)。然而,其检测限仅能达到5×10-4m,且无法排除其它单糖对于葡萄糖检测的干扰。非专利文献(volume47,issue44october20,2008pages8386–8389)中也公开了一种利用纳米金增强荧光来检测汞离子的方法,它采用原子吸收光谱法来检测重金属离子,不仅制样过程复杂,灵敏度也仅到达了10-6m。技术实现要素:针对现有技术的以上缺陷或改进需求,本发明提供了一种液体中组分的检测方法,利用聚集诱导发光化合物与待测组分在纳米通道内结合,从而实现微量组分的检测。为实现上述目的,按照本发明的一个方面,提供了一种液体中组分的检测方法,在待测液体中加入1μμ~100μμ的聚集诱导发光化合物以及纳米通道膜,使得所述聚集诱导发光化合物与待测组分在纳米通道内充分聚合,通过所述纳米通道膜的电化学信号和/或荧光信号的变化,获得待测组分的浓度;其中,所述纳米通道膜具有能跟所述聚集诱导发光化合物或所述待测组分结合的表面基团,所述聚集诱导发光化合物具有至少两个探针基团,所述待测组分具有至少两个目标基团或电子空轨道,所述探针基团用于与目标基团或电子空轨道结合,所述探针基团用于与目标基团或电子空轨道结合,从而使得所述聚集诱导发光化合物与待测组分聚合,形成长链寡聚物或长链复合物。优选地,所述纳米通道膜的厚度为12μm~60μm。优选地,所述纳米通道膜为聚对苯二甲酸乙二酯薄膜,阳极氧化铝薄膜或聚碳酸酯薄膜。优选地,所述纳米通道的直径为10nm~600nm,平均密度为107/cm2~109/cm2。作为进一步优选地,其特征在于,所述纳米通道的直径为10nm~100nm,平均密度为107/cm2~108/cm2。优选地,所述聚合的时间为5min~60min。优选地,所述待测组分的浓度大于等于4×10-6m,通过所述纳米通道膜的电化学信号变化获得待测组分的浓度。优选地,所述待测组分的浓度小于4×10-6m,通过所述纳米通道膜的荧光信号的变化,获得待测组分的浓度。优选地,所述待测组分为有机分子,具有至少两个目标基团。作为进一步优选地,所述待测组分为葡萄糖,所述目标基团为邻羟基,所述探针基团为硼酸基。作为更进一步优选地,所述聚集诱导发光化合物的化学结构式如式i所示优选地,所述待测组分为金属阳离子,具有至少两个电子空轨道。作为进一步优选地,所述待测组分为hg2+,所述探针基团为胸腺嘧啶基或尿嘧啶基。作为更进一步优选地,所述聚集诱导发光化合物的化学结构式如式ii所示1、聚集诱导发光化合物与待测组分聚合后形成了长链寡聚物或长链复合物,待测组分在无需与dna互补配对的情况下,聚集诱导发光化合物实现了检测信号的放大功能;2、利用聚集诱导发光化合物作为检测探针,可通过激光共聚焦显微镜来检测纳米通道膜上的荧光信号的变化来获得待测组分的浓度,避免了反应物吸附等因素对电化学信号的影响,同时在待测组分浓度较高时,仍可采用电化学检测方法弥补高浓度的待测物使荧光强度变化不明显的缺陷;3、聚集诱导发光化合物与待测组分在纳米通道膜中聚合后,可利用如s2-或h+等清除剂实现纳米通道的清除和再生,用同一纳米通道膜实现二次甚至三次检测过程,节省实验材料,经济环保;4、本发明的检测限低,与现有的检测葡萄糖浓度的技术相比,葡萄糖的检测限电化学方法为4×10-7m,光化学法为4×10-10m,检测限降低3个数量级;与现有的检测汞离子浓度的技术相比,汞离子的检测限达到了10-7m,降低了一个数量级;5、式i化合物具有硼酸基团,由于葡萄糖分子具有1,2-二醇特殊结构,能分别和带负电的硼酸基团的两个羟基发生脱水聚合反应,式i化合物对葡萄糖和硼酸具有较好的结合特异性,能排除其它单糖对葡萄糖含量检测的干扰,同时,由于该反应的反应机理并非基于氧化还原反应,该检测过程不受氧化剂或还原剂的干扰。附图说明图1为本发明实施例1电化学信号以及荧光信号变化曲线图;图2为本发明实施例2电化学信号以及荧光信号变化曲线图;图3为本发明实施例3电化学信号变化曲线图;图4为本发明实施例4实际尿液样本的抗氧化还原干扰荧光信号检测示意图;图5为本发明实施例5电化学信号以及荧光信号变化曲线图;图6为本发明实施例5利用同一纳米孔道实现3次循环检测电化学信号以及荧光信号变化曲线。具体实施方式为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。此外,下面所描述的本发明各个实施方式中所涉及到的技术特征只要彼此之间未构成冲突就可以相互组合。本发明提供了一种液体中组分的检测方法,在待测液体中加入1μμ~100μμ的聚集诱导发光化合物以及纳米通道膜,使得所述聚集诱导发光化合物与待测组分在纳米通道内充分聚合,使得薄膜两侧的电阻增大,同时聚集诱导发光化合物聚集发光,通过所述纳米通道膜的电化学信号和/或荧光信号的变化,获得待测组分的浓度。其中,所述纳米通道膜具有能跟所述聚集诱导发光化合物或所述待测组分结合的表面基团;该表面基团通常利用表面修饰法对薄膜改性获得,因此薄膜需具有羟基,羧基等易修饰的基团,例如聚对苯二甲酸乙二酯薄膜,阳极氧化铝薄膜或聚碳酸酯薄膜。纳米通道膜的面积只要能满足电化学信号检测中电解装置的大小即可,纳米通道膜的厚度为12μm~60μm,纳米通道的直径为10nm~600nm,优选为10nm~100nm,平均密度为107/cm2~109/cm2,优选为107/cm2~108/cm2。所述聚集诱导发光化合物具有至少两个探针基团,所述待测组分具有至少两个目标基团或电子空轨道,所述待测组分通过目标基团或电子空轨道与所述聚集诱导发光化合物的探针基团相结合或配对螯合;因此,待测组分为有机分子,或hg2+等第三、四、五周期的过渡金属离子。而待测组分的两个目标基团不一定要相同,聚集诱导发光化合物的两个探针基团亦不一定相同,只要目标基团和探针基团结合时的反应条件相同即可。当待测组分浓度过大时,例如大于等于4×10-6m时,由于聚集诱导发光化合物聚集量过大,荧光强度变化不明显,则更适用于利用电化学信号来获得待测组分的含量,或者通过稀释待测组分以及减小聚集诱导发光化合物的浓度降低荧光强度后再进行检测。而当待测组分浓度较小,如小于4×10-6m时,由于反应物在纳米通道表面发生物理性吸附等原因,会使得检测结果发生偏差,则更适用于利用荧光信号获得待测组分的含量。当待测组分含量的范围未知时,可利用两种方法进行综合检测,获得待测组分的含量。例如,当待测组分为葡萄糖时,由于硼酸基可以和葡萄糖上的1,2-二羟基以及5,6-二羟基形成可逆共价反应,可以选取硼酸基为探针基团,选取tpedb为聚集诱导发光化合物,其分子结构式如下而纳米通道膜可利用对氨基苯硼酸进行表面修饰,使得表面带有硼酸基。当待测组分为汞离子时,由于胸腺嘧啶或尿嘧啶可以与汞离子结合,可以选取胸腺嘧啶基团为探针基团,选取tpe-2t为聚集诱导发光化合物,其分子结构如下而纳米通道膜可利用6-氨基尿嘧啶进行表面修饰,使得表面带有尿嘧啶基团。而聚合的温度,则跟选取的聚集诱导发光化合物的探针基团以及待测组分的目标基团的反应温度相关;聚合的时间通常为5min~60min,其与反应温度,聚集诱导发光化合物以及待测组分的浓度都相关。反应温度处在最适反应温度,且聚集诱导发光化合物以及待测组分浓度较高时,聚合速度较快,聚合时间较短。在聚合反应发生并获得了待测组分的浓度后,可根据表面基团,探针基团,目标基团以及电子空轨道之间的组合,选择合适的清除剂实现纳米通道的清除和再生,用同一纳米通道膜实现二次甚至三次检测过程,如s2-或h+等。实施例1(1)取一片经过au原子轰击过的潜径迹平均密度为5×107个/cm2,厚度为12μm的pet(聚对苯二甲酸乙二醇酯)薄膜,在365nm的紫外灯下正反各照射30min后,将薄膜浸泡在50℃的2mnaoh溶液中,刻蚀5min,au原子轰击过的潜径迹被刻蚀成深度12μm,直径30nm,密度为5×107/cm2个贯穿于薄膜的圆柱孔道,在纳米孔道内修饰对氨基苯硼酸之后,使得孔道表面具有硼酸基团。(2)将该pet薄膜浸入4mm葡萄糖溶液中,加入50μμtpedb(双硼酸基修饰四苯基乙烯),tpedb的化学结构式为25℃温度下反应20min后的跨膜电压如图1a所示(电压检测的具体条件为:将pet薄膜夹在两边可以加电解液的槽子中间,电解液为50mmph7.48的pbs,电解液只能从纳米孔道穿过,两端的电解液中分别插入一根ag/agcl电极,在电极上施加电压,电压牵引电解液中的离子穿过纳米孔道),其中,方块线表示0时刻的跨膜电压,表示纳米孔通道为连通的;圆点线表示反应20min时的跨膜电压,此时电压明显下降,这是因为聚集诱导发光化合物以及葡萄糖在纳米孔内结合为(tpedb-glu)n复合物结构。25℃温度下分别反应5min,10min,15min,20min,25min后测试电流和荧光。得出电流降低-时间曲线和荧光增加-时间曲线,如图1b所示,其中圆点线表示电流,方块线表示荧光。由于tpedb和纳米孔都具有可以与葡萄糖结合的基团,随着反应时间的延长,聚集诱导发光化合物以及葡萄糖会在纳米孔内结合为(tpedb-glu)n复合物结构,使得电流降低,荧光增加。(3)反应20min后,将含有纳米孔道的pet薄膜浸入ph为2的盐酸溶液中,由于h+进入纳米孔道中会破坏(tpedb-glu)n复合物的结构,使得纳米孔道打开,荧光逐渐消失。h+加入5min,10min,15min,20min,25min,以及30mi后的电流增加-时间曲线和荧光降低-时间曲线,如图1c所示,其中,圆点线表示电流,方块线表示荧光。根据公式f-f0/fmax-fmin计算图1b和图1c中的信号变化值;其中,f表示特定时刻的信号,f0表示0时刻的信号,fmax表示信号最大值,fmin表示信号最小值,得到的信号变化比例如表1所示。表1反应时间(min)5101520反应过程电流降低值(%)56.473.883.194.1反应过程荧光升高值(%)51.969.788.898.9加入h+后电流升高值(%)37.157.383.495.0加入h+后荧光降低值(%)36.761.990.498.9实施例2以所述的相同步骤重复实施例1,其特征在于,葡萄糖的浓度分别为4×10-1nm,4nm,4×10nm,4×102nm,4×103nm,4×104nm,4×105nm以及4×106nm,反应时间为20min,得到的浓度-电流减小率检测曲线如图2a所示,浓度-荧光检测曲线如图2b所示;可以看到,在反应相同时间的情况下,葡萄糖浓度越高,电流降低越多,荧光值越大。荧光检测可达到4×10-10mol/l的检测限。实施例3以所述的相同步骤重复实施例1,其特征在于,以尿液样本(取病人的尿液样本1ml先在800rap/s的转速下离心3min后取上清液,上清液再在12000rap/s的转速下离心20min后再取上清液)取代葡萄糖溶液,反应20min后得到的电流降低曲线如图3所示,其中,nd为非糖尿病尿液样本、dm(before)表示糖尿病患者治疗前尿液样本,dm(after)表示糖尿病患者治疗后尿液样本,可以看出,糖尿病患者治疗后尿液样本以及非糖尿病尿液样本中葡萄糖的浓度明显高于糖尿病患者治疗前尿液样本。实施例4以所述的相同步骤重复实施例3,区别在于,在糖尿病患者治疗前尿液样本分别加入抗坏血酸钠(还原剂,终浓度为2.2mm)和过氧化氢(氧化剂,终浓度体积比2.7%),反应20min后测试穿过纳米孔道的电流和荧光,得到反应前后的荧光强度对比图如图4所示。其中,sample表示糖尿病患者治疗前尿液样本,sample+vc表示加入抗坏血酸钠的尿液样本,sample+h2o2表示加入过氧化氢的尿液样本。三者在反应前后的荧光强度基本一致,说明该反应体系能防止氧化还原剂的干扰。实施例5(1)以所述的相同步骤重复实施例1,区别在于,纳米孔内修饰有6-氨基尿嘧啶;(2)将该pet薄膜浸入1mm的汞离子溶液中,加入50μμtpe-2t(双尿嘧啶修饰四苯基乙烯),其分子结构式如tpe-2t与汞离子在纳米孔道内结合为(tpe-2t-hg2+)n复合物结构。用和实施例1相同的方法进行跨膜电压测试,区别在于电解液为100mm的nano3和kno3混合液(ph7.9),结果如图5a所示,其中,方块线表示0时刻的跨膜电压,表示纳米孔通道为连通的;圆点线表示汞离子与tpe-2t(反应20min时的跨膜电压,此时电压明显下降。(3)将该pet薄膜分别浸入100nm、1μm、10μm、100μm以及1mm的汞离子溶液中,反应时间为2小时,得到的浓度-电流减小率检测曲线如图5b所示,浓度-荧光检测曲线如图5c所示;两种方法均可达到100nm的低检测限。(4)将该pet薄膜分别浸入1μm、10μm、100μm以及1mm的汞离子溶液中,加入50μμtpe-2t,反应时间为1小时,得到的浓度-电流减小率检测曲线如图6a所示。然后在纳米通道膜中加入1mm的s2-浸泡1小时破坏(tpe-2t-hg2+)n复合物结构,再将该pet薄膜分别浸入同样的汞离子浓度的溶液中,加入50μμtpe-2t,反应时间为1小时,得到的浓度-电流减小率检测曲线如图6b所示。用同样的方法再次破坏(tpe-2t-hg2+)n复合物结构,再将该pet薄膜分别浸入同样的汞离子浓度的溶液中,加入50μμtpe-2t,反应时间为1小时,得到的浓度-电流减小率检测曲线如图6c所示。可以看到,在循环使用纳米通道膜三次时,仍然能稳定实现汞离子的检测。图6d为3次循环检测1mm汞离子的电流和荧光的绝对值的变化曲线,其中横坐标表示时间和循环次数,圆点线表示电流,方块线表示荧光,可以更直观的看到,经历了三次循环后,电流以及荧光变化值仍然很显著。本领域的技术人员容易理解,以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1