同时检测血液中维生素A和25‑羟基维生素D的方法与流程
本发明涉及维生素检测
技术领域:
,尤其涉及一种同时检测血液中维生素A和25-羟基维生素D的方法。
背景技术:
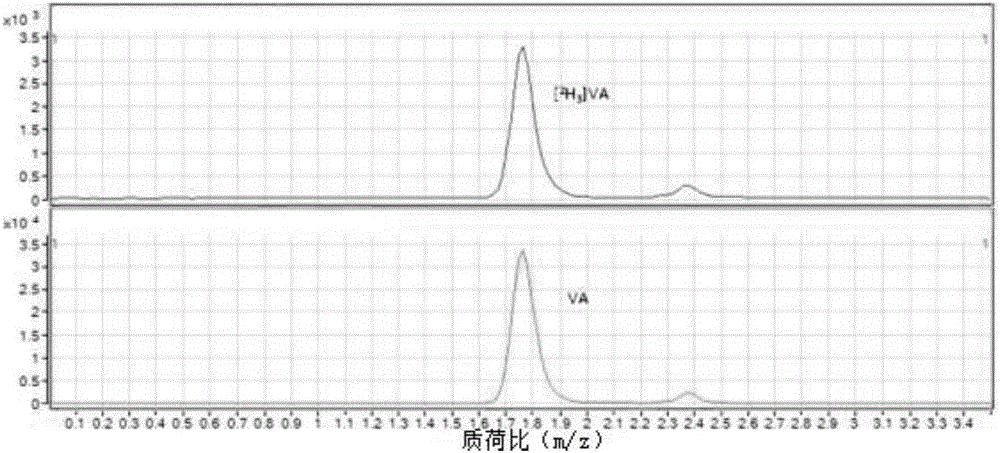
:维生素A(VA)是脂溶性的醇类物质,有多种分子形式,是最早被发现的维生素,其中维生素A1(VA1)主要存在于动物肝脏、血液和眼球的视网膜中,又叫视黄醇,熔点64℃,分子式C20H30O,见化学结构式(1);维生素A2(VA2)主要在淡水鱼中存在,熔点只有17~19℃,分子式C20H28O,又称视黄醛。维生素A是构成视觉细胞中感受弱光的视紫红质的组成成分,人体缺乏维生素A,影响暗适应能力,如儿童发育不良、皮肤干燥、干眼病、夜盲症,老年斑等。维生素D(vitaminD,简称VD)为固醇类衍生物,具抗佝偻病作用,又称抗佝偻病维生素。目前认为VD也是一种类固醇激素。VD均为不同的维生素D原(动物皮下的7-脱氢胆固醇,酵母细胞中的麦角固醇都是维生素D原)经紫外照射后的衍生物。VD家族成员中最重要的成员也是对健康关系较密切的D2(麦角钙化醇)和VD3(胆钙化醇)。它们有以下三点特性:它存在于部分天然食物中;人体皮下储存有从胆固醇生成的7-脱氢胆固醇,受紫外线的照射后,可转变为VD3。适当的日光浴足以满足人体对VD的需要,从食物中得来的VD,与脂肪一起吸收,吸收部位主要在空肠与回肠,胆汁帮助其吸收。吸收的VD与乳糜微粒相结合,由淋巴系统运输,但也可与VD运输蛋白(α-球蛋白部分)相结合在血浆中运输,有些与β-脂蛋白相结合,当VD运到肝脏中,在微粒体中经单氧酶系统作用,将其25位羟基化形成25-羟基维生素D(25-hydroxyvitaminD,简称25-(OH)VD),肝外的其他组织也可吸取VD及25-(OH)VD,因此组织中VD及25-(OH)VD及其总量比血浆中多。血浆中25-(OH)VD3在注射后1~3天达到高峰,其浓度可达到20~40ng/ml,最高可达80ng/ml。浓度与摄入量有一定的关系,小于4ng/ml,临床上可发生佝偻病及骨质软化。25-OH-VD3的经验分子式(希尔表示法)是C27H44O2,分子量400.64,见化学结构式(2)。25-OH-VD2的经验分子式(希尔表示法)是C28H44O2,分子量412.65,见化学结构式(3)。目前,测定维生素的方法包括分光光度法、层析法、气相色谱法、高效液相色谱法和液相色谱一串联质谱法等,其中,液相色谱法为测定维生素的首选方法。现有技术中对维生素的检测多采用高效液相色谱(HPLC)分离后与多波长吸收或联合吸收或荧光吸收相结合的检测方法,现有色谱方法或液相质谱检测方法存在特异性差、样品处理复杂导致样本处理期间维生素含量的变化、分析时间长,方法特异性差,整个检测过程时间长的问题,且用液相色谱一串联质谱法同时检测血液中维生素A和25-羟基维生素D文献很少。技术实现要素:针对上述技术问题,本发明的目的是提供一种同时检测血液中维生素A和25-羟基维生素D的方法,采用液相色谱串联质谱法同时测定血液中维生素A和25-羟基维生素D,该方法特异性强、准确度和灵敏度高、分析时间短。本发明采用的技术方案是:一种同时检测血液中维生素A(视黄醇)和25-羟基维生素D的方法,包括如下步骤:(一)将全血样本离心,取上清液得血清或血浆,备用;(二)标准溶液的标定:三个以上浓度的标准品的混合标准工作液200ul分别和10ul混合内标工作液涡旋混匀,制作标准曲线系列溶液;所述标准曲线系列溶液在检测前必须进行紫外分光光度计重新标定维生素A(视黄醇)的准确浓度;所述标准品为视黄醇、25-羟基维生素D2和25-羟基维生素D3,所述混合内标工作液为维生素A同位素内标和25-羟基维生素D同位素内标的混合液;(三)样品前处理:(1)精密移取步骤(二)中所述混合内标工作液加入到步骤(一)中所述血清或血浆中,涡旋混匀;(2)再加入纯水或甲酸水稀释后加入乙醇、甲醇或乙腈溶液,涡旋混匀后高速离心;(3)再加入正己烷萃取,涡旋混匀后离心;(4)然后取上清液后常温N2吹干;(5)加复溶液,涡旋混匀,超声,高速离心后取上清液样品待测;(四)取步骤(三)中处理后的待测上清液样品80μL放入自动进样瓶中经液相色谱串联质谱法进行分析,同时定量检测血液中维生素A和25-羟基维生素D的含量;液相色谱条件:色谱柱:ZORBAXXDBC82.1*50mm5μm;等度或梯度洗脱:流动相为甲醇和水,甲醇和水均含体积比为0.1%甲酸分析时间:4min;柱温:25℃;进样量:20μl;流速:0.35ml/min;串联质谱条件:采用电喷雾离子源ESI或大气压化学离子源APCI,正离子模式,选择反应监测模式,雾化气温度:350℃;雾化气气流:6L/min;雾化气压:35psi;毛细管电压:4500v;DeltaEMV(+):300。本发明所述的同时检测血液中维生素A(视黄醇)和25-羟基维生素D的方法,其中,步骤(二)中25-羟基维生素D包括25-羟基维生素D2和25-羟基维生素D3,所述视黄醇、25-羟基维生素D2和25-羟基维生素D3的同位素内标分别为[2H3]视黄醇、[2H3]25-OH-VD2和[2H6]25-OH-VD3。本发明所述的同时检测血液中维生素A(视黄醇)和25-羟基维生素D的方法,其中,步骤(三)中所述血清、乙醇和正己烷的体积比为1:1:6。本发明所述的同时检测血液中维生素A(视黄醇)和25-羟基维生素D的方法,其中,步骤(二)中标准溶液的标定,包括以下步骤:(1)维生素A的标准工作液的制备:制备浓度分别为0.014mg/L、0.028mg/L、0.056mg/L、0.113mg/L、0.225mg/L、0.45mg/L和0.90mg/L的维生素A标准工作液;(2)25-羟基维生素D的标准工作液的制备:25-OH-VD2的浓度分别为1.5ng/ml,2.5ng/ml,5ng/ml,10ng/ml,20ng/ml,40ng/ml,80ng/ml,160ng/ml和320ng/ml;25-OH-VD3的浓度分别为1.5ng/ml,2.5ng/ml,5ng/ml,10ng/ml,20ng/ml,40ng/ml,80ng/ml,160ng/ml和320ng/ml;(3)混合内标工作液的配制:制备含有400ng/ml的[2H3]视黄醇、73.5ng/ml的[2H3]25-OH-VD2和108.5ng/ml的[2H6]25-OH-VD3混合内标工作液。本发明所述的同时检测血液中维生素A(视黄醇)和25-羟基维生素D的方法,其中,步骤(四)中所述流动相中甲醇和水的体积比为87:13。本发明所述的同时检测血液中维生素A(视黄醇)和25-羟基维生素D的方法,其中,步骤(5)中所述复溶液为甲醇、乙醇或乙腈。本发明所述的同时检测血液中维生素A(视黄醇)和25-羟基维生素D的方法,其中,步骤(一)中离心速度为3500-4000r/min,离心时间为10-15min。本发明所述的同时检测血液中维生素A(视黄醇)和25-羟基维生素D的方法,特异性强、准确度和灵敏度高、前处理过程简单且仪器分析时间短,为临床上诊断血液中维生素A和维生素D的缺乏或过量提供了可靠的实验依据,为干眼病、儿童反复呼吸道感染、佝偻病、产前诊断及优生优育等提供了可靠的临床数据。本发明所述的同时检测血液中维生素A(视黄醇)和25-羟基维生素D的方法能够大幅度提高加样回收率,从而大大提高检测结果的准确度,消除系统误差;以同位素内标为内标,使得目标化合物的识别更为准确,特异性高,定量结果准确。附图说明图1为维生素A(视黄醇)及其同位素内标的标准溶液的总离子流图;图2为维生素A(视黄醇)及其同位素内标的标准溶液的色谱图;图3为维生素A(视黄醇)及其同位素内标的标准溶液的质谱图;图4为25-羟基维生素D及其同位素内标的标准溶液的总离子流图;图5为25-羟基维生素D及其同位素内标的标准溶液的色谱图;图6为25-羟基维生素D及其同位素内标的标准溶液的质谱图;图7为血清样本中维生素A(视黄醇)、25-羟基维生素D及其同位素内标的总离子流图;图8为血清样本中维生素A(视黄醇)、25-羟基维生素D及其同位素内标的色谱图;图9为血清样本中维生素A(视黄醇)、25-羟基维生素D及其同位素内标的质谱图。下面将结合具体实施例和附图对本发明作进一步说明。具体实施方式一种同时检测血液中维生素A和25-羟基维生素D的方法,包括以下步骤:(一)将全血样本离心,离心速度为3500r/min,离心时间为10min,取上清液得血清,所述血清置于4℃-8℃冷藏避光条件下保存(24h内)至分析前备用,或置于-20℃冷冻避光条件下(避免反复冻融)保存(72h内)至分析前备用,或置于-80℃冷冻避光条件下(避免反复冻融)保存(30天内)至分析前备用;(二)标准溶液的标定七种不同浓度的标准品的混合标准工作液200ul分别和10ul混合内标工作液以1500r/min涡旋混匀30s,充分混匀,制作标准曲线系列溶液;所述标准曲线系列溶液在检测前必须进行紫外分光光度计重新标定维生素A(视黄醇)的准确浓度;所述标准品为视黄醇、25-羟基维生素D2和25-羟基维生素D3,所述混合内标工作液为维生素A同位素内标和25-羟基维生素D同位素内标的混合液,所述标准曲线系列溶液经液相色谱法分析,绘制标准曲线;(1)维生素A(视黄醇)的标准工作液的制备:a.维生素A标准储备液的配制:精确称取视黄醇标准品10mg,置于10ml容量瓶,用乙醇溶解,并定容于10ml,得到维生素A标准储备液,-80℃避光(避免反复冻融)条件下保存,有效期3个月。b.维生素A标准校正液的配制:移取维生素A标准储备液20μL,置于5ml容量瓶中,用无水乙醇定容,混匀,用紫外分光光度计重新标定其浓度,在325nm波长下测定吸光值,结合标准比吸光系数,按照公式(1)和(2)计算出维生素A标准储备液的实际浓度,维生素A的1%比吸光系数为1835。避光操作。采用以下公式(1)(2)计算:稀释倍数=10000*5ml/20μl………………………(2)式中:CX—待标定的标准溶液的实际浓度值;g/100mLA—给定波长处测定的待标定标准溶液的吸光度平均值;E—待标定标准溶液的1%比吸光系数。c.维生素A标准工作液的配制:将维生素A标准储备液稀释得到的浓度为1.8mg/L的溶液用乙醇等比稀释,得到浓度分别为0.014mg/L、0.028mg/L、0.056mg/L、0.113mg/L、0.225mg/L、0.45mg/L和0.90mg/L的维生素A标准工作液,-80℃避光(避免反复冻融)条件下保存,有效期3个月。(2)25-羟基维生素D的标准工作液的制备表125-羟基维生素D的标准品列表分别精密量取25-OH-VD2和25-OH-VD3标准品溶液100μl,标准品见表1,并分别用甲醇-水(V:V=70:30)溶液稀释至1.0ml,分别作为25-OH-VD2标准储备液和25-OH-VD3标准储备液,同时将25-OH-VD2标准储备液和25-OH-VD3标准储备液混合稀释得到25-羟基维生素D的标准工作液,其中,25-OH-VD2的浓度分别为1.5ng/ml,2.5ng/ml,5ng/ml,10ng/ml,20ng/ml,40ng/ml,80ng/ml,160ng/ml和320ng/ml;25-OH-VD3的浓度分别为1.5ng/ml,2.5ng/ml,5ng/ml,10ng/ml,20ng/ml,40ng/ml,80ng/ml,160ng/ml和320ng/ml,备用。(3)混合内标工作液的配制a.维生素A(视黄醇)同位素内标的标准储备液的配制:精确称取维生素A同位素内标[2H3]视黄醇2mg,置于10ml容量瓶,用乙醇溶解,并定容于10ml,得到维生素A同位素内标的标准储备液(浓度为200ug/ml),-80℃避光(避免反复冻融)条件下保存,有效期3个月。b.5-羟基维生素D同位素内标的混合标准工作液的配制:表225-羟基维生素D同位素内标的标准品列表精密量取25-羟基维生素D2同位素内标[2H3]25-OH-VD2的标准品溶液50μl,标准品见表2,用甲醇-水(V:V=70:30)溶液稀释至1.0ml,作为[2H3]25-OH-VD2的标准储备液(浓度为4.9ug/mL)。精密称量25-羟基维生素D3同位素内标[2H6]25-OH-VD3的标准品0.5mg,用甲醇-水(V:V=70:30)溶液溶解并稀释至10ml,从该溶液中精密量取220μl,用甲醇-水(V:V=70:30)溶液稀释至5ml,作为[2H6]25-OH-VD3的标准储备液(浓度为2.17ug/mL)。c.维生素A同位素内标和25-羟基维生素D同位素内标的混合内标工作液的配制:精密量取[2H3]视黄醇的标准储备液5ul,加入甲醇-水(V:V=70:30)溶液稀释至500ul得到浓度为2000ng/ml的[2H3]视黄醇溶液。精密量取400ul浓度为2000ng/ml的[2H3]视黄醇溶液、30ul[2H3]25-OH-VD2的标准储备液和100ul[2H6]25-OH-VD3的标准储备液混合后加入甲醇-水(V:V=70:30)溶液稀释,分别得到含有浓度为400ng/ml的[2H3]视黄醇、73.5ng/ml的[2H3]25-OH-VD2和108.5ng/ml的[2H6]25-OH-VD3的混合内标工作溶液。-80℃避光(避免反复冻融)条件下保存,有效期3个月。(三)样品前处理(1)精密移取10ul混合内标工作液于2ml离心管中,加入200ul步骤(1)中所述血清,1500r/min涡旋混匀30秒;(2)再加入200ul乙醇于上述离心管中,2000r/min涡旋混匀3min,去除蛋白;(3)再加入1200ul正己烷,2500r/min涡旋混匀5min,以达到充分萃取的目的,然后12000r/min高速离心10min;(4)然后移取1000μl上清液到2ml离心管中,常温下氮气缓慢吹干,(5)加入100μl复溶液,所述复溶液为甲醇、乙醇或乙腈,2000r/min涡旋混匀1min,超声1min,12000r/min高速离心3min,得到处理后取上清液待测;(四)取步骤(2)中处理后的上清液80μL放入自动进样瓶中经液相色谱串联质谱法进行分析,同时定量检测血液中维生素A(视黄醇)和25-羟基维生素D(25-羟基维生素D2、25-羟基维生素D3),所述液相色谱串联质谱测定条件如下:色谱柱:ZORBAXXDBC82.1*50mm5μm;等度洗脱:流动相87v%甲醇-13v%水,甲醇和水均含体积比为0.1v%的甲酸;分析时间:4min;柱温:25℃;进样量:20μl;流速:0.35ml/min;质谱参数(或LC检测波长):采用电喷雾离子源ESI或大气压化学离子源APCI,正离子模式,选择反应监测模式,雾化气温度:350℃;雾化气气流:6L/min;雾化气压:35psi;毛细管电压:4500v;DeltaEMV(+):300。本实施例中技术方法论证如下:一、该方法的线性关系将上述配制的200μl的各个浓度的维生素A标准工作液和25-羟基维生素D标准工作液进行混合,再加10μl混合内标工作液,混匀30s,加入80μl复溶液,混匀进样20μl,按本实施例测定条件浓度由低到高进行测定,以定量离子峰面积一浓度作图,得到标准曲线,结果表明维生素A、25-OH-VD2和25-OH-VD3的线性范围如下:维生素A在0.1mg/L到4.0mg/L范围内,线性良好,相关系数R2﹥0.995;25-OH-VD2在1.4ng/mL到340.0ng/mL范围内,线性良好,相关系数R2﹥0.995;25-OH-VD3在1.4ng/mL到340.0ng/mL范围内,线性良好,相关系数R2﹥0.995。二、该方法的回收率和精密度分别取维生素A和维生素D标准工作液配制成高、中、低3种浓度进行加样回收率和精密度实验,按本实施例方法进行测定,重复分析测定6批次,维生素A和维生素D的回收率和精密度分别如表3和表4,维生素D为25-羟基维生素D2和25-羟基维生素D3。由表3可见,维生素A:低、中、高三个浓度的加样回收率均在90%-95%之间;由表4可见,25-OH-VD:低、中、高三个浓度的加样回收率均在90%-105%之间,大幅度提高了加样回收率,从而大大提高检测结果的准确度,消除系统误差。表3.维生素A加样回收率和精密度加标样本浓度0.60mg/L2.38mg/L4.76mg/L平均回收率92.1%94.0%90.3%精密度RSD1.02%2.74%4.35%表4.25-OH-VD加样回收率维生素A(视黄醇)及其同位素内标的标准溶液的总离子流图、色谱图和质谱图分别如图1、图2和图3所示,维生素A的标准溶液的保留时间为1.77min(见图2);25-羟基维生素D及其同位素内标的标准溶液的总离子流图、色谱图和质谱图分别如图4、图5和图6所示,25-OH-VD2和25-OH-VD3的标准溶液的保留时间分别为1.71min和1.67min(见图5);血清样本中维生素A(视黄醇)、25-羟基维生素D及其同位素内标的总离子流图、色谱图和质谱图分别如图7、图8和图9所示。由图1-图9可见,血清样本中的维生素A、25-OH-VD2和25-OH-VD3的保留时间和相对丰度均与其标准工作溶液一致,该方法的特异性强、准确度和灵敏度高,以同位素内标为内标,使得目标化合物的识别更为准确,特异性高,定量结果准确。以上所述的实施例仅仅是对本发明的优选实施方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案作出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1