一种筛选活性成分和活性组合物的方法与流程
本发明涉及高通量筛选领域,具体涉及一种基于生物化学反应发现活性成分以及活性组合物的方法。
背景技术:
据统计,从1981年到2010年的30年间,约有34%的新药来源于天然产物。作为天然产物在临床使用的一个重要来源,中药在几千年的历史长河中对中国人民的医疗保健起着十分重要的作用。尤其在治疗复杂的慢性疾病方面,中药疗效良好且副作用较低,这使得越来越多的人意识到从中药中寻找潜在的生物活性物质很可能会提高药物发现的速率和效率。
建立一种高效快速的筛选方法找到中药中的生物活性成分对于新药的研发具有十分重要的意义。传统发现中药活性成分的方法是在中药化学成分提取、分离和结构鉴定基础上,利用分子和细胞、离体器官和组织、整体动物等药理模型对得到的单体化合物进行生物活性测试。该方法利用各种提取分离技术(如薄层色谱、低中压柱色谱、逆流色谱、制备色谱法)分离制备中药中的各种成分,经药理活性测试后确定其有效成分,操作繁琐,周期长,最后分离得到的化合物可能没有活性或不是所需要的,是一种命中率较低的筛选方法。将中药天然产物库和高通量筛选技术集成,应用高通量筛选模型对中药化合物库进行筛选的方法已成为目前创新药物的重要技术手段之一。高通量筛选技术是将多种技术方法有机结合而形成的新的技术体系,它以分子水平和细胞水平的实验方法为基础,以微板形式作为实验工具载体,以自动化操作系统进行实验过程,以灵敏快速的检测仪器釆集实验数据,实现了较短时间内对数以千、万计的样品进行活性评价,并以相应的数据库支持整个技术体系的正常运转。高通量筛选技术由于其快速、高效、分析样本量大等特点,在寻找新的活性化合物方面有非常的优势。
此外,不同于西药“单一药物作用于单一靶点”的作用模式,中药发挥疗效是其中多个功能组分的整体表现,是多成分、多靶点协同作用的结果。
中药具有多成分组成,多靶点治疗的特色。随着科学的进步,人们对于中药的认识发生了一定的改变,越来越多的研究者意识到,中药发挥药效并不是单个成分作用的简单叠加,多成分彼此之间存在某种作用关系,或加和或协同或拮抗,它们可作用于多个靶点相互影响,从整体上发挥药效。因此,建立某种方法发现具有协同作用的药物组合对于新药的研发具有非常重要的意义。
本发明要解决的问题在于:建立一种基于在线生物化学反应的集生物活性成分的发现、分离与鉴定于一体,同时也能用于探究多成分间相互作用的筛选方法。
技术方案
本发明涉及一种筛选活性成分的方法,其特征是,步骤如下:
(1)将准备好的样品自动进样,在一定的洗脱条件下分离待测物,同时补偿泵调节洗脱液中的有机相,使之维持在一个恒定的范围内;调节后的洗脱液流经酶泵,在第一个反应线圈中与酶溶液相互作用;然后混合液经过底物泵,在第二个反应线圈中酶催化底物,观察产物吸收波长(470nm)下是否有倒峰生成,实现活性成分的分离及筛选;
待测物的分离以及洗脱液补偿的有机溶剂可以是甲醇、或、乙腈;
待测物可以是单体化合物、由单体组成的组合物、天然产物提取物、或、中药复方提取物;
参与反应的酶是以过氧化氢为底物,以愈创木酚为显色剂,含有血红素的过氧化物酶家族中的一员,来源可以是动物、植物、或、微生物;
(2)利用质谱技术对活性成分进行结构鉴定;
(3)围绕活性成分自由组合,利用在线装置探究其作用关系。
本发明涉及的方法,其特征在于,分离泵和补偿泵的流速一般一致,可以是0.2~0.5mL/min;优选地,流速为0.25mL/min。
本发明涉及的方法,其特征在于,用于样品分离和洗脱液补偿的水相溶剂可以是纯水、或、酸水溶液,酸水溶液可以是pH为1-3的甲酸、或、乙酸。
本发明涉及的方法,其特征在于,第二个反应线圈的长度可以是40~120cm;优选地,反应线圈2的长度为100cm;反应线圈2的内径可以是0.5~0.8mm;优选地,反应线圈2的内径是0.8mm。
本发明涉及的方法,其特征在于,酶的浓度可以是0.5~2.5U/mL;优选地,酶溶液的浓度为2U/mL。
本发明涉及的方法,其特征在于,底物过氧化氢和显色剂愈创木酚的浓度可以是0.5~25mM;优选地,底物过氧化氢和显色剂愈创木酚的浓度均为25mM。
本发明涉及的方法,其特征在于,用0.2mol/L pH 6.0的磷酸盐缓冲液溶解酶和底物、显色剂。
本发明涉及的方法,其特征在于,待测化合物可以是表没食子儿茶素没食子酸酯(EGCG)、表没食子儿茶素(EGC)、表儿茶素没食子酸酯(ECG)、杨梅素、丹参素、紫草酸、原儿茶醛、丹酚酸B、丹酚酸D、或、迷迭香酸中的一种、或、几种,也可以是含有这些成分的中药提取物、或、中药复方提取物。
本发明涉及的方法,其特征在于,组合物可以是上一条特征中提及的任意两种、或、多种单体成分的组合。
本发明涉及的仪器:在运用在线装置实现活性成分筛选的过程中,待测物经过液相分离后直接与泵入装置中的酶以及底物发生反应。考虑到成分洗脱时流动相中含有的有机溶剂会影响酶活性,在化合物参与生物活性测定之前需要有一个流动相补偿体系来调节洗脱液中有机溶剂的含量,以确保反应顺利进行。因此,整套在线装置由Agilent液相的7个模块构成,涉及的仪器包括1个自动进样器(1100系列),1个柱温箱(1100系列),1个多波长DAD检测器(1100系列)以及4个高效液相泵(二元泵或四元泵),这些泵分别用于实现待测物的分离、流动相的补偿,提供酶以及底物。
附图说明
图1:实施例1中EGCG在不同浓度下对过氧化物酶的抑制作用。
图2:实施例2中运用在线装置筛选待测混合物中抑制过氧化物酶的活性成分。
图3:实施例2中过氧化物酶样品和空白样品分别与待测混合物孵育、超滤后的高效液相色谱图。
图4:实施例3中运用在线装置筛选丹参水提取物中抑制过氧化物酶的有效物质。
图5:实施例4中运用在线装置探究EGCG与EGC之间对过氧化物酶的相互作用。
图6:实施例6中探究待测物分离体系内有机溶剂对过氧化物酶活性的影响。
图7:实施例6中考察分离流速对产物峰响应程度的影响。
图8:实施例7中基于在线生物化学反应筛选活性成分的装置图。
进一步的具体解释
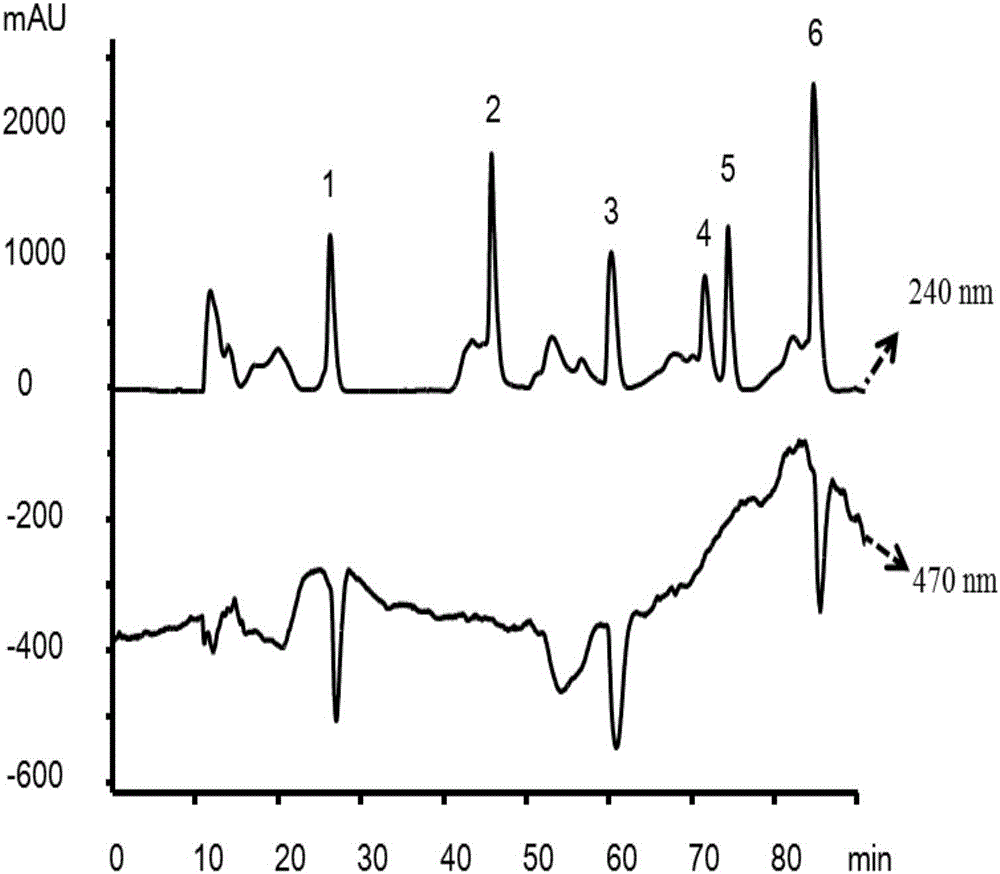
图2其中,峰1是EGC,峰2是芍药苷,峰3是ECG,峰4是柚皮苷,峰5是橙皮苷,峰6是杨梅素。
图3其中,虚线示空白样品与待测混合物孵育、超滤后的高效液相色谱图,实线示过氧化物酶与待测混合物孵育、超滤后的高效液相色谱图。其中,峰1是EGC,峰3是ECG,峰4是柚皮苷,峰5是橙皮苷,峰6是杨梅素。
图5其中,符号“*”代表显著性差异值P<0.05;符号“#”代表显著性差异值P<0.01。
具体实施方式
下面结合实施例对本发明的具体实施方式进行描述,更好地理解本发明,本发明不受具体实施方式的限制。
实施例1
测定表没食子儿茶素没食子酸酯(EGCG)对过氧化物酶的作用
试剂与耗材:乙腈、甲酸(HPLC级,德国Merck公司);Agilent ZorBax SB-C18分析柱,规格为250×4.6mm,5μm(美国Agilent公司);过氧化物酶(华中海威基因科技有限公司)、愈创木酚(阿拉丁试剂(上海)有限公司)、DMSO(美国Sigma公司)、磷酸二氢钠、磷酸氢二钠、30%的过氧化氢溶液(江苏南京化学试剂有限公司)
0.2mol/L pH 6.0的磷酸盐缓冲液(PBS缓冲液)的配制:
A液:精密称取磷酸二氢钠(NaH2PO4·2H2O)31.2g,加入1000mL超纯水超声溶解。
B液:精密称取磷酸氢二钠(Na2HPO4·12H2O)14.34g,加入200mL超纯水超声溶解。
取877mL A液与123mL B液充分混匀即可获得0.2mol/L pH 6.0的PBS缓冲液,置于4℃冰箱中保存。
过氧化物酶溶液的制备:
过氧化物酶冻干粉3000U(来源于辣根,type-VI),用1mL PBS缓冲液溶解,浓度为3000U/mL,分装后置于-20℃冰箱保存。每次使用前用PBS缓冲液稀释至2U/mL。
底物及显色剂溶液的配制:
取200mL PBS缓冲液于250mL的烧杯中,加入560μL愈创木酚,于磁力搅拌器上加热搅拌。待愈创木酚完全溶解后,置于4℃冰箱冷却过夜。隔天向其中加入500μL 30%的过氧化氢溶液,充分混合。混合液中过氧化氢及愈创木酚的浓度均为25mM。混合液置于4℃冰箱中保存。
EGCG溶液的配制:
精密称取一定量的EGCG,用DMSO溶液溶解,配成100mM的母液,置于-20℃冰箱保存。
运用在线装置检测EGCG对过氧化物酶的作用:
取一定量的100mM的EGCG溶液,用PBS溶解至初浓度为2mM,并依次对半稀释5次。在不接色谱柱,直接用二通阀连接仪器的情况下将6个浓度梯度变化的待测液依次进样。其中,进样量50μL,分离泵以0.25mL/min的流速,0.1%甲酸水-乙腈10:90的梯度等度洗脱3min,补偿泵以相同的流速,纯水-纯乙腈40:60的梯度持续调节装置内有机相的比例。酶和底物则以0.1mL/min的流速持续泵入装置。柱温25℃,检测波长240和270nm。若待测物对过氧化物酶有抑制作用,它与酶混合时会降低酶的活性,减少产物的生成,在化合物对应的色谱峰位置产物吸收波长470nm下形成倒峰。
检测结果:
EGCG作用于过氧化物酶后在470nm下有倒峰生成,且倒峰程度与EGCG的浓度正相关,表明EGCG对过氧化物酶有抑制作用(见附图1)。计算6个浓度下EGCG对过氧化物酶的抑制率,利用软件模拟其作用曲线,测得EGCG的IC50为13.69μM。
酶标仪方法验证:
测定方法:
取100μL待测物与15μL的过氧化物酶(1U/mL)于96孔板中混合均匀,在室温下共同孵育10min,再向其中加入85μL的反应混合液(0.5mM),利用酶标仪(POLARstar Omega,德国BMG Labtech)测定470nm下吸光度的变化。空白对照组以PBS缓冲液代替待测物。
测定EGCG的抑制作用:
取一定量的100mM EGCG母液,用PBS缓冲液稀释至初浓度为100μM,再对半稀释5次,得到6个浓度梯度变化的EGCG溶液。用上述测定方法依次测定不同浓度下EGCG对过氧化物酶的作用。空白对照组以PBS缓冲液代替EGCG。
测定结果:
EGCG对过氧化物酶的抑制呈现浓度依赖性。根据不同浓度下的抑制率,用酶标仪测得EGCG的IC50值为19.18μM,与在线装置测定结果相近,初步证明了该在线装置用于检测过氧化物酶活性的有效性。
实施例2
比较在线装置和超滤对待测混合物的筛选
待测混合物组成:
表没食子儿茶素(EGC),表儿茶素没食子酸酯(ECG),芍药苷,杨梅素,橙皮苷,柚皮苷
待测混合液的配制:
每个物质精密称取一定量,用DMSO溶液溶解成100mM的母液。每个物质各取一定的量混合,再用PBS溶液稀释,使得待测混合液中每个物质的初浓度为5mM,用于在线筛选。此外,用相同的方法配制另一份待测混合液,使其中每个物质的初浓度为100μM,用于超滤筛选。
运用在线装置筛选待测混合液中抑制过氧化物酶的活性成分:
液相条件:
色谱柱:Agilent ZorBax SB-C18柱(4.6×250mm,5μm)。
柱温:25℃;
流动相:A相为0.1%甲酸水,B相为乙腈;
分离泵流速:0.25mL/min;
分离梯度:
0min,13%B;
12min,13%B;
20min,21%B;
50min,23%B;
65min,28%B;
77min,45%B;
90min,45%B。
补偿体系:A相为纯水,B相为乙腈;
补偿泵流速:0.25mL/min;
补偿梯度:
0min,37%B;
12min,37%B;
20min,29%B;
50min,27%B;
65min,22%B;
77min,5%B;
90min,5%B。
酶泵:0.1mL/min
底物泵:0.1mL/min:
进样量:50μL;检测波长:240nm及470nm。
运用Agilent 1260液相系统偶联飞行时间串联质谱(HPLC-TOF/MS)进行结构鉴定:
液相条件:进样量5μL,检测波长240nm,其余洗脱条件与在线筛选的分离条件一致。
质谱条件:ESI离子源:负离子模式;质量范围:200~800;毛细管电压(Capillary voltage):3500V;干燥气(N2)流速:10.0L/min;干燥气温度(Drying gas temperature):330℃;雾化气压力(Nebulizer):35psig;裂解电压(Fragmentor):120~420V。
筛选结果:6个化合物中有3个成分对过氧化物酶有抑制作用,分别对应色谱峰1,3和6,其余3个化合物没有作用(见附图2)。通过质谱数据以及标准品比对,这3个活性物质分别是表没食子儿茶素(EGC,色谱峰1),表儿茶素没食子酸酯(ECG,色谱峰3)及杨梅素(色谱峰6)。
运用在线装置进一步测定EGC、ECG以及杨梅素抑制过氧化物酶的IC50值,分别为32.72,34.72及25.66μM。
超滤偶联液质技术筛选待测混合物中的过氧化物酶抑制剂:
实验组:2μL的待测混合液(初浓度100μM)与30μL过氧化物酶(浓度3000U/mL)混合,再加入PBS缓冲液使得溶液总体积为100μL。酶溶液与待测混合物在37℃恒温箱中孵育30min,然后转移至截留分子量为10KDa的YM-10型超滤管中。在13000r/min的转速下离心20min,移除反应体系内不与酶作用的成分。再加入200μL的PBS缓冲液,13000r/min下离心20min清洗靶标-配体复合物,重复操作3次。最后加入200μL甲醇-水混合液(体积比为1:1),超声15min使酶失活,13000r/min下离心20min释放结合的配体。运用液质技术检测收集的洗脱液。
对照组:用等体积的PBS缓冲液替代过氧化物酶,其余操作同实验组。
空白组:用等体积的PBS缓冲液替代过氧化物酶,在不超滤的情况下直接用液质技术进行检测。
运用Agilent 1290液相系统偶联三重四级杆质谱测定解离下的洗脱液:
液相条件:与HPLC-TOF/MS质谱鉴定的液相条件一致。
质谱条件:ESI离子源:负离子模式;筛选模式:SIM模式;毛细管电压(Capillary voltage):3500V;干燥气(N2)流速:3.0L/min;干燥气温度(Drying gas temperature):300℃;雾化气压力(Nebulizer):15psig;裂解电压(Fragmentor):135V。各成分的离子质荷比分别是:柚皮苷,579.4;橙皮苷,609.4;杨梅素,317.1;表没食子儿茶素(EGC),305.1;芍药苷,449.4;表儿茶素没食子酸酯(ECG),441.3。
实验结果:对比实验组和对照组的质谱图,除了芍药苷(色谱峰2),其他5个物质均能够被检测到,表明这5个成分均能结合与氧化物酶(见附图3),与在线装置筛选结果不一致。
酶标仪方法验证:
从化合物单体的100mM母液中取一定的量,用PBS缓冲液稀释至初浓度为1000μM,再对半稀释8次,得到9个浓度梯度变化的待测液。依次测定这6个化合物在不同浓度下对过氧化物酶的作用。测定方法同实施例1。
测定结果:6个成分中只有EGC、ECG以及杨梅素对过氧化物酶表现出抑制作用,芍药苷,橙皮苷及柚皮苷对过氧化物酶没有影响。这一结果与在线装置的筛选结果相吻合。用酶标仪测得EGC、ECG以及杨梅素抑制过氧化物酶的IC50值分别为45.23,29.10和28.11μM,与在线装置测得的数据接近。
对比这两种方法筛选结果,发现基于生化反应的在线筛选在提高筛选的准确率,减少假阳性结果方面较超滤更有优势,也进一步表现出在线装置筛选结果的可靠性。
实施例3
运用在线装置筛选丹参水提物中抑制过氧化物酶的活性成分
丹参水溶性提取物的制备:
称取丹参药材粉末25g,加200mL超纯水,加热回流1h。过滤,滤液用40%的氢氧化钠溶液调节pH值至9左右,然后再加热回流1h。过滤,滤液用冻干机冻干,密封后于-20℃冰箱中保存。
在线筛选:
精密称取一定量的水溶性提取物冻干粉末,用纯水溶解至1mg/mL,离心后取上清进样100μL。
色谱分析条件:
分离梯度:
0min,22%B;
25min,22%B;
40min,23%B;
55min,24%B;
67min,27%B;
77min,33%B。
补偿梯度:
0min,28%B;
25min,28%B;
40min,27%B;
55min,26%B;
67min,23%B;
77min,17%B。
其余液相条件与实施例2中在线筛选液相条件一致。
运用Agilent 1290液相系统偶联四级杆-飞行时间串联质谱进行结构鉴定:
液相条件:进样量5μL,检测波长240nm,其余洗脱条件与丹参水提物在线筛选的分离条件一致。
质谱条件:电喷雾负离子模式下采集数据,质量扫描范围为m/z 100~1000,毛细管电压3500V,雾化气压力35psig,干燥气流速10L/min,干燥气温度325℃,Skimmer 65V,二级碰撞能量为20、40、60、80eV。
筛选结果:
丹参水提物在该洗脱条件下分离出10个成分峰,除了色谱峰3(咖啡酸)在对应的生物活性色谱图中未出现倒峰,其余9个成分皆引起倒峰(见附图4)。通过对比标准品,色谱峰1,2,4,7,8,9分别为丹参素,原儿茶醛,丹酚酸D,迷迭香酸,紫草酸以及丹酚酸B。色谱峰5,6,10因为缺少标准品,只能对比文献数据,暂定为丹酚酸I,丹酚酸E以及丹酚酸L。各成分具体的离子碎片详见表1。
利用在线装置测得丹参素,原儿茶醛,丹酚酸D,迷迭香酸,紫草酸以及丹酚酸B抑制过氧化物酶的IC50值分别为104.4,49.66,48.97,50.45,53.39和36.85μM。
酶标仪方法验证:
精密称取一定量的丹参素,原儿茶醛,咖啡酸、丹酚酸D,迷迭香酸,紫草酸以及丹酚酸B,DMSO溶解成100mM母液,吸取一定量后再用PBS缓冲液稀释至初浓度为1000μM,对半稀释8次,每个化合物得到9个浓度梯度变化的溶液,依次测定这7个化合物在不同浓度下对过氧化物酶的作用。测定方法同实施例1。
测定结果:
丹参素,原儿茶醛,丹酚酸D,迷迭香酸,紫草酸以及丹酚酸B均能够抑制过氧化物酶,且IC50值分别为111.03,59.17,68.69,47.74,36.97和37.90μM。咖啡酸对过氧化物酶几乎没有作用,整体的结果与在线筛选结果一致,体现了该方法应用于中药活性成分筛选的有效性。
表1丹参水溶性提取物中各成分的结构鉴定
实施例4
检测多成分之间的相互作用
本实施例将围绕过氧化物酶,用建立的在线装置测定表没食子儿茶素没食子酸酯(EGCG)和表没食子儿茶素(EGC)之间的相互作用。
检测方法:EGCG和EGC按1∶5、1∶2、1∶1、2∶1、5∶1、10∶1和20∶1的物质的量混合。在不接色谱柱,用二通阀连接仪器的情况下将这7组混合物依次进样,对形成的倒峰面积进行积分并记录。对于不同组合中的EGCG和EGC也分别单独进样,记录引起的倒峰面积。液相条件同实施例1。利用GraphPad prism软件,对两个单体引起的倒峰面积之和与它们的混合物引起的倒峰面积进行T检验。
检测结果:
在不同比例下,混合物引起的倒峰面积都要显著大于两个单体作用产生的倒峰面积之和,即这两个成分混合后对过氧化物酶的抑制效果要明显强于两个单体的作用之和,说明EGCG和EGC在抑制过氧化物酶时存在一种协同关系(见附图5)。
酶标仪方法验证:
以结合指数(Combination Index,CI)作为指标(CI=1,加和关系;CI>1,拮抗关系;CI<1,协同关系),运用酶标仪方法进行验证。根据上述7种不同混合比例配制母液,再加入PBS对半稀释8次,每个混合比例下得到一系列浓度梯度变化的待测液。利用实施例1中的测定方法,测定不同混合比例下EGCG和EGC混合物的IC50值。再利用相关软件计算CI值。
检测结果:
不同比例下混合物的CI值都小于1,表明这两个成分在抑制过氧化物酶上存在协同作用,与在线装置的检测结论一致,体现了该方法用于发现药物协同组合的可行性。
实施例5
检测丹参水提取物中多成分之间的相互作用
检测过程:
将紫草酸与丹酚酸B分别与丹参素组合,测定它们之间的相互作用关系。每对组合的测定方法同实施例4一致。
检测结果:
当紫草酸和丹酚酸B分别与丹参素组合时,在不同混合比例下,混合物引起的倒峰面积与该组合中两单独成分引起的倒峰面积之和没有显著性差异,表明丹参素-紫草酸、丹参素-丹酚酸B这2对药物组合对过氧化氢酶的抑制存在一种加和的效应。
酶标仪方法验证:
检测操作如实施例4中所述酶标仪验证的方法。
检测结果:
如表2所示,药物组合丹参素-紫草酸、丹参素-丹酚酸B在不同混合比例下,CI值都在1±0.1的范围内,表征了一种加和效应。该结果与在线装置的检测结果一致,体现了该方法具有初步分析多成分之间相互作用关系的潜力。
表2酶标仪测定3对组合在不同比例下的CI值
实施例6
对洗脱条件进行考察及优化
在酶催化反应中,酶具有较高的活性,且与底物有足够的反应时间是反应顺利进行的两个必要因素。在该筛选方法中,待测物分离后直接进行生物活性检测。由于待测物分离体系中的流动相含有有机溶剂,会对酶活性产生一定的抑制作用,影响催化反应。此外,为了使酶与底物有足够的反应时间,整个体系中的流速都应该尽可能的小,但是流速过低不利于化合物的良好分离。因此,选择合适的有机溶剂以及分离流速有助于准确地找到活性成分。
有机溶剂的优化
当有机溶剂含量为0时,酶视为具有正常活性,470nm基线上升到最高点。当洗脱液中有机溶剂含量很高时能够使酶发生不可逆的失活,酶视为被完全抑制,470nm基线下降到最低点。最高点和最低点间存在一个吸光度响应变化,这个变化值即可表征酶在正常活性下催化底物完全生成的产物量。基于此,对分离体系中的不同有机相进行考察。
考察对象:液相分离中最常使用的有机溶剂——甲醇和乙腈
操作过程:
在不接色谱柱,不连补偿泵,用二通阀连接仪器的情况下,设定某一初始梯度,平衡液相,走空针。
分离梯度为:
0min,初始梯度
5min,初始梯度;
6min,100%B;
18min,100%B。
记录470nm下吸光度响应变化值△A。
其余液相设置同实施例1。
有机相的初始比例分别设为0,10%,20%,30%,40%,50%,60%,70%,80%,90%以及100%,每个比例重复操作三遍。
根据公式:酶活性(%)=(△A/△A0)*100%(其中,△A0是指有机相初始比例为0时测得的吸光度响应变化值,△A指有机相初始比例为任一设定值时测得的吸光度响应变化值),计算不同有机溶剂在不同浓度下对酶活性的影响,并绘制有机溶剂浓度-酶活性关系图(如附图6)。
实验结果:比较甲醇和乙腈两种有机溶剂对过氧化物酶的影响,发现随着流动相中甲醇比例的增加,过氧化物酶活性降低地更快,即酶活性受到的损伤更大。当甲醇含量在10%左右时,过氧化物酶仅维持40%左右的活性。所以,待测物的分离选用乙腈作为有机相。
由于酶活性过低时催化作用也不明显,因此酶活力应不低于50%,此时它对应的乙腈在洗脱溶液中比例上限约为25%。由于待测物分离后会存在一个补偿体系,且补偿泵的流速和分离泵一致,因此分离时乙腈在流动相中所占的最高比例可达50%,从而也能够分离出更多的化合物。
分离流速的优化
操作过程:
在不接色谱柱,不连补偿泵,用二通阀连接仪器的情况下,设定某一初始流速,平衡液相,走空针。
分离梯度为:
0min,0%B;
5min,0%B;
6min,100%B;
18min,100%B。
记录470nm下吸光度的变化△A。其余液相设置同实施例1。
初始流速分别设置为0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9以及1.0mL/min,记录不同流速下测得的吸光度变化值,每个比例重复三遍,绘制流速-吸光度响应关系图(如附图7)。
实验结果:根据流速-吸光度响应关系图,吸光度变化值△A随着流速的增加而减少。由于实际操作中还会加入补偿体系,补偿流速和分离流速一致,因此分离流速应该要比较小。但流速过低时不易于待测物的分离,因此最终选择0.25mL/min为分离流速和补偿流速。
实施例7
在线装置的搭建
基于在线生物化学反应发现活性成分的原理,该筛选过程可视为3步:首先是待测物中化合物的分离;紧接着这些化合物在第一个反应线圈中依次与酶作用;最后含有化合物以及酶的混合液与底物接触,在第二个反应线圈中进行生物化学反应,利用多波长检测器检测反应产物的变化,从而找到活性成分。为了尽可能的避免高浓度的有机溶剂对酶活性的影响,需要在催化反应发生前加入一个补偿体系。
作为一种使化合物分离与生物活性检测一体化的筛选方法,相比常规分离液相,在线装置对仪器设备的要求更高,设备搭建也更加复杂。总体上,整套在线装置需要的仪器设备包括1个自动进样器,1个柱温箱,1个多波长DAD检测器以及4个高效液相泵(二元泵或四元泵)。
具体搭建方式如下(见附图8):首先,一个高效液相泵与自动进样器连接,再与柱温箱连接,这3个模块的串联用于待测物的分离;紧接着通过一个三通阀串联一个补偿泵,用于洗脱液中有机相的调节;然后,洗脱液与补偿液的混合液用一个三通阀与酶泵相连,与酶溶液汇合后流经反应线圈1,化合物在线圈1中与酶发生作用;接下来,混合了化合物的酶溶液再次利用一个三通阀与底物泵相连,所有液体在反应线圈2中混合,充分进行生化反应。混合液经由反应线圈2最终流入DAD检测器中,通过观察反应产物吸收波长(470nm)处有无倒峰的生成从而判断化合物是否具有活性。
- 还没有人留言评论。精彩留言会获得点赞!