一种化学标记结合LC‑MS的方法及其在核苷酸分析中的应用与流程
本发明属于分析化学领域,具体涉及一种化学标记结合lc-ms的方法及其在核苷酸分析中的应用。
背景技术:
dna/rna修饰指的是在dna、rna碱基a\t\c\g\u以及核糖上的修饰。目前虽然已发现的dna修饰有十几种,rna修饰有一百多种,其中甲基化核苷酸占大部分,而且在所有的修饰类型中,胞嘧啶5位甲基化修饰是目前最为普遍的研究,但是对甲基化胞嘧啶修饰核苷酸的定量研究还未有报道。理论上,由含甲基化修饰的dna或rna分解代谢产物中存在5-甲基脱氧胞嘧啶核苷酸(5-me-dcmp)或5-甲基胞嘧啶核苷酸(5-me-cmp),而且这些甲基化修饰的单磷酸核苷酸有可能在磷酸激酶的作用下转变成其三磷酸形式而被dna或rna重新利用而随机插入到其中,导致毒性。但是一直以来,对内源性的5-me-dcmp和5-me-cmp的检测和定量还未有报道。究其原因,主要是因为甲基化胞嘧啶修饰核苷酸的定量检测存在着以下三个难题:首先,为了避免这些提前甲基化的核苷酸重新插入到dna或rna中,由核酸分解代谢而来的5-me-dcmp能在脱氨酶的作用下迅速脱氨基转化成正常的胸腺嘧啶核苷酸(tmp),因此即使有这些甲基化修饰的核苷酸,其含量也很低,不容易检测到;其次,核苷酸在反相色谱中的保留很弱,受实际样品中亲水性物质的干扰很强;再者,核苷酸在质谱上的响应本身不强,再加上很多未修饰的正常核苷酸对它们检测的干扰,使修饰核苷酸的检测更具挑战性。因此检测甲基化修饰胞嘧啶核苷酸的方法必须同时具备高灵敏度和高选择性。
lc-ms法本身具有很高的灵敏度和选择性,在目前检测核苷酸的分析方法中,是最灵敏的方法。但是,直接用lc-ms法分析核苷酸的灵敏度还是有限。因此,在核苷酸尤其是修饰核苷酸分析中迫切需要发展一种新的、高灵敏度、高选择性、准确的检测方法。
技术实现要素:
本发明的首要目的在于针对现有技术中存在的不足,提供一种能应用于核苷酸检测领域中,结合化学标记策略的具有高灵敏度和高选择性的lc-ms分析方法。
本发明的次要目的在于提供一种能将包括修饰核苷酸在内单磷酸的核苷酸进行标记的方法,并且提供一种用固相萃取将核苷核苷酸进行富集的方法。
本发明通过固相萃取将生物样品中的核苷酸进行富集,用n,n-二甲基对苯二胺(dmpa)对包括两种甲基化修饰的核苷酸在内的10种单磷酸核苷酸进行化学标记,再对标记产物进行纯化,最后用lc-ms检测这些经过标记的核苷酸。
本发明提供的技术方案具体如下:
一种化学标记与液相色谱-质谱联用技术相结合的分析方法,包括以下步骤:
(1)将除去蛋白后的生物样品溶于溶剂s中,得到样品溶液;将氨基硅胶填入固相萃取小柱,用溶剂s活化,然后将样品溶液上样至固相萃取小柱中,先用溶剂s清洗,再用乙腈、纯水体积比为1:9的解析液解析,解析液于37℃下氮气吹干;所述的溶剂s中氨水的体积分数为0.25%,乙腈的体积分数为80%,纯水的体积分数为19.75%;
(2)将步骤(1)得到的核苷酸溶于纯水中,加入ph=6的咪唑缓冲液、n,n-二甲基对苯二胺和edc,核苷酸、咪唑、edc和n,n-二甲基对苯二胺的摩尔浓度比为1:50-100:2000-8000:30000-70000,然后将样品强烈振荡,于50℃下反应;
(3)反应结束后,向反应液中加入纯水、二氯甲烷、正己烷体积比为3:2:1的混合溶液进行涡旋,然后离心,取上清液;将上清液上样至用纯水活化后的stratax固相萃取小柱中,先用纯水清洗两次,再用乙腈、纯水体积比为1:4的解析液进行解析,解析液于37℃下氮气吹干,所得固体样品复溶于水中后直接进行反相液相色谱-电喷雾质谱分析,采用正离子模式。
所述的生物样品为尿液、细胞或组织。
步骤(1)中尿液的除蛋白方式为:将尿液样品在4℃离心两次以除去不溶物,离心后的上清液通过一层13mm×0.22μm的尼龙滤膜以除去蛋白质。
步骤(1)中细胞的除蛋白方式为:细胞用pbs缓冲液清洗后,置于离心管中,2000×g离心沉淀细胞,倒掉上清液;再取一管细胞至匀浆管中,加入预冷至-80℃的甲醇、水体积比为4:1的混合溶液,将匀浆管置于冰水混合物中研磨,将匀浆后的混合物转移至离心管中,向匀浆管中加入预冷至-80℃的甲醇、水体积比为4:1的混合溶液,清洗匀浆管后的溶液与离心管中的溶液合并,将合并液以14000×g的转速在4℃条件下离心,取出上清液,即成。
步骤(1)中组织的除蛋白方式为:将组织加入匀浆管中,加入预冷至-80℃的甲醇、水体积比为4:1的混合溶液,将匀浆管置于冰水混合物中研磨,将匀浆后的混合物转移至离心管中,向匀浆管中加入预冷至-80℃的甲醇、水体积比为4:1的混合溶液,清洗匀浆管后的溶液与离心管中的溶液合并,将合并液以14000×g的转速4℃条件下离心,取出上清液,37℃下氮气吹干,即成。
步骤(2)中,核苷酸、咪唑、edc和n,n-二甲基对苯二胺的摩尔浓度比为1:100:5000:40000。
步骤(2)中,样品在50℃下反应的时间为1.5小时。
步骤(3)中,反应液和混合溶液的体积比为1:6。
上述分析方法在核酸分析领域中的应用。
本发明的原理具体如下:
本发明利用含有伯胺基团的试剂n,n-二甲基对苯二胺(dmpa)与含磷酸根的化合物(单磷酸核苷酸)之间的反应进行化学标记。dmpa和单磷酸核苷酸脱去一分子h2o,形成磷酰胺类结构;
dmpa带有疏水苯环结构和在esi源中易电离的叔胺基团,标记核苷酸之后一方面可以使这些修饰核苷酸疏水性增强,显著改善它们在反相液相色谱柱上的保留行为,达到更好的分离,减少干扰。另一方面可以使这些核苷酸带上易电离的叔胺基团,显著增强它们在esi-ms中的离子化效率,从而使lc-ms法的灵敏度和选择性发生进一步提高。
本发明具有以下优点和有益效果:
1.本发明用氨基硅胶固相萃取小柱对生物样品中的核苷酸进行富集,大大减少样品中的基质干扰。
2.本发明利用液液萃取有效除去过量标记试剂dmpa,避免污染质谱。
3.本发明可利用stratax固相萃取小柱除去过量的活化剂edc,避免污染质谱。
4.本发明涉及的标记反应具有较高的标记效率,利于定量分析。
5.本发明涉及的标记反应可显著改善核苷酸在lc中的分离以及其在esi-ms检测灵敏度(信号响应提高1-2个数量级),从而在修饰核苷酸分析领域具有广阔的应用前景。
附图说明
图1为本发明中两种甲基化修饰核苷酸的结构式以及核苷酸与dmpa的标记反应示意图。
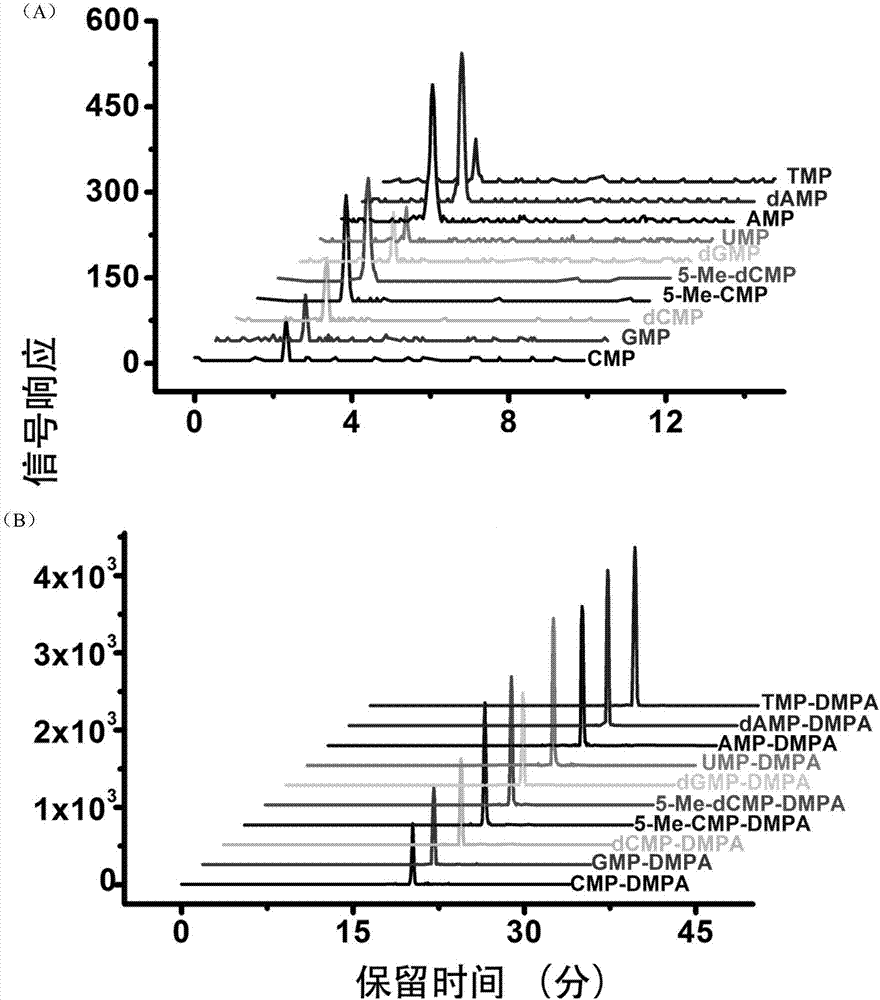
图2为本发明中化学标记前后lc-ms检测效果对比图,其中,图2(a)为化学标记前的lc-ms检测效果图,图2为(a)化学标记后的lc-ms检测效果图。
图3为肾癌组织中十种核苷酸用dmpa标记前后的提取离子色谱图,其中,图3(a)为dmpa标记前的提取离子色谱图,图3(b)为dmpa标记后的提取离子色谱图,图3(c)为图3(a)的放大图,图3(d)为图3(b)的放大图。
图4为dmpa-d4标记的5-me-dcmp和5-me-cmp提取离子色谱图以及实际样品尿样、293t细胞、hela细胞中dmpa标记的5-me-dcmp和5-me-cmp提取离子色谱图。
具体实施方式
以下通过具体实施例来进一步阐述本发明的技术方案,但本发明的保护范围并不局限于以下实施例。
实施例1
1、首先配制工作溶液:(1)将标记试剂dmpa溶解于色谱纯乙腈中,配制成浓度为1m的dmpa乙腈溶液;(2)将咪唑用水稀释,配制成浓度为2.5mm、ph=6的咪唑缓冲液;(3)edc溶解在水中,配制成浓度为500mm的edc水溶液;(4)在3ml固相萃取小柱中填充200mg氨基硅胶;(5)配制氨水的体积分数为0.25%、乙腈的体积分数为80%、纯水的体积分数为19.75%的溶剂s。
2、除蛋白:取一定量的生物样品加入3ml匀浆管中,加入预冷至-80℃的甲醇水溶液(甲醇:水=4:1,v/v)。将匀浆管置于冰水混合物中研磨组织10min,将匀浆后的混合物转移至5ml离心管中,向匀浆管中加入1.5ml预冷至-80℃的甲醇水溶液(甲醇:水=4:1,v/v)清洗匀浆管后与提取液合并。将合并后的提取液以13000×g的转速4℃条件下离心10min,取出上清液,37℃下氮气吹干。
3、先将经步骤2处理过的生物样品复溶在溶剂s中,再将固相萃取小柱用3ml溶剂s进行活化,上样后,用3ml溶剂s进行清洗,最后用2ml解析液将核苷酸解析下来,于37℃下用氮气吹干;优化后的解析液为乙腈、纯水体积比为1:9的混合液;
4、将经步骤3处理过的生物样品复溶于40μl水中,加入20μldmpa乙腈溶液、10μledc水溶液和40μl咪唑缓冲液,在50℃下用小型加热振荡器反应1.5小时,反应时的振荡速率为1500×g;
5、反应结束后,在100μl的反应体系中加入300μl水和300μl二氯甲烷-正己烷溶液(2:1,v/v)涡旋并13000×g离心5min后,取上清液除去过量的标记试剂dmpa;然后将上清液上样至30mg的stratax固相萃取小柱(预先用1ml纯水进行活化)除去过量的活化剂edc,用1ml纯水清洗两次,再用1mlcan乙腈水溶液(乙腈:水=1:4,v/v)进行解析,再于37℃下用氮气吹干,直接进行lc-ms定量分析。
若未特别指明,实施例中所用的技术手段包括核酸的提取为本领域技术人员所熟知的常规手段。lc-ms法中所用质谱仪为appliedbiosystems公司的ab3200qtrapmass固相萃取ctrometer(fostercity,美国),使用电喷雾离子源(turboionspray)。液相色谱为shimadzulc-20adhplc(tokyo,日本),装配有lc-20ad二元高压梯度泵、sil-20a自动进样器、cto-20ac恒温柱温箱和dgu-20a3脱气机。使用c18反相色谱柱(250mm×2.0mmi.d.,5μm)进行化合物分离,柱温控制在35℃。流动相a、b相分别为水(含2mmnh4hco3)、acn。流动相梯度为0-15min5%-30%b,15-20min30%b,20-22min30%-70%b,22-30min70%b,30-32min70%-5%b,32-40min5%b。流速设为0.2ml/min,采用正离子模式检测。
实施例2:尿样中核苷酸的分析
尿液样品以5000×g的转速在4℃离心两次,每次离心10min以除去不溶物。离心后的上清液通过一层尼龙滤膜(13mm×0.22μm,上海安普科学仪器有限公司)以除去蛋白质。除去蛋白后的尿液样品用氨基硅胶小柱对其中的核苷酸进行富集,然后用dmpa进行化学标记,再用液液萃取的方法除去过量标记试剂,最后用stratax小柱除去过量活化剂edc后,37℃下氮气吹干,复溶于100μl水中,进样70μl,用lc-ms分析。
实施例3:人体肾癌组织以及癌旁组织中核苷酸的分析
取一定量的肾癌及癌旁组织加入3ml匀浆管中,加入预冷至-80℃的甲醇水溶液(甲醇:水=4:1,v/v)。将匀浆管置于冰水混合物中研磨组织10min,将匀浆后的混合物转移至5ml离心管中,向匀浆管中加入1.5ml预冷至-80℃的甲醇水溶液(甲醇:水=4:1,v/v)清洗匀浆管后与提取液合并。将合并后的提取液以14000×g的转速4℃条件下离心10min,取出上清液,37℃下氮气吹干。
除蛋白后的样品用氨基硅胶小柱对其中的核苷酸进行富集,然后用dmpa进行化学标记,再用液液萃取的方法除去过量标记试剂,最后用stratax小柱除去过量活化剂edc后,37℃下氮气吹干,复溶于100μl水中,进样70μl,用lc-ms分析。
实施例4:尿样中核苷酸的分析
两种人类细胞系:hela(宫颈癌细胞)和293t(人胚肾细胞)。取一定数量培养的细胞用pbs缓冲液清洗后,置于1.5ml离心管中,2000×g离心20s沉淀细胞,倒掉上清液。再取一管细胞至3ml匀浆管中,加入预冷至-80℃的甲醇水溶液(甲醇:水=4:1,v/v)。将匀浆管置于冰水混合物中研磨细胞10min,将匀浆后的混合物转移至5ml离心管中,向匀浆管中加入1.5ml预冷至-80℃的甲醇水溶液(甲醇:水=4:1,v/v)清洗匀浆管后与提取液合并。将合并后的提取液以14000×g的转速在4℃条件下离心10min,取出上清液,37℃下氮气吹干。
除蛋白后的样品用氨基硅胶小柱对其中的核苷酸进行富集后,用dmpa进行化学标记,再用液液萃取的方法除去过量标记试剂,最后用stratax小柱除去过量活化剂edc后,37℃下氮气吹干,复溶于100μl水中,进样70μl,用lc-ms分析。
表1化学标记前后检测灵敏度对比
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!