一种基于抗体的乙酰胆碱酯酶芯片固定方法及其在小分子抑制剂研发中的应用与流程
本发明涉及一种乙酰胆碱酯酶的固定技术,尤其涉及一种基于抗体的乙酰胆碱酯酶的芯片固定方法及其在小分子抑制剂研发中的应用。
背景技术:
乙酰胆碱酯酶(acetylcholinesterase,ache)也称真性胆碱酯酶,属于丝氨酸水解酶类,主要存在于胆碱能神经末梢突触间隙,能够快速水解神经递质乙酰胆碱(acetylcholine,ach),以终止ach对突触后膜的兴奋作用,保证胆碱能神经信号的正常传递,此外也在红细胞、上皮细胞、内皮细胞、胸腺细胞、肝细胞和成骨细胞中表达,可能与其“非经典”作用相关,比如参与神经生长、细胞分化和细胞黏连等。ache在药理学研究中备受关注,其抑制剂是治疗阿尔茨海默病的一线药物,也被用于治疗重症肌无力。
表面等离子共振(surfaceplasmonresonance,spr)技术是研究生物分子相互作用的工具,由spr光学组件、微流控系统、传感芯片、流路系统组成,通过表面等离子共振原理测定生物分子相互作用的信息,传感芯片表面固定一层生物分子识别膜,当待测样品流过芯片表面时,若样品中有能够与芯片表面生物分子识别膜相互作用的分子,会引起金属膜表面折射率变化,最终导致spr角变化,通过检测spr角度变化,获得被分析物的浓度、亲和力、动力学常数和特异性等信息。通常蛋白可以通过氨基偶联、捕获等方式固定在芯片表面,但是这些固定方式并非适合所有蛋白,氨基偶联的方式对蛋白质量要求比较高,而且可能会对活性造成一些影响,偶联的蛋白活性只能保持一段时间。这种偶联方式是不可逆的,若蛋白失活,这个芯片则不能继续使用,造成芯片的损耗。
技术实现要素:
针对上述问题,本发明的目的在于提供一种基于抗体的乙酰胆碱酯酶芯片固定方法及其在小分子抑制剂研发中的应用,该固定方法可以随时调节偶联量,还可以反复偶联,并且在蛋白纯度不高的时候,也能通过抗体识别,使ache得到纯化并稳定结合到芯片上。
第一发明提供一种基于抗体的乙酰胆碱酯酶芯片固定方法,包括以下步骤:
(1)将乙酰胆碱酯酶抗体固定于芯片表面;以及
(2)使乙酰胆碱酯酶流入芯片表面从而结合于所述乙酰胆碱酯酶抗体上。
根据第一发明,将ache抗体固定在芯片表面,保持活性;再将ache流过芯片表面,ache抗体识别,会结合在抗体上。这种固定方式比起一般的氨基偶联的方式优点在于可以随时调节偶联量,还可以反复偶联。并且在蛋白纯度不高的时候,也能通过抗体识别,使ache得到纯化并稳定结合到芯片上。
较佳地,所述芯片是表面等离子共振系统中的传感芯片。通过将ache固定在表面等离子共振系统中的传感芯片表面,能应用于小分子抑制剂的研发,测定小分子抑制剂与乙酰胆碱酯酶之间的亲和力。
较佳地,步骤(1)包括:
用1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐和n-羟基琥珀酰亚胺活化芯片表面;
使乙酰胆碱酯酶抗体流入芯片表面从而与芯片表面结合;
结合完成后,用乙醇胺封闭芯片表面基团。
采用这样的氨基偶联的方式,可以将抗体牢固地固定。
较佳地,1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐和n-羟基琥珀酰亚胺的摩尔比为1:1,乙酰胆碱酯酶抗体的流速为5-100μl/min,与芯片表面接触时间为15-420s。
较佳地,步骤(2)中,用缓冲液将乙酰胆碱酯酶稀释至10~100μg/ml,以5-100μl/min的流速进样并流入芯片表面。
较佳地,所述表面等离子共振系统包括:
传感芯片;
用于向所述传感芯片供给样品的流路系统;
用于控制样品流的微流控系统;以及
用于检测所述传感芯片表面折光率的变化的表面等离子共振光学组件;
所述传感芯片被所述微流控系统包裹在内形成夹心结构。
这样,可以使得所述传感芯片表面形成4个流动池,可选择单独、配对、串联使用,增加使用灵活度。
第二发明提供一种筛选乙酰胆碱酯酶的小分子抑制剂的方法,其特征在于,包括:
采用上述任一方法在表面等离子共振系统中的芯片表面固定乙酰胆碱酯酶;
测定固定于所述芯片表面的乙酰胆碱酯酶的活性;以及
在所述乙酰胆碱酯酶具有活性的情况下,使待选小分子抑制剂流过芯片表面,并测试待选小分子抑制剂与乙酰胆碱酯酶的亲和力。
根据第二发明,可以方便、稳定地进行乙酰胆碱酯酶的小分子抑制剂的筛选。
较佳地,用已知的乙酰胆碱酯酶抑制剂测试乙酰胆碱酯酶的活性,优选地,所述已知的乙酰胆碱酯酶抑制剂选自他克林、毒扁豆碱、多奈哌齐中的任意一种。
较佳地,待选小分子抑制剂按两倍梯度稀释,浓度从低到高进样,流速5-100μl/min,结合15-420s,解离15-600s,拟合计算结合解离常数kd。
较佳地,在测得乙酰胆碱酯酶失活的情况下,用ph1.5~2.5的酸性缓冲液对芯片表面进行再生,使乙酰胆碱酯酶抗体和失活的乙酰胆碱酯酶解离。
附图说明
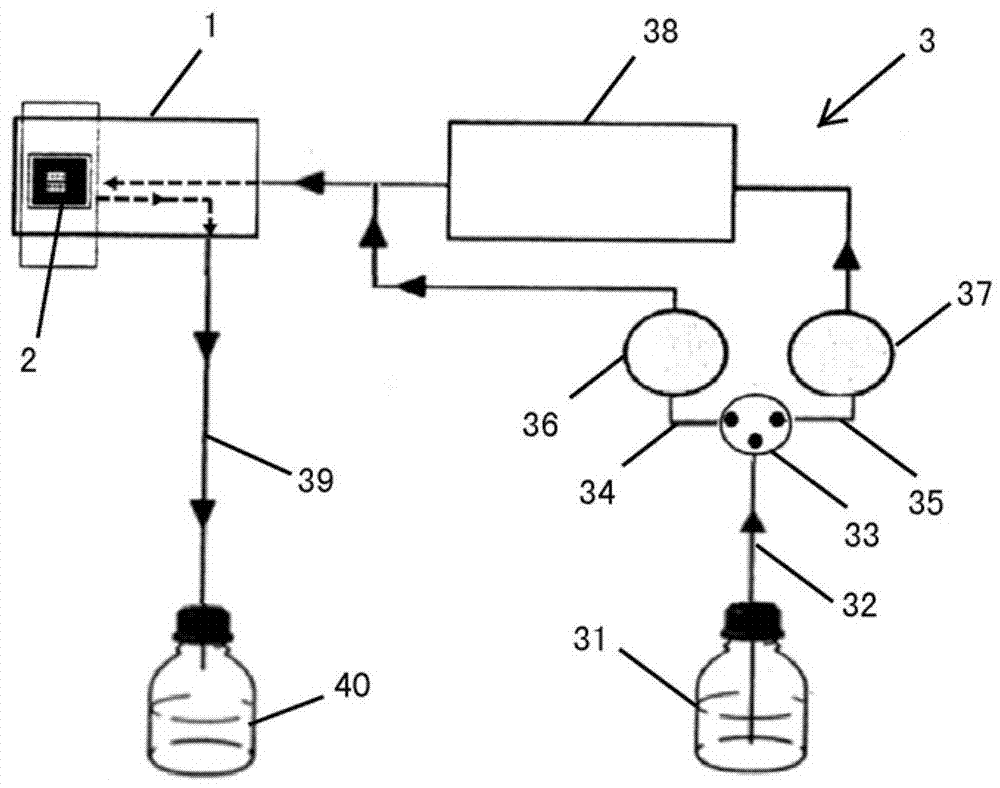
图1:表面等离子共振仪器装置图。
图2:ache抗体偶联图。
图3:ache与抗体稳定结合,说明此抗体能固定ache。
图4:ache与抗体不能稳定结合,说明此抗体不适合用于ache的固定。
图5:ache与抗体能结合,但解离迅速,说明此抗体不适合用于ache的固定。
图6:ache与梯度浓度的tacrine作用图,说明固定的ache保持了活性。
图7:梯度浓度的b9m与ache结合作用图。
图8:b9m亲和力拟合图。
图9:梯度浓度的qsj406与ache结合作用图。
图10:qsj406亲和力拟合图。
图11:梯度浓度的qsj407与ache结合作用图。
图12:qsj407亲和力拟合图。
图13:梯度浓度的qsj408与ache结合作用图。
图14:qsj408亲和力拟合图。
具体实施方式
以下结合附图和下述实施方式进一步说明本发明,应理解,附图和下述实施方式仅用于说明本发明,而非限制本发明。
在此公开一种基于抗体的乙酰胆碱酯酶芯片固定方法,首先将乙酰胆碱酯酶抗体偶联在芯片上,保持活性;然后将乙酰胆碱酯酶流入芯片表面,被偶联的抗体识别后,会结合在芯片上。
优选实施方式中,上述固定方法在表面等离子共振(surfaceplasmonresonance,spr)系统上进行,所述芯片是表面等离子共振系统中的传感芯片。
如图1所示,表面等离子共振系统可包括:spr光学组件(未图示)、微射流卡盘1、传感芯片2、流路系统3。流路系统3用于向整个spr系统运送缓冲液以及为传感芯片2供给样品流。微射流卡盘1作为液体传送系统,用于控制向传感芯片2供给的样品流,例如控制其流动的通道和流速等。传感芯片2为一片表面镀有金属薄膜的玻璃载片。微射流卡盘1表面有4个凹槽,与传感芯片2贴合后可形成包括微射流卡盘1、流通池、传感芯片2的夹心结构,组成微流控系统,能将极少量样品及试剂输入流通池,4个流通池可选择单独、配对、串联使用。样品通过微流控系统到达芯片2表面,发生结合后,spr光学组件能检测到芯片表面折光率的变化,输出信号。
如图1所示,流路系统3可包括缓冲液瓶31、与缓冲液瓶连接的流路32。从流路32可分岔出第一流路34和第二流路35。在分岔处可设置有阀门33。可通过调节阀门33使缓冲液瓶31中的缓冲液流入第一流路34和/或第二流路35。第一流路34上设置有缓冲液泵36,无样品时,其用于将缓冲液瓶里的缓冲液输送进入spr系统。第二流路35上设置有自动进样泵37,当需要进样时,其用于将样品仓中的样品输送至芯片。在第二流路35上,在自动进样泵37的下游侧设置有储存样品的样品仓38。第一流路34和第二流路35与传感芯片2连接。样品可流入传感芯片2,并可从传感芯片2经排出流路39流出至废液瓶40。
样品到达芯片2表面,发生结合后,spr光学组件能检测到芯片表面折光率的变化,输出信号,可以测定样品的结合量。
首先,将ache抗体偶联在芯片表面。偶联方式可为氨基偶联或者抗体捕获,需达到尽可能高的偶联量。
一实施方式中,用氨基偶联的方式固定抗体。如图2所示,将1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺(nhs)混合进样,使芯片表面活化。edc和nhs的摩尔比优选为1:1。edc和nhs可溶于去离子水中,进行进样。
将ache抗体溶于缓冲液中,进样与芯片表面结合。如上所述,缓冲液可以使用pbs、hepes、tris等,根据不同底物可以兼容使用。一个示例中,配置ph为7.4的pbs缓冲液,含137mmnacl、2.7mmkcl、1.8mmkh2po4、0.1mmna2h2po4、和0.05%tween20,过滤使用。进样时,流速可为5-100μl/min,例如为10μl/min。ache抗体与芯片接触时间可为15-420s,例如为420s。
结合完成后,可用乙醇胺封闭芯片表面剩余活化基团。
抗体固定后要保持活性,能特异性地稳定结合乙酰胆碱酯酶,确保胆碱酯酶结合后不易从芯片表面解离。
然后,将ache进样。可将ache溶于缓冲溶液中进行进样。一个示例中,用缓冲液将ache稀释至10~100μg/ml,以5-100μl/min(例如10μl/min)的流速进样。可通过进样时间调节固定量。优选以最大量结合,结合量大于20000ru后停止。
若抗体能特异性识别ache,则会稳定结合(如图3),可继续用于小分子抑制剂的筛选。若抗体不能稳定结合ache(如图4、5),则需更换更合适的抗体偶联。选择的抗体需要满足能稳定结合ache,但不影响其活性的特点。本实施方式中,所用的抗体可为mab303(milipore)。
将ache通过抗体固定于芯片表面后,可测试其活性。可用经典小分子胆碱酯酶抑制剂测试乙酰胆碱酯酶的活性。经典小分子胆碱酯酶抑制剂例如可选自他克林(tacrine)、毒扁豆碱(eserine)、多奈哌齐(donepezil)中的任意一种。
一实施方式中,通过进样梯度浓度的tacrine溶液,测定其与ache的亲和力,拟合计算出结合解离常数kd值,判断ache固定后是否保持了活性。具体地,可以将tacrine以缓冲液稀释,以两倍梯度往下稀释成一系列梯度浓度的溶液,保持溶液中dmso的含量恒定为0.5-10%(例如5%),在缓冲液中同样添加0.5-10%(例如5%)的dmso。将tacrine系列溶液从低到高进样分析,结合15-420s(例如60s),解离15-600s(例如60s),流速5-100μl/min(例如30μl/min)。图6示出了ache与梯度浓度的tacrine结合作用,可以看出ache固定后保持了活性。
确定了ache活性不受影响后,可以测试小分子抑制剂与ache的结合活性,从而筛选出ache抑制剂。
测定时可将tacrine作为阳性药物,若发现ache失活,则可对芯片表面进行再生,使抗体和失活的ache解离。之后可以用相同的方法重新固定ache,继续用于小分子抑制剂的测定。一个示例中,用ph1.5~2.5的酸性缓冲液对芯片表面进行再生。
测试小分子抑制剂活性时,可以将小分子抑制剂以缓冲液稀释成系列梯度浓度的待测溶液(例如按两倍梯度稀释),保持溶液中dmso的含量恒定为0.5-10%(例如5%),加入到圆底96孔板中,用封板膜封住,缓冲液中加入0.5-10%(例如5%)的dmso。小分子抑制剂从浓度低到高依次进样分析,一种抑制剂的系列溶液分析完后,进行一次溶剂校正,之后继续测定下一种抑制剂,结合15-420s(例如60s),解离15-600s(例如60s),流速5-100μl/min(例如30μl/min)。
所述溶剂校正可采用如下方式进行:用缓冲液配置含4%和6%dmso的溶液,以不同比例混合配成多个(例如8个)不同浓度dmso的系列溶液用于溶剂校正,每个小分子抑制剂系列溶液进样完成后,进行一次溶剂校正。
可通过spr测得不同浓度小分子抑制剂与ache的结合响应值。然后,对此进行数据分析,例如将小分子的浓度为横坐标,结合量为纵坐标作图,亲和力拟合计算结合解离常数kd值,从而筛选出ache抑制剂。
在此公开的一种新的基于抗体的乙酰胆碱酯酶芯片固定方法,是一种新的蛋白固定方式,解决了一般氨基偶联方法中对蛋白质量要求高,影响活性的问题,能固定纯度不高的蛋白,并且抗体选择合适的话,固定的蛋白活性不受影响。这种方式还能重复固定蛋白,减少了芯片的损耗。
下面进一步例举实施例以详细说明本发明。同样应理解,以下实施例只用于对本发明进行进一步说明,不能理解为对本发明保护范围的限制,本领域的技术人员根据本发明的上述内容作出的一些非本质的改进和调整均属于本发明的保护范围。下述示例具体的工艺参数等也仅是合适范围中的一个示例,即本领域技术人员可以通过本文的说明做合适的范围内选择,而并非要限定于下文示例的具体数值。
实施例一
1、使用试剂
pbs缓冲液、吐温20、ache抗体(mab303,milipore)、氨基偶联试剂盒(ge公司)。
2、使用仪器和其他耗材
spr系统(biacoret200,ge公司)、cm5芯片(ge公司)。
3、工作液的配制
配制ph为7.4的pbs缓冲液,含137mmnacl,2.7mmkcl,1.8mmkh2po4,10.1mmnah2po4,0.05%吐温20,作为固定抗体和ache的缓冲液。缓冲液中加入5%dmso,作为小分子抑制剂分析的缓冲液。
4、抗体和ache的固定
用缓冲液将ache抗体稀释为20μg/ml。将氨基偶联试剂盒中的edc、nhs以1:1混合进样,使芯片表面活化。ache抗体进样与芯片表面结合,流速10μl/min,接触时间420s,结合完成后,用乙醇胺封闭芯片表面基团。
用缓冲液将ache(p22303,r&dsystems)稀释成10μg/ml,10μl/min进样。
5、溶剂校正溶液的配置
用缓冲液配置含4%和6%dmso的溶液,以不同比例混合配成8个不同浓度dmso的系列溶液用于溶剂校正。
6、小分子抑制剂的分析
取胆碱酯酶抑制剂b9m(申请人自制的待选小分子抑制剂)母液,以缓冲液稀释成系列梯度浓度的待测溶液,保持溶液中dmso的含量恒定为5%,缓冲液中加入5%dmso。b9m从浓度低到高依次进样分析,分析完成后,进行一次溶剂校正,结合60s,解离60s,流速30μl/min。
7、数据分析
将b9m的浓度为横坐标,结合量为纵坐标作图,亲和力拟合计算结合解离常数kd值。结果图7和图8,测得b9m的kd值为0.76μm。
实施例二
继续使用已固定抗体和ache的芯片进行系列小分子抑制剂的筛选。
取系列胆碱酯酶抑制剂qsj406、qsj407、qsj408(申请人自制的待选小分子抑制剂),以缓冲液稀释成系列梯度浓度的待测溶液,保持溶液中dmso的含量恒定为5%,加入到圆底96孔板中,用封板膜封住,缓冲液中加入5%dmso。qsj406、qsj407、qsj408从浓度低到高依次进样分析,每个浓度进样一次。一种抑制剂的系列溶液分析完后,进行一次溶剂校正,之后继续测定下一种抑制剂,结合60s,解离60s,流速30μl/min。将qsj406、qsj407、qsj408系列化合物的浓度为横坐标,结合量为纵坐标作图,分别以亲和力拟合计算结合解离常数kd值。结果见图9~14,测定结果的qsj406的kd值为3.69μm,qsj407的kd值为3.345μm,qsj408的kd值为4.823μm。
- 还没有人留言评论。精彩留言会获得点赞!
- 黄芪丁酰胆碱酯酶抑制活性有效提取物及其组合物的医药用途和制备方法
- 漏芦花丁酰胆碱酯酶抑制活性有效提取物及其组合物的医药用途和制备方法
- 广枣乙酰胆碱酯酶抑制活性有效提取物及其组合物的医药用途和制备方法
- 一种提高千层塔芽孢移栽成活率的方法
- 组蛋白脱乙酰酶抑制剂与免疫调节药物的组合的制作方法
- 具抗记忆错误效果的乙酰胆碱酯酶抑制剂和5-羟色胺受体4(5ht4)激动剂的化合物,其制 ...的制作方法
- 组蛋白脱乙酰酶抑制剂与免疫调节药物的组合的制作方法
- 具抗记忆错误效果的乙酰胆碱酯酶抑制剂和5-羟色胺受体4(5ht4)激动剂的化合物,其制 ...的制作方法
- 一种具有抑制乙酰胆碱酯酶功能的真菌菌株及其应用
- 含有色氨酸基本骨架的邻苯二胺类选择性组蛋白去乙酰化酶抑制剂及其制备方法和应用