分析方法与流程
本发明涉及分析方法,尤其涉及通过毛细管电泳法来进行的试样的分析方法。
背景技术:
作为表示生物体的状态的指标,分析着各种蛋白质。其中,关于血细胞中的血红蛋白(hb),存在多个血红蛋白种类,除了正常血红蛋白(hba)之外,还存在多种变异血红蛋白(hbc、hbd、hbe、hbs等)。
试样的成分分析(例如,液体色谱法等)中,例如通过测定预先已知组成的样品而确认想要检测的成分被检测出的检测时间、峰值形状、并比较受检体的分析结果,来进行成分的特定(例如,参照日本专利特开昭60-73458号公报)。
血液(试样)的血红蛋白种类(成分)的分析中,由于因成分而检测时间不同,因此利用此来进行分离分析。分离分析中,考虑到测定的分散性(例如,因柱子劣化或者洗脱液保存状态等引起的检测时间的不同等),例如,如果某成分的检测时间进入预定的检测时间范围内,则确定为该成分。
作为血红蛋白(hb)的分析方法的一个,使用电泳法(例如,参照日本专利特开平11-337521号公报)。基于电泳法的试样的分析在分析装置中装填分析芯片的状态下进行。分析芯片提供保持试样并将该试样作为对象的分析的场所。作为该分析芯片,存在打算仅仅结束一次分析之后废弃的一次性分析芯片。使用了这样的一次性分析芯片的血红蛋白的分析方法例如在日本专利特开2016-57289号公报中公开。
在一次性分析芯片的情况下,即使成为分析对象的试样相同,按照分析芯片自身的批次之间差异、相同批次之间的个体差异,特定成分的检测时间变动。在以反复使用为前提的分析芯片的情况下,通过进行基于已知的分析结果的校正,能够提高分析结果的准确度,但在一次性分析芯片的情况下,在基于因该分析芯片的个体差异引起的检测时间的变动的误差大的情况下,可能发生因成分的确定有错而不能得到准确的分析结果的事态。
技术实现要素:
本发明的实施方式是基于上述的情况构思的方式,其课题在于,提供在利用一次性分析芯片进行的试样的分析中,适于分析准确度的提高的分析方法。
通过本发明的实施方式提供的分析方法是通过毛细管电泳法来进行的试样的分析方法,所述分析方法向被导入到微细流路的试样溶液施加电压,对所述试样溶液中所含的成分进行分离分析,并测定所述微细流路的测定部中的与测定开始后的经过时间对应的光学测定值,所述分析方法包括:波形形成工序,形成与所述光学测定值相关的波形,所述光学测定值与所述测定开始后的经过时间对应;界面检测工序,基于所述试样溶液与泳动液的界面到达所述微细流路中的预定的测定位置时的所述光学测定值,决定界面检测时间;特征波形特定工序,特定所述波形中所表现的多个特征波形;以及成分确定工序,基于与所述特征波形的每一个对应的经过时间以及所述界面检测时间,确定所述试样溶液中所含的成分。
此处,“所述微细流路中的预定的测定位置”是指,用于测定光学测定值的测定光通过的位置。此外,该界面涉及的光学测定值可以在与应当确定的成分涉及的光学测定值被测定的所述测定部相同的位置被测定,也可以在其他位置被测定。
在本发明的优选的实施方式中,所述光学测定值是吸光度,所述特征波形是所述波形中的峰值波形,所述特征波形特定工序是特定所述峰值波形的峰值波形特定工序。
在本发明的优选的实施方式中,所述界面检测工序中,基于所述界面到达所述预定的测定位置时的所述光学测定值的变化,决定所述界面检测时间。
在本发明的优选的实施方式中,所述成分确定工序基于最大峰值检测时间和所述界面检测时间的对比来确定最大峰值波形涉及的成分,所述最大峰值检测时间是与所述最大峰值波形对应的所述经过时间,所述最大峰值波形是所述峰值波形特定工序中特定的所述峰值波形之中最大的峰值波形。
在本发明的优选的实施方式中,所述成分确定工序基于最大峰值检测时间、第二峰值检测时间以及所述界面检测时间的对比来确定最大峰值波形以及第二峰值波形涉及的成分,所述最大峰值检测时间是与所述最大峰值波形对应的所述经过时间,所述最大峰值波形是所述峰值波形特定工序中特定的所述峰值波形之中最大的峰值波形,第二峰值检测时间是与所述第二峰值波形对应的所述经过时间,所述第二峰值波形是所述峰值波形特定工序中特定的所述峰值波形之中第二个大的峰值波形。
在本发明的优选的实施方式中,所述成分确定工序基于所述最大峰值检测时间与所述界面检测时间之差、以及所述第二峰值检测时间与所述界面检测时间之差的比,确定所述最大峰值波形以及所述第二峰值波形涉及的成分。
此外,上述分析方法中的试样溶液是包含成为分析对象的试样的溶液,不管是试样其本身占据100%的溶液还是试样被适当稀释的溶液,均为作为概念包含的溶液。关于该试样溶液,只要能够特定上述界面的到达、且具有液体的性质和状态,就没有特别限制。作为该液体,可以是将作为上述试样的固体例如悬浮、分散或者溶解在液体的介质中的稀释液。在上述试样为液体的情况下,例如,可以将上述试样的原液直接作为试样溶液使用,在浓度过高的情况下,例如可以将在液体的介质中悬浮、分散或者溶解了上述原液的稀释液作为试样溶液使用。关于上述液体的介质,只要能够悬浮、分散或者溶解上述试样,就没有特别限制,例如可以举出水或者缓冲液等。作为上述试样,例如可以举出源自生物体的待测体、源自环境的待测体、金属、化学物质或者医药品等。对于上述源自生物体的待测体,没有特别限制,例如可以举出尿、血液、毛发、唾液、汗或者指甲等。作为上述血液待测体,例如可以举出红细胞、全血、血清或者血浆等。作为上述生物体,例如可以举出人、非人动物或者植物等,作为上述非人动物,例如可以举出人以外的哺乳类、两栖爬行动物类、鱼贝类或者昆虫类等。对于上述源自环境的待测体,没有特别限制,例如可以举出食品、水、土壤、大气或者空气等。作为上述食品,例如可以举出生鲜食品或者加工食品等。作为上述水,例如可以举出、饮用水、地下水、河川水、海水或者生活排水等。
在本发明的优选的实施方式中,上述试样溶液是将血液作为试样包含的溶液,上述成分是血红蛋白。
在本发明的优选的实施方式中,所述分析方法使用具有所述微细流路的一次性分析芯片而进行。
根据本发明的实施方式,提供在使用一次性分析芯片进行的试样的分析中,能够适于分析准确度的提高的分析方法。
附图说明
图1是示出能够用于本发明的实施方式涉及的分析方法的执行中的分析系统的系统简要图;
图2是示出用于图1的分析系统中的分析芯片的俯视图;
图3是沿着图2的iii-iii线的截面图;
图4是示出本发明的实施方式涉及的分析方法的流程图;
图5是示出准备工序的顺序的流程图;
图6是示出图5的准备工序的一个工序的截面图;
图7是示出图5的准备工序的一个工序的截面图;
图8是示出图5的准备工序的一个工序的截面图;
图9是示出图5的准备工序的一个工序的截面图;
图10是示出分析工序的顺序を示す流程图;
图11示出hbaa待测体的电泳图的例子;
图12示出hbcc待测体的电泳图的例子;
图13示出hbee待测体的电泳图的例子;
图14示出hbss待测体的电泳图的例子;
图15示出hbsc待测体的电泳图的例子;
图16重叠示出图11~图15的电泳图。
具体实施方式
以下,针对本发明的优选的实施方式,参照附图具体说明。
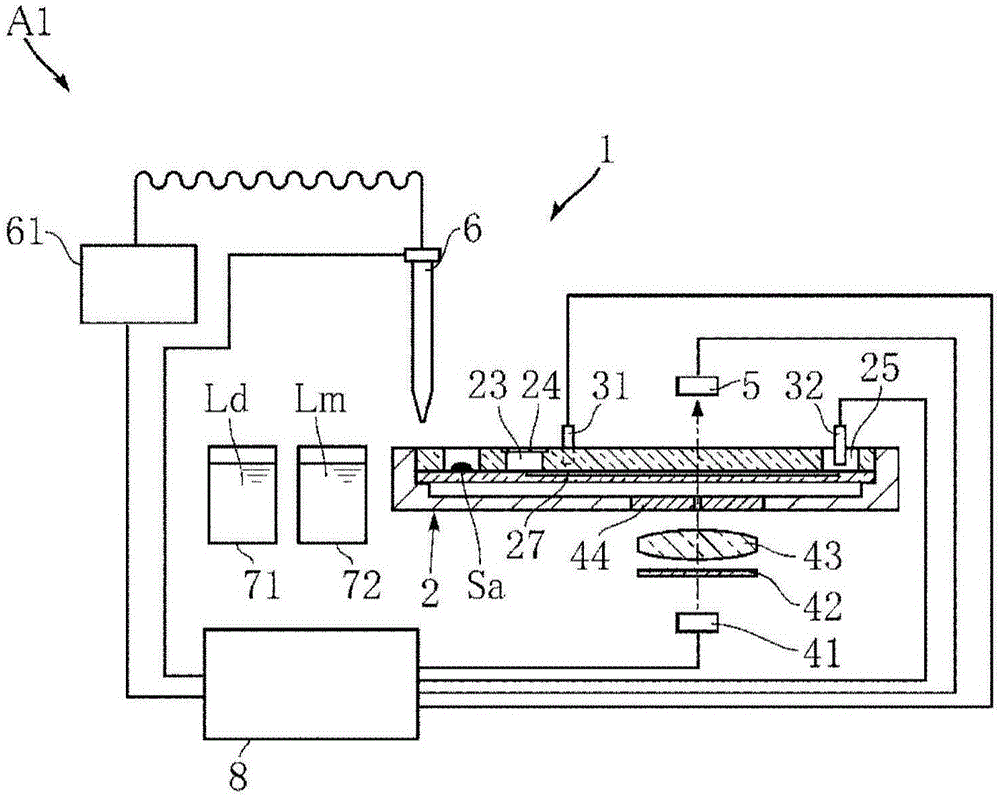
图1示出能够用于本发明的实施方式涉及的分析方法的执行中的分析系统a1的系统简要图。分析系统a1构成为具备分析装置1以及分析芯片2。分析系统a1是将试样sa作为对象而执行基于电泳法的分析方法的系统。对于试样sa,没有特别限制,在本实施方式中,将从人体采集的血液为例子进行说明。将试样sa中所含的成分之中成为分析对象的成分定义为分析成分。
作为上述分析成分,可以举出血红蛋白(hb)、白蛋白(alb)、球蛋白(α1、α2、β、γ球蛋白)或者纤维蛋白原等。作为上述血红蛋白,例如可以举出正常血红蛋白(hba)、变异血红蛋白(hbc、hbd、hbe、hbs等)或者胎儿血红蛋白(hbf)等的多个血红蛋白种类。关于变异血红蛋白,已知有成为各种疾病、病情的原因的情况(例如,hbs成为镰状红细胞贫血症的原因),期待通过确定血红蛋白种类来有用于疾病/病情的诊断、治疗。在以后的说明中,以上述分析成分为血红蛋白(尤其变异血红蛋白种类)的情况为例子进行说明。健康正常的成人的血红蛋白中包含大部分hba以及少量的hbf以及hba2。血红蛋白是四聚体,例如hba包括两个α链和两个β链。当支配该α链或β链的产生的基因序列中发生一些变异时,产生氨基酸序列与通常不同的链、或者其链的产生被抑制,其结果为产生与通常不同的血红蛋白种类。通常,将这样的血红蛋白种类称为变异血红蛋白。健康正常人的血红蛋白的基因型是hba/hba的纯合子,但变异血红蛋白携带者的基因型是hba/hbv的杂合子(hbv是hba以外的变异血红蛋白)、或者hbv/hbv的纯合子(在hbv之间不同的情况下,杂合子)。在临床检查领域中,将源自健康正常人的血液待测体称为hbaa待测体、将源自携带hba/hbv的杂合子的人的血液待测体称为hbav待测体(v是任意的变异)、将源自携带hbv/hbv的纯合子(在hbv之间不同的情况下,杂合子)的人的血液待测体称为hbvv待测体(v是任意的变异)。因此,例如hbas待测体中包含大部分hba及hbs、以及少量的hbf及hba2。例如,hbss待测体中包含大部分hbs、以及少量的hbf及hba2。此处,在以下的记述中,例如在记述为“hbxy”(但是,“x”以及“y”分别为“a”、“c”、“d”、“e”以及“s”中的任一者,彼此不同)的情况下,为hbx/hby的杂合子,意味着在先记述的一者(即,hbx)与在后记述的一者(即,hby)相比,在全血红蛋白中所占的比率更高。
分析芯片2是保持试样sa、且在分析装置1中装填的状态下提供将试样sa作为对象的分析的场所。在本实施方式中,分析芯片2构成为打算在结束一次分析之后废弃的所谓的一次性分析芯片。如图2以及图3所示,分析芯片2包括主体21、混合槽22、导入槽23、过滤器24、排出槽25、电极槽26、毛细管管27以及连络流路28。图2是分析芯片2的俯视图,图3是沿着图2的iii-iii线的截面图。此外,分析芯片2不限于一次性的,也可以是用于多次分析中的。另外,本实施方式涉及的分析系统不限于具备分析装置1中装填的独立的分析芯片2的构成,也可以是发挥与分析芯片2相同功能的功能部位被组装到分析装置1的构成。
主体21是分析芯片2的基底,对其材质没有特别限定,例如可以举出玻璃、溶融二氧化硅或者塑料等。在本实施方式中,主体21是图3中的上侧部分2a和下侧部分2b独立地形成、这些彼此结合的构成。此外,不限于此,例如可以一体形成主体21。
混合槽22是进行后面叙述的试样sa与稀释液ld的混合的混合工序的场所的一个例子。混合槽22例如通过形成于主体21的上述上侧部分2a的贯通孔来构成为向上方开口的凹部。导入槽23是导入混合试样sm的槽,上述混合试样sm是混合槽22中的通过混合工序得到的试样溶液。导入槽23例如通过形成于主体21的上述上侧部分2a的贯通孔来构成为向上方开口的凹部。
过滤器24设置于导入槽23的开口部,该导入槽23的开口部是朝向导入槽23的导入路径的一个例子。过滤器24的具体构成不受限制,作为优选例子,例如可以举出醋酸纤维素膜过滤器(advantec公司制,孔径0.45μm)。
排出槽25是位于电泳法中的电渗流的下游侧的槽。排出槽25例如通过形成于主体21的上述上侧部分2a的贯通孔来构成为向上方开口的凹部。电极槽26是在基于电泳法的分析工序中,电极31被插入的槽。电极槽26例如通过形成于主体21的上述上侧部分2a的贯通孔来构成为向上方开口的凹部。连络流路28连接导入槽23与电极槽26,并构成导入槽23与电极槽26的导通路径。
毛细管管27是连接导入槽23与排出槽25的微细流路,是电泳法中的电渗流(eof,electro-osmoticflow)产生的场所。毛细管管27例如构成为形成于主体21的上述下侧部分2b的槽。此外,可以在主体21中适当形成用于促进朝向毛细管管27的光的照射以及透射了毛细管管27的光的出射的凹部等。毛细管管27的尺寸没有特别限制,但在举出其一个例子时,其宽度为25μm~100μm、其深度为25μm~100μm、其长度为5mm~150mm。分析芯片2整体的尺寸根据毛细管管27的尺寸以及混合槽22、导入槽23、排出槽25以及电极槽26的尺寸、配置等来适当设定。
此外,上述构成的分析芯片2是一个例子,能够适当采用能够根据电泳法进行分析的构成的分析芯片。
分析装置1在试样sa被点样的分析芯片2被装填的状态下进行将试样sa作为对象的分析处理。分析装置1具有电极31、32、光源41、光学过滤器42、透镜43、狭缝44、检测器5、分注器6、泵61、稀释液槽71、泳动液槽72以及控制部8。此外,光源41、光学过滤器42、透镜43以及检测器5构成本实施方式中所称的测定部的一个例子。
电极31以及电极32是在电泳法中向毛细管管27施加预定的电压的部件。电极31被插入到分析芯片2的电极槽26,电极32被插入到分析芯片2的排出槽25,向电极31以及电极32施加的电压未受特别限制,但例如为0.5kv~20kv。
光源41是在电泳法中发出用于测定作为光学测定值的吸光度的光的部位。光源41例如具备出射预定的波长区域的光的led芯片。光学过滤器42衰减来自光源41的光之中预定波长的光的同时,透射剩余的波长的光。透镜43用于将透射光学过滤器42的光集光到分析芯片2的毛细管管27的分析位置。狭缝44用于去除通过透镜43集光的光之中、可能引起散射等的多余的光。
检测器5接受透射分析芯片2的毛细管管27过来的、来自光源41的光,例如构成为具备光电二极管、光电集成电路(photoic)等。
如此,从光源41发出的光到达检测器5的路径为光路。并且,在该光路与毛细管管27交叉的位置,针对流动在其毛细管管27的溶液(即,试样溶液以及泳动液中的任何一者或者其混合溶液)进行光学测定值的测定。即,在毛细管管27中与从光源41到检测器5的光路交叉的位置为光学测定值的测定部。作为该光学测定值,例如可以举出吸光度。吸光度表示该光路的光被毛细管管27中流动的溶液吸收的程度,表示入射光强度与透射光强度之比的常用对数值的绝对值。在该情况下,作为检测器5,能够利用通用的分光光度计。此外,即使不使用吸光度,只要是单纯的透射光强度值其本身等光学测定值,就能够用于本实施方式。以下,将作为光学测定值使用吸光度的情况为例子进行说明。
分注器6分注希望的量的稀释液ld、泳动液lm以及混合试样sm,例如包括喷嘴。分注器6能够通过未图示的驱动机构来自由移动在分析装置1内的多个预定位置。泵61是朝向分注器6的吸引源以及吐出源。另外,泵61可以作为设置于分析装置1的未图示的端口的吸引源以及吐出源而使用。这些端口用于泳动液lm的填充等。另外,也可以具备与泵61不同的其他专用的泵。
稀释液槽71是用于贮存稀释液ld的槽。稀释液槽71可以是永久设置于分析装置1的槽,也可以是封入预定量的稀释液ld的容器被装填到分析装置1的槽。泳动液槽72是用于贮存泳动液lm的槽。泳动液槽72可以是永久设置于分析装置1的槽,也可以是封入预定量的泳动液lm的容器被装填到分析装置1的槽。
稀释液ld用于通过与试样sa的混合来生成作为试样溶液的混合试样sm。稀释液ld的主剂未受特别限制,可以举出水、生理盐水,作为优选的例子,可以举出与后面叙述的泳动液lm类似的成分的液体。另外,对于稀释液ld,除了上述主剂之外,还可以根据需要添加添加物。
泳动液lm是在基于电泳法的分析工序中被填充到排出槽25以及毛细管管27、且产生电泳法中的电渗流的介质。泳动液lm未受特别限制,但优选使用了酸的泳动液。作为上述酸,例如存在柠檬酸、马来酸、酒石酸、琥珀酸、富马酸、邻苯二甲酸、丙二酸或者苹果酸。另外,泳动液lm优选包含弱碱基。作为上述弱碱基,例如存在精氨酸、赖氨酸、组氨酸或者三羟甲基氨基甲烷(tris)等。泳动液lm的ph例如为ph4.5~6的范围。作为泳动液lm的缓冲液的种类,存在2-吗啉乙磺酸(mes)、n-(2-乙酰氨基)亚氨基二乙酸(ada)、n-(2-乙酰氨基)-2-氨基乙烷磺酸(aces)、n,n-双(2-羟乙基)-3-氨基乙磺酸(bes)、3-(n-吗啡啉)丙磺酸(mops)、三羟甲基氨基甲烷乙磺酸(tes)或者4-羟乙基哌嗪乙磺酸(hepes)等。另外,与稀释液ld的说明中所述同样,泳动液lm中也可以根据需要添加添加物。
泳动液lm、稀释液ld以及混合试样sm例示以下,但在后面叙述的界面检测时间中,只要是能够产生因试样溶液(混合试样sm)与泳动液lm的界面的到达引起的光学测定值的变化的组合,就能够任意选择。
(泳动液lm)
泳动液lm例如含有以下的成分。
柠檬酸:40mm
硫酸软骨素c钠:1.25%w/v
哌嗪:20mm
聚氧烷基醚(商品名:emulgenls-110,花王公司制造):0.1%w/v
叠氮化钠:0.02%w/v
proclin(商标)300:0.025%w/v
除了以上的成分之外,滴落用于ph调整的二甲基氨基乙醇,调整为ph5.0。
(稀释液ld)
稀释液ld例如含有以下的成分。
柠檬酸:38mm
硫酸软骨素c钠:0.95%w/v
1-(3-磺丙基)氢氧化吡啶分子内盐(ndsb-201):475mm
2-吗啉乙磺酸(mes):19mm
聚氧烷基醚(商品名:emulgenls-110,花王公司制造):0.4%w/v
叠氮化钠:0.02%w/v
proclin300:0.025%w/v
除了以上的成分之外,滴落用于ph调整的二甲基氨基乙醇,调整为ph6.0。
(混合试样sm)
将1.5μl的试样sa添加到60μl的稀释液ld并作为混合试样sm。
控制部8控制分析装置1中的各部。控制部8例如具备cpu、存储器以及接口等。上述存储器中适当存储有用于进行本实施方式涉及的分析方法的程序、各种数据。
接着,针对使用分析系统a1进行的本实施方式涉及的分析方法的一个例子,以下进行说明。图4是示出本实施方式的分析方法的流程图。本分析方法具有准备工序s1、电泳工序s2以及分析工序s3。
<准备工序s1>
图5是示出准备工序s1中的具体顺序的流程图。在本实施方式中,如同图所示,准备工序s1具有试样采集工序s11、混合工序s12、泳动液填充工序s13以及导入工序s14。
<试样采集工序s11>
首先,准备试样sa。在本实施方式中,试样sa是从人体采集的血液。作为血液,可以是全血、成分分离血液或者实施了溶血处理的血液等。并且,将试样sa被分注的分析芯片2装填到分析装置1。
<混合工序s12>
接着,对试样sa和稀释液ld进行混合。具体而言,如图6所示,预定量的试样sa被点样到分析芯片2的混合槽22。接着,通过分注器6来吸引预定量的稀释液槽71的稀释液ld,如图7所示,将预定量的稀释液ld分注到分析芯片2的混合槽22。并且,将泵61作为吸引源以及吐出源,从分注器6反复进行稀释液ld的吸引以及吐出。由此,在混合槽22中试样sa与稀释液ld被混合,并得到作为试样溶液的混合试样sm。试样sa与稀释液ld的混合可以通过分注器6的吸引以及吐出以外的方法进行。
<泳动液填充工序s13>
接着,通过分注器6吸引预定量的泳动液槽72的泳动液lm,如图8所示,将预定量的泳动液lm分注到分析芯片2的排出槽25。并且,通过适当实施从上述端口的吸引、吐出等的方法,向排出槽25以及毛细管管27填充泳动液lm。
<导入工序s14>
接着,如图9所示,从混合槽22通过分注器6采集预定量的混合试样sm。并且,从分注器6向导入槽23导入预定量的混合试样sm。在该导入中,混合试样sm通过设置于导入槽23的开口部的过滤器24,该导入槽23的开口部是向导入槽23的导入路径的一个例子。另外,在本实施方式中,混合试样sm从导入槽23通过连络流路28向电极槽26填充。这时,引起从导入槽23经由了连络流路28的向电极槽26的混合试样sm的流动,但对于从导入槽23向连络流路28,试样sm向几乎与毛细管管27的长边方向正交的方向流动(参照图2)。另一方面,毛细管管27的泳动液lm在该阶段几乎不移动。其结果为,导入槽23与毛细管管27的连接部(参照图3)中产生剪切流,由此变成混合试样sm与泳动液lm的明确的界面产生的状态。此外,只要是产生混合溶液sm与泳动液lm的界面的方法,就能够采用物理地设置能够在导入槽23与毛细管管27的边界移动的过滤器、或者可控制地变更流动方法等、所谓的手段。
<电泳工序s2>
接着,如图1所示,向电极槽26插入电极31,向排出槽25插入电极32。接着,通过来自控制部8的指示向电极31以及电极32施加电压。该电压例如为0.5kv~20kv。由此产生电渗流,在毛细管管27中使混合试样sm从导入槽23向排出槽25慢慢移动。这时,由于在导入槽23填充有混合试样sm,因此在毛细管管27中连续供应混合试样sm的状态下,使作为上述分析成分的血红蛋白(hb)电泳。此时,在混合试样sm与泳动液lm的上述界面被维持的状态下,混合试样sm向下游方向推压泳动液lm的同时使毛细管管27泳动。另外,开始进行来自光源41的发光,并进行基于检测器5的吸光度的测定。并且,对从电极31以及电极32的电压施加开始时的经过时间与吸光度的关系进行测定。
<分析工序s3>
此处,与混合试样sm中的移动速度较快的成分对应的吸光度峰值在从上述电压施加开始时的经过时间较短的时间点出现。另一方面,与混合试样sm中的移动速度较慢的成分对应的吸光度峰值在从上述电压施加开始时的经过时间较长的时间点出现。利用该情况,进行混合试样sm中的成分的分析(分离测定)。在本实施方式中,进行血液中所含的血红蛋白(尤其变异血红蛋白)的分析,混合试样sm(血液)中可能所含的血红蛋白(变异血红蛋白)为分析成分。基于所测定的吸光度,通过控制部8的控制来执行分析工序s3。如图10所示,本实施方式的分析工序s3具有波形形成工序s31、界面检测工序s32、峰值波形特定工序s33以及成分确定工序s34。
<波形形成工序s31>
所测定的上述吸光度例如作为从测定开始时间点的随时间的累积值表示,因此成为随时间的单调增加的曲线。在本工序中,通过针对所测定的上述吸光度的随时间的累积值进行运算处理(例如,通过控制部8来进行的微分处理、差分处理等),制作电泳图。此处,将电压施加开始时作为测定开始时(0sec),形成和与该测定开始后的经过时间(检测时间)对应的吸光度相关的测定波形。
例如,未含有变异血红蛋白的hbaa待测体的电泳图变成如图11所示。此处,纵轴变成“吸光度变化率(mabs/sec)”表示在纵轴上取所测定的吸光度通过所述运算处理来微分处理得到的值(微分值)(以下,同样)。在本待测体中,源自hba的最大的峰值波形(以下,作为“最大峰值波形”)作为几乎单一的峰值波形而被明确识别,并且得到该峰值波形的检测时间是最大峰值检测时间。
另外,作为变异血红蛋白的纯合子的例子,hbcc待测体的电泳图变成如图12所示。在本待测体中,源自hbc的最大峰值波形被明确识别,但该峰值波形在比图11的hba的峰值波形的检测时间更长的检测时间(最大峰值检测时间)被检测出。
作为变异血红蛋白的纯合子的其他例子,hbee待测体的电泳图如图13所示。在本待测体中,源自hbe的最大峰值波形被明确识别,但该峰值波形在比图11的hba的峰值波形的检测时间稍微长、但比图12的hbc的峰值波形的检测时间更短的检测时间(最大峰值检测时间)被检测出。
作为变异血红蛋白的纯合子的另一个例子,hbss待测体的电泳图如图14所示。在本待测体中,源自hbs的最大峰值波形被明确识别,但该峰值波形在比图13的hbe的峰值波形的检测时间稍微长、但比图12的hbc的峰值波形检测时间更短的检测时间(最大峰值检测时间)被检测出。
此外,虽然未图示,但在作为变异血红蛋白的纯合子的hbdd待测体中,源自hbd的最大峰值波形在图13所示的hbe的峰值波形的检测时间与图14所示的hbs的峰值波形的检测之间的检测时间(最大峰值检测时间)被检测出。
并且,作为变异血红蛋白的杂合子的例子,hbsc待测体的电泳图变成如图15所示。在本待测体中,源自hbs的最大峰值波形在与图14所示的峰值波形的检测时间几乎相同的检测时间被检测出,该检测时间成为最大峰值检测时间。另外,源自hbc的第二个大的峰值波形(以下,作为“第二峰值波形”)在与图12所示的峰值波形的检测时间几乎相同的检测时间被检测出,该检测时间成为第二峰值检测时间。
如以上所示,测定波形具有与混合试样sm(试样sa)中所含的成分对应的峰值波形部分。并且,获取与上述峰值波形部分相关的信息。与上述峰值波形部分相关的信息针对所述最大峰值波形以及第二峰值波形的每一个包括峰顶部分的峰值时间(峰值波形部分中的最高位置的检测时间,参照图12)、低谷时间(峰值波形部分中的最低位置的检测时间,参照图12)、峰值波形部分的面积比(在夹着峰顶的两个低谷之间由峰值波形部分围绕的面积的、相对于测定波形中所表现的吸光度变化率为正的区域的全面积的比例)等,例如通过基于控制部8的运算处理等来得到。此外,低谷能够通过各种方法来决定。例如,可以将在峰顶的前后最近出现的极小值的位置作为低谷。另外,在没有这样的极小值的情况下(即,在从峰顶单调减少的情况下),例如可以将到达成为面积计算的基准的基线的位置视为低谷。
<界面检测工序s32>
此处,在图11~15中,测定开始后10秒左右看到的小的波形、即、一旦减少之后转为上升的波形表示在毛细管电泳中“eof”(electro-osmoticflow(电渗流)的简称)在测定部(具体而言,上述光路)中最初被检测出,“eof”是随着电压施加生成的毛细管中的液体整体的流动。此处,该eof最初被检测出的时间点具有作为表示混合试样sm与泳动液lm的界面到达测定部的情况的时间点的意义。在本实施方式中,从测定开始時到该时间点为止的时间称为“界面检测时间”。在本工序中,从作为光学测定值的吸光度的变化中检测出该eof,并决定作为从测定开始后到其被检测出为止的经过时间的“界面检测时间”。此外,在与上述测定部、上述光路不同地设置用于界面测定的测定部(光路)的情况下,只要在该位置决定即可。
<峰值波形特定工序s33>
在作为特征波形特定工序的峰值波形特定工序s33中,根据上述波形形成工序s31中得到的测定波形所表现的峰值波形涉及的成分,特定作为特征波形的最大峰值波形。
此处,重叠了前述图11~图15的电泳图的图为图16。如从本图中明确,可知源自hbc的峰值波形在比hba、hbe、hbd(未图示)以及hbs的各峰值波形的检测时间明显长的检测时间得到。另外,可知hba、hbe、hbd(未图示)以及hbs的各峰值波形接近,并且按照该顺序检测时间变长。即,当将hba、hbe、hbd、hbs以及hbc的各峰值波形的检测时间分别设为a、e、d、s以及c、且将界面检测时间设为t时,如图16所示,a、e、d以及s当然比t大,c显然大于a、e、d以及s。
具体而言,首先,根据上述波形形成工序中得到的测定波形,特定作为具有最大面积的峰值波形的最大峰值波形。此处,针对峰值波形的面积,如上所述,能够作为在峰顶的前后出现的低谷之间(参照图12)由峰值波形围绕的面积。
接着,根据相同的测定波形,特定作为具有第二个大的面积的峰值波形的第二峰值波形。此处,如图11~图14所示,在纯合子的情况下,最大峰值波形明确,但除此之外可以识别到若干个微小的峰值波形。由此,仅仅在相对于测定波形整体的面积占据预定的比例以上的情况下,能够识别为第二峰值波形。并且,在不是这样的情况下,第二峰值波形不存在,仅仅根据最大峰值波形来确定到作为纯合子的血红蛋白成分。
<成分确定工序s34>
在本工序中,基于上述峰值波形特定工序s33中特定的最大峰值波形被检测出的最大峰值检测时间(以及在存在第二峰值波形的情况下,该第二峰值波形被检测出的第二峰值检测时间)与界面检测时间的对比来确定。以下,针对具有图16所示那样能够与其他血红蛋白成分明显区分的hbc成分、以及实际上出现频率最高的hba成分中的至少一方的待测体中的血红蛋白成分的确定,进行说明。
此处,要求在使用了一次性分析芯片2的测定/分析中,即使因分析芯片2的个体差异等而相同成分的检测时间变动,也无需进行在多次测定中可进行的校正等,通过仅仅一次分析得到准确的分析结果。在通过仅仅一次分析以最大峰值波形部分的峰值时间(检测时间)为基准进行血红蛋白种类的确定的情况下,在分析成分的检测时间的变动大时,存在成分的确定未被准确地进行而分析结果中发生错误的情况。
鉴于如上所述的事情,通过将峰值波形的检测时间由界面检测时间相对化,未受到因分析芯片的个体差异等引起的检测时间的变动的影响而能够确定峰值波形涉及的血红蛋白成分。
具体而言,首先,将与上述峰值波形特定工序s33中特定的最大峰值波形的峰顶对应的检测时间作为最大峰值检测时间(p1)。
接着,在上述峰值波形特定工序s33中第二峰值波形被特定的情况下,将与该第二峰值波形的峰顶对应的检测时间作为第二峰值检测时间(p2)。
此时,例如,如图16所示,基于源自hbc成分的峰值波形的检测时间(c)比其他峰值波形的检测时间(a、e、d或者s)更长的情况,能够判定为如果最大峰值检测时间(p1)或第二峰值检测时间(p2)与界面检测时间(t)之比(换句刷说,将最大峰值检测时间或者第二峰值检测时间除以界面检测时间的值)大于预定的值,则其最大峰值波形源自hbc成分。
作为该预定的值,例如基于hbc成分以外最大的检测时间(图中,hbs成分的峰值波形的检测时间s)和hbc的峰值波形的检测时间c,优选具有满足
(s/t)<x<(c/t)
的关系的值x。
(1)存在hbc成分的情况
此处,针对最大峰值检测时间(p1)或者第二峰值检测时间(p2),如果
x<(p1/t)或者x<(p2/t),
则能够确定为该最大峰值波形或者第二峰值波形源自hbc成分。
(1-1)不存在第二峰值波形的情况
在该情况下,在仅仅最大峰值波形被特定、第二峰值波形未被特定的情况下,该待测体种类被确定为hbcc待测体。
(1-2)存在第二峰值波形的情况
另一方面,在存在最大峰值波形以及第二峰值波形两者的情况下,可以认为该待测体种类是具有hbc成分的杂合子、即、hbca待测体、hbce待测体、hbcd待测体、hbcs待测体、hbsc待测体、hbdc待测体、hbec待测体或者hbac待测体中的任何一者。
由此,基于最大峰值检测时间(p1)、第二峰值检测时间(p2)以及界面检测时间(t)的对比,即,基于由
y=(p1-t)/(p2-t)
定义的值y,能够确定上述最大峰值波形以及上述第二峰值波形涉及的成分,并能够确定待测体种类。
例如,如果
0.64≤y<0.67,
则该待测体确定为hbca待测体。针对其他杂合子,也可以通过适当设定该数值来确定。
(2)不存在hbc成分的情况
另一方面,如果
(p1/t)≤x且(p2/t)≤x,
则该最大峰值波形以及第二峰值波形均不是源自hbc成分待测体的波形。由此,可以认为该最大峰值波形以及第二峰值波形源自hba、hbe、hbd以及hbs中的任何一者的成分。但是,如前面叙述,hba成分以外的血红蛋白成分的出现频率稀少,因此在最大峰值波形未被判定为源自hbc成分的情况下,其最大峰值波形判定为源自hba成分。
(2-1)不存在第二峰值波形的情况
并且,在不存在第二峰值波形的情况下,如上面所述,最大峰值波形判定为源自hba成分,因此该待测体判定为hbaa待测体。
此外,在仅仅是最大峰值波形的情况下,该最大峰值波形不是作为上述中判定的纯合子的hbaa待测体,可能是稀少频率的、hbee待测体、hbdd待测体或者hbss待测体中的任何一者。在该情况下,利用最大峰值检测时间(p1)和界面检测时间(t),能够确定该待测体是哪个纯合子。
例如,在
下限值:(p1-t)×0.94+t
与
上限值:(p1-t)×0.97+t
之间的范围内存在被认为源自hba2成分的峰值波形的情况下,判断为存在该待测体为hbee待测体的嫌疑。
此外,在hbaa待测体的情况下,能够利用源自hba1c成分的峰值波形以及检测时间而确定。
(2-2)存在第二峰值波形的情况
另一方面,例如,在除了最大峰值波形之外第二峰值波形也被特定的情况下,可以认为该待测体是不具有hbc成分、具有hba成分的杂合子,即,hbsa待测体、hbda待测体、hbea待测体、hbae待测体、hbad待测体或者hbas待测体中的任何一者。
在该情况下,利用上述的值y,上述最大峰值波形以及上述第二峰值波形涉及的成分被确定,并能够确定待测体种类。
例如,如果0.81≤y<0.87,则该待测体确定为hbsa待测体。针对其他杂合子,也可以通过适当设定该数值来确定。但是,即使是不同的待测体种类,也存在值y处于相同范围、或者一部分重复的情况。在该情况下,优选通知存在每个待测体的嫌疑的情况。
此外,在上述中不存在源自hbc待测体的峰值波形、且存在第二峰值波形的情况下,以该待测体是具有hba成分的杂合子为前提进行待测体种类的确定,但实际上可能为最大峰值波形以及第二峰值波形均不源自hba待测体以及hbc待测体的杂合子。针对这样的基于hba待测体以及hbc待测体以外的组合的杂合子,可以利用上述值y来确定。
此时,也考虑到仅仅通过上述值y难以辨别的情况,但在该情况下,也能够参照测定波形而作为参照第三峰值波形的位置、面积确定的辅助信息。作为该第三峰值波形,例如可以考虑到hba1c、hba2、hbf等。另外,优选针对有可能性的待测体种类,通知存在嫌疑的情况。
此处,针对在表示上述说明中使用的数值范围的不等式中的不等号之中、到底对下限值以及上限值中的哪一个使用附带等号的不等号(≤),能够鉴于测定条件适当决定。
此外,针对用于本分析方法的一次性分析芯片2,也可能产生制造时的批次之间的分散性。关于同一批次的分析芯片2,各部的尺寸实质上相同,因此针对分析时的峰值波形的检测时间的变动,也可以观察到相同的变动倾向。因此,例如优选按照制造批次预先进行基于毛细管电泳法的分离测定,并收集峰值波形的检测时间的变动倾向等的批次之间差异的信息。并且,在试样的分析时,在成分确定工序(s34)之前,可以基于分析芯片2的批次之间差异信息来进行补正检测时间的工序。根据这样的分析方法,针对分析芯片2,即使产生批次之间的分散性也能够抑制分析准确度的降低。
以上,对本发明的具体实施方式进行了说明,但本发明涉及的分析方法不局限于上述的实施方式。本发明涉及的分析方法的各部的具体构成各种各样设计变更自如。
- 还没有人留言评论。精彩留言会获得点赞!