基于辅酶A适配体的电化学生物传感器的制备方法及其应用与流程
本发明涉及一种电化学生物传感器,尤其是涉及一种基于辅酶a适配体的电化学生物传感器的制备方法及其应用,属于功能生物材料和生物传感技术领域。
背景技术:
蛋白质乙酰化在真核细胞中是一个重要的过程。其中,组蛋白乙酰转移酶(hat)是一类具有催化活性的酶,它通过将乙酰辅酶a上的乙酰基转移至底物组蛋白或非组蛋白底物多肽的特定赖氨酸残基上,达到调节染色体结构进而调控基因的表达的目的。研究表明hat表达异常经常导致肿瘤疾病发生。p300是最常见的hat,其具有广泛的生物学功能,比如参与细胞的周期调控,基因转录的调控,维持某些蛋白质的功能及稳定性。此外,p300在病毒癌蛋白的转录翻译、胚胎的发育等方面也具有重要作用。因此,检测hatp300的活性有很重要的生化研究意义,也有利于制药业发展。
目前,关于hatp300的检测方法主要基于乙酰化抗体,如基于多肽连接量子点以及乙酰基特异性抗体的荧光检测方法和抗体介导的金纳米粒子比色分析方法等。然而,这些方法都存在抗体固有的缺点,比如高成本、低稳定性、较大差异性等。近年来,一些免抗体的测定hatp300活性的新方法已经引起极大关注,主要是基于乙酰化产物辅酶a(coa)的电化学及荧光方法,但仍然是冰山一角,存在较大研究空间。因此,开发一种简便、灵敏、低成本、选择性好的hatp300检测手段势在必行。核酸适配体(aptamer)是指利用指数富集配体系统进化技术,从人工合成的寡核苷酸文库中筛选得到的能够与靶分子特异结合的寡核苷酸链。与靶分子相互作用时,可以通过自适应的诱导契合变化和折叠,与靶分子形成稳定的复合物。核酸适配体与靶分子的识别结合作用包含了构象形状的互补作用、芳香化合物的堆砌作用、带电基团的静电作用及氢键作用等核酸适配体的特异结合功能与抗体蛋白质相似,但与抗体相比,核酸适配体具有许多独特优势,如化学稳定性强、能够体外筛选与化学合成、可以进行化学基团的修饰、不存在免疫源性等。分析检测领域,由于核酸适配体与靶分子的高特异性与高亲和力,使其非常适合作为识别元件来构成生物传感器,进行目标分子的特异识别。
本发明基于coa适配体(coa-aptamer)与coa特异性结合作用设计了hatp300电化学生物传感器制备方法及应用。首先,将coa适配体通过au-s作用修饰到电极表面,当乙酰化反应溶液加入到电极表面后,由于生成的coa与其适配体的特异性结合作用,阻碍了核酸外切酶(exoi)水解,再通过末端转移酶(tdt)延长形成富cdna链并制备银纳米簇(agncs),进而通过ag的溶出伏安信号间接实现hat活性检测。如果乙酰化反应没有发生,coa-aptamer保持单链状态,且能够被核酸外切酶(exoi)水解,不能产生电化学信号。该传感器可以用来检测hatp300活性并筛选其小分子抑制剂。基于coa-aptamer构建的电化学生物传感器特异性好、灵敏度高、结果准确可靠、成本低、快速,且制备过程极其简单。目前,国内外还没有公开任何基于coa-aptamer及ag溶出伏安法构建的电化学生物传感器用于检测hatp300及其小分子抑制剂的相关报道。
技术实现要素:
本发明的目的是提出一种基于辅酶a适配体的电化学生物传感器的制备方法及其应用。此方法首次将基于coa-aptamer及ag溶出伏安法构建的电化学生物传感器用于hatp300的活性检测。
本发明解决上述技术问题所采用的技术方案为:一种基于辅酶a适配体的电化学生物传感器的制备方法及其应用,具体步骤如下:
(1)基于coa适配体的电化学生物传感器的制备:
electrode1的制备:
将金电极(直径为2mm)在麂皮上用三氧化二铝粉末抛光2~5min,抛光后将电极置于超声清洗器中用二次蒸馏水中超声清洗2~5min,然后用n2吹干,取coa-aptamer溶液(2~5μl,0.1~0.5μm),80~90℃下加热5~10min,然后逐渐冷却至室温,滴涂于电极表面,在4℃冰箱孵育过夜,蒸馏水缓缓冲洗电极,采用巯基己醇(mch,2~5μl,0.5~1.0mm)处理30~60min,置换电极表面非au-s键固定的coa-aptamer,蒸馏水缓缓冲洗电极,标记为electrode1。
electrode2的制备:
依次取ac-coa(0.1~1μl,0.1~1mm),多肽(0.1~1μl,0.1~1mm),hatp300(0.1~1μl,0.01~500nm),加h2o至总体积2~5μl。搅拌器上剧烈搅拌2~5min至混合均匀,然后移至温度为32~40℃的水浴锅中孵育1~3h,稀释10倍备用。取2~5μl乙酰化反应液滴涂于electrode1表面,在32~40℃孵育30~60min,而后蒸馏水缓缓冲洗电极,标记为electrode2。
electrode3的制备:
取exoi溶液(2~5μl,0.5~1.0u/μl)滴涂于electrode2表面,在室温下孵育30~120min,而后蒸馏水缓缓冲洗电极。再滴加2~10μltdt反应液(组成为:1~5μl5×tdt缓冲液,dctp(1~3μl,5~10mm),tdt(1~3μl,5~10u/ml),加h2o至总体积为2~10μl),在32~40℃下放置1~3h,蒸馏水缓缓冲洗电极,标记为electrode3。
electrode4的制备:
向electrode3电极表面滴加ag+(2~5μl,1~3μm),室温孵育15~30min,蒸馏水缓缓冲洗电极,再向电极表面滴加硼氢化钠溶液(nabh4,2~5μl,1~3μm),室温下避光反应15~30min,蒸馏水缓缓冲洗电极,标记为electrode4。
(2)基于coa适配体的电化学生物传感器的应用
在electrode2制备过程中,改变hatp300浓度,用于传感器制备,然后如以上步骤(1)制备一系列传感器,用来检测不同浓度hatp300的电化学响应。
本发明用到的coa-aptamer序列为(5’-3’):gggcacgagcgaagggcataagctgacgaaagtcagacaagacatggtgccc。
利用上述基于coa-aptamer的电化学生物传感器,检测hatp300浓度。通过方波伏安法,设置电位范围为0.05~0.25v,振幅为25mv,检测所制备电化学生物传感器在磷酸缓冲溶液(pbs,0.1m,ph7.0)中对hatp300的电化学溶出伏安响应,获得hatp300对应的电化学溶出伏安响应电流大小,建立响应电流与hatp300浓度之间的定量关系,根据两者之间的定量关系,确定待测样品中hatp300含量。
发明原理:本发明基于coa-aptamer与coa特异性结合作用设计了hatp300电化学生物传感器制备方法及应用。首先,将coa-aptamer通过au-s作用修饰到电极表面,当乙酰化反应溶液加入到电极表面后,由于生成的coa与其适配体的特异性结合作用,阻碍了exoi水解,再通过tdt延长形成富cdna链并制备agncs,进而通过ag的溶出伏安信号间接实现hatp300活性检测。如果乙酰化反应没有发生,coa-aptamer保持单链状态,能够被exoi水解,不能产生电化学信号。
相对于现有技术,本发明所述的一种基于辅酶a适配体的电化学生物传感器的制备方法及其应用具有以下优势:
(1)高灵敏度。实验得出传感器的电流响应对hatp300对数的线性范围为0.01~100nm,线性相关方程为y=4.48x+9.92,r2=0.9973,检测限为0.005nm,可实现对hatp300的高灵敏检测。
(2)高特异性和强抗干扰能力。其他常见的酶如辣根过氧化物酶(hrp)、胰凝乳蛋白酶(chy)、溶菌酶(lzm)、乙酰胆碱酯酶(ache)、蛋白激酶(pka)和木瓜蛋白酶(papain)等对本检测体系均无干扰。
(3)结果准确。回收率均在90%~110%之间。
(4)传感器可以用于hatp300小分子抑制剂漆树酸和c646的筛选,ic50分别为28.50μm、3.62μm,对临床诊断及药物开发意义重大。
综上所述,本发明是基于coa-aptamer构建的电化学生物传感器,通过ag溶出伏安来实现hatp300活性检测其抑制剂的筛选,具有灵敏度高、选择性好、操作简单、分析快速、易于操作等优点,可以实现低浓度hatp300检测,具有良好的应用前景。
附图说明
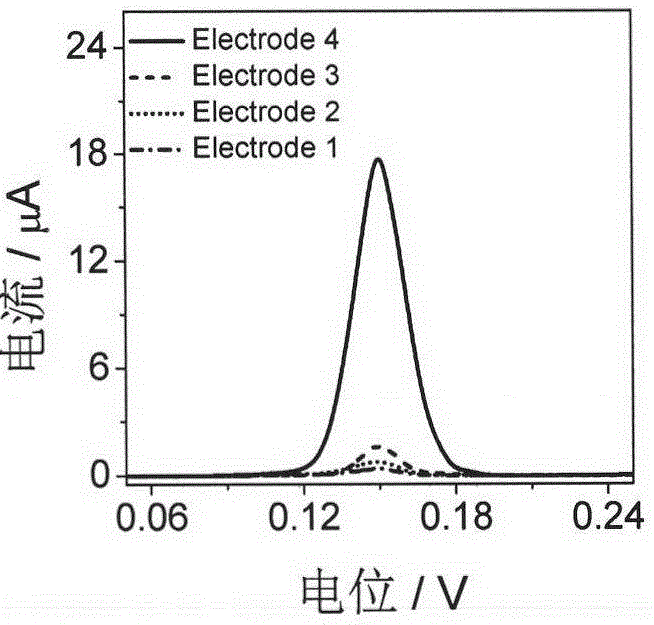
图1为本发明传感器的可行性实验图;
图2为本发明传感器对有无hatp300的对比图;
图3为本发明传感器对hatp300的电流响应对浓度对数的校准曲线图;
图4为本发明传感器对hatp300的选择性实验图;
图5为本发明传感器对hatp300的抗干扰实验图;
图6为本发明传感器对hatp300的抑制剂漆树酸的校准曲线图;
图7为本发明传感器对hatp300的抑制剂c646的校准曲线图。
具体实施方式
以下结合附图实施例对本发明作进一步详细描述。
实施例1传感器的制备
本发明解决上述技术问题所采用的技术方案为:基于辅酶a适配体的电化学生物传感器的制备方法及其应用,具体步骤如下:
electrode1的制备:
将金电极(直径为2mm)在麂皮上用三氧化二铝粉末抛光5min,抛光后将电极置于超声清洗器中用二次蒸馏水中超声清洗5min,然后用n2吹干,取coa-aptamer溶液(5μl,0.1μm),90℃下加热5min,然后逐渐冷却至室温,滴涂于电极表面,在4℃冰箱孵育过夜,蒸馏水缓缓冲洗电极,采用巯基己醇(mch,5μl,1.0mm)处理30min,置换电极表面非au-s键固定的coa-aptamer,蒸馏水缓缓冲洗电极,标记为electrode1。
electrode2的制备:
依次取ac-coa(1μl,1mm),多肽(0.4μl,1mm),hatp300(0.4μl,500nm),加h2o至总体积2μl。搅拌器上剧烈搅拌2min至混合均匀,然后移至温度为37℃的水浴锅中孵育3h,稀释10倍备用。取5μl乙酰化反应液滴涂于electrode1表面,在37℃孵育30min,而后蒸馏水缓缓冲洗电极,标记为electrode2。
electrode3的制备:
取exoi溶液(5μl,0.5u/μl)滴涂于electrode2表面,在室温下孵育30min,而后蒸馏水缓缓冲洗电极。再滴加5μltdt反应液(组成为:1μl5×tdt缓冲液,dctp(1μl,10mm),tdt(1μl,10u/ml),加h2o至总体积为5μl),在37℃下放置1h,蒸馏水缓缓冲洗电极,标记为electrode3。
electrode4的制备:
向electrode3电极表面滴加ag+(5μl,1μm),室温孵育15min,蒸馏水缓缓冲洗电极,再向电极表面滴加nabh4溶液(5μl,1μm),室温下避光反应15min,蒸馏水缓缓冲洗电极,标记为electrode4。
实施例2可行性实验
本发明解决上述技术问题所采用的技术方案为:基于辅酶a适配体的电化学生物传感器的制备方法及其应用,具体步骤如下:
(1)如实施例1制备electrode1~electrode4,并检测其在pbs(0.1m,ph7.0)溶液的电化学溶出伏安响应。利用方波伏安法,设置电位范围为0.05~0.25v,振幅为25mv。从图1可以看出:electrode4在pbs(0.1m,ph7.0)中有明显的电化学响应信号,其它电极的电化学响应信号几乎可以忽略。由此证明了基于coa适配体构建的电化学生物传感器成功制备和乙酰化反应发生,说明其在理论上和技术上是可行的。
(2)利用方波伏安法,设置电位范围为0.05~0.25v,振幅为25mv,研究了有无hatp300存在时,制备的电化学生物传感器在pbs(0.1m,ph7.0)中的电化学响应。从图2可以看出:无hatp300存在时,传感器在pbs(0.1m,ph7.0)中几乎无响应;有hatp300存在时,传感器在pbs(0.1m,ph7.0)中有明显的电化学响应。证明该传感器可用于hatp300活性的检测。
实施例3hatp300活性的检测
在实施例1electrode2的制备过程中,改变hatp300浓度,控制hatp300终浓度分别为:0,0.01,0.012,0.014,0.016,0.018,0.02,0.05,0.1,0.2,0.5,1.0,5.0,10,50,100,200,500nm,如实施例1制备一系列电化学生物传感器。实验结果如图3所示,传感器的电流响应对hatp300浓度对数值的线性相关方程为y=4.48x+9.92,r2=0.9973,线性范围为0.01~100nm,检测限为0.005nm,说明传感器对hatp300活性可实现高灵敏检测。
实施例4选择性及抗干扰实验
(1)选择性实验:在实施例1electrode2的制备过程中,将hatp300替换为其它酶(辣根过氧化物酶(hrp)、胰凝乳蛋白酶(chy)、溶菌酶(lzm)、乙酰胆碱酯酶(ache)、木瓜蛋白酶(papain)和蛋白激酶(pka)),如实施例1步骤制备一系列电化学传感器,浓度均为100nm,blank为空白信号。结果如图4所示,与hatp300对比,传感器对其他酶的电化学响应非常小,基本接近空白信号,说明传感器对于hatp300的检测有很好的选择性。
(2)抗干扰实验:在实施例1electrode2的制备过程中,将其它酶(辣根过氧化物酶(hrp)、胰凝乳蛋白酶(chy)、溶菌酶(lzm)、乙酰胆碱酯酶(ache)、木瓜蛋白酶(papain)和蛋白激酶(pka))添加到hatp300反应液中,如实施例1步骤制备一系列电化学传感器,浓度均为100nm,mixture为所有酶的混合物。结果如图5所示,峰电流的大小与仅有hatp300存在时的峰电流基本没有差异,说明该传感器的抗干扰能力较好。
实施例5抑制剂筛选
(1)小分子抑制剂漆树酸的检测:在实施例1electrode2的制备过程中,将不同浓度的漆树酸(终浓度分别为:0,0.1,0.2,0.5,1,2,5,10,20,40,80,100,150,200,500,1000μm)加入到乙酰化反应液中,如实施例1步骤制备一系列电化学传感器。根据实验结果得知(如图6),随着抑制剂漆树酸浓度的增大,电流响应随之减弱,说明漆树酸对p300活性有良好的抑制作用,半抑制浓度为28.50μm。
(2)小分子抑制剂c646的检测:在实施例1electrode2的制备过程中,将不同浓度的c646(终浓度分别为:0,0.01,0.02,0.05,0.1,0.2,0.5,1,2,5,10,20,40,80,120,200μm)加入到乙酰化反应液中,如实施例1步骤制备一系列电化学传感器。根据实验结果得知(如图7),随着抑制剂c646浓度的增大,相对应的电流响应越弱,说明c646对p300活性的抑制作用越强,半抑制浓度为3.62μm。
当然,上述说明并非对本发明的限制,本发明也并不限于上述举例。本技术领域的普通技术人员在本发明的实质范围内做出的变化、改型、添加或替换,也应属于本发明保护范围。
- 还没有人留言评论。精彩留言会获得点赞!