一种分析水体中微塑料对邻苯二甲酸酯吸附机理的方法与流程
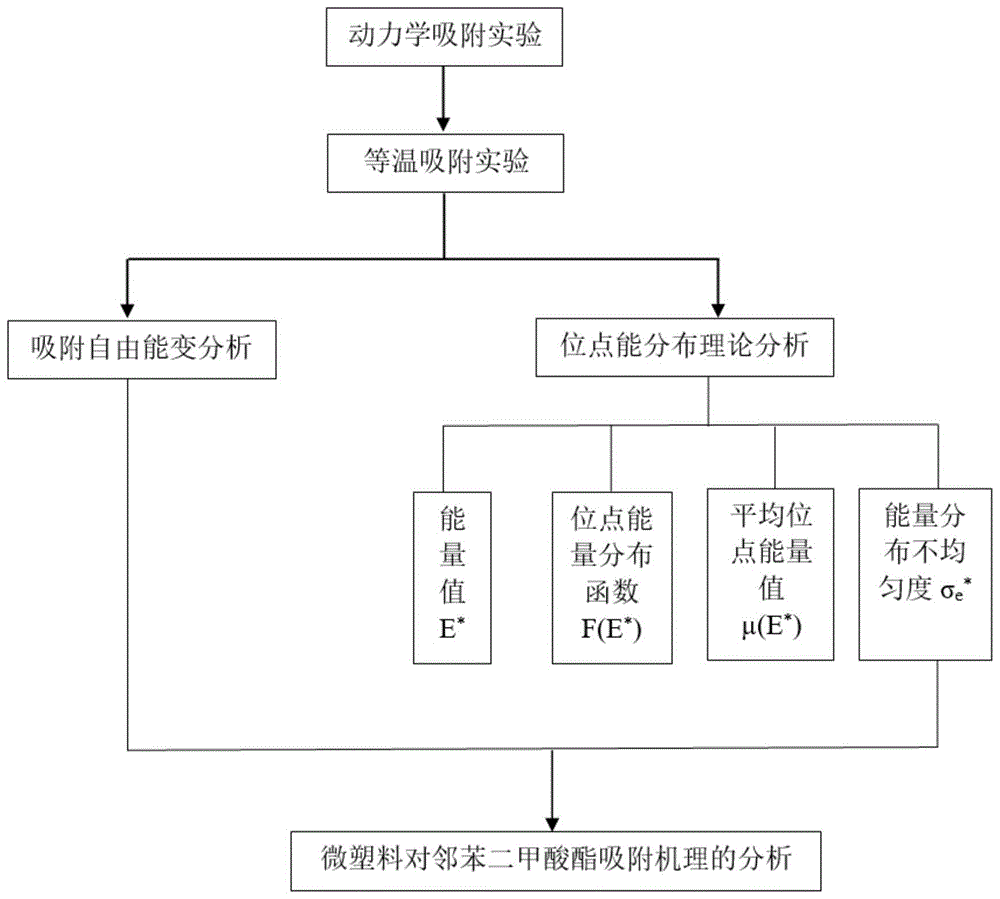
本发明涉及水体中微塑料的环境行为及其生态效应研究技术领域,更具体地,涉及一种分析水体中微塑料对邻苯二甲酸酯吸附机理的方法。
背景技术:
邻苯二甲酸酯(phthalateesters,paes)又称酞酸酯,是被广泛使用于工业生产中的一类常用增塑剂。paes普遍存在于自然环境和人类环境中,其在环境中性质稳定,存留时间长,有较强的生物蓄积毒性,给人体及环境带来极大危害。目前,paes已成为一种全球性的重要环境有机污染物,其在水体环境中已普遍检出。随着塑料的大量生产与使用,使得微塑料作为一种新兴污染物在环境中凸现出来。微塑料是指直径小于5mm塑料颗粒(microplastics,mps)。微塑料在自然环境中分布广泛,容易被生物摄食,对生物有一定的毒害作用。自然环境中的微塑料很难被彻底降解,其在环境中长期留存会对人类的生活造成严重威胁。已有一些研究发现水体中微塑料会吸附有机污染物,成为污染物的载体。吸附了污染物的微塑料随着洋流、风力等外力作用而发生迁移,扩大了污染物的分布范围,对生态环境造成影响。此外,吸附了污染物的微塑料一旦被生物摄食后,会在生物体内发生解吸并释放出有毒污染物,对生物体产生一系列的生态毒性。因此,研究不同水体溶液条件下微塑料对有机污染物的吸附作用有助于了解其在水体中的环境行为以及生态效应,也为水体环境中mps和paes的有效控制提供科学依据。
位点能分布理论因其可提供吸附剂吸附位点的能量分布等重要信息,在国内外吸附机理的研究中具有广泛的应用。位点能量分布分析是基于等温吸附模型相关参数构建不同的表达式来进行分析,可通过高能位点、低能位点和吸附位点能量的平均值等吸附位点能量信息,基于不同位点的能量强弱来揭示吸附的机理。此外,还可以通过吸附剂表面的不均匀性信息对吸附剂的异质性进行分析。目前已有一些研究对微塑料吸附有机污染物进行了报道,专利cn201710307713.6公开了一种分析微塑料携带邻苯二甲酸酯类化合物在生物体内富集含量的方法,但关于探究水体溶液化学对微塑料吸附有机污染物的影响以及深入分析其吸附机理的研究还鲜有报道,已有的关于微塑料吸附有机污染物的报道只是简单的分析了其动力学吸附于等温吸附过程,并没有系统的分析方法对其吸附行为进行阐述。位点能分布理论被广泛用于碳材料的吸附研究机理分析中,随后被应用到环境领域的相关研究中,然而目前还未见有将其应用到微塑料吸附污染物的吸附机理分析中的相关报道。
技术实现要素:
本发明为了克服现有技术存在的上述不足,提供一种分析水体中微塑料对邻苯二甲酸酯吸附机理的方法。本发明采用了基于freundlich模型的能量分布图对不同条件下mps吸附paes的行为进行分析,考察了ph、离子强度、腐殖酸浓度对水体中微塑料吸附邻苯二甲酸酯的影响,通过对比mps吸附不同paes之间的差异性,揭示了mps与paes的吸附机理。
本发明的上述目的是通过以下技术给予实现的:
一种分析水体中微塑料对邻苯二甲酸酯吸附机理的方法,包括以下步骤:
s1.进行水体中微塑料对邻苯二甲酸酯动力学吸附实验,对动力学吸附数据进行模型拟合,计算初始吸附速率;
s2.进行水体中微塑料对邻苯二甲酸酯等温吸附实验,分别利用freundlich模型、langmuir模型对吸附等温线进行拟合,分析等温吸附特性;
s3.利用步骤s2的等温吸附实验,计算自由能变△g0,通过自由能变△g0从热力学角度分析吸附过程;
s4.利用步骤s2的等温吸附实验,确定能量值e*及位点能量分布函数f(e*),计算平均位点能量值μ(e*)和能量分布不均匀度σe*,分析位点能量分布特性。
优选地,步骤s1所述拟合为进行准一级动力学、准二级动力学模型拟合,根据准二级动力学模型拟合参数计算初始吸附速率,见下列公式(1):
式中:v为初始吸附速率,单位为μg·mg-1·h-1;k2为准二级动力学模型速率常数;qe为准二级动力学模型理论平衡吸附量,单位为μg/mg。
优选地,步骤s3所述自由能变△g通过下列公式(2)(3)计算可得:
△g0=-rtlnkd(2)
式中:qe为达到平衡时吸附剂的吸附量,单位为μg/mg;ce是吸附达到平衡时溶液相中吸附质的浓度,单位为mg/l;kd为吸附平衡常数或分布系数,单位为l/g。
优选地,步骤s4所述能量值e*利用步骤s2的等温吸附实验,通过“近似凝聚法”得到以下e*与ce的关系式(4):
式中:cs是溶质最大溶解度,ce表示平衡时溶液中吸附质的浓度,r是通用气体常数8.314j·mol·k-1,t是绝对温度,e是ce时的吸附能,es指的是cs时的吸附能;e*为在参考点es的基础上的吸附剂表面的溶质和溶剂之间的吸附能量的差,单位为kj/mol。键能e*越大说明解吸所需能量越大,即吸附越稳定。
优选地,步骤s4所述位点能量分布函数f(e*)根据下列公式(5)确定:
式中:f(e*)为位点能量分布函数,能量分布函数f(e*)随e*的增加呈指数形式下降,f(e*)曲线下的面积可以被视为特定能量范围内可用吸附位点的数量;kf为freundlich常数,单位为l/g;n是freundlich模型拟合的无量纲常数。
优选地,步骤s4所述平均位点能量值μ(e*)计算公式(6)如下:
式中:μ(e*)为吸附平均位点能量值,单位为kj/mol。吸附位点能量的平均值μ(e*)数值越大,说明吸附剂的吸附性能越好。
优选地,步骤s4所述能量分布不均匀度σe*通过如下公式(7)(8)计算:
式中:σe*为能量分布不均匀度,即非均质性,单位为kj/mol,σe*数值越大。说明吸附剂的吸附位点异质性越强,吸附位点能量分布不均匀。
作为一种优选地可实施方式,本发明所述分析水体中微塑料对邻苯二甲酸酯吸附机理的方法,具体包括如下步骤:
步骤一,进行水体中微塑料对邻苯二甲酸酯动力学吸附实验,对动力学吸附数据进行准一级动力学、准二级动力学模型拟合,根据准二级动力学模型拟合参数计算初始吸附速率,见下列公式(1):
式中:v为初始吸附速率,单位为μg·mg-1·h-1;k2为准二级动力学模型速率常数;qe为准二级动力学模型理论平衡吸附量,单位为μg/mg。
步骤二,基于步骤一中的动力学吸附研究进行水体中微塑料对邻苯二甲酸酯等温吸附实验,分别利用freundlich模型、langmuir模型对吸附等温线进行拟合,分析了等温吸附特性。
步骤三,吸附自由能变分析
利用步骤二中的等温吸附实验,热力学参数自由能变△g0(kj/mol)可以通过下列公式(2)(3)计算可得:
△g0=-rtlnkd(2)
式中:qe为达到平衡时吸附剂的吸附量,单位为μg/mg;ce是吸附达到平衡时溶液相中吸附质的浓度,单位为mg/l;kd为吸附平衡常数或分布系数,单位为l/g。通过自由能变△g0从热力学角度对吸附过程进行分析。
步骤四,位点能分布理论分析
(1)能量值e*的确定:利用步骤二中的等温吸附实验,通过“近似凝聚法”可以得到以下e*与ce的关系式(4):
式中:cs是溶质最大溶解度,ce表示平衡时溶液中吸附质的浓度,r是通用气体常数8.314j·mol·k-1,t是绝对温度,e是ce时的吸附能,es指的是cs时的吸附能。e*指的是在参考点es的基础上的吸附剂表面的溶质和溶剂之间的吸附能量的差,是平衡浓度ce时发生吸附作用的最低键和能,单位为kj/mol。键能e*越大说明解吸所需能量越大,即吸附越稳定。
(2)位点能量分布函数f(e*)的确定:根据ce和e*之间的关系式(4),吸附等温线模型可以被描述为一个与e*相关的函数qe(e*)。然后通过对qe(e*)求导即可得到近似的位点能量分布函数f(e*),见下列公式(5):
式中:f(e*)为位点能量分布函数,能量分布函数f(e*)随e*的增加呈指数形式下降,f(e*)曲线下的面积可以被视为特定能量范围内可用吸附位点的数量。kf为freundlich常数,单位为l/g;n是freundlich模型拟合的无量纲常数。
(3)平均位点能量值μ(e*)的确定:构建吸附位点能量的平均值μ(e*)的计算公式(6)如下:
式中:μ(e*)为吸附平均位点能量值,单位为kj/mol,吸附位点能量的平均值μ(e*)数值越大,说明吸附剂的吸附性能越好。
(4)利用数学期望和标准偏差构建量化能量分布不均匀度(σe*),其可如下公式(7)(8)计算:
式中:σe*为能量分布不均匀度,即非均质性,单位为kj/mol,σe*数值越大,说明吸附剂的吸附位点异质性越强,吸附位点能量分布不均匀。
与现有技术相比,本发明具有以下有益效果:
本发明提供了一种分析水体中微塑料对邻苯二甲酸酯吸附机理的方法,不仅通过动力学吸附特性与等温吸附特性阐述了不同条件下微塑料吸附paes行为,同时结合热力学参数与位点能量分布特性揭示了微塑料对邻苯二甲酸酯的吸附机理;本发明方法操作步骤简洁,容易实现,系统地从不同角度分析了微塑料对邻苯二甲酸酯的吸附行为,具有较大的应用前景。
附图说明
图1为本发明分析水体中微塑料对邻苯二甲酸酯吸附机理的方法的技术路线流程图。
图2为不同腐殖酸浓度条件下水体中微塑料对邻苯二甲酸二乙酯(dep)、邻苯二甲酸二丁酯(dbp)动力学吸附拟合曲线。
图3为不同腐殖酸浓度条件下水体中微塑料对邻苯二甲酸二乙酯(dep)、邻苯二甲酸二丁酯(dbp)等温吸附拟合曲线。
图4为不同腐殖酸浓度条件下水体中微塑料吸附邻苯二甲酸二乙酯(dep)、邻苯二甲酸二丁酯(dbp)位点能量分布曲线。
图5为不同ph条件下水体中微塑料对邻苯二甲酸二乙酯(dep)、邻苯二甲酸二丁酯(dbp)动力学吸附拟合曲线和等温吸附拟合曲线。
图6为不同ph条件下水体中微塑料吸附邻苯二甲酸二乙酯(dep)、邻苯二甲酸二丁酯(dbp)位点能量分布曲线。
图7为不同离子强度条件下水体中微塑料对邻苯二甲酸二乙酯(dep)、邻苯二甲酸二丁酯(dbp)动力学吸附拟合曲线。
图8为不同离子强度条件下水体中微塑料对邻苯二甲酸二乙酯(dep)、邻苯二甲酸二丁酯(dbp)等温吸附拟合曲线。
图9为不同离子强度条件下水体中微塑料吸附邻苯二甲酸二乙酯(dep)、邻苯二甲酸二丁酯(dbp)位点能量分布曲线。
具体实施方式
以下结合具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。
实施例1考察腐殖酸浓度对水体中微塑料吸附邻苯二甲酸酯的影响
1、动力学吸附实验
以聚苯乙烯微粒(micro-ps)为模式微塑料,浓度为20mg/l;以邻苯二甲酸二乙酯(dep)、邻苯二甲酸二丁酯(dbp)为代表性邻苯二甲酸酯类(paes)有机污染物,浓度为1mg/l;腐殖酸(ha)浓度设置为0.1mgtoc/l、1.0mgtoc/l、5.0mgtoc/l,分别在5min、15min、30min、1h、2h、3h、5h、8h、10h、12h、24h时间点采样,每个采样时间点分别设置3组平行,0.45μm针式过滤器过滤,paes滤液经正己烷涡旋萃取1min,取溶剂相gc-ms分析检测。对动力学吸附数据进行准一级动力学、准二级动力学模型拟合,同时基于准二级动力学拟合参数计算了初始吸附速率v。
初始吸附速率计算见下列公式(1):
式中:v为初始吸附速率,单位为μg·mg-1·h-1;k2为准二级动力学模型速率常数;qe为准二级动力学模型理论平衡吸附量,单位为μg/mg。
拟合参数以及初始吸附速率如表1所示,拟合曲线如图2所示,可得出:动力学吸附过程符合准二级动力学模型,腐殖酸的存在对动力学吸附过程产生抑制作用。
表1动力学吸附数据表
2、等温吸附实验
micro-ps浓度设置为20mg/l,设置dep、dbp的浓度为0.5、1.0、1.5、2.0、2.5mg/l的梯度,每个梯度设置3组平行。吸取一定量micro-ps悬浮液于不同的玻璃瓶中,ph调至6。置于25℃恒温箱中避光搅拌,转速为120r/min,24h后取样,0.45μm针式过滤器过滤,paes滤液经正己烷涡旋萃取1min,取溶剂相gc-ms分析检测。分别利用freundlich模型、langmuir模型对吸附等温线进行拟合,拟合参数如表2所示,等温线拟合如图3所示。可得出:等温吸附过程符合freundlich模型,吸附过程为非均相吸附。
表2等温吸附数据表
3、吸附自由能变分析
基于等温吸附数据计算了吸附过程的自由能变△g0,热力学参数自由能变△g0(kj/mol)可以通过下列公式(2)(3)计算可得:
△g0=-rtlnkd(2)
式中:qe为达到平衡时吸附剂的吸附量,单位为μg/mg;ce是吸附达到平衡时溶液相中吸附质的浓度,单位为mg/l;kd为吸附平衡常数或分布系数,单位为l/g。通过自由能变△g0从热力学角度对吸附过程进行分析。
结果发现△g0均为负值,可得出:微塑料吸附paes的过程为自发吸附过程。
4、位点能分布理论分析
进行位点能分布理论分析,包括如下步骤:
(1)能量值e*的确定:利用步骤2等温吸附实验,通过“近似凝聚法”可以得到以下e*与ce的关系式(4):
式中:cs是溶质最大溶解度,ce表示平衡时溶液中吸附质的浓度,r是通用气体常数8.314j·mol·k-1,t是绝对温度,e是ce时的吸附能,es指的是cs时的吸附能。e*指的是在参考点es的基础上的吸附剂表面的溶质和溶剂之间的吸附能量的差,是平衡浓度ce时发生吸附作用的最低键和能,单位为kj/mol。键能e*越大说明解吸所需能量越大,即吸附越稳定。
(2)位点能量分布函数f(e*)的确定:根据ce和e*之间的关系式(4),吸附等温线模型可以被描述为一个与e*相关的函数qe(e*)。然后通过对qe(e*)求导即可得到近似的位点能量分布函数f(e*),见下列公式(5):
式中:f(e*)为位点能量分布函数,能量分布函数f(e*)随e*的增加呈指数形式下降,f(e*)曲线下的面积可以被视为特定能量范围内可用吸附位点的数量。kf为freundlich常数,单位为l/g;n是freundlich模型拟合的无量纲常数。
(3)平均位点能量值μ(e*)的确定:构建吸附位点能量的平均值μ(e*)的计算公式(6)如下:
式中:μ(e*)为吸附平均位点能量值,单位为kj/mol,吸附位点能量的平均值μ(e*)数值越大,说明吸附剂的吸附性能越好。
(4)利用数学期望和标准偏差构建量化能量分布不均匀度(σe*),其可如下公式(7)(8)计算:
式中:σe*为能量分布不均匀度,即非均质性,单位为kj/mol,σe*数值越大,说明吸附剂的吸附位点异质性越强,吸附位点能量分布不均匀。
基于freundlich模型的位点能量分布图如图4所示,同时计算了平均位点能量值和能量分布不均匀度如表3,可得出:微塑料表面的吸附位点能量分布不均匀,吸附过程中paes优先占据高能位点,dbp的疏水性大于dep,微塑料对dbp的吸附性能优于dep,paes主要通过疏水性相互作用吸附在微塑料表面。
表3位点能数据表
实施例2考察ph对水体中微塑料吸附邻苯二甲酸酯的影响
参照实施例1中的实施步骤,考察ph2、ph10对水体中微塑料吸附邻苯二甲酸酯的影响。
1、动力学吸附模型拟合参数以及初始吸附速率如表4所示,拟合曲线如图5(a)所示,可得出:ph对动力学吸附过程没有十分显著的影响。
表4动力学吸附数据表
2、等温吸附模型拟合参数如表5所示,拟合曲线如图5(b)所示,可得出:ph对等温吸附过程没有十分显著的影响。
表5等温吸附数据表
3、吸附自由能变△g0均为负值,可得出:不同ph条件下微塑料吸附paes的过程均为自发吸附过程。
4.位点能量分布图如图6所示,可得出:不同ph条件下位点能量分布特性十分接近,ph对微塑料吸附paes的影响甚微。
实施例3考察离子强度对水体中微塑料吸附邻苯二甲酸酯的影响
参照实施例1中的实施步骤考察了nacl离子强度为0.10mm、5.00mm、25.0mm、50.0mm对水体中微塑料吸附邻苯二甲酸酯的影响。
1、动力学吸附模型拟合参数以及初始吸附速率如表6所示,拟合曲线如图7所示,可得出:离子强度的增大促进了微塑料对paes的动力学吸附过程。
表6动力学吸附数据表
2、等温吸附模型拟合参数如表7所示,拟合曲线如图8所示,可得出:随着离子强度的增大,微塑料等温吸附paes的平衡吸附量增大,吸附性能增强。
表7等温吸附数据表
3、吸附自由能变△g0均为负值,可得出:不同离子强度条件下微塑料吸附paes的过程均为自发吸附过程。
4、位点能量分布图如图9所示,可得出:随着溶液中nacl离子强度的增大,微塑料吸附位点能量越大,分布曲线的积分面积越大,可提供给paes的吸附位点数量越多,吸附性能增强。
本发明方法模拟了实际水体中微塑料与有机污染物的相互作用,考察了ph、离子强度、腐殖酸浓度对水体中微塑料吸附邻苯二甲酸酯的影响,分析了吸附作用的发生机理。本发明的分析微塑料的吸附有机物的方法系统全面,不仅从动力学与热力学的角度分析,还结合了位点能分布理论对吸附机理进行分析,具有较大的应用前景。
- 还没有人留言评论。精彩留言会获得点赞!