一种宫颈癌检测量子点免疫荧光试剂盒的制备及应用的制作方法
本发明属于生物医药领域,具体设计一种检测宫颈癌的量子点免疫荧光试剂盒的制备方法及应用。适用于宫颈癌细胞与组织抗原的准确、定量检测以及qd-sa复合物应用中的质量控制还涉及该试剂盒在定量检测宫颈癌细胞与组织中抗原中的用途。
背景技术:
宫颈癌是目前严重威胁女性健康的妇科恶性肿瘤,其发病呈日益年轻化且发病率有逐年上升趋势。有数据统计,全世界每年约有宫颈癌新发病例50万约有2313万妇女死于该病,其中80%的新发病例是发生在发展中国家,而我国每年宫颈癌新发病例约占全世界发病人数的1/3。因此提高宫颈癌的早期诊断水平对于宫颈癌的预后有重要意义。传统的宫颈癌诊断方法包括影像学检查(如阴道镜检查)、实验室检查(如肿瘤标志物测定、细胞学检查及hpv检测等)和病理组织活检(如宫颈锥切及宫颈组织活检等)。传统检查方法固然有其实用性,但也存在弊端,因此,建立新的诊断和筛查技术对降低宫颈癌的死亡率至关重要。
量子点是近年发展起来的一种新型纳米发光粒子,相对于传统染料,它具有荧光强度高、荧光寿命长、抗光漂白能力强、激发波谱宽、发射波谱窄及可同时激发多重荧光等独特的光学特性。这些特性使其在生物医学领域,尤其是作为一种新型标记物应用于肿瘤的分子病理及体外成像诊断方面,应用十分广泛。qds对宫颈癌的检测是通过构建特异性探针来实现的,即qds与单个抗体、多肽或者其他生物小分子结合,制成高品质的荧光qd探针,靶向结合单个肿瘤细胞,从而实现宫颈癌的早期诊断。
p16基因是一种多肿瘤抑制基因,是人们发现的第一个直接作用于细胞周期,抑制细胞分裂的基因。研究表明,p16基因的缺失、突变和甲基化存在于多种人肿瘤细胞,提示其与肿瘤的发生、发展有着密切的关系。在对p16的进一步研究中,人们用免疫组织化学的方法检测p16蛋白后发现,在90%以上的宫颈癌病例中存在p16蛋白的高表达,且会随着宫颈癌病情的发生发展而呈现逐渐升高的趋势,但在正常细胞内无表达。因此,p16可作为宫颈癌特异性检测的靶向目标,通过构建量子点-链霉亲和素系统-生物素-抗原抗体复合物特异性靶向探针,进而实现宫颈癌的早期检测。
技术实现要素:
本发明所要解决的技术问题在于:提供一种用于检测宫颈癌的量子点免疫荧光试剂盒,并提供上述量子点试剂盒的用途。该试剂盒可与目前用于检测宫颈癌细胞与组织抗原的生物素化抗体相结合,可以达到快速、经济、灵敏、高效而准确地对肿瘤抗原进行检测。
本发明解决上述技术问题所采取的技术方案是:一种用于检测宫颈癌的量子点免疫荧光试剂盒,其特征是:该试剂盒包括a)固定液b)渗透液c)洗涤液d)封闭液e)单克隆抗体p16ink4a,f)生物素-兔抗鼠igg复合物g)量子点(qds)标记的链霉亲和素(sa)复合物探针;采用水溶性cdse/zns核壳型量子点标记的链霉亲和素复合物作为荧光探针,与检测宫颈癌细胞上的生物素化抗原抗体复合物结合,从而间接标记并检测宫颈癌细胞上的p16抗原。所述的固定液是0.01mph7.6tbs缓冲液,与多聚甲醛溶液按体积百分比100∶4配制。渗透液是0.01mph7.6tbs缓冲液与吐温-20按体积百分比100∶0.1配制。洗涤液是0.01mph7.6tbs缓冲液,与牛血清白蛋白bsa按质量百分比100∶1配制。封闭液是0.02mph7.6tbs缓冲液,与正常兔血清按体积百分比100∶10并与牛血清白蛋白bsa按质量百分比100∶5配制。
所述的单克隆抗体p16ink4a在宫颈癌细胞上对应的受体呈高表达(达90%以上),而在其他正常细胞上呈低表达。所述的量子点为:cdse、cdte、cdse/zns、cdte/zns、cdte/cdse、inp、inas、ingaas、ingap、ingap/zns中的一种纳米粒子或任意几种纳米粒子的组合。
所述的生物素-兔抗鼠igg复合物制备方法如下:
(1)取15mg生物素,3.6mgn-羟基丁二酰亚胺(nhss),2.4mg乙基3-(3-二甲氨基)碳二亚胺盐酸盐(edc)溶解于2ml0.02mph6.5pbs缓冲液中;
(2)将5.3mg兔抗鼠igg抗体加入到上述溶液中,室温置于混匀仪上搅拌30min;
(3)将上述溶液减压旋干溶剂,去离子水溶解在pbs和去离子水中透析1d;透析结束将得到的溶液置于-20℃储存。
所述的qd-sa复合物制备方法如下:
(1)取200μl量子点(浓度为8.3μm),采用活泼酯法,按照摩尔比1∶500分别加入0.166mgedc及0.166mgnhs溶于300μlph5.5的硼酸盐缓冲液,室温反应5-10min;
(2)调整溶液ph到8-8.5按摩尔比40∶1加入4.38mgsa,持续混匀2h后,加入终浓度为2%的氨基葡萄糖反应45min终止反应;
(3)偶联所得量子点标记的sa复合物10000r·min-1,离心5min,除去少量沉淀后,用ph7硼酸盐缓冲液在100k超滤管中洗涤(10倍体积交换),最后重悬于0.2mlph7的硼酸盐缓冲液中。步骤2中的氨基葡萄糖,分子式为c6h13o5n可通过其上的氨基封闭偶联产物中量子点表面残留的羧基,减少偶联产物对肿瘤组织及细胞的非特异性吸附。
针对上述的量子点试剂盒的用途。用于检测宫颈癌细胞,具体步骤如下:(1)获取对数期生长的hela细胞,种植于96孔板内,约1x104个/孔细胞,于37℃、5%co2培养箱内孵育24h,保证90%以上细胞贴壁;
(2)洗涤液冲洗3次,采用固定液在常温下固定细胞15min立即用洗涤液冲洗3次;
(3)用渗透液常温下渗透细胞20min,洗涤液冲洗3次后用封闭液封闭细胞上的非特异性结合位点1h;
(4)除去封闭液,加入适量单克隆抗体p16ink4a与细胞在常温下共孵育2h;(5)洗涤液冲洗3次(每次5min)后,加入生物素化-兔抗鼠igg复合物与细胞在常温下共孵育1h,用洗涤液冲洗3次(每次5min);
(6)加入适量qd-sa复合物反应30min冲洗3次脱去背景色,后立即在倒置荧光显微镜下观察荧光信号并通过荧光信号采集系统进行定量分析。
采用本发明技术方案具有如下有益效果:
1、本发明借助了生物素-链霉亲和素系统的信号放大效应,将量子点荧光信号成倍放大,在较低的肿瘤抗原表达量下也能实现肿瘤细胞的检测;
2、本方案为将抗体分子与生物素偶联,避免了常规方法中将抗体分子偶联于量子点表面导致抗体活性降低和空间位阻大的缺点;
3、相对于传统肿瘤细胞组织免疫染色的方法,量子点因其自身独特的光学性质使得免疫荧光信号强度高、持续时间长,且结果容易保存及反复观察;
4、本发明在制备qd-sa过程中,引入氨基葡萄糖,通过其上的氨基封闭偶联产物中量子点表面残留的羧基,一方面,中和了偶联产物表面所带电荷,另一方面,封闭羧基转变为中性的羟基,降低了qd-sa偶联物的表面ζ电位,可提高偶联产物的回收效率,同时减少偶联产物对肿瘤组织及细胞的非特异性吸附,降低背景效应;
5、本发明操作简单,易于标准化,外界影响因素相对较小,重复性好,结果判断便利,且可通过采集荧光信号来达到荧光强度定量分析,间接反映肿瘤组织或细胞上抗原的表达情况。
附图说明
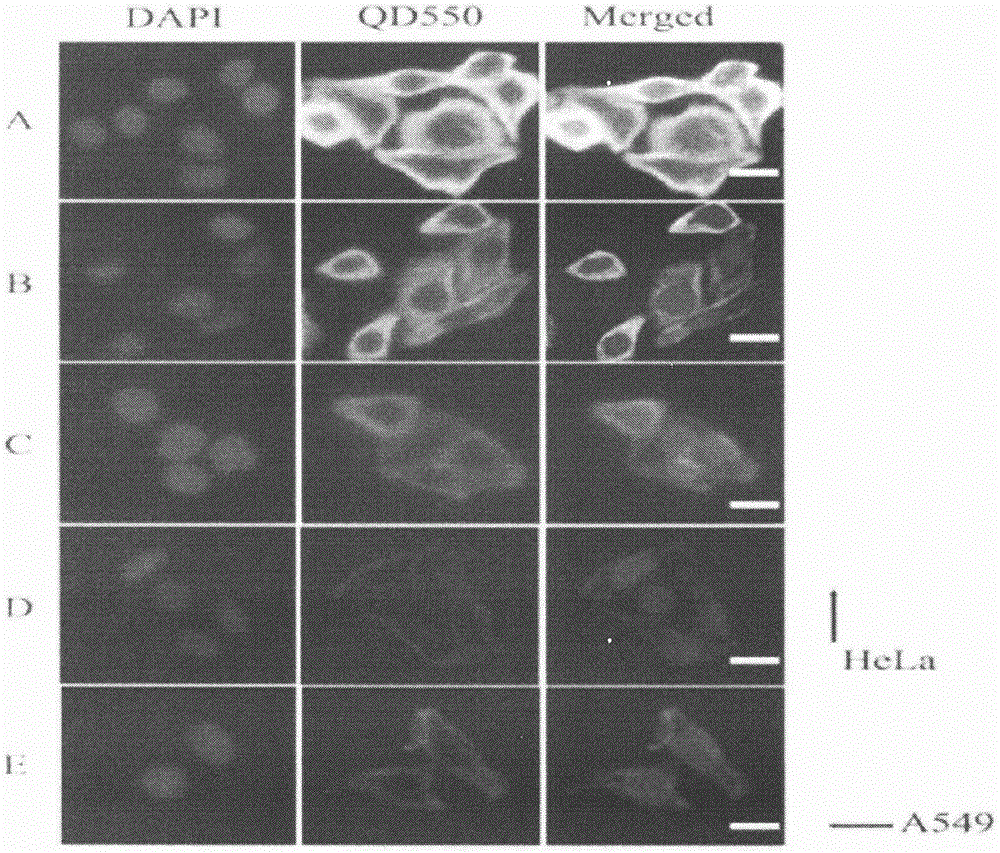
图1量子点试剂盒体外检测宫颈癌hela细胞图;(a)使用生物素-链霉亲和素信号放大系统的hela细胞量子点成像图;(b)不使用生物素-链霉亲和素系统传统hela细胞量子点成像图;(c)不加一抗处理,使用未处理(即不与氨基葡萄糖反应)量子点染色的hela细胞非特异性成像图;(d)不加一抗处理使用氨基葡萄糖处理量子点后的hela细胞非特异性染色图;(e)量子点试剂盒体外染色肺癌a549细胞图;标尺:20μm;
具体实施方式
实施例1用检测宫颈癌的量子点免疫荧光试剂盒在体外检测宫颈癌hela细胞上的应用运用本发明的技术方案,分别制备生物素化的抗体复合物及量子点标记的链霉亲和素复合物,用于特异性靶向结合肿瘤组织或细胞上的抗原。
1、生物素-兔抗鼠igg复合物制备方法:
(1)取15mg生物素(华蓝化学公司)3.6mgn-羟基丁二酰亚胺(nhss)2.4mg乙基3-(3-二甲氨基)碳二亚胺盐酸盐(edc)(美国sigma-aldrich公司)溶解于2ml0.02mph6.5pbs缓冲液中;
(2)将5.3mg兔抗鼠igg抗体(武汉boster公司)加入到上述溶液中室温置于混匀仪上搅拌30min;
(3)将上述溶液减压旋干溶剂,去离子水溶解,在pbs和去离子水中透析1d;透析结束将得到的溶液置于-20℃储存。
2、qd-sa复合物制备方法:
(1)取200μl8.3μm量子点,采用活泼酯法,按照摩尔比1∶500分别加入0.166mgedc及0.166mgnhs,溶于300μlph5.5的硼酸盐缓冲液,室温反应5-10min;
(2)调整溶液ph到8-8.5,按摩尔比40∶1加入4.38mgsa(华蓝化学公司)持续混匀2h后,加入终浓度为2%的氨基葡萄糖反应45min终止反应;
(3)偶联所得量子点标记的sa复合物10000r·min-1,离心5min除去少量沉淀后,用ph7硼酸盐缓冲液在100k超滤管中洗涤(10倍体积交换),最后重悬于0.2mlph7的硼酸盐缓冲液中。
3、实验组:获取对数期生长的hela细胞(江西省南昌大学第一附属医院实验中心馈赠),种植于96孔板内,约1x104个/孔细胞,于37℃、5%co2培养箱内孵育24h,保证90%以上细胞贴壁。洗涤液冲洗3次,采用固定液在常温下固定细胞15min立即用洗涤液冲洗3次。用渗透液常温下渗透细胞20min,洗涤液冲洗3次后用封闭液封闭细胞上的非特异性结合位点1h。除去封闭液,加入适量单克隆抗体p16ink4a与细胞在常温下共孵育2h。洗涤液冲洗3次(每次5min)后,加入生物素化-兔抗鼠igg复合物与细胞在常温下共孵育1h,用洗涤液冲洗3次(每次5min)。加入适量qd-sa复合物反应30min,冲洗3次脱去背景色,后立即在倒置荧光显微镜下观察荧光信号并通过荧光信号采集系统进行定量分析。每组重复3次。
4、对照组:做四组对照组,取相同量的hela细胞种植于96孔板内前期处理同实验组,第一组为不使用生物素-链霉亲和素系统,直接用qd-igg对孵育了一抗的hela细胞进行染色;第二组为细胞内不加入单克隆抗体p16ink4a而使用相同体积相同浓度的1xpbs液替代,同时使用未用氨基葡萄糖处理的qd-sa对hela细胞进行染色,余处理同实验组;第三组为细胞内不加入单克隆抗体p16ink4a而使用相同体积相同浓度的1xpbs液替代,同时使用氨基葡萄糖处理过的qd-sa对hela细胞进行染色,余处理同实验组;第四组则另取相同数量的肺癌a549细胞作为另一组对照,所有处理都与实验组相同。
5、结果:结果发现使用了本发明生物素-链霉亲和素信号放大系统的hela细胞每一个都有高强度的绿色荧光(图1a)而未使用生物素-链霉亲和素信号放大系统的hela细胞荧光强度明显更暗(图1b)未加单克隆抗体p16ink4a处理的hela细胞见明显更少或者无绿色荧光(图1c、1d)但是使用了氨基葡萄糖处理组其非特异性染色明显较弱(图1d),肺癌a549细胞只有比较少且暗的绿色荧光,多数没有绿色荧光(图1e)。可见本发明提供的量子点试剂盒能够很好地识别表达p16的宫颈癌细胞,在宫颈癌检测上具有很高的应用价值。
实施例2利用本发明试剂盒检测实际患者是否为宫颈癌患者的具体实施过程。本发明用于检测宫颈癌的量子点免疫荧光试剂盒。包括a)固定液b)渗透液c)洗涤液d)封闭液e)单克隆抗体p16ink4a,f)生物素-兔抗鼠igg复合物g)量子点(qds)标记的链霉亲和素(sa)复合物探针即qd-sa;所述的固定液是0.01mph7.6三羟基氨基甲烷-盐酸(tbs)缓冲液,与多聚甲醛溶液按体积百分比100∶4配制;所述的渗透液是0.01mph7.6tbs缓冲液与吐温-20按体积百分比100∶0.1配制;所述的洗涤液是0.01mph7.6tbs缓冲液与牛血清白蛋白bsa按质量百分比100∶1配制;所述的封闭液是0.02mph7.6tbs缓冲液与正常兔血清按体积百分比100∶10并与牛血清白蛋白bsa按质量百分比100∶5配制;羧基功能化的量子点qd550(绿色荧光9nm)购买于美国ocean公司。
1、按照如下步骤制备生物素-兔抗鼠igg复合物:
(1)取15mg生物素3.6mgn-羟基丁二酰亚胺(nhss)2.4mg乙基3-(3-二甲氨基)碳二亚胺盐酸盐(edc)溶解于2ml0.02mph6.5pbs缓冲液;
(2)将5.3mg兔抗鼠igg抗体加入上述溶液中室温置于混匀仪上搅拌30min;
(3)将上述溶液减压旋干溶剂去离子水溶解,在pbs和去离子水中透析1d;透析结束将得到的溶液置于-20℃储存。
2、按照如下步骤制备qd-sa复合物:
(1)取200μl8.3μm量子点,采用活泼酯法,按照摩尔比1∶500分别加入0.166mgedc及0.166mgnhs溶于300μlph5.5的硼酸盐缓冲液室温反应5-10min;
(2)调整溶液ph到8-8.5按摩尔比40∶1加入4.38mgsa持续混匀2h后,加入终浓度为2%的氨基葡萄糖反应45min终止反应;
(3)偶联所得量子点标记的sa复合物10000r·min-1,离心5min,除去少量沉淀后用ph7硼酸盐缓冲液在100k超滤管中洗涤(10倍体积交换)最后重悬于0.2mlph7的硼酸盐缓冲液中。
3、实验组:收集临床上宫颈癌组织20例及正常宫颈组织15例,都由医院有经验病理科医生证实以后的组织。每个组织由病理科医生分别作成至少3张切片,厚度为4μm,分别采用3种方式对这些组织进行染色,一种为本发明所涉及的量子点试剂盒对其进行染色,一种为不是使用生物素-链霉亲和素信号放大系统对其进行染色,另一种则是传统的免疫组化染色。
4、结果:显示采用生物素-链霉亲和素信号放大系统对于宫颈癌的检测明显有更高的灵敏度及特异性且相对于传统的免疫组化量子点检测试剂盒有简便、快速、灵敏度高等优势。
- 还没有人留言评论。精彩留言会获得点赞!
- 基于量子点的CA15‑3免疫层析试纸条的制备方法与制造工艺
- 肌红蛋白荧光免疫层析试纸条用活化荧光乳胶微球及应用的制造方法与工艺
- 铁蛋白荧光免疫层析检测卡用活化荧光乳胶微球的制造方法与工艺
- 全程C‑反应蛋白荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 一种微流控芯片上基于荧光量子点磁性富集并分离结核分枝杆菌TB的方法及装置与制造工艺
- 25‑羟基维生素D荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 25‑羟基维生素D3荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 降钙素原荧光免疫层析检测卡用活化荧光乳胶微球的制造方法与工艺
- 一种改变量子点荧光色的方法与制造工艺
- 一种基于荧光免疫层析技术的定量检测计算方法与制造工艺