组装有氯化血红素的碳纤维支架及其制备方法和应用
本发明涉及生物传感技术领域,尤其涉及一种组装有氯化血红素的碳纤维支架及其制备方法和应用。
背景技术:
实时检测细胞释放的具有特殊生理功能的生物活性分子,对于探讨细胞功能和病理机制以及相关疾病的诊断和药物开发具有十分重要的意义。一氧化氮(no)是一种典型的活性氮信号分子,在许多生理和病理过程中可作为跨细胞信使,可以调节许多生物过程,包括中枢神经系统、心血管频率、胃肠道活动、泌尿生殖系统、肿瘤病理过程以及免疫过程。因此,实时检测活细胞释放的no具有重要的基础研究意义和实际应用价值。然而,由于no扩散快、浓度低、半衰期短、易与生物体系中的氧和金属蛋白反应,实时定量检测no仍然是一个挑战,因此,需要构思和设计一种实用的解决方案来实现对活细胞释放no的检测。
目前,电化学生物传感器、荧光法和化学发光法等被报道来实现no的检测。与这些方法相比,电化学生物传感器能够实时检测no,具有灵敏度高、响应快、成本低、小型化等特点,同时避免了对细胞代谢的破坏或干扰。
氯化血红素(hemin)是一种具有过氧化物酶活性的铁(ⅲ)-卟啉化合物,它在脱氧核酶辅因子、过氧化氢传感器、光电化学传感等方面有着广泛的应用。此外,malinski等人和chandra等人将氯化血红素用作no仿生酶,其活性值得关注。然而,氯化血红素的溶解性差,易形成自聚集体,极大地限制了其催化活性和使用寿命。因此,研发一种基底材料作为氯化血红素的载体,提高其仿生催化稳定性和催化活性十分必要。
技术实现要素:
为解决上述技术问题,本发明的目的是提供一种组装有氯化血红素的碳纤维支架及其制备方法和应用,本发明利用生物质衍生分级碳纤维支架作为氯化血红素的载体,其可直接作为基底电极检测no,并可实现原位实时检测活细胞释放的no。
本发明的第一个目的是提供一种组装有氯化血红素的碳纤维支架的制备方法,包括以下步骤:
s1、在惰性气氛保护中,将蚕茧在600-1000℃下煅烧,形成具有三维分级多孔的碳纤维网(cfn);
s2、将碳纤维网浸没于含有氯化血红素和电解质盐的有机溶液中,并用循环伏安法进行电化学沉积,得到组装有氯化血红素的碳纤维支架。
进一步地,在步骤s1中,煅烧温度为900℃。
进一步地,在步骤s1中,煅烧时间为0.5-3h,优选为2h。
进一步地,在步骤s1中,升温速率为1℃/min。
进一步地,在步骤s2中,碳纤维网和氯化血红素的质量比为8:1~12:1,优选为12:1。
进一步地,在步骤s2中,有机溶液中,电解质盐的浓度为0.1~1m,优选为0.1m,电解质盐为高氯酸锂(liclo4)。
进一步地,在步骤s2中,碳纤维网浸没于有机溶液前,还包括对其进行裁切成型的步骤。
进一步地,在步骤s2中,有机溶液所使用的有机溶剂选自n,n-二甲基甲酰胺(dmf)和/或异丙醇(ipa)。
进一步地,在步骤s2中,将碳纤维网在有机溶液中浸泡0.5-1h。
进一步地,在步骤s2中,进行电化学沉积的步骤分为多个片段,在每个阶段中电化学沉积的电位为1.45v以下,扫描速率为0.04v/s。
进一步地,进行电化学沉积的步骤分为2~20个片段,优选为12。
本发明的第二个目的是提供一种采用上述制备方法所制备的组装有氯化血红素的碳纤维支架。
本发明的组装有氯化血红素的碳纤维支架包括生物质衍生分级碳纤维支架以及组装于生物质衍生分级碳纤维支架上的氯化血红素。
本发明的第三个目的是公开上述组装有氯化血红素的碳纤维支架在制备检测no的传感器中的应用。
进一步地,本发明的组装有氯化血红素的碳纤维支架可直接作为基底电极用于检测no。
进一步地,传感器用于原位检测活细胞产生的no。
本发明的组装有氯化血红素的碳纤维支架可用于构建活细胞直接生长的自支撑三维细胞黏附传感器,进一步实现原位实时检测活细胞释放的no。
进一步地,传感器检测no的方法包括以下步骤:
向传感器上滴加待检测溶液,检测no的氧化峰电流,根据测得的电化学信号对产生的no进行定性或定量分析。
进一步地,待检测溶液的ph值为6~9,优选为ph7.4。
进一步地,将传感器置于pbs底液中,然后向pbs底液中滴加待检测溶液。
进一步地,传感器对no的检测限为8nm。
借由上述方案,本发明至少具有以下优点:
本发明的组装有氯化血红素的碳纤维支架可实现氯化血红素在支架上的均匀分布,且避免其形成自聚集体,氯化血红素的负载量较高,使得组装有氯化血红素的碳纤维支架具有较高的仿生催化稳定性和催化活性。
本发明制得的组装有氯化血红素的碳纤维支架可用于制备检测no的传感器,进一步可用于构建活细胞直接生长的自支撑三维细胞黏附传感器,能够原位实时检测活细胞释放的no。此外,该传感器具备良好的重现性、稳定性以及选择性,可以检测出活细胞释放的no。
上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例并配合详细附图说明如后。
附图说明
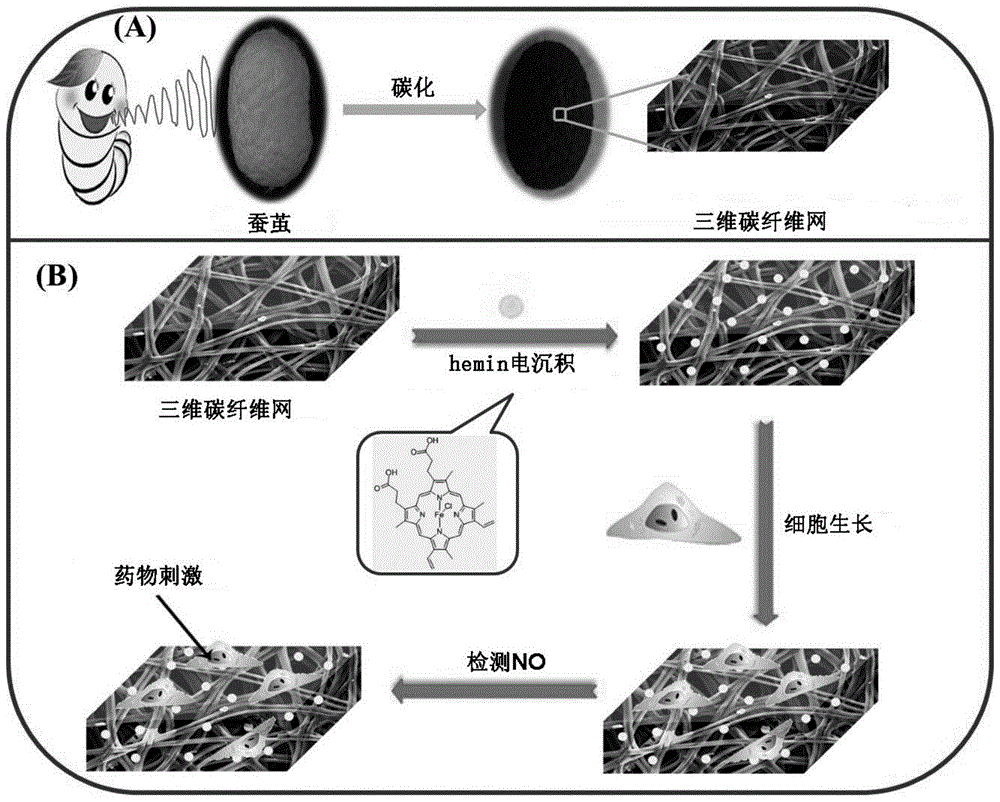
图1是hemin/cfn复合材料的制备过程及传感示意图;
图2为不同材料的扫描电子显微镜图、fe2p的高分辨x射线光电子能谱图及hemin/cfn的元素分布图像;
图3为不同材料的水接触角、细胞活性测试结果及人宫颈癌细胞/hemin/cfn的共聚焦荧光活细胞图像、hela/hemin/cfn的扫描电镜图像;
图4为不同材料对1.8mmno饱和溶液的循环伏安曲线及pbs的ph值对hemin/cfn测定no信号的调控曲线;
图5为hemin/cfn对no的计时电流曲线、对no的响应时间、no的计时电流曲线对应的线性回归曲线及传感器的选择性测试结果;
图6为hela/hemin/cfn生物传感平台在不同药物刺激下对附着的活hela细胞释放no的计时电流响应;不同细胞密度下,7mmach刺激hela细胞释放no的计时电流响应;及不同细胞在不同条件下释放no的浓度测试结果。
具体实施方式
下面结合实施例,对本发明的具体实施方式作进一步详细描述。以下实施例用于说明本发明,但不用来限制本发明的范围。
实施例1:合成组装有氯化血红素的碳纤维支架(即hemin/cfn复合材料)
1、将蚕茧以1℃/min的升温速率加热到900℃,氮气气氛下碳化2h,制得cfn材料(图1a)。
2、将cfn材料切成0.5×0.5cm大小的小方块(约3mg),然后将裁切后的cfn材料浸没到含有0.25mg/mlhemin和0.1mol/lliclo4·3h2o的dmf溶液(20ml)中30min,随后,在0.25mg/mlhemin和0.1mol/lliclo4·3h2o混合溶液中,在0.00~1.45v的电位范围内,以ag/agcl为参比电极,进行循环伏安扫描12个片段,扫描速率为0.04v/s,实现氯化血红素在cfn上的电聚合,即可得到hemin/cfn复合材料(图1b)。
如图2(a1)-(a2)所示,扫描电镜图表明步骤1制备的cfn具有三维分级结构,孔径为40-250μm,其庞大的比表面积为hemin的修饰提供了足够多的活性位点,超中空的多孔内部结构提供了优越的三维细胞培养基质。经步骤2电沉积上hemin后,hemin均匀分散在cfn支架上,如图2(b)所示,hemin的平均粒径为20nm。此外,采用x射线光电子能谱(xps)进一步研究了hemin和hemin/cfn的化学组成和元素结构。如图2(c)所示,hemin/cfn的fe2p的结合能位于711.6ev和724.1ev处,分别对应于fe2p3/2和fe2p1/2。此外,hemin/cfn的结合能位置与纯hemin的峰位相同,表明两个样品中铁的价态相同。此外,元素分布(图2(d)-2(g))显示了c(图2(e))、n(图2(f))和fe(图2(g))原子在复合材料中的分布。
如图3(a)-(c)所示,经hemin修饰后,cfn的亲水性发生了显著提升。图3(a)、(b)、(c)依次为纯蚕茧、步骤1制备的cfn及步骤2制备的hemin/cfn复合材料的亲水角测试结果。可以看出,与原料蚕茧相比,经过碳化处理蚕茧得到的cfn的水接触角从115.4°显著降低到90.5°。hemin的修饰使接触角进一步减小到64.8°。结果表明,碳化蚕茧制得的层状多孔cfn具有亲水性和良好的润湿性,hemin在cfn上的聚合显著提高了电极的亲水性。
实施例2:hemin/cfn复合材料的细胞黏附性测试
为了评价hemin/cfn支架的生物相容性,用cck-8实验测定了细胞在不同材料中的存活率。将细胞接种于96孔板(每孔104个细胞)过夜培养,然后与cfn,hemin/cfn、碳纳米管(cnt)和石墨烯等不同材料孵育,同时设置未添加任何材料的空白对照组。如图3(d)所示,细胞在cfn和hemin/cfn上的存活率分别为94%和92%,优于碳纳米管(86%)和石墨烯(85%),显示出良好的生物相容性。
人宫颈癌细胞(hela)采用dmem培养基、1%抗生素和10%胎牛血清混合制成培养基,在37℃,含有95%空气和5%co2的培养箱中培养。用70%乙醇和紫外光处理hemin/cfn支架,在控制细胞密度分别为5×105个/ml和1×105个/ml的条件下培养hela细胞48h。作为对照实验,人胚肾细胞(293a)也在同样的条件下于hemin/cfn支架上培养48h,细胞密度分别为5×105个/ml和1×105个/ml。
为了验证细胞在hemin/cfn支架上的生长行为,采用共聚焦荧光显微镜观察了细胞在三维hemin/cfn支架上生长前后的形态和荧光特性。应用高度特异的蓝色荧光染料4’,6-二氨基苯基吲哚(dapi)对hela/hemin/cfn生物支架上的hela细胞的细胞核进行染色。如图3(e)所示,细胞在hemin/cfn支架上培养48h后,可观察到丰富的亮蓝色荧光点,表明其具有良好的生物相容性。扫描电镜进一步表征了细胞的粘附和锚定性能,如图3(f1)所示,许多细胞附着在氯化血红素/cfn支架上。进一步地,从图3(f2)可以观察到细胞伸展的伪足稳定地将细胞固定在纤维上,这表明细胞具有很强的粘附行为。
实施例3:hemin/cfn复合材料的no检测能力测试
采用循环伏安法(cv)研究不同材料制备的传感器在0.01mph7.4pbs中对1.8mmno饱和溶液的响应情况。具体步骤如下:
将实施例1制备的hemin/cfn复合材料或cfn(约3mg)浸入5ml含有饱和no的0.01mpbs溶液中,no的浓度为1.8mm。扫描速率:0.05v/s。
如图4(a)所示,加入1.8mmno后,由hemin/cfn制备的传感器在900mv处出现一个明显的氧化峰(曲线a)。而未修饰hemin的cfn没有出现明显的氧化峰(图4(b)曲线a)。这可能是由于hemin含有一对可逆的氧化还原fe(ⅲ)/fe(ⅱ)电对,no是一种氧化性较强的分子,易失去电子,生成no+,发生以下反应:
no→no++e-(1)
no+是一种很强的lewis酸,可以直接与水反应,生成较稳定的no2-,其反应式如下:
no++h2o→no2-+2h+(2)
因此,hemin可作为no仿生酶对其进行高灵敏检测。
另外,按照上述测试缓冲溶液ph值对hemin/cfn测定no信号的调控,不同之处在于,改变pbs的ph分别为6.0、6.5、7.4、8.0、9.0。
如图4(c)所示,当缓冲溶液ph值从6.0升高到7.4时,no的氧化峰电流明显增加。当pbs的ph值超过7.4时,no的氧化峰电流不断降低(曲线b)。并且,用hemin/cfn测定no在pbs的ph值为7.4时出现最负的氧化电位,表明对no有最高的电催化活性(曲线a)。因此,为了获得高灵敏和高选择性,选择ph值为7.4进行进一步实验。
为了测试传感器的检测限及灵敏度,在均匀搅拌的0.01mph7.4pbs中分别连续加入no(图5(a1)-(a2)),在0.9v的电位下记录hemin/cfn的电流-时间曲线。传感器对加入的no迅速产生阶跃式响应,并在1.9秒内达到95%的稳态电流(图5(b))。基于no的半衰期为5秒,该传感器的快速响应性能可实现实时测定活细胞释放的no。如图5(c)所示,制备的传感器对no线性范围为两段:24nm~22.92μm和26.52~70.92μm,其线性回归方程分别为i=3.8922c-0.2654(r2=0.9992)和i=15.0231+3.0599c(r2=0.9987),其最低检测限值可达8nm(3s/k)。灵敏度分别为55.60和43.71μaμm-1cm-2。
另外,对所构建传感器的选择性及抗干扰能力进行了测试,研究了氯化钾(kcl)、氯化钠(nacl)、氯化钙(cacl2)、葡萄糖(glu)对no的干扰。结果表明90μmkcl,90μmnacl,90μmcacl2,90μmglu对检测9μmno的干扰可忽略不计(图5(d))。进一步研究了hemin/cfn对细胞内与no共存的多巴胺(da)、抗坏血酸(aa)的抗干扰作用,据报道,da的生物浓度为0.01-1μm,aa的生物浓度约为2.3μm。如图5(d)所示,2.3μmaa和1μmda不影响3.3μmno(相当于5×105个/mlhela细胞产生的no)的电流响应,表明hemin/cfn对no氧化具有良好的选择性和抗干扰能力。
进一步地用同一片材料对no进行六次重复检测来评估hemin/cfn的批内重现性。传感器表现出了良好的可重复性,no的相对标准偏差(rsd)为1.76%。通过对六片独立的材料测定no浓度来评价hemin/cfn的批间重现性,对no的rsd对为1.96%。因此,本发明制备的hemin/cfn复合材料作为no传感器时具有良好的稳定性。
实施例4:hemin/cfn复合材料原位检测细胞产生的no
在不同细胞和可控细胞密度下,原位定量检测活细胞释放的no。向溶液中注入乙酰胆碱(ach)并持续温和搅拌,分别刺激正常人体胚肾细胞和宫颈癌细胞(293a和hela,5×105个/ml)产生no,然后在0.9v电位下记录电流响应情况。用不同药物刺激细胞产生no,如图6(a)所示,注入5mmach和5mm血红蛋白混合物(ach-hb)后,细胞测试没有明显的电流增加,表明血红蛋白有效地消耗了细胞释放的no。在不同细胞密度时,hemin/cfn对hela细胞的电化学响应如图6(b)所示。在细胞密度为1.0×105个/ml和5×105个/ml的情况下,随着ach的加入,电流明显增加。分别控制ach药物的浓度为5mm和7mm,hela细胞(细胞密度为5×105个/ml)释放的no浓度分别为1.4mm和2.3mm,表明hela细胞的no释放过程具有药物浓度依赖性行为。作为对照实验,对培养在hemin/cfn支架上的正常293a细胞释放的no进行了实时检测。如图6(c)和6(d)所示,在7mmach刺激下,5×105个/mlhela细胞(图6(c))释放的no浓度比相同细胞密度下293a细胞(图6(d))多0.8μm。这些结果表明hemin/cfn支架在实时定量检测复杂生物体系中释放的no方面具有令人满意的潜力。
以上仅是本发明的优选实施方式,并不用于限制本发明,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变型,这些改进和变型也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!