一种非洲猪瘟病毒抗体的荧光微球鉴别检测卡的制作方法
本发明涉及一种病毒抗体检测卡,尤其涉及一种非洲猪瘟病毒抗体的荧光微球鉴别检测卡,属于病毒检测技术领域。
背景技术:
非洲猪瘟(africanswinefever,asf)是非洲猪瘟病毒(asfv)引起的一种急性、热性、高度传染性疾病,其特征为病程短,发病率和死亡率高,临床症状表现为高热,皮肤充血、流产、水肿及脏器充血。非洲猪瘟病毒是唯一的虫媒dna病毒,蜱是主要的传播媒介和贮存宿主。另外,猪肉及猪肉制品,被污染的饲料、水源、器具、泔水、工作人员及其服装以及污染空气均能成为传染源,经口和上呼吸道途径传播。
非洲猪瘟1909年首次出现在肯尼亚,一直存在于撒哈拉沙漠以南的国家,而后蔓延至非洲、欧洲、美洲数十个国家,2018年8月在我国爆发,给我国畜牧业造成了严重的经济损失,非洲猪瘟现已被世界卫生组织(oie)列为法定报告动物疫病,我国将其列为一类动物疫病。国内外相继建立了多种检测非洲猪瘟的方法,我国《中华人民共和国国家标准(gb/t18648-2002)》中非洲猪瘟抗体检测方法包括pcr检测病毒基因组dna和酶联免疫吸附试验(elisa)检验血清抗体。
pcr检测病毒基因组dna被认为是非洲猪瘟检测最为有效的和可靠的方法,可对非洲猪瘟进行定量、定性检测,具有准确性高、灵敏度好优点,但是耗时长、价格昂贵,对操作人员有一定的技术要求,对实验环境要求较高。
常见的酶联免疫吸附试验(elisa)检测非洲猪瘟抗体检测法耗时40min-3h不等,并且检测时需要借助酶标仪,需要提供合适的温育、洗板等条件,需要对样本进行前期处理,对操作人员技术及操作环境要求较高。
技术实现要素:
本发明的目的是针对现有非洲猪瘟抗体检测卡耗时长、价格昂贵,对操作人员有一定的技术要求,需要对样本进行前期处理,对操作人员技术及操作环境要求较高,无法实现对非洲猪瘟病毒抗体的现场快速定量检测的缺陷和不足,提供一种操作简单,检测快速,鉴别检测灵敏度高,并可借助于荧光分析仪实现猪场现场快速定量检测的一种非洲猪瘟病毒抗体的荧光微球鉴别检测卡。
为实现上述发明目的,本发明的技术解决方案是:一种非洲猪瘟病毒抗体的荧光微球鉴别检测卡,包括卡壳和设在卡壳内的试纸条,其特征在于:所述卡壳包括相互扣合的卡盖和卡座;所述试纸条包括pvc底板以及依次粘贴在pvc底板上的样品垫、吸水垫、检测垫、荧光微球垫;所述卡座内设有固定试纸条的卡槽;所述pvc底板为不吸水的pvc板,吸水垫为吸水滤纸;所述检测垫为设有质控线c、检测线t1和检测线t2的硝酸纤维素膜,质控线c包被从阳性质控血清中纯化的抗体,检测线t1包被p54抗原,检测线t2包被cd2v抗原;所述荧光微球垫为混合包埋时间分辨荧光微球标记的p54抗原和cd2v抗原的玻璃纤维素膜;样品垫是经样品垫处理液浸泡处理后干燥的玻璃纤维素膜。
进一步的,所述卡壳上对应样品垫开设加样孔,对应检测垫上检测线t1、检测线t2和质控线开设视窗口。
进一步的,所述质控线c上抗体的包被浓度为1.8mg/ml,检测线t1上p54蛋白抗原的包被浓度为1.1mg/ml,检测线t2上cd2v蛋白抗原的包被浓度为0.5mg/ml。
进一步的,所述时间分辨荧光微球为直径200nm的含有高亮稀土染料的羧基聚苯乙烯微球。
进一步的,所述荧光微球垫上喷涂的p54蛋白抗原的标记量是35μg/ml,荧光微球垫上喷涂的cd2v蛋白抗原的标记量是25μg/ml。
进一步的,所述p54抗原的制备方法如下:
步骤一:p54基因的合成:根据genbank中非洲猪瘟病毒减毒株ba71v的p54基因全长序列,合成p54基因,插入到pet32a载体;
步骤二:p54抗原的表达:将pet32a-p54载体转化至大肠埃希菌bl21(de3)感受态细胞挑取单菌落至lb液体培养基中,37℃过夜培养,以体积比为1:100的比例将培养菌液加至lb液体培养基中,37℃振荡培养至od600nm值为0.4~0.6,加入iptg,16℃诱导6小时,收集菌体超声破碎后,取上清和沉淀进行sds-page凝胶电泳,观察表达情况;
步骤三:p54抗原的纯化:ni-nta装柱,1.6×20cm,柱床体积为10ml;用缓冲液1平衡2~5个床体积,流速为2ml/min;将20ml细胞破碎液(50mmol/lpbs,ph7.4,0.5mol/lnacl)0.45µm滤膜过滤,上样,流速为1ml/min;用缓冲液1再洗2~5个床体积,流速为2ml/min;用分别含10、50、100、200、300mmol/l咪唑的缓冲液3进行阶段洗脱,流速为2ml/min,收集各阶段洗脱峰,用sds-page检测融合蛋白的分子量大小和纯度;用纯水流洗5个柱床体积,再用20%的乙醇流洗3个柱床体积,流速为2ml/min,柱子置于低温环境中保存。
进一步的,所述cd2v抗原的制备方法如下:
步骤一:培养生产用假病毒:将状态良好的sf9细胞以2×106个/ml的密度接种于6孔无菌培养板上贴壁培养2h,按照每孔4μg质粒进行首次转染,其中,表达质粒与线性化dna的总量比为20∶1,而后将足量的表达质粒、线性化dna与8μl转染试剂cellfectinⅱ进行混合,混合后进行共转染,当细胞转染4~6h后更换新鲜培养基,27℃培养箱培养7日后获得假病毒;
步骤二:重组蛋白在hi5细胞中分泌表达:将hi5细胞培养至2×106个/ml,按1/1000(v/v)比例滴加病毒,27℃表达72h后,以5000r/min离心15min收集细胞培养液;
步骤三:重组蛋白的浓缩和纯化:使用ni介质富集蛋白,使用分液漏斗截留介质,按20mmol/lhepes,150mmol/lnacl,5%甘油,500mmol/l咪唑,比例制备含有咪唑的buffer,并将ph值调节至7.5,使用制备成功的buffer将目的蛋白从ni介质上洗脱下来。使用30kda的浓缩管、3800r/min、4℃浓缩洗脱液和millipore收集并浓缩洗脱液,而后以500µl体积上样进行凝胶过离子色谱柱纯化,成功获得cd2v抗原。
进一步的,所述显色液b的制备方法为:称取tmb0.2g加入纯水中,用盐酸调节ph至3.0左右,加入柠檬酸5.76g,带起完全溶解后,加入proclin-3000.5ml,用量筒量取双蒸水定容至1000ml,2~8℃保存。
本发明的有益效果是:
1.本发明应用荧光微球免疫技术,基于双抗原夹心测抗体原理对非洲猪瘟病毒接种疫苗和野毒感染抗体进行鉴别检测,以动物接种疫苗和野毒感染后产生不同的抗体为基础,得以实现对非洲猪瘟病毒野毒感染抗体和疫苗免疫抗体的区分。
2.本发明利用检测卡内的试纸条,依托现有试纸条的结构和组成作为基本框架,检测非洲猪瘟病毒抗体,检测时间5~10min,相比pcr检测病毒基因组dna和酶联免疫吸附试验(elisa)检验血清抗体方法检测速度快,同样具有稳定性好,特异性强、灵敏度高的特点。相比传统的胶体金试纸条中胶体金颗粒与蛋白质的静电引力结合作用,带有羧基端的荧光微球与抗体以共价键相连,更加稳定;操作者无需进行专业的培训,操作简单,既可通过紫外线照射进行简单的定性鉴别,亦可借助于荧光分析仪检测荧光信号,通过数字化结果进行定量鉴别,实现非洲猪瘟抗体的快速现场检测,为非洲猪瘟的疫情防控提供更加全面的技术手段。
附图说明
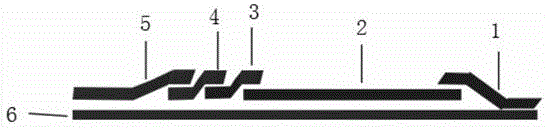
图1是asfv包被板上对照和样品添加模式图。
图中:吸水垫1,硝酸纤维素膜2,吸水垫3,荧光微球垫4,样品垫5,pvc底板6。
具体实施方式
以下结合附图说明和具体实施方式对本发明作进一步的详细描述。
参见图1,本发明的一种非洲猪瘟病毒抗体的荧光微球鉴别检测卡,包括卡壳和设在卡壳内的试纸条,其特征在于:所述卡壳包括相互扣合的卡盖和卡座;所述试纸条包括pvc底板6以及依次粘贴在pvc底板6上的样品垫5、吸水垫3、检测垫、荧光微球垫4;所述卡座内设有固定试纸条的卡槽;所述pvc底板6为不吸水的pvc板,吸水垫1为吸水滤纸;所述检测垫为设有质控线c、检测线t1和检测线t2的硝酸纤维素膜2,质控线c包被从阳性质控血清中纯化的抗体,检测线t1包被p54抗原,检测线t2包被cd2v抗原;所述荧光微球垫4为混合包埋时间分辨荧光微球标记的p54抗原和cd2v抗原的玻璃纤维素膜;样品垫5是经样品垫处理液浸泡处理后干燥的玻璃纤维素膜。
所述卡壳上对应样品垫开设加样孔,对应检测垫上检测线t1、检测线t2和质控线开设视窗口。
所述质控线c上抗体的包被浓度为1.8mg/ml,检测线t1上p54蛋白抗原的包被浓度为1.1mg/ml,检测线t2上cd2v蛋白抗原的包被浓度为0.5mg/ml。
所述时间分辨荧光微球为直径200nm的含有高亮稀土染料的羧基聚苯乙烯微球。
所述荧光微球垫4上喷涂的p54蛋白抗原的标记量是35μg/ml,荧光微球垫2上喷涂的cd2v蛋白抗原的标记量是25μg/ml。
所述p54抗原的制备方法如下:
步骤一:p54基因的合成:根据genbank中非洲猪瘟病毒减毒株ba71v的p54基因全长序列,合成p54基因,插入到pet32a载体;
步骤二:p54抗原的表达:将pet32a-p54载体转化至大肠埃希菌bl21(de3)感受态细胞挑取单菌落至lb液体培养基中,37℃过夜培养,以体积比为1:100的比例将培养菌液加至lb液体培养基中,37℃振荡培养至od600nm值为0.4~0.6,加入iptg,16℃诱导6小时,收集菌体超声破碎后,取上清和沉淀进行sds-page凝胶电泳,观察表达情况;
步骤三:p54抗原的纯化:ni-nta装柱,1.6×20cm,柱床体积为10ml;用缓冲液1平衡2~5个床体积,流速为2ml/min;将20ml细胞破碎液(50mmol/lpbs,ph7.4,0.5mol/lnacl)0.45µm滤膜过滤,上样,流速为1ml/min;用缓冲液1再洗2~5个床体积,流速为2ml/min;用分别含10、50、100、200、300mmol/l咪唑的缓冲液3进行阶段洗脱,流速为2ml/min,收集各阶段洗脱峰,用sds-page检测融合蛋白的分子量大小和纯度;用纯水流洗5个柱床体积,再用20%的乙醇流洗3个柱床体积,流速为2ml/min,柱子置于低温环境中保存。
所述cd2v抗原的制备方法如下:
步骤一:培养生产用假病毒:将状态良好的sf9细胞以2×106个/ml的密度接种于6孔无菌培养板上贴壁培养2h,按照每孔4μg质粒进行首次转染,其中,表达质粒与线性化dna的总量比为20∶1,而后将足量的表达质粒、线性化dna与8μl转染试剂cellfectinⅱ进行混合,混合后进行共转染,当细胞转染4~6h后更换新鲜培养基,27℃培养箱培养7日后获得假病毒;
步骤二:重组蛋白在hi5细胞中分泌表达:将hi5细胞培养至2×106个/ml,按1/1000(v/v)比例滴加病毒,27℃表达72h后,以5000r/min离心15min收集细胞培养液;
步骤三:重组蛋白的浓缩和纯化:使用ni介质富集蛋白,使用分液漏斗截留介质,按20mmol/lhepes,150mmol/lnacl,5%甘油,500mmol/l咪唑,比例制备含有咪唑的buffer,并将ph值调节至7.5,使用制备成功的buffer将目的蛋白从ni介质上洗脱下来。使用30kda的浓缩管、3800r/min、4℃浓缩洗脱液和millipore收集并浓缩洗脱液,而后以500µl体积上样进行凝胶过离子色谱柱纯化,成功获得cd2v抗原。
参见附图1,本发明包括检测垫、吸水垫1、吸水垫3、荧光微球垫4、样品垫5以及pvc底板6。pvc底板6为不吸水的pvc板,吸水垫1为吸水滤纸。检测垫为设有质控线c、检测线t1和检测线t2的硝酸纤维素膜2,质控线c包被从阳性质控血清中纯化的抗体,检测线t1包被p54抗原,检测线t2包被cd2v抗原。荧光微球垫4为混合包埋时间分辨荧光微球标记的p54抗原和cd2v抗原的玻璃纤维素膜,样品垫5是经样品垫处理液浸泡处理后干燥的玻璃纤维素膜。
缓冲液1的配制方法如下:使用量取0.5mol/l的nah2po419ml,0.5mol/l的na2hpo481ml,使用分析天平称取nacl29.3g,加适量水溶解定容至1l;
含不同浓度咪唑的所述缓冲液3配制如下:10mmol/l:98ml缓冲液1,2ml缓冲液2;50mmol/l:90ml缓冲液1,10ml缓冲液2;100mmol/l:80ml缓冲液1,20ml缓冲液2;200mmol/l:60ml缓冲液1,40ml缓冲液2;300mmol/l:40ml缓冲液1,60ml缓冲液2。
所述的缓冲液2配制方法如下:使用量取0.5mol/l的nah2po419ml、0.5mol/l的na2hpo481ml,使用分析天平称取nacl29.3g、咪唑34g,加适量水溶解定容至1l。
本发明cd2v抗原的制备方法如下:
步骤一:培养生产用假病毒:将状态良好的sf9细胞以2×106个/ml的密度接种于6孔无菌培养板上贴壁培养2h,按照每孔4μg质粒进行首次转染,其中,表达质粒与线性化dna的总量比为20∶1,而后将足量的表达质粒、线性化dna与8μl转染试剂cellfectinⅱ进行混合,混合后进行共转染,当细胞转染4~6h后更换新鲜培养基,27℃培养箱培养7日后获得假病毒;
步骤二:重组蛋白在hi5细胞中分泌表达:将hi5细胞培养至2×106个/ml,按1/1000(v/v)比例滴加病毒,27℃表达72h后,以5000r/min离心15min收集细胞培养液;
步骤三:重组蛋白的浓缩和纯化:使用ni介质富集蛋白,使用分液漏斗截留介质,按20mmol/lhepes,150mmol/lnacl,5%甘油,500mmol/l咪唑,比例制备含有咪唑的buffer,并将ph值调节至7.5,使用制备成功的buffer将目的蛋白从ni介质上洗脱下来。使用30kda的浓缩管、3800r/min、4℃浓缩洗脱液和millipore收集并浓缩洗脱液,而后以500µl体积上样进行凝胶过离子色谱柱(qhp)纯化,成功获得cd2v抗原,其核苷酸序列如序列表seqidno.2所示。
本发明样品垫的制备方法如下:
步骤一:使用分析天平称取8gnacl,5.8gna2hpo4,0.2gkcl,0.2gkh2po4,将其溶解于1l纯化水中,配制ph7.4的pbs;
步骤二:使用分析天平称取5g蔗糖,5gpvp-k30,5gpeg-20000,使用移液器移取20mltween-20,至1l上一步配置好的ph7.4的pbs中,使用磁力搅拌器搅拌均匀,配制样品垫处理液。
步骤三:将玻璃纤维素膜放置于自封袋中,按照20ml/张的比例加入上一步配置好的样品垫处理液,浸泡35min,而后将浸泡完成的玻璃纤维素膜置于30℃鼓风干燥箱中过夜干燥,干燥完成后置于干燥器中待用。
检测垫的制备方法如下:
所述检测垫是一种含有横向质控线(c线)、检测线(t1线、t2线)的硝酸纤维素膜;
步骤一:配制pb溶液:使用分析天平称取20.43g十二水磷酸氢二钠、22.27g二水和磷酸二氢钠,将其溶解于1l纯化水中,得到所需pb溶液;
步骤二:c线包被从阳性质控血清中纯化的抗体,t1线包被p54抗原,t2检测线包被cd2v抗原,分别将从阳性质控血清中纯化的抗体、p54抗原、cd2v抗原用上一步配制的ph8.0的pb稀释成1.8mg/ml、1.1mg/ml、0.5mg/ml,使用划膜机按照0.75μl/cm比例划膜,而后置于37℃鼓风干燥箱中干燥,干燥时间5h,干燥完成后置于干燥器中待用;
步骤三:c线与t1线包被间距6mm,t1线与t2线包被间距4mm,所述检测垫到吸水垫方向依次为t1线、t2线和c线,所述检测垫是指有效成份与固定在膜上的活性物质发生特异性结合的区域。
荧光微球垫的制备方法如下:
步骤一:取适量的固体含量为1%的荧光微球溶液放置于1.5ml离心管中,加入20倍体积的0.01mol/lmes溶液,混匀,12000r/min离心15min,弃去上清,重复清洗2次,将洗涤后的荧光微球重悬于20倍体积的0.01mol/lmes溶液;
步骤二:向上一步骤所得微球分散液中,加入等体积的0.4mol/ledc溶液,振荡混匀,避光反应30min,12000r/min离心15min,弃上清,按上述步骤重复清洗2次,沉淀即为活化的荧光微球,40倍体积0.05mol/lpbs溶液重悬;
步骤三:将p54抗原加入已活化的荧光微球1中,调节其终浓度为35μg/ml,混匀;将cd2v抗原加入到已活化的荧光微球2中,使其终浓度为25μg/ml,混匀。将混匀后含p54抗原的荧光微球溶液和含cd2v抗原的荧光微球溶液,分别于室温条件下,避光反应1h;
步骤四:分别按溶液总体积的10%加入封闭液(9%的酪蛋白)。置于室温条件下,分别避光反应30min。
步骤五:12000r/min离心15min,弃上清,分别加入1ml稀释液,超声打散微球,分别得到荧光微球-p54抗原复合物溶液和荧光微球-cd2v基因缺失抗原复合物溶液;
步骤六:向上述两种复合物溶液中分别加入1%胭脂红溶液,充分混匀,制得对应两种混合液,而后将两种混合液按照4μl/cm比例喷涂至玻璃纤维素膜上。
步骤八:将上述喷有混合液的玻璃纤维素膜放入37℃鼓风干燥箱中干燥,干燥时间为5h,制得荧光微球垫;将干燥后的荧光微球垫放入干燥器中,备用。
所述荧光微球为直径200nm的含有高亮稀土染料的羧基聚苯乙烯微球;吸收波长为365nm,检测波长是610nm。
所述mes是一种可溶于水的吗啉乙磺酸。
所述的edc是一种可溶于水的碳二亚胺。
所述胭脂红溶液可替换为柠檬黄、胭脂红、日落黄、亮蓝或其他色素溶液。
检测卡的组装方法如下:
步骤一:将样品垫、荧光微球垫、吸水垫、检测垫和吸水垫分别由上至下依次搭接粘贴在底板上,各组分在相邻处有1~2mm重叠;
步骤二:用切条机将贴好上述板子切成3mm宽的试纸条,置于卡座内的卡槽中,通过卡槽与卡壳按压固定。固定时,所述检测垫上的t1线靠近样品垫一侧、对应的卡盖上“t1”标志;质控线c线靠近吸水垫一侧,对应的卡盖上有“c”标志;
所述底板为不吸水的pvc胶粘板;
所述吸水垫为吸水滤纸,吸水滤纸裁切大小为:长30cm,宽2.0±0.1cm,所述吸水垫具有虹吸效果;
所述卡盖的规格为70mm×20mm×5mm,卡盖中心有一个16mm×3mm大小的视窗,卡盖与样品垫对应区域有标识为“s”的加样孔,加样孔下方有指示检测方向的箭头。
将所述的检测卡密封于铝箔袋内,所述铝箔袋内还应含有干燥剂和配套的吸管。
实施例2非洲猪瘟病毒抗体荧光微球鉴别检测试纸卡的使用方法:
步骤一:撕开检测卡铝箔包装袋,取出检测卡,放于平整、洁净的台面上;
步骤二:用配套滴管吸取已准备好的血清样本,垂直而缓慢的滴加60μl到加样孔内;
步骤三:室温静置8min读取结果,按卡盖上所示箭头方向将试纸卡插入荧光免疫分析仪的卡槽中,读取t1值和t2值;
所述该使用方法的判定标准为:当t1、t2检测值均≥0.1时,判定为非洲猪瘟感染抗体阳性;当t1检测值≥0.1,且t2检测值<0.1时,判定为非洲猪瘟疫苗免疫抗体阳性;当t1、t2检测值均<0.1时,判定为阴性。
实施例3:非洲猪瘟病毒抗体荧光微球鉴别检测特异性试验:
使用非洲猪瘟病毒抗体荧光微球鉴别检测卡对阳性血清进行检测,结果显示:非洲猪瘟野毒感染阳性血清t1、t2为1.052、1.031;非洲猪瘟疫苗免疫阳性血清t1、t2为1.058、0.026;猪瘟阳性血清t1、t2为0.026、0.045;蓝耳阳性血清t1、t2为0.027、0.042;阴性血清t1、t2为0.024、0.069;所述结果显示本研究建立的检测方法特异性强,与相似病原阳性血清均无交叉反应。
实例4:非洲猪瘟病毒抗体荧光微球鉴别检测临界值确定试验
步骤一:进行采集350份临床猪血清样本的采集;
步骤二:使用非洲猪瘟病毒抗体荧光微球鉴别检测试纸卡对大批量血清样品检测;
步骤三:运用roc(受试者工作特性曲线)方法进行统计学分析,通过t1/c值、t2/c值与敏感性和特异性的数量关系,确定临界值及判定标准:当t1、t2检测值均≥0.1时,判定为非洲猪瘟感染抗体阳性;当t1检测值≥0.1,且t2检测值<0.1时,判定为非洲猪瘟疫苗免疫抗体阳性;当t1、t2检测值均<0.1时,判定为阴性。
实例5:非洲猪瘟病毒抗体荧光微球鉴别检测敏感性试验:
步骤一:将阳性质控血清按1:16,1:32,1:64梯度稀释;
步骤二:从试制的3批试纸条中,每批随机取2盒试纸条进行检测,确定试纸条的最低检出量。具体结果见表1所示。
表1非洲猪瘟病毒抗体荧光微球快速鉴别检测试纸卡敏感性结果
实例6:非洲猪瘟病毒抗体荧光微球快速鉴别检测重复性检测试验
步骤一:制备了3批非洲猪瘟病毒抗体荧光微球快速鉴别检测成品试纸卡;
步骤二:每批抽取2盒试纸卡,分别对30份猪血清样品进行2次重复检测,按照使用说明书操作要求进行试验,检测结果显示3批试纸检测结果均一致,说明本试纸具有良好的重复性,具体结果如下表2所示。
表2非洲猪瘟病毒抗体荧光微球快速鉴别检测试纸卡重复性结果
由此可知,本发明的一种非洲猪瘟病毒抗体的荧光微球快速鉴别检测卡具有良好的敏感性、特异性和重复性,能够有效鉴别野毒感染非洲猪瘟病毒的猪只以及疫苗免疫的猪只,便于非洲猪瘟的防控措施的实施、为非洲猪瘟的防控政策的实施提供了新的技术。
核苷酸序列如序列表seqidno.1如下:
<210>1
<211>560
<212>dna
<213>大肠杆菌
<400>1
ttacaaggagttttccaggtctttgtgtgtataggtgcttctttgccgtagagcttcaac60
agccggcattgtttgtgaagcagtgttctgagtagtggctgttgtataaagctcatccga120
aggagcacttgcggccgctggccctccagttgccatgattagtctgtccgtaactgggtt180
gttcataactggcctgtccgcgaccgagctgttcgtaactggcctattcatggcaactgg240
cctgtctgtaattggcttgcctacgttgcctgtagtggctccagccggtttagaggtacc300
tggttgtggagtggctcctgcccactgctgatcttgataaggatttataaactgtatatc360
ttcctcctcaatagcgggggcagcagcttttttctttcttgaagaaaacagataaattag420
aacgatgataataatgattaagaccacgatagcaacgagaatagtacacatatgtgtgga480
gaagaagctcggtgtagaggttggtgacaaacattcgccataatgccgcggataaacggg540
ttgaaaaaattcagaatcca560
cd2v抗原,其核苷酸序列如序列表seqidno.2如下:
<210>2
<211>522
<212>dna
<213>hi5细胞
<400>2
gatgataaaatttttaatacgatgtttcagataatatatttaactaataaaattaattat60
acaatacgatggttacaacctgttgatcccccaaatatttcatttaatgatagtaattct120
ttaataaaatgtgaaaaaaataatggaacaaatactaaaatctatttatatttaaataat180
acatttattaataatactaatgaaaatgatcttaaatattattggaattgtagcgagtta240
aattataatattacagctacatgtattattaataatacacttaattcggcaaataccaca300
aaagttataaattgcactaatctattgttaaaatctgaccaaaattattttcttaaaaat360
attcatacattattttatatcataatttttattgtgggtgggacattaataagtattatt420
atatcaatcataacttttttatctttacgaaaaagaaaaaaacatgttgaagaaatagaa480
agtccaccacctgaatctaatgaagaagaacaatgtcagcat522
以上内容是结合具体实施方式对本发明所做的进一步详细说明,不能认为本发明的具体实施只局限于这些说明,对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,所做出的简单修改和替换,都应当视为属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!