一种流式荧光检测试剂的质量检测方法与流程
本发明属于流式荧光
技术领域:
,特别涉及一种流式荧光检测试剂的质量检测方法。
背景技术:
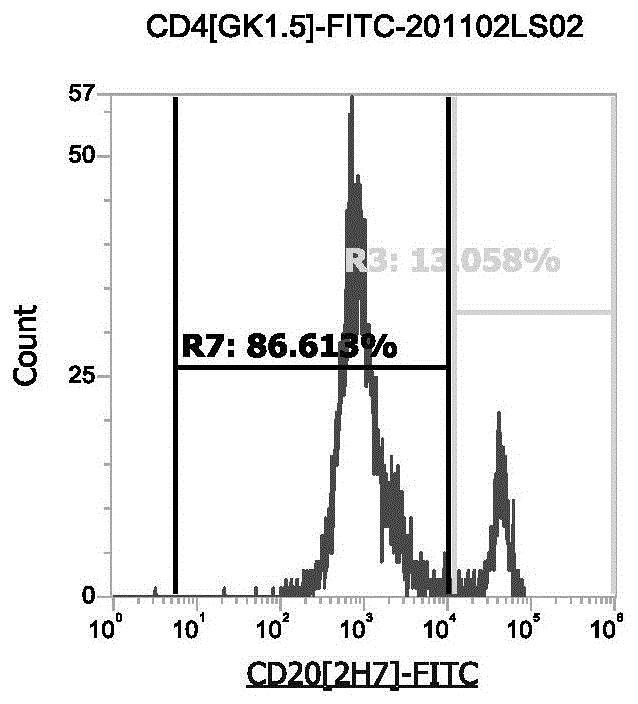
:流式荧光技术是基于编码微球和流式技术的一种临床应用型高通量发光检测技术,该技术有机整合了荧光编码微球、激光检测、应用流体学、高速数字信号处理技术等多项技术,具有多指标联合检测、通量高、速度快、标本用量少等诸多优点,且既能检测蛋白也能检测核酸、既适用于临床检验也适用于科研实验,应用领域十分广泛。在流式荧光技术中,用于检测目标抗原的荧光抗体的质量是确保检测结果准确有效的一大决定因素,对荧光抗体进行质量控制有利于技术实施的标准化和规范化。当前,本领域普遍采用中华人民共和国医药行业标准《yy/t1184-2010》对流式细胞仪用单克隆抗体试剂进行质量控制,该标准《yy/t1184-2010》仅仅对流式细胞仪用单克隆抗体试剂的以下三个指标做了要求,即:(1)批内精密度:即试剂对同一样本重复检测(n=10),检测结果应符合:a)阳性百分比大于等于30%时,cv值不大于8%;或b)阳性百分比小于30%时,cv值不大于15%;或c)平均荧光强度cv值应不大于10%(以荧光强度报告结果时);(2)批间精密度:即三个批号的试剂对同一样本的检测结果应符合:a)阳性百分比大于等于30%时,cv值不大于8%;或b)阳性百分比小于30%时,cv值不大于15%;或c)平均荧光强度cv值应不大于10%(以荧光强度报告结果时);(3)染色稳定性:即使用试剂对样本进行染色后,在生产企业规定的时间内重复检测,前后两次检测结果的差异相对于前一次检测的结果变化应符合:a)阳性百分比大于等于30%时,相对偏差值应不大于10%;b)阳性百分比为10%~30%时,相对偏差值应不大于20%;c)阳性百分比小于10%时,相对偏差值应不大于30%;d)平均荧光强度相对偏差值应不大于10%(以荧光强度报告结果时)。然而,具有不同信噪比的荧光抗体在采用当前行业标准进行质量控制时,虽然能获得相似的批间精密度和批内精密度数据,但显然信噪比较低的荧光抗体在实际应用过程中存在诸多问题,这就使得目前对流式荧光检测试剂的质量控制方法对不合格品的检出率还较低。技术实现要素:本发明的发明目的是提供一种流式荧光检测试剂的质量检测方法,采用该质量检测方法对待检流式荧光检测试剂(包括抗体或其他蛋白)进行质量评价,评价结果更为精准。为实现上述发明目的,本发明的技术方案如下:一种流式荧光检测试剂的质量检测方法,包括以下步骤:(1)分别采集待检流式荧光检测试剂的至少以下三个质控指标:其中,abslabel表示标记用荧光染料在其最大吸收峰处的吸光度(absorbanceoflabelingdyeattheabsorbancemaximumoflabelingdye),etarget表示被标记检测试剂的摩尔消光系数(molarextinctioncoefficientincm-1m-1oflabeledantibodyorprotein),abstarget表示被标记检测试剂在其最大吸收峰处的吸光度(absorbanceoflabeledantibodyorproteinattheabsorbancemaximumoflabeledantibodyorprotein;forantibodyandprotein,itis280nm),correctionfactortarget表示标记用荧光染料在被标记检测试剂的最大吸收峰处的吸光度的校正因子(correctionfactorforthefluorophore’scontributiontotheabsorbanceattheabsorbancemaximumoflabeledantibodyorprotein;forantibodyandprotein,itis280nm);b)染色指数:c)抗体均一性;(2)将采集到的各质控指标的检测值与相应的预设值进行一一比较,根据比较结果判断待检流式荧光检测试剂是否合格。本发明中,采用荧光标记度、染色指数和抗体均一性这三个质控指标对待检流式荧光检测试剂进行质量控制,其中,荧光标记度的预设值在2~10之间,若荧光标记度的检测值落入该预设值范围内,则该质控指标合格;染色指数的预设值为20,若染色指数的检测值大于等于20,则该质控指标合格;抗体均一性的预设值为90%,若抗体均一性的检测值大于等于90%,则该质控指标合格;作为优选,所有质控指标均合格的待检流式荧光检测试剂为合格品。经过本发明的质量检测方法判断为合格的流式荧光检测试剂批次间性能稳定、染色稳定性佳,荧光信号好、信噪比高。作为优选,在上述的流式荧光检测试剂的质量检测方法中,步骤(1)中,采用采用全波长酶标仪(如)multiskansky赛默飞全波长酶标仪,或与其具有相同功能的其他酶标仪)对待检流式荧光检测试剂的荧光标记度进行检测。作为优选,在上述的流式荧光检测试剂的质量检测方法中,步骤(1)中,采用流式荧光技术对待检流式荧光检测试剂的染色指数进行检测。在上述的流式荧光检测试剂的质量检测方法中,若待检流式荧光检测试剂的染色指数不合格,则分别对待检流式荧光检测试剂以及未经荧光标记的同克隆抗体进行效价测试,并将二者的测试结果进行比较,根据比较结果判断待检流式荧光检测试剂是否合格。即,若待检流式荧光检测试剂的染色指数的检测值小于20,则分别对待检流式荧光检测试剂以及未经荧光标记的同克隆抗体进行效价测试,分别检测待检流式荧光检测试剂与抗原的结合活性、未经荧光标记的同克隆抗体与抗原的结合活性,若二者与抗原的结合活性差异小于10%,则该质控指标仍为合格。作为优选,在上述的流式荧光检测试剂的质量检测方法中,通过elisa或流式细胞术(流式封闭实验)进行效价测试。作为优选,在上述的流式荧光检测试剂的质量检测方法中,步骤(1)中,采用快速蛋白液相色谱、聚丙烯酰胺凝胶电泳或质谱对待检流式荧光检测试剂的抗体均一性进行检测。对待检流式荧光检测试剂的抗体均一性进行检测时,需要确保液相中未形成大的聚合物且成分较为均一,均一性大于等于90%。本发明中,上述的流式荧光检测试剂的质量检测方法还包括以下步骤:(3)采用荧光信号系数对已判断为合格品的流式荧光检测试剂进行评分;荧光信号系数越高,则该流式荧光检测试剂合格品的质量越优。与现有技术相比,本发明的有益效果体现在:本发明中,采用荧光标记度、染色指数和抗体均一性这三个质控指标对待检流式荧光检测试剂进行质量控制,其中,荧光标记度的预设值在2~10之间,若荧光标记度的检测值落入该预设值范围内,则该质控指标合格;染色指数的预设值为20,若染色指数的检测值大于等于20,则该质控指标合格;抗体均一性的预设值为90%,若抗体均一性的检测值大于等于90%,则该质控指标合格;作为优选,所有质控指标均合格的待检流式荧光检测试剂为合格品,经过本发明的质量检测方法判断为合格的流式荧光检测试剂批次间性能稳定、染色稳定性佳,荧光信号好、信噪比高。附图说明图1为抗体cd4[gk1.5]-fitc-201102ls02的流式图(百分比);其中,count表示(细胞)计数,r7表示阴性细胞群比例,r3表示阳性细胞群比例,bl1-a-fitc表示fitc颜色通道(cd4-fitc)的信号分布,下同;图2为抗体cd4[gk1.5]-fitc-201102ls02的流式图(信号值);其中,r5表示cd4[gk1.5]-fitc染色后阴性细胞群的信号平均值,r3表示cd4[gk1.5]-fitc染色后阴性细胞群的信号平均值,bl1-a-fitc表示fitc颜色通道(cd4-fitc)的信号分布,下同;图3为抗体cd4[gk1.5]-fitc-201102ls03的流式图(百分比);图4为抗体cd4[gk1.5]-fitc-201102ls03的流式图(信号值);图5为抗体cd4[gk1.5]-fitc-201102ls04的流式图(百分比);图6为抗体cd4[gk1.5]-fitc-201102ls04的流式图(信号值);图7为抗体cd4[gk1.5]-fitc-201102ls05的流式图(百分比);图8为抗体cd4[gk1.5]-fitc-201102ls05的流式图(信号值);图9为抗体cd4[gk1.5]-fitc-190821dx07的流式图(百分比);图10为抗体cd4[gk1.5]-fitc-190821dx07的流式图(信号值);图11为抗体cd4[gk1.5]-fitc-200324yk01的流式图(百分比);图12为抗体cd4[gk1.5]-fitc-200324yk01的流式图(信号值);图13为各抗体cd4[gk1.5]-fitc的聚丙烯酰胺凝胶电泳图;其中,1即为抗体cd4[gk1.5]-fitc-201102ls02,2即为抗体cd4[gk1.5]-fitc-201102ls03,3即为抗体cd4[gk1.5]-fitc-201102ls04,4即为抗体cd4[gk1.5]-fitc-201102ls05,5即为抗体cd4[gk1.5]-fitc-190821dx07,6即为抗体cd4[gk1.5]-fitc-200324yk01;图14为在55℃下孵育24天后抗体cd4[gk1.5]-fitc-201102ls02的流式图(百分比);图15为在55℃下孵育24天后抗体cd4[gk1.5]-fitc-201102ls02的流式图(信号值);其中,r7表示cd4[gk1.5]-fitc染色后阴性细胞群的信号平均值,r3表示cd4[gk1.5]-fitc染色后阴性细胞群的信号平均值,下同;图16为在55℃下孵育24天后抗体cd4[gk1.5]-fitc-201102ls03的流式图(百分比);图17为在55℃下孵育24天后抗体cd4[gk1.5]-fitc-201102ls03的流式图(信号值);图18为在55℃下孵育24天后抗体cd4[gk1.5]-fitc-201102ls04的流式图(百分比);图19为在55℃下孵育24天后抗体cd4[gk1.5]-fitc-201102ls04的流式图(信号值);图20为在55℃下孵育24天后抗体cd4[gk1.5]-fitc-201102ls05的流式图(百分比);图21为在55℃下孵育24天后抗体cd4[gk1.5]-fitc-201102ls05的流式图(信号值);图22为在55℃下孵育24天后抗体cd4[gk1.5]-fitc-190821dx07的流式图(百分比);图23为在55℃下孵育24天后抗体cd4[gk1.5]-fitc-190821dx07的流式图(信号值);图24为在55℃下孵育24天后抗体cd4[gk1.5]-fitc-201102ls02的流式图(百分比);其中,r5表示阴性细胞群比例,r3表示阳性细胞群比例,下同;图25为在55℃下孵育32天后抗体cd4[gk1.5]-fitc-201102ls02的流式图(信号值);其中,r2表示cd4[gk1.5]-fitc染色后阴性细胞群的信号平均值,r6表示cd4[gk1.5]-fitc染色后阴性细胞群的信号平均值,下同;图26为在55℃下孵育32天后抗体cd4[gk1.5]-fitc-201102ls03的流式图(百分比);图27为在55℃下孵育32天后抗体cd4[gk1.5]-fitc-201102ls03的流式图(信号值);图28为在55℃下孵育32天后抗体cd4[gk1.5]-fitc-201102ls04的流式图(百分比);图29为在55℃下孵育32天后抗体cd4[gk1.5]-fitc-201102ls04的流式图(信号值);图30为在55℃下孵育32天后抗体cd4[gk1.5]-fitc-201102ls05的流式图(百分比);图31为在55℃下孵育32天后抗体cd4[gk1.5]-fitc-201102ls05的流式图(信号值);图32为在55℃下孵育32天后抗体cd4[gk1.5]-fitc-190821dx07的流式图(百分比);图33为在55℃下孵育32天后抗体cd4[gk1.5]-fitc-190821dx07的流式图(信号值)。具体实施方式下面结合附图和具体实施方式对本发明的技术方案做进一步详细说明。本实施例以cd4[gk1.5]-fitc荧光标记抗体为例,采用本发明的质量检测方法对如表1所示的来自不同批次或品牌的cd4[gk1.5]-fitc荧光标记抗体进行质量检测,以验证各cd4[gk1.5]-fitc的可靠性,确定其安全有效的使用期限,确保其在临床应用中的使用准确性。表1序号抗体[克隆号]批号1cd4[gk1.5]-fitc201102ls022cd4[gk1.5]-fitc201102ls033cd4[gk1.5]-fitc201102ls044cd4[gk1.5]-fitc201102ls055cd4[gk1.5]-fitc190821dx076cd4[gk1.5]-fitc200324yk01一种流式荧光检测试剂的质量检测方法,包括以下步骤:(1)分别采集待检cd4[gk1.5]-fitc的以下三个质控指标:a)荧光标记度:其中,abslabel表示标记用荧光染料在其最大吸收峰处的吸光度(absorbanceoflabelingdyeattheabsorbancemaximumoflabelingdye),etarget表示被标记检测试剂的摩尔消光系数(molarextinctioncoefficientincm-1m-1oflabeledantibodyorprotein),abstarget表示被标记检测试剂在其最大吸收峰处的吸光度(absorbanceoflabeledantibodyorproteinattheabsorbancemaximumoflabeledantibodyorprotein;forantibodyandprotein,itis280nm),correctionfactortarget表示标记用荧光染料在被标记检测试剂的最大吸收峰处的吸光度的校正因子(correctionfactorforthefluorophore’scontributiontotheabsorbanceattheabsorbancemaximumoflabeledantibodyorprotein;forantibodyandprotein,itis280nm);b)染色指数:采用流式荧光技术对待检cd4[gk1.5]-fitc抗体的染色指数进行检测;其中,阳性信号均值表示cd4+设门阳性细胞群设门区域的信号均值,阴性信号均值表示cd4-设门阴性细胞群设门区域的信号均值;c)抗体均一性;采用聚丙烯酰胺凝胶电泳对待检cd4[gk1.5]-fitc的抗体均一性进行检测;(2)将采集到的各质控指标的检测值与相应的预设值进行一一比较,根据比较结果判断待检cd4[gk1.5]-fitc抗体是否合格;其中,荧光标记度的预设值在2~10之间,若荧光标记度的检测值落入该预设值范围内,则该质控指标合格;染色指数的预设值为20,若染色指数的检测值大于等于20,则该质控指标合格;若染色指数的检测值小于20,则分别对待检cd4[gk1.5]-fitc以及未经荧光标记的同克隆抗体进行效价测试(elisa),分别检测待检cd4[gk1.5]-fitc抗体与抗原的结合活性、未经荧光标记的同克隆抗体与抗原的结合活性,若二者与抗原的结合活性差异小于10%,则该质控指标仍为合格;对于抗体均一性,则需要确保液相中未形成大的聚合物且成分较为均一,抗体均一性的预设值为90%,若抗体均一性的检测值大于等于90%,则该质控指标合格;以上三个质控指标均合格的待检cd4[gk1.5]-fitc即为合格品。(3)采用荧光信号系数对已判断为合格品的cd4[gk1.5]-fitc进行评分;荧光信号系数越高,则该cd4[gk1.5]-fitc合格品的质量越优。采用本发明的质量检测方法、采用当前行业标准《yy/t1184-2010》对表1中六种待检cd4[gk1.5]-fitc的质量检测结果见表2,以及图1至图13。表2从表2、图1至图13的检测结果可以看出,采用当前行业标准《yy/t1184-2010》进行检测时,各待检cd4[gk1.5]-fitc抗体均为合格品;但采用本发明的质量检测方法进行检测时,仅序号为1-5的待检cd4[gk1.5]-fitc为合格品,而序号为6的待检cd4[gk1.5]-fitc不合格;且根据荧光信号系数的检测结果,各抗体的质量排序为:产品1>产品2=产品3>产品4>产品5。采用本发明的质量检测方法,对上述被检出合格的cd4[gk1.5]-fitc抗体进行加速试验,以验证上述cd4[gk1.5]-fitc抗体在2年有效期内是否保持质量稳定。具体地,将上述被检出合格的cd4[gk1.5]-fitc抗体置于55℃恒温水浴锅内避光存放24天(55℃下孵育1天相当于4℃下保存1个月)后取出,检测各cd4[gk1.5]-fitc抗体的各质控指标,结果见表3、图14至图23;检测完成后,将上述在55℃下孵育过的各cd4[gk1.5]-fitc抗体继续置于55℃恒温水浴锅内避光存放8天后取出,检测各cd4[gk1.5]-fitc抗体的各质控指标,结果见表4、图24至图33。表3抗体序号荧光标记度染色指数抗体均一性荧光信号系数1553均一0.532549均一0.493551均一0.514548均一0.485941均一0.41从表3、图14至图23的检测结果可以看出,合格品在55℃下稳定孵育24天后,产品的各项质控指标均合格,表明经本发明质量检测方法检测为合格的产品在2年(24个月)的保质期内仍有效;且产品质量信号与表2的检测结果相一致,产品1仍为最优品,产品5为五种抗体中质量最差的产品。表4抗体序号荧光标记度染色指数抗体均一性荧光信号系数1334均一0.342333均一0.333332均一0.324322均一0.225517不均一不合格品从表4、图24至图33的检测结果可以看出,产品1-4在55℃下稳定孵育32天后,产品的各项质控指标均合格,表明经本发明质量检测方法检测为合格的产品1-4在32个月的保质期内仍有效;且产品质量信号与表2的检测结果相一致,产品1仍为最优品,产品4为五种抗体中质量最差的产品。产品5的染色指数小于20,抗体均一性变差,信噪比有所降低,表明产品5在保存32个月后已失效;产品1-4虽然在保存32个月后仍有效,但有效性也有所降低,因此建议各抗体的保质期均设置为2年。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1