基于有机硫物种的电池的制作方法
本申请系申请日为2013年04月09日、国际申请号为pct/us2013/035716、进入中国国家阶段后的国家申请号为201380019831.7、题为“基于有机硫物种的电池”的发明专利申请的分案申请。
发明领域
本发明涉及以下电池,这些电池具有基于钠、锂或其混合物或者钠和/或锂与一种或多种其他金属的合金或复合材料的阳极,与基于元素硫、硒或元素硫属元素混合物的阴极,该阳极和阴极被隔板元件分隔,导电盐溶于非水的极性非质子溶剂或聚合物中的液体或凝胶电解质溶液与电极接触。
发明背景
电化学电池是用于存储和提供电能的主要手段。由于电子,运输和网格存储应用对能源的需求不断增加,在未来对具有更强蓄电和传递能力的电池的需求将继续保持。
由于与其他类型的电池相比,锂离子电池重量轻和高能量存储能力,自20世纪90年代初锂离子电池已被广泛用于便携式电子应用。然而,目前的锂离子电池技术并不能满足大型应用,如网格存储或行驶距离可与内燃机汽车竞争的电动汽车的高功率和能源需求。因此,科学和技术界广泛努力继续识别具有更高能量密度和容量的电池。
钠-硫和锂-硫电化学电池提供甚至比锂离子电池更高的理论能量容量,并且因此继续作为“下一代”电池系统而引起关注。元素硫到单体硫化物(s2-)的电化学转变提供1675mah/g的理论容量,相比锂离子电池的小于300mah/g。
钠-硫电池已经开发和推出作为商用系统。不幸的是,钠-硫电池通常需要高温(300℃以上)来工作,并且因此只适合用于大型固定应用。
锂-硫电化学电池(最初在20世纪50年代后期和60年代提出的)现在正在开发作为商业电池系统。这些电池提供的理论比能量密度超过2500wh/kg(2800wh/l)相对于锂离子的624wh/g。li-s电池所表现出的比能量密度是在250wh/kg-350wh/kg的范围内(相比锂离子电池的100wh/g),较低的数值是在充电和放电过程中这些系统的电化学过程的特定功能的结果。考虑到锂离子电池的实际比能通常是理论值的25%至35%,li-s系统的最佳实际比能为约780wh/g(理论值的30%)。[v.s.kolosnitsyn,e.karaseva,美国专利申请2008/0100624a1]
锂-硫化学提供了阻碍这些电化学电池发展的大量技术挑战,特别是不良的放电-充电循环性能。然而,由于锂-硫电池固有的低重量、低成本和高容量,对于改善锂-硫系统的性能存在极大的兴趣,在过去20年中世界各地许多研究人员进行了大量的工作来解决这些问题。[c.liang等人在handbookofbatterymaterials2nded.[电池材料手册第2版],第14章,第811-840页(2011);v.s.kolosnitsyn等人,j.powersources[能源期刊]2011,196,1478-82;和其参考文献。]
锂-硫系统的电池设计通常包括:
·一个阳极,其组成为锂金属、锂合金或含有锂的复合材料。
·在该阳极和阴极之间的一个非反应性但多孔的隔板(通常是聚丙烯或β-氧化铝)。此隔板的存在导致分隔的阳极电解质液隔室和阴极电解质液隔室。
·并入粘合剂(常为聚偏二氟乙烯)和导电增强材料(通常是石墨、中孔石墨、多壁碳纳米管、石墨烯)中的一种多孔含硫阴极,
·一种电解质,其组成为一种极性非质子溶剂和一种或多种导电li盐[(cf3so2)2n-、cf3so3-、ch3so3-、clo4-、pf6-、asf6-、卤素等]。在这些电池中所用的溶剂包括碱性(阳离子络合)非质子极性溶剂,如环丁砜、二甲亚砜、二甲基乙酰胺、四甲基脲、n-甲基吡咯烷酮、四乙基磺酰胺、四氢呋喃、甲基-thf、1,3-二氧戊环、二甘醇二甲醚和四乙二醇二甲醚。低极性溶剂是不适合的,由于其导电性差、溶剂化li+物种能力差,而质子溶剂与li金属发生反应。在锂-硫电池的固态形式中,该液体溶剂被聚合材料如聚环氧乙烷所取代。
·通用的集电器和适当的外壳材料。
发明概述
在金属-硫电池,特别是锂-硫电池中使用的有机多硫化物和有机多硫醇盐的组合物和应用由本发明所提供。该有机多硫化物和有机多硫醇盐物种用于改善此电化学电池在反复充放电循环过程中的性能。
本发明因此涉及化学能源,该化学能源包括具有一个或多个正极(阴极),一个或多个负极(阳极)和一种电解质介质的电池或蓄电池(battery),其中进行的化学反应涉及硫或多硫化物物种的还原以及反应性金属物种的氧化。负极包括反应性金属,如锂、钠、钾或这些金属与其他材料的合金/复合材料。正极包括硫、有机多硫化物物种,和/或有机多硫化物金属盐,以及含有这些物种的基质。电解质基质包括有机溶剂或聚合物、无机或有机多硫化物物种、活性金属的离子形式的载体和旨在优化电化学性能的其他组分的混合物。
具体而言,本发明涉及有机多硫化物,和其锂(或钠、季铵或季鏻)有机硫醇盐或有机多硫醇盐类似物作为在阴极和电解质基质中的组分的用途。所述有机硫物种与硫及阴离子型的单硫化物或多硫化物物种化学结合形成有机多硫醇盐物种,这些物种具有增加的与正极材料和阴极电解质液相的非极性硫组分的亲和性。
本发明的一个方面提供了一种电池,该电池包括:
a)一个阳极,其包括一种阳极活性材料,该阳极活性材料包括钠、锂或者至少一种钠或锂与至少一种提供离子的其他金属的合金或复合材料;
b)一个阴极,其包括一种阴极活性材料,该阴极活性材料包括元素硫、元素硒或元素硫属元素的混合物;以及
c)放置在该阳极和该阴极之间的一种中间隔板元件,该隔板元件用于分离与该阳极和该阴极接触的液体或凝胶电解质溶液,在该电池的充电和放电循环过程中在该阳极和该阴极之间的金属离子和抗衡离子通过该隔板元件移动;
其中该液体或凝胶电解质溶液包括一种非水的极性非质子溶剂或聚合物以及一种导电盐并且满足条件(i)、(ii)或(iii)中的至少一个:
(i)该液体或凝胶电解质溶液中的至少一种另外包括至少一种有机硫物种;
(ii)该阴极另外包括至少一种有机硫物种;
(iii)该中间隔板元件包括一种含有至少一种有机硫物种的官能化的多孔聚合物;
其中该有机硫物种包括至少一个有机部分和至少一个–s-sn-键,其中n是1或更大的整数。
在一个实施例中,条件(i)、(ii)或(iii)只有一个得到满足。在另一个实施例中,所有三个条件都得到满足。在又一实施例中,只有两个条件得到满足,例如(i)和(ii)、(i)和(iii)或(ii)和(iii)。
在另一个方面,本发明提供了一种电解质,其包括至少一种非水的极性非质子溶剂或聚合物,至少一种导电盐和至少一种有机硫物种,该至少一种有机硫物种包括至少一个有机部分以及至少一个-s-sn-键,其中n是1或更大的整数。
本发明的另一个方面提供了一种阴极,其包括:a)元素硫、元素硒或元素硫属元素的混合物,b)至少一种导电添加剂,c)以及至少一种有机硫物种,该有机硫物种包括至少一个有机部分和至少一个-s-sn-键,n是1或更大的整数。
例如,有机硫物种可以选自有机多硫化物和/或有机多硫醇金属盐组成的组中。在本发明的某些实施例中,该有机硫物种含有选自下组的一种或多种含硫官能团,该组由以下各项组成:二硫缩醛、二硫缩酮、三硫代原碳酸酯、硫代磺酸根[-s(o)2-s-]、硫代亚磺酸根[-s(o)-s-]、硫代羧酸根[-c(o)-s-]、二硫代羧酸根[-c(s)-s-]、硫代磷酸酯、硫代膦酸酯、一硫代碳酸酯、二硫代碳酸酯和三硫代碳酸酯。在其他实施例中,该有机硫物种可以选自由芳香族多硫化物、聚醚-多硫化物、多硫化物-酸式盐及其混合物组成的组。
附图简要说明
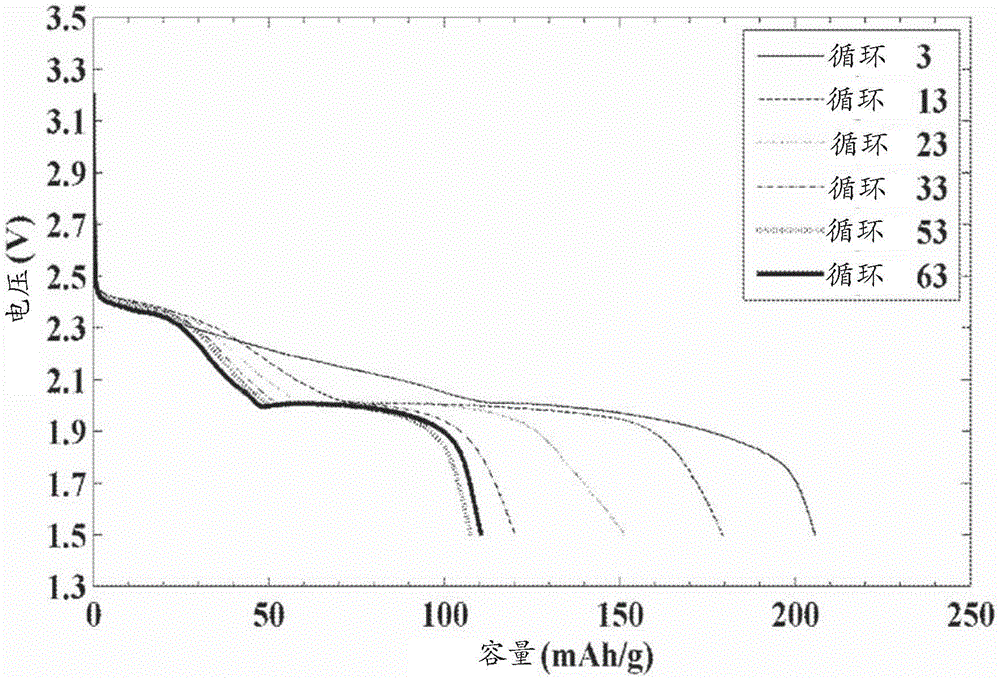
图1示出了将正c12h25sli加入到阴极的锂-硫电池重复充电/放电循环3次至63次的放电特征曲线(profile)。
发明的详细说明
已被加工成在电池中使用的结构的电活性材料被称为电极。在电池(作为一种化学电能源)中使用的一对电极中,在具有较高电化学电势的一侧的电极被称为正极或阴极,而在具有较低电化学电势的一侧的电极被称为负极或阳极。如本文所用,采用传统的电池命名法,其中术语“阴极”或“正极”和“阳极”或“负极”是指在电池放电提供电能的过程中电极的电化学功能。在循环的充电部分的过程中,电极的实际电化学功能与在放电过程中发生的刚好相反,但各电极的名称与放电时的名称保持相同。
电化学电池通常串联组合,这样的电池的集合被称为蓄电池。基于电池中进行的化学反应,原电池组被设计为单次放电来为外部装置提供动力。二次电池是可再充电的,用来自外部源的电能,并且从而通过多个放电和充电循环提供延长使用。
在阴极或正极使用的电化学活性材料在下文中被称为阴极活性材料。在阳极或负极使用的电化学活性材料在下文中被称为阳极活性材料。具有电化学活性并且包括一种电化学活性物质和任选的导电添加剂和粘结剂,以及其他任选的添加剂的多组分组合物在下文中被称为电极组合物。包含具有处于氧化态的阴极活性材料的阴极和具有处于还原态的阳极活性材料的阳极的电池被称为是处于已充电状态。因此,包含具有处于还原态的阴极活性材料的阴极和具有处于氧化态的阳极活性材料的阳极的电池被称为是处于已放电状态。
不希望被理论所束缚,以下内容是本发明的某些可能的优点或特征。有机硫物种可能分配到富硫阴极电解质液相。双阴离子硫化物或多硫化物(例如,li2sx,x=1,2,3…)与有机多硫化物或有机多硫醇盐(例如,r-sx-r’或r-sx-li,r和r’=有机部分)之间的化学交换反应,以及多硫化物和多硫醇盐常见的硫挤出/重新插入的化学反应,有利于最大限度地减少阴极电解质液中的双阴离子多硫化物的量,且有利于阴极的硫和含硫物种的再沉积。双阴离子多硫化物的净去除会降低电解质溶液的粘度,并且从而最大限度地减少高粘度对电解质导电率的有害影响。有机硫物种还可以增加阴极电解质液相和阳极电解质液相中的不溶性低级硫化锂物种(特别是li2s和li2s2)的溶解,并因此将其清除,从而最大限度地减少反复充电/放电循环时活性锂物种的损失。有机硫物种的性能可通过选择有机官能度而“调整”。例如,短链烷基或具有较强极性官能度的烷基将更多地分配到阳极电解质液相,而长链或较弱极性类似物将更多地分配到阴极电解质液相。调整长/非极性和短/极性链的有机物种的相对比例将提供一种控制将含硫物种分配到阴极/阴极电解质液的手段。此外,由于在阳极电解质液中存在一定量的多硫化物或多硫醇盐作为控制在充电过程中在阳极上的锂枝晶生长的一种手段是有利的,选择适当的有机部分和他们的相对比例将提供对枝晶生长的更大控制。
在本发明中使用的有机硫物种包括至少一个有机部分和至少一个-s-sn-键,其中n是1或更大的整数。在一个实施例中,该有机硫物种的每个分子中包括两个有机部分(其可以是相同或彼此不同的),其是由-s-sn-(多硫化物)键链接的(其中n是1或更大的整数)。该-s-sn-键可形成更大连接基团的一部分,如-y1-c(y2y3)-s-sn-键或-y1-c(=y4)-s-sn-键,其中y1是o或s,y2和y3是独立地一个有机部分或–s-so-z,其中o是1或更大,并且z是一个有机部分或选自li、na、季铵或季鏻的物种,并且y4是o或s。在另一个实施例中,有机硫物种包含一价有机部分和选自na、li、季铵以及季鏻的物种,该物种是由-s-sn-键链接的(例如,包括-y1-c(y2y3)-s-sn-键或-y1-c(=y4)-s-sn-键)。在又一实施例中,-s-sn-键可在有机部分的任一侧上出现。例如,有机部分可以是二价的,任选地取代的芳香族部分c(r3)2(每个r3独立地为h或有机部分如c1-c20有机部分),羰基(c=o)或硫代羰基(c=s)。
例如,有机硫物种可选自有机多硫化物、有机多硫醇盐、包括具有含硫官能团的那些如二硫缩醛、二硫缩酮、三硫代原碳酸酯、芳香族多硫化物、聚醚-多硫化物、多硫化物-酸式盐、硫代磺酸根[-s(o)2-s-]、硫代亚磺酸根[-s(o)-s-]、硫代羧酸根[-c(o)-s-]、二硫代羧酸根[-rc(s)-s-]、硫代磷酸酯或硫代膦酸酯官能度、或一硫代碳酸酯、二硫代碳酸酯和三硫代碳酸酯官能度;含有这些或类似官能度的有机-金属多硫化物;以及它们的混合物。
例如,合适的有机部分包括一价、二价和多价有机部分,其可以包括支链、直链和/或环状烃基。如本文所用,术语“有机部分”除了包括碳和氢外,可包括一个或多个杂原子如氧、氮、硫、卤素、磷、硒、硅、一种金属如锡和类似物的部分。一个或多个杂原子可在有机部分以官能团的形式存在。因此,烃基和官能化的烃基基团在本发明的上下文之内被认为是有机部分。在一个实施例中,该有机部分是c1-c20有机部分。在另一个实施例中,该有机部分包含两个或更多个碳原子。因此该有机部分可以是c2-c20有机部分。
有机硫物种在性质上可以是单体、低聚物或聚合物。例如,-s-sn-官能度可以悬接(pendant)在低聚物或聚合物物种的主链上,该低聚物或聚合物物种的主链中含有两个或更多个单体的重复单元。该-s-sn-官能度可并入此低聚物或聚合物的主链中,使得该低聚物或聚合物主链中含有多个-s-sn-键。
例如,有机硫物种可以是具有化学式r1-s-sn-r2的一种有机多硫化物或多种有机多硫化物的混合物,其中r1和r2独立地代表c1-c20有机部分,且n是1或更大的整数。该c1-c20有机部分可以是一价的支链、直链或环状烃基。r1和r2可以各自独立地是c9-c14烃基,其中n=1(前提条件为二硫化物,如叔十二烷基二硫化物)。在另一个实施例中,r1和r2各自独立地是c9-c14烃基,其中n=2-5(前提条件为多硫化物)。这类化合物的例子包括tps-32和tps-20,由arkema公司出售。在另一个实施例中,r1和r2独立地是c7-c11烃基,其中n=2-5。由arkema公司出售的tps-37ls是此类型的合适的多硫化物的一个例子。另一种类型的合适的多硫化物是一种多硫化物或多种多硫化物的混合物,其中r1和r2都是叔丁基且n=2-5。这类有机硫化合物的例子包括tps-44和tps-54,由arkema公司出售。
有机硫物种也可以是具有化学式r1-s-sn-m的有机多硫醇盐,其中r1是c1-c20有机部分,m为锂、钠、季铵或季鏻,且n是1或更大的整数。
在另一个实施例中,有机硫物种可以是二硫缩醛或二硫缩酮如对应于化学式(i)和(ii)的那些,或具有化学式(iii)的三硫代原羧酸酯(trithio-orthocarboxylate):
其中每个r3独立地是h或c1-c20有机部分,o、p和q各自独立地为1或更大的整数,并且每个z独立地是c1-c20有机部分、锂、钠、季铵或季鏻。这类有机硫物种的例子包括1,2,4,5-四噻烷(化学式i,r3=h,o=p=1),四甲基-1,2,4,5-四噻烷(化学式i,r3=ch3,o=p=1),和其低聚或聚合物物种。
本发明的另一个实施例利用有机硫物种,其是具有化学式(iv)的芳香族多硫化物、具有化学式(v)的聚醚-多硫化物,具有化学式(vi)的多硫化物-酸式盐,或具有化学式(vii)的多硫化物-酸式盐:
其中r4独立地是叔丁基或叔戊基,r5独立地是oh、oli或ona,并且在化学式(iv)中r是0或更大(例如0-10),其中这些芳环在一个或多个除氢以外的取代基的其他位置被任选取代,r6在化学式(vi)中是一个二价有机部分,r7在化学式(vii)中是一个二价有机部分,每个z独立地是c1-c20有机部分、锂、钠、季铵或季鏻,且o和p各自独立地为1或更大的整数。这类有机硫物种的例子包括由arkema公司以商标名称
在又一实施例中,有机硫物种是一种含有具有化学式(ix)的三硫代碳酸酯官能度的有机或有机-金属多硫化物,含有具有化学式(x)的二硫代碳酸酯官能度的有机或有机金属多硫化物,或一种含有具有化学式(xi)的一硫代碳酸酯官能度的有机或有机金属多硫化物:
其中z是c1-c20有机部分、na、li、季铵或季鏻,且o和p独立地为1或更大的整数。
液体或凝胶电解质溶液可以另外包括具有化学式m-s-sn-m的双金属多硫醇盐物种,其中每个m独立地为li、na、季铵或季鏻,且n是1或更大的整数。这样的物种因此不包含任何有机部分,不同于上述的有机硫物种。
中间隔板元件可以用作电化学电池内的隔室之间的分隔件。一个隔室可包括与阴极接触的电解质溶液(在此隔室中的电解质溶液可被称为阴极电解质液)。另一个隔室可包括与阳极接触的电解质溶液(在此隔室中的电解质溶液可被称为阳极电解质液)。阳极电解质液和阴极电解质液可以是彼此相同或不同的。阳极电解质液和阴极电解质液中的一者或两者可包含一种或多种根据本发明的有机硫物种。中间隔板元件可以上述方式放置在隔室之间,以便允许离子从阳极电解质液通过该中间隔板元件进入阴极电解质液,并且反之亦然,这取决于电化学电池是在充电或放电模式操作。
在本发明的另一个实施例中,该中间分隔元件包含一种多孔聚合物。该多孔聚合物可包含例如聚丙烯、聚乙烯或含氟聚合物。该多孔聚合物可使用本文所描述类型的有机硫物种官能化。该有机硫物种可以悬接在多孔聚合物的主链上,可存在于单个聚合物链的主链之间的交联中和/或可结合到该多孔主链的主链中。因此,多孔聚合物的主链可包含一个或更多个-s-sn-链和/或-s-sn-链可以悬接在聚合物主链上。此-s-sn-链也可存在于交联中。
在根据本发明的电化学电池中使用的合适的溶剂包括任何已知的或通常用于锂-硫电池的碱性(阳离子络合)非质子极性溶剂,如环丁砜、二甲亚砜、二甲基乙酰胺、四甲基脲、n-甲基吡咯烷酮、四乙基磺酰胺;醚类,如四氢呋喃、甲基-thf、1,3-二氧戊环、二甘醇二甲醚和四乙二醇二甲醚,和它们的混合物;碳酸酯类,如碳酸亚乙酯、碳酸亚丙酯、碳酸二甲酯、碳酸二乙酯、碳酸甲乙酯、碳酸甲丙酯、碳酸乙丙酯和类似物;以及酯类,如乙酸甲酯、乙酸乙酯、乙酸丙酯和γ-丁内酯。该电解质可包含这些溶剂的单一一种或这些溶剂的混合物。电池技术领域中已知的任何极性非质子聚合物也可以使用。该电解质溶液可以包括聚合物材料,且可以是凝胶的形式。用于该电解质溶液的合适的聚合物可以包括,例如,聚环氧乙烷,聚醚砜,聚乙烯醇,或聚酰亚胺。该电解质溶液可以是凝胶的形式,其可以是一个三维的网络,包含液体和粘合剂成分。该液体可以是被夹带在聚合物(如交联聚合物)中的单体溶剂。
在结合有非水的极性非质子溶剂和/或聚合物的电解质溶液中存在一种或多种导电盐类。电池技术领域中众所周知的导电盐类包括,例如,(cf3so2)2n-、cf3so3-、ch3so3-、clo4-、pf6-、asf6-、卤素等类似物的锂盐。也可以使用钠和其他碱金属的盐及其混合物。
该阳极活性材料可以包括碱金属如锂或钠或其他活性材料或组合物。特别优选的阳极活性材料包括金属锂,锂合金,金属钠,钠合金,碱金属或它们的合金,锂与铝、镁、硅和/或锡的合金、金属粉末,碱金属-碳和碱金属-石墨插层物,能够可逆地与碱金属离子的氧化和还原的化合物,以及它们的混合物。在电池内也可以以一层薄膜或任选由陶瓷材料分离的多层薄膜的形式含有金属或金属合金(例如金属锂)。合适的陶瓷材料包括,例如,二氧化硅,氧化铝,或含锂玻璃材料,如磷酸锂、铝酸锂、硅酸锂、锂磷氧氮化物、氧化锂钽、铝硅酸锂、氧化锂钛、硅硫化锂,锗硫化锂、铝硫化锂、硼硫化锂、磷硫化锂和它们的混合物。
该阴极包括元素硫,硒元素或元素硫属元素的混合物。在一个实施例中,该阴极另外包含一个或多个按照本文之前详细描述的那些有机硫物种。该阴极可另外和/或替代地包含粘合剂和/或导电添加剂。合适的粘合剂包括聚合物如,例如,聚乙烯醇,聚丙烯腈,聚偏二氟乙烯(pvdf),聚氟乙烯,聚四氟乙烯(ptfe),四氟乙烯和六氟丙烯的共聚物,偏二氟乙烯和六氟丙烯的共聚物,偏二氟乙烯和四氟乙烯的共聚物,乙烯-丙烯-二烯单体橡胶(epdm),聚氯乙烯(pvc)。导电添加剂可以是,例如,导电碳如石墨、石墨烯、碳纤维、碳纳米管、碳黑,或烟灰(例如,灯或炉烟灰)。该阴极可以存在于蓄电池或结合有集电器的电化学电池中,该集电器如在电池或电化学电池技术领域中任何已知的集电器。例如,该阴极可以涂覆在金属集电器的表面上。
实例
阴极制造,电池制备,以及电池测试
实例1
组成为70wt%的升华硫元素粉末、20wt%的聚环氧乙烷(peo,分子量4×106)、10wt%的炭黑(super
这些组分的混合物在n-甲基-2-吡咯烷酮(nmp)中在行星式铣床进行机械研磨。加入乙腈来稀释混合物。将所得悬浮液用自动薄膜涂布机(mathis)涂覆到铝箔(76μm厚)上。该涂层在真空烘箱中50℃下干燥18小时。得到的涂层含有3.10mg/cm2的阴极混合物。
实例2
含有正十二烷基硫醇锂(10wt%的硫)的正极材料按照实例1中所描述的步骤制备。得到的涂层含有3.4mg硫/cm2。
实例3
来自实例2的正极材料在ptfeswaglok电池中使用,该ptfeswaglok电池具有两个不锈钢棒或不锈钢(cr2032)制成的硬币电池组件。该电池单元在氩气填充的手套箱(mbraun)中如下组装:将阴极放置在底部,接着放置隔板。然后将电解质溶液加入到隔板。将锂电极放置在该隔板上。在锂电极的顶部放置间隔件和弹簧。电池芯用不锈钢棒或用卷边机密封。
实例4
按实例3中所描述的方法,在0.1ma的电流下对电池进行了充放电循环测试,该电池单元的组成为来自实例2(直径7/16”)的阴极,20μl的0.5m的litfsi溶于四乙二醇二甲醚(tegdme):1,3-二氧戊环(dol)=1:1的溶液,隔板,以及锂电极(厚度0.38mm,直径7/16”)。该测试使用gamry电位计(gamryinstruments)截止电压为1.5v和3.2v在室温下进行测试。放电循环曲线在图1中示出。
烷基硫醇锂的合成
实例5-使用己基锂合成正十二烷基硫醇锂
在-30℃下,向正十二烷基硫醇(9.98g,1当量)的己烷溶液(100ml)中逐滴加入正己基锂(33wt%的己烷溶液,1.1当量)来保持混合物的温度低于-20℃。减压下除去溶剂,以一定量的产率得到白色固体。
实例6-用氢氧化锂合成正十二烷基硫醇锂
将正十二烷基硫醇(2.0g,1当量)和氢氧化锂一水合物(0.41g,1当量)的混合物的乙腈(8ml)溶液加热到75℃,并在75℃下搅拌16小时。冷却至室温后,将反应混合物过滤。将滤饼用乙腈冲洗,在真空烘箱中50℃下干燥过夜。得到的正十二烷基硫醇锂为白色固体,产率93.5%(1.93g)实例7-使用己基锂合成正十二烷基硫醇锂
按实例6中所描述的方法,以一定量的产率从二硫醇合成3,6-二氧杂辛烷-1,8-二硫醇二锂盐,为白色固体。
烷基多硫醇锂的合成
实例8-使用氢氧化锂合成正十二烷基多硫醇锂
向正十二烷基硫醇(2.00g,1当量)溶于1,3-二氧戊环(25ml)的氮脱气的溶液中加入氢氧化锂一水合物(0.41g,1当量)和硫(1.27g,4当量)。在氮气下室温搅拌该混合物30min。得到正十二烷基多硫醇锂溶于1,3-二氧戊环的深红色溶液。硫醇向正十二烷基多硫醇锂的完全转化由13c-nmr和lcms证实。
实例9-使用氢氧化锂和硫合成3,6-二氧杂辛烷-1,8-多硫醇锂
按实例8中所描述的步骤,3,6-二氧杂辛烷-1,8-多硫醇锂溶于1,3-二氧戊环的深红色溶液,是来自3,6-二氧杂辛烷-1,8-二硫醇(0.72g,1当量)、氢氧化锂一水合物(0.33g,2当量)、以及硫(1.02g,8当量)在1,3-二氧戊环(10ml)中的反应。
实例10-从烷基硫醇锂合成正十二烷基多硫醇锂
向正十二烷基硫醇锂(0.21g,1当量)溶于1,3-二氧戊环(5ml)的氮脱气的浆体中加入硫(0.13g,4当量)。在氮气下室温搅拌该混合物16小时。通过过滤除去不溶性固体。通过lcms测定,深红色滤液中含有63%的正十二烷基多硫醇锂和37%的双(正十二烷基)多硫化物的混合物。
实例11-使用锂金属和硫合成正十二烷基多硫醇锂
向正十二烷基硫醇(2.23g,1当量)溶于1,3-二氧戊环(25ml)的氮脱气的溶液中加入硫(1.41g,4当量)和锂(76.5mg)。将该混合物加热到60℃,并在氮气下60℃下搅拌1小时。得到正十二烷基多硫醇锂溶于1,3-二氧戊环的深红色溶液。正十二烷基硫醇的完全转化由13c-nmr证实。
实例12-使用锂金属和硫合成3,6-二氧杂辛烷-1,8-多硫醇锂
按实例11中所描述的步骤,由3,6-二氧杂辛烷-1,8-二硫醇(1.97g,1当量)、锂金属(0.15g,2当量)、以及硫(2.77g,8当量)在1,3-二氧戊环(11ml)中反应,得到3,6-二氧杂辛烷-1,8-多硫醇锂溶于1,3-二氧戊环的深红色溶液。初始二硫醇的完全转化由13c-nmr证实
实例13-通过添加正十二烷基多硫醇锂溶解li2s
为测定硫化锂在含有正十二烷基多硫醇锂的电解液中的溶解度,按如下方法制备硫化锂的饱和溶液:
按实例10中所描述的步骤制备0.4m的正十二烷基多硫醇锂溶于1,3-二氧戊环的溶液。然后用四乙二醇二甲醚将该溶液稀释至0.2m,然后将其以1:1=v/v加入到1m的litfsi溶于1:1的四乙二醇二甲醚:1,3-二氧戊环的溶液中。向所得的溶液加入硫化锂,直至获得一种饱和混合物。然后将混合物过滤并且用icp-ms(agilent7700xicp-ms)分析滤液的溶解锂。硫化锂的溶解度基于锂的水平进行计算。在0.5m的litfsi和0.1m的正十二烷基多硫醇锂溶于1:1的四乙二醇二甲醚:1,3-二氧戊环的溶液中,测定硫化锂的溶解度为0.33wt%。比较而言,如果没有正十二烷基多硫醇锂,硫化锂在0.5m的litfsi中的溶解度仅为0.13wt%。这清楚地表明了当本发明的有机硫存在时,改进了li2s在电池的电解质基质中的溶解度。
- 还没有人留言评论。精彩留言会获得点赞!