一种检测缺氧对果蝇的影响的检测装置和方法与流程
本发明总体上涉及生命科学领域,具体涉及用于检测缺氧对果蝇的影响的检测装置和方法。本发明还公开了该装置的用途。
基金支持
中国国家重点基础研究计划(2013cb530900)和国家自然科学基金(81371400;81571101;和81071026)。
背景技术:
氧气对维持生命至关重要,而缺氧会对机体和组织造成不良后果。由于大脑对能量需求高,其相比其他器官对缺氧更加敏感。当脑部血流量减少时,大脑可能会产生中风,导致细胞和组织的死亡(moskowitz,m.a.,lo,e.h.&iadecola,c.heartdiseaseandstrokestatistics--2011update:areportfromtheamericanheartassociation.neuron67,181-198(2010).)。在60岁以上的人群中,中风是第二大致死原因(feigin,v.l.etal.globalandregionalburdenofstrokeduring1990–2010:findingsfromtheglobalburdenofdiseasestudy2010.thelancet383,245-255(2014).)。预计每三到四分钟就会有人因中风而死亡,或因中风而患严重残疾或其他神经系统疾病。这导致在世界范围内为中风患者提供了护理和治疗的巨大经济负担,因此,中风的预防和治疗不仅是一个医疗问题,也是一个社会问题(johnston,s.c.,mendis,s.&mathers,c.d.globalvariationinstrokeburdenandmortality:estimatesfrommonitoring,surveillance,andmodelling.thelancet.neurology8,345-354(2009).)。
缺氧损伤可以由局部缺血造成缺氧和缺乏营养的组织血液供应减少而引起。缺血可通过激活细胞死亡而引起严重的组织损伤。然而,缺血后再灌注(恢复供血)会导致所谓的缺血/再灌注损伤中引起更多的损伤。长时间的缺氧后重复再灌注可能会损害线粒体活动和呼吸链,可引起氧化应激增加以及后续的损伤或炎症(lighton,j.r.&schilman,p.e.oxygenreperfusiondamageinaninsect.plosone2,e1267(2007);idris,a.h.etal.oxidantinjuryoccursrapidlyaftercardiacarrest,cardiopulmonaryresuscitation,andreperfusion.criticalcaremedicine33,2043-2048(2005);hermes-lima,m.&zenteno-savin,t.animalresponsetodrasticchangesinoxygenavailabilityandphysiologicaloxidativestress.comparativebiochemistryandphysiology.toxicology&pharmacology:cbp133,537-556(2002);datta,g.,fuller,b.j.&davidson,b.r.molecularmechanismsofliverischemiareperfusioninjury:insightsfromtransgenicknockoutmodels.worldjournalofgastroenterology19,1683-1698(2013).)。
在过去几十年中已经提出了一些关于缺血诱发损伤的假说,主要的假说是能量缺乏导致谷氨酸的大量释放,离子平衡的破坏和氧化应激(moskowitz,m.a.,lo,e.h.&iadecola,c.heartdiseaseandstrokestatistics--2011update:areportfromtheamericanheartassociation.neuron67,181-198(2010).)。针对这些假说涉及的过程或分子,已经开发了超过1000种潜在的中风药物或干预措施,对其中一部分进行了大约160次临床试验,但没有一项在临床中取得成功(ginsberg,m.d.currentstatusofneuroprotectionforcerebralischemia:synopticoverview.stroke40,s111-114(2009).)。改变这种状况的一个方法是通过遗传或化学筛选发现新的调节生物体的缺氧损伤易感性或对缺氧耐受能力的分子或信号通路。
果蝇寿命短,可以在消耗低资源的情况下繁殖出大量的后代。果蝇基因组包含大约14,000个基因,许多基因在哺乳动物中是保守的,约75%的已知人类疾病的基因在果蝇可找到同源基因。此外,果蝇研究界积累了各种突变体、转基因品系和基因编辑工具/技术。因此,果蝇经常用于模拟人类疾病,特别是神经疾病(bilen,j.&bonini,n.m.drosophilaasamodelforhumanneurodegenerativedisease.annualreviewofgenetics39,153-171(2005);lloyd,t.e.&taylor,j.p.flightlessflies:drosophilamodelsofneuromusculardisease.annnyacadsci1184,e1-20(2010).),这些可以进一步用于遗传和化学筛选,以鉴别介导/调节缺氧诱导的损伤和潜在药物的新分子。
与哺乳动物相比,果蝇具有非常强的耐受长时间缺氧的能力。经过长时间缺氧的果蝇放置在室温空气中可以恢复并再次活跃(hermes-lima,m.&zenteno-savin,t.animalresponsetodrasticchangesinoxygenavailabilityandphysiologicaloxidativestress.comparativebiochemistryandphysiology.toxicology&pharmacology:cbp133,537-556(2002).)。然而,缺氧/再氧化(a/r)应激会在果蝇中产生损伤,因为一部分果蝇在缺氧数小时后的随后几天死亡(vigne,p.,tauc,m.&frelin,c.strongdietaryrestrictionsprotectdrosophilaagainstanoxia/reoxygenationinjuries.plosone4,e5422(2009);caraballo,j.c.etal.roleofponinanoxia-reoxygenationinjury:adrosophilamelanogastertransgenicmodel.plosone9,e84434(2014).)。这与上述优点一起,使得果蝇有助于研究体内对缺氧的易感性和耐受性的分子机制,并通过遗传和化学筛选鉴定潜在的靶向药物和治疗氧缺乏诱导的损伤的药物(bartholomew,n.r.,burdett,j.m.,vandenbrooks,j.m.,quinlan,m.c.&call,g.b.impairedclimbingandflightbehaviourindrosophilamelanogasterfollowingcarbondioxideanaesthesia.scientificreports5,15298(2015);haddad,g.g.tolerancetolowo2:lessonsfrominvertebrategeneticmodels.experimentalphysiology91,277-282(2006);zhou,d.,visk,d.w.&haddad,g.g.drosophila,agoldenbug,forthedissectionofthegeneticbasisoftoleranceandsusceptibilitytohypoxia.pediatricresearch66,239-247(2009).)。为了帮助这些研究,我们开发了一种完全剥夺果蝇氧气的精密装置,以及非常可靠的测定方法,用于定量检查经历缺氧的果蝇的死亡率和运动能力的恢复。
技术实现要素:
在本发明的一个方面,提供了一种缺氧装置,其特征在于,所述缺氧装置包括以下设备:
a.气体流量指示器;
b.水箱;
c.缺氧室;
其中以上设备之间采用管道连接,且气体依次通过以上设备;缺氧室中设置有倒置的塑料管。
在本发明的一个实施例中,所述缺氧室是一个双层平台,包括:网状网、带孔的塑料板、倒置漏斗;其中所述带孔的塑料板位于网状网的上方,所述倒置漏斗位于双层平台的中心且其大开口位于网状网的下方,其小开口通过蛇形管连接入所述缺氧装置的气体管道中。
在本发明的一个具体实施例中,所述蛇形管的直径为1.0厘米以下。
在本发明的一个实施例中,所述缺氧室还包括带有中心孔的盖子,连接倒置漏斗小开口的蛇形管穿过所述中心孔,且中心孔直径大于所述连接倒置漏斗小开口的蛇形管的直径。
在本发明的一个实施例中,连接缺氧室盖子和水箱之间的蛇形管外层,套有更大直径的蛇形管且与缺氧室盖子上的中心孔紧密连接。
在本发明的一个具体实施例中,所述更大直径的蛇形管的直径为2.0厘米以上。
在本发明的一个实施例中,所述倒置塑料管为ep管,优选1.5mlep管。
在本发明的一个具体实施例中,所述倒置塑料管的开口用纱布覆盖。
在本发明的一个实施例中,所述气体选自氮气。
在本发明中,所述装置可用于检测缺氧对果蝇的影响。
在本发明中,所述装置可用于筛选缺氧损伤相关基因或揭示缺氧相关疾病组织损伤的机制。
在本发明的一个实施例中,所述缺氧相关疾病包括高血压、糖尿病、心脏病、中风、癌症,优选为缺血性卒中。
在本发明的另一方面,提供了一种检测缺氧对果蝇影响的方法,其特征在于,使用如权利要求1至9任一项所述的装置。
在本发明的一个实施例中,给予果蝇缺氧的时间优选2.5-3小时,缺氧处理后第4-6小时进行攀爬能力测定。
附图说明
图1示出缺氧装置的示意图和实际图。(a)缺氧装置的示意图(顶部)和实际图像(底部)。氮气流动方向由绿色箭头标记。来自密封的缺氧室的额外气体排放通过黑色管道进入开放水箱(红色箭头和点)。(bi)将果蝇放入1.5mlep管中,盖子被取出,并用纱布代替。(bii)ep管被倒置在2层平台的孔中。
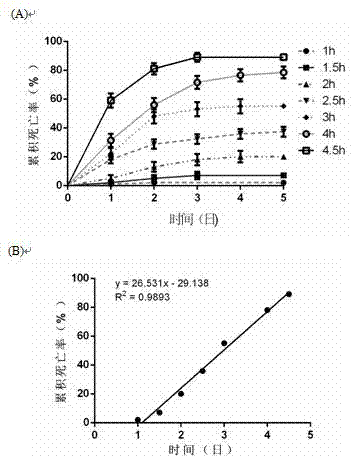
图2示出缺氧期长度对a/r引起死亡率的影响。(a)经历不同缺氧期的果蝇在后第-至第五天的累积死亡率百分比的曲线图。对于每个数据点,n=5。(b)缺氧后第5天累积死亡率百分比相对于缺氧期(小时,h)的图和直线拟合。显示最佳拟合方程的线,r2和p值。数据以平均值±sem表示,统计学分析采用单因素方差分析,tukey多重比较t检验,*p<0.05。羽化后5天评估果蝇。
图3示出使用爬管能力测定法检测在缺氧/再氧化后果蝇运动能力的恢复。(a)缺氧后果蝇运动能力与恢复时间(再氧化时间的关系),通过分析每只果蝇的爬升高度(cm)来评估果蝇的运动能力。(b)为了进一步扩展研究,经历不同缺氧时期(h)后再氧化5小时后,通过攀爬高度(cm)评估果蝇的运动能力。数据以平均值±sem表示,统计学分析采用单因素方差分析,tukey多重比较t检验,*p<0.05。羽化后5天评估果蝇,每组n=20只果蝇。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
在本发明中,这种检测方法优于其他传统的缺氧筛选装置,因为它易于使用,适用于大规模研究和产生可重复的结果。缺氧装置可以快速,有效和低成本地使用。该装置将有助于提供新的见解,以了解在暴露于受损氧供应(如缺血性卒中)后组织损伤的机制。
如本文所用,“缺血性卒中”是指缺血性脑卒中是指由于脑的供血动脉(颈动脉和椎动脉)狭窄或闭塞、脑供血不足导致的脑组织坏死的总称。有四种类型的脑缺血:短暂性脑缺血发作(tia);可逆性神经功能障碍(rind);进展性卒中(sie);完全性卒中(cs)。tia无脑梗死存在,而rind、sie和cs有不同程度的脑梗死存在。
实施例
通过以下实施例进一步说明本发明。提供实施例仅用于说明目的,并且不应被解释为以任何方式限制本发明的范围或内容。
实施例1:果蝇家族和培养
将黑腹果蝇的基因野生型(wt)w1118果蝇保持在相对湿度为50-70%的标准玉米面-琼脂-红糖-酵母培养基中,在25℃下和12/12小时的昼夜循环下培养。培养基配方为:ddh2o0.65l/l、面包酵母16g/l、玉米粉80g/l、琼脂6.5g/l、红糖137.5g/l、啤酒酵母7.5g/l、对羟基苯甲酸甲酯2g/l,乙醇20ml/l,ddh2o100ml/l,丙酸6.25ml/l,防止霉菌生长。雄性和雌性果蝇在解剖显微镜下进行鉴定。在研究的时候,选择在蛹化后4-6天之间的成年果蝇。
实施例2:缺氧装置
缺氧装置的设计和实际图像如图1所示,缺氧装置由缺氧室(直径12cm,高14cm的筒状透明密闭容器)、水箱、气体流量指示器和管道组成。在缺氧室中有一个双层圆形平台,底层是一个网状网,上层是一个带有孔的塑料板。在每个孔中,1.5mlep管可以坐下并容纳10-20只果蝇。将ep管的盖子取出,用纱布覆盖并倒置在平台上。一个塑料漏斗安装在平台的中心,漏斗的头端连接到一个小的蛇形管(直径为1.0cm),纯氮气(n2)通过该漏斗流向缺氧室的中心底部,氧气(o2比n2重)在ep管中流动,并且在缺氧室中可以通过另一个更大的蛇形管(直径为2.0厘米),通过盖的中心的孔完全排出,其紧紧地附着在那个洞口。n2输送蛇形管放置在较大的管道中,两条管道都进入水箱,这样可以使来自缺氧室的气体排出,但阻挡进入室内的空气。载有n2的蛇形管从水箱中出来,与气体流量指示器连接,并进一步连接到含有压缩纯n2气的n2气瓶中。硅胶和石蜡膜被用于防止连接处的气体泄漏。在每个连接处的气密性在水下测试。
实施例3:缺氧试验
在二氧化碳(1-2分钟)下快速收集5天龄的果蝇,并在缺氧处理前18-24小时用标准培养基在小瓶中回收,以尽量减少二氧化碳麻醉的混杂影响。每个小瓶包含相同数量的雌雄和雄蝇(总数为10或20)。恢复后,将一个小瓶中的所有果蝇用漏斗小心地转移到1.5mlep管中,用纱布和橡皮筋快速覆盖ep管,以避免逃逸。然后,将含有飞沫的ep管转移到缺氧室中的平台中,并将纯n2以5l/分钟的恒定流速引入到缺氧室中。记录时间。每只小瓶中的果蝇仅经历一次至缺氧期。将所有测定物保持在相同的室中,并在25℃、50-70%湿度下暴露于相同水平的光和噪声中。
所有数据集均表示为平均值±sem。使用单因素方差分析进行统计学分析,p<0.05被认为具有统计学意义。软件graphpadprism用于统计分析。所有实验至少运行一式三份。
使用该系统,通过检测缺氧时间长短对累计死亡率和爬管能力恢复的影响来检测年轻w1118果蝇野生型(wt)中的a/r诱导的损伤。在n2以每分钟5l的速度流入的缺氧室中,所有果蝇在3分钟内因缺氧昏迷从ep管壁上倒下至纱布,此后保持静止。经过指定的缺氧时间后,终止n2流入缺氧室,并从缺氧室中取出果蝇,在室温空气中,所有果蝇在缺氧后再供氧化后恢复活跃。恢复时间的长短取决于缺氧时间的长短。缺氧时间越长,需要恢复的时间越长(数据未显示)。然而,当缺氧时间≥6小时时,绝大多数果蝇没有恢复。相比之下,当缺氧时间小于1小时时,所有果蝇恢复,并且在随后的5天内未死亡(数据未显示)。
实施例4:死亡率分析
暴露于1.0、1.5、2、2.5、3、4和4.5小时的缺氧期后,将每个ep管中的果蝇被转移回标准果蝇食物培养小瓶中。在随后的5天内每天对每个小瓶中的死蝇进行计数,并计算每个小瓶的累积死亡率百分比。为了避免果蝇被培养基捕获,培养瓶在缺氧后的第一天水平放置。
本研究定量研究了7个缺氧期,1、1.5、2、2.5、3、4和4.5小时对果蝇死亡率的影响。蛹化后的野生型5日龄果蝇被分为7组,每组都面临7个缺氧期中的一期。对于每组,将100只野生果蝇分为5个亚组,每组有10只雄性和10只雌性。如图2a所示,在暴露于缺氧≥1.5小时后的5天内,部分果蝇每天在死亡,累积死亡率在前3天随时间增加而上升,第四天达到峰值。缺氧时间越长,累积死亡率越高。对缺氧时间-第五天的累积死亡率的数据点进行直线拟合,方程显示累积死亡率与缺氧时间呈线性正相关。相关系数r2为0.9893,显著性高(p<0.0001,图2b)。值得注意的是,当缺氧时间为2.5-3小时时,第五天的累积死亡率约为50%。
实施例5:爬管能力测定
暴露于适当的缺氧期后,将果蝇转移回其培养瓶中,并使其在常氧条件下恢复5小时或其它指示时间,然后进行如前所述的自动化ring(aring)测定。简单来说,将同一组的10只果蝇转移到一个测试小管中,该小管是内径为2.0厘米,高度为20.0厘米的透明塑料圆筒。测试管垂直安装在aring装置上,该装置通过步进控制马达的驱动下自动上下震动4次将所有果蝇震倒到测试管的底部,随后果蝇沿测试管壁爬升。将此录像。将视频转移到计算机,并在攀爬开始后第5秒进行快照,并使用自制软件rflydetection进行分析测量第5秒的每只飞行的爬升高度。
使用aring测定,还研究了缺氧后在空气中再氧化时间对果蝇运动能力恢复的影响。将50只雄性和50只雌性5日龄雌性等分为10组,在缺氧装置中进行2.5小时缺氧,然后转移回含有标准培养基和空气的培养管再氧化恢复。在再氧化后的第3、4、5、6、7小时,随机测量10组中的2组,并用aring进行爬坡测定,并测量爬升起始后第5秒的每只果蝇的爬升高度。计算了20只果蝇的平均爬升高度。如图3a所示,再氧化越长,迁移率恢复越好,但在再氧化后的第4-6小时内,攀爬高度保持稳定。
我们进一步研究了0、1.5、2、2.5和3小时不同缺氧时间对在空气中再氧化后的第5小时爬管能力的影响。50只雄性和50只雌性5日龄果蝇等分为10组,10组中的2只经受0、1.5、2、2.5或3小时缺氧,然后转移回含有标准培养基和空气的培养管再氧化恢复,5小时后,通过使用aring检测法检测每只果蝇的爬坡能力。如图3b所示,缺氧时间越长攀爬能力越差,显示运动能力恢复越慢。结果显示缺氧暴露与运动功能(1.5小时为5.19cm,2小时为3.35cm,2.5小时为1.54cm,3小时为0.85cm,而不暴露于缺氧为8.24cm)为负剂量依赖关系。
讨论
缺氧损伤涉及一个尚未完全了解的复杂而动态的过程。为了进一步了解参与缺氧损伤的已知途径,需要进一步研究确定参与缺氧和a/r诱导的损伤的新分子靶标。果蝇是一种强大的模型,用于各种遗传筛选,用于鉴定涉及不同表型的新基因(queliconi,b.b.,kowaltowski,a.j.&nehrke,k.ananoxia-starvationmodelforischemia/reperfusioninc.elegans.journalofvisualizedexperiments:jove(2014).)。本发明测定方法和装置提供了一种有效和可靠的方法来筛选参与缺氧诱导的损伤的基因,筛选可以减少缺氧诱导损伤的药物化合物。
在本发明中,蛹化后5天龄的w1118,经过1小时的缺氧处理是致命的,缺氧后第5天的死亡率与缺氧期的时间长度呈线性正相关,达到约40-60%缺氧时间为2.5-3小时。因此,本发明证实,2.5-3.0小时的缺氧持续时间可以是量化遗传操作或化学应用对死亡率的正面或负面影响的适当时间长度。另外,2.5小时缺氧处理后,迁移恢复缓慢,第4-6个小时的爬升高度基本保持不变。因此,我们建议在未来的缺氧测定的移动性分析之前,用2.5-3小时的缺氧处理和4-6小时的恢复。
传统的缺氧装置包括含有单个或多个果蝇的塑料管进行测试,并且可以在缺氧试验期间使用特别设计的腔室监测氧气水平和温度(zhou,d.,visk,d.w.&haddad,g.g.drosophila,agoldenbug,forthedissectionofthegeneticbasisoftoleranceandsusceptibilitytohypoxia.pediatricresearch66,239-247,(2009))。因此,我们开发了一种简单的缺氧试验,用于研究飞行中的氧缺乏,这种效率更高效,可以同时量化许多不同基因型的果蝇的性能。该装置可以有助于克服使用当前的缺氧试验中已知的许多限制,并将有助于进一步了解缺氧性卒中等缺氧疾病的潜在机制。
通过引用并入
本文引用的每个专利文献和科学文献的全部公开内容通过引用并入本文用于所有目的。
等效
本发明可以在不脱离其基本特征的情况下以其他具体形式实施。因此,前述实施例被认为是说明性的,而不是对本文所述的本发明的限制。本发明的范围由所附权利要求书而不是由前述说明书表示,并且意在将落入权利要求书的等同物的含义和范围内的所有改变包括在其中。
- 还没有人留言评论。精彩留言会获得点赞!