用于在反刍动物中进行能量分配的菌株和方法与流程
相关申请的交叉引用
本申请是2009年12月2日提交的美国专利申请号12/629,497的部分继续申请,该申请根据35u.s.c.§119(e)要求2008年12月2日提交的美国临时专利申请号61/119,256的优先权;其各自的全部内容通过引用并入本文。
参考书目
本文由第一作者的姓氏和出版年份引用的参考文献的完整的书目引文可以在紧邻权利要求之前的参考书目部分中找到。
发明领域
本发明涉及用于控制酸中毒的菌株和方法。更具体地,本发明涉及可用于改进反刍动物健康和/或性能的细菌菌株以及制备和使用这些菌株的方法。
发明背景
过去50年来,向反刍动物喂养高浓度可发酵碳水化合物已成为牛肉和乳牛行业的常见做法。改进肉类生产效率和质量的需要已经导致了这种趋势。生产的改进在没有遇到某些困难的情况下没有发生。通过喂养较高水平的谷物来增加可发酵碳水化合物的反刍动物消耗导致代谢性疾病如酸中毒的发生率增加。高浓缩物消耗与瘤胃酸中毒之间的关系在评论中得到了充分记载(dunlop,1972;slyter,1976)。许多研究人员显示出在将高水平的容易发酵的碳水化合物(rfc)喂养到牛中后,瘤胃ph值下降,并且随后破坏瘤胃微生物群和在动物中发生的生理变化(allison,等人,1975,hungate等人,1952;elam,1976)。大多数人将这种下降归因于瘤胃细菌如牛链球菌过量生产有机酸。然而,过量碳水化合物对引起该应答的瘤胃微生物群的影响尚未得到充分记载。
在过去,喂养密集管理一直是打击酸中毒的唯一手段。更具体地说,谷物用粗饲料稀释,并且膳食浓缩物百分比的增加是以逐步方法仔细控制的,以确保在14-21天的时间内顺利过渡到高水平的浓缩物。大多数商业饲养场配置并递送包含不同比例的粮食与草料的若干种“适应”饮食。
虽然强化喂养管理通常在控制酸中毒方面相当有效,但由于生产、运输、切割草料、处理增加的动物废物的成本高,以及较低的生产效率,其对生产者是非常昂贵的。生产者和饲养场管理者需要实施将允许有效地生产高浓缩日粮喂养的家畜的策略。
其他策略是将适应饮食的使用与喂养抗微生物组分(如离子载体)相结合。离子载体抑制摄入并且通过减少革兰氏阳性、产乳酸生物体如牛链球菌和乳杆菌属的瘤胃种群来减少瘤胃中乳酸的产生(muir等人1981)。
虽然离子载体的使用降低了饲养场中急性酸中毒的发生率,但消费者关心肉类生产中抗生素的使用,并且饲养场管理者对不断寻找降低成本同时改进动物性能的方法的存在需求,并且屠体组成导致了减少酸中毒和改进饲养场牛性能的替代方法的检查。
使用直接喂养微生物作为调节瘤胃功能和改进牛性能的方法在过去10年中已经得到越来越多的接受。存在目前可供牛肉行业用于控制瘤胃酸中毒的两种基本的直接喂养微生物技术:(1)使用产乳酸的dfm技术和(2)添加能够利用瘤胃乳酸的特异性细菌物种。虽然所报道的这些技术中每种的作用方式不同,但它们都试图解决瘤胃乳酸积累的问题。
第一种方法,即,使用产乳酸的dfm技术,尝试通过刺激天然的瘤胃微生物群来增加瘤胃乳酸的利用率。据报道,添加相对缓慢生长的产乳酸细菌,如肠球菌属物种,产生了稍微升高浓度的瘤胃乳酸。逐渐增加迫使瘤胃微生物群落适应较高部分的耐酸乳酸利用者。然而,这些肠球菌菌株未能充分控制和预防酸中毒。
第二种方法,即,添加能够利用瘤胃乳酸的特异性细菌物种,是基于如下发现:丙酸杆菌属的物种在大量易发酵碳水化合物(rfc)的酸中毒激发期间显著地最小化了瘤胃乳酸的积累。丙酸杆菌属在乳制品和肉用牛中是瘤胃的天然居住者,并且通过使用乳酸生产重要的挥发性脂肪酸如乙酸和丙酸以在瘤胃中起作用。
迄今为止开发的目前的dfm技术是基于对瘤胃酸中毒发生率的陈旧的微生物学理解而开发的。直到最近,研究瘤胃微生物生态学的方法都依赖于培养技术。由于未知的生长要求和许多瘤胃微生物的不合适的厌氧条件,这些技术受到了限制。因此,依靠这些培养技术的生态学研究是基于对瘤胃微生物群的有限了解。
当单独使用或与酵母一起使用以最小化瘤胃酸中毒的风险并改进包含高浓缩物的饲养场牛饮食的利用时,目前的dfm提供了混合的结果。然而,对单独喂养或与酵母、酿酒酵母组合喂养的dfm菌株丙酸杆菌p15、以及屎肠球菌ef212和屎肠球菌ef212的研究表明,添加与或不与酵母结合的dfm对预防瘤胃酸中毒没有影响(yang,w.,2004)。
鉴于上述,期望提供一种或多种菌株以预防和/或治疗酸中毒。如果一种或多种菌株还改进反刍动物健康和/或性能的其他度量将是有利的。还需要提供制备和使用菌株的方法。
概述
由在本披露的最后提出的权利要求限定的本发明旨在解决上述问题中的至少一些。提供了分离的菌株,这些分离的菌株包括屎肠球菌菌株8g-1(nrrlb-50173)、具有屎肠球菌菌株8g-1(nrrlb-50173)的所有鉴别特征的菌株、屎肠球菌菌株8g-73(nrrlb-50172)、具有屎肠球菌菌株8g-73(nrrlb-50172)的所有鉴别特征的菌株、短小芽孢杆菌菌株8g-134(nrrlb-50174)、具有短小芽孢杆菌菌株8g-134(nrrlb-50174)的所有鉴别特征的菌株、及其组合。
另外提供了包括上述一种或多种菌株和莫能菌素的组合。
还提供了向动物施用有效量的一种或多种上述菌株的方法,以及向动物施用包括有效量的一种或多种上述菌株的组合的方法。
在至少一些实施例中,当与未施用该菌株的动物相比时,向动物施用一种或多种菌株以在动物中或向动物提供至少一种以下益处:(a)减少酸中毒,(b)使瘤胃新陈代谢稳定,如通过延迟的乳酸积累和延长的挥发性脂肪酸的产生所指示的,(c)从酸中毒激发更快地恢复,如通过ph恢复和乳酸下降所测量的;(d)减少与酸中毒相关的临床病征的展示,(e)增加泌乳乳牛的奶产量,(f)增加泌乳乳牛乳的奶脂肪含量,(g)降低泌乳乳牛的体细胞计数(scc),(h)改进免疫学应答和健康,如减少的scc所证明的和(i)增加泌乳乳牛中奶生产的效率。
在一个实施例中,菌株、组合物、和方法可以与任何动物一起使用,这些动物包括但不限于产后动物、围产期动物、牛类动物、牛、公牛、肉牛、小母牛、牛犊、母牛、乳牛、产后乳牛、围产期乳牛、羊类动物、绵羊、美洲驼、羊驼、公山羊、山羊、反刍动物、猪类动物、猪、生猪、阉猪、禽类物种、火鸡、家禽、鸡、和母鸡。
还提供了制备直接喂养微生物的方法。在该方法中,将选自下组的菌株在液体营养液中生长,该组由以下各项组成:屎肠球菌菌株8g-1(nrrlb-50173)、屎肠球菌菌株8g-73(nrrlb-50172)、和短小芽孢杆菌菌株8g-134(nrrlb-50174)。将菌株与液体营养肉汤分离,以制备直接喂养微生物。在该方法的至少一些实施例中,将菌株冷冻干燥。
另外,提供了制备直接喂养微生物的方法。在该方法中,将选自下组的菌株在液体营养液中生长,该组由以下各项组成:屎肠球菌菌株8g-1(nrrlb-50173)、屎肠球菌菌株8g-73(nrrlb-50172)、和短小芽孢杆菌菌株8g-134(nrrlb-50174)。将菌株与液体营养肉汤分离,以制备直接喂养微生物。将莫能菌素添加到直接喂养微生物中。
在一个实施例中,本披露涉及一种用于减少动物中负能量平衡的方法,该方法包括:(a)鉴别处于负能量平衡风险中的动物;并且(b)向步骤(a)中鉴别的动物施用有效量的短小芽孢杆菌菌株8g-134(nrrlb-50174)或具有短小芽孢杆菌菌株8g-134(nrrlb-50174)的全部鉴别特征的菌株,以减少负能量平衡。
在又另一个实施例中,本披露涉及一种用于降低动物中疾病的发生率的方法,该方法包括:(a)向该动物施用有效量的短小芽孢杆菌菌株8g-134(nrrlb-50174)或具有短小芽孢杆菌菌株8g-134(nrrlb-50174)的所有鉴别特征的菌株,以降低疾病的发生率,其中该疾病选自下组,该组由以下各项组成:酮症、皱胃移位、胎盘滞留、乳腺炎、子宫炎、和子宫积脓。
在仍又另一个实施例中,本披露涉及一种用于减少动物中炎症的方法,该方法包括:(a)鉴别处于炎症风险中的或显示出炎症病征的动物;并且(b)向步骤(a)中鉴别的动物施用有效量的短小芽孢杆菌菌株8g-134(nrrlb-50174)或具有短小芽孢杆菌菌株8g-134(nrrlb-50174)的全部鉴别特征的菌株,以减少炎症。
本文披露的菌株、组合物和方法的一个优点是向动物施用短小芽孢杆菌8g-134改进能量平衡。
本文披露的菌株、组合物和方法的一个优点是向动物施用短小芽孢杆菌8g-134减少负能量平衡。
本文披露的菌株、组合物和方法的一个优点是喂养短小芽孢杆菌8g-134降低了动物中非酯化脂肪酸(nefa)的水平,同时保持高奶产量。
本文披露的菌株、组合物和方法的一个优点是喂养短小芽孢杆菌8g-134促进动物中免疫细胞群体的变化。
本文披露的菌株、组合物和方法的一个优点是喂养短小芽孢杆菌8g-134改进了动物的免疫应答。
本文披露的菌株、组合物和方法的一个优点是喂养短小芽孢杆菌8g-134影响了在奶和身体组织之间分配的能量,促进适当平衡的体况,这可以在随后泌乳中促进健康和能育性。
附图简要说明
在附图中示出了本文描述的优选示例性实施例,其中全文中相同的参考号表示相同的部分,并且其中:
图1是示出了测试者(非酸性;簇2)和驱动者(酸性;簇1)群体之间的ph差异的图。
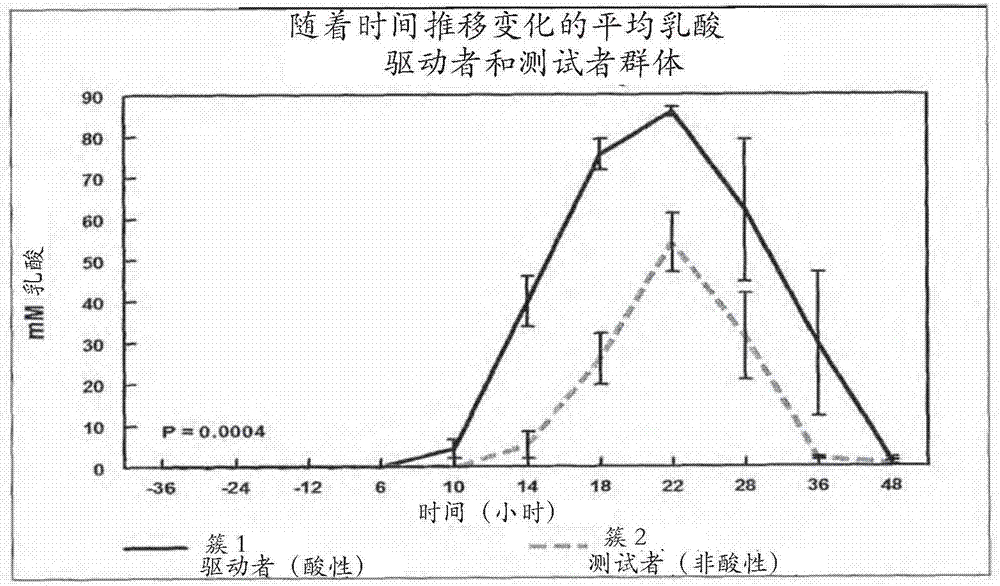
图2是示出了测试者(非酸性;簇2)和驱动者(酸性;簇1)群体之间的乳酸积累差异的图。
图3是示出了随着时间推移,治疗产生的体外葡萄糖的图。
图4是示出了随着时间推移,治疗产生的体外乳酸积累的图。
图5是示出了随着时间推移,总vfa(乙酸+丙酸+丁酸)积累的图。
图6是示出了在对照和候选dfm牛中随着时间推移变化的平均瘤胃ph。
图7是示出了在对照和候选dfm牛中随着时间推移变化的平均瘤胃乳酸。
图8是示出了随时间推移,治疗的瘤胃vfa浓度的图。(总vfa=乙酸+丙酸+丁酸)。
图9是描绘了乳牛的血液中产后nefa水平的条形图。水平是第7、14、21和28天产后测量值的平均值。dfm治疗以5x109cfu/母牛/天施用短小芽孢杆菌8g-134。dfm治疗(p=0.05)和天数(p<0.0001)的影响是显著的。
图10是描绘了喂养了5x109cfu/母牛/天的短小芽孢杆菌8g-134或对照(无dfm)的多产乳牛的约60产奶天数的t细胞表面标志物的平均荧光强度的条形图。具有不同上标的组内平均值不同p≤0.05。
图11是描绘了喂养了5x109cfu/母牛/天的短小芽孢杆菌8g-134或对照(无dfm)的多产乳牛的约60产奶天数的t细胞表面标志物的平均荧光强度的条形图。具有不同上标的组内平均值不同p≤0.05。
图12是描绘了在12周泌乳期内由产奶天数(dim)分类的多产母牛中的奶脂肪百分比的条形图。产奶天数(dim)类别是协变量(<100dim(62对照母牛,75trt母牛),101-200dim(77对照母牛,58trt母牛)和>201dim(6对照母牛,16trt母牛)。在用dfm治疗的早期和晚期泌乳组中观察到脂肪%的数值下降。
图13a-d是描绘了膳食淀粉和短小芽孢杆菌浓度之间关系对产后血清代谢物的线图。(13a)葡萄糖:s1(p=0.56);bp2(p=0.49);s*bp3(p=0.66);s*b*w4(p=0.97);sem=2.37;(13b)nefa:s1(p=0.29):bp2(p=0.05);s*bp3(p=0.33);s*b*w4(p=0.33);sem=68.8;(13c)bhba:s1(p=0.92);bp2(p=0.07);s*bp3(p=0.41);s*b*w4(p=0.50);sem=2.57。(13d)触珠蛋白:s1(p=0.22);bp2(p=0.66);s*bp3(p=0.09);s*b*w4(p=0.46)。相互作用:1淀粉;2短小芽孢杆菌;3淀粉和短小芽孢杆菌;4淀粉、短小芽孢杆菌和周数。
在详细解释本文所述的实施例之前,应理解本发明就其应用而言并不局限于在以下描述中阐述的或在附图中示出的构建的细节和组分的布置。本发明能够具有其他实施例或能够以不同方式实践或进行。还应理解,在此采用的措辞和术语是出于说明的目的并且不应被视为限制性的。
发明详细说明
除非另有定义,否则本文使用的所有技术和科学术语都具有本披露所属技术领域的普通技术人员通常理解的相同含义。辛格尔顿(singleton)等人,微生物学和分子生物学词典(dictionaryofmicrobiologyandmolecularbiology),第20版,约翰威利父子公司(johnwileyandsons),纽约(1994);以及黑尔(hale)和迈尔哈姆(marham),哈珀柯林斯生物学词典(theharpercollinsdictionaryofbiology),哈珀永久出版社(harperperennial),纽约州(1991)为技术人员提供了本披露中所使用的许多术语的通用词典。
本披露并不受本文披露的示例性方法和材料的限制,并且与本文所述的那些方法和材料相似或等同的任何方法和材料都可以用于本披露的实施例的实践或测试。数值范围包括限定范围的数值在内。
本文提供的标题并不是对本披露的各个方面或实施例的限制,这些方面或实施例可以通过将本说明书作为一个整体来参考而得到。因此,把说明书作为一个整体参考时,以下立即定义的术语得以更全面地定义。
应注意,除非上下文另外清楚地指明,否则如本说明书及所附权利要求书中所用,单数形式“一个(a)”、“一种(an)”、和“该(the)”包括复数指示物。
本披露中的数值范围是近似值,并且因此可以包括范围之外的值,除非另外指明。数值范围包括来自并包括下限值和上限值的所有值,这些值以一个单位递增,条件是在任何较低值和任何较高值之间存在至少两个单位的间隔。作为一个实例,如果组成、物理或其他特性(例如像分子量、粘度等)为从100至1,000,旨在清楚地列举所有单独的值,如100、101、102等,以及子范围,如100至144、155至170、197至200等。对于包含小于1的值或包含大于1的分数(例如1.1、1.5等)的范围,在适当时,一个单位被认为是0.0001、0.001、0.01或0.1。对于包含小于10的单个数字的范围(例如1至5),一个单位典型地被认为是0.1。这些只是具体意指的实例,并且在所列举的最低值与最高值之间的数值的所有可能的组合将被认为明确地陈述在本披露中。除其他事项之外,在本披露中提供了混合物中组分相对量的数值范围、以及方法中所述的各种温度和其他参数范围。
如本文所用,“cd”(簇分化)是指可用于鉴别和表征白细胞的细胞表面标志物的分子。cd命名是通过hlda(人类白细胞分化抗原)研讨会开发和维护的。
“施用”意指将至少一种菌株和/或上清液从本文所述的至少一种菌株的培养物引入到动物胃肠道中的动作。更具体地说,该施用是通过口服途径的施用。这种施用可以具体地通过用至少一种菌株补充旨在用于动物的饲料来进行,如此补充的饲料随后被动物摄取。也可以使用胃管或使得可以将至少一种菌株直接引入动物的胃肠道中的任何其他方法来进行该施用。
如本文所用,术语“有效量”是指将引发应答的菌株、菌株组合或组合物的量,该应答包括但不限于正在寻找的组织、系统或动物的生物或医学应答。在一个实施例中,术语“有效量”包括当施用时足以预防正接受治疗的病症或障碍的症状中的一种或多种的发展或者在一定程度上使其缓解的菌株、菌株组合或组合物的量。有效量可以根据菌株、菌株组合或组合物、障碍或病状及其严重程度而变化。
如本文所用,短语“改进繁殖性能”是指增强有利于繁殖的性状和/或减少阻碍繁殖的性状、病症、和/或疾病。改进繁殖性能包括但不限于减少子宫炎、胎盘滞留、乳腺炎、和产后疾病。改进繁殖性能还包括减少繁殖周期时间。
如本文所用,“负能量平衡”是在乳牛中频繁发生的病症。它由饮食能量供应与生产要求之间的不平衡组成。通常在负能量平衡状态期间,以体况评分为代价,高奶产量可以到来,因为脂肪和肌肉被动员起来支持生产。体况的丧失与可能影响能育性的改变的血液代谢物和激素分布有关。
如本文所用,“性能”是指通过一个或多个以下参数所测量的动物,如猪或畜禽的生长:平均日增重(adg)、体重、家畜腹泻病、死亡率、饲料转化率,其包括(饲料:增重和增重:饲料两者)、和饲料摄入量。如本文所用的“性能的改进”或“改进的性能”是指在性能定义下列出的至少一个参数的改进。
如本文所用,“预防(prevent、preventing、prevention)”及其语法变体是指部分或完全延迟或排除障碍或病症和/或其伴随症状中的一种或多种的发生或复发,或禁止动物获得或重新获得障碍或病症或降低动物获得或重新获得障碍或病症或其伴随症状中的一种或多种的风险的方法。
如本文所用的,关于具体性状、特征、特性、生物过程、或现象的术语“减少”是指特定性状、特征、特性、生物过程、或现象的减少。性状、特征、特性、生物过程、或现象可以降低5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%或大于100%。
如本文所用,“t细胞群体”包括调节性t细胞和效应t细胞。t细胞群体包括活化的和非活化的t细胞。t细胞群体内的细胞可以表达标志物,该标志物包括但不限于:cd1、cd1a、cd1b、cd1c、cd1d、cd2、cd3、cd3d、cd3e、cd3g、cd4、cd5、cd6、cd7、cd8、cd8a、cd8b、cd9、cd11、cd11a、cd11b、cd11c、cd11d、cd13、cd16、cd17、cd18、cd20、cd21、cd23、cd25、cd26、cd27、cd28、cd29、cd30、cd31、cd32、cd32b、cd35、cd37、cd38、cd39、cd40l(又称为cd40配体)、cd43、cd44、cd45、cd45r、cd45ra、cd45rb、cd45rc、cd45r0、cd45rhi、cd46、cd47、cd48、cd49a、cd49b、cd49c、cd49d、cd49e、cd49f、cd50、cd52、cd53、cd54、cd55、cd56、cd57、cd58、cd59、cd60a、cd62l、cd63、cd64、cd68、cd69、cd70、cd73、cd74、cd80、cd81、cd82、cd84、cd85a、cd85j、cd86、cd87、cd92、cd94、cd95、cd96、cd97、cd98、cd99、cd99r、cd100、cd101、cd102、cd103、cd107a、cd107b、cd108、cd109、cd119、cd120a、cd120b、cd121a、cd121b、cd122、cd124、cd126、cd127、cd129、cd130、cd132、cd134、cd137、cd146、cd147、cd148、cd150、cd152、cd153、cd154、cd156b、cd158a、cd158b1、cd158b2、cd158e、cd158f、cd158g、cd158h、cd158i、cd158j、cd158k、cd159a、cd159c、cd160、cd161、cd162、cd164、cd166、cd171、cd172g、cd178、cd181、cd182、cd183、cd184、cd185、cd186、cd191、cd192、cd193、cd194、cd195、cd196、cd197、cdw198、cdw199、cd200、cd205、cd210a、cdw210b、cd212、cd215、cd217、cd218a、cd218b、cd220、cd221、cd222、cd223、cd224、cd225、cd226、cd227、cd229、cd230、cd231、cd245、cd246、cd247、cd253、cd254、cd256、cd257、cd258、cd261、cd262、cd263、cd264、cd267、cd268、cd270、cd272、cd273、cd274、cd275、cd277、cd278、cd279、cd283、cd288、cd289、cd290、cd294、cd295、cd296、cd298、cd300a、cd300c、cd305、cd306、cd307c、cd314、cd316、cd317、cd319、cd321、cd328、cd351、cd352、cd354、cd355、cd357、cd358、cd359、cd360、cd361、cd362、cd363或白介素-2-受体。
如本文所用,“调节性t细胞”或“treg细胞”是指通常通过抑制其活性来调节其他一种或多种t细胞和/或其他免疫细胞的活性的t细胞(t淋巴细胞)。在一个实施例中,treg细胞是cd4+、cd25+、foxp3+t细胞(但是本领域技术人员将理解,treg细胞不完全限于该表型)。
如本文所用,“效应t细胞”或“teff细胞”是指执行免疫应答功能的t细胞(t淋巴细胞),如杀死肿瘤细胞和/或活化抗肿瘤免疫应答,该免疫应答可以导致肿瘤细胞从身体清除。在一个实施例中,该teff细胞是具有cd4+或cd8+的cd3+。teff细胞可以分泌、包含或表达效应标志物如ifn-γ,粒酶b和icos(但是本领域技术人员将理解,treg细胞不完全限于该表型)。
如本文所用,术语“治疗(treat、treating、treatment)”及其语法变体包括部分或完全延迟、减轻、缓和或减少障碍或病症的一种或多种伴随症状的强度和/或减轻、缓和或阻碍障碍或病症的一种或多种病因。根据本披露的治疗可以预防性地、防止性地、缓和地或矫正地应用。
本文提供的是菌株。还提供了制备和使用这些菌株的方法。
在至少一些实施例中,用本文提供的一种或多种菌株制备的直接喂养微生物(dfm)允许牛肉和乳制品生产者继续管理喂养方案以优化生长和性能,而不会由于与瘤胃酸中毒相关的消化不良而牺牲健康。基于通过乳酸利用管理瘤胃乳酸浓度或引发瘤胃以维持利用乳酸的微生物群落来选择dfm的至少一些实施例。开发dfm的至少一些实施例来管理瘤胃能量浓度。与向牛生产者销售以缓解酸中毒的当前dfm不同,本发明的至少一些实施例不意在被开发以在问题发生后来对其进行管理,而是在发生问题之前缓解问题。
菌株:
本文提供的菌株包括屎肠球菌菌株8g-1、屎肠球菌菌株8g-73、和短小芽孢杆菌菌株8g-134,其在本文中还分别称为8g-1、8g-73、和8g-134。
菌株屎肠球菌菌株8g-1、屎肠球菌菌株8g-73、和短小芽孢杆菌菌株8g-134于2008年8月29日在农业研究服务培养物保藏中心(nrrl),北部大学街1815号,皮奥瑞亚,伊利诺伊州,61604(1815northuniversitystreet,peoria,illinois,61604)保存,并分别给出登录号b-50173、b-50172、和b-50174。这些保藏是根据国际承认用于专利程序目的的微生物保藏的布达佩斯条约的规定进行的。本文提供的一种或多种菌株可以用作直接喂养微生物(dfm)。
出于本披露的目的,“生物纯的菌株”意指不包含足以干扰菌株的复制或可通过正常的细菌学技术检测到的量的其他细菌菌株的菌株。当与本文所述的生物体和培养物结合使用时,“分离”不仅包括生物纯的菌株,而且还包括除自然界中发现的那些之外生长或维持的生物体的任何培养物。在一些实施例中,菌株是菌株8g-1、8g-73、或8g-134的突变体、变体、或衍生物,这些菌株还提供了与由8g-1、8g-73、或8g-134所提供的益处相当的益处。在一些实施例中,菌株是具有菌株8g-1、8g-73、或8g-134的所有鉴别特征的菌株。此外,每个单独的菌株(8g-1、8g-73、或8g-134)或这些菌株的任何组合也可以提供本文所述的一种或多种益处。还可以清楚的是,添加其他微生物菌株、载体、添加剂、酶、酵母等也将提供对酸中毒的控制,并且不构成实质上不同的dfm。
芽孢杆菌属菌株具有很多使其可用作dfm的品质。例如,若干种芽孢杆菌属物种还具有gras状态,即,它们被美国食品和药品管理局认定为总体上安全的,并且还被美国饲料控制官方协会(aafco)批准用于动物饲料。本文所述的芽孢杆菌菌株是需氧和兼性产孢菌,并且因此是稳定的。芽孢杆菌属物种是唯一被认为是gras的产孢菌。发现预防或治疗酸中毒的芽孢杆菌属菌株是短小芽孢杆菌菌株8g-134。
肠球菌属菌株也具有很多使其可用作dfm的品质。已知肠球菌属菌种存在于单胃和反刍动物的胃肠道中,并且适合在这种环境中生存。肠球菌属已显示出是兼性厌氧生物体,使其在有氧和缺氧条件下都稳定并活跃。诸位发明人鉴别了屎肠球菌菌株8g-1和屎肠球菌菌株8g-73可用于这些目的。
亚博科技公司(agtech)和w227n752韦斯特蒙路,沃基肖,威斯康星州53186,美国(w227n752westmounddr.waukesha,wi53186,usa)的丹尼斯克美国公司(daniscousainc.)授权兰格布罗盖德1,邮政信箱17,dk-1001,哥本哈根k,丹麦(langebrogade1,pobox17,dk-1001,copenhagenk,denmark)的杜邦营养生物科学公司(以前称丹尼斯克公司(daniscoa/s))在本专利申请中提及这些保藏的生物材料,并且对可供公众使用的保藏材料施用无保留和不可撤销的同意。
菌株的制备:
在至少一个实施例中,使用常规的液体或固体发酵技术单独培养本文所述的每种菌株。在至少一个实施例中,芽孢杆菌属菌株和肠球菌属菌株在芽孢杆菌的情况下在液体营养肉汤中生长至形成最多数量孢子的水平。通过发酵细菌菌株来生产芽孢杆菌属菌株,其可以通过同比例放大种子培养物来开始。这涉及重复和无菌地将培养物转移到越来越大的体积以用作发酵的接种物,该发酵可以在大型不锈钢发酵罐中的包含最佳生长所必需的蛋白质、碳水化合物、和矿物质的培养基中进行。非限制性示例性培养基是mrs或tsb。然而,也可以使用其他培养基。将接种物添加到发酵容器后,控制温度和搅拌以允许最大生长。在一个实施例中,菌株在搅拌下在32°至37°下生长。一旦培养物达到最大群体密度,通过从发酵培养基中分离细胞来收获培养物。这通常通过离心来完成。
在一个实施例中,为了制备芽孢杆菌菌株,将芽孢杆菌菌株发酵至5x108cfu/ml至约4x109cfu/ml水平。在至少一个实施例中,使用2x109cfu/ml的水平。通过离心收获细菌,并且除去上清液。然后可以使用沉淀的细菌来生产dfm。在至少一些实施例中,将沉淀的细菌冷冻-干燥,并且然后用于形成dfm。然而,在使用芽孢杆菌之前不需要将其冷冻干燥。菌株也可以与或不与防腐剂一起使用,并且处于浓缩的、未浓缩的、或稀释的形式。
然后可以确定培养物的计数。cfu或菌落形成单位是由标准微生物平板培养法得到的样品的活细胞计数。该术语源自以下事实:当在适当培养基上涂布时,单个细胞将生长并成为琼脂培养基中的有活力的菌落。由于多个细胞可能产生一个可见的菌落,所以术语菌落形成单位是比细胞数更有用的单位测量值。
使用菌株:
在至少一些实施例中,使用一种或多种菌株来形成dfm。可以将一种或多种载体,包括但不限于蔗糖、麦芽糖糊精,石灰石、和稻壳添加到菌株中。
为了混合一种或多种菌株和载体(如果使用的话),可以将它们添加到条带或桨式混合器中,并且优选混合约15分钟,尽管时间可以增加或减少。将组分混合,这样使得导致培养物和载体的均匀混合物。最终产物优选为干燥的可流动粉末,并且可以基于终产物中期望的最终dfm浓度来配制。
在制备dfm的方法的至少一个实施例中,本文所述的菌株在培养基如液体营养肉汤中生长。将菌株与液体营养肉汤分离,以制备直接喂养微生物。该菌株在与肉汤分离后可以进行冷冻干燥。
可以向动物喂养一种或多种屎肠球菌菌株8g-1、屎肠球菌菌株8g-73、和短小芽孢杆菌菌株8g-134以减少并甚至消除酸中毒的发生。为此,向动物施用有效量的这些菌株中的一种或多种。在向动物施用时,一种或多种菌株在动物中或给动物提供以下益处中的至少一种:(a)减少动物的酸中毒,(b)使瘤胃新陈代谢稳定,如通过延迟的乳酸积累和延长的挥发性脂肪酸的产生所指示的,(c)从酸中毒激发更快地恢复,如通过ph恢复和乳酸下降所测量的,和(d)不显示与酸中毒有关的临床病征。
这些动物可以是牛,包括肉用牛和乳牛,即一个或多个公牛,肉牛,小母牛,牛犊、或母牛;山羊;绵羊;美洲驼;羊驼;其他四室胃的反刍动物,当喂养容易发酵的碳水化合物(rfc)时,这些动物可能会遇到瘤胃不平衡。
在至少一个实施例中,当喂养屎肠球菌菌株8g-1或屎肠球菌菌株8g-73时,以一定水平向动物施用该菌株,这样使得这些动物每天给药约5x108cfu/动物/天至约5x1010cfu/动物/天。在至少一个实施例中,当喂养短小芽孢杆菌菌株8g-134时,以一定水平向动物施用该菌株,这样使得每天给药这些动物约5x108cfu/动物/天至约5x1010cfu/动物/天。在至少一个实施例中,喂养屎肠球菌菌株8g-1、屎肠球菌菌株8g-73和屎肠球菌菌株8g-134中的两种或更多种,并且以一定水平向动物基于这些菌株,这样使得每天给药这些动物约5x108cfu/动物/天至约5x1010cfu/动物/天(作为组合菌株的总剂量)。可以向这些动物喂养其他水平的一种或多种菌株。可以从约30日龄至成年反刍动物生产期的剩余时间或持续其他时间段向这些动物施用该菌株。
在至少一个实施例中,将菌株作为直接喂养的微生物(dfm)进行喂养,并且将dfm用作每日日粮上的追料(topdressing)。此外,该菌株能以全混合日粮(颗粒饲料)进行喂养,与液体饲料混合,在蛋白质预混物中混合,通过维生素和矿物质预混物递送。
在至少一个实施例中,将菌株作为dfm进行喂养,并且将dfm与a类含药物品莫能菌素
在至少一个实施例中,将该菌株作为dfm进料,并且将dfm与a类含药物品泰乐菌素磷酸盐
用于降低疾病的发生率的方法
在另一个实施例中,本文披露的菌株、方法、和组合物可用于降低动物中疾病的发生率。在一个实施例中,该菌株是短小芽孢杆菌8g-134。
在一个实施例中,本披露涉及用于降低动物中疾病的发生率的方法,该方法包括:向该动物施用有效量的短小芽孢杆菌8g-134(nrrl-b-50174)或具有短小芽孢杆菌菌株8g-134(nrrl-b-50174)的所有鉴别特征的菌株,以降低疾病的发生率。在一个实施例中,该动物是选自下组,该组由以下各项组成:围产期动物、产后动物、临产动物。
在一个实施例中,本披露涉及用于降低动物中疾病的发生率的方法,该方法包括:向围产期动物施用有效量的短小芽孢杆菌8g-134(nrrl-b-50174)或具有短小芽孢杆菌菌株8g-134(nrrl-b-50174)的所有鉴别特征的菌株,以降低疾病的发生率,其中将短小芽孢杆菌8g-134(nrrl-b-50174)在临产和分娩前施用持续两周。在另一个实施例中,将短小芽孢杆菌8g-134(nrrl-b-50174)在临产和分娩前施用持续四周。在仍另一个实施例中,将短小芽孢杆菌8g-134(nrrl-b-50174)在临产和分娩前施用持续六至八周。在仍另一个实施例中,将短小芽孢杆菌8g-134(nrrl-b-50174)在临产和分娩前施用持续一段时间,这段时间包括但不限于:1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、和16周。
在一个实施例中,本披露涉及用于降低动物中疾病的发生率的方法,该方法包括:向围产期动物施用有效量的短小芽孢杆菌8g-134(nrrl-b-50174)或具有短小芽孢杆菌菌株8g-134(nrrl-b-50174)的所有鉴别特征的菌株,以降低疾病的发生率,其中将短小芽孢杆菌8g-134(nrrl-b-50174)在临产和分娩前施用持续一段时间,并且在临产和分娩后施用持续一段时间。在一个实施例中,将该菌株在临产和分娩前施用持续一段时间,这段时间包括但不限于:1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、和16周。在另一个实施例中,将该菌株在临产和分娩后施用持续一段时间,这段时间包括但不限于:1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、和16周。
在一个实施例中,本披露涉及用于降低动物中疾病的发生率的方法,该方法包括:向围产期动物、产后动物、或临产和分娩动物施用有效量的短小芽孢杆菌8g-134(nrrl-b-50174)或具有短小芽孢杆菌菌株8g-134(nrrl-b-50174)的所有鉴别特征的菌株,以降低疾病的发生率,其中将短小芽孢杆菌8g-134(nrrl-b-50174)在产后施用持续两周。在另一个实施例中,将短小芽孢杆菌8g-134(nrrl-b-50174)在产后施用持续四周。在仍另一个实施例中,将短小芽孢杆菌8g-134(nrrl-b-50174)在产后施用持续六至八周。在仍另一个实施例中,将短小芽孢杆菌8g-134(nrrl-b-50174)在产后施用持续一段时间,这段时间包括但不限于:1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、和16周。
在一个实施例中,动物为反刍动物。在仍另一个实施例中,该动物是乳牛。在又另一个实施例中,该动物是围产期乳牛,产犊过程中的乳牛、或产后乳牛。
在一个实施例中,该疾病选自下组,该组由以下各项组成:酮症(酮血症)、皱胃移位、胎盘滞留、子宫炎、炎性疾病、炎症、和乳腺炎。
a.酮症
酮症是一种代谢状态,其中大部分身体的能量供应来自血液中的酮体,与其中血糖提供了大部分能量的糖酵解状态相反。它几乎总是全身性的,伴有高酮血症,即全身血液中高水平的酮体。当肝糖原储存耗尽时,通过酮生成形成酮体。用于能量的主要酮体是乙酰乙酸和β-羟基丁酸,并且酮体的水平主要由胰岛素和胰高血糖素调节。身体中的大多数细胞可以使用葡萄糖和酮体二者供能,而在酮症游离脂肪酸和葡萄糖合成(糖异生)期间以其余部分供能。
在糖酵解中,较高水平的胰岛素促进身体脂肪的储存并阻止脂肪从脂肪组织释放,而在酮症中,脂肪储备容易释放和消耗。由于这个原因,酮症有时被称为身体的“脂肪燃烧”模式。
在乳牛中,酮症是一种常见的失调,通常在产生牛犊后的头几周发生。在这些情况下,酮症有时被称为酮血症。2011年的一项研究揭示了,酮症是否发展取决于用于制造乳脂的母牛的脂质。容易发生酮症的动物从脂肪组织中移出脂肪酸,而强壮的动物由血液磷脂酰胆碱(卵磷脂)产生脂肪酸。可以通过高水平的奶甘油磷酰胆碱和低水平的奶磷酸胆碱鉴别健康动物。
b.皱胃移位
皱胃(或真胃)通常位于腹部的基底上,但是当它被称为“异位”时,可以充满气体并且升起到腹部的顶部。与右移位(rda)相比,皱胃更可能向左移位(lda)。大多数病例在产犊后不久就发生。在怀孕期间,子宫取代皱胃,这样使得在产犊之后,皱胃必须回到其正常位置,增加了移位的风险。
在产后两周内诊断出百分之五十至八十的lda。在产后一个月内诊断出百分之八十至九十的lda。患有lda的母牛患酮症风险增加50倍。
皱胃移位也可以由皱胃的张力缺失引起。如果皱胃皱缩停止收缩并且翻转其内容物,会发生气体积累,并且该皱胃将倾向于向上移动腹部。这往往是营养不足的原因。
皱胃移位的症状包括但不限于:食欲不振;奶产量下降;减少的反刍;和轻度腹泻。
c.胎盘滞留
胎盘滞留(rp)也称为胎膜滞留或清洁滞留。当胎盘(胎膜)的牛犊侧不能与母体侧分离时,发生rp。在牛犊出生后,通常会发生膜的分离(早期分离是死产的一个原因)。rp通常定义为在分娩后24小时内未能排出胎膜。
胎盘滞留是最常见的与难产,产乳热(代谢性疾病)和双胎出生相关。与rp相关的单一病征是从外阴垂下的、变性的、变色的、最终恶臭的膜。有时,滞留的膜可以保留在子宫内,并不容易看出,在这种情况下,它们的存在可以通过臭味排出而发出信号。患有胎膜滞留的母牛在随后的怀孕中发生子宫炎、酮症、乳腺炎、以及甚至流产的风险增加。
d.乳腺炎
当白血细胞(白细胞)被释放到乳腺中时,通常响应于乳头沟的细菌侵袭发生乳腺炎。分泌奶的组织和整个乳腺中的各种管道可能被来自细菌的毒素损伤。乳腺炎也可能由于化学、机械、或热损伤而发生。
乳牛中的乳腺炎是乳房组织的持续性炎症反应。这种潜在致命的乳腺感染是美国乳牛中最常见的疾病。其对乳制品行业也是最昂贵的。
炎症应答导致乳腺组织中的血液蛋白质和白血细胞的增加,然后这些血液蛋白质和白血细胞可以传入奶制品中。这种应答旨在消灭刺激物,修复损伤的乳腺组织并使乳房恢复正常功能。然而,由于这种乳腺炎,经验是往往导致奶产量的损失。
用于减少动物的负能量平衡的方法
负能量平衡由于各种原因而发生,这些原因包括但不限于:干物质摄入量(dmi)的降低;由于奶生产造成的对能源需求的增加;以及分娩后dmi的滞后增加。当母牛将能量分配给牛奶生产时,较高血nefa和β-羟基丁酸(bhba)在产后早期是典型的,并且已知与能量平衡负相关。不受特定理论的约束,具有较高nefa的母牛正在动员更多的脂肪组织来支持奶生产,并且相对于具有较低nefa水平的母牛而言,丧失了更多的体况(bc)。脂肪作为nefa被动员并转运到肝脏被氧化或再酯化成甘油三酸酯。当甘油三酸酯的再酯化增加时,酮体的产生增加。酮体包括bhba,乙酰乙酸和丙酮。
较低水平的nefa和/或bhba可能表明对新能源需求的正常调整,然而,较高水平的nefa和/或bhba可以预示着更大的疾病的发生率,如酮症和皱胃移位。
在一个实施例中,本文披露的菌株、方法、和组合物可用于减少动物的负能量平衡。在一个实施例中,该菌株是短小芽孢杆菌8g-134。
在一个实施例中,本披露涉及用于减少动物的负能量的方法,该方法包括:向该动物施用有效量的短小芽孢杆菌8g-134(nrrl-b-50174)或具有短小芽孢杆菌菌株8g-134(nrrl-b-50174)的所有鉴别特征的菌株,以减少动物的负能量平衡。
在一个实施例中,动物为反刍动物。在又另一个实施例中,该动物是围产期动物。在另一个实施例中,该动物是产后动物。在仍另一个实施例中,该动物是在临产和分娩过程中的动物。在仍另一个实施例中,该动物是乳牛、围产期乳牛、产后乳牛、或产犊过程中的乳牛。
在一个实施例中,本披露涉及用于减少动物的负能量的方法,该方法包括:向动物施用有效量的短小芽孢杆菌8g-134(nrrl-b-50174)或具有短小芽孢杆菌菌株8g-134(nrrl-b-50174)的所有鉴别特征的菌株,其中施用短小芽孢杆菌8g-134(nrrl-b-50174),与未施用该菌株的动物相比,导致更好的奶产量和体况评分。
在一个实施例中,本披露涉及用于减少动物的负能量的方法,该方法包括:向动物施用有效量的短小芽孢杆菌8g-134(nrrl-b-50174)或具有短小芽孢杆菌菌株8g-134(nrrl-b-50174)的所有鉴别特征的菌株,其中施用短小芽孢杆菌8g-134(nrrl-b-50174),与未施用该菌株的动物相比,导致更低水平的nefa。在另一个实施例中,施用短小芽孢杆菌8g-134(nrrl-b-50174),与未施用该菌株的动物相比,导致更低水平的bhba。在仍另一个实施例中,施用短小芽孢杆菌8g-134(nrrl-b-50174),与未施用该菌株的动物相比,导致更低水平的nefa和bhba。
在一个实施例中,本披露涉及一种用于减少动物的负能量的方法,该方法包括:从动物获得样品;确定样品中nefa和/或bhba的水平;向动物施用有效量的短小芽孢杆菌8g-134(nrrl-b-50174)或具有短小芽孢杆菌菌株8g-134(nrrl-b-50174)的所有鉴别特征的菌株,其中nefa和/或bhba的水平指示负能量平衡。在一个实施例中,该样品是血液。在另一个实施例中,从围产期动物(从产前14天至产后14天)收集样品。在一个实施例中,在多个时间点收集样品以避免日变化和餐后变化。
在一个实施例中,本披露涉及一种用于减少动物的负能量的方法,该方法包括:从畜群中的许多动物获得样品;确定每个所获得样品中nefa和/或bhba的水平;当10%-25%的采样动物具有指示疾病的nefa和/或bhba浓度时,向畜群施用有效量的短小芽孢杆菌8g-134(nrrl-b-50174)或具有短小芽孢杆菌菌株8g-134(nrrl-b-50174)的所有鉴别特征的菌株。在一个实施例中,当15%的采样动物具有指示疾病的nefa和/或bhba浓度时,施用该菌株。
在一个实施例中,大于0.27meq/l的产前动物中的nefa水平指示负能量平衡。
在又另一个实施例中,大于0.70meq/l的产后动物中的nefa水平指示负能量平衡。
在又另一个实施例中,大于12mg/dl的产后动物中的bhba水平指示负能量平衡。
在仍另一个实施例中,本披露涉及用于减少动物的负能量的方法,该方法包括:向动物施用有效量的短小芽孢杆菌8g-134(nrrl-b-50174)或具有短小芽孢杆菌菌株8g-134(nrrl-b-50174)的所有鉴别特征的菌株,其中向该动物施用短小芽孢杆菌8g-134(nrrl-b-50174),与未施用该菌株的动物相比,导致更低水平的nefa和更好的奶产量。在另一个实施例中,施用短小芽孢杆菌8g-134(nrrl-b-50174),与未施用该菌株的动物相比,导致更低水平的bhba和更好的奶产量。在仍另一个实施例中,施用短小芽孢杆菌8g-134(nrrl-b-50174),与未施用该菌株的动物相比,导致更低水平的nefa和bhba以及更好的奶产量。
在一个实施例中,施用短小芽孢杆菌8g-134(nrrl-b-50174),与未施用该菌株的动物相比,可以增加奶产量一定百分比,该百分比选自下组,该组由以下各项组成:0.1%-0.5%、0.5%-1%、1%-3%、3%-5%、5%-7%、7%-9%、10%、10%-12%、12%-15%、15%-20%、20%-25%、25%-30%、30%-35%、以及大于35%。在另一个实施例中,施用短小芽孢杆菌8g-134(nrrl-b-50174),与未施用该菌株的动物相比,可以增加奶产量大于0.1%、大于0.3%、大于0.5%、大于1%、大于3%、大于5%、大于7%、或大于10%。
在一个实施例中,向动物施用短小芽孢杆菌8g-134(nrrl-b-50174),与未施用该菌株的动物相比,可以降低动物中的nefa水平一定的百分比,该百分比选自下组,该组由以下各项组成:0.1%-1%、1%-5%、5%-10%、10%-15%、15%-20%、20%-25%、25%-30%、35%-40%、40%-45%、45%-55%、55%-65%、65%-75%、75%-85%、85%-95%、以及大于95%在又另一个实施例中,向动物施用短小芽孢杆菌8g-134(nrrl-b-50174),与未施用该菌株的动物相比,可以降低动物中的nefa水平一定的百分比,该百分比选自下组,该组由以下各项组成:1%-10%、10%-20%、20%-40%、40%-60%、60%-80%、80%-100%以及大于100%。
在一个实施例中,向动物施用短小芽孢杆菌8g-134(nrrl-b-50174),与未施用该菌株的动物相比,可以降低动物中的bhba水平一定的百分比,该百分比选自下组,该组由以下各项组成:0.1%-1%、1%-5%、5%-10%、10%-15%、15%-20%、20%-25%、25%-30%、35%-40%、40%-45%、45%-55%、55%-65%、65%-75%、75%-85%、85%-95%、以及大于95%在又另一个实施例中,向动物施用短小芽孢杆菌8g-134(nrrl-b-50174),与未施用该菌株的动物相比,可以降低动物中的bhba水平一定的百分比,该百分比选自下组,该组由以下各项组成:1%-10%、10%-20%、20%-40%、40%-60%、60%-80%、80%-100%以及大于100%
在仍另一个实施例中,本披露涉及用于减少动物的负能量的方法,该方法包括:向动物施用有效量的短小芽孢杆菌8g-134(nrrl-b-50174)或具有短小芽孢杆菌菌株8g-134(nrrl-b-50174)的所有鉴别特征的菌株,其中向该动物施用短小芽孢杆菌8g-134(nrrl-b-50174)降低了与负能量平衡相关的疾病的发生率。在另一个实施例中,施用短小芽孢杆菌8g-134(nrrl-b-50174)导致更低的疾病的发生率,该疾病包括但不限于亚临床酮症、胎盘滞留、皱胃位移、和乳腺炎。
用于改进动物免疫应答的方法
在一个实施例中,本文披露的菌株、方法、和组合物可用于改进动物的免疫应答。在一个实施例中,改进动物的免疫应答包括改变动物的免疫细胞群体。在一个实施例中,改进动物的免疫应答包括增加t细胞标志物的表达。
a.用于改变动物免疫细胞群体的方法
在一个实施例中,本文披露的菌株、方法、和组合物可用于改变动物中的免疫细胞群体。在另一个实施例中,本文披露的菌株、方法、和组合物可用于诱导反刍动物的免疫细胞群体的变化。在一个实施例中,该菌株是短小芽孢杆菌8g-134。
在一个实施例中,改变动物的免疫细胞群体包括改变免疫细胞的表达模式而不增加总免疫细胞群体。
在一个实施例中,本披露涉及用于诱导动物的免疫细胞群体变化的方法,该方法包括:(a)鉴别需要免疫细胞群体变化的动物;并且(b)向该动物施用有效量的短小芽孢杆菌8g-134(nrrl-b-50174)或具有短小芽孢杆菌菌株8g-134(nrrl-b-50174)的所有鉴别特征的菌株,以诱导免疫细胞群体的变化。在一个实施例中,需要免疫细胞群体变化的动物是处于疾病和/或感染风险中的动物或显示疾病和/或感染病征的动物。
在一个实施例中,免疫细胞群体是白细胞。
白细胞(白血细胞)分为两大系:骨髓白细胞和淋巴细胞。骨髓系的白细胞包括嗜中性粒细胞、单核细胞、嗜酸性粒细胞和嗜碱性粒细胞。淋巴细胞的白细胞包括t细胞、b细胞和天然杀伤细胞。
在一个实施例中,该反刍动物是乳牛。在又另一个实施例中,该反刍动物是产后乳牛。
在一个实施例中,需要白细胞群体变化的反刍动物是患有疾病或感染的动物。该疾病或感染可以是急性或慢性的。在一个实施例中,该疾病选自下组,该组由以下各项组成:酮症(酮血症)、皱胃移位、胎盘滞留、和乳腺炎。
1.用于诱导t细胞群体变化的方法
在一个实施例中,披露了用于改变t细胞群体亚群的菌株、方法、和组合物。在另一个实施例中,披露了用于诱导t细胞群体亚群变化的菌株、方法和组合物。在一个实施例中,t细胞群体的变化由t细胞cd标志物的表达增加反映,这些标志物包括但不限于:cd4、cd8、cd25、cd45r、cd45r0、cd62l、和cd45rhi。在一个实施例中,该菌株是短小芽孢杆菌8g-134。在一个实施例中,
t细胞是作为针对各种病原体的生物防御系统在免疫系统中发挥重要作用的细胞群之一。这样的t细胞大致分为cd4阳性辅助t细胞和cd8阳性细胞毒性t细胞,其中前者涉及促进免疫应答,后者涉及排除病毒感染的细胞和肿瘤细胞。辅助t细胞进一步分类为促进细胞免疫的i型辅助t细胞和用于促进体液免疫的ii型辅助t细胞。具有这种多样化特性的这些t细胞具有排除病原体并在均衡的免疫应答下获得感染抗性的功能。
在一个实施例中,本披露涉及用于诱导动物的t细胞群体变化的方法,该方法包括:(a)鉴别需要t细胞群变化的动物;并且(b)向该动物施用有效量的短小芽孢杆菌8g-134(nrrl-b-50174)或具有短小芽孢杆菌菌株8g-134(nrrl-b-50174)的所有鉴别特征的菌株,以诱导t细胞群体的变化。在一个实施例中,t细胞群体的变化是由t细胞cd标志物的表达增加证明的,这些标志物包括但不限于:cd4、cd8、cd25、cd45r、cd45r0、cd62l、和cd45rhi。
在一个实施例中,本披露涉及用于诱导动物的t细胞群体变化的方法,该方法包括:(a)从动物获得样品;(b)确定来自动物的样品中的初始t细胞群体;并且(c)向该动物施用有效量的短小芽孢杆菌8g-134(nrrl-b-50174)或具有短小芽孢杆菌菌株8g-134(nrrl-b-50174)的所有鉴别特征的菌株,以诱导t细胞群体的变化。在又另一个实施例中,该方法进一步包括(d)在施用短小芽孢杆菌8g-134(nrrl-b-50174)后确定来自动物的第二样品中的t细胞群体。
在一个实施例中,通过细胞表面标志物的变化显示t细胞群体的变化。在一个实施例中,细胞表面标志物选自下组,该组由以下各项组成:cd4、cd8、cd45r、cd45r0、cd62l、和cd45rhi。
b.用于改进对感染的免疫应答的方法
黏膜表面是身体暴露于外部病原体的最大面积。免疫球蛋白a(iga)以其分泌形式是粘膜免疫系统的主要效应物,并且为防止在粘膜表面入侵身体的大多数病原体提供了重要的第一道防线。
分泌型iga(siga)代表身体分泌物最丰富的免疫球蛋白,如唾液、眼泪、初乳和胃肠道分泌物。分子稳定性和效应物免疫功能使siga特别适合提供抵抗病原体的粘膜保护。
iga介导了各种保护功能。内腔siga被认为干扰病原体粘附到粘膜上皮细胞,这是一个称为免疫排斥的过程。此外,iga似乎具有两种其他防御功能:细胞内中和和病毒排泄。还发现iga作为血清中的单体,在血清中它可以通过消除已经破坏粘膜表面的病原体而作为第二道防线。血清iga与称为fcαr1的fc受体相互作用,引发抗体依赖性细胞介导的细胞毒性(adcc)。
在一个实施例中,本文披露的菌株、方法、和组合物可用于改进动物对感染的免疫应答。在一个实施例中,该菌株是短小芽孢杆菌8g-134。
在一个实施例中,本披露涉及用于改进动物对感染的免疫应答的方法,该方法包括:向该动物施用有效量的短小芽孢杆菌8g-134(nrrl-b-50174)或具有短小芽孢杆菌菌株8g-134(nrrl-b-50174)的所有鉴别特征的菌株,以改进动物对感染的免疫应答。
在又另一个实施例中,将该菌株在临产和分娩前施用持续一段时间,这段时间包括但不限于:在临产和分娩前的1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、和16周。
在又另一个实施例中,将该菌株在临产和分娩后施用持续一段时间,这段时间包括但不限于:在临产和分娩后的1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、和16周。
在另一个实施例中,在产犊后的前两周内施用该菌株。在又另一个实施例中,在产犊后的第一周内施用该菌株。
在另一个实施例中,在产犊前两周施用该菌株。在又另一个实施例中,在产犊前一周施用该菌株。
在一个实施例中,本披露涉及用于改进动物的免疫应答的方法,该方法包括:向该动物施用有效量的短小芽孢杆菌8g-134(nrrl-b-50174)或具有短小芽孢杆菌菌株8g-134(nrrl-b-50174)的所有鉴别特征的菌株,其中iga的增加,与未施用该菌株的动物相比,指示了改进的免疫应答。在产犊后第一周期间,奶中iga的增加可以在乳腺中提供改进的免疫防御,以防止细菌粘附和乳腺上皮细胞的侵袭。还预期为牛犊提供益处,通过被动地传递免疫力来提高牛犊的健康。
在一个实施例中,本披露涉及一种用于改进动物的免疫应答的方法,该方法包括:从动物获得样品;确定样品中iga的水平;向动物施用有效量的短小芽孢杆菌8g-134(nrrl-b-50174)或具有短小芽孢杆菌菌株8g-134(nrrl-b-50174)的所有鉴别特征的菌株,其中iga的水平指示抑制的免疫应答。在一个实施例中,该样品是血液。在另一个实施例中,从围产期动物(从产前14天至产后14天)收集样品。
在一个实施例中,向动物施用短小芽孢杆菌8g-134(nrrl-b-50174),与未施用该菌株的动物相比,可以增加动物中的iga水平一定的百分比,该百分比选自下组,该组由以下各项组成:1%-5%、5%-10%、10%-15%、15%-20%、20%-25%、25%-30%、35%-40%、40%-45%、45%-55%、55%-65%、65%-75%、75%-85%、85%-95%、以及大于95%。在又另一个实施例中,向动物施用短小芽孢杆菌8g-134(nrrl-b-50174),与未施用该菌株的动物相比,可以增加动物中的iga水平一定的百分比,该百分比选自下组,该组由以下各项组成:1%-10%、10%-20%、20%-40%、40%-60%、60%-80%、80%-100%以及大于100%。在一个实施例中,治疗的动物中iga的水平,与未治疗的动物相比,增加10%-30%。在一个实施例中,治疗的动物中iga的水平,与未治疗的动物相比,增加至少15%。
用于改进动物繁殖性能的方法
在一个实施例中,本文披露的菌株、方法、和组合物可用于改进动物的繁殖性能。在一个实施例中,该菌株是短小芽孢杆菌8g-134。
在一个实施例中,本披露涉及用于改进动物的繁殖性能的方法,该方法包括:向该动物施用有效量的短小芽孢杆菌8g-134(nrrl-b-50174)或具有短小芽孢杆菌菌株8g-134(nrrl-b-50174)的所有鉴别特征的菌株,以改进动物的繁殖性能。
在一个实施例中,动物为反刍动物。在仍另一个实施例中,该动物是乳牛。在又另一个实施例中,该动物是产后乳牛。
在一个实施例中,本披露涉及用于改进动物的繁殖性能的方法,该方法包括:向产后动物施用有效量的短小芽孢杆菌8g-134(nrrl-b-50174)或具有短小芽孢杆菌菌株8g-134(nrrl-b-50174)的所有鉴别特征的菌株,以改进动物的繁殖性能。在一个实施例中,产后动物被诊断患有一种疾病,该疾病包括但不限于酮症(酮血症)、皱胃移位、胎盘滞留、和乳腺炎。
在仍另一个实施例中,将短小芽孢杆菌8g-134(nrrl-b-50174)在产后施用持续一段时间,这段时间包括但不限于:1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、16-20、20-24、24-28、28-32、32-36、36-40、40-44、44-48、48-52、和大于52周。
产犊后,一头母牛恢复循环通常需要60到90天。这个时期称为产后乏情期。在初产牛犊小母牛中,产后乏情期持续时间比成熟母牛长。初产牛犊小母牛恢复循环通常需要90到120天。
在一个实施例中,本披露涉及用于改进动物的繁殖性能的方法,该方法包括:向产后动物施用有效量的短小芽孢杆菌8g-134(nrrl-b-50174)或具有短小芽孢杆菌菌株8g-134(nrrl-b-50174)的所有鉴别特征的菌株,以改进动物的繁殖性能,其中施用短小芽孢杆菌8g-134(nrrl-b-50174)的动物比未施用该菌株的动物更迅速恢复循环。在一个实施例中,施用该菌株的动物比未施用该菌株的动物恢复循环早1-5、5-10、10-15、15-20、20-25、25-30、30-35、35-40、40-45、45-50、50-55、55-60、60-65、65-70、70-75、和75-80天。
在另一个实施例中,施用短小芽孢杆菌8g-134(nrrl-b-50174)的动物比未施用该菌株的动物更快地实现随后的受精。在一个实施例中,施用该菌株的动物比未施用该菌株的动物早5%-10%、10%-15%、15%-20%、20%-25%、25%-30%、30%-35%、35%-40%、40%-45%、45%-50%、50%-55%、55%-60%、60%-65%、65%-70%、70%-75%、75%-80%、80%-85%、和85%-90%、90%-95%、95%-100%、以及大于100%实现随后的受精。
在一个实施例中,本披露涉及用于改进动物的繁殖性能的方法,该方法包括:向产后动物施用有效量的短小芽孢杆菌8g-134(nrrl-b-50174)或具有短小芽孢杆菌菌株8g-134(nrrl-b-50174)的所有鉴别特征的菌株,其中施用短小芽孢杆菌8g-134(nrrl-b-50174)的动物,与未施用该菌株的动物相比,具有增加数量的的受孕。在一个实施例中,施用短小芽孢杆菌8g-134(nrrl-b-50174)的动物比未施用该菌株的动物具有多出5%-10%、10%-15%、15%-20%、20%-25%、25%-30%、30%-35%、35%-40%、40%-45%、45%-50%、50%-55%、55%-60%、60%-65%、65%-70%、70%-75%、75%-80%、80%-85%、85%-90%、90%-95%、95%-100%、以及大于100%的受孕。
用于减少炎症的方法
急性期蛋白质是一类蛋白质,其血浆浓度响应于炎症而增加(阳性急性期蛋白)或减少(阴性急性期蛋白)。这种应答称为急性期反应(也称为急性期应答)。两种阳性急性期蛋白是触珠蛋白和血清淀粉样蛋白a。触珠蛋白是一种炎症标志物,并且当动物具有导致组织损伤的感染或炎症时,动物的肝脏产生丰富的触珠蛋白。已经报道了在患有如下疾病的动物血液中的高触珠蛋白水平:乳腺炎、子宫炎、子宫积脓、创伤性蜂巢胃炎、皱胃移位、创伤性心包炎、细菌性肾炎、和肝脏脂肪沉积。
在一个实施例中,本文披露的菌株、方法、和组合物可用于减少动物中的炎症。在一个实施例中,该菌株是短小芽孢杆菌8g-134。
在一个实施例中,本披露涉及用于减少动物的炎症的方法,该方法包括:向该动物施用有效量的短小芽孢杆菌8g-134(nrrl-b-50174)或具有短小芽孢杆菌菌株8g-134(nrrl-b-50174)的所有鉴别特征的菌株,以减少动物的炎症。
在一个实施例中,动物为反刍动物。在仍另一个实施例中,该动物是乳牛。在又另一个实施例中,该动物是围产期乳牛,产犊过程中的乳牛、或产后乳牛。
在一个实施例中,本披露涉及用于减少动物的炎症的方法,该方法包括:向动物施用有效量的短小芽孢杆菌8g-134(nrrl-b-50174)或具有短小芽孢杆菌菌株8g-134(nrrl-b-50174)的所有鉴别特征的菌株,其中施用短小芽孢杆菌8g-134(nrrl-b-50174),与未施用该菌株的动物相比,减少炎症。
在一个实施例中,本披露涉及用于减少动物的炎症的方法,该方法包括:向动物施用有效量的短小芽孢杆菌8g-134(nrrl-b-50174)或具有短小芽孢杆菌菌株8g-134(nrrl-b-50174)的所有鉴别特征的菌株,其中施用短小芽孢杆菌8g-134(nrrl-b-50174),与未施用该菌株的动物相比,增加阴性急性期蛋白的水平。
在一个实施例中,本披露涉及用于减少动物的炎症的方法,该方法包括:向动物施用有效量的短小芽孢杆菌8g-134(nrrl-b-50174)或具有短小芽孢杆菌菌株8g-134(nrrl-b-50174)的所有鉴别特征的菌株,其中施用短小芽孢杆菌8g-134(nrrl-b-50174),与未施用该菌株的动物相比,降低阳性急性期蛋白的水平。在一个实施例中,阳性急性期蛋白是触珠蛋白和血清淀粉样蛋白a。
在一个实施例中,本披露涉及用于减少动物的炎症的方法,该方法包括:向动物施用有效量的短小芽孢杆菌8g-134(nrrl-b-50174)或具有短小芽孢杆菌菌株8g-134(nrrl-b-50174)的所有鉴别特征的菌株,其中施用短小芽孢杆菌8g-134(nrrl-b-50174),与未施用该菌株的动物相比,导致触珠蛋白和/或血清淀粉样蛋白a水平的降低。
在一个实施例中,本披露涉及一种用于减少动物的炎症的方法,该方法包括:从动物获得样品;确定样品中一种或多种急性期蛋白的水平;向具有指示炎症的一种或多种急性期蛋白水平的动物施用有效量的短小芽孢杆菌8g-134(nrrl-b-50174)或具有短小芽孢杆菌菌株8g-134(nrrl-b-50174)的所有鉴别特征的菌株。在一个实施例中,该样品是血液。在另一个实施例中,从围产期动物(从产前14天至产后14天)收集样品。在一个实施例中,在多个时间点收集样品以避免日变化和餐后变化。
在一个实施例中,向动物施用短小芽孢杆菌8g-134(nrrl-b-50174),与未施用该菌株的动物相比,可以降低动物中的一种或多种急性期蛋白水平一定的百分比,该百分比选自下组,该组由以下各项组成:0.1%-1%、1%-5%、5%-10%、10%-15%、15%-20%、20%-25%、25%-30%、35%-40%、40%-45%、45%-55%、55%-65%、65%-75%、75%-85%、85%-95%、以及大于95%。在又另一个实施例中,向动物施用短小芽孢杆菌8g-134(nrrl-b-50174),与未施用该菌株的动物相比,可以降低动物中的一种或多种急性期蛋白水平一定的百分比,该百分比选自下组,该组由以下各项组成:1%-10%、10%-20%、20%-40%、40%-60%、60%-80%、80%-100%以及大于100%。
在一个实施例中,向动物施用短小芽孢杆菌8g-134(nrrl-b-50174),与未施用该菌株的动物相比,可以降低动物中的触珠蛋白水平一定的百分比,该百分比选自下组,该组由以下各项组成:0.1%-1%、1%-5%、5%-10%、10%-15%、15%-20%、20%-25%、25%-30%、35%-40%、40%-45%、45%-55%、55%-65%、65%-75%、75%-85%、85%-95%、以及大于95%。在又另一个实施例中,向动物施用短小芽孢杆菌8g-134(nrrl-b-50174),与未施用该菌株的动物相比,可以降低动物中的触珠蛋白水平一定的百分比,该百分比选自下组,该组由以下各项组成:1%-10%、10%-20%、20%-40%、40%-60%、60%-80%、80%-100%以及大于100%。
在一个实施例中,向动物施用短小芽孢杆菌8g-134(nrrl-b-50174),与未施用该菌株的动物相比,可以降低动物中的血清淀粉样蛋白a水平一定的百分比,该百分比选自下组,该组由以下各项组成:0.1%-1%、1%-5%、5%-10%、10%-15%、15%-20%、20%-25%、25%-30%、35%-40%、40%-45%、45%-55%、55%-65%、65%-75%、75%-85%、85%-95%、以及大于95%。在又另一个实施例中,向动物施用短小芽孢杆菌8g-134(nrrl-b-50174),与未施用该菌株的动物相比,可以降低动物中的血清淀粉样蛋白a水平一定的百分比,该百分比选自下组,该组由以下各项组成:1%-10%、10%-20%、20%-40%、40%-60%、60%-80%、80%-100%以及大于100%。
实例
仅仅提供了用于说明性目的的以下实例。本文包括实例仅助于更全面地理解目前描述的发明。实例不以任何方式限制本文描述或要求保护的范围。
实例1
酸中毒模型实验设计:
将十只杂交肉牛按重量分区并分配到两个围栏。在干物质基础上,在激发之前,所有治疗组的每日饲料日粮由45%粗饲料和55%浓缩物组成。早晨喂养牛一次15lbs/头/天的日粮,并且剩下的饲料在下午晚些时候推近喂养支柱(feedingstanchion)。两个围栏在用浓缩饮食治疗进行激发前禁食24小时。浓缩饮食治疗由基于90%如所喂养的基础的蒸汽压片玉米的高度可发酵的碳水化合物来源组成。禁食24小时后,将浓缩饮食随意以100lbs/围栏任意量供给所有围栏(0h)。目视监测激发饮食消耗,并在必要的基础上添加额外饲料。
通过使用附接到真空瓶的收集管通过口腔插管从单个动物获得瘤胃液样品。每个围栏使用不同的烧瓶和收集管,以最小化治疗之间的微生物群的交叉污染。将真空烧瓶中收集的瘤胃液倒入无菌的50mlfalcon管中,该falcon管标有采样时间和动物鉴别号(耳标号)。在-36h、-24h、和-12h,从所有围栏中收集瘤胃样品。时间-36h和-24h样品代表每只动物的生理基线。时间-12h样品代表每只动物处于禁食状态的瘤胃液。时间0h被指定为喂养激发的开始。从+6至+22小时每4小时从所有动物收集瘤胃样品。所有围栏在+28、+36、和+48小时进行取样。采集后立即分析来自单个瘤胃样品的ph值。将所有样品冷冻并准备运往亚博科技产品公司(agtechproducts,inc.)(沃基肖,威斯康星州)进行进一步分析。
在单个瘤胃样品中测量挥发性脂肪酸和碳水化合物浓度。通过从每个时期的每只动物收集的瘤胃液中无菌取出双份1.0ml样品,来制备样品用于hplc分析。将样品置于1.5ml微量离心管中,并且通过离心(10分钟,在12,500rpm下)将碎屑沉淀。将上清液(750μl)转移到干净的管中,并用等体积的5mmh2so4酸化。将酸化液充分混合并通过0.2μm过滤器直接过滤到2mlhplc自动进样器小瓶中并加盖。使用沃特世(waters)2690hplc系统(沃特世公司(watersinc.),米尔福德(milford),马萨诸塞州)分析样品。将样品注入加热至65℃的5mmh2so4流动相中,并使用伯乐(biorad)hpx-87h柱(伯乐实验室公司(bio-radlaboratories,inc.),赫拉克勒斯(hercules),加利福尼亚州)分离。使用每种感兴趣化合物的一组浓度对hplc进行标准化。用作标准物的化合物包括右旋糖(葡萄糖)、乳酸、甲基乙二醛、丁酸、丙酸、和乙酸。
非酸性牛瘤胃微生物群落中细菌基因的发现:抑制性消减杂交:
将基因组消减试剂盒(克罗泰克公司(clontech),帕洛阿尔托(paloalto),加利福尼亚州)用于确定两组汇集的瘤胃样品之间的微生物群体差异。基于随着时间推移变化的ph和乳酸分布,进行层次聚类分析以确定动物之间的相似性和差异。聚类分析在簇1中定位了牛2069、2071、2078、2113、和2127,并且在簇2中定位了牛2107、2115、2088、2133、和2124。进行重复测量分析,以比较从簇1到簇2的ph和乳酸。分别分析所有变量。在整个激发饮食期间(图1和2),簇1比伴随着较低的平均ph(p=0.0075)的簇2(p=0.0004)具有显著更高的平均乳酸分布。来自单个动物的瘤胃液被汇集在簇内用于阻抑性消减杂交(ssh)程序。
开发了阻抑性消减杂交(ssh)策略来将在样品时间+6h、+10h、+14h、和+18h处的来自簇1中牛的汇集的瘤胃dna样品与簇2中那些进行比较。使用簇2作为测试者(非酸性牛)和簇1作为驱动者(酸性牛)进行阻抑性消减杂交。假设ssh导致来自生物体的独特的dna片段,这些dna片段导致较低水平的乳酸和较高的ph(调节瘤胃能量的生物体)。通过使用来自时间+10h的样品进行消减,发现的dna片段(基因)来自能够以rfc形式调节瘤胃环境中过剩能量利用的生物体,并减轻酸中毒的潜在影响。
克隆和筛选独特的测试者序列文库:
在消减后回收的菌株特异性dna序列被克隆以用于进一步分析。将dna序列插入到pcr2.1载体(英杰公司(invitrogen))中,并转化到大肠杆菌化学感受态的top10细胞中。将转化混合物涂布在包含50μg/ml卡那霉素的22x22cmlb琼脂平板上,并在dmf中用40mg/mlx-gal覆盖。将板在37℃下孵育24小时。将重组菌落(白色菌落)挑选到包含lb培养基和50μg/ml的卡那霉素的无菌微量滴定板中。将包含重组pcr产物的所有孔分离成1ml等分试样。使用qiaquickpcr纯化试剂盒(凯杰公司(qiagen))纯化一个等分试样,第二个等分试样通过离心沉淀,重悬于lb+kan+10%甘油中并储存在-80℃下。
dna印迹杂交:
使用标准方案进行斑点印迹杂交。为了证实克隆的dna插入片段的特异性,将带正电的
确定来自每个测试者阳性插入片段的dna序列(百灵科技有限公司(larktechnologies);休斯顿,得克萨斯州)。使用blastx功能将来自每个插入片段的序列与来自ncbi数据库的序列进行比较。翻译核苷酸序列,并且使用blastx功能通过将序列与ncbi数据库中发现的那些序列进行比较,来推导出基因功能。使用直系同源组簇(cog)网站,将基因功能放置在基因类别中。鉴别的特异性cog基因用于构建用于菌落杂交和斑点印迹杂交实验的寡核苷酸探针。基于来自非酸性牛的选择的功能属性,从ssh10中选择二十九个中的四个基因用于菌落杂交。基因选自克隆79、84、94、和110,通过使用具有分配的功能的ncbiblastx功能来鉴别:β-木糖苷酶、葡萄糖/半乳糖转运蛋白、4-α-葡聚糖转移酶、和4-α-葡聚糖转移酶。选择的用于菌落杂交的所有基因都具有如由cog鉴别的分配的性质,如碳水化合物和运输代谢功能,这将向包含这些基因的细菌在代谢过剩能量(如在用rfc激发时在瘤胃中发现的那种过剩能量)方面提供了优势。
菌落杂交:
利用在酸中毒试验期间从牛在时间+10h、+14h、和+18h处收集的瘤胃液。从这些时间段的每一个中选择牛2107、2124、2115、2088、和2133。这些牛代表先前针对“测试者群体”或非酸化组所选择的动物。从-20℃取出单个瘤胃样品,并在室温下解冻。解冻的瘤胃样品一式两份分别涂布在三个不同的培养基上。使用的培养基由乳酸钠琼脂(nla)、乳酸丙酸杆菌选择性琼脂(lpsa)、和改良的强化的梭菌培养基(rcs)组成。制备类似于商业上可获得的无葡萄糖的强化的梭菌培养基的rcs。因此,rcs中的主要碳水化合物来源是淀粉。下表1表示孵育条件和每种培养基上涂布的瘤胃液的稀释物。
孵育后,从每个板中挑出单个菌落,并接种到由接种到由各自培养基组成的10ml肉汤管中,lpsa除外,其被接种到nlb中。从每个时期和每只动物(五头牛x三个时期)选择菌落。对于rcs培养基,每个动物时期选择五个菌落。lpsa在板上表现出较少的菌落和多样性,并且每个动物时期所选择的菌落数量是可变的。从nla培养基中选择每个动物时期的两个菌落,在时期18处的动物2107除外。由于可见多样性的增加,从这个动物时期挑选了六个菌落。孵育后不是所有接种的管都显示生长。
将显示出生长的管分离成9ml和1ml两个分开的等分试样。使用高纯pcr模板制备试剂盒,将1ml等分试样用于dna分离程序(罗氏分子生物化学(rochemolecularbiochemicals);曼海姆(mannheim),德国)。将9ml等分试样转移到无菌的15mlfalcon管中并离心,直至形成固体颗粒。然后将沉淀物重组在包含10%甘油的nlb或rcs肉汤中。将重构的样品置于-80℃下以备将来使用。然后将提取的dna用于个体分离株的rapd-pcr分析,以确定分子系统进化关系。使用bio-numerics(应用数学公司(appliedmathsinc.),奥斯丁,克萨斯州)对rapddna条带图案进行分析,以确定分离株的相关性。使用dice系数和非加权组平均法(upgma)确定分离株的相似系数。使用80%以上的相似度将109个分离株分成65个单独簇。在65个簇中,23个仅在rcs上生长,11个仅在lpsa上生长,14个仅在nla上生长,4个簇在rcs和lpsa上生长,6个在rcs和nla上增长,3个在lpsa和nla上增长3个,并且发现4个簇存在于所有三种培养基上。
使用bio-dotsf微量过滤装置(伯乐公司(bio-rad);赫拉克勒斯,加利福尼亚州)制备斑点印迹杂交。选择簇内单个分离株的基因组dna代表该簇并印迹到膜上。使用pcrdig探针合成试剂盒(罗氏分子生物化学;曼海姆,德国)制备探针,用于杂交。所选择的探针衍生自上述克隆的插入片段分析,并由来自ssh10的四个克隆插入片段(克隆79、84、94、和110)组成。标记的探针在杂交前汇集。在45℃下进行杂交5小时。使比色反应在膜上显影过夜。rcs膜上37个分离株(簇)中的三十个,以及lpsa/nla膜上28个分离株(簇)中的25个,表现出如通过比色反应鉴别的杂交。
然后制备显示杂交的分离株,用于16srrna测序。简言之,通过使用引物8f(agagtttgatymtggctcag)和1406r(acgggcggtgtgtrc)的pcr扩增55个分离株中的每一个的16srrna。使用qiaquickpcr纯化试剂盒(凯杰公司,瓦伦西亚,加利福尼亚州)纯化pcr产物。通过凝胶电泳分析纯化产物。当有足够的产品可用时,将纯化的样品在冰上放置过夜,用于进行单程测序(百灵科技有限公司,休斯顿,得克萨斯州)。使用blastn功能将来自每个簇的16s序列与来自ncbi数据库的序列进行比较。从该比较中提出的感兴趣的生物体由屎肠球菌菌株8g-1、屎肠球菌菌株8g-73、和短小芽孢杆菌菌株8g-134组成。
实例2
体外菌株测试:
自两只一岁的赫里福德(hereford)小母牛收集体外试验的瘤胃液。小母牛通过鉴别标签鉴别,并且被称为101和133。喂养小母牛6lb/头/天的干酒糟(ddgs),并有机会获得自由选择窖藏半干草料。
遵循体外方案尽可能接近以减少每次试验之间的实验误差。简言之,从每只小母牛收集瘤胃液,并将其置于有标记的、预热的保温瓶中。将保温瓶运送到亚博科技产品公司进行处理。向包含mcdougall缓冲液和3.0%葡萄糖(将mcdougall缓冲液和瘤胃液混合至180ml的体积后的终浓度)的瓶子中一式两份添加瘤胃液,将其回火至39℃。将候选dfm菌株、屎肠球菌菌株8g-1、屎肠球菌菌株8g-73、和短小芽孢杆菌菌株8g-134以1.0x107cfu/ml(终浓度)添加至指定的瓶中。观察单位是瓶子,并且一式四份进行处理。处理由对照(添加了葡萄糖但不含dfm)、屎肠球菌菌株8g-1、屎肠球菌菌株8g-73、和短小芽孢杆菌菌株8g-134组成。然后用co2吹扫瓶子并加盖。将瓶子保持在39℃和140rpm下振荡水浴中。在取样前约10分钟,将瓶子短暂排出以释放作为发酵副产物产生的气体。最初以及每6小时从每个瓶中抽取出瘤胃液,直到36小时标志。测量和记录瘤胃ph和挥发性脂肪酸。使用重复测量分析进行统计分析,以确定随时间推移的dfm效应或单向方差分析,从而确定特定时间点的治疗影响。
瘤胃体外实验的重点是确定候选dfm菌株、屎肠球菌菌株8g-1、屎肠球菌菌株8g-73、和短小芽孢杆菌菌株8g-134是否能够在能量过量环境中积极地影响瘤胃发酵。在体外将过量的葡萄糖添加到每个瘤胃中,用易于发酵的碳水化合物来复制牛充血。如图3中所示,随着时间推移,每种候选菌株的添加显著增加了葡萄糖的利用(p=0.0001)。与对照(图4)相比,随着时间推移,对乳酸产量的影响也显著受添加候选dfm到激发的体外模型影响(p=0.0025)。按时间点36小时,在短小芽孢杆菌中乳酸产量减少了17%,并且在肠球菌属候选物二者中乳酸积累减少了32%。
通过hplc进行挥发性脂肪酸分析。总vfa(醋酸+丙酸+丁酸)受添加肠球菌属候选物的显著影响(p=0.0279)(图5)。肠球菌属候选物,8g-1和8g-73,似乎增加了随时间推移产生的总vfa的量。当比较短小芽孢杆菌候选物和对照的总vfa产量时,对总vfa产量没有显著影响。
体外结果表明,与对照治疗相比,候选dfm8g-1、8g-73、和8g-134通过增加葡萄糖利用而没有相应的乳酸产生的增加来影响瘤胃发酵。瘤胃中过量的葡萄糖通常以乳酸生产迅速发酵。这是驱动急性酸应答的乳酸的积累。通过利用葡萄糖而不伴随乳酸的产生,候选dfm已经证明有可能改善酸中毒的作用的潜能。瘤胃体外模型表明,这些菌株可能能够成功地调节喂养大量易于发酵的碳水化合物的牛中过量的瘤胃能量。
实例3
在喂养易于发酵性碳水化合物的牛中的候选dfm测试-急性酸中毒激发:
材料与方法:
牛和围栏分配:
在当地的销售畜棚购买了二十头杂交的肉用肉牛。在试验开始之前,将牛在研究机构安置两周,以观察发病率或死亡率。在整个治疗期间,将牛按重量随机分区。五头牛被分配到一个围栏并将围栏指定为四种治疗之一。治疗由3个围栏组成,每个围栏接收不同的dfm,如下文详细所述,第四个围栏不接收dfm(对照)。治疗分配可以参见下表2。
在激发之前,所有治疗组的每日饲料日粮由以下62.5%粗饲料和30%碎玉米和7.5%蛋白质补充剂组成(表3)。蛋白质补充剂包含以375mg/头/天喂养的莫能菌素
*两种日粮均包含莫能菌素和tylan。
早晨喂养牛一次15lbs/头/天的日粮,并且任何剩下的饲料在下午晚些时候推近喂养支柱。禁食前十四天,治疗组以上表2所指定的剂量、作为每日日粮上的追料喂养候选dfm。
以至少5x109cfu/头/天喂养短小芽孢杆菌菌株8g-134。以5x1010cfu/头/天喂养肠球菌候选物8g-1和8g-73。
候选dfm制备:
先前选择用于激发试验的候选dfm菌株是肠球菌属8g-1和8g-73;以及短小芽孢杆菌菌株8g-134。菌株保存在-80℃下。将每种培养物接种到包含mrs(man,rogosa和sharpe)或tsb(胰酶大豆培养液)的10ml肉汤管中。分别将芽孢杆菌属和肠球菌属候选物的肉汤管在32℃和37℃下孵育24小时。在各自琼脂培养基上,敲击培养物来进行分离,并孵育。将分离的菌落挑取到10ml肉汤中,并使其生长至对数中期(18至24h),并转移到新鲜肉汤(10%vol/vol转移)中。肠球菌候选物在37℃下在mrs肉汤中生长。芽孢杆菌在振荡培养箱中以130rpm在32℃下在水平tsb管中生长。对于肠球菌属的生长,将2ml转移到包含198ml肉汤的250ml瓶中并孵育18hr。
将200ml培养物接种到包含1.8l肉汤的2l瓶中,并允许孵育18hr。对于芽孢杆菌属候选物,将5ml转移到包含50ml的tsb的250烧瓶中,并且然后在振荡培养箱中在32℃下以130rpm孵育24hr。将50ml用于接种包含600ml的1l烧瓶,并允许再孵育24小时。
在收获细胞之前记录肠球菌属候选物的18hr培养物的光密度(od)。将od与先前的生长曲线进行比较,以确定培养物的cfu/ml。涂布样品,用于进行计数和基因指纹分析。通过rapd-pcr分析确定每个发酵批次之间的质量控制。在肠球菌属候选物的目标最小值为5.0e10cfu/头/天的情况下,将计算量的培养物分配到250ml的nalgen离心瓶中,并在4℃下以4500rpm旋转10min。芽孢杆菌候选物的目标最小值为5.0e9cfu/头/天,并且将总共100ml芽孢杆菌属培养物与肠球菌属类似地进行旋转沉降。丢弃上清液。将沉淀重悬于包含10%甘油的30ml生长培养基中。将该量转移至50ml锥形管中。然后将离心瓶用10ml培养液冲洗并转移至相同的锥形管中。将样品用菌株标记,收获候选物日期,和发酵批号。使用平板计数来确定每个管中的总cfu。合并各管以提供计数,针对肠球菌属候选物至少5.0e10cfu/头/天,并且针对芽孢杆菌属候选物至少5.0e9cfu//头/天。所有锥形管在-20℃下冷冻
激发饮食和瘤胃液收集阶段:
使用装有滤网并通过真空瓶附接到真空源的收集管通过瘤胃插管从单个动物获得瘤胃液样品。瘤胃液采集后,立即测量ph值,并且将样品冷冻运送至亚博科技产品公司进行vfa分析。在取样时间-12h、+6h、+10h、+14h、+18h、+22h、+30h、+36h、和+48h处,从牛收集样品,其中时间0h代表激发起始。所有饲料在时间-24h处从牛中去除,以开始禁食,并且鼓励牛在时间0处暴食激发日粮。
所有围栏在用浓缩饮食进行激发前禁食24小时(时间0)。浓缩饮食由28lb薄片重蒸汽压片玉米组成(上表3)。喂养激发日粮以递送20lbs/头。目视监测激发日粮消耗,并在必要的基础上通过剩余试验添加额外饲料。
从+6至+22小时每4小时从所有牛收集瘤胃样品。采集后立即分析每个瘤胃样品ph。然后将瘤胃液冷冻并运送至亚博科技产品公司,用于经hplc进行vfa分析。使用单个动物作为观察单位,对瘤胃ph、vfa和葡萄糖水平进行重复测量分析。在每个候选dfm治围栏和对照围栏之间随时间推移进行成对比较,以确定候选物改变瘤胃发酵模式的有效性。
结果与讨论:
在治疗过程中将平均重量为731.95lbs的二十头杂交肉用牛按重量随机分区,这样使得按重量计治疗组之间无显著差异(表4)。存在具有五头/围栏的3个治疗围栏和一个对照围栏。每围栏的治疗分配可以参见上表2。
在时间0处喂养牛激发日粮,并在指定的时间点收集瘤胃液以测量瘤胃发酵值。在24小时后监测并记录每个围栏的饲料消耗量。将平均饲料消耗量/肉牛计算为该围栏平均肉牛重量的百分比(上表4)。与其他治疗组相比,对照围栏(围栏1)似乎具有最高的饲料消耗,平均肉牛消耗其体重的4.8%。最低的激发日粮消耗/围栏是在围栏4中,平均肉牛吃掉约其体重的3.6%。所有围栏中的牛平均会消耗约5.625lbs浓缩物/天,作为激发前日粮的一部分,其平均构成平均肉牛体重的0.8%。尽管激发日粮消耗的围栏变化,但与激发前日粮的差异不大于浓缩物消耗的增加,并且不会致使围栏之间的发酵差异。
24小时后,从牛中去除饲料,并且地面草原干草随意喂养。牛被给予自由选择干草作为防止持续降低的瘤胃ph的预防措施。添加干草将刺激额外的反刍咀嚼,并帮助缓冲瘤胃。尽管添加了干草,但瘤胃ph仍然持续下降。
瘤胃液收集后立即分析样品的ph。如可在图6中所观察到的,所有治疗组均展现出瘤胃ph下降。对照组的ph在30小时处达到最低点,并且此后开始逐渐攀升。通过最后一个瘤胃样品收集,对照围栏的平均ph值仍然是急性酸中毒的,ph为4.94。急性酸中毒与值保持在5.2以下的ph有关,并且慢性或亚急性酸中毒的特征在于低于5.6的ph(owens等人,1998)。当与来自时间+22至+48的对照的平均数值相比,围栏2、3、和4中菌株8g-1、8g-73、和8g-134出现平均数值更高的趋势。这表明在这些围栏中用候选dfm治疗的牛更快地从酸中毒激发中恢复。在时间+48处,用8g-1、8g-73、和8g-134治疗的牛的平均ph分别为5.96、6.02、和6.14,其高出对照围栏大于1.0ph单位。当与对照围栏相比时,随着时间推移(+6至+48),这三种菌株的重复测量分析没有显著差异。然而,当将用8g-1、8g-73、和8g-134处理的围栏与对照围栏从时间+22h至+48h进行ph比较时,差异显著或接近显著(针对8g-1、8g-73、和8g-134分别是p=0.1562、0.0965、和0.0466)。
所有治疗组的平均乳酸分布如图7中所示。在接受激发日粮后30小时,对照围栏的平均瘤胃乳酸积累峰值为105mm。与对照围栏的乳酸积累相比,候选dfm菌株8g-1、8g-73、和8g-134再次表现出乳酸积累中可见的平均数值差异。在激发的前14个小时期间,对照牛和8g-1治疗的牛之间的平均乳酸积累是相似的。在8g-1治疗的牛中,剩余试验的后续累积水平要低得多,尽管不是那么显著(p=0.1892)。治疗围栏8g-73在时间30处显示降低水平的乳酸积累,针对剩余试验仍然低于对照围栏。从+22h开始,候选菌株8g-134还显示出降低水平的乳酸,并且直到+48h一直保持低于对照围栏。
测量和分析单个vfa。在对照围栏中,挥发性脂肪酸(vfa)浓度增加,并且在六小时处治疗8g-73和8g-134达到峰值(图8)。六个小时后,这些治疗围栏中的每一个都显示下降水平的总vfa(乙酸、丙酸和丁酸)。这些治疗与对照之间无显著性差异。然而,治疗8g-1表现出vfa下降的延迟,该延迟直到+14h才发生。在试验过程中,总vfa浓度或单个vfa(由乙酸、丙酸、或丁酸组成)水平没有显著差异。
除了在酸中毒试验的过程中监测并测量瘤胃发酵特征之外,在整个试验期间针对可见的与酸中毒相关的临床效应来观察牛。在酸中毒激发早期(+0h至+14h),激发饮食的效果最小。牛没有出现抑郁症的病征,并继续以激发日粮为食。在接受激发日粮后+22小时,除接受治疗8g-1之外的所有牛均显示出酸痛、抑郁的病征,并且具有松散的、液体粪便排泄。围栏2中的牛不再消耗饲料,但没有出现临床症状,尽管类似地具有类似下降的ph水平。
按照定义,急性瘤胃酸中毒是瘤胃ph值下降至不仅对瘤胃功能而且对家畜健康有害的水平。急性酸中毒的特征是乳酸的积累和vfa生产的下降。适当的瘤胃功能是管理饲料中可用的能量和可用氮组分的组合。当发生瘤胃新陈代谢不平衡时,通常跟随消化不良并且可表现为酸中毒。在该试验中,菌株8g-1、8g-73、和8g-134增强了瘤胃功能的恢复,如瘤胃发酵参数所指示的。
喂养8g-1屎肠球菌的牛平均更快从酸中毒激发中恢复,如通过ph恢复和乳酸下降所测量的。除测量的瘤胃发酵模式外,喂养候选dfm8g-1的牛没有表现出与酸中毒有关的临床病征。
候选菌株8g-73屎肠球菌通过试验过程改进了瘤胃发酵。对于在+48h处,在12.54mm下测试的所有候选菌株,平均乳酸水平是最低的。ph的相应增加也与恢复有关,最终ph为6.02,该最终ph比对照的最终ph高出1.08个ph单位。
候选菌株8g-134短小芽孢杆菌也在酸中毒激发期间增强了瘤胃恢复。在8g-134喂养的牛中,平均乳酸水平在时间+22h处达峰值为89mm,而对照围栏持续增加,并且时间+30小时处达峰值为105mm。在+30小时,平均乳酸水平降低至57mm。与乳酸积累一样,喂养8g-134的牛的瘤胃ph比对照的瘤胃ph更快恢复,并且发现从+22至+48h显著不同(p=0.0466)。
实例4
概述:
三十只初生和多产的荷斯坦母牛(holsteincow)通过以前的泌乳和预测生产能力(ppa)分区,并分配到三种治疗的一种中。每个治疗分配了10头牛,并且治疗组由对照组(治疗1)、治疗2和治疗3组成,该对照组接受基础全混合日粮(tmr),该治疗2和治疗3接受基础全混合日粮tmr并且从产前3周至分娩后22周分别喂养5x109和1x1010cfu/头/天的短小芽孢杆菌8g-134。主要目标是确定短小芽孢杆菌8g-134在这一时期对母牛奶产量和表现的优于对照牛的影响。次要目的是确定是否存在与喂养短小芽孢杆菌8g-134相关的剂量应答。短小芽孢杆菌8g-134方案显著增加了奶产量、奶脂肪,并且降低了体细胞计数。这些显著的短小芽孢杆菌8g-134产量效应并没有以牛体况评分、体重、干物质摄入量增加为代价而出现,或显著改变血液代谢物谱,并且将指示出短小芽孢杆菌8g-134还提供了乳牛效率益处。
材料与方法:
家畜:
在连续泌乳试验中,从分娩前3周至产后22周,将三十头荷斯坦母牛随机分配至三种膳食治疗中的一种中。针对不同治疗组,对于两岁或更老的母牛的以前的奶产量或初次泌乳母牛的预测的生产能力(ppa),没有显著差异。初次和第二次泌乳动物的数量在组间存在偏离,但不影响总体平均产量,因为在统计模型中调整了泌乳。从产前约三周至产后22周,对动物进行研究。
营养:
下表5中分别呈现了列出了干乳期和泌乳期母牛的膳食成分和全混合日粮(tmr)的配制组成。每组的基础tmr是相同的,并且差别在于追料治疗。每组接受8盎司细磨玉米的追料,该追料添加了1盎司的麦芽糖糊精(治疗1,对照),5x109cfu/头/天的芽孢杆菌属物种(治疗2)和1x1010cfu/头/天的芽孢杆菌属物种(治疗3)。
表5.提供给干乳期和泌乳期母牛的tmr的配方组成。
样品和数据收集:
收集每日tmr样品和废物并且每周复合,每周复合物每月合并,并通过坎伯兰谷分析服务公司(cumberlandvalleyanalyticalservices),莫根斯维尔(maugansville),马里兰州分析每月样品的以下各项:干物质(dm)、粗蛋白(cp)、酸性洗涤剂纤维结合蛋白(adf-cp)、中性洗涤剂纤维结合蛋白(ndf-cp)、可溶性蛋白质(sp)、酸性洗涤剂纤维(adf)、中性洗涤剂纤维(ndf)、木质素、脂肪、淀粉、糖、灰分、钙(ca)、磷(p)、镁(mg)、钾(k)、硫(s)、钠(na)、氯(cl)、铁(fe)、锰(mn)、锌(zn)和铜(cu)。
母牛每天挤奶两次,并且每次挤奶都以电子方式记录奶量,并且将上下午量总计为每天总量。每周一次,将来自上午和下午挤奶的奶样品复合,用于通过宾夕法尼亚州立学院中的乳制品奶实验室(dairyonemilklaboratory)使用fossamatic4000(foss;伊登普雷利(edenprairie),明尼苏达州)分析以下各项含量:脂肪、蛋白质、体细胞、非脂固体、以及奶尿素氮(mun)。
从产前约三周至产后22周,对动物进行研究。在产后第1、3、7、11、15和18周,通过心脏围周长估计动物体重。在收集体重的同时,由两名独立观察员评估体况。
在产后第2和8周,从尾静脉收集血液样品,收集血清,冷冻,并分析葡萄糖、β-羟基丁酸(bhb)、和非酯化脂肪酸(nefa)。使用雅培(abbott)precisionxtratm仪(雅培糖尿病保健公司(abbottdiabetescareinc.),阿拉米达(alameda),加利福尼亚州)分析葡萄糖和bhb。使用兰多克斯(randox)测定试剂盒(目录hn1530,兰多克斯实验室(randoxlaboratories),北爱尔兰),采用酶联免疫吸附测定(elisa)酶标仪,针对多个样品在波长为550nm下,来测量血清中的非酯化脂肪酸(nefa)浓度。兰多克斯试剂盒使用酰基coa合成酶和氧化酶将nefa转化为2,3-反式-烯酰-coa加过氧化物;过氧化物加n-乙基-n-(2-羟基-3-磺丙基)间二甲苯导致紫色产物,这是血清中nefa浓度的指标。
统计模型.
使用sas统计软件中的混合程序分析奶产量和含量、体重和体况评分。母牛是重复受试者,协方差矩阵设置为1型相关结构。在产后以周计总结每日奶观察。统计模型如下:
yi=ui+trtj+lactk+周l+trtj*lactk+trtj*周l+trtj*lactk*周l+ejklm
其中
yi=产量因变量的最小均方;
ui=各种生产变量的总平均值;
trtj=第j个治疗效果,1、2、3;
lactk=第k次泌乳,1、2+;
周l=第l周,1..22;
交互项(trtj*lactk+trtj*周l+trtj*lactk*周l)
ejklm=误差
使用sas中的means程序,测试每个治疗的tmr和饲料废物的每月样品的差异。
使用sas统计软件中的一般线性模型分析葡萄糖、bhb、和nefa的血液浓度。类变量为母牛、周数和治疗。将治疗嵌套在母牛中,是用于检测治疗意义的误差项。使用残差测试以周计的治疗的相互作用的统计显著性。
结果:
表6中呈现了在研究过程中干乳期和泌乳期tmr的平均tmr组成。治疗组之间的组合物没有差异。
表6.干乳期和泌乳期母牛的tmr的所分析的组成
均值的标准误差(sem),
nfc,非纤维性碳水化合物
ndf,中性洗涤剂纤维
adf,酸性洗涤剂纤维
治疗1对照;治疗2,5x109的短小芽孢杆菌8g-134;治疗3,1x1010的短小芽孢杆菌8g-134。
一个对照(治疗1)母牛表现出异常的奶产量,并且将她的数据从数据分析中删除。对29头母牛重复进行奶产量分析。奶产量显著受到治疗影响(下表7)。以5x109cfu/头/天喂养短小芽孢杆菌8g-134(治疗2)和以1x1010cfu头/天喂养短小芽孢杆菌8g-134(治疗3)的母牛比喂养安慰剂对照的母牛产生显著更多的奶。治疗2和3的母牛比治疗1产生多出约2kg奶(表7)。存在与胎次的显著的相互作用。在第二胎母牛中,产量增加5.2kg是明显的,但是在第一胎母牛中,奶产量无显著差异。
表7.从产犊至产后22周喂养微生物添加剂的荷斯坦母牛中奶产量的最小均方
具有不同上标的组内平均值不同,p<0.05
具有*的平均值变化与0显著不同
治疗1对照;治疗2,5x109的短小芽孢杆菌8g-134;治疗3,1x1010的短小芽孢杆菌8g-134。
下表8中呈现了奶脂肪和产量。通过治疗2和3显著增加了奶脂肪,高于对照。产量应答随着奶产量与脂肪产量在短小芽孢杆菌8g-134喂养的治疗组中增加。治疗2和3的短小芽孢杆菌8g-134牛产生高于对照牛的、显著更高的脂肪百分比,分别为高出0.24%和0.31%的水平(表8)。加上奶产量的显著增加,治疗2和3的每日脂肪产量提供了高于对照的、每日脂肪产量的显著增加(表8)。
表8.治疗组的奶脂肪含量
具有不同上标的列内平均值不同,p<0.05。
治疗1对照;治疗2,5x109的短小芽孢杆菌8g-134;治疗3,1x1010的短小芽孢杆菌8g-134。
线性体细胞计数(logscc)评分的对数因治疗和泌乳而不同。短小芽孢杆菌8g-134治疗(治疗2和3)比对照母牛具有显著更低的对数线性分数(下表9)。与对照母牛的logscc为5.92相比,治疗2和3母牛分别具有4.97和4.96的logscc。第二胎母牛比初次泌乳母牛具有显著更高的对数线性评分。体细胞计数与泌乳期乳牛的感染以及免疫状况和健康有关。另外,增加的scc指示对感染的炎症应答。在这里证明的scc的减少可能表明喂养短小芽孢杆菌8g-134的母牛在泌乳期间在免疫学上更好地处理传染性激发,并维持乳房和母牛的健康。
表9.治疗对体细胞计数(scc)的影响。
logscc=体细胞计数的对数
治疗1对照;治疗2,5x109的短小芽孢杆菌8g-134;治疗3,1x1010的短小芽孢杆菌8g-134。
下表10中是干乳期和泌乳期的组平均dmi数据。在整个组中,干乳期母牛的干物质摄入量范围在从10.79至11.64kg/d。针对治疗组1、2、和3,泌乳组分别消耗22.02、21.31和21.48kg/d(表10)。表10中呈现了在产后以周计的基于nrc等式的牛的预测的dmi。治疗1的摄入比预测的高出0.83kg;治疗2的摄入比预测的低出-1.37kg;治疗3的摄入比预测的低出-1.04kg。完成关于治疗2和3的奶产量增加,其中dmi没有增加。事实上,与组平均摄入量相比,基于nrc预测的预测的或预期的dmi显示出,这些奶牛少消耗1.0至1.5kg/d的dmi。因此,增加了治疗2和3的dm利用效率。
表10.就治疗组而言,组饲料摄入量、血清葡萄糖、β-羟基丁酸、非酯化脂肪酸的最小均方。
bhb=β-羟基丁酸酯
治疗1对照;治疗2,5x109的短小芽孢杆菌8g-134;治疗3,1x1010的短小芽孢杆菌8g-134;
预测的dmi=(.372*fcm+0.0968*bwt(kg)^.75)*(1-exp(-0.192*(周+3.67)))
dmi差异和产值可以表明,治疗2和3的母牛可能会比对照母牛动员更多的身体组织,以产生更多的奶,并且吃得比预期的更少。然而,血清nefa、葡萄糖、和bhb表明这些母牛处于与对照母牛相似的能量状态(上表10)。此外,相对于对照组,芽孢杆菌组的体重和bcs相似(下表11)。这表明他们没有动员更多的身体组织来产生额外的奶量,表明母牛饲料治疗2和3中的饲料转化效率与剂量无关。
表11.就治疗组而言,体重(lb)和体况评分的最小均方。体况评分是两名观察员的平均分数。
wt=重量,lbs
bcs=体况评分,按0.25分划成等级1至5;1=瘦弱,2=瘦,3=中等,4=胖,5=肥胖
治疗1对照;治疗2,5x109的短小芽孢杆菌8g-134;治疗3,1x1010的短小芽孢杆菌8g-134。
实例5
材料与方法
a.研究设计
通过泌乳、bcs、和体重分区四十八头(n=12/治疗)多产荷斯坦和荷斯坦杂交(荷斯坦×montbéliarde×瑞典红(swedishred))乳牛,并且随机分配至2×2因子设计(产前和产后淀粉[低对比高]和产后惰性石灰石载体或bp+载体的补充)。合并的因素导致4种治疗:(1)产前和产后ls+产后惰性石灰石运输(lsco);(2)产前和产后ls+产后短小芽孢杆菌8g-134(bp)(lsbp);(3)产前和产后hs+产后惰性石灰石载体(hsco);(4)产前和产后hs+产后bp(hsbp)。在tmr上每天一次通过追料28g/d的粉末产品来添加短小芽孢杆菌,以从产犊至112dim提供5x109菌落形成单位(cfu)/头/天的活的bp菌株(杜邦营养与健康公司(dupontnutritionandhealth),沃基肖,威斯康星州)。
b.血液收集与分析
相对于在0800h处产犊,每周在第-28、-21、-14、-7、1、7、14、21、28天收集血液样品。将约10ml的血液从尾静脉收集到抽空的血清管(血清分离器,bd公司(bectondickinson)真空采血管系统,富兰克林湖,新泽西州)中,样品收集后立即以2,000xg离心20min,并在-20℃下冷冻直到分析。使用nefac试剂盒(和光诊断公司(wakodiagnostic),里士满,弗吉尼亚州)测定血清nefa浓度。通过酶反应定量血清葡萄糖浓度(斯坦比奥实验室(stanbiolaboratory),伯尔内,得克萨斯州)。使用钙(偶氮胂(arsenazo))试剂组(点科技公司(pointscientific,inc.),坎顿,密歇根州)测量相对于产犊的第-7天和第1天的血清钙浓度。通过如hulbert等人(2011)所述的比色程序来确认血清触珠蛋白浓度。使用微板分光光度计(eontm,伯腾仪器有限公司(biotekinstrumentsinc.),威努斯基,佛蒙特州)对nefa、葡萄糖、钙、和触珠蛋白测定的吸光度进行定量。使用precision
c.统计分析
使用sas(9.2版,sas研究所(sasinstitute),凯利(cary),北卡罗来纳州)分析数据。分别对产前和产后数据进行分析。使用sas的mixed模型程序将产前数据作为完全随机的设计进行分析。模型包括品种、淀粉浓度、时间和淀粉浓度随时间的相互作用的影响。
使用sas的mixed模型程序将产后数据作为具有治疗的2x2因子排列的随机完全区组设计进行分析。模型包括品种,淀粉浓度,bp,时间,和淀粉、bp、和时间之间的相互作用的影响。在产前和产后期间,用自回归[ar(1)]建模随着时间推移变化的重复度量,并且使用kenwards-rogers方法估计分母的自由度。用自回归[ar(1)]建模单次测量值,并且使用satterthwaite方法估计分母的自由度。当整个f测试p≤0.05时,通过使用pdiff语句分离淀粉、bp、时间和所有相互作用的最小均方。p≤0.10时指出趋势。
结果:喂养短小芽孢杆菌8g-134降低了产后早期乳牛血液中非酯化脂肪酸(nefa)的水平
葡萄糖、β-羟基丁酸(bhba)、和非酯化脂肪酸(nefa)的血清浓度被认为是牛的能量平衡的良好指标。当母牛将能量分配给牛奶生产时,较高血nefa和β-羟基丁酸(bhba)在产后早期是典型的,并且已知与能量平衡负相关。
5x109cfu/牛/日喂养短小芽孢杆菌8g-134的多产母牛在早期泌乳期间显示血液nefa的改进,当喂养高淀粉饮食时,对奶产量没有不利影响(表12,图9)。对于喂养低淀粉饮食的母牛,还观察到产后nefa的数值减少。表13中示出了饮食的营养组成
表12.在产后第7、14、21、和28天处所测量的产后早期nefa的最小均方比较
表13.高淀粉和低淀粉饮食的营养组成
dm=干物质,cp=粗蛋白,rup=瘤胃不可降解蛋白质,adf=酸洗涤剂纤维,ndf=中性洗涤剂纤维,ne=净能量
实例6
概述
在产犊和早期泌乳期间,许多高产乳牛不能消耗足够的饲料来满足能源需求,导致负能量平衡状态。使用奶产量(数量和组成),膳食摄入量(数量和组成)和体况量化的能量平衡(eb)与产后健康和能育性有关。通常在负能量平衡状态期间,以体况评分为代价,高奶产量可以实现,因为脂肪和肌肉被动员起来支持生产,特别是在高产母牛中。体况的丧失与可能影响能育性的改变的血液代谢物和激素分布有关,并且已经证明产后7-10周具有低体况的母牛需要更长的时间才能怀孕。此外,负能量平衡与代谢性疾病如酮症有关。在酮症期间,血液中存在β-羟基丁酸(bhba)和其他酮体的积累(5),并且临床和亚临床酮症已被证明显著降低乳畜群中的产奶量约1-1.5kg奶/天(5,9)。
影响奶和身体组织之间分配的能量是平衡奶产量、健康、和生殖效率的一个策略。葡萄糖、β-羟基丁酸(bhba)、和非酯化脂肪酸(nefa)的血清浓度被认为是牛的能量平衡的良好指标。以下呈现的数据使用nefa、bhba、疾病发生率指标和免疫数据来支持短小芽孢杆菌8g-134的使用,以改进能量平衡。短小芽孢杆菌8g-134可以通过免疫调节机制影响乳牛的能量平衡,对代谢标志物(包括nefa和bhba)、代谢疾病(sck和rp)、以及最终的奶产量具有下游有利影响。预计更高的繁殖效率也将是短小芽孢杆菌8g-134施用的结果。
材料与方法
a.动物护理和棚
所有实验程序均由伊利诺伊大学厄巴纳-尚佩恩分校机构动物护理和使用委员会(universityofillinoisaturbana-champaigninstitutionalanimalcareandusecommittee)批准。在随机完全区组设计中,将四十三只多产的荷斯坦母牛分配到两种治疗。在产前期间,将母牛安置在带有单个卡兰(calan)饲料门(美国卡兰公司(americancalaninc.),诺斯伍德(northwood),新罕布什尔州)的散养栏圈中。在预期分娩前约2天,将母牛移至同一畜棚内的单个下仔栏直到分娩。在分娩后,将母牛安置在被设计用于测量饲料摄入量的具有管理员的拴养栏圈中。母牛每天挤奶三次。在实验期间,使母牛以随意摄入量进行喂养。饮食(产前和产后)根据nrc(2001)配制以满足或超过母牛的要求,并且作为全混合日粮(tmr)每日递送一次。
b.治疗与管理
dfm治疗中的母牛(dfmt,n=21)在28g麦芽糖糊精载体中接受了5.0x109cfu/母牛的短小芽孢杆菌8g-134dfm(杜邦营养与健康公司,沃基肖,威斯康星州),而对照治疗(con,n=22)中的母牛单独接受28g麦芽糖糊精载体作为安慰剂。治疗与0.45kg磨碎玉米混合,并针对每只母牛每日一次在闭合或泌乳tmr上追料。从预期的产犊日期之前的21±1天至产犊后154天施用治疗。母牛被随机分配到治疗,并且平衡初始体重(bw;针对con和dfmt分别为719±9.59kg对比715±9.78kg),胎次(针对con和dfmt分别为2.53±0.42对比2.03±0.36)和以前的泌乳期(305天)奶产量(针对con和dfmt分别为11,703±543kg对比11,389±473kg)。
c.样品收集
每周获取饲料成分和tmr样品,并通过在110℃的压力通风烘箱中干燥24小时,针对干物质(dm)含量进行分析(aoac,1995)。每周针对dm含量变化调整膳食dm。每周采集全混合日粮样品,并且储存于-20℃下直至提交用于分析。每月使用湿化学方法(乳制品公司(dairyone),伊萨卡(ithaca),纽约州)针对以下各项的含量分析混合样品:dm、粗蛋白(cp)、酸性洗涤剂纤维(adf)、中性洗涤剂纤维(ndf)、木质素、淀粉、脂肪、灰分、ca、p、mg、k、na、fe、zn、cu、mn、mo、和s。rfv、tdn、ne1、nem、neg、me和de的值由实验室提供,并基于nrc(2001)。测量每只母牛的摄入量,并且每天记录dmi。
母牛每天在0600、1400、和2100h挤奶3次。每天记录奶重量,并且每周从3次连续的挤奶中获得样品。在每次取样时连续每周样品与奶产量成比例复合并且保存(800broadspectrummicrotabsii;d&f对照系统公司,圣拉蒙,加利福尼亚州(d&fcontrolsystems,inc.,sanramon,ca))。在商业实验室(乳品实验室服务公司(dairylabservices),迪比克,艾奥瓦州),使用中红外程序(aoac,1995)分析复合奶样品的脂肪、蛋白质、乳糖、尿素n(mun)、总固体和体细胞计数(scc)。
健康障碍包括胎盘滞留(rp)、皱胃移位(da)、临床酮症(ck)、乳腺炎(mast)、和子宫炎(met)。胎盘滞留被定义为在牛犊分娩后超过12h不能完全分娩的胎盘;da是由兽医诊断的;ck是由尿分析条(ketostix,拜耳公司(bayercorp.),诊断部,埃尔克哈特,印第安纳州)诊断的;mast通过阳性微生物培养证实的改变的奶组分进行诊断;而met被定义为子宫排泄物,该子宫排泄物是恶臭的,化脓的,颜色为橙棕色。每天记录粪便评分(fs)和一般外观(ga)。根据如下(krause等人,2009),粪便评分为1到4级:1=水分过多:液体质地,在冲击时溅射,容易扩散;2=松散:可能会轻微堆积,并在冲击和沉降时适度扩散和飞溅;3=软:坚固但不硬,堆积,但在冲击和沉降时稍微扩散;4=干燥:硬,干燥的外观,原始形式不会在冲击和沉降时扭曲。一般外观评分为(krause等人,2009):1:愉快并警惕;2:抑郁;3:不愿起来。粪便评分≤2的母牛被分类为经历短暂消化问题(fs≤2),而fs>2的母牛被分类为健康(健壮)。ga≥2的母牛被分类为病态(异常),而ga<2的母牛被分类为健康(健壮)。
每头牛每周测量体重,并且体况评分(bcs)以四分之一单位增量(ferguson等人,1994)进行分配。独立地在整个实验的每次评分时,多于一名个人分配bcs。
在产犊后第5天和第14天从尾静脉或动脉收集血液样品。在用商业血液酮监测系统(precisionxtra,雅培糖尿病保健公司,阿拉米达,加利福尼亚州)收集后立即测量β-羟基丁酸酯(bhba)。具有高于1.2mmol/l的血液bhba浓度的母牛被分类为经历亚临床酮症(sck)。将血液样品收集在包含血清凝块活化剂的管(bd真空采血管;bd公司,富兰克林湖,新泽西州)中。通过以1,300×g离心15min获得血清样品,并保存在-20℃下直到分析。分析血清样品的非酯化脂肪酸(nefa),其通过酶分析来确定(nefa-hr(2),和光诊断公司,里士满,弗吉尼亚州)。具有高于0.7meq/l的nefa血清浓度的母牛被分类为高(hnefa),而具有低于0.7meq/l的nefa血清浓度的母牛被分类为低(lnefa)。基于以前由ospina(2010)等人建立的分界点,对bhba和nefa变量进行二分。根据制造商的方案,通过elisa测定(bethyl实验室,蒙哥马利,德克萨斯州),在产犊后第一周期间收集的奶和在第5天和第14天收集的血清中定量免疫球蛋白iga、igg和igm。根据制造商的方案,通过elisa测定(alpco、salem、nh)在血清样品中定量触珠蛋白。根据eckersall等人(2010)先前建立的分界点,具有低于20μg/ml的触珠蛋白血清浓度的母牛被分类为阴性的(阴性),而具有高于20μg/ml血清触球蛋白浓度的母牛被分类为阳性的(阳性)。
d.统计分析
使用sas(v9.3;sas研究所公司,凯利(cary),北卡罗来纳州)分析数据。mixed模型程序用于每周平均的感兴趣的结果dmi、bw、bcs、奶参数、和组成变量(例如,fe)。该模型包含治疗、周数、和以周计的治疗的相互作用的固定效应。在分析因变量bw和bcs时,将治疗施用前的初始测量值用作协变量。变量经历了5个协方差结构:复合对称性、1阶自回归、1阶非均质自回归、非结构化、和托普利兹矩阵(toeplitz)。在模型中使用产生最低校正赤池(akaike)信息量准则的协方差结构(littell等,1998)。母牛是实验单位,并且被认为是随机效应。周被包含在模型中作为重复测量,其中母牛作为受试者。所有性能变量都按每周平均值进行分析。计算最小均方,并与标准误差(sem)一起呈现。在模型语句中使用kenward-roger方法来估计自由度(littell等,1998)。评估残差分布的正态性和方差齐性。
使用mixed程序从产犊前后3周的干物质摄入量变化,从产犊至3周的奶产量变化,血液bhba,血浆nefa,血清和奶iga、igm、igg以及血清触珠蛋白浓度作为连续变量进行分析。针对二分变量(sck、nefa、rp、da、ck、met、mast、fs、ga和haptoglobin)使用多变量逻辑混合模型(glimmix程序)。用于每个变量的程序也在结果部分中针对每个感兴趣的结果指示出。为了更好的残差分布均匀性,针对变量nefa、scc、和触珠蛋白使用对数转化。对这些变量的表格和图表所示的平均值进行了反向转换。统计显著性宣布为p值低于0.05,并且趋势宣布为p值低于0.10。
结果
a.喂养短小芽孢杆菌8g-134减少产后早期乳牛中与负能量平衡相关的疾病。
以5x109cfu/牛/天喂养短小芽孢杆菌8g-134的多产乳牛,如通过血液bhba水平所测量的,在产后第5天,比喂养没有dfm的对照饮食的母牛,具有更低的亚临床酮病的发生率的倾向(p=0.09)(表14)。以5x109cfu/牛/天喂养短小芽孢杆菌8g-134的母牛还倾向(p=0.13)于比喂养没有dfm的对照饮食的母牛,具有更低的胎盘滞留(rp)的发生率(表15)。
表14.产后早期亚临床酮症发生率的比较
卡方,p=0.09。dfm=5x109cfu/牛/天的短小芽孢杆菌8g-134
表15.胎盘滞留发生率的比较
卡方,p=0.13。dfm=5x109cfu/母牛/天的短小芽孢杆菌8g-134
b.从产犊前第4周至产犊后第22周,来自追料短小芽孢杆菌8g-134(dfmt)或安慰剂(con)的荷斯坦母牛的血液代谢物和健康事件的多变量辑混合模型
在14dim时,当与dfmt母牛相比时,接受con的母牛具有更高可能性(or=3.21)被分类为hnefa的趋势(p=0.07)(表16)。在5dim时,当与dfmt母牛相比时,接受con的母牛具有更高可能性(or=3.85)被分类为sck的趋势(p=0.06)(表16)。在第5天或第14天,在治疗之间在血液触珠蛋白浓度上没有检测出差异(p>0.18)。在产犊后第14天,当与dfmt母牛相比时,接受con的母牛具有更高可能性(or=3.55)被分类为阳性的趋势(p=0.09)(表14)。
在奶或血清样品中的igg和igm浓度方面没有差异(p>0.25)。当与con相比时,在第一周期间,来自dfmt母牛的iga奶浓度更高(p=0.03),然而,在治疗之间的血清iga浓度方面没有差异(p=0.42)。关于血清触珠蛋白,在14dim时,当与dfmt母牛相比时,接受con的母牛具有更高可能性(or=3.55)被分类为阳性的趋势(p=0.09)(表16)。
产犊后,与dfmt母牛相比,接受con的奶牛显示出过量的脂肪组织动员的病征,如由bhba和nefa的较高水平所指示的(表16)。dfmt改进了乳腺中的免疫力,并且降低了触珠蛋白应答升高的发生率。所有测量的健康事件如表16中所示。当分析其频率时,当与dfm母牛相比时,接受con的母牛倾向(p=0.08)于具有更高的消化事件概率(表16)。
d.追料短小芽孢杆菌8g-134(dfmt)的荷斯坦母牛的奶产量
当施用短小芽孢杆菌8g-134时,保持奶产量,同时nefa较低(参见上文数据和表17)。典型地,当观察到较低nefa时,还观察到了较低的奶产量,这是所不希望的。在这种情况下,保持奶产量,同时降低nefa水平,这指示出所治疗的母牛不需要以与对照动物相同程度地动员身体脂肪资源,以便产生相同量的奶-节省能源以及健康益处。
表17.从产犊前第4周至产犊后第22周,追料短小芽孢杆菌8g-134(dfmt)或安慰剂(con)的荷斯坦母牛的奶参数应答(最小均方)。
e.追料短小芽孢杆菌8g-134(dfmt)免疫球蛋白a的荷斯坦母牛的奶中的iga具有保护作用,这些保护作用将有助于防御乳腺中的病原体。
当与con相比时,来自dfmt母牛的iga奶浓度更高(参见表18)。通常在粘膜部位发现的免疫球蛋白a与细菌细胞结合并防止其与上皮细胞的粘附。由dfmt提供的另外的免疫防御可以解释dfmt和con母牛之间触珠蛋白水平的差异。在健康的母牛中,血清触珠蛋白浓度低于20μg/ml。响应于疾病如乳腺炎或子宫内膜炎,触珠蛋白血清浓度可增加100倍或更多。乳腺中iga的增加可以提供针对感染的更好保护,降低疾病的发生率并且降低升高的触珠蛋白浓度。升高的奶免疫球蛋白还具有通过被动转移免疫力来增加新生牛犊健康的附加益处。特别地,iga在牛犊胃肠道中提供了粘膜保护,有助于形成健康的免疫系统和肠道微生物群。
表18.在相对于产犊的5天和14天,从产犊前第4周至产犊后第22周,来自追料短小芽孢杆菌8g-134(dfm)和安慰剂(con)的荷斯坦母牛的奶中的iga的最小均方。
1con和dfm治疗中使用的观察。
2在泌乳第一周收集的样品。
实例7
在产后60天,从30头乳牛中的每头收集奶。通过流式细胞术分析奶中的外周血单核细胞。以5x109cfu/牛/天喂养短小芽孢杆菌8g-134的母牛具有增加的t细胞表面标志物cd4、cd8、cd62l、cd25、和cd45ro的表达(图10和11)(p<0.05)。t细胞标志物的增强表达可以帮助母牛从在分娩期间自然发生的免疫抑制更快恢复,增加对乳腺炎和其他常见的产后疾病的抗性。
这些标志物的更多表达产生了t细胞群体,这些t细胞群体可以更有效并高效地对抗致病性激发,因此促进对动物的就能量消耗而言成本较低的免疫应答。免疫抑制可以导致繁殖问题,如子宫炎和胎盘滞留,并增加对疾病如乳腺炎的易感性,所有这些都导致降低的奶产量。在施用短小芽孢杆菌8g-134的情况下,更有效的免疫应答和较少的产后疾病将可能导致增加的用于奶生产的能量。
实例8
在中晚泌乳期,母牛必须恢复在早期泌乳期所丢失的体况,才能将能量分配给牛犊的胎儿生长。然而,在帮助母牛恢复体况中,必须注意避免过度调理或过度肥胖,因为产犊前具有高体况评分的母牛显示出产后较高的体况损失,这些损失负面影响怀孕率并可能花费更多的时间在负能量平衡方面,导致产生经济后果的代谢紊乱和生殖问题。
已经观察到,过度调理的母牛在产犊后更可能经历酮症、脂肪肝和皱胃移位。因此,体况的健康平衡避免了瘦牛或超重牛的极端,对于保持乳牛的健康、康乐和生产性能至关重要。此外,胎次对母牛适当分配能源的能力有影响。结果表明,在泌乳期头一个月期间,胎次高于3的多产母牛与初次分娩的母牛相比具有更高的体况损失(p<0.01),并且在泌乳的第3个月期间,胎次高于4的多产母牛的体况恢复比胎次低于3的母牛的恢复更慢(p<0.01)。在生产和经济结果方面,这可能对母牛的寿命产生负面影响。
短小芽孢杆菌8g-134,当每天向高产乳牛喂养持续12周时,改进了奶产量1.62kg/天(对于治疗的和没有治疗的母牛分别是48.72和47.10kg/天,p<0.05),而且还促进了降低奶蛋白质%的趋势(对于治疗的和没有治疗的母牛分别是3.04%和3.11%,p=0.06),并且促进乳脂肪%的数值下降(对于治疗的和没有治疗的母牛分别是3.58%和3.70%,p=0.19,表19)。
表19.经治疗的生产和组分最小均方(+/-se),其中产奶天数(dim)分类包含在持续12周的母牛研究的统计模型中
1研究84天后每日奶产量
2模型包括围栏、泌乳组、dim类(<100dim(62头对照母牛,75头trt母牛),101-200dim(77头对照母牛,58头trt母牛)和>201dim(6头对照母牛,16头trt母牛))的固定效应,及其双向相互作用以及围栏中母牛的随机效应。
3基于约3个组分测试天数的每周平均奶产量
43.5%fcm,kg=((0.4255*奶,lbs)+(16.425*(%奶脂肪/100))*奶,lbs)/2.2)
5预试验scc作为协变量(p<0.0001)
在泌乳早期和晚期(<100dim或>200dim,图12)中,主要观察到奶脂肪的数值下降。还证实了改进的奶生产的持续性,因为接受短小芽孢杆菌8g-134治疗的晚期泌乳母牛(>200dim)比对照动物具有增加奶产量的趋势(+2.01kg/天,p=0.06)。在晚期泌乳期间改进奶生产的持续性是可以用来防止过度调理的一种策略。我们的结果表明,短小芽孢杆菌8g-134补充改变了能量吸收和分配,以更有效的利用能量。补充短小芽孢杆菌8g-134可能有助于在整个泌乳期促进适当的能量分配,从而在母牛达到干乳期时支持改进的体况和能量平衡。
总之,结果表明短小芽孢杆菌8g-134可以通过免疫调节机制影响乳牛的能量平衡,对代谢标志物(包括nefa和bhba)、代谢疾病(sck和rp)、以及奶产量具有下游有利影响。预计更高的繁殖效率将是短小芽孢杆菌8g-134施用的结果。
实例9
材料与方法
材料与方法如实例5中所描述。
结果
产后nefa浓度不受淀粉影响(p=0.29),但是针对bp补充治疗它是较低的(p=0.05)(参见表20)。与lsco相比,分配至lsbp的母牛具有52.2μeq/l较低nefa浓度,并且与hsco相比,分配至hsbp的母牛具有161μeq/l较低nefa浓度。
表20.多产母牛的泌乳早期(第1-4周)血清代谢物的最小均方
1产前和产后低淀粉+产后载体(lsco);产前和产后低淀粉+产后短小芽孢杆菌(lsbp);产前和产后高淀粉+产后载体(hsco);产前和产后高淀粉+产后短小芽孢杆菌(hsbp);产前饮食:ls(12%淀粉)、和hs(19%淀粉)。产后饮食:ls(20%淀粉)、和hs(27%淀粉)。28g/d粉末产品的量追料在tmr上,提供5x109cfu/头/天的芽短小芽孢杆菌(bp)。
2淀粉效应。
3短小芽孢杆菌效应。
4淀粉和短小芽孢杆菌的相互作用。
5在产犊后第7、14、21和28天收集血液。
此外,贯穿产犊后28天,分别与lsbp和hsbp相比,lsco和hsco的nefa浓度一致更高(图13)。类似地,补充有bp的母牛的较低nefa浓度,反映了在相同治疗方式下较低bhba浓度的趋势(p=0.07)。分配到lsbp的母牛倾向于具有比lsco低2.5mg/dl的bhba浓度,并且分配到hsbp的母牛具有比hsco低6.5mg/dlbhba浓度。此外,贯穿产犊后28天,分别与lsbp和hsbp相比,lsco和hsco的bhba浓度一致更高(图13)。
由于nefa的降低和bhba的降低,当向泌乳早期母牛喂养时短小芽孢杆菌补充可能是有利的,这表明身体脂质动员的减少。
应当理解,上文显示和描述了各种优选实施例,以说明本文所述的不同可能特性以及可组合这些特征的变化方式。除了以各种方式组合上述实施例的不同特性之外,其他修改也被认为在本文所述的范围内。本发明不旨在局限于上述优选的实施例。
参考书目
allison,m.j.,m.robinson,r.w.dougherty,andj.a.bucklin.1975.grainoverloadincattleandsheep:changesinmicrobialpopulationsinthececumandrumen.amer.j.vetres.36:181。
dunlop,r.h..1972.pathogenesisofruminantlacticacidosis.adv.vetsci.compmed.16:259。
elam,c.j.1976.acidosisinfeedlotcattle:practicalobservations.j.anim.sci.43:898。
hungate,r.e.,r.w.dougherty,m.p.bryant,andr.m.cello.1952.microbiologicalandphysiologicalchangesassociatedwithacuteindigestioninsheep.cornellvet.42:423。
muir,l.a.,e.l.rickes,p.f.duquette,andg.e.smith.1981.preventionofinducedlacticacidosisincattlebythiopeptin.j.anim.sci.52:635。
owens,f.n.,secrist,d.s.,hill,w.j.,gill,d.r.1998.acidosisincattle:areview.j.anim.sci.76:275-286。
slyter,l.l.1976.influenceofacidosisonrumenfunction.j.anim.sci.43:910。
yang,w.,2004.effectsofdirect-fedmicrobialsupplementationonruminalacidosis,digestibility,andbacterialproteinsynthesisincontinuousculture.animalfeedscienceandtechnology,114(4):179-193。
- 还没有人留言评论。精彩留言会获得点赞!