一种载益生菌的微胶囊的制备方法及由其制得产品和应用与流程
本发明属于微生物技术领域,具体涉及一种载益生菌的微胶囊的制备方法及由其制得产品和应用。
背景技术:
益生菌是可改善宿主肠道微生态平衡,对宿主有益的活性微生物,定植于人体肠道、生殖系统内,能产生确切健康功效。当一定数量的益生菌被人体摄入后,将产生诸多促进健康的作用,包括控制肠道感染、增强免疫力、调节血浆及胆固醇水平、抗癌,对于患有乳糖不耐症的患者可以促进他们对乳糖的利用。近年来越来越多的研究证实益生菌能够抑制致病菌生长,消除致癌因子,维持肠道正常菌群,而且具有缓解乳糖不耐症,降低胆固醇,提高免疫力等重要生理功效。当益生菌缺乏时,就会导致肠道菌群失调、腐败细菌滋生、肠道蠕动减弱、免疫功能低下以及合成b族维生素功能下降等不利影响。
很多益生菌口服经过胃的强酸环境时容易失活,导致其在肠道发挥的活性作用较弱,为了最大限度保证益生菌在肠道中的活性,发挥肠道菌群调节作用的有益功效,将益生菌微胶囊化可以起到很好的隔离保护作用,使其到达肠道时发挥更好的功效。嗜酸乳杆菌,为乳杆菌属,革兰式阳性杆菌,广泛存在人体和一些动物肠道内。
cn104911171a公开了以海藻酸钠、明胶复合凹土制备益生菌微胶囊的方法,该方法首先是纯化凹土,其次将凹土与海藻酸钠、明胶混合成复合壁材,接着将已制备好的益生菌菌悬液在一定的条件下与上述复合壁材混合均匀,然后缓慢滴入cacl2中固化成型,最后真空冷冻法干燥,获得益生菌微胶囊,此方法制备得到的益生菌微胶囊包埋物质的活性较低和存活率较低。
cn102228235a公开了一种益生菌微胶囊的制备方法及其应用,采用将海藻酸钠溶液与变性淀粉溶液等体积混合,再与益生菌混合,通过喷雾器喷嘴喷入cacl2溶液中,静置固化后生理盐水洗涤过滤,这种方法虽然在一定程度增强了胶囊壁得机械强度,但是所得到的胶囊大小难于控制,很难应用于食品以及药品当中工业生产,而且加入变性淀粉后,微胶囊的ph敏感释放的特性减弱,导致其在浸入胃部后,部分微胶囊在胃部的酸性环境下表面无法变得致密,而在肠道的弱酸环境下又无法迅速崩解,释放出包埋的益生菌。
因此,开发一种能保持所包埋物质的活性且易于释放的载益生菌的微胶囊的制备方法,是本领域目前亟待解决的问题。
技术实现要素:
针对现有技术的不足,本发明的目的在于提供一种载益生菌的微胶囊的制备方法及由其制得产品和应用,所述方法制备得到的载益生菌的微胶囊,具有胶囊球形佳、粒径小、分散性好,ph敏感性好,且在肠道易于释放的优点,可满足后续动物体内评价需求。
为达到此发明目的,本发明采用以下技术方案:
第一方面,本发明提供一种载益生菌的微胶囊的制备方法,所述方法包括如下步骤:
(1)将海藻酸钠溶于溶剂中,得到海藻酸钠溶液;
(2)将益生菌与步骤(1)得到的海藻酸钠溶液混合均匀,得到益生菌悬浮液;
(3)向步骤(2)得到的益生菌悬浮液中喷入盐溶液,搅拌固化,得到所述载益生菌的微胶囊。
本发明采用海藻酸钠作为益生菌微胶囊的壁材,由于海藻酸钠具有良好的生物相容特性和生物可降解特性,海藻酸钠可在某些二价阳离子如钙、钡存在时吸收水分生成凝胶,可用于微胶囊的制备。另外,海藻酸盐微胶囊具有优良的ph敏感释放的特性,在酸性环境下表面更为致密,保护所包埋的益生菌,而在肠道的ph环境下,能够迅速崩解,释放出包埋的益生菌,发挥调节肠道菌群的作用。喷雾干燥法应用最广泛,具有操作简单,成本较低的优点。本发明所述的制备方法采用海藻酸钠作为微胶囊的壁材,喷雾法结合离子固化法制备微胶囊,两种方法协同作用,以实现微胶囊球形佳,粒径小,分散性好,可满足后续动物体内评价需求的目的。
优选地,步骤(1)所述溶剂为水和/或氯化钠水溶液,优选为氯化钠水溶液。
优选地,所述氯化钠水溶液的质量百分浓度为0.85-0.9%,例如可以是0.85%、0.86%、0.87%、0.88%、0.89%、0.9%。
优选地,步骤(1)所述溶剂为生理盐水。
优选地,步骤(1)所述海藻酸钠溶液的质量百分浓度为0.5-3%,例如可以是0.5%、0.6%、0.7%、0.8%、0.9%、1%、1.2%、1.4%、1.6%、1.8%、1.9%、2%、2.2%、2.4%、2.6%、2.8%、3%。
优选地,步骤(2)所述益生菌的加入量为108-1011cfu/ml,例如可以是1×108cfu/ml、2×108cfu/ml、3×108cfu/ml、4×108cfu/ml、5×108cfu/ml、6×108cfu/ml、7×108cfu/ml、8×108cfu/ml、9×108cfu/ml、1×109cfu/ml、2×109cfu/ml、3×109cfu/ml、4×109cfu/ml、5×109cfu/ml、6×109cfu/ml、7×109cfu/ml、8×109cfu/ml、9×109cfu/ml、1×1010cfu/ml、2×1010cfu/ml、3×1010cfu/ml、4×1010cfu/ml、5×1010cfu/ml、6×1010cfu/ml、7×1010cfu/ml、8×1010cfu/ml、9×1010cfu/ml、1×1011cfu/ml。
优选地,步骤(2)所述益生菌选自嗜酸乳杆菌、双歧杆菌或革兰氏阳性球菌中的任意一种或至少两种的组合。
优选地,步骤(3)所述喷入盐溶液的方式为通过喷雾干燥器的喷嘴喷入。
优选地,所述盐溶液为钙盐溶液。
优选地,所述钙盐溶液的浓度为0.5-1.5mol/l,例如可以是0.5mol/l、0.6mol/l、0.7mol/l、0.8mol/l、0.9mol/l、1mol/l、1.1mol/l、1.2mol/l、1.3mol/l、1.4mol/l、1.5mol/l。
优选地,所述钙盐溶液包括葡萄糖酸钙、磷酸氢钙、乳酸钙、硫酸钙或氯化钙中的任意一种或至少两种的组合,优选为氯化钙。
优选地,所述喷入离子溶液的气速为450-550l/h,例如可以是450l/h、460l/h、470l/h、480l/h、490l/h、500l/h、510l/h、520l/h、530l/h、540l/h、550l/h。
优选地,所述喷雾干燥器进料速度为1-3ml/min,例如可以是1ml/min、1.2ml/min、1.4ml/min、1.6ml/min、1.8ml/min、2ml/min、2.2ml/min、2.4ml/min、2.6ml/min、2.8ml/min、3ml/min。
本发明提供一种提高微胶囊包埋率及胃肠道敏感释放的海藻酸钙微胶囊制备工艺,该制备工艺通过控制微胶囊形成过程中的喷入含芯材的壁材悬浮液的气速和喷射装置的料液进料速度,进一步提高微胶囊包埋率,同时形成的海藻酸钙微胶囊具有在胃部酸性环境下形成致密保护层、不释放包埋物质,而到达呈中性至弱碱性的肠道后交联的钙离子价键能够迅速解离,释放微胶囊中包埋的芯材物质,使其具备良好的ph敏感释放行为。同时,通过喷嘴尺寸选择、喷射工艺控制,还能够控制胶囊大小,进而提高微胶囊的整体性能。
优选地,步骤(3)后还包括步骤(4):将步骤(3)得到的载益生菌的微胶囊洗涤、收集,悬浮保存在溶剂中。
优选地,所述洗涤为离心洗涤。
优选地,所述溶剂为生理盐水。
优选地,所述方法包括如下步骤:
(1)将海藻酸钠溶于溶剂中,得到质量百分浓度为0.5-3%的海藻酸钠溶液;
(2)将益生菌与步骤(1)得到的海藻酸钠溶液缓慢搅拌混合均匀,所述益生菌的加入量为108-1011cfu/ml,得到益生菌悬浮液;
(3)将步骤(2)得到的益生菌悬浮液,通过喷射装置的喷嘴喷入钙盐溶液中,所述钙盐溶液浓度为0.5-1.5mol/l,喷入气速为450-550l/h,喷雾干燥器进料速度为1-3ml/min,搅拌固化,得到载益生菌的微胶囊;
(4)将步骤(3)得到的载益生菌的微胶囊进行离心洗涤、收集,悬浮保存在生理盐水中。
第二方面,本发明提供一种如第一方面所述载益生菌的微胶囊的制备方法制备得到的载益生菌的微胶囊。
优选地,所述微胶囊的粒径为25-40μm,例如可以是25μm、26μm、27μm、28μm、29μm、30μm、31μm、32μm、34μm、35μm、36μm、37μm、38μm、39μm、40μm。
优选地,所述微胶囊的粒径为30-35μm。
第三方面,本发明提供一种如第二方面所述载益生菌的微胶囊的用途,所述微胶囊用于制备保健食品、饮料食品、临床营养制剂、药物微囊制剂或化妆品。
相对于现有技术,本发明具有以下有益效果:
(1)本发明所述的载益生菌的微胶囊的制备方法,解决了传统方法制备益生菌微胶囊粒径大、球形不规整、分散性差、成本高、制备繁琐的问题。
(2)本发明的益生菌微胶囊粒径为25-40μm,ph敏感性佳,在酸性环境下表面更为致密,保护所包埋的益生菌,而在肠道的ph环境下,能够迅速崩解,释放出包埋的益生菌,可满足后续动物体内评价需求。
附图说明
图1为嗜酸乳杆菌光学显微镜表征图。
图2是嗜酸乳杆菌扫描电镜表征图。
图3是实施例1制备的载有嗜酸乳杆菌微胶囊光学显微镜表征图。
图4是实施例1制备的载有嗜酸乳杆菌微胶囊扫描电镜表征图。
图5是实施例1制备的载有嗜酸乳杆菌微胶囊的粒径及粒径分布图。
图6a是实施例1制备的载有嗜酸乳杆菌微胶囊在ph=1.2的环境下表面的形态。
图6b是实施例1制备的载有嗜酸乳杆菌微胶囊在ph=1.2的环境下表面的形态局部放大图。
图6c是实施例1制备的载有嗜酸乳杆菌微胶囊在ph=6.8的环境下表面的形态。
图6d是实施例1制备的载有嗜酸乳杆菌微胶囊在ph=6.8的环境下表面的形态局部放大图。
图6e是对比例5制备的载有嗜酸乳杆菌微胶囊在ph=1.2的环境下表面的形态。
图6f是对比例5制备的载有嗜酸乳杆菌微胶囊在ph=1.2的环境下表面的形态局部放大图。
图6g是对比例5制备的载有嗜酸乳杆菌微胶囊在ph=6.8的环境下表面的形态。
图6h是对比例5制备的载有嗜酸乳杆菌微胶囊在ph=6.8的环境下表面的形态局部放大图。
图7a是未给药的小鼠肠道细胞增殖的免疫组化图。
图7b是未给药的小鼠肠道细胞增殖的免疫组化图的局部放大图。
图7c是生理盐水灌胃后第7天小鼠肠道细胞增殖的免疫组化图。
图7d是嗜酸乳杆菌液灌胃后第7天小鼠肠道细胞增殖的免疫组化图。
图7e是实施例1制备的水灌载嗜酸乳杆菌微囊低剂量灌胃后第7天小鼠肠道细胞增殖的免疫组化图。
图7f是实施例1制备的水灌载嗜酸乳杆菌微囊中剂量灌胃后第7天小鼠肠道细胞增殖的免疫组化图。
图7g是实施例1制备的水灌载嗜酸乳杆菌微囊高剂量灌胃后第7天小鼠肠道细胞增殖的免疫组化图。
图7h是生理盐水灌胃后第14天小鼠肠道细胞增殖的免疫组化图。
图7i是嗜酸乳杆菌液灌胃后第14天小鼠肠道细胞增殖的免疫组化图。
图7j是实施例1制备的水灌载嗜酸乳杆菌微囊低剂量灌胃后第14天小鼠肠道细胞增殖的免疫组化图。
图7k是实施例1制备的水灌载嗜酸乳杆菌微囊中剂量灌胃后第14天小鼠肠道细胞增殖的免疫组化图。
图7l是实施例1制备的水灌载嗜酸乳杆菌微囊高剂量灌胃后第14天小鼠肠道细胞增殖的免疫组化图。
图7m是生理盐水灌胃后第21天小鼠肠道细胞增殖的免疫组化图。
图7n是嗜酸乳杆菌液灌胃后第21天小鼠肠道细胞增殖的免疫组化图。
图7o是实施例1制备的水灌载嗜酸乳杆菌微囊低剂量灌胃后第21天小鼠肠道细胞增殖的免疫组化图。
图7p是实施例1制备的水灌载嗜酸乳杆菌微囊中剂量灌胃后第21天小鼠肠道细胞增殖的免疫组化图。
图7q是实施例1制备的水灌载嗜酸乳杆菌微囊高剂量灌胃后第21天小鼠肠道细胞增殖的免疫组化图。
图8a是实施例1制备的载有嗜酸乳杆菌微胶囊灌胃后小鼠肠道细胞增殖的统计柱状图。
图8b是实施例1制备的载有嗜酸乳杆菌微胶囊灌胃后小鼠肠道细胞增殖的统计曲线图。
图9是实施例1制备的载有嗜酸乳杆菌微胶囊对小肠巨噬细胞活性影响统计柱状图。
图10a是实施例1制备的载有嗜酸乳杆菌微胶囊对淋巴细胞亚群的影响的代表性流式图。
图10b是实施例1制备的载有嗜酸乳杆菌微胶囊对辅助性t淋巴细胞影响的统计图。
图10c是实施例1制备的载有嗜酸乳杆菌微胶囊对抑制性/细胞毒性t淋巴细胞影响的统计图。
具体实施方式
下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
实施例1
本实施例提供一种载嗜酸乳杆菌微胶囊的制备方法:
(1)将海藻酸钠溶于生理盐水中,制备成海藻酸钠溶液,其中海藻酸钠溶液的浓度为2wt%;
(2)将嗜酸乳杆菌液与海藻酸钠溶液混合,缓慢搅拌,使其混合均匀形成悬浮液,其中加入的嗜酸乳杆菌液的量为109cfu/ml;
(3)将步骤(2)中的悬浮液,在500l/h气速下,喷雾干燥器的进料速度设置为2ml/min,通过喷雾干燥器的喷嘴喷入1mol/l氯化钙溶液中,缓慢搅拌固化液滴,形成微胶囊;
(4)离心洗涤去除多余的氯化钙和未固化的液滴,收集制备的微胶囊,悬浮保存在生理盐水中。
其中,所述嗜酸乳杆菌的准备及检测如下:
采用光学显微镜和扫描电子显微镜对嗜酸乳杆菌的形貌进行观察,嗜酸乳杆菌光学显微镜表征如图1所示,嗜酸乳杆菌扫描电镜表征如图2所示。通过革兰氏染色法对嗜酸乳杆菌进行鉴别,图1结果显示:包埋用的嗜酸乳杆菌为革兰式阳性菌;采用扫描电子显微镜观察了嗜酸乳杆菌的形貌,图2为放大5,000倍下的嗜酸乳杆菌的形貌,结果显示:嗜酸乳杆菌为杆状菌,杆的末端呈圆形,长度约为2-3μm,杆的截面直径约为600nm左右。
实施例2
本实施例提供一种载嗜酸乳杆菌微胶囊的制备方法:
(1)将海藻酸钠溶于生理盐水中,制备成海藻酸钠溶液,其中海藻酸钠溶液的浓度为0.5wt%;
(2)将嗜酸乳杆菌液与海藻酸钠溶液混合,缓慢搅拌,使其混合均匀形成悬浮液,其中加入的嗜酸乳杆菌液的量为108cfu/ml;
(3)将步骤(2)中的悬浮液,在450l/h气速下,喷雾干燥器的进料速度设置为1ml/min,通过喷雾干燥器的喷嘴喷入0.5mol/l氯化钙溶液中,缓慢搅拌固化液滴,形成微胶囊;
(4)离心洗涤去除多余的氯化钙和未固化的液滴,收集制备的微胶囊,悬浮保存在生理盐水中。
其中,所述嗜酸乳杆菌的准备及检测方法同实施例1。
实施例3
本实施例提供一种载嗜酸乳杆菌微胶囊的制备方法:
(1)将海藻酸钠溶于生理盐水中,制备成海藻酸钠溶液,其中海藻酸钠溶液的浓度为3wt%;
(2)将嗜酸乳杆菌液与海藻酸钠溶液混合,缓慢搅拌,使其混合均匀形成悬浮液,其中加入的嗜酸乳杆菌液的量为1010cfu/ml;
(3)将步骤(2)中的悬浮液,在550l/h气速下,喷雾干燥器的进料速度设置为3ml/min,通过喷雾干燥器的喷嘴喷入1.5mol/l氯化钙溶液中,缓慢搅拌固化液滴,形成微胶囊;
(4)离心洗涤去除多余的氯化钙和未固化的液滴,收集制备的微胶囊,悬浮保存在生理盐水中。
其中,所述嗜酸乳杆菌的准备及检测方法同实施例1。
实施例4
本实施例提供一种载嗜酸乳杆菌微胶囊的制备方法:
(1)将海藻酸钠溶于生理盐水中,制备成海藻酸钠溶液,其中海藻酸钠溶液的浓度为2wt%;
(2)将嗜酸乳杆菌液与海藻酸钠溶液混合,缓慢搅拌,使其混合均匀形成悬浮液,其中加入的嗜酸乳杆菌液的量为1011cfu/ml;
(3)将步骤(2)中的悬浮液,在500l/h气速下,喷雾干燥器的进料速度设置为2ml/min,通过喷雾干燥器的喷嘴喷入1mol/l氯化钙溶液中,缓慢搅拌固化液滴,形成微胶囊;
(4)离心洗涤去除多余的氯化钙和未固化的液滴,收集制备的微胶囊,悬浮保存在生理盐水中。
其中,所述嗜酸乳杆菌的准备及检测方法同实施例1。
实施例5
本实施例提供一种载双歧杆菌微胶囊的制备方法:
(1)将海藻酸钠溶于生理盐水中,制备成海藻酸钠溶液,其中海藻酸钠溶液的浓度为2wt%;
(2)将双歧杆菌液与海藻酸钠溶液混合,缓慢搅拌,使其混合均匀形成悬浮液,其中加入的双歧杆菌杆菌液的量为1011cfu/ml;
(3)将步骤(2)中的悬浮液,在500l/h气速下,喷雾干燥器的进料速度设置为2ml/min,通过喷雾干燥器的喷嘴喷入1mol/l氯化钙溶液中,缓慢搅拌固化液滴,形成微胶囊;
(4)离心洗涤去除多余的氯化钙和未固化的液滴,收集制备的微胶囊,悬浮保存在生理盐水中。
对比例1
本对比例制备方法同实施例1,区别仅在于:步骤(3)所述喷入盐溶液的气速为300l/h,所述喷雾干燥器进料速度为5ml/min。
对比例2
本对比例制备方法同实施例1,区别仅在于:步骤(3)所述喷入离子溶液的气速为600l/h,所述喷雾干燥器进料速度为5ml/min。
对比例3
本对比例制备方法同实施例1,区别仅在于:步骤(3)所述喷入盐溶液的气速为300l/h,所述喷雾干燥器进料速度为0.5ml/min。
对比例4
本对比例制备方法同实施例1,区别仅在于:步骤(3)所述喷入离子溶液的气速为600l/h,所述喷雾干燥器进料速度为0.5ml/min。
对比例5
本对比例制备方法同实施例1,区别仅在于:步骤(1)将海藻酸钠和变性淀粉的混合物溶于生理盐水中,所述海藻酸钠和变性淀粉的质量比为1:1,制备成海藻酸钠和淀粉混合液。
试验例1
微胶囊的粒径测定
取实施例1-5制备的载益生菌微胶囊和对比例1-5制备的微胶囊重悬于生理盐水中,超声分散后,将其滴加到激光粒度仪的样品池中,进行体积平均粒径(d4,3)及粒径分布(span)的测定。微囊的粒径大小及粒径分布采用激光粒度仪进行测定,实施例1制备的载有嗜酸乳杆菌微胶囊的粒径及粒径分布图如图5所示,实施例1-5制备的载益生菌微胶囊和对比例1-5制备的微胶囊平均粒径大小如表1所示。
表1
由表1的测试数据可知,实施例1-5制备的载益生菌微胶颗粒在25-40μm之间,本发明所述流程工艺能够控制胶囊大小,获得颗粒粒径小便于人体吸收的微囊,微胶囊的整体性能得以提高。说明本发明所述的制备方法采用海藻酸钠作为微胶囊的壁材,喷雾法结合离子固化法制备微胶囊,两种方法协同作用,能够实现微胶囊球形佳、粒径小、分散性好,可满足后续动物体内评价需求的目的。
试验例2
包埋率测试
取实施例1-5制备的载益生菌微胶囊和对比例1-5制备的微胶囊进行包埋率测试,所述测试方法包括步骤:实施例1-5制备的载益生菌微胶囊和对比例1-5制备的微胶囊包埋率如表2所示:
表2
由表2的测试数据可知,实施例1-5制备的载益生菌微胶囊包埋率在75%以上,这充分说明本发明的制备工艺通过控制微胶囊形成过程中的喷入含芯材的壁材悬浮液的气速和喷射装置的料液进料速度,能够进一步提高微胶囊包埋率,可满足后续动物体内评价需求。
试验例3
微胶囊的显微观察和ph敏感性测试
采用光学显微镜和扫描电子显微镜对载嗜酸乳杆菌微胶囊的形貌进行观察(显微镜型号为jeol(jem-6700f)),结果如图3和4所示。采用具有拍摄功能的光学显微镜对微胶囊的形态进行观察、拍照及记录,实施例1制备的载有嗜酸乳杆菌微胶囊光学显微镜表征如图3所示。具体过程如下:使用滴管滴加少量样品于载玻片上,轻轻盖上盖玻片,先在低倍镜下找到合适的视野,再转换到高倍镜进行微胶囊形态观察,同时用wv-cp230/g摄像头将样品状态拍摄记录,通过形态观察初步评价微胶囊的质量。由图3的显微镜照片可以看出,微囊中包埋了很多杆状菌,表明微囊对菌具有比较好的包埋效果。采用扫描电子显微镜观察了载嗜酸乳杆菌微胶囊的形貌,实施例1制备的载有嗜酸乳杆菌微胶囊扫描电镜表征如图4所示。由图4的微囊形貌可以看出,微囊表面有杆状菌的形态存在,表明微囊能够包埋较多的菌颗粒。
在电镜下观察不同ph值条件下,微胶囊表面的形态:实施例1制备的载有嗜酸乳杆菌微胶囊在ph=1.2的环境下表面的形态及其局部放大图如图6a、图6b所示,实施例1制备的载有嗜酸乳杆菌微胶囊在ph=6.8的环境下表面的形态及其局部放大图如图6c、图6d所示,对比例5制备的载有嗜酸乳杆菌微胶囊在ph=1.2的环境下表面的形态及其局部放大图如图6e、图6f所示,对比例5制备的载有嗜酸乳杆菌微胶囊在ph=6.8的环境下表面的形态及其局部放大图如图6g、图6h所示。
由图6a-图6h的对比可知,在电镜下观察不同ph值环境条件下,在酸性条件下,本发明实施例1制备的微胶囊的表面更加致密,表现出优良的ph值敏感性,能够有效的保护益生菌,在弱酸条件下胶囊由很快崩解迅速释放,便于肠道吸收;而对比例5加入淀粉做壁材制备的胶囊在酸性条件下ph值敏感性低,表面孔洞较大,无法有效的保护益生菌。
试验例4
实施例1制备的嗜酸乳杆菌微囊对肠道细胞增殖的影响
balb/c小鼠(白变种实验室老鼠)连续灌胃给药14天后,解剖小鼠取其回肠,制备切片,利用免疫组化进行ki-67染色,显微镜下拍照,通过vectraiii全自动定量病理成像分析系统对切片进行数据处理统计。生理盐水、嗜酸乳杆菌液以及口服低、中、高剂量的嗜酸乳杆菌微胶囊(低、中、高剂量组每剂菌含量分别为108cfu、109cfu和1010cfu)第0、7、14和21天时小鼠回肠细胞增殖的免疫组化情况如图7a-q所示,可以看出,随着给药天数的增加,与空白对照组(灌胃生理盐水组)相比,灌胃菌液组、载菌微胶囊低剂量组、载菌微胶囊中剂量组以及载菌微胶囊高剂量组的小鼠道内上皮细胞增殖均有增加,但是服用载菌微胶囊小鼠道内上皮细胞增殖相比灌胃菌液组更为明显。其中,以服用载菌微胶囊高剂量的小鼠肠道上皮细胞增殖最明显,说明载菌微胶囊高剂量服用效果最佳。
实施例1制备的载有嗜酸乳杆菌微胶囊灌胃后小鼠肠道细胞增殖的统计柱状图如图8a所示,实施例1制备的载有嗜酸乳杆菌微胶囊灌胃后小鼠肠道细胞增殖的统计曲线图如图8b所示,与空白对照组(灌胃生理盐水组)相比,口服低、中、高剂量的嗜酸乳杆菌微胶囊均能显著促进小鼠肠道上皮细胞的增殖;给药第7、14和21天3个时间点,与空白对照组相比,灌胃菌液组、载菌微胶囊低剂量组、载菌微胶囊中剂量组以及载菌微胶囊高剂量组小鼠肠道上皮细胞增殖的情况均呈现显著性差异,说明小鼠服用载嗜酸乳杆菌微胶囊后效果显著。
试验例5
实施例1制备的载嗜酸乳杆菌微囊对巨噬细胞吞噬活性测试
balb/c小鼠灌胃嗜酸乳杆菌微胶囊14天后,颈椎脱臼致死,无菌摘取脾脏,制备成脾细胞悬液。检测灌胃载菌微胶囊后对小鼠脾脏巨噬细胞吞噬活性的影响。实施例1制备的载有嗜酸乳杆菌微胶囊对小肠巨噬细胞活性影响结果如图9所示,图9中纵坐标吸光度值为570nm处的吸光度值,这个值的大小与巨噬细胞吞噬活性相关,值越高,吞噬活性越强,其中,横坐标中的低、中、高分别代表以及口服低、中、高剂量的嗜酸乳杆菌微胶囊(低、中、高剂量组每剂菌含量分别为108cfu、109cfu和1010cfu)与空白对照组相比,口服嗜酸乳杆菌微胶囊均能够提高小鼠脾脏巨噬细胞的吞噬活性,其中,小鼠脾脏巨噬细胞的吞噬活性呈现剂量依赖性,即载菌微囊中含菌量越高,小鼠脾脏巨噬细胞吞噬活性越好。与空白对照组相比,载菌微囊高剂量能够极其显著提高小鼠脾脏巨噬细胞的吞噬能力(p<0.001),说明嗜酸乳杆菌微胶囊具有活化巨噬细胞的能力,从而能够提高机体的非特异性免疫功能。
试验例6
实施例1载嗜酸乳杆菌微囊对t淋巴细胞亚群的影响
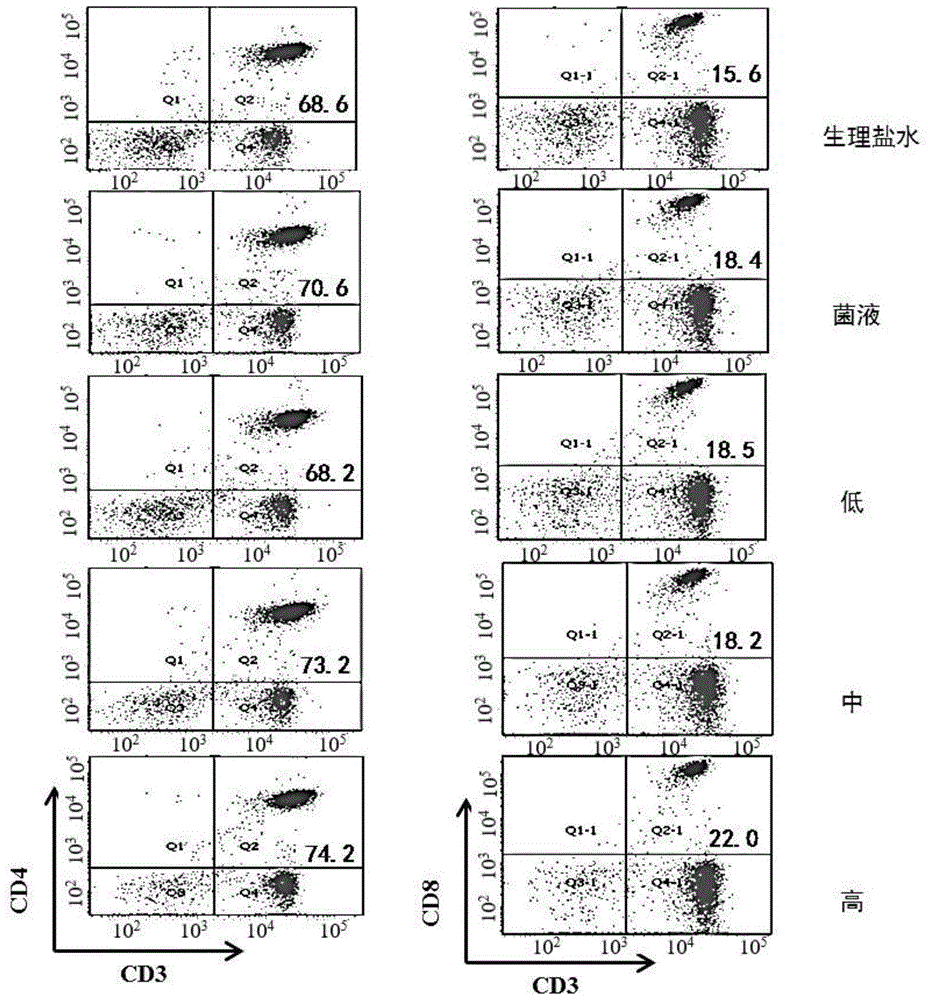
成熟的t淋巴细胞可经淋巴管、外周血等进行再循环,发挥细胞免疫及免疫调节等功能。流式细胞分析仪根据淋巴细胞表面标志的不同来检测各淋巴细胞亚群:淋巴细胞主要包括t淋巴细胞(cd3+),b淋巴细胞(cd19+),nk细胞(cd16+cd56+),其中t淋巴细胞可进一步测定辅助性t淋巴细胞(cd3+cd4+)和抑制性/细胞毒性t淋巴细胞(cd3+cd8+)。
实施例1制备的载有嗜酸乳杆菌微胶囊对淋巴细胞亚群的影响的代表性流式测试结果如图10a所示,其中,横坐标和纵坐标分别表示对应细胞亚群的细胞数,右侧低、中、高分别代表以及口服低、中、高剂量的嗜酸乳杆菌微胶囊(低、中、高剂量组每剂菌含量分别为108cfu、109cfu和1010cfu);实施例1制备的载有嗜酸乳杆菌微胶囊对小鼠辅助性t淋巴细胞(cd3+cd4+)的影响如图10b所示;实施例1制备的载有嗜酸乳杆菌微胶囊对抑制性/细胞毒性t淋巴细胞(cd3+cd8+)影响的如图10c所示。结果表明:与空白对照组相比,balb/c小鼠在口服嗜酸乳杆菌微胶囊后,其外周血t淋巴细胞亚群中cd3+cd4+和cd3+cd8+淋巴细胞的含量呈现显著升高(p<0.05)。cd4+t淋巴细胞含量的升高有利于辅助体液免疫,并且介导细胞免疫来调节机体的免疫作用,而cd8+t淋巴细胞的含量的升高,有利于机体免疫水平的提高。
申请人声明,本发明通过上述实施例来说明本发明的工艺方法,但本发明并不局限于上述工艺步骤,即不意味着本发明必须依赖上述工艺步骤才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明所选用原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
- 还没有人留言评论。精彩留言会获得点赞!