胰岛素抵抗改善剂以及用于预防胰岛素抵抗疾病的健康辅助食品的制作方法
本发明涉及胰岛素抵抗改善剂以及用于预防胰岛素抵抗疾病的健康辅助食品,用于预防·改善内脏肥胖所致的胰岛素抵抗所带来的疾病,例如,脂质代谢异常、糖代谢异常、脂肪细胞因子的产生平衡异常、对于脂肪组织的氧化应激的亢进等。
背景技术:
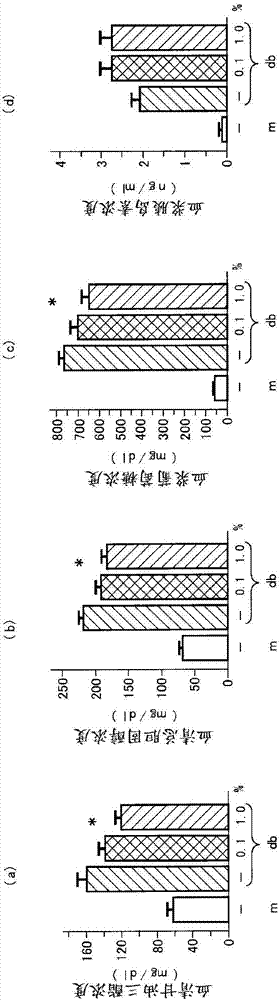
:已知代谢综合症是以内脏肥胖、糖耐量异常、高血压和脂质异常症为特征的疾病状态,其也是2型糖尿病、动脉血栓症的主要原因。内脏肥胖和胰岛素抵抗被认为是代谢综合症的开端,在预防肥胖和胰岛素抵抗的同时,开发能对其进行治疗的新物质也极其重要。另外,肥胖的疾病状态中发现慢性炎症,全身的炎症标记物的上升与肥胖和胰岛素抵抗密切相关,临床上利用炎症标记物作为动脉硬化的主要的预测标记物。近年的研究表明脂肪组织是释放瘦素、脂联素、肿瘤坏死因子(tnf-α)、单核细胞趋化因子(mcp-1)和纤溶酶原激活物抑制剂1(pai-1)等被总称为脂肪细胞因子的众多生理活性物质的重要的内分泌脏器。而且,由于在因内脏肥胖而蓄积的脂肪组织中,发现炎症性和抗炎症性脂肪细胞因子的产生平衡的破坏,因此脂肪组织中的炎症性改变被认为与代谢综合症的多种症状的进展相关,特别被认为是2型糖尿病、血栓症的原因。另外,作为增进健康的保健营养食品,已知市售的恩基美(enzamin)(注册商标),其是具有以下作用的发酵代谢物提取物:以在体内有效生成生物体所需要的诸成分的方式提高代谢活性,而且使t淋巴细胞转化(幼若化),增强免疫功能(下述专利文献1)。该发酵代谢物提取物恩基美(注册商标)是在高温或低温的生长环境、在照射紫外线或x射线或者酸性化的生长环境等中重复传代培养被选拔的特定的枯草芽孢杆菌ak株产生的提取物,关于该发酵代谢物提取物,本申请的发明人等公开了在小鼠的体内水平和使用血管内皮细胞的细胞水平具有纤溶活性亢进作用等抗血栓效果(下述专利文献2)。现有技术文献专利文献专利文献1:日本专利第3902015号公报专利文献2:日本特开2012-143187号公报技术实现要素:但是,在上述所示的公知技术中,对于上述的发酵代谢物提取物恩基美(注册商标),并没有与伴随内脏肥胖的胰岛素抵抗相关的见解,没有将其用作确实具有胰岛素抵抗的改善效果的药剂、食品。因此,本发明的课题是制备胰岛素抵抗改善剂以及使用其的能够预防胰岛素抵抗疾病的健康辅助食品,以解决上述的问题而能将规定发酵代谢物提取物用于新的用途,即弄清规定的发酵代谢物提取物恩基美(注册商标)对于内脏肥胖所致的胰岛素抵抗所致的疾病起到改善作用,能够广泛预防胰岛素抵抗所致的疾病。本申请的发明人等使用肥胖模型小鼠的db/db小鼠,详细研究了含有规定发酵代谢物提取物的恩基美(注册商标)对于胰岛素抵抗、脂肪细胞因子的分泌破坏状态的作用,证明了改善脂质代谢异常、糖代谢异常、脂肪细胞因子的产生平衡异常、对于脂肪组织的氧化应激的亢进等,发现能够用于新的用途,从而完成本发明。即,在本发明中,解决了上述课题,将规定的发酵代谢物提取物应用于新的用途,制成胰岛素抵抗改善剂,其含有如下所述的液状成分作为有效成分,该液状成分是将利用淀粉酶水解淀粉而得的糖化物作为培养基用基材,向其添加酵母提取物制备发酵用培养基,在该培养基中接种枯草芽孢杆菌ak(保藏编号:fermp-18291),使其发酵和熟化后而生成的。本发明涉及的上述构成的胰岛素抵抗改善剂含有在规定的条件下发酵和熟化而得的发酵代谢物作为有效成分,由此可以改善多种原因所致的胰岛素抵抗。作为本发明的胰岛素抵抗改善剂,例如是改善脂质代谢异常或糖代谢异常所致的胰岛素抵抗的胰岛素抵抗改善剂,另外是改善脂肪组织中的炎症性脂肪细胞因子的产生亢进或抗炎症性脂肪细胞因子的产生减少所致的胰岛素抵抗的胰岛素抵抗改善剂,另外是改善脂肪组织中的炎症或巨噬细胞的浸润所致的胰岛素抵抗的胰岛素抵抗改善剂,或是改善对于脂肪组织的氧化应激的亢进所致的胰岛素抵抗的胰岛素抵抗改善剂。含有上述胰岛素抵抗改善剂的食品是安全的且可以日常摄取上述有效成分的食品,是可以预防胰岛素抵抗导致的多种疾病的健康辅助食品。由于本发明是含有规定条件下发酵且熟化后的发酵代谢物作为有效成分的胰岛素抵抗改善剂,因此规定的发酵代谢物提取物在新的用途中被利用,其具有成为对例如脂质代谢异常或糖代谢异常、或脂肪组织中的炎症性脂肪细胞因子的产生亢进或抗炎症性脂肪细胞因子的产生减少、脂肪组织中的炎症或巨噬细胞的浸润、或对于脂肪组织的氧化应激的亢进之类的胰岛素抵抗所致的疾病发挥改善效果的胰岛素抵抗改善剂的优点。另外,含有这种胰岛素抵抗改善剂的食品是可以广泛预防胰岛素抵抗所致的疾病的食品,具有成为预防该疾病的新的健康辅助食品的优点。附图说明图1:(a)是表示各试验小鼠组的体重的图表,(b)是表示各试验小鼠组的体脂肪率的图表,(c)是表示各试验小鼠组的内脏脂肪量的图表,(d)是表示各试验小鼠组的试验后的皮下脂肪量的图表。图2:(a)是表示各试验小鼠组的血清甘油三酯浓度的图表,(b)是表示各试验小鼠组的血清总胆固醇浓度的图表,(c)是表示各试验小鼠组的血浆葡萄糖浓度的图表,(d)是表示各试验小鼠组的血浆胰岛素浓度的图表。图3:(a)是示出葡萄糖耐受性试验的结果,表示各试验小鼠组的试验时间和血浆葡萄糖浓度的关系的图表,(b)是示出胰岛素耐受性试验的结果,表示各试验小鼠组的试验时间和血浆葡萄糖浓度的关系的图表。图4:(a)是表示各试验小鼠组的tnf-α的mrna表达量的图表,(b)是表示各试验小鼠组的mcp-1的mrna表达量的图表,(c)是表示各试验小鼠组的il-6的mrna表达量的图表,(d)是表示各试验小鼠组的pai-1的mrna表达量的图表,(e)是表示各试验小鼠组的血清tnf-α浓度的图表,(e)是表示各试验小鼠组的血清脂联素浓度的图表。图5:(a)是db+m小鼠(对照组)的脂肪组织的免疫染色照片,(b)是对db/db小鼠(对照组)的脂肪组织的免疫染色照片,(c)是对db/db小鼠(恩基美0.1%添加组)的脂肪组织的免疫染色照片,(d)是对db/db小鼠(恩基美1.0%添加组)的脂肪组织的免疫染色照片图6:(a)是表示各试验小鼠组的f4/80阳性细胞率的图表,(b)是表示各试验小鼠组的f4/80mrna量的图表,(c)是表示各试验小鼠组的cd68mrna量的图表,(d)是表示各试验小鼠组的tlr-4mrna量的图表。图7:(a)是表示各试验小鼠组的nox2mrna量的图表,(b)是表示各试验小鼠组的p22phoxmrna量的图表,(c)是表示各试验小鼠组的p47hoxmrna量的图表。图8是表示各试验小鼠组的tnf-αmrna量的图表。图9:(a)是表示各试验小鼠组的glut2mrna量的图表,(b)是表示各试验小鼠组的g6pasemrna量的图表,(c)是表示各试验小鼠组的cpt1amrna量的图表,(d)是表示各试验小鼠组的glut4mrna量的图表,(e)是表示各试验小鼠组的cpt1bmrna量的图表。具体实施方式本发明的胰岛素抵抗改善剂,含有利用规定的菌使淀粉发酵熟化而得的液状成分作为有效成分,该有效成分将利用淀粉酶水解包括玉米淀粉等的淀粉而得的糖化物作为培养基用基材,向其添加作为氮源的酵母提取物制备发酵用培养基,在该培养基中接种规定的作为纳豆菌的枯草芽孢杆菌ak(保藏编号:fermp-18291),使其发酵且熟化后,分离生成的液状成分。其中,作为发酵用培养基的基材使用的糖化物,可以使用利用淀粉酶将包括从玉米粒分离、精制的玉米淀粉等的淀粉进行水解而得的产物。另外,也可以代替精制的玉米淀粉使用粗精制的玉米淀粉。另外,除了玉米淀粉以外,也可以使用将大豆粉、米糠或它们的混合物进行水解的产物作为培养基用基材。首先,作为发酵用培养基的氮源使用的酵母提取物,可以使用将对酿酒酵母(saccharomycescerevisiaemeyen)的菌体进行消化并提取的水溶性成分干燥的产物等通常在食品的发酵、酿造等的细菌培养中可作为氮源添加的物质。另外,在有效成分制造所使用的发酵用培养基中,除了上述的糖化物和酵母提取物之外,也可以根据需要配合蛋白质等有机物、无机盐类等。作为有机物可举出大豆蛋白质、其他植物性蛋白质,作为无机盐类可举出氯化钙、氯化钠、磷酸钠等。对作为培养基用基材的利用淀粉酶将淀粉水解的糖化物,进一步优选添加糖分,作为这样的糖分,例如可举出蔗糖、葡萄糖、糖浆等。在按照上述方式制备的发酵用培养基中接种的发酵菌是作为纳豆菌的枯草芽孢杆菌(bacillussubtilis)ak,枯草芽孢杆菌ak在专利微生物保藏中心(npmd)以“(保藏编号)fermp-18291”被保藏。另外,根据需要,除枯草芽孢杆菌ak之外可以接种不妨碍枯草芽孢杆菌ak增殖的作为乳酸杆菌的乳杆菌(lactobacillus)、作为乳酸球菌的链球菌(streptococcus)、酵母(saccharomycescerevisiae)、米曲霉(aspergillusoryzae)的菌体、菌提取物或菌发酵提取物。此外,在本发明的食品的有效成分的制造所使用的发酵用培养基中,根据需要,可以添加不妨碍枯草芽孢杆菌ak增殖的白菜、卷心菜、胡萝卜、药用人参(薬用ニンジン)、西芹、芹菜、洋葱等的植物提取物。枯草芽孢杆菌ak是将通常的作为纳豆菌的枯草芽孢杆菌在紫外线、x射线照射下、在高·低温环境(100℃,0℃)下、与乳酸菌竞争、在容易产生芽胞的培养基[肉提取物5.0重量%、蛋白胨10.0重量%、氯化钠5.0重量%、琼脂15.0重量%、蔬菜(卷心菜、胡萝卜、芹菜、西芹)压榨汁65.0重量%]等诸条件下反复传代培养选拔而发现的耐性菌。这样得到的枯草芽孢杆菌ak菌株具有以下所示的细菌学性质,可以确认为枯草芽孢杆菌。应予说明,本发明使用的枯草芽孢杆菌ak菌株(保藏编号:fermp-18291),由于细菌学性质等分类指标的不同在同源性的评价中发现差异,在利用16srrna基因的序列的通过数据库(microseqid:abi)的分类检索中,发现与多粘芽孢杆菌(paniebacilluspolymyxa)具有高的同源性,但是在利用以下的(a)形态学性质、(b)培养性质、(c)生物化学性质的细菌学性质的系统分类中得到为枯草芽孢杆菌的鉴定结果。本发明使用后者的结果利用在专利微生物保藏中心(npmd)保藏的上述规定菌株。(a)形态学性质1细胞的形状和大小杆菌1.0~1.2×3.0~50μm2细胞的多态性的有无无3运动性的有无有(周生鞭毛)4芽胞的有无有椭圆菌体的基本中央(b)培养的性质1肉汁琼脂平板培养圆形菌落白色混浊2肉汁液体培养上部或下部菌凝体(c)生化学的性质1革兰氏染色阳性2硝酸盐的还原阳性3mr试验阴性4vp试验阳性5吲哚的生成阴性6硫化氢的生成阴性7柠檬酸的利用阳性8过氧化氢酶阳性9生长的范围ph5.5~7.0温度25℃~40℃本发明优选采用的发酵条件为ph4.5~6.5、28~32℃下2个月以上。发酵条件在比上述强的酸性范围且不足规定温度的条件下,被认为即使使其发酵2个月以上,本发明使用的规定的纳豆菌也不会有效将糖和氮源同化,得到的食品不能充分获得期望的效果。超过上述的酸性范围,在中性或碱性的条件下超过规定温度在高温下发酵变得不充分,规定的纳豆菌不会有效将糖和氮源同化,得到的保健营养食品与上述同样地不能充分获得期望的效果。另外,本发明优选采用的熟化条件为ph4.0~6.0,13~17℃下4个月以上。在比上述强的酸性范围且不足规定温度的条件下,被认为即使使其熟化4个月以上,作为发酵产物具有各种活性的氨基酸、脂蛋白、脂多糖(lipopolysaccharide)、脂质等也没有充分低分子量化,有时不能充分获得期望的效果。超过上述的酸性范围在中性或碱性的条件下超过规定温度在高温下使其熟化时,被认为活性降低,得到的健康辅助食品有时不能充分获得期望的效果。分离生成的液状成分可采用过滤或离心分离等周知的分离手段,得到的食品用原液可以直接使用,但是为了便于运输、保存,可以预先将其浓缩,而后适当地稀释来使用。本发明的胰岛素抵抗改善剂的有效成分是可以利用上述所示的制造工序制造的产品,也可以利用市售品。此时,除了株式会社恩基美研究所制造的恩基美(注册商标)的原液(enm:商品名)之外,可以将其20倍浓缩提取物恩基美浓缩液(enm-hl:商品名)换算为原液浓度再使用。对于本发明的胰岛素抵抗改善剂,将上述的恩基美浓缩液(enm-hl:商品名)作为规定的液状成分,在水或赋形剂等可饮用食用的材料中配合0.1~1.0质量%,在使小鼠摄食时确认了有效性。此时,如果恩基美浓缩液(enm-hl:商品名)以浓度0.1质量%摄食,则摄取量为平均0.5mg/kg体重/日/小鼠,如果以浓度1.0质量%节食时,则摄取量为平均5.0mg/kg体重/日/小鼠,分别确认有效性。如果将该摄取量换算为人的情形,则根据体表面积进行换算,为小鼠用量的15分之1左右,因此,成人(体重60kg)的恩基美(注册商标)的原液(enm:商品名)的1次/日的摄取量是20×(2~20mg),即40~400mg是被确认的有效成分量。本发明的用于预防胰岛素抵抗所致的疾病的健康辅助食品,是将上述方式制备的有效成分与食品领域通常被使用的赋形剂(例如,淀粉或糊精、纤维素、乳糖、麦芽糖、还原乳糖、还原麦芽糖、山梨糖醇、甘露醇、赤藓糖醇、木糖醇等)、辅助剂(例如,溶剂、分散介质、被覆剂、稳定剂、稀释剂、保藏剂、防腐剂、杀菌剂、抗真菌试剂、等渗试剂、吸收抑制试剂、崩解剂、乳化剂、粘合剂、润滑剂、色素等)混合,利用健康辅助食品领域通常被使用的制剂方法,制造成例如片剂、胶囊、颗粒、粉末、提取液、溶液、糖浆、混悬剂、乳浊液的形态的健康辅助食品。另外,本发明的用于预防胰岛素抵抗所致的疾病的健康辅助食品,将上述的规定的液状成分恩基美(注册商标)的原液(enm:商品名),以上述的每1日的有效成分量为基准,相对于辅助食品整体的重量,例如,可以含有约0.05~100质量%,优选含有约0.1~90质量%,更优选含有约1~85质量%,进一步优选含有约5~80质量%,最优选含有约10~50质量%。实施例[胰岛素抵抗改善剂的有效成分的制备]向黄色玉米淀粉2.3kg、大豆蛋白胨0.5kg、米糠汁0.5kg、氯化钙80g、食盐150g添加精制水50kg,加热溶解。接下来将其冷却,添加淀粉酶40g使其充分糖化。糖化结束后,添加砂糖1.5kg、葡萄糖1.5kg、酵母提取物450g、糖浆1.5kg、磷酸钠80g、蔬菜的压榨汁(卷心菜、胡萝卜、芹菜、西芹的合计)5kg和精制水,将总量设置为150kg。随后,添加氢氧化钠将ph调整至7.3~7.8的范围内,将其装入培养罐,120℃下高压灭菌20分钟。将其冷却后,接种枯草芽孢杆菌ak株,温度30±2℃的恒温室内ph4.5~6.5下发酵60日,接下来在温度15±2℃的恒温室内在ph4.0~6.0的条件下熟化180日使培养液透明化。利用过滤器将其过滤,得到125升的液状的保健营养食品的原液(以下称为培养滤液)。得到的胰岛素抵抗改善剂的液状有效成分的原液100g中的一般分析结果示于以下的表1中。应予说明,表中的符号φ表示检测极限以下的微量。[表1]分析试验项目结果水分99.80%蛋白质φ脂质φ灰分φ糖0.2%全固体成分0.2%食物纤维0.12g/100g钠64.4mg/100g吡啶二羧酸0.008g核黄素(维生素b2)0.02mg/100g甲萘醌-6(维生素k2)1.1μg/100g甲萘醌-7(维生素k2)45μg/100g糖度(refubrix)2.7度比重1.009另外,关于含有得到的液状成分或相同成分的恩基美(注册商标)的食品的经口安全性,如日本特许第3902015号公报的段落0031记载所示,使用了wister系大鼠的经口ld50值雄雌均是42.0ml/kg以上的高的数值,本发明使用的有效成分显然具有高的安全性。接下来,制备将上述的液状成分的原液的20倍浓缩液(恩基美研究所公司制:enm-hl,在以下的实施例1、2、比较例,这些试验的说明以及图表中的说明中,将其称为恩基美)作为有效成分的实施例1、2、比较例(对照)的各胰岛素抵抗改善剂,这些胰岛素抵抗改善剂通过以下试验进行评价。应予说明,以下的试验结果以平均值±标准误差表示,%的记载是质量%,显著差异检测使用单因素方差分析法(one-wayanova),只要没有特别说明,将p<0.05作为具有显著差异。另外,统计分析均使用statviewversion5.0software(美国sasinstitute公司制)进行。[实施例1、2、比较例]<脂质代谢异常的胰岛素抵抗改善剂、糖代谢异常的胰岛素抵抗改善剂>制备含有0.1质量%浓度的按上述方式得到的有效成分的恩基美的饮料水(实施例1)、恩基美的1.0质量%浓度的饮料水(实施例2)、完全不含有恩基美的水(比较例),评价小鼠经口摄取所产生的作为实施例1、2的脂质代谢异常或糖代谢异常的胰岛素抵抗改善剂的适应性。[小鼠的经口摄取]从日本charlesriver公司购入的5周龄的雄性db/db小鼠(肥胖模型小鼠)和杂合的db/+m小鼠(瘦的模型小鼠)中,对db/db小鼠从6周龄开始给予8周的标准固体食品和将恩基美以0.1%(平均0.5mg/kg体重/日/小鼠)和1.0%(平均5.0mg/kg体重/日/小鼠)混合的饮水(实施例1、2)。作为比较例(对照),给予完全不含有恩基美的水。应予说明,饵料和饮水自由摄取,作为瘦的对照使用db/+m小鼠,使其在相同的时间内自由摄取标准固体食品和饮水。这些小鼠以12小时的明暗循环进行饲养,全部的动物实验按照学校法人近畿大学医学部动物实验指南进行。在评价上述的实施例、比较例的发明的效果时,作为其前提,为了确认通过恩基美投与对db/db小鼠的体重和体脂肪量没有影响,针对对供试小鼠的在与实施例1、2的经口摄取完全相同的条件下经口摄取的小鼠,研究体重、体脂肪率、皮下脂肪率的增减,其结果示于图1。应予说明,图中记载的%是质量%。另外,关于体脂肪率、内脏脂肪量、皮下脂肪量的测定,进行以下的身体组成解析试验。[身体组成解析试验]利用计算机断层摄影术(ct解析)进行体脂肪组成的解析。即,利用异氟醚将小鼠麻醉后,使用实验动物ct解析装置(日立alokamedical公司制:lathetalct-200)测定体脂肪组成。此时,在实验动物的第1腰椎到第5腰椎之间以1mm的间隔进行扫描,制作连续的分片断层图像后,使用lathetasoftware(version3.40)进行定量化。内脏脂肪和皮下脂肪利用腹肌的位置区分,总脂肪量、内脏脂肪重量和皮下脂肪重量通过对总分片图像进行积分而算出。如图1所示的结果表明的那样,没有发现0.1%浓度和1%浓度的恩基美投与所致的对体重的影响,在根据ct图像计算的体脂肪率、内脏脂肪量和皮下脂肪量、肝脂肪量中也没有发现恩基美投与所致的变化。其次,为了研究脂质代谢异常或糖代谢异常的胰岛素抵抗改善剂所带来的期望的直接的胰岛素抵抗所致的效果,对于实施例1、2、比较例,进行以下的利用代谢标记物的解析试验,其结果示于图2、3。应予说明,图中,%是质量%。[利用代谢标记物的解析试验(1)]关于使用db/db小鼠的实施例1、2、比较例和使用db/+m小鼠的对照,血清甘油三酯、血清总胆固醇、血浆葡萄糖、血浆胰岛素的浓度,分别使用甘油三酯e试验(和光纯药工业公司制)、胆固醇e试验(和光纯药工业公司制)、glutestace(三和化学研究所制)、超高灵敏度小鼠胰岛素测定试剂盒(森永生科学研究所制)测定。[脂质代谢异常所致的胰岛素抵抗的改善]由图2(a)所示的结果可知,由db/db小鼠的血清甘油三酯的测定结果表明,db/db小鼠的空腹时的血清甘油三酯浓度(158.1±12.4mg/ml),与db/+m小鼠(对照组:图中表示为m)的血清甘油三酯浓度(59.9±6.7mg/dl)相比,显示显著(p<0.01)的高值。另外,根据图2(a)可知,通过0.1%浓度的恩基美投与,db/db小鼠中的血清甘油三酯浓度为137.0±8.0mg/dl,与对照组的158.1±12.4mg/dl相比没有显著差异但是有减少的趋势,此外发现1%浓度的恩基美投与组(122.0±8.4mg/dl),与恩基美非投与的db/db小鼠组相比显著(p<0.05、图中添加*号)减少。同样根据图2(b)可知,发现与db/db小鼠的空腹时的血清总胆固醇浓度(217.9±8.7mg/dl)相比,0.1%浓度的恩基美投与组(181.4±8.3mg/dl)有减少趋势,发现1%浓度恩基美投与组显著(p<0.05)减少。根据上述结果可知,有效成分恩基美投与浓度依赖性地使血清甘油三酯和总胆固醇浓度减少,通过有效成分的摄取可改善db/db小鼠的脂质代谢。<糖代谢异常所致的胰岛素抵抗的改善剂>接下来,研究对于db/db小鼠的糖代谢异常的恩基美的效果。根据图2(c)所示的结果可知,db/db小鼠的空腹时血浆葡萄糖浓度(758.7±24.7mg/dl)与db/+m小鼠(对照组54.6±1.5mg/dl:图中以m表示)相比显著的增加(p<0.01)。另外,0.1%浓度的恩基美投与组的db/db小鼠的血浆葡萄糖浓度显示减少趋势,1.0%浓度的恩基美投与组(643.0±34.0mg/dl)显示显著(p<0.05)的减少。根据图2(d)所示的结果可知,血浆胰岛素浓度与db/+m小鼠(图中以m表示,0.12±0.04ng/ml)比较,在db/db对照组中为2.05±0.22ng/ml,具有显著的高值(p<0.01),但是0.1%恩基美投与组(2.72±0.27ng/ml)、1.0%恩基美投与组(2.72±0.30ng/ml),没有发现恩基美投与所致的对血浆胰岛素值的影响。此外,为了详细研究恩基美对于糖代谢的效果,进行葡萄糖耐受性试验(intraperitonealglucosetolerancetest(ipgtt))和胰岛素耐受性试验(intraperitonealinsulintolerancetest(ipitt)),这些结果示于图3(a)(b)。首先,为了进行葡萄糖耐受性试验,使小鼠绝食16小时,其后,在腹腔内投与1.5mg/kg体重的浓度的葡萄糖。其结果示于图3(a)。另外,为了进行胰岛素耐受性试验,使小鼠绝食6小时后,在腹腔将1u/kg体重的浓度的普通人胰岛素投与至腹腔。其结果示于图3(b)。血液样品在投与前和投与后采取,血中葡萄糖浓度使用glutestace(三和化学研究所制)测定,投与前(0分)和投与后(30~90分)的结果示于图3(b)。应予说明,关于图3的折线图中的符号表示以下各组的结果,○:表示db/+m小鼠,●:表示enzamin非投与db/db小鼠(对照),△:表示0.1%恩基美投与db/db小鼠,□:表示1.0%恩基美投与db/db小鼠。根据图3(a)的结果可知,对腹腔内投与葡萄糖后的血浆葡萄糖浓度,db/db小鼠与db/+m小鼠相比显著上升,显示显著的糖耐量异常。通过投与1.0%浓度的恩基美,db/db小鼠的葡萄糖注入30分钟后、60分钟后和90分钟后的血浆葡萄糖浓度的上升被显著抑制。应予说明,通过投与0.1%浓度的恩基美没有显著差异,但是发现血浆葡萄糖浓度的上升的抑制趋势。由此可见,通过投与恩基美,db/db小鼠的糖耐量异常得到改善。另外,根据图3(b)的结果可知,在db/db小鼠中,糖耐量异常的同时,发现胰岛素感受性有显著的障碍。即,与db/+m小鼠相比,db/db小鼠投与胰岛素后的血浆葡萄糖浓度的降低显著被抑制。投与0.1%浓度的恩基美没有发现效果,但是1.0%浓度的恩基美(□符号)的投与,投与胰岛素后的db/db小鼠的血浆葡萄糖浓度的降低在30分钟、60分钟、90分钟和120分钟后与对照组(●符号)相比显著亢进。由此可见,恩基美的投与改善db/db小鼠的胰岛素抵抗。<脂肪组织中的炎症性脂肪细胞因子的产生亢进或抗炎症性脂肪细胞因子的产生减少所致的胰岛素抵抗改善剂>研究恩基美对于实施例1、2的脂肪细胞因子表达·分泌的效果,评价作为发挥上述效果的胰岛素抵抗改善剂的适用性。即,进行与上述同样的对小鼠的经口摄取试验,对使用db/db小鼠的实施例1、2、比较例以及使用db/+m小鼠的对照,进行以下的试验,其结果示于图4。[代谢标记物的解析试验(2)]为了研究恩基美投与(8周时间)所致的胰岛素抵抗改善效果的机理,研究恩基美对于实施例1、2、比较例的db/db小鼠的脂肪组织中的炎症性脂肪细胞因子和抗炎症性脂肪细胞因子的表达和分泌的效果。血清脂联素和血清tnfα浓度分别使用脂联素elisa试剂盒(大冢制药公司制)和quantikinetnf-alphaelisa试剂盒(美国r&dsystems公司制)测定。图4的(a)~(f)依次表示tnf-α,mcp-1,il-6,pai-1的mrna表达量、各组的小鼠的血清tnf-α浓度、血清脂联素浓度,各图中的m符号是db/+m小鼠(瘦的对照(n=6))的脂肪组织,-符号是恩基美非投与(n=10)db/db小鼠的脂肪组织,0.1是恩基美投与0.1%(n=9)的实施例1的db/db小鼠的脂肪组织,1.0是恩基美投与1.0%(n=8)的实施例2的db/db小鼠的脂肪组织。这些结果由平均值±标准误差表示,相对于恩基美非投与db/db小鼠具有p<0.05的显著差异的小鼠由*符号表示,p<0.01的显著差异的小鼠由**号表示)应予说明,图中,%表示质量%。根据图4(a)的结果可知,db/db小鼠的脂肪组织中的tnfα的表达与db/+m小鼠的表达相比,增加到5倍,确认db/db小鼠的脂肪组织中诱发了炎症。特别值得注意的是,发现投与的恩基美的浓度依赖性地抑制db/db小鼠的脂肪组织中的tnf-α的mrna的表达量。特别是,1.0%浓度的恩基美投与与对照组相比,抑制了40%的tnf-α的mrna的表达。另外,根据图4(b)、(c)的结果可知,通过投与1.0%浓度的恩基美,单核细胞趋化因子(monocytechemoattractantprotein1(mcp-1))和白介素6(il-6)的表达,与对照组相比分别被抑制50%、60%。另外,根据图4(d)的结果可知,纤溶酶原激活物抑制剂1(plasminogenactivatorinhibitor-1(pai-1))的表达,在投与0.1%和1.0%浓度的恩基美两组中发现显著的抑制。根据这些结果,发现恩基美的投与抑制db/db小鼠的脂肪组织中的炎症。此外,为了研究将恩基美作为有效成分的胰岛素抵抗改善剂对于全身的炎症状态的效果,测定db/db小鼠的血中tnf-α浓度。根据图4(e)的结果可知,与对照组(-符号)的45.2±6.5pg/ml相比,投与1.0%浓度的恩基美的实施例2,发现血中tnf-α浓度为27.2±6.4pg/ml这样的显著的抑制(p<0.05)。因此,可知将恩基美作为有效成分的胰岛素抵抗改善剂,与脂肪组织的炎症抑制效果同样地也抑制全身的炎症。根据图4(f)的结果可知,发现作为抗炎症性脂肪细胞因子的血中脂联素浓度依赖于恩基美的投与浓度而增加,特别是1.0%浓度的恩基美的投与中为11.4±0.8μg/ml,相对于db/db对照组的8.1±0.7μg/ml增加至1.4倍。由此可见,将恩基美作为有效成分的胰岛素抵抗改善剂改善了肥胖小鼠的脂肪细胞因子的产生破坏。<脂肪组织中的巨噬细胞的浸润所致的胰岛素抵抗的改善剂>其次,为了研究将恩基美作为有效成分的胰岛素抵抗改善剂对于巨噬细胞向脂肪组织的浸润的胰岛素抵抗的效果,对肥胖小鼠的脂肪组织中的f4/80(成熟巨噬细胞的标记物)进行组织免疫学解析。[组织免疫学的解析]将小鼠的睾丸上体白色脂肪组织在4℃的条件下使用4%多聚甲醛固定12~16小时,制作4μm厚的石蜡切片,使其与大鼠单克隆抗f4/80抗体(美国abdserotec公司制)反应。随后,使其与结合有西洋辣根过氧化酶的二次抗体反应。使用酪胺信号放大系统(美国perkinelmer公司制),将阳性信号可视化。另外,将切片利用4′,6-二氨基-2-苯基吲哚(dapi)进行后染色,使用荧光显微镜(佳能公司制:e800)和ccd照相机(keyence公司制)观察。观察由各个小鼠个体制作的石蜡切片中的10视野,使用图像解析软件(nih图像)计数f4/80表达阳性细胞的核的数量和全部的细胞的核的数量,算出相对于全部细胞数的f4/80阳性细胞的比例。如图5的免疫染色图像所示,首先,与db/+m小鼠(图5(a))相比,db/db小鼠(图5(b))脂肪组织中的f4/80阳性细胞的数量显著增加,这表示巨噬细胞对脂肪组织的浸润显著增加。随后,由图5(c)、(d)可知,可以观察到通过投与0.1%、1.0%的将恩基美作为有效成分的胰岛素抵抗改善剂,f4/80阳性细胞数量浓度依赖性减少。另外如图6(a)所示,计数f4/80阳性细胞的数量,算出相对于全体细胞的比例,结果投与0.1%的恩基美(47.4±5.1%)与db/db对照组(54.5±2.4%)相比没有发现显著差异(p<0.05),但是,发现抑制巨噬细胞对脂肪组织的浸润的趋势,此外投与1.0%的恩基美(42.8±2.3%)发现巨噬细胞浸润的显著的抑制。此外,为了确认巨噬细胞的活化和脂肪组织的炎症,如下所示进行“细胞培养”,进行利用“定量实时聚合酶链式反应”的基因表达定量解析。[细胞培养]将小鼠巨噬细胞培养细胞的raw264.7细胞(atcc)利用含有10%胎牛血清(fbs)和100mg/ml的青霉素·链霉素的dulbecco改良培养基在37℃、5%co2条件下培养维持。将raw264.7细胞以1×106cells/孔播种至6孔板,培养24小时后,分别添加0.01%和0.1%的恩基美,此外添加1μg/ml的浓度的脂多糖(lps),使其反应12小时。利用磷酸生理食盐缓冲液(pbs)清洗2次后,从细胞提取rna,进行利用定量实时聚合酶链式反应(定量rt-pcr反应)的基因表达解析。[定量实时聚合酶链式反应]使用rneasyminikit(qiagen公司制)从小鼠的睾丸上体白色脂肪组织(100mg)和raw264.7细胞提取rna。随后,使用superscriptiii逆转录试剂盒(lifetechnologies公司制)合成cdna(环状dna)。使用sybrgreenpcrmastermix作为发光试剂,通过steponeplus实时pcr装置(lifetechnologies公司制),进行基因表达定量解析。通过基因表达解析被定量化的mrna量,通过作为内部标准的18s核糖体rna进行标准化,单位以任意单位表示。如图6(b)所示,上述的标记物基因的表达定量解析的结果,1.0%浓度的恩基美投与组与对照组相比,脂肪组织中的emr1(f4/80)mrna的表达被抑制40%。此外如图6(c)(d)所示,巨噬细胞的活化标记物和炎症状态的标记物cd68和tolllikereceptor4(tlr4)的表达也分别被抑制40%。由上述结果可知,将恩基美作为有效成分的胰岛素抵抗改善剂抑制炎症性巨噬细胞对于db/db小鼠的脂肪组织的浸润。<脂肪组织中的氧化应激所致的胰岛素抵抗的改善剂>为了评价将恩基美作为有效成分的胰岛素抵抗改善剂对于脂肪组织中的氧化应激的效果,研究db/db小鼠的睾丸上体白色脂肪组织中的烟酰胺腺嘌呤二核苷酸磷酸(nadph)氧化酶的亚单元(nox2,p22phox和p47phox)的基因(mrna)表达量。关于细胞培养试验和定量实时聚合酶链式反应,按照与上述的“脂肪组织中的巨噬细胞的浸润所致的胰岛素抵抗的改善”的实验操作相同的顺序进行,研究nox2、p22phox和p47phoxmrna的表达量。由图7(a)(b)(c)所示的结果可知,nox2、p22phox和p47phox的各mrna的表达量,在db/db小鼠中与db/+m小鼠相比,显著增加,db/db小鼠的脂肪组织中的氧化应激亢进。0.1%浓度的恩基美投与没有发现相对于恩基美非投与的显著差异(p<0.05),但是发现了抑制这些nadph氧化酶亚单元的表达量的趋势。此外1.0%浓度的恩基美投与,分别将nox2、p22phox和p47phox的基因表达上升显著抑制40%、30%和40%左右。根据上述结果可知,将恩基美作为有效成分的胰岛素抵抗改善剂抑制db/db小鼠的脂肪组织中的氧化应激。<脂肪组织中的lps诱导性的炎症反应所致的胰岛素抵抗的改善剂>接下来,为了研究将恩基美作为有效成分的胰岛素抵抗改善剂对于巨噬细胞的炎症反应的lps诱导性的炎症反应的效果,使用小鼠巨噬细胞培养细胞raw264.7细胞,研究将恩基美作为有效成分的胰岛素抵抗改善剂对于lps刺激时的tnf-α的表达上升的添加效果。关于细胞培养试验和定量实时聚合酶链式反应,按照与上述的“脂肪组织中的巨噬细胞的浸润所致的胰岛素抵抗的改善”的实验操作相同的顺序进行,研究tnf-α的mrna的表达量。即,研究raw264.7细胞中的lps(1μg/ml)的存在下、非存在下的将0.01%和0.1%恩基美作为有效成分的胰岛素抵抗改善剂的12小时的添加效果,其结果,图8中以平均值±标准误差表示,图中的**表示p<0.01(各组n=3)具有显著差异。根据图8的结果,可知在lps非存在下(-符号),通过添加0.1%的恩基美,raw264.7细胞中的tnf-α的表达量略微增加。但是,将0.01%和0.1%浓度的恩基美作为有效成分的胰岛素抵抗改善剂的添加组,显著抑制了因lps显著诱导表达的tnf-αmrna。由此可见,将恩基美作为有效成分的胰岛素抵抗改善剂抑制巨噬细胞中的炎症反应。[对于肝脏和肌肉中的糖代谢和脂质代谢的影响]为了研究将恩基美作为有效成分的胰岛素抵抗改善剂对于肌肉中的糖代谢和脂质代谢的效果、和对于肝脏的影响,与上述同样,使db/db小鼠从6周龄开始与饵料一同自由摄取8周时间的标准固体食品以及混合有0.1%(平均0.5mg/kg体重/日/小鼠)和1.0%(平均5.0mg/kg体重/日/小鼠)的恩基美的饮用水(实施例1、2),另外作为比较例(对照),db/db小鼠给予不含有恩基美的水。另外,作为其他比较例(瘦的对照),使db/+m小鼠在上述相同时间内自由摄取标准固体食品和水。对于上述被饲养试验的各小鼠的肝脏中的glut2基因和g6pase基因(mrna)的表达、还有肌肉中的glut4基因(mrna)的表达,另外对于肝脏和肌肉中的肉碱棕榈酰转移酶1基因(mrna)的表达,使用遗传学方法(elisa法)研究以下的(a)~(e)的各酶。即,对于(a)glut2(肝脏中将葡萄糖摄入细胞内的转运体)、(b)g6pase(与糖新生相关的酶)、(c)cpt1a(与脂质氧化相关的线粒体酶:肝脏型)、(d)glut4(肌肉中将葡萄糖摄入细胞内的转运体)、(e)cpt1b(与脂质氧化相关的线粒体酶:肌肉型)研究各mrna的表达量,其结果示于图9中。应予说明,该图中,标记平均值±标准误差,图中的**表示p<0.01(各组n=3)具有显著差异。根据图9的(a)、(b)所示的结果,可知恩基美投与对于db/db小鼠的肝脏中的glut2和g6pase的mrna表达没有影响。根据上述结果,提示了恩基美对于肝脏的糖代谢没有影响。根据图9(d),可知肌肉中的glut4的mrna表达,db/db小鼠中与db/+m小鼠相比显著减少。这表示肥胖小鼠的肌肉中的葡萄糖的摄入相关因子(glut4)的表达与瘦小鼠的该因子的表达相比显著变弱,另一方面,1%浓度的恩基美投与显著促进肥胖小鼠的肌肉中的葡萄糖摄入。其次,对于db/db小鼠的肝脏和肌肉内的肉碱棕榈酰转移酶1(cpt1:与脂质氧化相关的线粒体酶)的基因表达,按照以下方式评价。根据图9(c)、(e)的结果可知,cpt1a(肝脏型)和cpt1b(肌肉型)的mrna表达,与db/+m小鼠相比db/db小鼠中减少。另外,如图9(c)所示,肥胖小鼠的肝脏中的cpt1b的mrna表达不受恩基美的投与浓度的影响。另一方面,如图9(e)所示,肥胖小鼠的肌肉中的cpt1b的mrna表达,在1%浓度的恩基美的投与中最显著。可见,与肥胖小鼠的肝脏和肌肉内的脂肪燃烧相关的酶(cpt1a、b)的表达,与瘦小鼠的相比显著减少。与此相对,1%浓度的恩基美的投与,使肌肉内的脂肪燃烧酶增加,对于肝脏内的脂肪燃烧酶没有影响。根据上述试验结果可以看出,恩基美的投与不对肝脏产生影响,改善db/db小鼠的肌肉内的葡萄糖吸收和脂质氧化。产业上的可利用性胰岛素抵抗改善剂可以用于预防或治疗内脏肥胖所致的胰岛素抵抗而导致的疾病,例如是用于预防·改善脂质代谢异常、糖代谢异常、脂肪细胞因子的产生平衡异常、对于脂肪组织的氧化应激的亢进等的胰岛素抵抗改善剂。更具体而言,是对于肥胖细胞组织的脂质代谢异常的抑制剂或糖代谢异常的抑制剂、脂肪细胞因子产生平衡调整剂、肥胖脂肪组织的炎症·氧化应激抑制剂、肥胖细胞组织的巨噬细胞阻碍(浸润抑制)剂等。另外,如果使多种饮料食品含有本发明的胰岛素抵抗改善剂,则成为用于预防胰岛素抵抗疾病的健康辅助食品,例如用于预防脂质代谢异常的健康辅助食品或用于预防糖代谢异常的健康辅助食品、用于预防脂肪细胞因子产生失调的健康辅助食品、用于预防肥胖脂肪组织的炎症·氧化应激的健康辅助食品、用于预防肥胖细胞组织的巨噬细胞阻碍(浸润抑制)的健康辅助食品等。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种DPPIV抑制剂马来酸盐的多晶型及其制备方法与流程
- 一种具有降血糖、降血脂、增强免疫力、抗氧化功效的组合物、饮料及其应用的制造方法与工艺
- 一种特异靶向猪IRS1基因的sgRNA导向序列及其应用的制造方法与工艺
- 一种可有效治疗II型糖尿病的汤剂药物及制备方法与制造工艺
- 一种肿瘤患者全营养补充剂及其制备方法与制造工艺
- 卡路里测量器的制造方法与工艺
- 重组人成纤维细胞生长因子21融合蛋白及其在制备治疗代谢疾病药物中的应用的制造方法与工艺
- G蛋白信号调节因子6及其抑制剂在治疗脂肪肝和Ⅱ型糖尿病中的功能和应用的制造方法与工艺
- 一种代代花萼多酚在制备减肥药物中的应用的制造方法与工艺
- 一种人源性asprosin蛋白的ELISA检测试剂盒及其用途的制造方法与工艺