包含间充质干细胞‑水凝胶的组合物及其制备方法与流程
本发明涉及在水凝胶中培养的间充质干细胞组合物,更详细地,涉及人脂肪来源间充质干细胞-水凝胶组合物及其制备方法,更具体地,在水凝胶中培养间充质干细胞后,进行清洗并向注射器填充,从而可以随即进行给药,在最终移植细胞准备过程中,无需进行酶处理,且无需进行利用离心分离等的清洗步骤,而是以水凝胶状态进行清洗,因此,无细胞损失,而且生理活性物质插入在水凝胶孔(pore)内,从而具有从给药到个体之后开始呈现治疗效果的优点。
背景技术:
在利用通过胰蛋白酶或分散酶等蛋白酶处理来取得得的所分离的细胞对蛋白酶进行处理的过程中,以往的第一代干细胞治疗剂非选择性地对暴露于细胞膜的所有蛋白质进行分解,因此,几乎无法维持细胞间结合和基底膜蛋白质等。并且,为了使蛋白酶非活性化,添加胎牛血清(fbs)等动物来源物质,并为了去除胎牛血清而执行数次清洗-离心分离过程,通常在进行一次清洗-离心分离过程发生5~10%左右的细胞被损失。因此,使用蛋白酶的细胞收集过程为非常低效的方法。
并且,若将所分离的单细胞移植于疾病部位,则通过扩散及吸收等而从目标部位流出,因此,细胞的停留率低。此外,由于间充质干细胞为附着性强的细胞,当被分离为单细胞时,存在会在6~24小时内被死灭且生存率非常低的缺点。
在wo2006/004951号中公开了从生物相容性支架内的成体间充质干细胞(msc)对规定形态和规模的软组织重新(denovo)进行体内(invivo)合成的方法及通过该方法制备的组合物。在上述文献中提出了利用生物相容性支架使用水凝胶聚合物的方法,更具体地,使用聚乙二醇二丙烯酸酯的方法。但是,上述组合物用于修复软组织的结合,在将聚乙二醇二丙烯酸酯作为支架来使用的情况下,仅预测到需要使直径几乎无变化,但对于在培养后填充于注射器并及时进行给药的制备过程,没有公开或暗示。
韩国授权专利第1289834号中公开了包含羊水来源干细胞的括约肌再生细胞治疗剂,若上述细胞治疗剂注入于水凝胶复合体,具体地,注入于藻酸盐/pf-127/透明质酸,则其效果会增大。但是,在上述文献中,并没有公开可通过改善收集干细胞的过程本身来提高取得率。
韩国授权专利684940号中公开了将间充质干细胞分化为软骨细胞的方法,更具体地,公开了通过将间充质干细胞固定于包含作为生物降解性高分子的纤维蛋白/ha的混合支撑体来进行培养的方法。但是,在上述文献中,仅公开了在将纤维蛋白/ha作为支撑体来使用的情况下,无需添加为了以往的细胞分化而添加的转化生长因子β(tgf-beta),也可以促进间充质干细胞分化为软骨细胞。
在以往的方法的情况下,在最终移植细胞准备过程中,进行酶处理,因此会对细胞间结合和基底膜蛋白质造成损伤,在细胞收集、清洗、小瓶填充步骤以及从小瓶重新填充至注射器的各步骤中,会发生细胞损失,并且存在如下的问题,即,进行酶处理后,仅收集单细胞并进行注射,因此,在细胞培养期间所合成的如胶原蛋白的大部分活性物质被去除。
对此,在本发明中,提供在水凝胶中细胞后,进行清洗并可向注射器填充来及时进行给药的形态的组合物,从而在最终移植细胞准备过程中,无需进行酶处理,且无需进行利用离心分离等的清洗步骤,而是以水凝胶状态进行清洗,因此,几乎无细胞损失,而且生理活性物质插入在水凝胶孔内,从而从给药到个体之后开始呈现治疗效果,通过在如上所述的方面重新推究来完成了本发明。
现有技术文献
专利文献
wo2006/004951号
韩国授权专利第1289834号
韩国授权专利684940号。
非专利文献
wux,renj,lij.,cytotheray,2012may;14(5):555-62
liaoht.etal.,j.trauma.,2011jan;70(1):228-37
wangk.etal.,tissueengparta.,2012dec;18(23-24):2507-17
fangh.etal.,jhuazhongunivscitechnologmedsci.,2004;24(3):272-4
inokkimetal.,tissueengparta.,2013;19(21-22):2373-81.
技术实现要素:
技术问题
本发明的目的在于,提供如下的细胞组合物的制备方法及由此获得的组合物,即,为了将从人的脂肪组织分离的间充质干细胞使用于疾病治愈,而最大限度得到改善的方法:1)在充分培养细胞后收集的过程中,防止细胞的损失,2)防止因蛋白酶处理等而发生的细胞损失,3)在目标部位使细胞损失最小化。并且,向注射器填充通过已改善的方法制备的细胞组合物,从而便于使用。通过本发明制备的所填充的细胞-水凝胶可适用为能够利用20~25标准尺寸的针来进行局部给药的所有疾病的治疗剂。
解决问题的方案
为了实现上述目的,本发明提供在水凝胶中培养脂肪来源间充质干细胞后利用注射器收集干细胞-水凝胶的方法。
在本发明的疾病治疗用组合物中,间充质干细胞可以为对cd29、cd44、cd73、cd90等呈阳性且对cd34及cd45呈阴性的自身或同种来源细胞。
在本发明的一实施方式,水凝胶可选自由纤维蛋白胶、透明质酸或其衍生物、明胶、胶原蛋白、褐藻酸、纤维素及果胶组成的组中,此时,形成纤维蛋白胶的纤维蛋白原的浓度可以为0.4mg/ml至1.8mg/ml,更具体地,可以为0.9mg/ml至1.6mg/ml。
在本发明的一实施方式,将100000~2000000个干细胞与1ml的水凝胶相混合并向12~24孔板中添加1ml~2ml来制备凝胶后,添加培养基培养3~6天来制备。培养基可以为(用于治疗瘘孔的自身及同种的脂肪来源基质干细胞组合物,授权号:1,328,604)在现有的专利中提出的包含10%的胎牛血清(fbs)及碱性纤维母细胞生长因子(bfgf)或表皮细胞生长因子(egf)的达尔伯克改良伊格尔培养基(dmem)或者包含1~10%的人血清白蛋白和通过现有专利(包含高浓度的细胞生长因子的间充质干细胞培养液的制备方法及由此获得的组合物)来制备的1~50%的组合物的达尔伯克改良伊格尔培养基。
发明的效果
在包含本发明的脂肪来源间充质干细胞-水凝胶的组合物的制备方法中,在水凝胶中细胞后,进行清洗并随即向注射器填充来使用,从而在最终移植细胞准备过程中,无需进行酶处理,且无需进行利用离心分离等的清洗步骤,而是以水凝胶状态进行清洗,因此,几乎无细胞损失,而且生理活性物质插入在水凝胶孔内,从而从给药到个体之后开始呈现治疗效果,因此非常有用。
更具体地说明,在包含本发明的脂肪来源间充质干细胞-水凝胶的组合物的制备方法中,无需进行利用蛋白酶的隔离(筛选)步骤,防止因以往的细胞收集过程而发生的细胞损失,从而可有效取得细胞。并且,可将通过如上所述的方法取得的干细胞以高活性状态给药到疾病部位,被给药的细胞停留在目标部位直到水凝胶被分解而全部被吸收为止,从而可持续呈现治疗效果。而且,在培养步骤中,从间充质干细胞分泌的如胶原蛋白、层粘连蛋白、纤维连接蛋白、弹性蛋白的细胞外基质以完整地插入水凝胶的方式来存在,从而相比于以往的治疗剂,呈现治疗能力明显有效、可缩短治疗期间的有益的效果。
实验结果表示,在本发明的脂肪来源间充质干细胞-水凝胶中,干细胞在水凝胶中生存一周以上并维持成纤维细胞形态,因此相比于以往的干细胞治疗剂,生存期间明显增加,并且,在一周期间持续分泌促进细胞生长及血管形成的多种生长因子和细胞因子,并不仅分泌大量的多种细胞外基质,而且分泌出的细胞外基质停留在水凝胶中,当被接种到体内时,提供多种基质,从而可容易进行伤口治愈。并且,不引发免疫反应,并抑制反而在被激活的免疫细胞中分泌出的作为炎症引发物质的肿瘤坏死因子α(tnf-alpha),来缓解炎症,从而具有可有助于伤口治愈的优点。
附图说明
图1为人脂肪来源间充质干细胞-水凝胶照片,图1的a部分为培养后形成细胞-水凝胶的状态,图1的b部分为向注射器填充图1的a部分的细胞-水凝胶后的照片,图1的c部分和d部分用照片示出将填充于注射器的细胞-水凝胶通过针注射的过程及注射后维持凝胶的原形态。
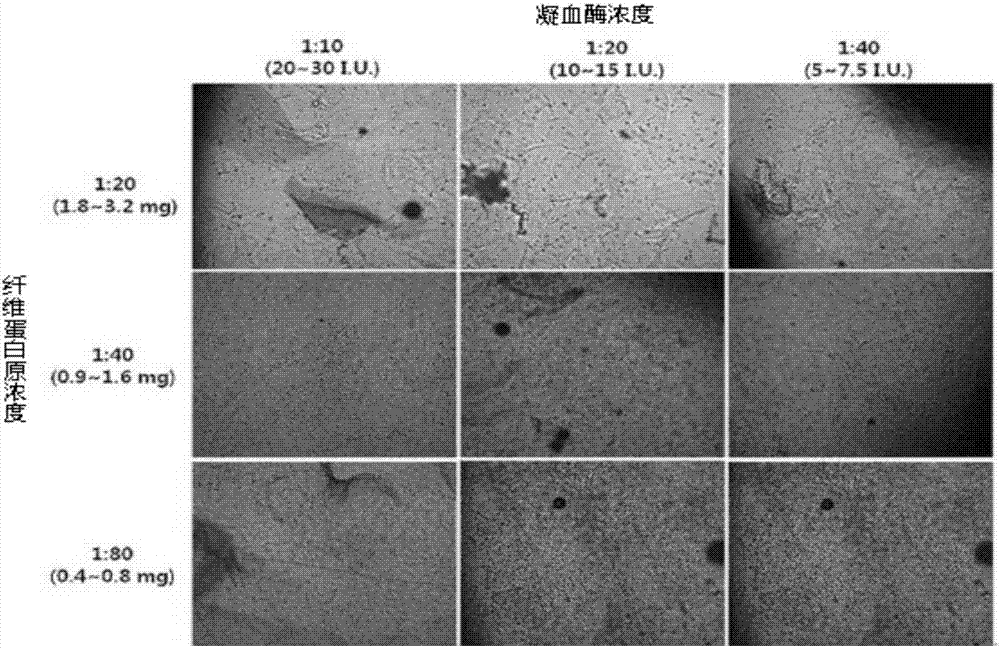
图2a为利用光学显微镜观察向注射器填充将纤维蛋白原及凝血酶溶液与分阶段进行稀释而制成的纤维蛋白凝胶相混合来培养的人脂肪来源间充质干细胞并及时通过23标准规格的针注射的干细胞-水凝胶的照片(100倍率)。最后,对在水凝胶中的纤维蛋白原和凝血酶的稀释倍数及浓度进行标记。
图2b在与体内温度相同的37℃保管填充于注射器的细胞-水凝胶24小时后通过23标准规格的针注射后利用光学显微镜进行观察的照片(100倍率)。最后,对在水凝胶中的纤维蛋白原和凝血酶的稀释倍数及浓度进行标记。
图3为示出在对根据以往的技术第二次培养的细胞进行收集、清洗、小瓶填充以及注射器填充的各步骤中的细胞回收率和在对水凝胶中培养的细胞进行收集、清洗、向小瓶填充以及向注射器填充的步骤中的细胞回收率的曲线图。
图4为将根据以往的技术第二次培养并向小瓶填充的细胞(比较例1)和在水凝胶中培养并向注射器填充的细胞-水凝胶(实施例3)的存活率利用吖啶橙/溴化乙锭(ao/etbr)进行染色来示出的照片。
图5为利用酶联免疫吸附分析法对作为包含在根据以往的技术进行第二次培养、收集、清洗、填充的细胞悬浮液(比较例1)和在水凝胶中进行培养、清洗、填充于注射器的细胞-水凝胶(实施例3)的细胞外基质的胶原蛋白ⅰ型的量进行定量来示出的曲线图。
具体实施方式
本发明提供包含脂肪来源间充质干细胞-水凝胶的组合物的制备方法,在使用本发明的制备方法的情况下,在水凝胶中细胞后,进行清洗并及时向注射器填充来使用,从而在最终移植细胞准备过程中,无需进行酶处理,且无需进行利用离心分离等的清洗步骤,而是以水凝胶状态进行清洗,因此,几乎无细胞损失,而且生理活性物质插入在水凝胶孔内,从而从给药到个体之后开始呈现治疗效果,因此非常有用。
以下,更详细地说明本发明。
本发明涉及间充质干细胞-水凝胶组合物的制备方法,包括步骤(a),培养脂肪来源间充质干细胞;步骤(b),对所培养的上述脂肪来源间充质干细胞和水凝胶进行混合来形成凝胶;以及步骤(c),培养上述凝胶。
在本发明的一实施方式中,作为水凝胶,可使用选自由纤维蛋白胶、透明质酸、明胶、胶原蛋白、褐藻酸、甲壳质、纤维素、果胶、甲基丙烯酸2-羟基乙酯衍生物及其共聚物、聚氧化乙烯以及聚乙烯醇组成的水凝胶组中的一种或两种以上的复合体,更具体地,作为水凝胶,可使用选自由纤维蛋白胶、透明质酸、明胶、胶原蛋白、褐藻酸、纤维素及果胶组成的组中的一种或两种以上的复合体,更具体地,可使用纤维蛋白胶。
在本发明的一实施方式中,上述纤维蛋白胶可包含浓度为0.4mg/ml至1.8mg/ml的纤维蛋白原,更具体地,可包含浓度为0.9mg/ml至1.6mg/ml的纤维蛋白原。实验结果表示,在纤维蛋白胶的最终浓度超过上述范围的情况下,不利于细胞增殖或者发生细胞和水凝胶分离现象。
在本发明的一实施方式中,纤维蛋白胶可包含浓度为1i.u./ml至300i.u./ml的凝血酶,具体地,可包含浓度为5i.u./ml至30i.u./ml的凝血酶,更具体地,可包含浓度为10i.u./ml至15i.u./ml的凝血酶。在上述范围内,在细胞的增殖及细胞-水凝胶附着性方面上不会发生问题。
在本发明的一实施方式中,在步骤(c)之后,还可包括向安瓶、小瓶或注射器填充间充质干细胞-水凝胶组合物的步骤(d)。可使用20~25标准规格的针对通过上述本发明的制备方法来制备的脂肪来源间充质干细胞-水凝胶组合物进行局部给药。
在本发明的一实施方式中,在步骤(d)中制备的在填充于安瓶、小瓶或注射器的间充质干细胞-水凝胶中计数而得的细胞数可以为对在步骤(c)中取得的间充质干细胞进行计数而得的细胞数的70%以上,更具体地,可以为80%以上。
实验结果表示,在使用以往的方法的情况下,在填充于注射器的状态下测定的结果,约70%以上的细胞被损失,相反地,在使用本发明的制备方法的情况下,只有不到20%左右的细胞被损失,因此,相比于以往的方法,使用本发明的制备方法则明显降低细胞的损失率。
本发明提供包含通过上述方法来制备的间充质干细胞-水凝胶组合物作为有效成分的细胞治疗剂。
在本发明中,术语“细胞治疗剂”是指从人分离、培养及通过特殊操作来制备的细胞及组织,作为治疗、诊断及预防的目的来使用的医药品。尤其,是指为了修复细胞或组织的功能而通过在体外对自身、同种或异种细胞进行增殖筛选或者利用其他方法来使细胞的生物学特性发生变化等一系列行为,作为治疗、诊断及预防的目的来使用的医药品。根据细胞的分化程度,将细胞治疗剂分为体细胞治疗剂、干细胞治疗剂,更具体地,本发明涉及脂肪来源干细胞治疗剂。
在本发明中,“个体”是指可通过给药本发明的细胞治疗剂来预防或治疗的疾病已发病或者可能会发病的、包括人在内的所有动物。
以下,通过实施例对本发明进行更详细的说明。但是下述实施例仅用于容易地理解本发明,本发明的要求保护范围并不限定于此。
实施例1.人脂肪来源间充质干细胞培养方法
通常,可通过抽脂手术来取得脂肪组织,但并不限定于此。
从通过抽脂来取得的脂肪组织通过如下的方法分离脂肪来源间充质干细胞。为了去除血液而利用与脂肪组织体积相同的体积的磷酸缓冲盐溶液(pbs)对脂肪组织进行3~4次清洗。放入与脂肪组织体积相同的体积的胶原酶溶液,在37℃的水浴中进行反应。将脂肪组织移动至离心分离用管中,在20℃、1500rpm下,进行离心分离10分钟。去除作为上层液的脂肪层,小心平稳地分离下层的胶原酶溶液。放入基质培养进行悬浮后,在在20℃、1200rpm下,进行离心分离5分钟。此时,沉淀下来的是基质-血管组分,并去除了上层液。使基质-血管组分悬浮于基质培养基并接种于培养容器,在37℃、5%的co2培养箱中进行培养24小时。去除培养液后,利用磷酸盐缓冲液进行清洗,利用基质培养基或者在基质培养基中以1ng/ml的浓度包含的碱性纤维母细胞生长因子的增殖培养基或者在基质培养基中以5ng/ml的浓度包含的表皮细胞生长因子的培养基进行增殖。若脂肪来源间充质干细胞生长至培养容器的80~90%左右,则通过进行胰蛋白酶处理并分离为单细胞来取得。
实施例2.纤维蛋白胶水凝胶的浓度决定
向在上述实施例1取得的5×105个/ml的脂肪来源间充质干细胞中以1:10、1:20、1:40的比例添加凝血酶溶液(400~600i.u.)。将纤维蛋白原(71.5~126.5mg/ml)分别以1:20、1:40、1:80的比例进行稀释来准备。利用双筒注射器系统向12孔板的各孔(well)中分别添加500~700μl的包含纤维蛋白原和凝血酶的细胞悬浮液。若凝胶完全凝固,则添加包含10%的胎牛血清、1ng/ml的碱性纤维母细胞生长因子的培养基后,在37℃、5%的co2培养箱中进行培养5天。利用达尔伯克改良伊格尔培养基清洗3次后添加包含1ng/ml的碱性纤维母细胞生长因子的达尔伯克改良伊格尔培养基,在37℃、5%的co2培养箱中进行培养约12小时。去除上层液,利用1ml的注射器收集细胞-水凝胶。将23标准规格的针连接在注射器,将细胞-水凝胶推入皿后,利用光学显微镜进行观察。
图1的a部分为将在12孔中培养的细胞-水凝胶移动至皿后进行观察的照片,示出形成水凝胶后在培养期间维持原状态。
图1的b部分示出向注射器填充细胞-水凝胶,细胞-水凝胶填充于注射器之后也维持凝胶的原状态。
图1的c部分为在填充有细胞-水凝胶的注射器连接23标准规格的针后注射细胞-水凝胶的过程,可从图1的d部分看出,通过23标准规格的针注射的细胞-水凝胶仍然维持水凝胶的原形态。
图2a为向注射器填充以各比例制备的细胞-水凝胶并通过23标准规格的针向孔板注射后利用光学显微镜观察的照片。图2a示出,纤维蛋白胶的稀释浓度越低,细胞的增殖越优秀,在纤维蛋白胶的最终浓度为0.9~1.6mg/ml或0.4~0.8mg/ml的情况下,细胞的增殖优秀,且细胞和纤维蛋白胶水凝胶很好地融合在一起。没有观察到基于凝血酶浓度的显著差异。
图2b为向注射器填充以各比例制备的细胞-水凝胶并通过在37℃放置24小时的23标准规格的针向孔板注射后利用光学显微镜观察的照片。图2b示出,在纤维蛋白原的最终浓度为1.8~3.2mg/ml和0.4~0.8mg/ml的情况下,细胞和水凝胶几乎分离,但当纤维蛋白原的最终浓度为0.9~1.6mg/ml时,细胞很好地融合在水溶胶内直到经过24小时。没有观察到基于凝血酶浓度的显著差异。
实施例3.细胞-水凝胶培养液的制备
向在上述实施例1取得的5×105个/ml脂肪来源间充质干细胞中以1:20的比例添加凝血酶溶液,将纤维蛋白原以1:40的比例进行稀释来准备后,按照实施例2进行培养,进行清洗后,向注射器填充。
比较例1.使用以往细胞治疗剂的培养法的制备
作为以往的细胞治疗剂培养法,使用如下的方法。
在培养容器中培养脂肪来源间充质干细胞后,当填至80%左后时,添加胰蛋白酶-乙二胺四乙酸分离为单细胞后,利用包含胎牛血清的达尔伯克改良伊格尔培养基使酶非活性化,收集至离心分离用管后,以1500rpm进行离心分离。去除上层液后,为了去除胎牛血清而添加达尔伯克改良伊格尔培养基来使细胞悬浮后,再以1500rpm进行离心分离,去除上层液。供清洗3次,在最后步骤中,将细胞悬浮为适当体积的细胞悬浮剂后,向小瓶填充。将所填充的细胞移动至连接有23标准规格的针的1ml的注射器。
实验例1.细胞回收率测定试验
在上述实施例3的各步骤中,添加tryple表达酶使纤维蛋白胶溶解后,测定细胞数。同样,在比较例1的各步骤中,测定细胞数。
图3a为当按照以往的制备方法(比较例1)制备细胞治疗剂时,将在各步骤中的细胞回收率与最初收集步骤(胰蛋白酶-乙二胺四乙酸非活性化)进行比较来示出的曲线图,图3a示出,在各步骤中减少了10~25%,最终,在向注射器填充之后,相对于最初收集步骤,仅回收了约30%的细胞。
图3b为当按照本发明的制备方法(实施例3)制备细胞治疗剂时,将在各步骤中的细胞回收率与最初收集步骤(结束培养后)进行比较来示出的曲线图,图3b示出,在各步骤中细胞减少了1~5%,最终,至向注射器填充的步骤,回收了约80%以上的细胞。
实验例2.在细胞-水凝胶中培养的细胞的存活率及细胞形态
按照上述实施例3在水凝胶中培养并向1ml的注射器填充后,在常温下进行保管,在0、24、48小时及7天后,利用吖啶橙/溴化乙锭(acridinorange/etidiumbromide)进行染色来测定细胞存活率。作为对照组,利用在上述实施例3中按照以往的方法来制备并向小瓶填充的细胞。
如图4所示,通过以往的方法来制备并向小瓶填充的细胞在0小时维持95%以上的高存活率,但在第24小时细胞开始被死灭且细胞膜被破坏而无法维持细胞形态或者凝结,在第72小时几乎所有细胞被死灭而没有被观察。相反,在细胞-水凝胶中培养的细胞一直生存至第7天,而且维持成纤维细胞的原形态。
实验例3.包含在细胞-水凝胶的细胞外基质
对按照上述实施例3在水凝胶中培养并填充于1ml的注射器的细胞-水凝胶进行酶处理并使其溶解后,利用酶联免疫吸附分析法(elisa)对胶原蛋白i型的量进行分析。作为对照组,利用按照上述实施例3的以往的方法进行培养后填充于1ml的注射器细胞悬浮液。
如图5所示,按照以往的细胞治疗剂制备方法来培养的细胞悬浮液中几乎不含有胶原蛋白,但在细胞-水凝胶含有3μg/ml以上的胶原蛋白。
产业上可利用性
在包含本发明的脂肪来源间充质干细胞-水凝胶的组合物中,在水凝胶中细胞后,进行清洗并及时向注射器填充来使用,从而在最终移植细胞准备过程中,无需进行酶处理,且无需进行利用离心分离等的清洗步骤,而是以水凝胶状态进行清洗,因此,几乎无细胞损失,而且生理活性物质插入在水凝胶孔内,从而从给药到个体之后开始呈现治疗效果,因此在产业上非常有用。
- 还没有人留言评论。精彩留言会获得点赞!