在癌症和免疫恢复中监测CD4+1型T辅助细胞应答的方法与流程
本申请要求于2014年3月14日提交的,序列号为61/953,726的美国临时专利申请的优先权和权益。
致谢
本申请是在国立卫生研究院授予的基金号为r01ca096997的部分支持下开发的。政府对于本申请具有一定的权利。
本实施例针对癌症中免疫应答的逐渐损失,尤其是抗-her2/neucd4+1型t辅助细胞(“th1”)应答在her2-驱动的乳腺癌及其恢复中的损失,和基于其的诊断监测方法,治疗方法和工具。
背景技术:
乳腺癌(“bc”)是世界范围内癌症相关死亡率的主要原因。见,jemal,a.等,全球癌症统计。ca:癌症临床医生杂志61:69-90(2011)。通过基因表达标记的发展,目前认识到至少四种显著的乳腺肿瘤表型:管腔a型和管腔b型,基底细胞样型和人表皮生长因子受体-2型/neu(“her2pos”)。见,perou,cm.,等,nature406:77-52(2000)。her2过表达,在包括约20-25%乳腺癌的多种肿瘤类型中的驱动分子(meric,f,等,j.amcoll.surg.194:488-501(2002)),与侵袭性临床病程,化学疗法抗性以及乳腺癌的整体不良预后相关。见,henson,e.s.,clin.can.res.12:845-53(2006)(“henson,等”)和wang,g.s.,mol.med.rep.6:779-82(2012)。在乳腺癌初期,her2过表达与增强的侵袭性(roses,r.e.,等,癌症控制措施.生物标记&prev.18(5):1386-9(2009)),肿瘤细胞迁移(wolf-yadlin,a.,等,分子系统生物学2:54(2006)),和促血管生成因子的表达(wen,x.f.,等,致癌基因25:6986-96(2006))相关,表明her2在促进肿瘤发生环境中起到关键性作用。尽管her2-靶向治疗(即,赫赛汀
有越来越多的证据表明肿瘤微环境中强力的细胞免疫应答与乳腺癌中改善预后有关,尤其在her2pos亚型中,见alexe.,g.,等,can.res.67:10669-76(2007)。为此,已经在这些抗肿瘤作用的个体免疫介质的破译中取得了进步。尽管细胞毒素cd8+t淋巴细胞(“ctl”)过去被认为是抗肿瘤免疫的主要效应物(mahmoud,s.m.,等,j.clin.oncol.29:1949-55(2011)),在her2-驱动的乳腺癌中用多肽疫苗推进ctl应答已经产生了最小的临床影响(amin.,a.,等,癌症免疫.免疫疗法.57(12):1817-25(2008)),可能是因为ctl功能在没有合适的cd4+t-淋巴细胞的帮助下是非最优化的,依据bos,r.,等的报道,癌症研究.70:8368-77(2010)。除了对ctls的产生和持续至关重要之外,cd4+t辅助(“th”)细胞通过其他机制调节抗肿瘤作用,包括直接细胞毒素的破坏肿瘤活性,调控抗肿瘤细胞因子应答,和增强长时程免疫记忆(cintolo,j.a.,等,futureoncol.8:1273-99(2012))。通过促进免疫球蛋白的类型转换,th细胞也有助于抗肿瘤体液免疫以及效应b细胞应答。见,parker,d.c.,等,ann.rev.免疫学11:331-60(1993)(″parker,等″)。的确,在肿瘤微环境中产生cd4+1型t辅助细胞(“th1”)的干扰素(“ifn”)-γ的渗透与乳腺癌的改善预后相关。见,gu-trantien,c,等,j.clin.inv.123:2873-92(2013)。
然而,在her2-驱动的乳腺肿瘤发生的全身抗-her2cd4+th1应答的作用尚不明确。仍然迫切需要预测治疗失败高风险患者亚群的策略,以及提高使用曲妥单抗的her2-靶向治疗和化学疗法的应答率的方法。因此,本申请的一个或多个实施例旨在应对在此提到的一个或多个问题。
技术实现要素:
在一个广义方面,本发明提供了诊断或治疗患有癌症或者有发生癌症风险的哺乳动物受试者的方法,包括:从抗原递呈细胞(“apcs”)或其前体细胞以及来自所述受试者的血液样本中的cd4+t-细胞生成循环的抗癌cd4+th1应答,其引起干扰素伽玛(”ifn-γ”)的分泌;和检测所述的抗-癌cd4+th1应答以确定所述应答是否下调。
在另外一个方面,所述生成步骤进一步包括:从所述血液样本中分离未膨胀的外周血单核细胞(“pbmcs”);用组合物脉冲pbmcs和其中的apc-前体单核细胞,所述组合物包括基于使受试者受到折磨的癌症类型的免疫原性ii类mhc结合肽,从而激活pbmc中的cd4+th1细胞以分泌ifn-γ;所述检测步骤包括检测所分泌的ifn-γ。
在可供选择的方面,所述生成步骤进一步包括:将来自受试者样本中纯化的cd4+t细胞与来自受试者样本的、用组合物脉冲过的apc未成熟或成熟的树突状细胞(”dcs”)共同培养,所述组合物包括基于使受试者受到折磨的癌症类型的免疫原性ii类mhc结合肽,从而激活cd4+t细胞以分泌ifn-γ;所述检测步骤包括检测所分泌的ifn-γ。
在另一方面,所述癌症选自由乳腺癌,脑癌,膀胱癌,食管癌,肺癌,胰腺癌,肝脏癌,前列腺癌,卵巢癌,大肠癌和胃癌或其任意组合所组成的组。
在另一方面,所述癌症是表达her2的。
再一方面,所述癌症是her2-阳性乳腺癌,所述受试者是人类女性,并且所述免疫原性ii类mhc结合肽是基于her2分子的。
在优选的实施例中,所述的组合物进一步包括her2ii类mhc抗原结合肽,其包括:
肽42-56(seqidno:1);肽98-114(seqidno:2);肽328-345(seqidno:3);肽776-790(seqidno:4);肽927-941(seqidno:5);和肽1166-1180(seqidno:6)。
在优选的实施例中,采用ifn-γ酶联免疫斑点法(″elispot″)测定所述ifn-γ的产生。
在另一方面,在有需求的her2-阳性乳腺癌患者中恢复her2-特异性cd4+th1免疫应答的方法,包括:向所述患者施用治疗有效量的树突状细胞疫苗(dcvaccine),所述树突状细胞疫苗包括用免疫原性her2ii类mhc结合肽脉冲过的自体树突状细胞(“树突状细胞疫苗接种”,dcvaccination)以提高所述患者的抗-her2cd4+th1应答的;和根据上述方面的生成和检测步骤来测定所述患者接种树突状细胞疫苗之前和之后的抗-her2cd4+th1应答以确定在所述应答中的增加量,其中所述恢复方法进一步包括:通过在一个或多个附加时间间隔实施上述方面的生成和检测步骤来测定接种树突状疫苗之后患者的抗-her2cd4+th1应答恢复状态,以监测所述应答恢复。
在另一方面,筛选乳腺癌或其他癌症个体的方法,包括:根据上述方面的生成和检测步骤的方法来检测个体的抗-her2cd4+th1应答,以确定与健康个体相比,所述应答是否下调。
在另一方面,筛选有发生乳腺癌或其他癌症风险的个体的方法,包括:根据上述方面的生成和检测步骤的方法来检测所述个体的抗-her2cd4+th1应答,以确定与健康个体相比,所述应答是否下调。
在另一方面,预测her-阳性乳腺癌患者是否对例如化学疗法和曲妥单抗的标准非免疫治疗应答良好的方法,包括:根据上述方面的生成和检测步骤的方法来检测所述患者的抗-her2cd4+th1应答。
在另一方面,在用化学疗法和曲妥单抗治疗的her2-阳性-侵袭性乳腺癌(“her2pos-ibc”)患者中预测新的乳腺事件的方法,包括:根据上述方面的生成和检测步骤的方法来测定所述患者的抗-her2cd4+th1应答,以确定所述应答是否下调。
在另一方面,预测her2-阳性乳腺癌患者经新辅助治疗曲妥单抗和化学疗法(“t/c”)之后her2-阳性乳腺癌的病理学应答的方法,包括:根据上述方面的生成和检测步骤的方法在t/c治疗后的患者中测定抗her2-cd4+th1应答性的程度,以确定所述应答是否是与新辅助治疗病理学完全应答相关(在术后病理无残留的浸润性乳腺癌)的显著升高的抗-her2cd4+th1应答,或者是与非病理学完全应答相关的较低的应答,并且进一步,在所述患者的非病理学完全应答的情况下,所述患者的抗-her2cd4+th1应答通过dc疫苗接种得以恢复。
在另一广义方面,诊断或治疗患有癌症或有发生癌症风险的哺乳动物受试者的方法,包括:从所述受试者获取血液;和在抑制的情况下,进行血液检测以测定抗癌cd4+th1应答的抑制;从选自由dc疫苗,曲妥单抗等癌症靶向治疗,化学疗法,手术和辐射等常规癌症治疗所组成的组中选择向所述受试者施用有效量的癌症药物。
为了更好地理解示例性实施例,及其他和其进一步的特征及优点,参照下文描述,结合附图,通过所附权利要求指出本实施例所要求的范围。
附图说明
当结合附图进行阅读时,如下优选实施例的具体描述将得到更好地理解。为了说明实施例,在附图中示出了目前优选的实施例。然而,应该理解,优选实施例不是受限于附图中示出的的实施例的精确排列和手段。
图1是表示包括在这里描述的研究中的患者/供体组的层次结构图表。框格被标记a-h。框格g和框格h的治疗方案以及抽血的时间点用红色标注框表示。特别地,在t/c治疗的her2pos-ibc框格中(g),患者接受新辅助治疗t/c中的任意一个,随后通过手术并以佐剂曲妥单抗作为结束;患者选用手术-优先的方法并以佐剂t/c作为结束。在完成佐剂曲妥单抗<6个月或者≥6个月进行抽血。
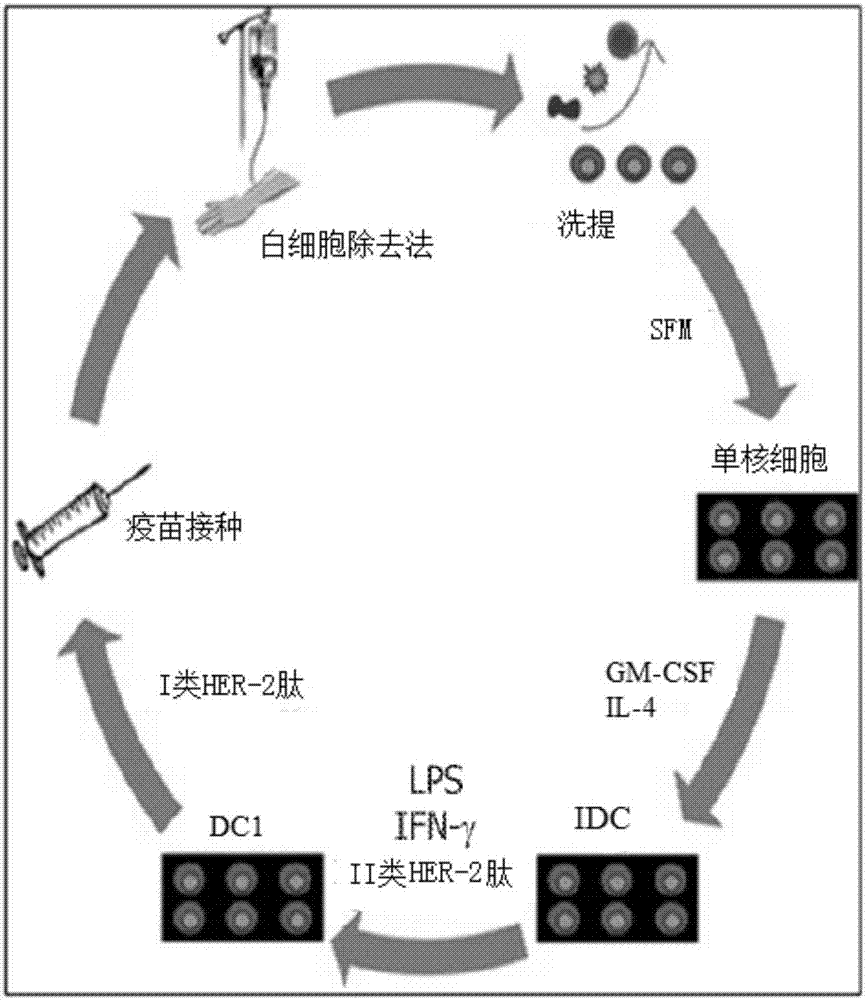
图2示出了树突状细胞(“dc”)疫苗接种策略。通过白细胞除去法和洗提,将患者的单核细胞首先从其他白细胞中分离出来。将这些单核细胞在无血清培养基(“sfm”)中与粒细胞-巨噬细胞集落刺激因子(“gm-csf”)以及白介素(“il”)-4进行培养以变为未成熟的树突状细胞(“idcs”或“idcs”)。然后将这些细胞与6种her2ii类mhc结合肽进行脉冲,并且添加干扰素(“ifn”)-γ和脂多糖(“lps”)来完成成熟和激活过程,从而在注射回患者之前实现全部dc激活为dc1s。见,fracol,m.,等,ann.surg.oncol.20(10):3233(2013)。至于hla-a2pos患者,有一半的细胞与i类mhc结合肽进行脉冲,另外一半细胞与不同的mhc1类结合肽进行脉冲。
图3a和3b是示出elispot试验间精密度的图表。对于图3a的研究来自,在elispot试验中具有已知的不同的抗her2反应活性的5个供体(用不同的符号表示)的样本在3天内进行三个平行重复。对于用her2胞外结构域(“ecd”)肽混合物(肽42-56(seqidno:1)),肽98-114(seqidno:2)和肽328-345(seqidno:3)体外刺激的供体,针对其累积的抗her2th1应答(“平均sfc(斑点形成细胞)/2x105细胞”)绘制平均变异系数(“平均cv”),误差条表示各重复间的标准偏差(“sd”)。对于作为实验间变异测定的每个供体(用不同的符号表示),图3b示出了针对其累积的th1应答(“平均sfc/2x105细胞”)绘制的在单独各天三组试验之间的标准差(“sd”)。连接线表示产生的sd的线性回归,用平行虚线示出回归的95%置信区间。
图4示出了说明elispot线性关系的图表。来自两个高应答的her2-反应供体(供体#1,(三角形)和供体#2(圆形))的一式三份的外周血单核细胞(“pbmcs”)被逐级稀释至来自己知的异源非-her2应答者的pbmcs中(其对于所有该试验是相同的pbmc供体),用her2ecd肽混合物(肽42-56(seqidno:1),肽98-114(seqidno:2)和肽328-345(seqidno:3))对其在体外刺激。在elispot试验中为每个稀释点减去没受刺激的背景。
图5a-5d示出了抗-her2cd4+th1应答和igg1/igg4反应活性在her2pos乳腺肿瘤发生逐渐损失。图5a示出了系统性cd4+t细胞和抗her2cd4+th1应答的ifn-γelispot分析的柱形图(左侧);相应地,患者组之间的post-hocscheffep-值比较在柱形图的旁边(右侧)示出。研究的患者组是:hd(健康供体);bd(良性乳腺活组织检查);her2negdcis;her2negibc(非可疑her2neg(her20和1+)浸润性乳腺癌);her2posdcis(her2pos导管原位癌);和her2posibc(阶段i/iiher2pos浸润性乳腺癌)。顶部的柱形图示出了整体抗her2的应答率(%100)(患者对反应肽的应答率大于1%)(也被称为“抗-her2应答率”);中间的柱形图示出了反应肽的平均数(n)(将组中的患者作出反应的反应肽(n)的平均数目作为整体)(也被称为“应答组库”);底部的柱形图示出了平均总sfc/106细胞(来自每个受试组的所有6种ii类mhc结合肽反应斑点的总和(来自ifn-γelispot分析的每106细胞的斑点形成细胞“sfc”))(也被称为“累积应答”)(所有方差分析p<0.001)。当通过抗her2应答率,应答组库和累积应答进行评估时,在her2pos乳腺肿瘤发生中示出了cd4+th1应答的逐渐损失(即,hd/bd→her2pos-dcis→her2pos-ibc)。在her2neg-dcis和her2neg-ibc(ihc0/1+)以及hd/bd受试者中没有发现th1应答的区别。图5b通过elispot(累积应答(平均总sfc/2x105细胞))示出了与图5a中所示的在分别相同的患者组以及t/c治疗的her2pos-ibc患者组("t/c"意思是曲妥单抗和化学疗法)中的ifn-γ的分泌,。结果通过在盒须图中的每2x105细胞的中位值±四分位数间距(″iqr")ifn-γsfc表示。图5c通过供体年龄(年龄<50相比年龄≥50)(左上侧),绝经状态(绝经前相比绝经后)(右上侧),人种(白种人相比其他人种)(左下侧)以及怀孕(0相比≥1次怀孕)(右下侧)分层的示出了hd/bds中抗her2th1累积应答差异的柱形图。在每个th1度量标准内,结果通过比例或平均值(±sem)表示。图5d示出了针对重组her2ecd肽的血清反应活性的elisa结果。elisa测定以在1∶100血清稀释条件下的光密度值(“od”)示出(分组的散点图,用横线表明平均od值)。在hd(圆圈/左边),her2pos-dcis(正方形/中间)和her2pos-ibc(三角形/右边)患者中测定抗-her2igg1抗体水平(顶侧)和抗-her2igg4抗体水平(底侧)(通过未配对t-检验或使用post-hocscheffe检测的方差分析,***d<0.001,作为准据)。与健康供体(hds)相比,抗-her2igg1和igg4的抗体水平在her2pos-dcis患者中表现出显著升高,在her2pos-ibc患者中衰减。
图6示出了对于hd(健康供体);bd(良性乳腺活组织检查);her2negdcis;her2negibc(非可疑her2neg(her20和1+)浸润性乳腺癌);her2posdcis(her2pos导管原位癌);和her2posibc(阶段i/iiher2pos浸润性乳腺癌)的患者单个her2肽对her2pos乳腺肿瘤发生中累积的cd4+th1免疫的贡献不反映免疫雕塑(immunesculpting)。使用her2胞外结构域(“ecd”)-限制性肽和胞内结构域(“icd”)-限制性肽。示出了ecd肽42-56(“ecdp42-56”)(seqidno:1)(左上角);ecd肽98-114(“ecdp98-114”)(seqidno:2)(左中部)和ecd肽328-345(“ecdp328-345”)(seqidno:3)(左下角)和icd肽776-790(“icdp776-790”)(seqidno:4)(右上角);icd肽927-941(“icdp927-941”)(seqidno:5)(右中部);和icd肽1166-1180(“icdp1166-1180”)(seqidno:6)(右下角)的th1反应性情况。个体的特异性肽应答通过elispot以每2x105个外周血单核细胞(pbmcs)的平均ifn-γsfc描述。th1反应性情况示出了在her2pos乳腺肿瘤发生中抗her2th1免疫力的连续显著性逐步下降(hd→bd→her2neg→dcis→her2neg-ibc→her2pos-dcis→her2pos-ibc)(通过方差分析,所有p<0.005)。结果以平均值±sem表示。
图7示出了供体抗her2th1应答的最低时间变率。为成对hd(绿色三角型;n=4)和之前未经治疗的her2pos-ibc受试者(蓝色正方形;n=4)绘制从相距至少6个月获取的血液样本产生的与供体匹配的抗her2th1累积应答(左侧)和应答组库(右侧)。随时间观察hd和之前未经治疗的her2pos-ibc受试者供的最低体内th1反应变异性。
图8a-8e示出了her2pos-ibc中抗her2th1的亏损并不是由于缺乏免疫活性或免疫抑制表型的增强,而是与ifn-γ:il-10-生产表型的功能转变有关。图8a通过测定累积的th1应答(意思为平均总sfc/105细胞)示出ifn-γ的生产来回忆(recall)ifn-γelispot中破伤风类毒素或白色念珠菌的刺激物。结果通过在盒须图中的每2x105细胞对应的中位值±四分位数间距(″iqr″)ifn-γsfc表示。来自her2pos-ibc患者的外周血单核细胞,与健康供体的外周血单核细胞没有显著的不同,所述患者无论是未接受过治疗的还是接受t/c治疗的。图8b,顶侧,使用来自hd,her2pos-ibc(阶段i/ii)和her2pos-ibcs/pt/c(t/c-治疗的患者)患者的外周血单核细胞示出了的有代表性的流式细胞术染色以确定它们的免疫表型。底部柱形图分别示出和表示了cd4+(cd3+cd4+)(顶部染色)或cd8+(cd3+cd8+)t细胞(底部染色)的相对比例,其分别示出了患者组的cd4+(cd3+cd4+)t细胞(左侧)和cd8+(cd3+cd8+)t-细胞(右侧)的相对比例:hd(深色柱),阶段i/iiherpos-ibc(中间柱)和her2pos-ibcs/pt/c(浅色柱)。来自her2pos-ibc患者的pbmc,与健康供体的pbmc没有显著的不同,所述患者无论是未接受过治疗的还是接受t/c治疗的,。图8c,顶侧,使用来自hd,her2pos-ibc(阶段i/ii)和her2pos-ibcs/pt/c的外周血单核细胞示出有代表性的流式细胞术染色以确定它们的免疫表型。较低的柱形图分别示出和表示调节性t细胞(“treg”;cd4+cd25+foxp3+)(顶部染色)和髓源性抑制细胞(“mdsc”;cd11b+cd33+hla-dr-cd83-)(底部染色)的相对比例,患者组的调节性t细胞(″treg″;cd4+cd25+foxp3+)(左侧)或髓源性抑制细胞(“mdsc”;cd11b+cd33+hla-dr-cd83-)(右侧)的相对比例:hd(深色柱),阶段i/iiherpos-ibc(中间柱)和her2pos-ibcs/pt/c(浅色柱)。来自her2pos-ibc患者的pbmc,无论患者是之前未经治疗的还是经过t/c治疗,与健康供体没有显著的不同。图8d示出了循环her2-特异性il-10的分泌不会在患者组之间变化。通过elispot,来自her2pos-ibc患者的外周血单核细胞,所述患者无论是未接受过治疗的(“her2pos-ibc”)还是接受t/c治疗的(her2pos-ibcs/pt/c),与健康供体在抗-her2il-10分泌没有显著的不同,以整体抗-her2的应答率(顶部),组库(中部)以及累积应答(底部)进行评估。结果通过比例或平均值±sem表示。图8e示出了在her2pos乳腺肿瘤发生中相对的her2-特异性ifn-γ以及il-分泌。在hd,her2pos-ibc(之前未经治疗的),以及her2pos-ibcs/pt/c(t/c治疗)的患者中对跨越六种her2ii类肽的与供体匹配的累积ifn-γ分泌以及il-10分泌(sfc/106细胞)进行比较。所述柱形图通过跨越患者组的sfc贡献的百分比(柱形图所描述的百分比)为her2抗原-特异反应(顶侧)和阳性对照(cd3或cd8/28)(底侧);(ifn-γ分泌(绿色);il-10分泌(红色))示出了her2-特异性ifn-γ与il-10的相对比例。从健康供体到接受或未接受t/c-治疗的her2pos-ibc患者,her2-特异性ifn-γ与il-10的相对比例显著降低。绝对的ifn-γ:il-10分泌比值变化分别从6.6∶1(hds)到0.97∶1(t/c治疗)和0.74∶1(her2pos-ibc)(顶侧)。对于阳性对照(抗-cd3/抗-cd3/cd28)(底侧)的ifn-γ:il-10分泌没有观察到显著的相对变化。
图9a-9b示出了抗-her2cd4+th1亚群的全身损失与运输至her2pos乳腺病变的比例失调的癌周t淋巴细胞无关。图9a示出了两幅来自her2pos-dcis病变(顶部)和her2pos-ibc肿瘤(底部)有代表性的苏木精和伊红(″h&e″)染色的组织样本(放大柱25μm)的照片。通过免疫组织化学着色,箭头指向与her2pos-dcis病变(顶部)相比,her2pos-ibc肿瘤(底部)癌周基质观察到淋巴细胞浸润相对缺乏。在可评估的her2pos-dcis(n=14)和her2pos-ibc(n=8)中的基质淋巴细胞浸润在照片旁的表中以低(损害<15%),中(15%-24%)和高(>25%)定量。图9b示出了四副在有代表性的her2pos-dcis(左边)和her2pos-ibc(右边)病变中多重标记免疫荧光的结果的照片。在5/5(100%)her2pos-ibc肿瘤中观察到cd4+-t细胞(绿色信号)的显著缺乏,其中主要的浸润和基质淋巴细胞性浸润是cd8+(黄色信号)。通过对比,在包括dcis的导管中(4/4肿瘤)观察到主要的cd4+-t细胞浸润。描述了有代表性的her2pos-dcis和ibc病变;多重标记的图像示出了上述相应的h&e部分(放大柱25μm)。
图10a-10d示出了cd4+th1诱导her2high,而不是her2low人类和鼠类乳腺癌细胞的凋亡。图10a(顶侧)示出了检测裂解的半胱天冬酶-3的蛋白质印迹分析的拍摄结果。将sk-br-3细胞与如下进行共培养:泳道1)-仅用完全培养基(完全培养基);泳道2)-仅用106cd4+t细胞(仅有cd4+);泳道3和4)-106cd4+t-细胞分别加上105her2ii类肽(“idch”)或不相关的ii类braf肽(“idcb”)-脉冲过的未成熟树突状细胞(“idcs”);泳道5和6)-106cd4+t-细胞分别加上105her2(“dc1h”)或braf(“dc1b”)-脉冲过的树突状细胞1s;泳道7)-cd4+106dc1h105+ifn-γ和tnf-αneutrab和泳道8)-cd4+106dc1h105+igg同型对照ab。增加的半胱天冬酶-3裂解表明当与dc1h:cd4+t-细胞而不是dc1b,idch,或idcb组共培养时,sk-br-3细胞剂量依赖性凋亡。粘着斑蛋白用作装载对照。展示的蛋白质印迹是三个试验的代表。中间部分的柱形图(红色柱)示出了以平均半胱天冬酶-3/粘着斑蛋白比率±sem表示的结果,该结果显示了与上面部分泳道1-6的蛋白质印记对应的细胞凋亡倍数(用imagej软件定量)。在柱形图中的右图(黑色柱)(对应于上面部分的蛋白质印迹泳道7-8),这些柱表示三个试验的细胞凋亡拯救率/平均半胱天冬酶-3/粘着斑蛋白比率±sem(31.4±5.3%,ifn-γ/tnf-α中和相比对照组)。与igg同型对照相比较,cd4+:dc1h诱导的sk-br-3细胞凋亡通过中和ifn-γ以及tnf-α得以显著获救。底部通过elisa示出了在各自的共培养中ifn-γ(左侧y轴)(实心柱)和tnf-α(右侧y轴)(线性柱)相应的生产。结果用pg/ml表示,且其代表三个试验。图10b示出了“仅有cd4+”,“cd4++dc1b”,和“cd4++dc1h,”细胞组的细胞照片。通过dapi染色来观察凋亡细胞。当与“cd4++dc1b”或“仅有cd4+”组比较,在cd4++dc1h组观察到数目增多的凋亡细胞(星号)。柱形图(右图)示出了图示三个细胞组的凋亡细胞的百分比(倍数),与视觉效果相关的cd4++dch组的细胞凋亡增加到25倍。结果代表三个试验,并且以凋亡细胞百分比±sem表示。图10c示出了蛋白质印迹分析的拍摄结果,其中her2highsk-br-3,her2intermediatemcf-7,和her2lowmda-mb-231人类bc细胞中一致维持了ifn-γ-ra和tnf-α-r1受体的表达。粘着斑蛋白用作装载对照。图10d示出了与未经处理的对照组(无rx)或选择单一细胞因子的治疗相比,在转基因鼠类her2high乳腺癌tubo(顶图)和mmc15(her2high)细胞(中图)中,重组鼠类(“rm”)th1细胞因子rmifn-γ和rmtnf-α的联合治疗导致细胞凋亡的显著增加。在鼠类her2low/neg细胞4t1(底部图)中用双重rmifn-γ+rmtnf-α治疗,此作用没有重现。结果代表三个试验,并且用凋亡细胞百分比±sem表示,其通过流式细胞仪检测pipos/膜联蛋白vpos的百分比(*p≤0.05,**p<0.01,***p<0.001)获得。
图11a-11c示出了借助th1-elaborated细胞因子ifn-γ和tnf-a,her2high而不是her2low人类bc细胞对cd4+th1介导的细胞凋亡是敏感的。图11a(上部图)示出了检测裂解的半胱天冬酶-3的蛋白质印迹分析的拍摄结果。使用transwell体系,将50x103mcf-7(her2intermediate)和50x103mda-mb-231(her2low)细胞分别与培养基(完全培养基),仅106cd4+t-细胞(仅有cd4+)和106cd4+t-细胞+105每个her2(dc1h)-或braf对照(dc1b)-脉冲dc1s进行共培养。在蛋白质印迹中示出的以及在如下相应的柱形图(较下侧)表示的半胱天冬酶-3裂解表明在当与dc1h:cd4+t-细胞共培养时,mcf-7细胞(左侧)而不是mda-mb-231细胞(右侧)凋亡增加。粘着斑蛋白用作装载对照。展示的蛋白质印迹代表三个试验,其结果用平均半胱天冬酶-3/粘着斑蛋白的比率±sem表示(表明细胞凋亡的诱导倍数)。图11b示出了将50x103sk-br-3细胞与来自图10a中以下操作条件获得的培养上清共培养的蛋白质印迹结果照片[仅用完全培养基;仅用106cd4+t细胞(仅有cd4+);cd4+t-细胞+her2脉冲idc(“idch”);和cd4+t-细胞+braf-脉冲idc(“idcb”);cd4+t细胞+105her2-脉冲dc1(“dc1h”);以及cd4+t-细胞+105braf-脉冲dc1(“dc1b”)]。与dc1b,idch,idcb,或仅有cd4+的组相比,dc1h:cd4+组所检测出的裂解的半胱天冬酶-3水平相对较高。结果代表三个试验。图11c示出了为检测裂解的半胱天冬酶-3,用指示数量的tnf-α以及ifn-γ培养sk-br-3(左侧),mcf-7(中间),和mda-mb-231细胞(右侧)的蛋白质印迹的照片。较低的柱形图对应于顶部展示的蛋白质印迹图的泳道。与未处理的对照相比,用th1细胞因子ifn-γ和tnf-α联合治疗引起sk-br-3(her2high;10ng/mltnf-α+100u/mlifn-γ)和mcf-7(her2mtermediate;100ng/mltnf-α+1000u/mlifn-γ)细胞有较高的细胞凋亡。mda-mb-231细胞(her2low;200ng/mltnf-α+2000u/mlifn-γ)依然在很大程度上没有受到双重ifn-γ+tnf-α治疗的影响。结果代表三个试验。(*p<0.05,**p<0.001)。
图12a-12e示出了抗her2cd4+th1免疫力在her2-脉冲dc1免疫后,而不是在her2-靶向治疗之后有区别地修复,。图12a是通过评估整体抗-her2应答率(顶部),应答组库(中间),和累积应答(底部),得到接受曲妥单抗和化学疗法(“″t/c-治疗her2pos-ibc”)(红色)的her2pos-ibc患者和之前未经治疗的her2pos-ibc患者(“her2pos-ibcnotx”)(黑色)在cd4+th1应答中的柱形图。通过抗her2应答率(顶部),组库(中部)以及累积应答(底部)说明,与之前未经治疗的阶段i/iiher2pos-ibc患者(notx)相比,抗her2th1应答没有在阶段i-iiiher2pos-ibc患者(t/c治疗)的t/c治疗之后得以全局扩增。与notx(n=5)相比,在her2-特异性和破伤风(阳性对照)刺激后,ifn-γ:il-10反应细胞的相对比例(描述在较下方的柱形图的百分比;ifn-γ:实心;il-10:对角线)在t/c治疗(n=5)并没有改进。图12b是通过评估整体抗her2应答率(顶部),应答组库(中部)以及累积应答(底部),得到在her2脉冲-dc1免疫之前和之后(“her2pos-ibcprevax″)(黑色)和(″her2pos-ibcpostvax″)(绿色),her2pos-ibc患者中各自即时的cd4+th1应答的图表。在her2脉冲-dc1免疫(postvax)之后,立即可以在11个第i阶段her2pos-ibc(pervax)患者中观察到全部抗-her2th1免疫度量的显著改善。然而,在破伤风刺激后,ifn-γ与il-10反应细胞的相对比例(描述在较下方的柱形图的百分比;ifn-γ:实心;il-10:对角线)并没有明显改变,与prevax(n=5)患者相比,her2脉冲疫苗接种显著增加了ifn-γ与il:10反应细胞在postvax(n=5)中的相对比例。图12c示出了dc疫苗接种和曲妥单抗/化学疗法在抗her2th1免疫的的阶段匹配作用。在ajcc阶段i之前未经治疗的(“notx”),t/c治疗的(“t/c治疗”),和her2-脉冲dc1免疫(“post-vax”)her2pos-ibc患者之间的匹配比较是通过整体的抗her2应答率(顶部),应答组库(中间)和累积应答(底部)进行评估的。在her2-脉冲dc1免疫之后,而不是t/c治疗之后,阶段iher2pos-ibc患者的阶段匹配比较中th1有区别的恢复得以持续。结果以比例或平均值±sem表示;(**p<0.01,***p<0.001)。图12d和12e示出了在dc疫苗接种之后的cd4+th1免疫应答的持续性。在dc疫苗接种之前(“prevaccine”),接种dc疫苗后立即(“immediatepostvaccine”)和接种疫苗≥6个月(“≥6mopostvaccine”),将阶段i/iiher2pos-ibc的患者中的免疫应答进行比较。接种疫苗后的立即期间过后,尽管在此时间点(断续箭头)在所有患者体内全身化学疗法已初始化或完成,在11个接种疫苗≥6个月用于评估的患者中有9个患者的抗her2cd4+th1免疫持续扩增。分散的点给出了应答组库的cd4+th1反应活性分析(图12d)和个体接种疫苗受试者的累积应答(图12e)。
图13a-13e示出了在t/c治疗后下调的抗her2th1应答与不利的临床和病理结果相关。根据图13a化学疗法顺序(新辅助治疗相比佐剂),图13b-从结束曲妥单抗治疗到在本研究中登记的时间(<6相比≥6个月);图13c-雌激素受体状态(erpos相比erneg)和图13d-病理学阶段(i相比ii相比iii)进行分类,图13a-13d示出了t/c治疗的her2pos-ibc患者的亚群分析,这些患者在抗her2应答率(顶部图),组库(中间图)或累积应答(底部图)没有证明出有明显的差异。图13e示出了与t/c结束后没有发生乳腺事件(“nobe”)的her2pos-ibc患者相比,发生乳腺事件(“+be”)的患者具有显著下调的抗-her2反应性(左上图)和累积th1反应(左下图),在新辅助治疗t/c后达到病理学完全应答(pcr)的her2pos-ibc患者中,与没有进行pcr的患者相比,抗-her2th1应答组库(右中图)和累积应答(右下角图)显著提高。
具体实施例
应该理解本实施例已经简化了附图,图片和描述,以说明用于清楚理解相关元素,而为了清楚的目的,去除了许多其他可能在本实施例出现的元素。相关领域的普通技术人员应当知道这些其它元素是合适的和/或需要的,以便实施本发明。然而,由于这些元素在本领域中是公知的,并且由于它们并不便于更好地理解本发明,故在此并不提供对这些元素的讨论。
在该说明书中,提到的“一个实施例”或“实施例”或类似手段描述的与实施例有关的特定特征、结构或特性包括在本发明的至少一个实施例中。因此,贯穿本说明书的短语“在一个实施例”或“实施例”等在各个位置的出现并不一定全都指代相同的实施例。
另外,为了促进对本发明原理的理解,现在将参考在此示出和描述的实施例,并且将使用特定的语言对其进行描述。然而可以理解本发明的范围不会因而受到限制;在此以描述或用插图表示的实施例的任何改变和进一步的变型以及本发明一般原则的进一步的应用,这对于本发明所涉及领域的技术人员而言是常规的。本发明的范围的限定应该根据和以一个或多个公布的专利中最终权利要求的表达来确定。
定义
除非另外限定,这里使用的所有技术和科学术语具有本发明所属主题的本领域普通技术人员的通常理解相同的意义。虽然类似或等同于本文所述的任何方法和材料可用于本实施例,这里描述优选的方法和材料。
通常,这里使用的命名法和细胞培养中的实验步骤,分子遗传学,有机化学和核酸化学以及杂化是本领域众所周知的且通常采用的那些。
使用标准法合成核酸和肽。方法和步骤一般地按照本领域常规方法和各种普遍参考文件进行(例如,sambrookandrussell,2102,分子克隆:试验室手册,coldspringharborpress,coldspringharbor,ny,和ausubel等,2012,现代分子生物学实验技术,johnwiley&sons,ny),贯穿该文件提供。
这里使用的命名法和在如下的分析化学和有机合成中使用的实验步骤是本领域众所周知的且通常采用的那些。标准法或对其修改用于化学合成和化学分析。
如这里使用的,每个如下术语的含义与其在此部分的含义相关。
这里使用的冠词“一种”指的是本文中语法上一个或多于一个(也就是至少一个)的客体。例如,“一种元素”指的是一个元素或多于一个元素。
这里使用的“约”,当指的是例如数量,持续时间等可测值时,意思是包括离标准值±20%或±10%,或±5%,或±1%,或±0.1%的变化范围,这样的变化对于实施所公开的方法是适当的。
这里使用的用于乳腺癌的“佐剂治疗”指的是在主要治疗(即,手术)后给予的任何用于增加长期存活可能性的治疗。“新辅助治疗”是在主要治疗之前给予的治疗。
这里使用的术语“抗原”或“ag”被定义为引起免疫应答的分子。该免疫应答可能包括抗体生产或者激活特异免疫活性细胞,或者两者都包括。本领域技术人员将理解,实质上包括所有蛋白质或肽的任何大分子,可以作为抗原。进一步,抗原可以从重组的或基因组dna获得。本领域技术人员将会理解,任何dna,包括编码引发免疫应答蛋白质的部分核苷酸序列或核苷酸序列,编码在这里使用的术语“抗原”。进一步,本领域技术人员将理解抗原不需要仅依靠基因全长核苷酸序列进行编码。很显然地,本实施例包括,并不限于,使用多于一个基因的部分核苷酸序列,并将这些核苷酸序列进行不同的组合以引发期望的免疫应答。而且,本领域技术人员将理解,抗原完全不需要“基因”的编码。很显然地,抗原可以产生或者合成或者从生物样本获得。这样的生物样本可以包括但不限于组织样本,肿瘤样本,细胞或生物流体。
“抗原递呈细胞”或者“apc”是能够激活t细胞的细胞,包括,但不限于单核细胞/巨噬细胞,b细胞和树突状细胞(“dcs”)。
“抗原-脉冲apc”或者“抗原-负载apc”包括已经向抗原暴露和被抗原活化的apc。例如,在抗原存在的培养期间,apc可以在体外负载抗原。通过向抗原暴露,apc也可以在体内被负载。“抗原负载apc”传统上用两种方法中的一种制备:(1)小肽片段,公知作为抗原肽,被直接脉冲到抗原递呈细胞的外部;或(2)将apc与整蛋白质或蛋白质颗粒孵化,随后这些蛋白质或蛋白质颗粒被apc摄取。这些蛋白质被apc消化成小的肽段并最终运输到和递呈到apc表面。另外,也可以通过将编码抗原的多聚核苷酸引入细胞来产生抗原-负载apc。
“抗-her2应答”是特异性针对her2蛋白的免疫应答。
这里使用的术语“抗肿瘤作用”指的是可以通过肿瘤体积的减小,肿瘤细胞数量的减少,转移肿瘤数量的减小,预期寿命的增加或与癌症病症相关的多种生理症状的改善来显示的生物学效应。“抗癌效应”也可以通过结合肽,多聚核苷酸,细胞以及抗体在第一时间预防肿瘤的发生的能力来显示。
“细胞凋亡”是细胞程序性死亡的过程。半胱天冬酶-3是频繁被活化的死亡蛋白酶。
这里使用的“自体的”指的是从与之后被引入的个体相同的个体所获取的任何物质。
这里使用的术语“b细胞”被定义为从骨髓和/或脾脏获得的细胞。b细胞可以发展成为生产抗体的浆细胞。
“结合肽”,见“her2结合肽”。
这里使用的术语“癌症”被定义为具有独特的特点-正常控制的损失、导致没有节制的增长、缺乏分化、局部组织浸润、和/或转移细胞增殖的细胞增殖。例子包括但不限于,乳腺癌,前列腺癌,卵巢癌,宫颈癌,皮肤癌,膀胱癌,食管癌,胰腺癌,大肠癌,胃癌,肾癌,肝癌,脑癌,淋巴瘤,白血病,肺癌,生殖细胞肿瘤等。
“cd4+th1细胞”,“th1细胞”,“cd4+t-辅助1型细胞”,“cd4+t细胞”等被定义为表达表面蛋白cd4和生产高水平的细胞因子ifn-γ的t-辅助细胞的亚型。也见,“t辅助细胞”。
“累积应答”意思是患者组的联合免疫应答,其以来自特定患者组的所有6种mhcii类结合肽的反应斑点的全部数量表示(来自ifn-γelispot分析的每106细胞的斑点形成细胞“sfc”)。
“dc疫苗接种”,“dc免疫”,“dc1免疫”等指的是用自体的树突状细胞来治理免疫系统从而识别特异分子和对其发动特异应答的策略。
术语“树突状细胞”或“dc”是存在于体内,体外,离体或者在宿主或受试者内,或者可以从造血干细胞或单核细胞获得的抗原递呈细胞。树突状细胞和他们的前体可以从多种淋巴组织分离,例如,脾脏,淋巴结,以及来自骨髓和外周血。树突状细胞具有一种形态学特点,其有向多个方向扩展远离树突状细胞体的薄片(片状伪足)。典型地,树突状细胞表达高水平mhc和共刺激分子(例如,b7-1和b7-2)。树突状细胞可以在体外诱导t细胞的抗原特异性分化,并且可以发起体内和体外的最初的t细胞应答。在疫苗生产的环境,“活化的dc”是已经向脂多糖“lps”等的toll样受体激动剂暴露的dc。活化的dc可能负载或可能没负载有抗原。也见,“成熟dc”。
“cd-1极化树突状细胞”,“dc1s”和“1型极化dc”指的是分泌比如il-12,il-18和il-23等th1驱动细胞因子的成熟的树突状细胞,dc1s完全能够促进细胞介导的免疫。在这里的优选实施例中,用her2mhcii类结合肽脉冲dcis。
“雌激素受体(“er”)阳性”或“erpos”癌症是检测雌激素表达为阳性的癌症。相反地,对于此表达,“er阴性”癌症检测这样的表达为阴性。er状态的分析可以通过本领域已知的任何方法实施。
“her2”是人表皮生长因子受体(“egfr”)家族中的成员。her2在约20%-25%的人类乳腺癌中过表达以及在许多其他癌症中表达。
这里使用的“her2结合肽”,“her2mhcii类结合肽”,“结合肽”,“her2肽”,“免疫原性mhcii类结合肽”,“抗原结合肽”,“her2抗原决定簇”,“反应肽”等指的是从her2/neu蛋白质的序列获得或基于其的mhcii类肽,其是在约20%-25%的所有人类乳腺癌及其等同物中发现的一种靶向物。her2胞外结构域“ecd”指的是在细胞外包括其碎片的her2的结构域,其或者锚定在细胞膜或者在循环中。her2胞内结构域“icd”指的是在细胞质内的her2/neu蛋白的结构域。根据优选实施例,her2抗原决定簇或其他结合肽包括6种her2结合肽,所述her2结合肽包括3种her2ecd肽和3种her2icd肽。
优选的her2ecd肽包括:
肽42-56:hldmlrhlyqgcqvv(seqidno:1);
肽98-114:rlrivrgtqlfednyal(seqidno:2);和
肽328-345:tqrcekcskpcarvcygl(seqidno:3);
优选的her2icd肽包括:
肽776-790:gvgspyvsrllgicl(seqidno:4);
肽927-941:pareipdllekgerl(seqidno:5);和
肽1166-1180:tlerpktlspgkngv(seqidno:6)。
“her2pos”是乳腺癌类型以及很多其他类型癌症的分类或者分子亚型。目前,her2阳性通过fish(荧光原位杂交)试验、通过基因扩增以及病理学染色的强度2+或3+来定义。
“her2neg”通过fish、通过缺乏基因扩增来定义,并且其大部分情况下可以包括从0至2+的病理学染色。
“分离”意思是从自然状态中改变或移除。例如,自然存在于活的动物内的核酸或肽不是“分离”,然而将部分或者全部的同样的核酸或者肽从其自然状态中的共存物质中分开是“分离”。分离的核酸或蛋白质可以以实质上纯化的形式存在,或者可以在非原位环境存在,例如,宿主细胞。
这里使用的术语“主要组织相容性复合体”或“mhc”被定义为特异基因簇,许多这些基因簇编码抗原递呈中涉及的与进化相关的表面蛋白,这些表面蛋白是组织相容性中最重要的决定因素。i类mhc,或mhci类主要在向cd8t淋巴细胞的抗原递呈中起主要作用。ii类mhc或mhcii类主要在向cd4+t淋巴细胞的抗原递呈中起主要作用(t-辅助细胞)。
这里使用的“成熟dc”意思是表达包括高水平ii类mhc,cd80(b7.1)和cd86(b7.2)分子的树突状细胞。相反地,未成熟的树突状细胞(“idcs”或“idcs”)表达低水平的ii类mhc,cd80(b7.1)和cd86(b7.2)分子,然而依旧能摄取抗原。“成熟dc”也指存在于体内,体外,离体,或在宿主或者是受试者内的抗原递呈细胞,也可以是极化的dc1(即,其完全能够促进细胞-介导免疫)。
cd4+th1应答(或th1应答)的“度量”通过为每个受试组分析抗her2cd4+th1免疫应答来定义:(1)整体抗her2应答率(以应答≥1种反应肽的受试者的百分比表示);(2)应答组库(以被每个受试组识别的反应肽的平均数量(n)表示);和(c)累积应答(以来自每个受试组的6种ii类mhc结合肽的全部反应斑点的全部数量来表示(来自ifn-γelispot分析的每106细胞的斑点形成细胞“sfc”)。
“非可疑her2neg”被定义为非-基因扩增和0或1+病理学染色。“可疑her2neg”被定义为非-基因扩增,但在病理学染色为2+。
“应答率”或“抗-her2应答率”在这里可交换使用,意思是对6种结合肽中的至少1种应答的受试者百分数。
“应答组库”被定义为被每个受试组识别的反应肽的平均数量(“n”)。
这里使用的“样本”或“生物样本”意思是来自受试者的生物材料,包括但不限于血液,器官,组织,外来体,血浆,唾液,尿液和其他体液。样本可以是来自受试者的任何来源的材料样本。
术语“受试者”,“患者”,“个体”等在这里可交换使用,指的是适用于在这里描述的方法的任何动物,或其无论在体外或在原位的细胞。在某种非限制实施例中,患者,受试者或者个体是人类。
这里使用的术语“靶向治疗”指的是使用药物或其他物质的癌症治疗,所述药物或其他物质干扰通常涉及癌症细胞生长的特异靶分子,而对正常细胞几乎没有损害以实现抗肿瘤的作用。相反地,常规的细胞毒素化学疗法药物,针对所有正在分裂的细胞。在乳腺癌治疗单克隆抗体中,特别是曲妥单抗/赫赛汀
“t/c”被定义为曲妥单抗和化学疗法。这指的在乳腺癌手术之前/之后接受曲妥单抗和化学疗法二种治疗的患者。
这里使用的术语“t-细胞”或“t细胞”被定义为在许多细胞-介导免疫反应中参与的胸腺-来源的细胞。
这里使用的术语“t-辅助细胞”,“辅助t细胞”,“th细胞”等参照细胞表示能被本领域技术人员识别的包括不同细胞类型的淋巴细胞亚组(一种白血细胞或白血球)。特别地,t-辅助细胞是主要功能为促进其他b和t淋巴细胞和/或巨噬细胞的活化和发挥作用的t-效应细胞。辅助t细胞分化为“th1”或“1型”和“th2”或“2型”表型的两大细胞亚型。这些th细胞分泌细胞因子,蛋白质,或肽,所述细胞因子,蛋白质,或肽刺激其他白血球或与其他白血球相互作用。这里使用的“th1细胞”,“cd4+th1细胞”,“cd4+1型t-辅助细胞”,“cd4+t细胞”等指的是已经表达表面糖蛋白cd4的成熟的t-细胞。当用肽抗原将cd4+t-辅助细胞通过在如树突状细胞的抗原-递呈肽(“apcs”)表面表达的ii类mhc分子进行递呈时,cd4+t-辅助细胞被激活。一旦通过mhc-抗原复合物将cd4+t辅助细胞激活,cd4+t辅助细胞分泌高水平的如干扰素-γ(“ifn-γ”)的细胞因子。此细胞被认为高效地针对某些在宿主细胞内生存的引起疾病的细菌,并在人类癌症的抗癌应答中至关重要。
这里使用的“treg”“treg”和“调节性t细胞”指的是免疫系统的警察,用来调节免疫系统抗-癌活性。其在某些癌症中会增加,其是在这些癌症类型中对免疫疗法产生抗性的中介物。
这里使用的“治疗有效量”或者“有效量”可交换使用,指的是这里描述的化合物,制剂,物质或组合物的数量,当给药患者时,能够有效实现特殊的生物效果。这里描述的构成“治疗有效量”的化合物,制剂,物质或组合物的数量会根据化合物,制剂,物质或组合物,疾病状态及其严重性,被治疗患者的年龄等而变化。治疗有效量是通过一个本领域技术人员参考他/她自己的知识以及此公开来常规确定。
这里使用的术语“治疗”指的是这里描述的治疗或预防措施。“治疗”方法采用对需要本实施例中的治疗、组合物或方法的受试者采取措施的方式,例如,受疾病或失调折磨的受试者,或最终可能获得此疾病或失调的受试者,为了预防、治疗、延期、降低严重性或改善一种多种失调或复发失调的症状,或者延长受试者的存活使其超出不施用此治疗时的预期存活。
这里使用的术语“疫苗”被定义为被用来向动物,优选哺乳动物,更优选人类施用后引起免疫应答的物质。一旦引入受试者体内,疫苗可以引起免疫应答,该免疫应答包括但不限于,抗体生产,细胞因子和/或其他细胞应答。
范围:贯穿本公开,实施例的不同方面可以通过一个范围形式来表示。应该理解的是范围形式的描述仅仅是为了方便和简洁,并不应该被解释为对实施例范围的刻板的限定。因此,范围的描述应该被认为已经明确公开所有可能的子范围以及在所述范围内的所有可能个体数值。例如,从1到6的范围的描述应该被认为已经具体公开了例如从1到3,从1到4,从1到5,从2到4,从2到6,从3到6等的子范围,以及在所述范围内的个体数值,例如1,2,2.7,3,4,5,5.3和6。无论所述范围的宽度如何,此解释都适用。
现在将详细参考不同的实施例,这些实施例中的实例也以附图,照片,和/或插图来说明。
具体描述
乳腺癌发生的终生危险性是将近八分之一。erb-b2致癌基因(hek-2/neu)是在相当数量的乳腺、卵巢、胃食管、肺、胰腺、前列腺和其他实体肿瘤过表达的分子驱动。her2过表达(“her2pos”),包括约20%-25%的乳腺癌在内的一些肿瘤类型的分子致癌驱动,其与更多的临床侵袭性疾病、对化学疗法的抗性,高复发和转移的比率,以及较差的整体预后相关。在初期的乳腺癌,her2的过表达是与增强的侵袭性,肿瘤细胞迁移和促血管生成因子的表达相关,其表明her2在促进肿瘤发生环境中起到关键性作用。在导管原位癌(“dcis”)的回顾分析中,过表达her2的dcis病变与浸润性乳腺癌相关的可能性是没有her2过表达的dcis病变的6倍。
尽管分子靶向治疗以her2作为目标,即,曲妥单抗,已经在此乳腺癌类型中产生了巨大的积极临床作用,但在晚期的疾病状态中对现存her2治疗几乎全部产生抗性,以及相当大比例接受靶向治疗的女性疾病复发都证明了需要额外的以her2为目标的策略。尽管针对her2来激活免疫系统以缓解肿瘤转移和防止复发的疫苗前景是令人鼓舞的,但还没有完全实现。因此,依然需要额外测验和治疗来诊断和治疗her2乳腺癌。在此描述的实施例解决这些问题。
然而,在her2-驱动的乳腺肿瘤发生中的全身抗-her2cd4+th1应答的作用依旧不清楚。在此描述的实施例基于在her2pos-乳腺癌中肿瘤发生的连续过程中抗-her2cd4+th1应答逐渐损失的鉴定,其看上去好像her2-特异性和不依赖于调节t-细胞(treg)的。特别地,抗-her2cd4+th1应答与her2表达和疾病继续进展呈负相关。另外,在her2pos-浸润性乳腺癌中,下调的抗-her2th1应答在接种her2-脉冲1型极化树突状细胞(“dc1”)疫苗后有区别地恢复,但是在用本文将进行详细说明的曲妥单抗和化学疗法(“t/c”)的her2-靶向治疗之后或通过其他的例如外科手术切除术或放射的标准治疗方法,下调的应答并没有恢复。恢复的抗her2th1应答似乎在至少6个月或者更长的时间内持续。
在此描述的优选实施例提供了在哺乳动物受试者中产生和检测循环的抗-癌cd4+th1应答的物质和方法。提供了产生循环的抗癌cd4+th1应答(即,ifn-γ-分泌)的血液测验/试验,并且产生的ifn-γ生产被检测和测定。在另一个优选的实施例中,包含cd4+th1细胞和抗原-递呈细胞或其前体细胞的受试者血液样本与ii类mhc免疫原性肽进行脉冲,该ii类mhc免疫原性肽基于折磨受试者的和能够在所述受试者中诱导免疫应答的癌症类型。优选的抗原递呈细胞或其前体是成熟的或未成熟的树突细胞或其单核细胞前体。在特别地优选实施例中,癌症优选的是表达her2的,哺乳动物受试者优选为人类,更优选的癌症是her2pos乳腺癌,人类受试者为女性。
这里经鉴定的抗-her2cd4+th1应答的衰减使以下情况实现,在所述血液测验中产生的检测到的免疫应答只作为癌症诊断/应答预测器或将其与为了恢复患者免疫应答的特异疫苗串联使用。与依赖肿瘤细胞鉴定的诊断和治疗方法截然相反,这里描述的优选的实施例将癌症诊断和治疗的重点转移到患者免疫力和血液测验的使用以确定和/或预测针对癌症的免疫应答,包括具有复发风险的患者。
提供优选的实施例:通过从受试者中分离未膨胀的外周血单核细胞(“pbmcs”),并将该pbmcs用包含能够在受试者内产生免疫应答的、her2-来源的ii类mhc抗原结合肽的组合物进行脉冲,以在哺乳动物受试者产生循环抗-her2cd4+th1应答。不期望受任何具体理论的束缚,当结合肽被递呈到存在于pbmc样本中的cd4+th1细胞时,它们激活cd4+th1细胞并且此活化的cd4+th1细胞产生干扰素-y(“ifn-γ”)。从包括在受试者pbmc样本中的前体多能单核细胞中获得的dc1s(1型极化树突状细胞)(“apcs”)是抗原递呈细胞(“apcs”),其一旦暴露于结合肽就会变为负载抗原的抗原递呈细胞,其将ii类mhc抗原结合肽递呈到样本中的受试者cd4+th1细胞,从而激活cd4+th1细胞从而产生/分泌ifn-γ。并且产生的ifn-γ随后用于分析测定。
在可选的优选实施例中,通过将来自受试者血液样本内的预先未受刺激的纯化的cd4+t-细胞与自体未成熟或成熟的树突状细胞(“idcs”或“成熟dcs”,共同地,“dcs”)共培养,在哺乳动物受试者内产生循环抗her2cd4+th1应答,所述自体未成熟或成熟的树突状细胞是经过包括能够在受试者内产生免疫应答的、her2-来源的ii类mhc抗原结合肽的组合物脉冲的。不期望受任何理论的束缚,当结合肽被递呈到存在于t细胞样本中的cd4+th1细胞时,它们激活cd4+th1细胞并且此活化的cd4+th1细胞产生/分泌干扰素-γ。未成熟的树突状细胞成熟到dc1’s,其将ii类mhc结合肽递呈到存在于样本中的受试者的cd4+th1细胞从而激活cd4+th1细胞产生ifn-γ,其随后用于分析测定。
在受试者内产生抗-her2免疫应答的两个可选的优选实施例中,抗-her2cd4+th1细胞分泌的ifn-γ通过ifn-γ酶联免疫斑点法("elispot")进行检测和测定,本领域技术人员应该知道可能使用其他方法进行检测。例如,可以使用流式细胞术,酶联免疫吸附测定(“elisa”)和免疫荧光(“if”)来监测免疫应答。可选地,与直接ifn-γ检测,例如示出全部cd4+细胞斑点的elispot形成对照或者在此之外,在患者免疫监测的例子中,测定ifn-γ对il-10的比例(在参考实例和图8e示出完成的)是有利的。这些检测尤其对于具有风险的患者是有利的。进一步,免疫荧光的应用通过使用以荧光来阅读结果的elispot阅读器提供了测定和显现免疫应答的其他方法。在这样的实例中,结果能够被安排示出2,3种或更多的细胞因子/其他分泌的免疫分子,在相同的患者样本中每个结果用不同的颜色示出。
本领域技术人员不难看出,除了树突状细胞和单核细胞,可以使用其他适合的apc,例如,巨噬细胞和b细胞。
在优选的实施例中通过使用ifn-γelispot试验来检测ifg-γ的分泌(阳性肽应答:最小阈值20sfc/2x105和2x高于未受刺激的对照组)。结果优选地表示为三种th1应答的度量:(a)整体抗-her2应答率(以对≥1种反应肽产生应答的受试者百分比表示);(b)应答组库(以被每个受试组识别的反应肽的平均数量(n)表示);和(c)累积应答(以来自每个受试组的6种ii类mhc结合肽的反应斑点的全部数量(来自ifn-γelispot分析的每106细胞的斑点形成细胞“sfc”)表示。
对于her2pos癌症的优选实施例,用包括6种ii类mhc结合肽的组合物脉冲树突状细胞,未成熟的或i型极化dc1s,所述ii类mhc结合肽从能够在患者中产生免疫应答的her2之中获得或基于其获得。her2ii类mhc结合肽或抗原决定簇包括:
肽42-56:hldmlrhlyqgcqvv(seqidno:1);
肽98-114:rlrivrgtqlfednyal(seqidno:2);
肽328-345:tqrcekcskpcarvcygl(seqidno:3);
肽776-790:gvgspyvsrllgicl(seqidno:4);
肽927-941:pareipdllekgerl(seqidno:5);和
肽1166-1180:tlerpktlspgkngv(seqidno:6)。
在供体具有a2.1血型的实施例中,her21类mhc肽或抗原决定簇包括:
肽369-377:kifgslafl(seqidno:7);和
肽689-697:rllqetelv(seqidno:8)。
如下文进一步的描述,优选实施例中的her2结合肽/抗原决定簇并不限于如上提到的六种肽,也包括功能性等同物或在此将会进行更详细讨论的通过seqidnos:1-6鉴别的结合肽的替代物,还有另外的i类肽可以用于受试者,所述受试者具有a2.1和a3.1血型以及其他包括与任何表型结合的i类肽的血型(例如,a5,a6)。
除了乳腺癌,还有许多其他的her2pos实体癌,例如,脑癌,膀胱癌,食管癌,肺癌,胰腺癌,肝脏癌,前列腺癌,卵巢癌,大肠癌,和胃癌,以及其他癌,在这里描述的实施例中的物质和方法可以用于诊断和治疗上述癌症。因此,上述描述的六种抗her2结合肽可以根据这里的实施例使用从而产生能够检测的免疫应答,并且上述描述的六种抗her2结合肽对这些和其他表达her2癌症的诊断是有用的。
可以通过使用上述描述的同样的抗-her2结合肽或采用具有免疫原性的任何her2组合物,例如dna,rna,肽,或蛋白质或例如icd和ecd结构域的组分来开发疫苗,所述疫苗以表达her2的肿瘤为靶向物。例如,受试者可以接种针对可用来检测患者免疫应答的全her2蛋白和六种上述参考结合肽的疫苗。也可以为其他类型的癌症开发类似的疫苗,例如包括her1,her3和c-met的her2家族的其他成员。
尽管现有的优选实施例旨在治疗和诊断女性的her2pos乳腺癌,本领域技术人员应该很容易的理解到,本实施例不限于女性。目前的优选实施例包括男性,例如,表达her2的前列腺癌,还包括其他哺乳动物受试者。
组合物
优选实施例包括基于her2蛋白或从her2蛋白获得的分离的肽的应用。优选实施例的结合肽表示相应her2蛋白的抗原决定簇。尽管目前优选的实施例是以六种her2ii类mhc结合肽/抗原决定簇为特征,其他可能的her2ii类mhc肽可以用在目前的实施例中,因为整个her2分子的任何组分只要其在患者体内有充分的免疫活性就可以作为其他结合肽的来源。
在优选的实施例中,her2结合肽包括
六种her2ii类mhc结合肽,具有序列:
肽42-56:hldmlrhlyqgcqvv(seqidno:1);
肽98-114:rlrivrgtqlfednyal(seqidno:2);
肽328-345:tqrcekcskpcarvcygl(seqidno:3);
肽776-790:gvgspyvsrllgicl(seqidno:4);
肽927-941:pareipdllekgerl(seqidno:5);和
肽1166-1180:tlerpktlspgkngv(seqidno:6)。
通过seqidno:1鉴定的her2抗原决定簇表示her2蛋白质的位置42-56。通过seqidno:2鉴定的her2抗原决定簇表示her2蛋白质的位置98-114。通过seqidno:3鉴定的her2抗原决定簇表示her2蛋白质的位置328-345。通过seqidno:4鉴定的her2抗原决定簇表示her2蛋白质的位置776-790。通过seqidno:5鉴定的her2抗原决定簇表示her2蛋白质的位置927-941。通过seqidno:6鉴定的her2抗原决定簇表示her2蛋白质的位置1166-1180。
进一步,技术人员能进一步感知到在这里描述的实施例并不限于使用与这里描述的优选实施例相关的所有六种结合肽。所描述的结合肽的任何数量可以用于患者血液测验,以较低的范围约2或3,需要警告的是患者的cd4+t-细胞必需有足够的免疫活性以引起ifn-γ生产。因此,在her-来源的ii类结合肽以少于/不同于这里描述的与优选实施例相关的六种ii类结合肽的形式被使用的实例中,依据受试者内产生的免疫应答,结合肽的数量可以实质上低于或高于六种。
如这里表述的,优选实施例的her2结合肽也包括与被seqidnos:1-6鉴定的肽是功能等同物的肽。这样的功能等同物可能具有改变的序列,在改变的序列中,在相应的her2肽序列中的一个或多个氨基酸被取代,或者从相应的参考序列中删除或添加一个或多个氨基酸。例如,可以将1-3个氨基酸添加到氨基端,羧基端或者两端。在一些例子中,her2肽可以是糖基化的。
her2结合肽或者根据本实施例的任何肽可以环化或者线性化。当环化时,抗原决定簇可以以任何合适的方式环化。例如,二硫键可以在选定的半胱氨酸(“cys”)对之间形成,以提供期望的构象。人们相信,环化抗原决定簇的形成可以提供提高免疫应答的构象。
在其他的实例中,her2结合肽可以是her2结合肽的逆向-反转异构体。逆向-反转的改变包括在肽骨架中反转所有的酰胺键。这样的反转可以通过使用d-氨基酸代替l-氨基酸以反转序列的方向和反相每个氨基酸残基的手性来实现。这样的逆向-反转异构体形式可能保持平面化并且在至少一些肽键中是有构象限制的。
也可以进行非保守性氨基酸取代和/或保守性氨基酸取代。当取代的氨基酸与参考序列中相应氨基酸的结构或化学性质相似时,是保守氨基酸取代。作为例子,保守的氨基酸取代涉及一个脂肪族或疏水氨基酸,例如,丙氨酸,缬氨酸,亮氨酸和异亮氨酸,被用另一个取代;一个含有羟基的氨基酸,例如,丝氨酸和苏氨酸,被用另一个取代;一个酸性残基,例如,谷氨酸或天冬氨酸,被用另一个取代;一个包含酰胺的残基,例如,天冬酰胺和谷氨酰胺,被用另一种替换;一个芳香族残基,例如苯丙氨酸和酪氨酸,被用另一个替换;一个碱性残基,例如赖氨酸,精氨酸和组氨酸,被用另一个替换;一个小氨基酸,例如,丙氨酸,丝氨酸,苏氨酸,蛋氨酸和甘氨酸,被用另一个替换。
在一些实例中,删除和添加定位于优选实施例的结合肽序列的氨基端,羧基端或者两端。例如,her2结合肽等同物具有的氨基酸序列与相应的her2结合肽序列相比至少70%是相同的,至少80%是相同的,至少85%是相同的,至少90%是相同的,至少91%,至少92%,至少93%,至少94%,至少95%,至少96%,至少97%,至少98%,或至少99%是相同的。至少90%相同的序列在参考序列的每10个氨基酸中具有不多于1个的改变,即,删除,增加或取代的任何组合。通过使用已知的或在本领域待开发的程序将变化的氨基酸序列与参考序列进行对比,以确定同源性百分比。
对于比相应的her2结合肽序列长的功能等同物,功能等同物可以具有至少90%的序列与her2肽序列以及野生型her2蛋白中位于her2肽序列侧面的序列相同。
her2结合肽的功能等同物可以通过修饰肽的序列、和之后检测产生的多肽的能力被鉴定,所述能力是指刺激受试者的单核细胞、树突状细胞或其他将结合肽/抗原决定簇递呈到cd4+th1细胞的抗原递呈细胞的能力。
根据其他实施例,提供了包括一种或多种嵌合肽的嵌合肽和组合物。根据不同的实施例,嵌合肽包括her2肽、另外的肽和将所述her2肽连接到另外的肽的接头,应当进一步理解任何适合的接头可能被使用。例如,依据所使用的肽,her2结合肽可以被连接到另外的结合肽的氨基端或羧基端。另外的肽的定位和选择取决于her2肽的结构特点,是否是α螺旋或β转角或链。
在另一个实施例,接头可以是从约2个到约15个氨基酸、约2个到约10个氨基端、或者从约2个到约6个氨基端长度的肽。嵌合肽可以是线性的或环化的。另外,her2肽,另外的肽,和/或接头可以是逆向-反转的形式。因此,her2肽可以是一起逆向-反转的形式。可选地,her2肽和另外的肽可以是逆向-反转的形式。在另一个例子中,her2肽,其他抗原决定簇和接头可以是逆向-反转的形式。
包括嵌合肽的肽可以使用已知的技术来制备。例如,肽可以通过使用重组dna技术或化学合成的方法被合成的制备。本实施例的肽可以单独合成或者被合成为由两个或更多肽组成的更长的多肽。目前优选实施例的肽优选被分离,即,实质上不受其他自然出现的宿主细胞蛋白和其片段的约束。
本实施例的肽和嵌合肽可以用商业上可获得的多肽合成仪来合成。例如,可以使用描述在kaumaya,p.t.p.,等,“denovo”在肽,设计,合成和生物活性中,作为潜在疫苗的免疫原性肽和抗原决定因素工程学,pp133-164(1994)中的内容。例如,her2结合肽可以与另外的结合肽共线合成以形成嵌合肽。可以用fmoc/t-but化学法来合成肽。肽和嵌合肽可以用任何合适的方式环化。例如,可以通过使用有差异的受到保护的半胱氨酸残基、碘氧化、添加水以推动acm基团的去除以及二硫键的相伴形成、和/或甲硅烷基氯化物-亚砜来获得二硫键。
肽以及嵌合肽也可以通过用无细胞翻译系统以及编码抗原决定簇或结合肽的dna构象中获得的和rna分子来产生。可选地,抗原决定簇或者嵌合肽可以通过使用包括编码分别的抗原决定簇或嵌合肽的表达载体转染宿主细胞,然后诱导多肽在宿主细胞内的表达。对于重组生产,包括编码肽抗原决定簇,嵌合肽或其变体的一个或多个序列的重组构建体通过常规方法引入宿主细胞,这些常规方法例如磷酸钙法转染,deae-dextran介导的转染,显微注射,阳离子脂质体介导的转染,电穿孔,转导,刮提(scrapelading),弹道引入(ballisticintroduction)或感染。
只要修饰不破坏结合肽的生物活性,本实施例的结合肽可以包括修饰,例如,糖基化,侧链氧化或磷酸化作用。其他修饰包括引入d-氨基酸或其他氨基酸模拟物。
本实施例的结合肽可以被制备为包括两个或更多肽的组合。肽可以是混合物或者通过使用标准方法使彼此共轭。例如,肽可以以单独的多肽序列表达。组合中的肽可以是相同的或不同的。
本实施例也应该被解释为包括实施例的肽(或编码其的dna)的“突变体”,“衍生物”,和“变体”,实施例中突变体、衍生物和变体是一个或多个氨基酸改变的肽(或者当指的是编码其的核苷酸序列时,是一个或多个改变的碱基对),这样得到的肽(或dna)与这里列举的序列是不同的,但是与这里公开的肽具有相同的生物活性。
一些实施例也提供了编码至少一种肽的多核苷酸,所述肽选自具有任一种或多种seqidnos:1-6序列的肽。核苷酸序列包括被转录成rna的dna序列以及被翻译成肽的rna序列。根据其他实施例,多核苷酸是从优选实施例的肽的氨基酸序列推测出来的。如本领域所公知的,当保留翻译肽的生物活性时,由于冗余密码子,一些可选的多核苷酸是可能的。
进一步,优选实施例包括分离的核酸,所述核酸编码与在这里公开的结合肽具有实质上同源性的肽。优选地,编码本发明肽的分离核酸的核苷酸序列与编码优选实施例中结合肽的分离核酸的核苷酸序列是“实质上同源的”,即,约60%同源,优选地约70%同源,甚至更优选地为约80%同源,更优选的为约90%同源,甚至更优选的为约95%同源,甚至更优选的为约99%同源。
应当明确的理解到优选实施例的范围包括同系物,类似物,变异体,衍生物和盐,包括更短和更长的肽和多核苷酸,以及用一种或多种氨基酸或核酸取代的肽和多核苷酸类似物,以及在本领域公知的氨基酸或核酸衍生物,非天然氨基酸或核酸和合成氨基酸或核酸,其规定是这些修饰必须保护原始结合肽的免疫学活性。根据在此描述的原则,特别地,包括活性结合肽的任何有活性的片段以及扩展,缀合物以及混合物。
优选的实施例应该被解释为包括与在这里描述以及参考的核酸同源的任何以及所有的分离的核酸。假设这些同源的dna具有这里公开的结合肽的生物活性。
本领域技术人员将会理解优选实施例的核酸包括编码优选实施例的肽的rna或者dna序列,和其任何修饰的形式,包括使得核苷酸序列在无细胞或者与细胞相关时更加稳定的dna或rna的化学修饰。核苷酸的化学修饰还可以用来提高核苷酸序列被细胞摄入的效率或者其在细胞内表达的效率。任何以及所有的核苷酸序列修饰的组合在优选的实施例中预测到。
进一步,使用本领域已知的重组dna方法,例如在sambrook和russell,supra和ausubel等,supra所描述,任何数目的步骤可以用于优选实施例的肽的突变体,衍生物或者变体形式的产生。通过改变编码多肽的dna序列在肽或多肽中引入氨基酸改变的步骤在本领域是公知的,也在这些,和其他,论文得以描述。
优选实施例中编码结合肽的核酸可以被合并入合适的载体,例如,逆转录病毒载体。这些载体在本领域是公知的。核酸或者有效包括这些核酸的载体通常可以被导入期望的细胞,此细胞最好选自患者。
低温贮藏
从受试者获得外周血单核细胞并进行分离后,在进行任何在此描述的血液测验/试验前,使用对于本领域技术人员已知的方法将其进行冷藏保存。
使用诊断/预后/治疗监测工具
如这里描述的,已经发现,循环her2-反应性ifn-γposcd4+th1细胞的损失最早开始于dcis乳腺癌并在早期浸润阶段iher2pos肿瘤中实质上下降。更具体地,从健康供体到her2posdcis(导管原位癌)到her2posibc(浸润型乳腺癌)跨越乳腺肿瘤发生的连续过程中抗-her2cd4+th1应答逐步衰减。免疫应答损失的原因,并不是因为,即,并不是由于与癌症有关的免疫抑制,其不像是与从迁移到浸润病变的增加有关,并且它独立于调节性t细胞。
基于此发现-her2cd4+th1免疫应答的损失的实施例提供了为表面上健康的个体筛选乳腺癌和其他癌症的方法,这些乳腺癌和其他癌症通过乳房摄影术或其他筛选方法可能不会被检测到,该方法包括进行快速免疫检测/试验以检测抗-her2cd4+th1应答率,优选实施例进行血液检测。这些个体的测验结果要比那些健康个体低,这使得更多确定的测验和更快治疗选项的实施可以实现。例如,这里的血液测验可以有利的用于鉴别处于风险中的、疫苗接种可能被认为可以降低其her-2表达乳腺癌风险的患者。例如,处于风险中的患者可以是下面的完成哺乳、怀孕和其他可能降低应答的生活应激事件的患者。
由于例如遗传倾向或生活方式等因素,这样的筛选方法对于有高风险发展成乳腺癌的患者是有益的,从诊断的角度,免疫生物标记物可以获得发展以用来筛选这样的高-风险的患者中抗-her2th1免疫的波动。当ihc染色或者fish分析乳腺活检标本仅仅提供了肿瘤进化的分离的快照的时候,免疫分析(例如用这样的潜在的生物标记物)可以提供肿瘤自然史和免疫反应的信息。可以用于预测被诊断为任何乳腺癌的患者,无论其是否具有her-2表达的新乳腺事件或复发的风险。
在另一个实施例,基于抗-her2th1应答损失的诊断或监测测验可以用于预测具有her2pos乳腺癌的患者是否对于如化学疗法外加曲妥单抗的标准非免疫治疗有好的应答。
根据将会在此进行详细描述的进一步的实施例,与靶向(例如,曲妥单抗)或者常规的乳腺癌治疗(即,化学疗法)相比,通过her2-来源的ii类肽(dc1免疫)和自体dc1疫苗接种,cd4+th1应答能够优先恢复。这样,在her2pos-ibc患者中,在her2-脉冲dc疫苗接种后,而不是在曲妥单抗/细胞毒素化学疗法(“t/c”)治疗之后,cd4+th1应答得到有效的恢复。因此,优选实施例中在接种疫苗前或接种疫苗后进行血液测验以确定th1免疫应答的恢复或非-恢复的程度。从而,患者可以通过这里的血液测验在乳腺癌治疗后容易地再评估它们的cd4+th1应答以确定任何先前发现的cd4+th1免疫损失是否已经通过接种疫苗得以恢复。
在另一个实施例,依赖于抗her2cd4+th1应答衰减的血液测验可以用于确定dc1疫苗接种是否已经充分的恢复或者增强抗-her2免疫至能够对癌症的进一步的侵袭提供保护的水平。post-dc1疫苗接种,优选实施例中的血液测验可以进行多次,优选按照患者医师推荐的时间表,从而追踪患者的cd4+th1免疫状态。接种疫苗之后,由于疫苗诱导的对her2肿瘤靶向物致敏作用的持续性以及长时间的保护的可能性,这些附加的测验可以进行好多个月,例如,接种疫苗后至少到60个月或更多。
这里使用的血液测验可以用于示出her2表达的浸润性乳腺癌患者在化学疗法/曲妥单抗治疗之后的her2-应答率的程度。这里示出了相关性,该相关性是这样的患者将对治疗做出如何的反应,以及因此这样的患者的结局预测好坏之间的相关性。例如,下调的抗-her2th1应答在佐剂-t/c治疗的患者中预测后续复发的增强的风险。
其他实施例提供了免疫策略的方法,即,dc疫苗接种,以提高或恢复在her2pos浸润性乳腺癌患者中的抗-her2cd4+th1损失。可以利用“免疫恢复”的能力结合目前的曲妥单抗治疗用于治疗。也提供了将疫苗接种与包括化学疗法外加曲妥单抗的标准治疗结合起来的基本原理。
另一实施例表明预测新乳腺事件风险的免疫相关性。在用化学疗法/曲妥单抗治疗的her2pos-ibc患者中,示出了应答变化,更为特别地,下调的抗her2cd4+th1应答与新的乳腺癌事件所增加的风险有关。因此这样下调的应答可以用于预测结果如患者是否有可能经受新的乳腺事件,并且如果发生,患者是否需要附加的治疗。从而可以基于此开发生物标志物。
进一步,这里观察到,表达ifn-γ和tfn-α受体的her2pos乳腺癌细胞,一旦暴露于th1来源-细胞因子(包括ifn-γ和tnf-α,由th1细胞分泌的典型的细胞因子)就会经历细胞凋亡,表明在例如乳房退化的生理过程中,抗-her2th1细胞对控制或者消除her2表达细胞是起作用的。在这里描述的经过检测的所有her2pos乳腺癌细胞系均发现了ifn-γ和tfn-α受体的表达,可见这些抗-her2cd4+th1细胞产生使her2表达的乳腺癌细胞系细胞凋亡的可溶的因子。表明在例如乳房退化的生理过程中,抗-her2th1可能对控制或消除her2表达的细胞有作用,也可以解释cd4+th1细胞是如何做到不能识别ii类negi类pos肿瘤细胞,但却能调节肿瘤细胞的破坏。
如这里详细的描述,进一步的实施例提供了预测her2pos乳腺癌中对标准新辅助治疗产生的病理应答率的免疫相关性。设计试验以研究表达her2的浸润性乳腺癌患者在化学疗法/曲妥单抗治疗后的her2应答率的程度与它们将在多大程度上应答治疗的相互关系。这样的试验揭示了预测对标准新辅助治疗产生病理应答率的免疫相关性。与没有病理学完全应答的患者相比,发现新辅助治疗完全应答和显著较高的抗her2cd4+th1应答之间有相关性。
t/c-治疗的her2pos-ibc患者的her2-特异性th1抑制的幅度与新乳腺事件的后续复发的增加的风险有关,相反,上述描述的抗-her2cd4+th1免疫的保持与对新辅助化学疗法的完全病理应答有关。合起来,这些数据表明抗-her2th1免疫反应活性可以用于作为生物标记以帮助识别易受伤害的、具有临床或病理失败风险的患者亚群。
尽管这里描述的本实施例可能包括对表达her2的乳腺肿瘤的特殊参考,本领域技术人员应该理解其他类型的表达her2的肿瘤,仅仅举例说明,,卵巢癌,胃食管癌,肺癌,胰腺癌,肝脏癌,前列腺癌和其他实体瘤,可能得益于本实施例的教导。相似地,本领域技术人员能够感受到这里的教导可以延伸到非-表达her2的乳腺癌,包括三倍阴性肿瘤和er-阳性肿瘤以及其他肿瘤。
此外,还有来自受体络氨酸激酶家族的其他her家族靶向物可以根据优选实施例使用。her家族由四种在许多癌症中涉及的、相关信号分子组成:her1,her2,her3和her4。尽管,已知her-2的过表达在约20%到25%的乳腺癌中被发现,其他的her家族成员也被发现在早期和浸润性乳腺癌以及其他癌症均有涉及。例如,her1在少数的乳腺癌中表达,通常是三倍阴性的。c-met是在激活her3的许多癌症的复发中有所涉及的生长因子受体。her3在结肠、前列腺、乳腺和黑素瘤中过表达。her3在大量的dcis病变和乳腺癌中表达。在接受dc1her2疫苗接种的一些患者中,her3可以在外科手术时残留的dcis中检测到。因此,其他her家族靶向物,例如引起乳腺癌以及其他实体癌的其他her家族靶向物,如:her3、her1和c-met,可能被有益的作为靶向物,并且针对这些其他靶向物的肽疫苗也被开发,就如这里描述的her2的开发。因此,用于识别哪些分子在患者的乳腺肿瘤中表达的、包括致癌驱动/被提议的致癌驱动(oncodrivers/proposedoncodrivers)的乳腺癌驱动(panel),例如her2,her3,her1和c-met,可以发展成为辅助疗法和用于疫苗靶分子。因此,预期除了这里描述的针对her2的dc1疫苗,相似疫苗针对非表达her2的乳腺癌类型也可以发展。
实例
优选实施例进一步参考如下的试验实例进行详细描述。这些实例仅以说明的目的提供,除非另有规定外,并不打算被限制。因此,优选实施例应该绝不解释为受限于如下的实例,更确切地说,应该被解释为包括任何以及所有的变化,其作为这里提供的教导的结果变得显而易见。
没有进一步的描述,本领域技术人员相信能够,使用先前的描述和之后的例证,制造和利用本实施例并实践要求的方法。从而如下的工作实例特别地指出优选实施例,并不能够解释为受限于公开的剩余部分的任何方式。
如下的参考实例包括方法,结果和讨论部分。
参考实例
方法
患者选择和研究设计
经过宾夕法尼亚大学机构审查委员会的批准,143个患者被相继招募到参加目前描述的研究并获得同意。在健康供体(“hd”)(n=21),具有良性乳腺疾病(“bd”)(n=10),her2neg-dcis(n=11),her2neg(0/1+)ibc(n=11),her2pos-dcis(n=31),和her2neg-ibc(n=22)的患者中检查抗-her2cd4+th1(“th1”)应答。编入her2pos-dcis的新辅助dc1免疫方法的以及在手术中发现具有阶段iher2pos-ibc(n=11)的患者的th1应答,在免疫之前和之后进行分析(立即以及在≥6个月后)。将之前未经治疗的her2pos-ibc患者的th1应答与t/c治疗阶段i-iiiher2pos-ibc患者(n=37)进行对比。图1示出了符合研究条件的患者和供体组。监控t/c-治疗her2pos-ibc患者乳腺事件的发展,乳腺事件被定义为任何局部的或远端复发。如下的表1示出了本研究人群的人口统计和与肿瘤相关的特点(个体患者亚群的年龄,种族,ajcc病理阶段,激素受体状况,化学疗法时间和完成曲妥单抗的时间(可适用的))(“ibc”:浸润性乳腺癌;“dcis”:导管原位癌;“t/c”:曲妥单抗/化学疗法)。在t/c治疗之后,观察her2pos-ibc患者的后续乳腺事件(“bes”)的发展,乳腺事件被定义为任何局部的或远端复发。所有受试者的th1免疫应答产生了并被前瞻性的分析。
疫苗试验设计和免疫接种程序
两种针对her2pos-dcis患者的her2-脉冲1型-极化树突状细胞疫苗接种、“dc1疫苗接种”的新辅助治疗被研发出来。树突状细胞疫苗按照前述方法制备。详见koski,g.k.等,j.immonother.35(1):54(2012)(“koski等”);sharma,a.等,癌症118(17):4354(2012)(“sharma等”);fracol,m.等,ann.surg.oncol.20(10):3233(2013);lee,m.k.4th等,expertrev.8(ll):e74698(2013);czemiecki,b.j.等,cancerres.67(4):1842(2007);czemiecki,b.j.等,癌症研究67(14):6531(2007);和美国公开专利申请us2013/0183343a1。
图2示出了本研究中的树突状细胞疫苗接种策略。正如其中示出的那样,通过串联的白细胞除去法和逆流离心洗脱从受试者获取单核树突状细胞前体(cd14+外周血单核细胞)。树突状细胞在巨噬细胞无血清培养基(cellgro/mediatech,manassas,va)中与粒细胞-巨噬细胞集落刺激因子(“gm-csf”)(250iu/ml;berlex,wayne,nj)以及il-4(1000μ/ml;r&dsystems,minneapolis,mn)培养过夜-他们被认为是未成熟的树突状细胞(″idc″)。接下来的几天,这些未成熟的树突状细胞用6种her2ii类mhc结合肽(42-56(seqidno:1);98-114(seqidno:2);和328-345(seqidno:3)(her2的胞外结构域),和776-790(seqidno:4);927-941(seqidno:5);和1166-1180(seqidno:6)(her2的细胞内结构域)(见,disis,m.l等,clin.can.res.5:1289(1999))(美国生物化学研究,西雅图,华盛顿州;肽冻干储存并在无菌的pbs中复原以供使用)进行脉冲.在8~12小时的培养后,加入干扰素伽玛(”ifn-γ”)(1000u/ml)。第二天,加入nih参考标准品脂多糖(“lps”)(10ng/ml)以使得树突状细胞在收获前6个小时全部活化为1型的极化表型(“dci”)。对于hla-a2.1pos患者,用2种额外的1类mhc结合肽(肽369-377(seqidno:7)和肽689-697(seqidno:8))脉冲dcls。洗涤收获的细胞,确认了>70%存活能力的批量释放标准,革兰氏阴性,内毒素<<5eu/kg。
按照koski等描述的那样进行了内部节点疫苗注射和内部病变疫苗注射。简言之,免疫是由美国国立卫生研究院(nih)指定的宾夕法尼亚大学医院的综合临床研究中心给药的。注射包括悬浮在1ml无菌盐水中的1000~2000万her2脉冲的dc1s,并且通过超声引导给入腹股沟的淋巴结,乳腺,或者两者都有。免疫给药,一周一次,一共给6周,所有的患者完成6次免疫。免疫相关的安全和毒性数据在以前sharma等已报道过。
免疫应答的检测
循环的抗-her2cd4+应答是通过用6种前述的her22类结合肽脉冲患者未膨胀的外周血单核细胞产生的,通过酶联免疫斑点法(“elispot”)来测定干扰素伽玛(“ifn-γ”)的产生。酶联免疫斑点法(“elispot”)是根据koski等人描述的方法开展的。简言之,pvdf薄膜板(mabtechinc.,cincinnati,oh)用抗-ifn-γ捕获抗体(1-d1k(mabtech))包被过夜。通过密度梯度离心法分离得到的冷藏的外周血单细胞,被投入到预热过的补充了5%人血清的dmem培养基中。在培养板被洗涤和封闭后,外周血单细胞被一式三份的置于板中(2×105细胞/孔),然后培养板在37℃下选择用her2-来源的2类结合肽(4μg)的任意一种(肽42-56(seqidno:1);肽98-114(seqidno:2);肽328-345(seqidno:3);肽776-790(seqidno:4;肽927-941(seqidno:5);和肽1166-1180(seqidno:6)、仅培养基(未受刺激的对照)或者阳性对照(抗-人类cd3和抗-cd28抗体(每个0.5μg/ml))孵育24~36小时(两个抗体均为bdpharmingen,圣迭戈,加州)。洗涤之后,将检测抗体(7b6-1-生物素(mabtech);100μg/ml;)加入到每个孔中,在37℃下培养板培养2个小时。然后,加入按照1∶1000的比例在pbs+0.5%fcs中稀释后的链霉抗生物素蛋白-辣根过氧化物酶,然后在37℃下再培养1个小时。tmb底物液(kirkegaard&perry实验室,th1gaithersburg,md)接下来被加入,以显示斑点形成。在颜色变化后,用自来水洗涤孔。用自动的elispot阅读器数出斑点形成细胞(“sfc”)的数量(immunospotctl,克利夫兰,俄亥俄州)。
此外,回忆th1应答是通过刺激从特定的患者亚群获取的可供研究的pbmcs来检测的,所述刺激使用按照1∶100的比例稀释后的回忆刺激白色念珠菌(allermedlaboratories,圣迭戈,加州)和破伤风类毒素(santacruzbiotechnology,达拉斯,德克萨斯)。为了确定treg和/或th2表型的相关功能活性,根据guerkov,r.e.等在j.immunol.meth.279:111(2003)的报道,以2.5μg/ml的抗-cd3抗体作为阳性对照组,通过elispot测定了il-10的生产。
由于elispot的内部重复差异性较低(未示出数据),实施了确定抗原特异性应答的经验方法。针对单个的her22类肽的阳性应答被定义为:(1)在减去未刺激的背景后,试验孔中的最小阈值为20sfc/2×105细胞(2)在背景上抗原特异性sfc至少有两倍的增长。每个患者组都定义了3个单独的cd4+th1应答度量。(a)整体的抗her2应答率(即,对≥1的肽进行相应的患者比例(“应答率”))(b)反应肽的平均数(“应答组库”)(c)6种肽的累积应答(被报告为sfc/106细胞)(“累积应答”)。
elispot的试验间精密度
依据之前maecker,h.t.等人在bmcimmunology9:9(2008)(″maecker等″)的报道,进行了elispot试验间精密度的测定。当针对受刺激的五个供体产生的累积th1应答绘制平均变异系数(cv)(3天内进行3个平行重复)后,可以观察到一个特征性的非线性关系,其中刺激是使用her2胞外结构域(ecd)肽混合物(肽42-56(seqidno:1);肽98-114(seqidno:2);和肽328-345(seqidno:3))在体外进行刺激。从图3a可以看出,当累积应答接近0时,平均变异系数会急剧上升。由于平均变异系数(cv)和累积应答水平是非线性的关系,3个试验在3天内单独每天的标准偏差(“sd”)针对于累计th1应答被绘制出来,作为测试试验间差异性的手段。如图3b所示,发现标准偏差和累积应答是线性相关的。(连接线表示产生的sd的线性回归,用平行虚线示出回归的95%置信区间。)(r2=0.96,p<0.0001)。
进行了线性的研究,其中从两个高-应答her2-反应应答体中获取的一式三份外周血单核细胞样品被来自已知异体非-her2应答体中外周血单核细胞进行系列稀释,并在体外用her2ecd肽混合物(肽42-56(seqidno:1);肽98-114(seqidno:2);和肽328-345(seqidno:3))刺激。同样的非应答供体也用于所有检测中。在每个稀释点都减去未刺激的背景。在两组供体(1号三角形;2号圆形)都观察到了th1应答和稀释浓度之间显著的线性关系。总的来说,这些数据表明elispot是精确的,可靠的,和可重复的。
her2抗体检测
使用elisa来测试患者血清中内生的igg1和igg4抗-her2抗体。eia/ria板被碳酸氢盐缓冲剂中的her2ecd肽包被(5μg/ml;speedbiosystems,rockville,md),在室温下(rt)孵育一夜。接下来的那天,培养板被在pbs中的1%酪蛋白的中封闭,将一式四份的血清(1∶100稀释)加入到封闭缓冲液中,孵育2个小时,在加入对于igg1或者igg4(lifetechnologies,grandisland,ny)具有特异性的、1∶500-稀释后的hrp共轭抗人类二抗之前洗涤三次。在孵育1个小时后,洗涤培养板,用tmb底物溶液继续进行(kirkegaard&perrylaboratories实验室)。
流式细胞术
pbmc悬浮液在facs缓冲液(pbs+1%fcs+0.01%叠氮)和抗人-cd3,-cd4,-cd8,-cd83,-hla-dr,-cd11b,-cd33,-cd19,-cd56,-cd16(allbdbiosciences,圣何塞,加州)中制备,-cd4和-cd25(bothbiolegend,圣迭戈,加州)被用于确定相关的pbmc的免疫表型。在洗涤后,将细胞和抗体混合物在室温下培养30分钟。培养后,用facs缓冲液洗涤细胞三次,并将细胞用2%的多聚甲醛固定。在24小时内分析染色的样品。根据制造商的说明使用一个foxp3固定/透化试剂盒(biolegend)进行含抗foxp3(ebioscience,圣迭戈,加州)的外周血单核细胞的细胞内染色。使用bdlsr-ii细胞仪进行流式细胞术分析,使用cellquestprotm(bdbiosciences)软件进行数据集的分析。
病例染色
将从her2pos-dcis和ibc肿瘤中获取的经福尔马林固定,石蜡包埋的组织块切片,并经苏木精和曙红染色后,去评估癌周淋巴细胞浸润程度。复合标记if(perkinelmer,沃尔瑟姆,马萨诸塞州)被用于测定从her2pos-dcis和ibc肿瘤获取的样品中的淋巴细胞亚群。(见wang,c等,journalforimmunotherapyofcancer118:1(suppl.1)54(2013))(“wang,c.,etal.”)。使用酪胺信号放大技术为具有同种荧光标记的cd4,cd8,cd20和4’,6’-二氨基-2-苯基吲哚的肿瘤染色。使用vectra多光谱显微镜的模式识别软件分析图像,并识别肿瘤、基质和t/b淋巴细胞。
凋亡分析
具有her2表达光谱的bc细胞系(ithimakin,s.等,can.res.73:1635-46(2013))-her2highsk-br-3.her2intermediatemcf-7,her2lowmda-mb-231(americantypeculturecollection)在rpmi-1640+10%fbs(cellgro/mediatech,马纳萨斯,弗吉尼亚州)培养。50×103细胞被铺在transwell系统上(bdbiosciences),与106cd4+t细胞和105dcis(成熟的树突状细胞)或者idc细胞(不成熟树突状细胞)共培养。依据sharma等人的报道,dcis,不成熟的dc细胞和cd4+t细胞是从选中的接种后的患者中获取的。dcis/idcs,用ii类her2或者非相关对照braf肽(20μg/ml)在37℃下脉冲24小时。特别的,正如图i0a中示出的那样,50×103sk-br-3和仅有培养基(完全培养基),106人cd4+t细胞(仅cd4+),106cd4+t细胞+105ii类her2肽(“idch”)-或者非相关的2类braf肽(“idcb”)-脉冲的idcs,和106cd4+t细胞+105每个her2(“dc1h”)-或者braf(“dc1b”)-脉冲的dcis。dc1s/idcs用2类her2或者非对照的braf肽(20μg/ml)在37℃下脉冲24小时。对照孔只包括培养基或者cd4+t细胞。
多克隆山羊的igg抗人tnf-α(0.(0.06ug/ml每0.75ng/mltnf-α)和ifn-γ(0.3ug/ml每5ng/mlifn-γ)抗体(r&dsystems,明尼阿波利斯,明尼苏达州)被用于中和th1细胞因子,山羊的igg同型作为对照。后续的处理,bc细胞被裂解,并进行蛋白质印迹分析以检测裂解的半胱天冬酶-3。通过dapi染色来评估核碎裂的程度。此外,通过裂解的半胱天冬酶-3检测用(i)从idc:cd4+或者dc1:cd4+t细胞共同培养物获取的上清液,或者(ii)tnf-α(表明为10-200ng/ml)+ifn-γ(表明为100-2000u/ml)(r&dsystems)孵化的50×103bc细胞的凋亡。
表达高水平啮齿动物her2/erbb2(her2hightubo和mmc15,[后者是li-xinwang的试剂,克利夫兰诊所])和her2low/neg(4t1)转基因鼠类乳腺细胞系与单独的培养基(rpmi-1640+10%fcs),单独的重组鼠类rmtnf-α(ng/ml;派普泰克),单独的rmifn-γ(12.5ng/ml,派普泰克),或者rmtnf-α+rmifn-γ的混合培养基中在37℃下培养72小时。接下来的胰蛋白酶化中,收获的细胞被洗涤,并重新悬浮于facs缓冲液中,加入fitc-annexinv(4μl)和pi(2μl)。细胞在4℃下培养20min,洗涤两次,随后进行流式细胞术。凋亡的细胞被定义为那些对两种标记染色都呈现为阳性的。粘着斑蛋白用作装载对照。相应的平均半胱天冬酶-3/膜联蛋白比例±sem,表明凋亡的倍数,可以用imagej软件量化。
elisa
根据制造商的建议使用捕获和生物素化探测抗体和标准为ifn-γ和tnf-α(bdpharmingen)。
统计分析
采用描述性的统计来总结患者特征的分布和免疫应答变量。通过平均数,sem和范围对连续变量进行总结,并且分类变量依据频率和百分比。在必要的时候,使用数据转换(自然对数或者平方根),以满足参数测试的假定情况。对于>3组的情况,使用事后多重比较的配对测验的anova或者秩和检验(kruskal-wallis)(非参数的)来对比持续的可变性。学生t检验被用于2组对比。fisher的精确试验被用于在多层次表格中比较可变性。学生的配对t-检验和mcnemar的精确测试都被用于在th1应答变量中评估患者内配对的变化(比如疫苗接种前和接种后)。p值≤0.05在统计上就被认为是显著的。所有的测试都是双面的。使用spss(ibm公司)或者statxact(cytel公司,圣迭戈,加州)进行了统计分析。
结果
患者特征
在随机的连续登记后,共有143个受试者满足参与研究的标准。参加者的平均年龄是53.1±1.4(范围,21~88)岁,并且大部分(79.0%)是白种人。患者/供体组,以及他们抽血的时间,在图1和上述的方法部分表明。研究参与者的供体人口统计和肿瘤相关的特征在上表1中详细列出。分别是her2pos-dcis组和-ibc组的26个(83.9%)和11个(50.0%)参与者,,之前参加了针对her2pos-dcis的新辅助治疗1型极化(dc1)疫苗接种试验。他们的患者/肿瘤特征已经得到过sharma等人的报道。
合成的抗her2-th1免疫性损失与乳腺肿瘤的发展有关
使用外周血单细胞(“pbmcs”),通过体外her2肽刺激的ifn-γelispot试验检测全身抗-her2cd4+th1应答在肿瘤发生的连续过程中的变化。在组间对比了3个th1应答指标:(a)整体的抗her2应答(对≥1肽有应答的患者比例)(b)反应肽的平均数,和(c)上述6种2类肽的累积应答。当与健康的供体(“hd”)或良性乳腺疾病患者对比时,(图1,a组),观察到在her2pos乳腺癌患者中对于th1应答有一个显著的逐步下降。从之前未经治疗的her2pos-dcis(图1,c组)开始,在未经治疗的阶段i/iiher2pos-ibc达到低点(图1,f组),观察到th1免疫在所有th1应答指标上都有一致的逐渐损失。比如,整体的抗-her2应答率从hd/bd的100%下降到her2pos-dcis的84%以及her2pos-ibc患者下降到32%(p<0.0001)。同样的,如图5a所示,在hd,bd,her2pos-dcis,和阶段i/iiher2pos-ibc患者中也观察到了应答组库的类似的显著下降(5.2±0.2相比4.5±0.4相比2.0±0.3相比0.4±02;p<.0001)和累积应答的显著下降(259.9±23.5相比225.1±25.5相比126.1±24.4相比32.3±5.4斑点形成细胞(sfc)/106细胞,p<0.0001)。当用应答组库(p<0.001)以及累积应答(p=0.001),而不是整体应答率(p=0.07)评估时,对于事后比较(post-hoc),her2pos-dcis患者的th1应答显著低于健康供体。her2pos-ibc患者的th1应答更进一步被抑制,因为这些患者与her2pos-dcis患者相比具有明显更低的整体应答率(p=0.0003)、组库(p-0.001)和累积应答(p<0.001)。每106pbmc的反应细胞百分比在hd的0.03%到her2pos-ibc患者的0.003%之间。
需注意,th1应答在未经治疗的her2neg-dcis(图1,b组),或者her2neg-ibc(图1,d组)患者和hd/bd患者间并没有显著差异。然而,与her2neg-dcis患者相比,her2pos-dcis患者的抗-her2th1组库(p<0.001)和累积应答(p=0.002)显著更少。同样的,与her2neg-ibc患者相比,her2pos-ibc患者具有更低的应答率(p=0.0003),组库(p<0.001)和累积应答(p=0.001),如图5a所示。
正如图6示出的在所有的her2胞外结构域(“ecd”)和细胞内结构域(“icd”)肽的反应活性情况中(p<0.0050),单个her2肽对患者组的累积th1应答的特异贡献证明了从hd/bd到her2pos-ibc患者间的th1应答会有类似的递减,。在dcis/ibc患者中th1免疫应答对有选择性的her2抗原决定簇比例失调的聚焦(focus)不能解释her2pos肿瘤发生中th1的逐渐损失。
为了调查hd/bd供体的th1应答是否比例失调的高于某个亚群,比较了不同年龄(<50岁(n=16),≥50岁(n=15)),不同绝经状态(绝经前(n=16),绝经后(n=15)),不同种族(白种人(n=23),其他(黑人/亚洲人等等,n=8))或者不同妊娠(0次(n=12),>1次(n=19))的应答。在基于年龄、种族、绝经状态分类后的hd亚群中,没有观察到在抗her2th1组库或者累积应答上有明显的区别。然而,妊娠的供体(例如,≥1次妊娠)具有比未妊娠的供体明显更高的抗her2th1组库(5.3±0.2相比4.6±0.2,p=0.01)和累积应答(293.1±21.2相比178.2±19.0,p=0.0008)(图5c)。hd/bd和her2pos-ibc供体(每个n=4)的th1应答在时间上的差异性被检测出来。从同一患者≥6个月间隔的抽血来看,检测出了th1组库和累积应答对于时间相对不变,如图7所示。
her2pos-ibc中抗her2igg1和igg4抗体应答的丧失
注意到hd中之前存在的抗her2th1应答在her2pos乳腺肿瘤中衰减后,使用从健康供体,her2pos-dcis和her2pos-ibc患者提取的血清检测了血清针对重组的her2胞外结构域(ecd)肽的反应活性。评估了与th1免疫相关的igg1和与慢性抗原暴露相关的igg4。如图5d所示,与健康供体(n=12)和之前未经治疗的her2pos-ibc患者(n=7)相比,在her2pos-dcis患者(n=10igg1,n=11igg4)中通过elisa观察到了抗-her2igg1和igg4(d均为<0.0001)的水平均有相对提高。her2pos-ibc患者的相对较低的抗her2抗体水平表明在疾病进展中,内源性抗her2应答的损失。
可疑表达her2的ibc中的cd4+th1应答与其在非可疑her2neg-ibc中是明显不同的
检测了her2neg-ibc患者的th1情况以确定抗-her2th1免疫相对降低的亚群。当与非可疑her2neg-ibc患者(ihc0/1+)(n=11)相比时,可疑表达her2的ibc患者(ihc2+/fish阴性)(n=7)表现出明显的更低的整体应答率(28.6%[ihc2+]相比100%[ihc0/1+],p=0.002),组库(0.3±0.2相比3.9±0.3,p=0.0001)和累积应答(21.4±6.5相比191.2±11.7sfc/106细胞,p=0.002)。如图5a所示,可疑表达her2的ibc患者的th1应答与her2pos-ibc患者的应答类似。通过elispot测定il-10生产和通过流式细胞术测定treg(cd4+cd25+foxp3+)细胞的相对比例时,可疑的和非可疑的her2neg-ibc患者之间并没有明显的不同(未给出数据)。
th1应答损失与宿主水平t细胞耐受性或者增加的免疫抑制循环免疫表型无关
可评价的供体亚群的免疫活性是通过采用ifn-γelispot测定对抗-cd3/抗-cd28的th1应答来评估的;在所有elispot试验中这些应答也作为供体特异性阳性对照。抗-cd3/cd28应答的中值在hd/bd(n=31),her2neg-dcis(n=11),her2neg-ibc(n=11),her2pos-dcis(n=5),her2pos-ibc(n=11)和t/c治疗的her2pos-ibc(n=37)之间并没有不同(1098相比1104相比1032相比1099相比1318相比1032sfc/2x105细胞,p=0.22),分别如图5b所示。此外,分别如图8a所示,激发刺激物(破伤风类毒素)(105±17.0相比96±15.6相比101±11.3sfc/2x105)和白假丝酵母菌(185±10.2相比199±15.3到181±14.6sfc/2x105)的th1应答在被评估的hd(n=10),her2pos-ibc(n=11),和t/c治疗的ibc(n=10)组之间是相似的。共同地,这些数据表明her2驱动的乳腺癌的抗-her2th1应答的逐渐损失不归咎于ibc患者外周血单核细胞中host-levelt细胞的耐受性或者受损的抗原递呈的能力。
分别如图8b所示,使用流式细胞术,来自健康供体组,her2pos-ibc组,t/c治疗her2pos-ibc组的外周血单核细胞中cd3+cd4+(72.8±2.3%相比62.6±3.2%相比63.3±6.9%,p=0.26)和cd3+cd8+(25.1±2.9%相比37.9±4.7%相比38.2±6.6%,p=0.15)细胞的平均比例并无明显不同。未观察到组间的b细胞(cd19+)或者自然杀伤(nk)细胞(cd3-cd16+)比例的区别(未示出数据)。在以下的组别中比较了全身免疫抑制表型。如图8c所示,hd,her2pos-ibc,和t/c治疗her2pos-ibc亚群之间的cd4+cd25+foxp3+细胞(treg)(1.8±0.3%相比1.5±0.2%相比1.7±0.3%,p=0.78)和cd11b+cd33+hla-dr-cd83-细胞(髓源性抑制细胞“mdsc”)(0.6±0.1%相比1.0±0.3%相比0.9±0.1%,p=0.33)的平均比例并没有明显不同。
her2-特异性il-10的生产也通过elispot在患者亚群中检测,所述il-10是2型t-辅助(“th2”)或者treg功能的代替。如图8d所示,在hd,her2pos-ibc,和t/c治疗ibc组之间,他们的抗her2应答性(所有100%),组库(1.8±0.4相比1.8±0.2相比2.0±0.3)和累积应答(77.4±15.2相比66.6±8.2相比92.8±4.7)并没有明显的不同。如图8e所示,il-10生产的抗-cd3刺激物在所有评估组中都是相似的。然而,亚群之间的整体il-10生产并没有不同,供体匹配的her2特异性ifn-γ:il-10产量比从hd组中的6.6∶1(相对th1有利的表型)急剧变化到未治疗her2pos-ibc患者组的0.74∶1和t/c治疗的her2pos-ibc患者组的0.97∶1(相对treg/th1有利表型)(p=0.009)(顶侧)。
系统性的th1应答损失与运输至her2pos-ibc病变的比例失调的t淋巴细胞无关
从病理学的角度,对14个her2pos-dcis和8个her2pos-ibc病变进行了免疫组织化学分析,以确定系统性的ifn-γposcd4+应答损失是否与运输至ibc病变的比例失调的淋巴细胞有关。结果如图9a所示。然而,在大多数(12/14,85.7%)的评估患者中,观察到中等(≥15%基质转移)到较高(≥25%)的淋巴细胞水平集聚在含dcis导管外的基质区(顶部)(箭头示出),在所有8个ibc患者中(8/8,100%)(底部)观察到在侵入病灶的周围相对缺乏淋巴细胞(箭头)。
根据wang,c等人的描述,通过新型的多标记免疫荧光图像技术分析了淋巴细胞的表型,这种方法能够辨别肿瘤和基质区,能够可靠地检测相对的cd4+(绿色),cd8+(黄色)和cd20+(红色)亚群。结果如图9b所示。her2pos-ibc肿瘤的大多数基质(stl)和肿瘤浸润的淋巴细胞(til)由cd8+细胞组成(右上侧)。此外,与dcis病灶(左上侧)相比,在her2pos-ibc肿瘤中观察到相对较少的cd4+til/stl。比例失调的癌周cd4+t细胞运输至her2pos-ibc病变并不能解释fn-γposcd4+t-细胞亚群的系统性消耗。
较高/中等her2表达而非较低her2表达的bc细胞对cd4+th1介导的细胞凋亡是敏感的
评估了th1介导效应对体外her2highsk-br-3,her2intermediatemcf-7和her2lowmda-mb-231bc细胞系的影响。采用transwell培养系统将比例不断增加的her22类肽-特异性cd4+th1细胞和上述种类的表达her的bc细胞共培养,所述th1细胞被her2-脉冲dc1刺激,使用transwell培养系统导致了冲击性的sk-br-3剂量依赖的凋亡,其由蛋白质印记分析法检测的增加的半胱天冬酶-3证明,如图10a所示。图11a可见mcf-7、而非mda-mb-231bc细胞。相反,如图10a和图11a所示的,与cd4+细胞共培养的bc细胞中细胞凋亡相对不是很显著,所述cd4+t细胞用未成熟的dcs(idch和idcb)或者对照的2类肽(braf)-脉冲的dcis(dc1b's)刺激。通过elisa分析这些共培养的上清液中的th1细胞因子的数量,可以看出相比图10a示出的cd4+:braf对照dc1,cd4+t细胞:her2脉冲的dc1产生的ifn-γ和tnf-α有显著增加,对应于观察到的凋亡程度。
如图11b所示,当与cd4+t细胞:her2脉冲的dc1共培养物而不是与cd4+:her2-idc或者cd4+:braf对照-dc1共培养物的上清液一起培养时,能够在sk-br-3细胞中观察到相似的特异性凋亡。与对照组相比,her2-特异性的th1细胞对导致sk-br-3凋亡的25倍的增加,这可以从图10b的dapi染色看出,右图和柱形图。综合考虑,这些数据表明抗her2cd4+th1细胞产生了可溶性因素调控了高/中表达的her2,而非低表达的her2,乳腺癌细胞。
重要的是,如图10a所示,her2highsk-br-3的凋亡能够通过中和ifn-t和tnf-α显著救援,表明多效性的th1细胞因子在调控her2特异性的细胞凋亡中有关键的作用。为了进一步研究这些现象,检测了ifn-γ和tnf-α对bc细胞的影响。不论her2表达如何,人体bc细胞能够均一地维持ifn-γ和tnf-α受体表达,如图10c所示。ifn-γ和tnf-α处理导致her2highsk-br-3和her2intermediatemf-7的显著凋亡,不包括her2lowmda-mb-231,如图11c所示。接下来,为了评估mda-mb-231细胞恢复的her2表达保留了对th1细胞因子调控凋亡的敏感性,mda-mb-231细胞用野生型的her2质粒(pcdna-her2)或者对照组的空白载体(pcdna3;kindgiftsofmarki.greene,宾夕法尼亚大学)转染,并用ifn-γ和tnf-α(2000u/mland200ng/ml;与图11c所示的对mda-mb-231处理的计量不同)。观察到her2转染后发生了ifn-γ/tnf-α诱导下的显著凋亡,未在空白转染的mda-mb-231发现此现象(未给出数据)。
最后,这些th1细胞因子调控的her2特异性凋亡在转基因的鼠乳腺癌细胞中得到了证实。用重组的鼠ifn-γ和tnf-α,而不是单独的细胞因子进行两次处理,会导致her2hightubo和mmc15而不是her2low/neg4t1的显著凋亡,见图10d。这个her2pos-ibc的应答损失在her2脉冲dc接种后就可以恢复,而不是在her2靶向或者常规治疗后。
在her2-脉冲dc疫苗接种之后,而不是her2-靶向或传统治疗之后,her2pos-ibc中的th1应答损失被恢复
分析并且在图12a顶层给出了t/c治疗和her2脉冲dc1免疫对her2pos-ibc患者th1应答的不同影响。之前未经治疗的阶段i/iiher2pos-ibc患者(n=22,图1f组)和t/c治疗阶段i-iiiher2pos-ibc患者(n=37,图1g组)在抗her2应答性(31.6%未处理相比45.9&t/c治疗,p=0.39),组库((0.4±0.2相比0.8±0.2,p=0.24)或者累积应答(32.3±5.4相比54.5±12.0sfc/106,p=0.97)上没有明显的区别。如图12b顶层所示,紧接着对11个阶段1her2pos-ibc患者进行her2脉冲的dc1接种(图1h组),然而,观察到在抗her2应答率(18.2%接种前相比90.9%接种后,p=0.0035),组库(0.3±0.2相比3.7±0.5,p=0.0001)和累积应答(29.7±7.9相比162.8±33.7sfc/106,p<0.0001)上有显著的提高。dc1疫苗接种后,而不是t/c收到之后的冲击性的th1恢复影响会持续到和阶段1之前未经治疗(n=11),t/c-治疗(n=8)和接种后(n=11)her2pos-ibc患者匹配的阶段,如图12c所示。
在dc1疫苗接种后检测了其与t/c治疗在ifn-γpos:il-10pos反应t细胞相对比例上的不同。在同时进行的供体匹配对比中,然而her2特异性ifn-γ(196.8±56.8接种后相比32.1±6.1接种前sfc/106,p=0.02)和il-10(79.0±7.4相比33.8±5.1sfc/106,p=0.001)应答在her2脉冲的dc1疫苗接种后增加了,ifn-γ:il-10应答的相对比例从0.95∶1(相对的treg/th2-有利)/重新接种变到2.5∶1(th1有利)疫苗接种后(p=0.008)。然而,ifn-γ:il-10应答的相对比例并不能表明相比于之前未经治疗的(0.74∶1,p=0.78)her2pos-ibc患者来说在t/c治疗(0.97∶1)后有一个明显趋向于th1有利的表型。
纵向的≥6个月的疫苗接种后th1免疫评估对9个患者(81.8%)是可能的。如图12d和图12e所示,尽管所有患者在接种后都已完成了术后的化学疗法,但是观察到了相对于接种后基准线更为持续的抗her2th1反应活性,其中值时间为16个月(6~16岁范围),抗her2应答(100%≥接种后6个月相比22.2%接种前,p=0.008),组库(4.0±0.4相比0.3±0.2,p<0.0001),累积应答(255.1±49.2相比33.8±9.2sfc/106,p=0.006)。
进行了t/c治疗后组的亚群分析,以研究th1反应活性的差异,依据化学疗法(新辅助治疗或者佐剂);从完成描述的曲妥单抗到研究登记的时间(<或者≥6个月);雌激素受体的状态(erpos或者erneg);和病理学状态(i~iii)。图13a示出了化学疗法的顺序(新辅助治疗[n=12]相比佐剂[n=25]);图13b示出了曲妥单抗完成后的时间(<6,[n=16]相比≥6个月[n=21];),或者图13c表示了er的状态(erpos[n=21]相比erneg[n=16]),并没有影响抗her2的th1的应答性,组库,或者累积应答(所有p=ns)。重要的是,图13d表示了ajcc阶段i(n=8),阶段ll(n=20)或者阶段iii(n=9)t/c治疗的患者在th1指标上并未有不同,表明观察到的her2pos-ibc的抗her2th1损失与疾病负担没有依赖性。此外,这些数据总体来说能够表明部分亚群的主导的th1反应活性不是引起观察到的在t/c治疗的her2pos-ibc患者中全面出现的免疫恢复减少的原因。
下调的的抗-her2th1应答与不良临床结果有关
为了评估这些发现的横向相关性,进行了一个评估,以确定t/c治疗的her2pos-ibc患者出现的th1应答的差异是否与后续的乳腺事件(“be”;定义为任何局部的/远端复发)的发展有关。后续的中值是33.5个月(四分位数间距iqr25.5-45.8)。如下表2所示,表示出her2pos-ibc患者在曲妥单抗和化学疗法之后发生后续的乳腺癌事件(定义为任何局部的或者全身复发)的人口和临床特征。8个患者(21.6%)在接受了t/c治疗后发生了后续的be,其中位持续时间为29个月(四分位数间距iqr16.2-36)。图13e,左侧,表示出了与没有be的患者相比,发生be的患者具有显著抑制后的抗her2应答性(顶侧)(有be的患者12.5%相比没有be的患者55.2%,p=0.048)和累积应答(底部)(9.4±3.6,66.9±14.5sfc/106,p=0.046),但不包括应答组库(中间)(1.03±0.3相比0.13±0.1;p=0.11))。
表2
在12个(32.4%)接受新辅助治疗t/c的t/c治疗的her2pos-ibc患者中,比较了病理完全应答(pcr,定义为术后病理中未发现残留的浸润bc)和非病理完全应答患者在抗her2th1应答方面的差异。图13e右侧的结果,表示4个患者(33.3%)获取的病理完全应答的结果,与显著较高的抗her2组库(3.3±1.1,0.13±0.13,p=0.002)(中间)和累积应答(193.1±64.9,13.6±4.6,p=0.002)有关。抗her2应答(100%,25%,p=0.06)(顶部)不具有统计学意义。
讨论
反制点抑制剂的出现(topalian,s.l.等,n.eng.j.med.366:2443-54(2012)),免疫调控策略比如说接种(kantoff,p.w.等,n.eng.j.med.363:411-22(2010)),toll样受体激动剂,或者针对特定组织特异性抗原决定簇的t细胞治疗(kalos,m.等,sci.transl.med.3(95):95ra73(2011)和rosenberg,南非,自然评论临床肿瘤学,8:577-85(2011))已经为更加有效的癌症免疫疗法打好了基础。这些疗法中的大多数都是面向广泛的免疫调控。与这些发现同时,基因组学已经识别了肿瘤发生的致癌分子驱动,包括v-raf鼠肉瘤病毒癌基因同系物b1(braf),表皮生长因子受体(“egfr”),肝细胞生长因子受体(“c-met”)和her2。靶向疗法比如“驱动”能够获得令人鼓舞的应答率,他们的成功相对短暂,因为大多数肿瘤最终会复发或者变得对疗法有抗性(genuinepohlmann等和flaherty,k.t.等,n.eng.j.med.363:809-19(2010))。在肿瘤发展期间识别致癌驱动特异性的免疫缺陷可能会为特定的癌症亚类提供因病施治的治疗机会。此处所述的被认为是在肿瘤发生中识别cd4+th1免疫缺陷的的初始研究,该免疫缺陷对特定的bc表型的分子驱动具有特异性,即her2/neu。
抗-her2cd4+th1免疫的衰变开始于癌前的dcis阶段,并且逐渐损失于早期侵润疾病阶段。此外,th1免疫似乎也会特异地在her2过度表达的表型中损失。应用广泛的肿瘤发生的连续过程中,在此已经证实her2neg-dcis和her2neg-ibc患者(ihc0/1+)的抗her2th1应答与hd/bd供体的十分类似,并且显著地高于her2pos(ihc3+或者2+/fish阳性)dcis和ibc患者,此外,在可疑的表达her2的(ihc2+/fish阴性)个体中的th1应答会损失,类似于her2pos-ibc患者。特别是,her2neg-ibc患者的her2-特异性cd4+免疫性的维持,可以部分地解释他们接受了以激活cd8+t细胞为目的的her2肽疫苗接种后取得的改善的临床结果。见benavides,l.c.,等,clin.can.res.15:2895-904(2009)。
在某种程度上令人吃惊的是hd/bd维持了可识别的循环抗her2th1细胞数量。由于妊娠哺乳期的her2在名义上是存在于分支乳腺导管细胞的膜组分,(press,m,f等,oncogene5:953-62(1990)),所以hd/bd中预先存在的cd4+t细胞应答是乳腺中的抗原递呈细胞(“apcs”)递呈her2-抗原决定簇所产生的结果是貌似可信的。事实上,尽管与年龄,种族或者绝经状态无关,在hd/bd中事先存在的抗-her2th1免疫要高于非妊娠期的供体,特别的,后者是bc发展的危险更高的群体。此外,通过her2hig、而不是her2low体外表达ifn-γ/tnf-α受体的bc细胞系中的细胞因子ifn-γ和tnf-α实现的显著的her2-特异性th1的细胞凋亡作用,表明了抗-her2th1可能在诸如乳腺退化的生理过程对控制或者消除her2过度表达细胞是有帮助的。因而,健康供体中预先存在的抗-her2th1免疫可能会针对肿瘤发生事件予以保护,然而抗-her2th1功能的丧失可能代表了一种肿瘤驱动的机制,其可以避免her2pos肿瘤发生中的免疫监控。有趣的是,最近的证据表明优先的循环肿瘤相关的抗原(比如mage6,epha2)特异性cd4+th1死亡程序可能导致在有活跃疾病的黑色素肿瘤患者中观察到的免疫障碍(wesa,a.k.等,front.oncol.4:266(2014))。相似的机制也出现在目前研究中观察到的抗her2cd4+th1免疫的损失中-解密,和靶向,这些机制对于旨在预防早期bc的免疫干涉的发展来说是重要的。这些机制,以及乳腺稳态中的抗her2th1细胞的功能意义,保证了进一步研究。
虽然先前的her2-th1免疫存在于hd/bd中,但her2反应性体液应答却不是。在健康的乳腺中,非炎性设置中通过抗原递呈细胞早启动cd4+th1细胞,在通过ifn-γ/tnf-α分泌引起her2表达细胞的稳态时,不能够驱动抗体的产生。然而,在her2pos-dcis中,在her2-反应igg1/igg4的相对增加是与中间物相关的,但不能缺少th1应答。her2抗原的出现对发展的肿瘤的刺激,以及后续的抗原递呈细胞在炎性环境中保留th1细胞,使瞬态的抗体得以分泌。最终,在her2pos-ibc中,cd4+t细胞的减弱可能会侵蚀抗体的连续分泌,导致他们最终的损失。这些适应免疫的方面的耗散将致使这些患者不能够实现肿瘤的早期预防和控制。
除了以上讨论的之外,抗-her2th1免疫的损失也会其他其他机能比如,慢性t细胞损耗或者外周耐受性及其对协同信号(比如tims,pd-l1,ctla-4等)的影响作用,或者her2-反应免疫表型的改变。事实上,虽然整体il-10应答在肿瘤发生连续体中都有维持,当使用抗原特异性ifn-γ:il-10比例评估时,her2-特异性应答从强的th1-有利的(hd/bd)到相对th2/treg-有利的(在her2pos-ibc)表型的功能性转变。完整的,虽然是柔和的,在7/22(32%)her2pos-ibc患者的th1应答率,因而,可能会影响进行中的th1抗癌免疫保护和肿瘤发生过程中的耐受的treg/th2贡献(levings,m,k等,blood105:1162-9(2005))之间的平衡。
虽然如此,抗her2th1免疫的损失却不是在her2pos-ibc患者中引起循环免疫抑制数量增加的原因。虽然之前的研究已经报道了在后期的bc(阶段hi/iv)(liyanage,u.k.等,j.immunol.169:2756-61(2002))和其他实体肿瘤(zhang,b.等,在plosone8(2):e57114(2013)),在此项研究中,早期(阶段i/ii)的ibc患者似乎相对于hd有可比得上的免疫抑制。因而,这些患者在抗her2th1应答上的急剧下降甚至是更加强制性的。更进一步,这种外周血抗her2ifn-γposcd4+t细胞亚群的降低与以下无关(i)免疫雕塑(immunesculpting),由于在连续肿瘤发生中未观察到偏向于选择性her2肽反应活性。第二个发现应当谨慎解释,然而,由于这些数据没有说明肿瘤微环境中her2特异性cd4+til的汇集或者损耗。最后,抗her2th1免疫抑制不能用通用的ibc患者宿主水平t细胞无反应性来解释。然而,现有的研究也没有完全排除抗原特异性细胞水平无反应性作为这一现象可能的解释。
重要的是,这个抗her2th1消耗与t/c治疗的her2pos-ibc患者的增加的局部或者远端复发的风险相关。相反,抗her2th1的保留与pcr之后的新辅助治疗t/c有关。总的来说,这些数据说明监测her2直接疗法后的抗her2th1免疫反应活性可以识别容易遭受临床或者病理学失败的的亚群。此外,抗-her2th1的缺乏和不利的临床病理学的结果证明了研究可能扭转这些免疫损耗的治疗策略的正确性。
甚至在控制疾病负担之后(比如病理学阶段),her2pos-ibc患者的受到抑制的抗her2th1应答在手术、放射、化学疗法或者没有曲妥单抗下的her2靶向均为受到影响。若干研究已经证明了曲妥单抗在降低her2pos肿瘤增长和诱导其消亡方面的能力(dogan,i.等,mol.cell.biochem.347:41-51(2011)道),同时也证明了其使her2pos细胞对细胞因子化学疗法的杀肿瘤的敏感性(henson,e.s.等,clin.cancerres.12:645-53(2006))。虽然有这些优势,但使用曲妥单抗并未能明显地恢复大多数患者的her2特异性th1疫能力,包括哪些处于阶段i的患者。此外,在后期肿瘤阶段观察到了几乎是普遍的对于这些her2靶向疗法的抗性。pohlman等。因而,需要额外的以her2为目标的策略。
如此处所述,一个这样的策略,就是用her2来源的2类肽和自体dc1一起进行免疫。接受新辅助治疗之后,在her2pos-ibc患者(术前)内进行her2脉冲dc1疫苗接种,免疫接种后抗her2th1的持续恢复可以在长达60个月被观察到。总的来说,这些数据说明了,(i)这个her2特异性的cd4+th1免疫缺陷并不是免疫学中“固定的”,因为它可以通过合适的免疫干涉措施加以更正;和(ii)将疫苗接种(或者别的免疫调节策略)和现有的以体液为基础的her2靶向疗法的组合能够改善这种疾病的长期结局。事实上,在鼠模型中,细胞的(ifn-γ-生成的cd4+,但不是cd8+,t细胞(sakai,y.等,cancerres.64:8022-8(2004)))和体液的针对her2免疫性的合作对于消灭her2pos肿瘤是重要的(reilly,r.t.等,cancerres.61:880-3(2001))。
总的来说,目前的发现对于her2pos-bc患者的免疫监测和疗法选择是有意义的。正如讨论的那样,他们证实了在her2驱动的bc的高危人群中将抗her2免疫添加至标准化her2靶向疗法中的正确性;事实上,在接受新辅助治疗t/c治疗后仍有残留疾病的her2pos-ibc患者中以及那些在佐剂治疗后处于肿瘤后期的患者中测试这些组合的疗效的试验已经开始进行。更进一步,由于常规的监测策略(射线照相,乳腺活检样本的ihc/fish分析)只能提供对肿瘤变化的单独的快照,监测高风险患者的抗her2th1免疫实时波动能够为了解自然病程和对肿瘤的免疫影响提供信息。将cd4+th1免疫检测方法整合到将来的bc临床试验设计是合乎情理的。
总结如下,据我们所知,此处我们认为在乳腺肿瘤发生中分子肿瘤驱动的第一步是cd4+th1免疫的逐步和特异性损失。了解那些与下调的抗her2th1免疫相关的不利的临床和病理结果表明接种获得的免疫恢复或者别的免疫调控策略是值得在这些高风险患者中研究的,以缓解肿瘤的发展或者预防复发。也进行了额外的研究以确定抗her2cd4+应答是否在其他的her2pos癌症中也受到损失了(比如卵巢癌,胃癌等),以及确定在肿瘤发生过程中对其他分子致癌驱动产生免疫的th1免疫是否有普遍的损失。
试验实例
抗-her2cd4+th1应答是一种针对her2阳性的乳腺癌的、在新辅助治疗之后的、与病理应答有关的新型免疫疗法
在当代的实践中,具有较大的可切除肿瘤的患者经常会从曲妥单抗和化学疗法(t/c)的新辅助治疗施用中受益,约有40%~60%能够获得病理学的完全应答(pcr)。见gianni,l.,等,lancet375:377-84(2010);untch,m.等,j.clin.oncol.28:2024-31(2010);untch,m.等,j.clin.oncol.29:3351-7(2011)。与手术治疗的残余疾病相比(“<pcr”),新辅助治疗t/c治疗之后的pcr是降低复发和提高长期生存机会的确定的方法。
以上的参考实例证实了her2pos乳腺癌肿瘤发生的连续过程中抗her2cd4+1型t辅助细胞(th1)免疫逐渐损失。特别令人感兴趣的是,这一her2特异性th1应答在健康的志愿者和含有her2neg(0-1+)浸润性乳腺癌细胞(“ibc”)的患者均有存留。在her2pos-ibc患者中,这一抗her2th1损耗不会受到标准疗法——手术切除,放疗或者t/c治疗的影响,反而会在her2脉冲的1型极化树突状细胞(dc1)疫苗接种后恢复。此外,也示出了下调的的抗her2th1应答预测了接受佐剂t/c治疗的患者会有更高的后续复发的风险。这些观察促成了对于相似的下调的抗her2th1应答是否也能在另一种已知的复发前兆中被观察到的研究,即,新辅助治疗t/c后的<pcr状态(kim,m.m.等,ann.oncol.24:1999-2004(2013)),相反,假设抗her2th1应答的预防和恢复也被假设为与pcr有关。因而pcr和<pcr患者在抗her2th1应答上的差异被检测以确定可更改的免疫与病理应答的相关性。
前瞻性地分析了87个her2pos-ibc患者的抗her2cd4+th1应答,并且比较了阶段i/iiher2pos-ibc患者(n=22)和阶段i-iiit/c治疗的her2pos-ibc患者(n=65)的应答的区别。在t/c治疗的组-抗her2th1应答生成在佐剂曲妥单抗完成后-应答按照化学疗法时间(比如新辅助治疗相比佐剂)分级,或者更进一步在新辅助治疗组中按照pcr和<pcr的状态分级。pcr定义为在对切除乳腺样本和取样的淋巴结的病理学检查中残余的侵入癌症(即,ypt0/tisypn0)已经不存在。
<pcr组中的4个患者被重新召集参加一个佐剂her2脉冲的1型极化dc(dc1)疫苗接种试验(nct02061423)。分析了这些患者在免疫前和免疫后的抗-her2th1应答。
方法
正如参考实例中描述的那样,检测未膨胀的pbmc的循环抗her2cd4+th1应答,所述pbmc用6个her2来源的2类肽(肽42-56,肽98-114,肽328-345,肽776-790,肽927-941,和肽1166-1180)(seqidnos:1-6))进行体外脉冲,通过酶联免疫斑点法(elispot)测定了ifn-γ的生成,elispot按参考实例中的描述进行。从hla-a2.1pos供体中获得的pbmc使用2种her2来源的1类肽(肽369-377(seqidno:7)和肽689-697(seqidno:8))刺激,同时将pma(50ng/ml)和离子霉素(1ug/ml;sigma-aldrich)作为阳性对照。
使用了一种确定抗原特异性应答的经验方法。对单个her2肽的阳性应答定义为:(1)减去未受刺激的背景后在试验孔中的最小阈值为20sfc/2x105细胞,和(2)相对背景有大于等于2倍的抗原特异性sfc的增长。th1应答的度量为上述参考实例中描述的抗her2应答率,反应肽(组库)的数量和6种肽(sfc/106细胞)的累积应答。分析了接受佐剂her2脉冲的1型极化树突状细胞(dc1)疫苗接种的<pcr患者(n=4)在免疫前后的th1应答。
结果
研究包括87个患者。在t/c治疗(n=5)之后,之前未经治疗her2pos-ibc患者的下调的抗her2th1应答不能够全面提高。与佐剂t/c相比,新辅助治疗-t/c(61.5%)与较高的th1组库(1.5相对0.8,p=0.048)相关。虽然pcr患者(n=16)和<pcr患者(n=24)在人口/临床特征上没有区别,然而pcr患者更可能有erneg肿瘤。与<pcr患者相比,pcr患者具有高得多的抗her2应答性(94%相比33%,p=0.0002),组库(3.3相比0.3,p=0.001)和累积应答(148.2相比22.4,p=0.0001)。这种不一致性是通过cd4+t-bet+ifn-γ+表型来调解的,对<pcr患者的免疫失效,宿主水平t细胞无效性,或者增加的免疫抑制的数量不起作用。在4个<pcr患者中,在her2脉冲dc1疫苗接种后,th1组库(3.7相比0.5,p=0.014)和累积应答(192.3相比33.9,p=0.014)有显著的改善。
结论
抗her2th1应答是一种新型的免疫疗法,其与新辅助治疗t/c治疗之后的病理应答有关。在<pcr患者中,接受过新辅助治疗的具有her2表达的患者,其下调的th1应答可以通过her2-th1免疫干预来恢复,并且能够改善pcr或者复发率。
因此,将her2靶向的th1免疫干预添加到新辅助治疗t/c方法中或者添加到高风险<pcr亚群中进行的佐剂设置中已经被证实。此外,根据参考实例中证实的下调的抗her2th1免疫与佐剂t/c治疗的患者的后续复发有关系,监测高风险<pcr患者的抗her2th1免疫的实时波动可以作为现有的射线成像法检查的补充,并且帮助确定在治疗上进行干预的关键窗口。
综上所示,这可以作为her2pos-ibc患者在抗her2cd4+th1免疫和新辅助治疗t/c之后pcr之间的关键联系的首次描述。虽然尚不能确认因果关系,但是在新辅助治疗t/c治疗的<pcr患者中观察到的急剧的ifn-γ+抗her2th1损耗增大了使用her2th1干预的免疫救助在改善高风险患者的疗效上作为标准的her2靶向疗法的补充的可能性。
本公开的每个和每一个专利,专利申请和在这里引用的出版物将其全部内容通过引用并入本文。
本申请提供了对本发明的描述以用于举例说明和描述的目的,但无意于穷举或限制。许多修改和变化将对本领域技术人员是显而易见的。实施例被选择和描述从而最好地解释原理和实际应用,并使得本领域的其他普通技术人员理解有不同修正的各种实施例的公开,这些修正适于具体考虑的使用。
虽然本发明例示的实施例已经参照附图在此加以描述,但应该明白本发明并不限于这些确切的实施例,本领域技术人员可在不背离本发明的范围或精神的前提下,进行各种其它变化和变更。本发明的所附权利要求通常应理解为涵盖在所有这样的实施例和同等变化。
- 还没有人留言评论。精彩留言会获得点赞!