可降解镁基骨内植物可载药高分子/钙磷复合涂层及制备的制作方法
本发明属于生物医用材料制备技术领域,具体为一种可降解镁基骨内植物可载药高分子/钙磷复合涂层及制备。
背景技术:
在骨科内植入物领域,镁及镁合金内植入物材料有希望替代传统医学中的不锈钢、钛及钛合金等骨科内植入材料。与其它医用金属材料相比,镁及镁合金具有如下的优势:1)可降解性。镁合金具有较低的腐蚀电位,在含有氯离子的体内环境下易发生腐蚀,并以缓慢腐蚀的方式在体内完全降解,可实现镁在人体中的降解吸收。2)生物安全性高。Mg作为人体必需的营养元素,在人体内含量仅次于Ca、K、Na排第四。3)生物力学相容性好。镁是目前所有金属材料中生物力学性能与人体骨最接近的金属材料。镁及其合金的密度约为1.7g/cm3,与人体骨组织的密度(1.75g/cm3)接近。同时,纯镁的弹性模量44.1GPa,稍高于一般骨12-20GPa,同齿骨40-80GPa水平相当,抗拉强度为120-160MPa。由此可见,镁的物理机械性能更接近于生物骨,可有效缓解应力遮挡效应。但是镁及镁合金应用到临床上作为骨科内植入物材料尚存在一些技术难题,主要是镁及镁合金在体内降解太快,在修复器官恢复功能前难以维持其必要的强韧性,并且其生物相容性有待进一步提高,因此有必要对镁及镁合金材料进行表面改性以满足其临床应用。通过在镁及镁合金表面构筑生物活性钙-磷涂层,是镁及镁合金骨内植入材料表面改性的一个重要方向。构筑生物活性钙-磷涂层不仅能提高植入物的生物相容性,促使植入体与骨组织间形成直接的化学键性结合,对骨组织在镁及镁合金表面沉积有积极的诱导作用,促进骨的生长,有利于植入体早期稳定,缩短手术后的愈合期,而且可以延缓基体在体液中的腐蚀和降解速率。
近年来,国内外关于在镁及镁合金表面构筑生物活性钙-磷涂层已经进行了大量的研究,研究表明构筑钙-磷涂层确实提高了镁及镁合金生物相容性,显著降低了镁及镁合金的腐蚀速率。随着骨科疾病在日常中越来越普遍,传统的截肢手术治疗手段已经逐渐向保肢手术治疗方向发展。镁合金内植入物生物活性钙-磷涂层能显著提高植入物的 生物相容性,促进骨的生长,延缓基体在体液中的腐蚀和降解速率,但是生物活性钙-磷涂层存在无法有效载药达到长期缓慢释药功效的问题。目前遇到的最大挑战是如何在降低镁合金在体内环境中的降解速度,确保在修复器官恢复功能前维持其必要的强韧性前提下,同时在骨内植入物材料上载药,对骨科疾病进行治疗。
技术实现要素:
本发明的目的在于针对现有技术存在的上述不足,提供一种用于可降解镁合金骨内植物表层的载药高分子载体及生物活性钙-磷复合涂层及其制备方法。本发明的制备聚合物(载药高分子载体)及生物活性钙-磷复合涂层的方法,具体是指在骨内植物用镁及镁合金合金表面先后依次修饰载药的可降解聚合物涂层及在聚合物涂层表面继续沉积生物活性钙-磷层的复合涂层的制备方法。本发明解决了目前生物活性钙-磷涂层无法有效载药的问题,在生物活性钙-磷涂层与基体之间加入一层高分子药物载体涂层,能够在满足外层生物活性钙-磷涂层提高植入物的生物相容性,促使植入体与骨组织间形成直接的化学键性结合,促进骨的生长,延缓基体在体液中的腐蚀和降解速率的情况下,又能在镁合金表面载入药物,治疗一系列骨病变疾病,并且可以通过改变聚合物涂层厚度、载药量及生物活性钙-磷涂层厚度来调节药物释放速度;操作工艺简单、易行,制备的涂层与基体结合力强,厚度可控。
本发明的目的是通过以下技术方案来实现:
将骨内植入物用镁或镁合金置于氢氟酸恒温浸泡,将生物可降解高分子材料溶解在有机溶剂中,形成聚合物溶液,然后采用浸涂法将聚合物溶液均匀涂覆在氟化处理镁合金表面,真空干燥,形成均匀的聚合物涂层,最后对涂覆聚合物涂层的镁合金进行紫外臭氧预处理后,置于磷酸盐混合液中恒温浸泡,制备得到用于载药的高分子载体及生物活性钙-磷复合涂层。
第一方面,本发明涉及一种可降解镁基(镁或镁合金)骨内植物的可载药高分子/钙磷复合涂层,所述复合涂层由里至外包括氟化膜、生物可降解高分子涂层和生物活性钙-磷涂层,所述氟化膜设于所述骨内植物表层。
作为优选技术方案,所述氟化膜厚度为150nm~3μm;所述生物可降解高分子涂层的厚度为0.1μm~100μm;所述生物活性钙-磷涂层的厚度为100nm~500μm。
作为优选技术方案,所述生物可降解高分子涂层与氟化膜结合力≥10MPa,所述生物活性钙-磷涂层中Ca/P原子比为1~1.2∶1,所述生物活性钙-磷涂层与生物可降解高分子涂层结合力≥10MPa,复合涂层的成骨细胞毒性在0级。
作为优选技术方案,所述生物可降解高分子涂层为聚乳酸、聚己内酯、聚三亚甲基碳酸酯、聚乳酸-三亚甲基碳酸酯共聚物、聚己内酯-三亚甲基碳酸酯共聚物、聚羟基乙酸或聚乳酸-羟基乙酸共聚物载体涂层。
第二方面,本发明涉及一种可降解镁基(镁或镁合金)骨内植物的可载药高分子/钙磷复合涂层的制备方法,所述制备方法包括如下步骤:
A、将镁或镁合金骨内植物置于氢氟酸中恒温浸泡;
B、将生物可降解高分子材料溶解在有机溶剂中,形成聚合物溶液;所述聚合物溶液中生物可降解高分子材料的质量百分比浓度为0.1%~10%;
C、将所述聚合物溶液涂覆在步骤A处理后的骨内植物表面,真空干燥,形成生物可降解高分子载体涂层(未载药时,称为生物可降解高分子载体涂层;载药时,称为生物可降解高分子载药涂层);
D、对步骤C处理后的骨内植物进行紫外臭氧或氧气、空气等离子体预处理后,置于磷酸盐混合液中恒温浸泡,取出干燥,即得所述复合涂层。
作为优选技术方案,所述复合涂层载药时,步骤B是将生物可降解高分子材料和药物溶解在有机溶剂中,形成聚合物溶液;所述聚合物溶液中药物的质量百分比浓度为0.1%~50%,所述药物为除生物大分子药物以外的各类有机小分子药物,包括但不限于紫杉醇、雷帕霉素、地塞米松、庆大霉素等。
作为优选技术方案,所述骨内植物是指:骨板、骨钉或骨组织工程支架等骨修复相关的内固定物。
作为优选技术方案,所述镁为纯镁,所述镁合金为Mg-Al系、Mg-Zn系、Mg-Ca系、Mg-Mn系或Mg-RE系等未经任何处理的裸金属镁合金系列。
作为优选技术方案,步骤A中,所述恒温浸泡为在4~40℃(更优选20℃)下在20wt.%~40wt.%氢氟酸中浸泡6~48h。形成的氟化膜,可作为镁或镁合金基体表面的保护膜,减慢基体的腐蚀速度。
作为优选技术方案,所述生物可降解高分子材料的重均分子量为5000~500000;所述生物可降解高分子材料为具有良好生物相容性以及可生物降解性能的聚乳酸(包括PLLA、PDLA和PDLLA)、聚己内酯(PCL)、聚三亚甲基碳酸酯(PTMC)、聚乳酸-三亚甲基碳酸酯共聚物(P(LA-TMC))、聚己内酯-三亚甲基碳酸酯共聚物(P(CL-TMC))、聚羟基乙酸(PGA)、聚乳酸-羟基乙酸共聚物(PLGA)中的一种。聚合物溶液中生物可降解高分子材料的质量百分比浓度控制为0.1%~10%,聚合物浓度过高会造 成溶液粘度过大,且会造成涂层厚度过大且不均匀。
作为优选技术方案,所述有机溶剂为乙酸乙酯、二氯甲烷、三氯甲烷、甲醇、乙醇、丙酮中的一种。
作为优选技术方案,步骤C中,所述涂覆采用浸涂法。
作为优选技术方案,步骤C中,所述真空干燥是在20℃~50℃真空干燥箱中干燥12h~48h。干燥温度不宜过高。
作为优选技术方案,所述紫外臭氧或氧气、空气等离子体预处理的时间为0.5min~60min。
作为优选技术方案,所述磷酸盐混合液为6~8重量份的磷酸盐与2~4重量份的无机碱的混合水溶液。
作为优选技术方案,所述磷酸盐为Ca3(PO4)2、CaHPO4或CaHPO4·2H2O、Ca(H2PO4)2或Ca(H2PO4)2·H2O中的一种或其组合。
作为优选技术方案,所述无机碱为NaOH、KOH、NH3·H2O中的一种。更优选无机碱为NaOH。
作为优选技术方案,所述磷酸盐混合液具体为任一配方:
a)Ca3(PO4)2∶NaOH∶H2O=8∶2∶90(wt.%);
b)CaHPO4∶NaOH∶H2O=6∶4∶90(wt.%);
c)Ca(H2PO4)2∶NaOH∶H2O=7∶3∶90(wt.%);
d)Ca(H2PO4)2·H2O∶NaOH∶H2O=8∶2∶90(wt.%)。
作为优选技术方案,所述生物活性钙-磷涂层与基底(生物可降解高分子载体/载药涂层)的结合力≥10MPa,生物相容性较好,成骨细胞毒性在0级。
与现有技术相比,本发明具有如下有益效果:
(1)本发明提出一种镁及镁合金表面具备载药特性及表面生物活性的涂层,该涂层由化学转化膜、生物可降解高分子药物涂层和生物活性钙-磷涂层组成。
(2)本发明解决了目前生物活性钙-磷涂层无法载药的问题,在生物活性钙-磷涂层与基体之间加入一层生物可降解高分子药物载体涂层,能够在满足外层生物活性钙-磷涂层提高植入物的生物相容性,促使植入体与骨组织间形成直接的化学键性结合,促进骨的生长,延缓基体在体液中的腐蚀和降解速率的情况下,又能在内层镁合金表面高分子药物载体涂层载入药物,治疗一系列骨病变疾病。
(3)本发明采用简便、快捷的紫外-臭氧或等离子体表面处理方法解决了大部分载 药可降解高分子层上难以复合钙-磷无机涂层的技术难题,并提高了界面结合力。
(4)本发明可以通过改变聚合物涂层厚度、载药量及生物活性钙-磷涂层厚度来调节药物释放速度。
(5)本发明工艺简单、易操作,成本低。
(6)本发明适用范围广,适用于目前所有的镁及镁合金。
附图说明
通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:
图1为可降解镁基骨内植物材料表面的可载药高分子、钙磷复合涂层的结构示意图;其中,1为生物活性钙-磷涂层,2为生物可降解高分子涂层,3为氟化膜,4为镁基底;
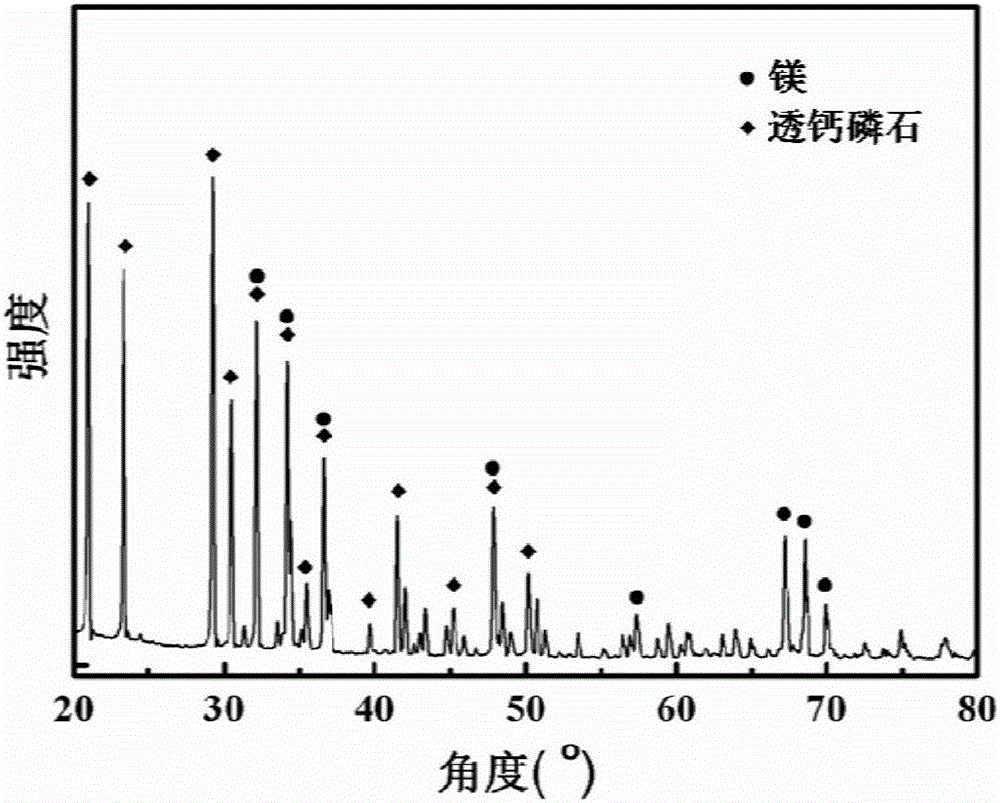
图2为纯镁表面制备的用于载药的高分子载体及生物活性钙-磷(CaHPO4·2H2O)复合涂层的XRD衍射图谱;
图3为优化工艺下得到的镁表面制备的用于载药的高分子载体及生物活性钙-磷复合涂层的表面SEM形貌图;
图4为优化工艺下得到的AZ31镁合金表面制备的用于载药的高分子载体及生物活性钙-磷复合涂层的截面SEM-EDX谱图;
图5为优化工艺下得到的ZK60镁合金表面制备的高分子载体及生物活性钙-磷复合涂层的成骨细胞MC3T3粘附实验的荧光显微镜照片,其中,(a)为阴性对照组样品(TCPS培养皿);(b)为未修饰的镁合金,(c)为表面修饰了高分子/钙磷复合涂层的镁合金样品;
图6为优化工艺下得到的AZ31镁合金表面制备的载2wt.%紫杉醇药物的聚乳酸高分子载体及生物活性钙-磷复合涂层的一周释药曲线。
具体实施方式
下面结合附图及具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以进行若干变形和改进,这些都属于本发明的保护范围。
实施例1
在纯Mg表面制备用于载药的可降解高分子载体及生物活性钙-磷复合涂层,最终形成的复合涂层,其结构示意图见附图1,包括镁基底4、氟化膜3、生物可降解高分 子涂层2和生物活性钙-磷涂层1。制备时,首先将纯镁制作成的试样,依次用320目、1200目和3000目的水砂纸打磨。用无水乙醇和丙酮分别超声清洗10min,吹干。将试样放在40%HF溶液中室温浸泡24h,先后用去离子水、无水乙醇清洗,吹干。取重均分子量为80000~100000的聚三亚甲基碳酸酯(PTMC),按8wt.%的比例溶于乙酸乙酯溶剂中,采用浸涂法把聚三亚甲基碳酸酯均匀涂覆在氟化处理纯镁表面,将涂覆有聚三亚甲基碳酸酯涂层的纯镁放入真空干燥箱35℃干燥48h,即得到以聚三亚甲基碳酸酯涂层为药物载体的样品。将该涂覆有生物可降解高分子涂层的样品放入紫外臭氧仪器紫外辐照0.5~60min,然后将试样放入CaHPO4∶NaOH=6∶4(wt.%)的溶液中水浴恒温(20℃)浸泡48h,取出后用超纯水清洗两次,吹干,即可得到用于载药的高分子载体及生物活性钙-磷复合涂层。扫描电镜观察到化学转化膜厚度为2μm,成分分析结果表面该化学转化膜为MgF2,观察到高分子涂层厚度为12μm,观察到Ca-P涂层厚度约为50μm,Ca/P原子比为1∶1,进一步XRD检测显示该钙磷涂层为透钙磷石Brushite(附图2)。扫描电镜检测可见高分子层上完备的覆盖了一层片状的钙磷晶体,晶体尺寸在100微米左右(附图3)。力学性能测试结果表明聚合物涂层与基体的结合力及生物活性钙磷涂层与聚合物涂层结合力均较强,超过12MPa。该复合涂层的细胞毒性0级,满足细胞相容性要求。
实施例2
在AZ31(Mg-Al系)合金表面制备用于载药的可降解高分子载体及生物活性钙-磷复合涂层。首先将AZ31镁合金制作成的试样,依次用320目、1200目和3000目的水砂纸打磨。用无水乙醇和丙酮分别超声清洗10min,吹干。将试样放在40%HF溶液中水浴恒温(20℃)浸泡14h,先后用去离子水、无水乙醇清洗,吹干。取重均分子量为100000~150000的外消旋聚乳酸(PDLLA),按6wt.%的比例溶于乙酸乙酯溶剂中,同时取紫杉醇按2wt.%的比例溶解,采用浸涂法把混有紫杉醇药物的聚乳酸溶液均匀涂覆在氟化处理镁合金表面,将涂覆有载紫杉醇的聚乳酸涂层的镁合金放入真空干燥箱35℃干燥48h,即得到以聚乳酸涂层为药物载体的镁合金样品。将涂覆有载药生物可降解高分子涂层(载紫杉醇药物的聚乳酸涂层)的样品放入氧气等离子体表面处理器预处理0.5~60min,然后将试样放入Ca(H2PO4)2·H2O:NaOH=8:2(wt.%)的溶液中在25℃浸泡10h,取出后用超纯水清洗两次,吹干,即可得到载药的高分子层及生物活性钙-磷复合涂层,其结构如图4所示。扫描电镜观察到化学转化膜厚度为1μm,成分分析结果表面该化学转化膜为MgF2,截面SEM-EDX检测(附图4)显示镁合金基体上一层厚度约为5μm的高分子层(距离表面8-13微米处C,O峰显著增高) 上继续复合了一层厚度约为8μm的钙磷涂层(距离0-8微米处Ca,P,O峰显著增高)。Ca/P原子比为1.2:1。测试结果表明聚合物涂层与基体的结合力及生物活性钙磷涂层与聚合物涂层结合力强,超过10MPa。该复合涂层的成骨细胞毒性在0-1级间,满足细胞相容性要求。涂层载紫杉醇药物量约80μg,一周内累计释放药物量约23%,并且没有出现明显的药物突释现象(附图6)。
实施例3
在Mg-Nd-Zn-Zr合金表面制备用于载药的可降解高分子载体及生物活性钙-磷复合涂层。首先将Mg-Nd-Zn-Zr镁合金制作成的试样,依次用320目、1200目和3000目的水砂纸打磨。用无水乙醇和丙酮分别超声清洗10min,吹干。将试样放在20%HF溶液中水浴恒温(20℃)浸泡8h,先后用去离子水、无水乙醇清洗,吹干。取重均分子量为80000~100000的聚乳酸-羟基乙酸共聚物(PLGA),按8wt.%的比例溶于乙酸乙酯溶剂中,同时取紫杉醇按2wt.%的比例溶解,采用浸涂法把混有紫杉醇药物的PLGA溶液匀涂覆在氟化处理镁合金表面,将涂覆有PLGA涂层的镁合金放入真空干燥箱35℃干燥48h,即得到以PLGA涂层为药物载体的镁合金。将涂覆有载药生物可降解高分子涂层的样品放入紫外臭氧仪器紫外辐照0.5~60min,然后将试样放入Ca3(PO4)2∶NaOH=8∶2(wt.%)的溶液中在4℃浸泡6h,取出后用超纯水清洗两次,吹干,即可得到用于载药的高分子载体及生物活性钙-磷复合涂层。扫描电镜观察到化学转化膜厚度为800nm,成分分析结果表面该化学转化膜为MgF2。观察到高分子涂层厚度约为10μm,观察到Ca-P涂层厚度约为6μm,Ca/P原子比为1.1∶1。测试结果表明聚合物涂层与基体的结合力及生物活性钙磷涂层与聚合物涂层结合力强,超过10MPa。该复合涂层的成骨细胞毒性在0-1级间,满足细胞相容性要求。涂层载紫杉醇药物量约150μg,一周内累计释放药物量约39%,并且没有出现明显的药物突释现象。
实施例4
在ZK60(Mg-Zn系)合金表面制备用于载药的可降解高分子载体及生物活性钙-磷复合涂层。首先将ZK60镁合金制作成的试样,依次用320目、1200目和3000目的水砂纸打磨。用无水乙醇和丙酮分别超声清洗10min,吹干。将试样放在20%HF溶液中水浴恒温(20℃)浸泡24h,先后用去离子水、无水乙醇清洗,吹干。取重均分子量为80000~100000的聚乳酸-三亚甲基碳酸酯共聚物(P(LA-TMC)),按10wt.%的比例溶于乙酸乙酯溶剂中,同时取雷帕霉素按10wt.%的比例溶解,采用浸涂法将混 有雷帕霉素药物的聚乳酸-三亚甲基碳酸酯共聚物均匀涂覆在氟化处理镁合金表面,将涂覆有P(LA-TMC)涂层的镁合金放入真空干燥箱35℃干燥48h,即得到以P(LA-TMC)涂层为药物载体的镁合金。将涂覆有生物可降解高分子涂层的样品放入紫外臭氧仪器紫外辐照15min,然后将试样放入Ca(H2PO4)2∶NaOH=7∶3(wt.%)的溶液中水浴恒温(20℃)浸泡24h,取出后用超纯水清洗两次,吹干,即可得到用于载药的高分子载体及生物活性钙-磷涂层。扫描电镜观察到化学转化膜厚度为1.5μm,成分分析结果表面该化学转化膜为MgF2,观察到高分子涂层厚度为15μm,观察到Ca-P涂层厚度为40μm,Ca/P原子比为1∶1。成骨细胞粘附实验显示修饰复合涂层的样品(附图5c)比阴性对照组(TCPS培养皿,附图5a)及未修饰的ZK60镁合金(附图5b)具有更高的粘附细胞密度,说明制得的Ca-P表面涂层具有更优异的生物相容性。测试结果表明聚合物涂层与基体的结合力及生物活性钙磷涂层与聚合物涂层结合力均较强,超过11MPa。该复合涂层的细胞毒性在0-1级间,满足细胞相容性要求。涂层载雷帕霉素药物量约450μg,一周内累计释放药物量约28%,并且没有出现明显的药物突释现象。
以上对本发明的具体实施例进行了描述。需要理解的是,本发明并不局限于上述特定实施方式,本领域技术人员可以在权利要求的范围内做出各种变形或修改,这并不影响本发明的实质内容。
- 还没有人留言评论。精彩留言会获得点赞!