用于癌症疫苗的包被的溶瘤腺病毒的制作方法
发明领域
本发明涉及腺病毒载体及其用途,其中病毒衣壳已用多肽包被,所述多肽能够在个体中刺激肽特异性免疫应答。此外,本发明涉及通过腺病毒载体治疗疾病如癌症的方法,所述腺病毒载体已被能引起肽特异性免疫应答的多肽包被。本发明还涉及通过特异性肽包被腺病毒载体的方法以及鉴定适合于包被腺病毒载体衣壳的那些肽的方法。
发明背景
癌症是需要更有效治疗的致命疾病。溶瘤病毒是值得关注的,因为它们拥有比任何其它标准疗法更安全且更有效的潜能。然而,在癌症患者中,总的治疗效果是较小的。有很多关于修饰腺病毒载体以便找到最佳的治疗工具的研究。调节腺病毒功能的一个方面是修饰该病毒的表面。腺病毒表面的遗传修饰和非遗传修饰都是公知的。
例如,stevensonmetal.(cancergenetherapy(2007)14,335–345)致力于增强腺病毒载体向靶位点的递送。stevensonetal.描述了一项研究,其中腺病毒载体经由转移性肿瘤细胞上选择性表达的整联蛋白而靶向感染细胞。为了该目的,层粘连蛋白来源的肽(-sikvav-)被并入到聚合物包被的病毒表面上。
wo2013/116778描述了用于癌症的免疫增强的腺病毒。通过将肿瘤抗原转基因以以下方式插入腺病毒的基因组来修饰腺病毒:所述肿瘤抗原在病毒复制周期中表达并直接呈递至mhc-i。对于个性化疗法,该方法非常缓慢、很费力,并且昂贵,因为对于每一种不同的肿瘤抗原都需要新病毒的生成(例如,对于想要被表达的每种肽都必须克隆一种新的病毒)。
实际上,存在对用于治疗学,尤其是个性化疗法的简单且改进的腺病毒工具以及方法的需求。本发明提供了用于在个体中指导免疫应答,同时利用腺病毒作为肽的递送系统但不涉及对该病毒的遗传操作的腺病毒应用。
本发明涉及溶瘤腺病毒作为平台以递送患者特异性的和疾病特异性的肽,并因此将抗衣壳免疫力转化为肽特异性免疫应答(例如,抗肿瘤免疫力)的用途。
发明概述
本发明提供了新的、有效的可定制化免疫病毒疗法(例如癌症免疫病毒疗法)平台。一个目的是提供具有修饰的病毒表面的腺病毒载体,其用途以及治疗疾病的方法,所述方法通过刺激肽特异性(即,抗肽)免疫应答以解决例如低效、缓慢、昂贵且费力的腺病毒疗法以及腺病毒疗法不适合个性化医疗等问题。本发明的目的通过独立权利要求所陈述的内容来表征的安排和方法来实现。本发明的优选实施方案在从属权利要求中公开。
通过本发明,现有技术的问题,例如溶瘤腺病毒缺乏特异性和免疫优势,能够得到解决。
腺病毒感染所生成的免疫应答主要靶向病毒而非肿瘤。此外,大多数病毒免疫力指向衣壳蛋白。本发明将克服这些问题。实际上,本发明基于这样的理念:包被有源自肿瘤蛋白的肽的病毒衣壳将病毒免疫力转移至肿瘤(图3)。嵌到溶瘤腺病毒衣壳上的主要组织相容性复合体i(mhc-i)限制性肽将衣壳免疫力转移至抗肿瘤免疫力。
简单而言,当肽和病毒作为单一物理连接的实体而施用时,危险信号(病毒)和肿瘤抗原(肽)二者都将进入同一抗原呈递细胞以最大化抗肿瘤效应。临床经验已表明,单独的肽疫苗接种仅导致不能控制肿瘤生长的暂时的、次优的免疫应答1。相应地,尽管溶瘤病毒显示出作为单一疗法的潜力,但是它们所引发的免疫应答主要靶向病毒而非肿瘤。即便肽和病毒被注射入同一解剖学位置,由于它们没有被连接在单一的治疗实体中,它们不能进入同一细胞——对于实现适合的且最大的免疫激活至关重要的方面2。肽和腺病毒类病毒物理连接在单一的治疗实体中相对于现有的病毒和肽类癌症疫苗技术有明显改善。与现有技术的经工程化以表达一种肿瘤相关的抗原或肽的重组病毒相比,本发明使得相比之前以更快且更划算的方式实现个性化医疗成为可能。实际上,根据本发明,连接到病毒衣壳上的肽不是由腺病毒载体编码。
本发明的一个方面是这样的技术:其允许恒定地、快速地监测肿瘤抗原呈递为小肽(mhc-i限制性)。本发明利用疾病(例如肿瘤)特异性的和患者特异性的肽,其被同时呈递到腺病毒疗法之前和之后的肿瘤细胞上(即,其在疗法后未被掩饰或编辑)以及腺病毒疗法之后的树突细胞(dc)上。在鉴定出这些特异性肽之后,它们能被合成并嵌到溶瘤腺病毒衣壳上以实现高的抗肿瘤免疫力。通过这种方式可能确保,肿瘤被病毒疗法之后的细胞毒性t-细胞(ctl)有效靶向,使得免疫逃逸由于免疫系统靶向病毒而变得不可能。相反地,通过比较存在或不存在肿瘤情况下的呈现在病毒疗法之后的dc上的肽,可能消除“仅仅病毒”的肽,并找到源自肿瘤细胞的诱导ctl应答的那些肽。
个性化包被的腺病毒可以在距活检少至两周内获得,这成为可能是因为来自mhc的肽的分离和测序以及自动化合成是快速过程,并且病毒(例如,对于所有的肽均为相同的骨架病毒)能够被大量积累以等待包被。包被本身在一个小时内完成,之后,包被的腺病毒已准备好注射。这是我们的系统的非常独特的特征,因为其绕开了对病毒的任何遗传操作,所述遗传操作减缓了过程,使得“个性化疫苗方法”成为不可能的事。
本发明还使得发现新颖的免疫原性肿瘤特异性肽成为可能。
除了癌症疗法,本发明的包被的腺病毒可用于治疗需要更高的和肽特异性免疫应答情况下的任何其它疾病。
本发明涉及在有需要的个体中刺激肽特异性免疫应答的方法,其中所述方法包括向所述个体施用包含附着至病毒衣壳上的多肽的腺病毒载体。本发明还涉及在有需要的个体中刺激肽特异性免疫应答的方法,其中所述方法包括向所述个体施用包含附着至病毒衣壳上的多肽的腺病毒载体,其中所述多肽并非由所述腺病毒载体遗传编码。
本发明还涉及用于在个体中刺激肽特异性免疫应答用途的包含附着至病毒衣壳上的多肽的腺病毒载体。本发明还涉及用于在个体中刺激肽特异性免疫应答用途的包含附着至病毒衣壳上的多肽的腺病毒载体,其中所述多肽并非由所述腺病毒载体遗传编码。
本发明还涉及治疗有需要的个体中的癌症的方法,其中所述方法包括向所述个体施用包含多肽的腺病毒载体,所述多肽能够在所述个体中刺激肽特异性免疫应答并且已被附着至病毒衣壳上。本发明还涉及治疗有需要的个体中的癌症的方法,其中所述方法包括向所述个体施用包含多肽的腺病毒载体,所述多肽能够在所述个体中刺激肽特异性免疫应答并且已被附着至病毒衣壳上,其中所述多肽并非由所述腺病毒载体遗传编码。
此外,本发明涉及用于治疗个体中的癌症用途的包含多肽的腺病毒载体,所述多肽能够在个体中刺激肽特异性免疫应答并且已被附着至病毒衣壳上。本发明还涉及用于治疗个体中的癌症用途的包含多肽的腺病毒载体,所述多肽能够在个体中刺激肽特异性免疫应答并且已被附着至病毒衣壳上,其中所述多肽并非由所述腺病毒载体遗传编码。
此外,本发明涉及腺病毒载体,其中病毒衣壳已用多肽附着,并且其中用多肽附着的腺病毒载体能够在个体中刺激肽特异性免疫应答。
此外,本发明涉及包被腺病毒衣壳的方法,其中所述方法包括将能够在个体中刺激肽特异性免疫应答的多肽与腺病毒衣壳共价或非共价连接。本发明还涉及修饰腺病毒衣壳的方法,其中所述方法包括将聚赖氨酸修饰的多肽与腺病毒衣壳共价或非共价连接,其中经修饰的腺病毒载体能够在个体中刺激肽特异性免疫应答。
本发明还涉及多肽(例如聚赖氨酸修饰的多肽)用于包被腺病毒衣壳的用途,其通过将所述多肽共价或非共价附着或连接至所述衣壳,所述多肽能够在个体中刺激肽特异性免疫应答。
本发明的腺病毒载体和方法用于将抗病毒免疫力转化为抗肽免疫力。本发明的修饰的病毒载体在个体中产生抗肽应答。
本发明还涉及包含本发明的腺病毒载体的药物组合物。
与此同时,本发明涉及从个体鉴定肿瘤特异性的和mhc-i特异性的多肽的方法,所述方法包括
i)用腺病毒载体感染所述个体的肿瘤细胞;
ii)用腺病毒载体感染所述个体的树突细胞;
iii)从步骤i)的肿瘤细胞和步骤ii)的树突细胞分离mhc-i分子,并鉴定来自两个组的mhc-i相关的多肽;
iv)从未感染的肿瘤细胞分离mhc-i分子,并鉴定mhc-i相关的多肽;
v)鉴定被步骤iii)和iv)的感染的肿瘤和未感染的肿瘤以及步骤iii)的树突细胞呈递的那些多肽。
附图说明
在下文,参照附图通过优选实施方案来更加详细地描述本发明,其中
图1显示了本发明的示意图,其中修饰的腺病毒能够复制并杀伤癌细胞,同时将抗-病毒免疫应答向肿瘤转移。
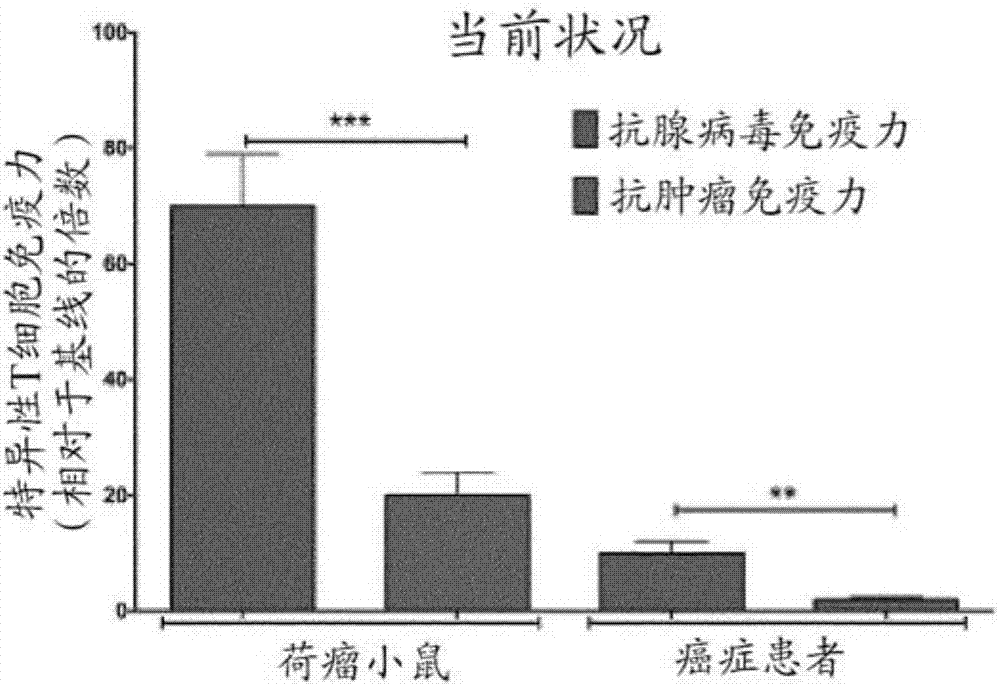
图2显示了抗-腺病毒应答(左边的柱)对比肿瘤应答(右边的柱)的免疫优势。小鼠)荷b16-ova肿瘤的c57bl/6小鼠用pbs(模拟组),ad5d24(未修饰的溶瘤病毒)和(ad5d24-cpg,免疫原性更强的溶瘤病毒)处理。收获来自肿瘤的t细胞,并进行ifnγelispot以评估抗肿瘤应答和抗-腺病毒应答。癌症患者)在来自用gmcsf-装备的溶瘤腺病毒(ad5d24-gmcsf)处理的患者的pbmc上进行ifnγelispot15。ad5-来源的肽(抗-病毒的)和生存素-来源的肽(抗-肿瘤)用于在elispot之前刺激pbmc。
图3揭示了本发明的包被的腺病毒代表了对比现有技术的优势。a)溶瘤腺病毒有能力触发apc,从而不仅能呈递病毒抗原(导致抗病毒应答)(图a的细胞上呈递的另一种抗原),作为副作用还能呈递肿瘤抗原(图a的细胞上呈递的另一种抗原),导致抗肿瘤免疫力。抗肿瘤t细胞被标示为t细胞组最下面的两个细胞。b)本发明的包被的腺病毒将促成肿瘤抗原呈递(标示为图b的细胞上呈递的两种抗原),因为其衣壳被mhc-i即用型肿瘤特异性抗原(肽)覆盖。以这种方式,抗-衣壳免疫力能够被回转成抗肿瘤免疫力。抗肿瘤t细胞被标示为t细胞组最下面的四个细胞。本文所用的apc指抗原呈递细胞,taa指与抗原相关的肿瘤,“prr激活”指模式识别受体激活。prr是由先天免疫系统的细胞所表达的能识别病原体相关分子模式的蛋白,所述病原体相关分子模式例如与微生物病原体相关。
图4显示了暴露于溶瘤腺病毒的树突细胞的顶端上调生物功能网络。收获人原代树突细胞,并与il4和gmcsf一起培养两周。将细胞用溶瘤腺病毒(ad5d24)以10vp/细胞脉冲。72h以后,收集总的rna,并在agilentsureprintg3人8x60k(mrna)上进行分析。然后用ingenuitypathway软件分析数据。
图5显示了表示发现新颖的免疫原性肿瘤相关mhci限制性肽的示意图。不同的条件允许我们将肿瘤表达的肽与树突细胞呈递的相同肿瘤的肽匹配。这在系统中促进免疫原性肽的鉴定起关键作用。a)用肿瘤溶解剂脉冲的树突细胞以允许肿瘤抗原呈递。b)未脉冲的树突细胞成熟并被分析。这充当随后消除dc呈递的自身肽的对照。c)未感染的肿瘤细胞系(与条件a相同)用溶瘤腺病毒感染,并在完全裂解(小于48h)之前分析。该条件帮助我们区别腺病毒是否对所呈递的肿瘤抗原的质量产生显著影响。d)这是在mhci上呈递肿瘤抗原和自身肽(当然这两种可以相同)的未感染肿瘤。
图6显示了ova-特异性包被的病毒的示意图。a)在这种情况下,由于我们了解鸡卵清蛋白(ova)的所有经处理的肽,我们用ova特异性的免疫原性肽(siinfekl)(seqidno:1)包被病毒。然后我们生成了用作对照的其它包被的病毒如siinfdl(seqidno:2)(拮抗剂)和filksine(seqidno:3)(乱序)以及包被的病毒。b)一旦概念验证得到证明,我们开始用不同的肽包被的第ii代腺病毒的研究。(pepticrad指用肽包被的溶瘤腺病毒)。
图7显示了表示生成肽包被的溶瘤腺病毒的三个不同策略的示意图。
图8显示了溶瘤腺病毒和肿瘤特异性肽之间的复合形成以及修饰的表位和溶瘤腺病毒之间的相互作用。图8a显示了ad5d24溶瘤腺病毒和肿瘤特异性肽之间的复合形成。“z-电势”线)1×1010个病毒颗粒与不同浓度的带正电荷的肿瘤特异性肽缀合。反应之后,测量单个颗粒的z-电势。“尺寸”线)1×1010个病毒颗粒与不同浓度的带正电荷的肿瘤特异性肽缀合。之后,测量单个颗粒的尺寸并报道为肽浓度的函数。当z-电势处于-20mv至+20mv时,复合物的尺寸存在剧烈变化,这表明高度的多分散性(很可能是病毒聚集),但是该状态在较高的肽浓度时恢复正常,这提示该复合物(pepticrad)完成包被,不可能形成促进聚集物(高多分散性)形成的偶极子。图8b揭示了修饰的mhc-i表位siinfekl和溶瘤腺病毒之间的相互作用。病毒/肽相互作用通过spr测量。aptes硅石sio2传感器用ad5d24包被,并向流动系统中注射递增浓度(0.15,0.3,0.6,1.2,2.4和7.2μm)的siinfekl(虚线)或聚k-siinfekl(实线)。spr信号反应显示与实验的持续时间相关。
图9显示了本发明的包被的腺病毒ad5d24(pepticrad)与未包被的溶瘤病毒相比展现出增强的细胞杀伤活性。在肺癌腺癌细胞系(a549)上进行代表性的细胞活力分析(mts分析)。在第0天接种细胞,在第1天以指定的感染复数感染,在第3天停止测试并进行分析。
图10显示了ova-特异性腺病毒增强了ova-特异性免疫力。荷皮下b16-ova肿瘤的小鼠经瘤内注射:pbs、溶瘤病毒(ad5d24)、溶瘤病毒+siinfekl肽(未复合的)、溶瘤病毒+siinfekl(复合为单一实体,pepticrad)。a)测量肿瘤生长并在显示的时间点报告。b)siinfekl特异性免疫力通过流式细胞术(五聚物分析)评估。
图11显示了肽包被技术的一致性。该图显示了用修饰的肽(6k-siinfekl)包被的两种不同的溶瘤腺病毒的净电荷。在该实例中使用的两种病毒为ad5d24-cpg(经遗传修饰在其基因组中富含cpg岛的溶瘤腺病毒)和ad5d24-rfp,其是编码用于促进体外和体内成像的红色荧光蛋白的溶瘤腺病毒;(rfp指红色荧光蛋白)。
图12显示了pepticrad的净电荷与其尺寸之间的相关性。在该实例中,我们用裸露的病毒(净电荷约-25至-30mv)开始,然后添加递增浓度的肽以形成我们称为pepticrad的复合物。其显示了我们添加的肽越多,病毒的净电荷从负值转变成正值越多,在结束时,当复合物pepticrad形成时,用肽包被的病毒的净电荷为约+30至+35mv。
图13显示了吸附至或未吸附至病毒衣壳的mhc-i上的修饰的siinfekl类似物的交叉呈递。脾从c57bl/6小鼠(h-2kb)收集,并在含有10%fbs的rpmi-1640生长培养基中制备单细胞悬液。(a)共计2×106个脾细胞与含有以下的200μl培养基一起孵育:未修饰的siinfekl(阳性对照)、含有氨基己酸的siinfekl-ahx-聚k(阴性对照)、c-末端衍生的siinfekl-聚k或n-末端延伸的聚k-siinfekl(0.19μg/μl)。在37℃下孵育2h之后,洗涤细胞并用与siinfekl结合的apc抗-h-2kb或同种型对照染色。(b)与(a)类似,新鲜的鼠脾细胞用ova-pepticrad(100vp/细胞+37.5μg肽)和37.5μgsiinfekl(阳性对照)或聚k-siinfekl感染。孵育2h之后,洗涤样品并通过流式细胞术分析。数据显示为平均数±sem(n=2)。利用单向anova与邦弗朗尼多重比较检验评估显著性;*p<0.05,**p<0.01,***p<0.001。
图14显示了pepticrad保留了完整的溶瘤活性,并在具有低car表达的细胞系中展现出增加的感染性。(a)以1×104个细胞/孔的密度接种细胞,并用ova-pepticrad或裸露的ad5d24,利用不同的vp/细胞比值(0.1、1、10和100)感染。包括肽聚k-siinfekl(虚线,圆圈)作为对照。然后通过mts分析测定细胞活力。数据显示为平均数±sem(n=3)。(b)通过icc对病毒感染性的研究。将共计2×105个细胞/孔接种到24-孔板中,并在第二天用含有ova-pepticrad或ad5d24(对照)的100μl病毒稀释物(10vp/细胞)感染。孵育两天之后,进行抗-六邻体icc,并利用数字显微镜获取5个非重叠的图像。呈现了每个视野中斑点的平均数。来自代表性实验的数据显示为平均数±sem(n=2-3)。利用未配对t检验与韦尔奇氏校正评估显著性;*p<0.05,**p<0.01,***p<0.001。
图15显示了pepticrad的抗肿瘤功效以及抗原特异性cd8+t细胞和dc的免疫分析。(a)c57bl/6小鼠(n=6)在两胁接受了3×105个b16-ova细胞。处理在9天之后开始,并包括盐溶液(模拟组)、单独的肽(siinfekl)、单独的病毒(ad5d24-cpg)、病毒和肽的混合物(ad5d24-cpg+siinfekl)以及病毒-肽复合物(ova-pepticrad)。小鼠被处理三次(在第0天、第2天和第7天)。然后测量肿瘤尺寸并呈现为作为时间函数的平均数±sem。利用双向anova与邦弗朗尼多重比较检验评估进行统计分析;*p<0.05,**p<0.01,***p<0.001。在两个时间点:第7天(早期)(b)和第16天(晚期)(c)从小鼠(n=3-4)收集肿瘤、脾和腹股沟淋巴结。然后通过门控筛出cd19+细胞来确性siinfekl-特异性cd8+t细胞的比例。cd8+ova+t细胞的百分比呈现为平均数±sem。(d)将实验结束时的平均肿瘤尺寸(线性y轴)相对双阳性cd8+ova+t细胞的平均百分比(log10x轴)作图。还计算皮尔森r值和r2值,并针对每组样品作图。(e)确定显示成熟谱和在其mhc-i分子上交叉呈递siinfekl的dc的倍数变化。成熟dc定义为cd19-cd3-cd11c+cd86高细胞。与siinfekl结合的apc抗-小鼠h-2kb用于追踪在所选择的dc库中mhc-i上的siinfekl的交叉呈递。
图16显示了用pepticrad靶向两种肿瘤抗原降低了处理的肿瘤和远端的、未处理的肿瘤的生长。利用1×105个b16-f10黑素瘤细胞将一个原发瘤移入c57bl/6小鼠的右胁。在第10天开始处理。在第16天时,小鼠在其左胁接受了3×105个b16-f10细胞。(a)报道了原发瘤(右)的生长,数据呈现为平均数±sem(n=5)。利用双向anova与邦弗朗尼多重比较检验确定显著性;*p<0.05,**p<0.01,***p<0.001。(b)实验结束时的继发瘤(左)的尺寸报道为log2比例。利用曼-惠特尼u检验评估显著性;*p<0.05,**p<0.01,***p<0.001。(c)收获脾和腹股沟淋巴结,通过mhc-i五聚物染色确性每个器官中trp-2-特异性cd8+t细胞和hgp100-特异性cd8+t细胞的水平。每个器官中存在的表位-特异性cd8+t细胞的百分比针对模拟组标准化,并呈现为每个实验组的累积相对应答。
图17显示了pepticrad在荷人黑素瘤的人源化小鼠中的功效。三联基因敲除ngs小鼠在每胁接受了2×106个人黑素瘤细胞(sk-mel-2)。当肿瘤达到4-5mm的平均直径时,一组小鼠(n=3)接受了来自hla-a-匹配的健康供体的人pbmc,而另一组小鼠(n=2)没有接受pbmc。然后,用以下之一处理小鼠(在第0天、第2天和第4天):i)盐溶液(模拟组),ii)ad5d24-gm-csf,和iii)mage-a1pepticrad。人源化小鼠的肿瘤体积(a)呈现为平均数±sem。利用双向anova与邦弗朗尼多重比较检验评估显著性;****p<0.0001。(b)对于每组人源化小鼠,呈现为相对于肿瘤尺寸的曲线下面积(auc)。(c)非人源化小鼠的肿瘤体积报道为平均数±sem(****p<0.0001)。
发明的详细描述
肿瘤免疫学和免疫肽组
树突细胞(dc)是骨髓来源的专职抗原呈递细胞。dc是用于将肿瘤抗原表位呈递至cd8+和cd4+t细胞的最佳的抗原呈递细胞3。外源抗原可以被加载到mhci类之上用于“交叉呈递”至cd8+t细胞4。交叉呈递是一种其结果由dc的激活状态决定的现象5。在癌细胞中,导致肿瘤抗原交叉呈递的dc成熟的程度通常非常低,这是由于不利的肿瘤微环境和也位于局部淋巴结的肿瘤来源的免疫抑制。这些障碍可以被溶瘤病毒疗法克服,因为肿瘤破坏病毒既提供必要的“危险信号”以驱动dc成熟,又干扰肿瘤抑制以暴露隐藏的免疫原性抗原6-8。
溶瘤腺病毒,也称为条件复制型腺病毒(crad),经遗传修饰能复制并只杀死癌细胞9,10。已知病毒诱导的肿瘤凋亡和/或坏死导致抗原呈递细胞通常不易靠近的大量肿瘤相关蛋白的释放,这驱动肿瘤引流淋巴结中肿瘤相关dc的有效交叉呈递11-13。
已发现癌症的病毒疗法通常被良好耐受,然而,总的治疗功效仍然较小,在监视病毒疗法的免疫效果时,在小鼠和人中均观察到病毒相对于肿瘤的明显的优势(图2)。用合成的mhc-i限制性肿瘤特异性肽包被腺病毒衣壳将“欺骗”抗原呈递细胞(apc),以将这些肿瘤抗原呈递为病毒的一分部。换句话说,本发明利用腺病毒衣壳作为递送mhc-i限制性肽的支架,将转移免疫应答远离病毒,反而转向肿瘤。
本文所用的“i类主要组织相容性复合体”分子指两类主要的主要组织相容性复合体(mhc)分子之一(另一类是ii类mhc),并且被发现于身体几乎每一种有核细胞上。它们的功能是将来自细胞内的蛋白的片段展示给t细胞,健康的细胞将被忽略,而含有外源蛋白的细胞将被免疫系统攻击。i类mhc分子结合主要由蛋白酶体降解胞质蛋白所生成的肽。mhci:肽复合体然后被插入细胞质膜。肽结合至i类mhc分子的细胞外部分。因此,i类mhc的功能是将细胞内蛋白展示给细胞毒性t细胞(ctl)。然而,i类mhc也能够在称为交叉呈递的过程中呈递由外源蛋白生成的肽。本文所用的“mhc-i-特异性多肽”指结合至mhc-i,即i类mhc分子的细胞外部分,并被展示给ctl的那些肽。
所有的mhc-i肽(mip)统称为免疫肽组14。只在最近,借助于先进技术,才有可能开始研究mhc-i免疫肽组。与其它试图广泛地筛查整个免疫肽组的策略相比,本发明中的重要不同在于,本发明致力于同时呈递到疗法之前和之后的肿瘤细胞上(即,其在疗法后未被掩饰或编辑)以及疗法之后的dc上的特异性肽(图3)。
本发明与传统的基于肽的免疫疗法之间的显著区别在于本发明充分利用这样的事实:病毒,尤其是腺病毒,具有特殊的与dc相互作用的手段(因此,无需必须靶向dc)。腺病毒刺激几种模式识别受体(prr)、toll样受体16,17、nod样受体家族18和炎性体19,使dc倾向于强烈的抗原呈递和ctl激活20。为此目的,我们证实,用溶瘤腺病毒脉冲的人原代dc激活参与细胞粘附、细胞-细胞相互作用和信号转导、成熟和抗原呈递的通路,这提示腺病毒能够促进未成熟原代树突细胞的成熟和迁移(图4)。
本文所用的“刺激肽特异性免疫应答”指引起免疫应答,其中呈递特异性肽的细胞将被攻击和破坏。“免疫应答”指涉及淋巴细胞(即白细胞),即t淋巴细胞或b淋巴细胞任意一种或两种的系统。t淋巴细胞直接攻击抗原并帮助控制免疫应答。它们还释放称为细胞因子的化学物质,其控制整个免疫应答。b淋巴细胞成为产生抗体的细胞。抗体附着至特异性抗原并使得免疫细胞更容易破坏抗原。
在本发明的一实施方案中,附着至病毒衣壳上的一种或多种多肽选自:酪氨酸酶相关蛋白2(trp-2)的片段、人黑素瘤抗原gp100(hgp100)的片段、黑素瘤相关抗原a1(mage-a1)的片段、siinfekl、聚k-siinfekl、siinfekl-聚k、slfravitk(seqidno:4)、聚k-slfravitk、slfravitk-聚k、svydffvwl(seqidno:5)、聚k-svydffvwl、svydffvwl-聚k、kvprnqdwl(seqidno:6)、聚k-kvprnqdwl和kvprnqdwl-聚k。在本发明的一实施方案中,附着至病毒衣壳上的一类或多类多肽包括siinfekl、slfravitk、svydffvwl或kvprnqdwl。在另一实施方案中,将trp-2和hgp100的多肽片段(例如svydffvwl或kvprnqdwl)附着至腺病毒衣壳上。在本发明的一实施方案中,用于本发明中的多肽是聚赖氨酸(聚k)修饰的。如本文所用,聚k可以选自3k-15k、3k-10k、3k-8k、5k-8k、5k-7k和6k。本文所用的“聚赖氨酸修饰的多肽”指多肽,其中已插入聚赖氨酸序列。将聚赖氨酸序列添加到多肽导致肽电荷的改变以及随之发生的吸附到病毒表面上。
腺病毒载体
用肽包被的腺病毒可以是腺病毒科的任何类型和种类(例如,不限于人腺病毒)。在本发明的一实施方案中,腺病毒能够复制并杀死癌细胞,同时将抗病毒免疫应答转向肿瘤(图1)。本发明的包被有患者来源的肿瘤特异性免疫激活肽的癌症破坏病毒增强并将抗病毒免疫力转移至抗肿瘤免疫力。
用于本发明中的腺病毒载体可以是适合治疗人或动物的任何腺病毒载体。可选地,根据本发明,可以使用多种类型的腺病毒载体。而且,载体可以以本领域内已知的任何方式进行修饰,例如,通过缺失、插入、突变或修饰任何病毒区域。在复制方面,载体可以被制成肿瘤特异性的。例如,腺病毒载体可以包含位于e1、e3和/或e4中的修饰,例如肿瘤特异性启动子的插入、区域的缺失和转基因的插入。
在本发明的一实施方案中,腺病毒载体是溶瘤腺病毒载体。本文所用的“溶瘤腺病毒载体”指通过在肿瘤(相比正常细胞)中选择性复制而能够感染并杀死癌细胞的腺病毒载体。在本发明的一实施方案中,载体仅能在rb-通路,尤其是rb-p16通路有缺陷的细胞中复制。这些缺陷型细胞包括动物和人中的所有肿瘤细胞。本文所用的“rb-通路有缺陷”指在该通路的任何基因或蛋白中的突变和/或表观遗传变化。肿瘤特异性溶瘤腺病毒可以通过例如缺失e1恒定区2(cr2)的24个碱基对(d24)而工程化。本文所用的“d24”或“24bp缺失”指根据heisec.etal.(2000,naturemed6,1134-1139),对应于载体的氨基酸122-129的核苷酸的缺失。在本发明的一实施方案中,腺病毒载体包含24bp缺失(溶瘤病毒)或e1基因缺失(第二代病毒),或者病毒是辅助病毒依赖型载体。e1基因缺失可以是e1区的部分缺失或完全缺失。本文所用的“辅助病毒依赖型载体”指这样的载体:其不包含编码复制所需的酶和/或结构蛋白的基因,因此为了复制而依赖于辅助病毒的协助。
腺病毒载体的骨架可以为任何血清型。在本发明的一实施方案中,腺病毒载体骨架的血清型选自血清型3或5。如本文所用的,“腺病毒血清型5(ad5)核酸骨架”指ad5的基因组,且“腺病毒血清型3(ad3)核酸骨架”指ad3的基因组。
此外,载体可以是嵌合载体,例如ad5/3、ad3/5或ad5/35载体。举例来说,“ad5/3载体”指具有ad5和ad3载体的一部分的嵌合载体。
在本发明的一实施方案中,腺病毒载体包含衣壳修饰(即编码形成病毒衣壳的蛋白的核苷酸序列中的修饰)。腺病毒的“衣壳”指病毒的蛋白外壳。衣壳由称为原聚体的蛋白构成的几个寡聚结构亚基组成。
此外,可以修饰载体的纤突结(fiberknob)区。在本发明的一实施方案中,腺病毒载体是包含ad5核酸骨架和纤突结的ad5/3或ad5/35,所述纤突结选自ad3纤突结、ad35纤突结、ad5/3嵌合纤突结和ad5/35嵌合纤突结。
在本发明的具体实施方案中,溶瘤腺病毒载体基于腺病毒血清5(ad5)核酸骨架并且包含d24缺失、任选地转基因和任选地cpg位点。在另一实施方案中,溶瘤腺病毒载体基于腺病毒血清型5(ad5)核酸骨架并且包含衣壳的修饰(例如ad3纤突结)、任选地d24缺失和任选地转基因。
外源元件的插入可以增强载体在靶细胞中的效应。外源组织或肿瘤特异性启动子的使用在重组病毒中是常见的,并且它们也可以在本发明中利用。合适的启动子是本领域技术人员公知的,它们包括但不限于htert、cmv、e2f。
腺病毒载体还可以引起任何转基因(例如粒细胞巨噬细胞集落刺激因子(gm-csf))的表达。在本发明的一实施方案中,腺病毒载体包含一个或多个转基因。合适的转基因的一个实例是细胞因子,其操纵免疫细胞在受疾病影响的部位,例如肿瘤部位增加的输送。用于本发明中的细胞因子可以选自本领域内任何已知的细胞因子。在本发明的一实施方案中,转基因选自趋化因子和细胞因子以及在肿瘤位置,尤其是涉及t细胞、树突细胞、巨噬细胞、天然杀伤细胞的地方招募或操纵免疫基质的信号肽。本发明的病毒载体可以编码一个或数个转基因,例如细胞因子(例如,两种、三种、四种、五种或更多种)。腺病毒载体可以例如表达特异性阻止免疫检验点(例如ctla4、pd1、pdl1)的单克隆抗体。
转基因可以位于腺病毒载体的不同位置。转基因可以位于例如e3启动子或外源启动子下的部分或完全缺失的e3区,或者e1启动子或外源启动子下的部分或完全缺失的e1区。
在本发明的一实施方案中,用于包被的腺病毒载体是ad5d24、ad5d24cpg或ad5d24-gmcsf。在ad5d24-gmcsf中,gm-csf转基因位于e3启动子控制下的缺失的e3区(即,缺失的6.7k/gp19k)的位置(cerullovetal.2010,cancerresearch70:4297-4309)。如本文所用的,cpg指被加入腺病毒基因组以使该病毒具有更强免疫刺激性的cpg部分。在腺病毒骨架中插入cpg富含区,增加了腺病毒刺激抗原呈递细胞中的tlr9,从而增加t细胞刺激和成熟以及nk激活的能力(nayaks,herzogrw.genether.2010mar;17(3):295-304.)。
用于本发明中的病毒载体还可以包含上文所描述之外的其它修饰。可以任选地使用任何其它成分或修饰,但是对于本发明而言不是强制性的。
包被腺病毒载体
根据本发明,腺病毒衣壳用能够在个体中刺激肽特异性免疫应答的合成的多肽或肽包被。用于包被腺病毒载体的多肽并非由所述腺病毒载体遗传编码。在此,术语“多肽”和“肽”可互换使用,指任何长度的氨基酸聚合物。
可以通过任何已知的合适的化学方法或生物化学方法将多肽附着至衣壳。在本发明的一实施方案中,肽已被共价或非共价地附着至病毒衣壳。在本发明的另一实施方案中,多肽已通过静电连接、二硫连接或酰胺键连接附着至衣壳,或者在单个纳米颗粒中被共递送并附着至衣壳。纳米颗粒也可以例如通过静电连接、二硫连接或酰胺键连接共价或非共价地附着至衣壳。如本文所用的,“纳米颗粒”指大小为1至100纳米的任何颗粒。静电连接策略利用这样的事实:腺病毒衣壳具有负的净总电荷,这暗示附着至小接头(其附着至目的肽)的由聚赖氨酸组成的带正电荷的肽的合成。第一个策略有两个潜在优势:1)其是迅速的(例如在室温下约15-30分钟或在室温下约20分钟),这可能在个性化药物中起关键作用,以及2)与阳离子聚合物复合的腺病毒的转导被显著增加26,29。
附着至病毒衣壳上的多肽可以都是相同的肽或者是选自两种或更多种不同的肿瘤抗原的不同的肽。在本发明的一实施方案中,腺病毒用一种以上的肽包被。肽可以是,例如相同抗原的不同mhc-i特异性的多肽、来自不同抗原的mhc-i多肽或mhc-i和mhc-ii限制性肽的组合。在本发明的一实施方案中,附着至病毒衣壳上的多肽选自i类主要组织相容性复合体(mhc-i)-特异性多肽(结合mhc-i的多肽)、ii类主要组织相容性复合体(mhc-ii)-特异性多肽(结合mhc-ii的多肽)、疾病特异性多肽(与疾病相关的多肽)、肿瘤特异性多肽(与肿瘤或特定肿瘤相关的多肽)以及dc特异性多肽(结合dc的多肽)。在本发明的具体实施方案中,附着至病毒衣壳上的多肽是肿瘤特异性的mhc-i限制性肽。这些肽可以直接从患者肿瘤分离,其过程在图5中描述。通过采用图5的方法,待被附着至病毒衣壳上的多肽可以同时呈递在肿瘤的mhc-i上并来自已被供应肿瘤溶解剂的dc。本文所用的“肿瘤特异性多肽”指肿瘤细胞呈递的多肽。本文所用的“dc特异性多肽”指dc呈递的多肽。本文所用的“疾病特异性多肽”具有疾病表型的细胞或被疾病感染的细胞呈递的多肽。
待被附着至腺病毒衣壳载体的多肽包括同时被一位患者的患病细胞或肿瘤细胞以及树突细胞呈递的任何多肽(例如肿瘤抗原或源于它们的肽)。合适的肽的实例包括但不限于gp100。
衣壳上的多肽的浓度可以变化,并且在本发明的一实施方案中,多肽的浓度为至少500nm。
根据本发明,可以在患者适合的多肽包被的腺病毒的产生中,分离并鉴定患病细胞来源的或肿瘤来源的mhc-i-装载的肽,合成该肽并混合至dc刺激的溶瘤腺病毒的衣壳。然而,该方法包括至少两步。第一,鉴定mhc-i上装载的免疫原性最强的多肽,以及第二,将这些多肽装载到溶瘤腺病毒衣壳上。
药物组合物
本发明不仅提供了用于治疗病症的治疗方法和用途,还提供了用于所述方法和治疗用途中的药物组合物。此类药物组合物包含单独的或与其它药剂组合的包被的腺病毒,所述其它药剂例如一种或多种治疗有效量的药剂和/或一种或多种药学可接受的媒介物。
药学可接受的媒介物可以例如选自药学可接受的溶剂、稀释剂、佐剂、赋形剂、缓冲液、载体、防腐剂、填充剂、稳定剂和增稠剂。任选地,可以包括对应产品中常见的任何其它成分。在本发明的一实施方案中,药物组合物包含多肽包被的腺病毒和药学可接受的媒介物。
药物组合物可以采用适合施用的任何形式,如固体、半固体或液体形式。剂型可以选自但不限于,例如溶液、乳剂或悬浮剂。用于配制本发明的药物制剂的方式和方法是本领域技术人员已知的,并且可以以其本身已知的方式来制备。
疗法
本发明范围内包括通过针对疾病所引起的异常细胞刺激肽特异性免疫应答可以被治疗,其进程能被减慢,或其中可以改善症状的任何疾病或病症。在本发明的一实施方案中,肽特异性免疫应答选自抗肿瘤免疫应答(针对原发瘤和/或继发瘤)、抗癌免疫应答(针对原发恶性肿瘤和/或继发恶性肿瘤)、抗感染免疫应答和抗病毒免疫应答。在这些情况下,免疫应答相应地指向肿瘤(包括恶性和良性肿瘤以及原发瘤和继发瘤)、癌(即,原发恶性肿瘤或继发恶性肿瘤)、传染病(例如,疟疾)、病毒(假设病毒感染,例如流感、sars-cov或hiv)等。例如,任何癌症都可以是本发明的包被的腺病毒的靶标。在本发明的一实施方案中,癌症选自鼻咽癌、滑膜癌、肝细胞癌、肾癌、结缔组织的癌症、黑素瘤、肺癌、肠癌、结肠癌、直肠癌、结肠直肠癌、脑癌、喉癌、口腔癌、肝癌、骨癌、胰腺癌、绒毛膜癌、胃泌素瘤、嗜铬细胞瘤、催乳素瘤、t细胞白血病/淋巴瘤、神经瘤、脑视网膜血管瘤病、佐林格-埃利森综合征、肾上腺癌、肛门癌、胆管癌、膀胱癌、输尿管癌、脑癌、少突神经胶质瘤、神经母细胞瘤、脑(脊)膜瘤、脊髓肿瘤、骨癌、骨软骨瘤、软骨肉瘤、尤因肉瘤、原发部位不明癌症、类癌、胃肠道类癌、纤维肉瘤、乳腺癌、佩吉特病、宫颈癌、结肠直肠癌、直肠癌、食道癌、胆囊癌、头癌、眼癌、颈癌、肾癌、肾母细胞瘤、肝癌、卡波西肉瘤、前列腺癌、肺癌、睾丸癌、霍奇金病、非霍奇金淋巴瘤、口腔癌、皮肤癌、间皮瘤、多发性骨髓瘤、卵巢癌、内分泌性胰腺癌、胰高血糖素瘤、胰腺癌、甲状旁腺癌、阴茎癌、垂体癌、软组织肉瘤、视网膜母细胞瘤、小肠癌、胃癌、胸腺癌、甲状腺癌、滋养层癌、葡萄胎、子宫癌、子宫内膜癌、阴道癌、外阴癌、听神经瘤、蕈样肉芽肿病、胰岛素瘤、类癌综合征、生长抑素瘤、牙龈癌、心脏癌、唇癌、脑膜癌、口癌、神经癌、腭癌、腮腺癌、腹膜癌、咽癌、胸膜癌、唾液腺癌、舌癌和扁桃体癌。
如本文所用的,术语“治疗(treatment)”或“治疗(treating)”指向个体至少施用包被的腺病毒载体或包含包被的腺病毒载体的药物组合物。如本文所用的,术语“治疗”,以及从其衍生的词汇,并非必然意味着100%或完全的治疗或增加。而是,本领域技术人员公认的具有不同程度的潜在益处或治疗效果。在这一点上,本发明的方法和用途可以提供疾病的任何程度的治疗或预防。因此,“治疗”不仅包括完全治愈,还包括例如预防、改善或减轻病症或与考虑中的疾病(如癌症、肿瘤、传染病或病毒感染)相关的症状。治疗效果可以通过本领域技术人员已知的任何方法,例如通过监测患者的症状或血液中的疾病标志物来评价。
如本文所用的,术语“个体”指选自动物、哺乳动物或人的个体。在本发明的一实施方案中,个体是人或动物。
以引起肽特异性免疫应答的治疗有效量向个体施用包被有多肽的腺病毒。如本文所用的,术语“治疗有效量”指这样量的包被的腺病毒:该量使疾病或病症(例如癌症)的有害效应在最低限度上得到改善。有害效应包括个体任何可检测的或能被注意的效应如疼痛、头晕或肿胀。
仅施用一次本发明的包被的腺病毒载体或药物组合物可以具有治疗效果。另一方面,治疗可以包括数次施用。例如,可以在2、3、4或8周内,或者治疗期内施用1至10次腺病毒载体或药物组合物。治疗期的长度可以变化,例如可以持续2至12个月或更久。在一些情况下,也可能对一位患者使用数个治疗期。
载体的有效剂量至少取决于需要治疗的个体、疾病的类型和疾病的阶段。剂量可以例如从约1×108病毒颗粒(vp)至约1×1014vp,具体从约1×109vp至约1×1013vp,且更具体从约5×109vp至约1×1012vp变化。
包被的腺病毒的施用可以通过本领域技术人员已知的任何合适的方法进行。在本发明的一实施方案中,腺病毒载体的施用通过以下进行:瘤内注射、动脉内注射、静脉内注射、胸膜内注射、囊内注射、腔内注射或腹膜内注射,或经口施用。还可能将不同的施用途径组合。
包被的腺病毒还可以与其它治疗剂或治疗方法或治疗组合一起(同时或顺序)使用。例如,本发明的方法或用途还可以包括放疗、化疗、其它药物的施用或任何临床操作。
在将人或动物患者归类为适合用于本发明的疗法之前,临床医生可以检查患者。基于偏离正常和显示疾病如癌症的结果,临床医生可以向患者建议本发明的方法或治疗。
用于包被的特异性肽的鉴定
本发明显示了从个体鉴定至少肿瘤特异性的和mhc-i-特异性的多肽的方法。该方法采用对肿瘤和暴露于(尤其是体内的)肿瘤裂解物的dc的mhc-i免疫肽组的定性和定量研究。方法简单地在图5中概括,其包括从肿瘤细胞和肿瘤溶解剂体外脉冲(病毒感染的肿瘤细胞)的dc分离mhci分子,并通过基于质谱的技术对mhc-相关的多肽进行测序。免疫相关的肽将被肿瘤和肿瘤裂解物脉冲的树突细胞二者呈递。例如,使用表达ova的小鼠模型可以促进系统的验证,实际上,公知的免疫原性的ova来源的肽(例如siinfekl)由小鼠实验产生,并且可以充当阳性对照。
将体外腺病毒感染之前和之后的个体肿瘤细胞用于方法中,以便阻止由于病毒感染而被该细胞展示的那些多肽。用肿瘤溶解剂体外脉冲的dc也用于方法中,以便允许呈递肿瘤抗原。为了分离肿瘤特异性肽,不仅使用肿瘤还使用用肿瘤溶解剂脉冲的dc的优势是为了更好地鉴定免疫活性肽(只有肽被呈递在肿瘤和dc二者之上时,才会有有效的免疫应答)。从肿瘤细胞和树突细胞分离mhc-i分子可以通过本领域内任何合适的分离方法进行。此后,可以通过任何合适的基于质谱的技术(例如lc–ms/ms)进行多肽的测序,以用于鉴定mhc-相关的肽。被肿瘤和树突细胞二者呈递的多肽可以通过比较这些细胞所呈递的多肽来鉴定。两组中共有的多肽,即用裂解物脉冲的dc所呈递的多肽减去未脉冲的dc所呈递的多肽(以消除dc自身的肽)以及病毒感染的肿瘤和未感染的肿瘤均呈递的多肽(以消除病毒特异性肽),适合用于包被腺病毒。多肽的比较可以手动或通过本领域技术人员已知的任何生物信息学方法来进行。任选地,对于任何特异性多肽或其组合,可以进行体外、离体和/或体内验证。在本发明的一实施方案中,除了从感染的肿瘤细胞和未感染的肿瘤细胞以及感染的树突细胞分离mhc-i分子之外,方法还包括从未感染的树突细胞分离mhc-i分子并鉴定mhc-i相关的多肽;以及鉴定由步骤iii)和iv)的感染的肿瘤和未感染的肿瘤以及步骤iii)的感染的树突细胞呈递,但不被未感染的树突细胞所呈递的那些多肽。在本发明的具体实施方案中,用腺病毒载体感染肿瘤细胞和dc发生在体外。用于本发明方法的腺病毒载体可以是任何腺病毒载体,例如先前的章节中所描述的这些载体的任何一种。
在本发明的一实施方案中,从个体鉴定肿瘤特异性的和mhc-i-特异性的多肽的方法被用于选择包被腺病毒衣壳的一种或多种肿瘤特异性的和mhc-i-特异性的多肽。这些肿瘤特异性的和mhc-i-特异性的多肽的任何一种或其组合可用于包被。
将对本领域技术人员显而易见的是,作为技术进步,本发明的构思可以以多种方式实施。本发明及其实施方案并不限制于上文所述的实例,而是可以在权利要求的范围内变化。
实施例
以下实施例至少证实用于分离和选择肿瘤特异性多肽的肿瘤mhc-i免疫肽组的分析,肿瘤特异性多肽包被的溶瘤腺病毒的生成和物理表征,以及包被的腺病毒在动物模型中的表征(例如i)治疗功效,ii)将抗病毒免疫力转移至抗肿瘤免疫力的能力以及iii)招募免疫系统的细胞并促进t细胞应答的能力)。
溶瘤腺病毒制备
如之前所描述的(8),使用标准方案来生成和繁殖所有溶瘤腺病毒(oad)。简而言之,通过用70-80%汇合的a549细胞以30的感染复数(moi)感染10t175烧瓶来扩增病毒。感染后三天,收集细胞并通过四次冷冻(-80℃)和融解(37℃)循环裂解细胞。然后通过在cscl梯度上的两次超速离心(22,000和27,000rpm)从细胞碎片和杂质分离腺病毒颗粒。通过持续搅拌下,在4℃针对a195缓冲液过夜透析来纯化回收的条带。具体而言,使用具有10,000kda的分子量截留的透析盒(pierce,lifetechnologies)。从盒中回收纯化的病毒,等分式样并储存于-80℃。
利用特异于e3基因和e1a基因中的d24缺失的引物,通过pcr评估腺病毒基因组的完整性。
如本节其它部分所描述的,利用分光光度法测定病毒颗粒滴度,而通过免疫细胞化学染色测定感染性滴度。利用bio-radproteinassaydyereagentconcentrate(bio-radlaboratories,hercules,ca,usa)通过bradford分析测定病毒制剂的蛋白浓度。用spectrostarnano分光光度计(bmglabtech,ortenber,germany)进行分光光度计读取。
本研究中使用的所有病毒在之前均有报道:ad5d24是特征为在e1a基因中有24个碱基对缺失(d24)的腺病毒(9),ad5d24-cpg是在e3基因中承载富含cpg的基因组的oad(30),而ad5d24-gm-csf是表达在病毒e3启动子控制下的gm-csf的oad(8)。
用于分离和选择肿瘤特异性肽的肿瘤mhc-i免疫肽组的分析
方法1a:
从c57bl/6小鼠收获小鼠cd11c+分选的骨髓树突细胞并培养1周23。然后将细胞暴露于:
a)作为对照的pbs,
b)来自b16-ova细胞的肿瘤溶解剂(肿瘤溶解剂来自感染了溶瘤腺病毒ad5d24直至完全裂解的b16-ova细胞),
c)通过细胞的冻融而获得的b16-ova细胞裂解物。
在不同的时间点,利用弱酸洗脱从活dc分离装载了肽的mhc-i25。在分析时,将肽溶解在水性溶液中并在ltq-orbitrapelite质谱仪(thermofisherscientific)上通过纳米lc–ms/ms进行分析。针对国际蛋白索引第3.23版小鼠数据库(http://www.ebi.ac.uk/ipi/ipihelp.html,其含有51536条序列和24497860个残基)进行数据库检索。相关的肽处于由两个组中共同呈递的肽所形成的组中,即用裂解物脉冲的dc减去未脉冲的dc(以消除dc自身的肽)以及b16-ova病毒感染的减去b16-ova未感染的(以消除病毒特异性肽)。
方法1b:
我们首先在计算机中降低了免疫肽组复杂度。mhc-i类肽的预测(http://www.syfpeithi.de/home.htm)。使用蛋白的功能注释(http://david.abcc.ncifcrf.gov)和(http://www.ingenuity.com)。
oncomine分析(https://www.oncomine.org)用于显示不同的人类癌症和细胞系中给定蛋白的表达水平。最重要的是,我们利用表位预测工具验证了我们的肽([17])。
在实验上,为了选择免疫原性最强的肽,我们对从c57bl/6小鼠收集的并用方法1a分离的所有不同的肽脉冲的脾细胞、肿瘤和淋巴结使用了小鼠ifn-γelispot(mabtechab,sweden)
简而言之,用溶瘤腺病毒(ad5d24)处理荷b16-ova肿瘤的c57bl/6小鼠。处理之后一至两周,将小鼠安乐死,收集器官和肿瘤,并降解成单细胞悬液以用于ifn-γelispot分析(mabtech,paloaltoca)。随后,一旦我们鉴定出一些免疫原性最强的肽库时,我们生成常规的四聚物或五聚物(proimmune,uk),用于基于流式细胞仪检测能识别mhc-i分子上的这些肽的特异性cd8t细胞。
肿瘤特异性肽包被的溶瘤腺病毒的生成和物理表征
由于ova来源的肽是相当熟知的,作为概念验证,我们首先生成了ova-特异性包被的病毒(图6)。更具体而言,我们生成了siinfekl-包被的腺病毒(siinfekl(seqidno:1)是免疫原性最强的ova来源的肽);siinfedl-包被的病毒(siinfedl(seqidno:7)是siinfekl肽的拮抗物);filksine-包被的病毒(filksine(seqidno:3)是siinfekl的乱序肽)。
方法2a:
为了生成肽包被的溶瘤腺病毒,考虑了不同的策略(图7)。
一种将利用病毒和肽之间的静电结合,另外两种将包括病毒和肽之间的共价键合。
i.静电相互作用。带正电荷的肽与负电荷的病毒衣壳复合26。
ii.共价键合。与衣壳蛋白的半胱氨酸的二硫键27,28。
iii.共价键合。酰胺键。与衣壳赖氨酸的氨基的琥珀酰亚胺酯反应28。
连接的方法在对应的参考文献中描述。
在本发明的一实施方案中,肽包被的溶瘤腺病毒如下制备:
pepticrad复合物形成
根据以下方案,本项工作中描述的所有pepticrad复合物均通过将溶瘤病毒(如标题“溶瘤腺病毒制备”下所描述的)与聚k-表位以1:500的比值混合(参见图8a和12):i)对于使用的每微升病毒制剂,计算存在的蛋白的对应的微克数;ii)然后,对于每微克病毒蛋白,添加500μg肽;iii)涡旋之后,将混合物在室温(rt)下孵育15min;以及iv)将溶液进行涡旋并用于分析或动物注射。在每次实验之前使用新鲜的试剂制备新的pepticrad。在调整至ph7.4的无菌milli-q水中进行孵育之前所需的病毒和肽的所有稀释。然后用分析所需的缓冲液稀释pepticrad。
方法2b:
来自方法2a的该肽包被的病毒的感染性通过在不同细胞系(人和鼠)中的荧光素酶分析和qpcr来体外评估30。为了评估感染性,将一组具有不同表达水平的car的不同的肿瘤细胞系用不同浓度的表达荧光素酶的包被病毒(ad5d24-luc)(1、10、100、1000vp/细胞)感染;未包被的病毒总是用作对照。在不同的时间点,对荧光素酶表达进行定量。同时,收获总的dna并通过qpcr定量病毒dna复制。通过tcid50和mts分析测试体外溶瘤活性31。
在本发明的一实施方案中,感染性通过如下的icc进行研究:
通过icc的感染性分析
将肿瘤细胞以2.0×105细胞/孔接种到24-孔板上,一式3或5份。第二天,将细胞用100μl病毒稀释物感染。然后在37℃下,将平板以1,000rcf离心90min,然后孵育48h。孵育期之后,去除培养基,并通过与250μl冰冷的甲醇孵育15min来固定细胞。一去除甲醇,就将细胞用补充有1%牛血清白蛋白(bsa)的300μlpbs洗涤3次。然后将细胞用1:2,000稀释的250μl小鼠单克隆抗-六邻体抗体(novusbiologicals,littleton,co,usa)在黑暗中在rt下染色1h。然后洗涤细胞,并用以pbs/1%bsa1:500稀释的250μl生物素-链霉亲和素-缀合的山羊抗-小鼠抗体,在黑暗中在rt下染色1h。随后将细胞与1:200稀释的250μlextravidin-过氧化物酶(sigma-aldrich,st.louis,mo,usa)在rt下孵育30min。充分地洗涤细胞,并根据生产商的说明书制备dab染色溶液(sigma-aldrich,st.louis,mo,usa)。然后向每孔施加250μldab染色溶液,并在显微镜下监测细胞中黑点的出现。当达到最佳信噪比时,通过添加pbs/1%bsa(500μl/每孔)来淬灭反应。对于每个重复(即,孔),利用amgevosxl显微镜(amggroup,lifetechnologies)捕获5个非重叠视野的图像。以下公式用于确定感染性滴度:
为了比较感染性,将数据呈现为每个视野中的斑点的平均数。
支持方法2:
将带负电荷的腺病毒衣壳用肿瘤特异性肽通过静电作用包被。该复合物的z-电势发生变化,所述z-电势与肽的量成比例。z-电势的这一变化表明,带正电荷的肽结合了病毒衣壳,决定了电荷的反转(图8a,带圆点的线)。一旦衣壳的所有负电荷被饱和,z-电势似乎达到平台期(图12,带圆形的线)。用于进行体外和体内功效测定的均匀的单分散复合物由浓度超过500nm的多肽形成。
为了进一步表征肽包被的腺病毒复合物,我们进行了几种活力分析(mts分析),将pepticrad的细胞杀伤功效与未包被的溶瘤病毒相比较(图9)。结果表明,与未包被的溶瘤病毒相比,病毒的包被总是导致未改变的或更好的细胞杀伤活性。
在本发明的一实施方案中,如下进行活力分析:
活力分析
将肿瘤细胞以1.0×104细胞/孔接种到96-孔板的含有5%fbs的生长培养基中。第二天,去除培养基,并将稀释于含有2%fbs的生长培养基中的50μl病毒用于在37℃下感染细胞2h。此后,添加100μl含有5%fbs的生长培养基,并将细胞于37℃下再次孵育。每隔一天更换生长培养基。当最具感染性的条件(100vp/细胞)显示出广泛的细胞病变效应(>90%),根据生产商的说明书通过mts分析测定细胞活力(celltiter96aqueousonesolutioncellproliferationassay;promega,nacka,sweden)。用varioskanflashmultimodereader(thermoscientific,carlsbad,ca,usa)获取分光光度计数据。
研究设计
利用以下公式确定样品量:
其中c是基于α和β值的常数,s是估计的变量,d是待观察的影响(34)。对于所有的动物实验,考虑至少80%的能力(1-β)和0.05的显著性(α)。停止数据收集的规则是i)一组或多组中超过60%的小鼠死亡以及ii)肿瘤完全清除。在实验结束之前死亡的所有小鼠均从生长曲线排除,以保持分析的统计学完整性。
研究的目标是利用黑素瘤模型测试oad能否代表肽类癌症疫苗方法的有效佐剂。此外,提出两个具体的问题:i)pepticrad能限制远端、未处理的肿瘤的生长么?ii)pepticrad的功效能通过靶向多肿瘤抗原而非单肿瘤抗原而增强么?为了回答这些问题,我们采用了荷黑素瘤肿瘤的免疫活性小鼠或人源化小鼠。小鼠被随机分配至各实验组,并且未采用盲法。
细胞系、试剂和人样品
人肺癌细胞系a549、人结直肠腺癌细胞系caco-2、人恶性黑素瘤细胞系sk-mel-2、人黑素瘤细胞系hs294t和小鼠黑素瘤细胞系b16-f10从美国典型培养物保藏中心(atcc;manassas,va,usa)购买。细胞系b16-ova(35)、表达鸡ova的小鼠黑素瘤细胞系由richardvile教授友情提供(mayoclinic,rochester,mn,usa)。
a549、caco-2和b16-ova细胞系在低葡萄糖dmem(lonza,basel,switzerland)中培养,hs294t细胞系在高葡萄糖dmem(gibco,lifetechnologies,carlsbad,ca,usa)中培养,sk-mel-2细胞系在emem(atcc)中培养,且b16-f10细胞系在rpmi-1640(gibco,lifetechnologies)中培养。所有的培养基均补充了10%胎牛血清(fbs;gibco,lifetechnologies)、2mmglutamax(gibco,lifetechnologies)以及100u/ml盘尼西林和0.1mg/ml链霉素(gibco,lifetechnologies)。b16-ova细胞系还在存在5mg/ml遗传霉素(gibco,lifetechnologies)的情况下培养以确保表达ova的细胞的选择。在培养期间或当需要用于分析时,将细胞用1x磷酸盐缓冲盐水(pbs)洗涤,并通过在37℃下与1xtrypleexpress(gibco,lifetechnologies)孵育3min来分离。
siinfekl(ova257-264)、聚k-siinfekl、siinfekl-聚k、聚k-ahx-siinfekl、聚k-svydffvwl(trp-2180-188)、聚k-kvprnqdwl(hgp10025-33)和聚k-slfravitk(mage-a196-104)肽从浙江鸿拓生物技术有限公司(zhejiangontoresbiotechnologiesco.,中国浙江)购买。所有的肽的纯度估计均>80%,并通过质谱分析来分析它们。
在实施例章节,聚k指6k。
肽的净电荷通过peptidepropertycalculatorver.3.1在线工具(http://www.biosyn.com/peptidepropertycalculator/peptidepropertycalculator.aspx)来计算。
sk-mel-2细胞系的基因型为hla-a*03-*26;b*35-*38;c*04-*12。来自健康供体的血沉棕黄层也获自finnishredcross服务,并将基因型确定为hla-a*03-*03;b*07-*27;c*01-*07。
包被的腺病毒在动物模型中的表征
方法3a:
我们体内测试了包被的病毒与未包被的常规溶瘤病毒的功效、免疫原性、毒性和生物分布。功效和免疫原性在荷b16-ova肿瘤的c57bl/6小鼠中测试。与其它未包被的病毒(拮抗剂、乱序和未包被的)相比,siinfekl-包被的病毒呈现更强烈的抗-ova应答,其被转化成更显著的肿瘤控制(功效)。同时,通过放射性标记细胞(dc和t细胞)的过继转移,还评估了这些细胞至肿瘤微环境的输送。最后,还研究了修饰的腺病毒载体的毒性和生物分布。
为了研究包被的病毒的功效,荷同系基因型b16-ova肿瘤(每只小鼠两个肿瘤)的不同组的c57bl/6小鼠(每组n=15)被进行如下处理:a)siinfekl-包被的病毒,b)siinfedl-包被的病毒,c)filksine-包被的病毒,和d)作为对照的未包被的病毒。在从施用病毒3天起的不同时间点,将每组的两只小鼠安乐死,并将脾、淋巴结和肿瘤收获进单细胞悬液中用于elispot、共培养和流式细胞术分析。同时随时间用标准卡尺测量肿瘤生长。流式细胞术分析直接显示了肿瘤、脾和淋巴结(肿瘤引流淋巴结和非肿瘤引流淋巴结)中siinfekl-特异性t细胞的量。对于该分析,我们使用了siinfekl-特异性五聚物(例如31)。小鼠ifn-γelispot也为我们提供了抗-ova(抗-siinfekl)t细胞激活的定量指示。在共培养实验中,我们体外测试了t细胞(从实验小鼠收获)杀伤b16和b16-ova的能力。将细胞以不同的细胞:靶标比进行共培养,并通过mts或mtt分析评估b16和b16-ova的活力。在所有的这些实验中,将从ot-i小鼠收获的t细胞用作对照。还使用了cmt64-ova模型,其是表达ova的鼠肿瘤,其中人腺病毒是半受纳的33。
方法3b:
比较了用以下包被的病毒的抗肿瘤活性和免疫原性:i)ova-肽(siinfekl(seqidno:1)),ii)b16肽trp2(svydffvwl(seqidno:5)),iii)hgp100肽(kvprnqdwl(seqidno:6))或iv)方法1中鉴定的新肽。
测试这些病毒诱导抗肿瘤免疫应答的功效和能力。将抗病毒应答与抗肿瘤应答相比较(elispot和五聚物分析)。还评估了针对不同表位(例如ova-病毒触发了trp2应答,表位扩展)诱导免疫应答的能力。在方法中所用的方法已在方法3a中有所描述。
基于方法2和3的研究:
我们生成了图7策略i中所描述的ova-特异性pepticrad(siinfekl-包被的溶瘤腺病毒)。简而言之,合成的siinfekl肽被合成并附着至聚赖氨酸接头(聚k-siinfekl)以便赋予肽正的净电荷,在注射前30分钟将其与具有负的净电荷的裸露病毒复合。然后将复合物经瘤内施用于荷皮下b16-ova肿瘤的小鼠。监测肿瘤生长并在实验结束时将小鼠安乐死,收集肿瘤并通过流式细胞术对ova-特异性t细胞进行定量(图10)。
该实验证明本发明的修饰的腺病毒载体与单独的病毒和分开施用的病毒和肽相比的优越性。其还表明正确配制包被的病毒的重要性,因为利用过高的肽浓度,似乎诱导出较少的肿瘤特异性t细胞(数据未显示)。
第二代包被的腺病毒
方法4:
通过用一种以上的单独肽(以便引发更强烈和多价的免疫应答)包被溶瘤病毒而生成了第二代pepticrad。同方法2一样对这些新的病毒进行表征,并同方法3一样来评估功效。随后,我们用几种多肽包被了细胞因子-装备的溶瘤腺病毒。多肽可以是相同抗原的不同mhc-i特异性肽,或来自不同抗原的mhc-i肽,或者mhc-i和mhc-ii限制性肽的组合。
用于分析包被的溶瘤病毒的方法
z电势和动态光散射(dls)分析
如在标题“pepticrad复合物形成”下所描述的那样来制备包被的溶瘤病毒样品。然后对每个样品进行涡旋,并用调整至ph7.4的无菌milli-q水稀释至700μl的终体积,之后将样品转移至聚苯乙烯的一次性小杯中以确定复合物的尺寸。然后从小杯中回收样品,并转移至dts1070一次性毛细管池(malvern,worcestershire,uk)用于z电势测量。所有的测量均在25℃下用zetasizernanozs(malvern)进行。
spr
利用spr评估聚k-siinfekl或siinfekl与oad的相互作用。利用多参数sprnavitm220a仪器(bionavisltd,tampere,finland)进行测量。该仪器包括具有一体化流体系统的温控双流道和用于缓冲液和样品处理的自动进样器。其ph被调整至7.4的milli-q水用作运行缓冲液。此外,在整个实验中使用30μl/min的恒定流速,并且温度被设定为+20℃。波长为670nm的激光用于表面等离子体激发。
在spr实验之前,具有二氧化硅表面的滑条传感器通过以下激活:3min的等离子处理,随后通过在含50mmaptes((3-氨丙基)三乙氧基硅烷)的甲苯溶液中孵育传感器1h来用aptes包被。然后将传感器置于spr装置中,并通过注射入于milli-q水(ph7.4)中的50μg/mload持续大约12min,随后用20mmchaps(3-[(3-胆酰胺丙基)二甲基氨基]-1-丙磺酸盐)洗涤3min而将oad原位固定于测试通道的传感器表面上。第二流道用作参照,并注射入milli-q水(ph7.4),随后用chaps洗涤。在样品注射之前,观察基线至少10min。然后将聚k-siinfekl或siinfekl以递增的浓度平行地注射入流通池的两个流道中。
交叉呈递实验
从空白c57bl/6小鼠收集新鲜的脾,并促使其通过70-μm的细胞滤网(fisherscientific,waltham,ma,usa)。通过将样品与5mlack裂解缓冲液(lifetechnologies)在rt下孵育5min来裂解红血细胞。此后,洗涤并制备脾细胞以用于分析(对于测试的每个条件,2×106个细胞于800μl10%rpmi-1640培养基中)。向脾细胞添加共计200μlsiinfekl、聚k-siinfekl、siinfekl-聚k或siinfekl-ahx-聚k肽稀释物(0.19μg/μl)。为了测试ova-pepticrad,使用100vp/细胞的感染条件(共计7.9×109vp与于200μl10%rpmi-1640中的37.5μg聚k-siinfekl混合)。pepticrad复合物如方法2下所述的那样来制备。然后将脾细胞于37℃孵育2h。此后,将细胞充分洗涤,并用与siinfekl结合的apc抗-小鼠h-2kb,或apc小鼠igg1,κ同种型对照(biolegend,sandiego,ca,usa)染色。在冰上孵育30-min之后,洗涤样品并通过流式细胞术分析。
流式细胞术分析
收集经处理的小鼠的肿瘤、脾和淋巴结,促使其通过70-μm的细胞滤网,并在10%rpmi-1640培养基中过夜培养。必要时,将样品于rpmi-1640(具有10%fbs和10%dmso)中冷冻并储存于-80℃。单细胞悬液用荧光染料缀合的单克隆抗体染色,并利用bdlsrii(bdbiosciences)或gallios(beckmancoulter)流式细胞仪以及flowjo软件(treestar,ashland,or,usa)进行分析。无菌pbs用于染色缓冲液。利用i类mhc五聚物(proimmune,oxford,uk)来研究表位特异性t细胞。所用的其它抗体包括以下:鼠和人fc封闭cd16/32(bdpharmingen);fitc抗-小鼠cd8和fitc抗-人cd8(proimmune);pe/cy7抗-小鼠cd3ε,pe/cy7抗-小鼠cd19,fitc抗-小鼠cd11c,percp/cy5.5抗-小鼠cd86,与siinfekl结合的apc抗-小鼠h-2kb和apc小鼠igg1,κ同种型对照(biolegend)。所有染色方案均按照生产商的推荐进行。
统计学分析
利用graphpadprism6(graphpadsoftware,inc.,lajolla,ca,usa)确定统计学显著性。用于分析来自各实验的数据的统计学方法的详细描述可以参见附图的每一个简要说明。
动物实验和伦理问题
在芬兰和欧洲法律和立法下进行动物实验。动物许可(esavi/5924/04.10.03/2012)已被修订,并且得到芬兰官方(赫尔辛基大学和南芬兰省省政府的实验动物委员会)的认可。完全免疫活性的c57bl/6小鼠获自scanbur(karlslunde,denmark),而免疫缺陷的三联基因敲除nod.cg-prkdcscid-il2rgtm1wjl/szj小鼠获自jacksonlaboratories(barharbor,me,usa)。购买的所有小鼠均处于4-6周龄,并在研究前隔离2周。小鼠被关在具有单独和受控气流的笼子中,并且在整个研究期间,它们可以不受限制地接近食物。经常监测小鼠的健康状况,并在首次出现疼痛或焦虑迹象时将动物处死。所有方案均在无菌条件下在2级生物安全级别的小房间内进行。
对于功效实验,在60-70%汇合度(对数生长期)时收集肿瘤细胞,并经皮下(s.c.)注射入小鼠两胁。注射入各胁的肿瘤细胞的数量根据细胞系类型而变化:3×105b16-ova、1×105b16-f10和2×106sk-mel-2。在所有实验中,给予三次处理注射。然后追踪肿瘤生长,并使用公式确定肿瘤体积。
根据我们的许可证,人道终点如下:i)失重25%,ii)肿瘤直径>15mm,和iii)明显的疼痛迹象(移动减少或肿瘤溃烂)。通过二氧化碳吸入,随后颈椎脱位来进行安乐死。
结果
腺病毒衣壳的负电荷能够用于复合带正电荷的免疫原性肽,从而形成pepticrad。
腺病毒衣壳携带高度负的净电荷(36),因此,我们假设正电荷的mhc-i-限制性肽将通过静电相互作用结合衣壳,从而用免疫相关的肽(即,肿瘤特异性的mhc-i-限制性肽)覆盖病毒。为了检验我们的假设,我们使用了b16-ova肿瘤模型(37)。该细胞系表达鸡卵清蛋白(ova)并呈递ova-来源的肽siinfekl,我们用该肽作为mhc-i上的模式表位。
为了允许中性的、疏水性siinfekl肽和带负电荷的病毒表面之间的静电相互作用,我们向肽序列添加了聚-赖氨酸(聚k)链。这种化学修饰使肽的净电荷在生理条件下从0增加至+6mv。接下来,我们通过表面等离子体共振(spr)研究了病毒衣壳和修饰的肽之间的相互作用。具体而言,我们用oad包被了aptes硅石sio2传感器,并向流动系统中注射递增浓度的siinfekl或聚k-siin(图8b)。用未修饰的肽未观察到信号的增加(图8b,虚线),而用修饰的肽观察到信号的浓度依赖性增加(图8b,实线),这证明肽的修饰显著增加了与腺病毒衣壳的相互作用。
接下来,我们研究了有效覆盖病毒表面所需的肽的最佳浓度。为此,我们评估了由不同的oad:肽比值(1:5,1:50、1:100和1:500)得到的病毒-肽复合物的净电荷和流体动力学直径。我们观察到反应中带正电荷的肽的量和复合物的净电荷之间的明确的关系(图8a)。最低的比值(1:5)能够使病毒颗粒的电荷从-29.7±0.5mv增加至+6.3±0.06mv,尽管在这些条件下,观察到了严重的聚集,如通过复合物尺寸的增加所指示的(800±13.5nm)。1:5以上,净电荷增加,达到平台期样动力学;实际上,我们对于1:50、1:100和1:500比值分别测量到了+17.5±0.2mv、+18.4±0.1mv和+18±0.8mv的z电势。然而,只有在1:500的比值时,复合物的直径减小到120nm以下,这代表了腺病毒颗粒的正常直径(图8a)。还用肽的浓度而不是比值重复了相同的实验以促进再现性(图12)。
吸附到pepticrad上的修饰的mhc-i表位被有效交叉呈递
为了诱导有效的细胞毒性t-淋巴细胞-介导的免疫应答,肽必须通过apc上的mhc-i被呈递到初始cd8+t淋巴细胞。因此,我们研究了聚k链的存在和位置是否能够影响交叉呈递效率。为此目的,我们用天然siinfekl或两种不同的赖氨酸-延伸版本:聚k-siinfekl(n-末端延伸的)和siinfekl-聚k(c-末端延伸的)脉冲离体培养的脾细胞(来自c57bl/6小鼠)。作为阴性对照,我们包括了含有氨基己酸(ahx)残基的延伸的siinfekl,所述氨基己酸(ahx)残基是公知的能够抑制蛋白酶体的蛋白水解活性的赖氨酸类似物。然后,在使用能特异性识别装载了siinfekl的mhc-i的抗体的情况下,我们评估了siinfekl的交叉呈递(38)。
如所预期的,98.5%的siinfekl-脉冲的脾细胞对于脾细胞膜的mhc-i分子上存在siinfekl是阳性的(图13a)。有趣的是,聚k链在肽序列中的位置显著改变了着色细胞的比例。实际上,94.5%的用n-末端延伸的肽脉冲的脾细胞交叉呈递siinfekl。相比之下,当用c-末端延伸siinfekl-聚k脉冲脾细胞时,着色的群体降低至27.1%。当用阴性对照siinfekl-ahx-聚k脉冲时,只有1.36%的脾细胞交叉呈递siinfekl肽。基于这些发现,我们选择了n-末端延伸的版本(聚k-siinfekl)用于进一步的研究。
接下来,我们研究了修饰的siinfekl吸附病毒衣壳上能否影响其交叉呈递。如同在之前的实验中一样,我们将小鼠脾细胞与肽siinfekl或聚k-siinfekl或ova-pepticrad一起孵育。我们发现,n-末端延伸的聚k-siinfekl与oad复合,形成pepticrad,允许siinfekl肽的有效mhc-i-限制性呈递(图13b)。
与未修饰的病毒相比,pepticrad显示出未改变的感染性和完整的溶瘤活性。
oad能够选择性感染肿瘤细胞并经由oad复制循环而裂解它们。因此,我们研究了用修饰的肽包被病毒是否将影响其生物学性质。我们选择研究表达低水平柯萨奇病毒和腺病毒受体(car)的人结直肠腺癌细胞系(caco-2)和表达高水平car的两种人黑素瘤细胞系(sk-mel-2和a2058)。首先进行了比较ova-pepticrad与未修饰的病毒ad5d24的体外活力分析(图14a),结果表明关于溶瘤活性没有显著性差异。如所预期的,最具感染性的条件(100vp/细胞)与所有细胞系中的最低活力相关。此外,我们表明了肽聚k-siinfekl对细胞没有毒性作用。
接下来,我们利用了相同的体外细胞系通过免疫细胞化学(icc)分析评估了pepticrad的感染性(图14b)。然而,我们在sk-mel-2细胞系、caco-2和a2058细胞系中没有观察到任何差异,与裸露的腺病毒相比较,pepticrad显示出感染性的显著增加(p<0.01)。这一增加可能是由于pepticrad和裸露的腺病毒的电荷不同(36)。
pepticrad癌症疫苗在鼠黑素瘤模型中的抗肿瘤功效和免疫学研究
为了彻底地研究pepticrad的抗肿瘤功效和其促进的抗肿瘤免疫力,我们首先使用了过表达鸡ova(b16-ova)的鼠黑素瘤模型(35)。具体而言,将b16-ova植入小鼠的两胁,之后对建立的肿瘤进行处理。使用在e1a中携带有d24缺失的oad(ad5d24)进行实验(37),然后用富含cpg的腺病毒(ad5d24-cpg)重复(39),以进一步增强免疫力(图15)。研究组包括用ova-pepticrad、非复合的ad5d24-cpg和siinfekl(ad5d24-cpg+siinfekl)、单独的oad(ad5d24-cpg)或肽(siinfekl)、或者盐溶液(模拟组)处理的小鼠。
与模拟处理或oad和siinfekl的混合物(p<0.01)相比,pepticrad处理显著降低了肿瘤生长。在实验结束时,ova-pepticrad-处理的小鼠中的肿瘤的平均体积低于所有其它组(120.4±31.6mm3对比模拟组中的697.7±350mm3、siinfekl中的255±61.5mm3和ad5d24-cpg中的713.7±292.6mm3、ad5d24-cpg+siinfekl中的489.7±73.2mm3;图15a)。
在两个不同的时间点(对于早期和晚期时间点分别为第7天和第16天),将小鼠处死,并收集脾、肿瘤和引流淋巴结用于免疫分析。该分析揭示了,在用pepticrad处理的小鼠的组中,在腹股沟引流淋巴结中存在大群的siinfekl-特异性cd8+t细胞(cd8+ova+t细胞)(在第7天为7.4%,且在第16天为3.2%)。相同的分析表明,在早期时间点的肿瘤中没有巨大差异,而在晚期时间点观察到大幅度增加(在第16天,ova-pepticrad中的0.23%对比模拟组中的0.02%、siinfekl中的0.03%、ad5d24-cpg中的0.01%和ad5d24-cpg+siinfekl中的0.02%,图15b和c)。
然后,我们研究了肿瘤尺寸与脾、淋巴结和肿瘤中ova-特异性t细胞(cd8+ova+t细胞)群体之间的相关性。我们计算了皮尔森r值以估算相关性的性质(负值,负相关性;正值,正相关性),并观察到肿瘤体积和抗-ova应答程度之间的负相关性(图15d),表明具有较小肿瘤的动物组对应于具有较强烈cd8+ova+t细胞群体的动物组。此后,计算每个样品组的r2值以评估该相关性的强度(脾,r2=0.5719;淋巴结,r2=0.6385;肿瘤,r2=0.7445)。有趣的是,在相关性分析中,pepticrad组(图15d中的红点)一致地表明,最小的肿瘤体积和最大的免疫应答。
最后,为了深化我们对pepticrad机制的理解,我们评估了在小鼠脾中的mhc-i上呈递siinfekl肽的成熟dc的群体(cd19-cd3-cd11c+cd86高细胞)。在晚期时间点,用ova-pepticrad处理的小鼠中的成熟siinfekl-呈递dc的比例显著高于(p<0.05)用非复合ad5d24-cpg+siinfekl处理的小鼠。当考虑两个时间点时,pepticrad是诱导了成熟siinfekl-呈递dc增加的唯一处理,如通过cd86高ova+dc群体的9.67倍的增加所显示的(图15e)。
这些结果提示,成熟和表位特异性dc库的扩增可能是pepticrad的更高抗肿瘤功效的基础。
多价pepticrad显示了对远端、未处理的黑素瘤的抗肿瘤活性。
利用溶瘤疫苗的一个主要优势是所引发的免疫应答不仅促进靶向原发瘤还靶向散布的转移。为此原因,我们在鼠黑素瘤模型中研究了pepticrad对未处理的对侧肿瘤的抗肿瘤功效。在相同的实验组中,我们还研究了靶向两种肿瘤抗原(经由多价pepticrad),而不是单一的一种,是否将增加总的功效。因此,我们选择了两种肿瘤特异性的mhc-i-限制性表位以包被溶瘤病毒ad5d24-cpg:svydffvwl(trp-2180-188;限制于鼠mhc-i分子h-2kb)和kvprnqdwl(人gp10025-33,或hgp100;限制于鼠mhc-i分子h-2db(40))。对于这些实验,我们利用高侵袭性的黑素瘤b16-f10,其表达两种肿瘤抗原(41)。肽在其n-末端用聚k链修饰,以利于其吸附至病毒衣壳上,如之前针对siinfekl的一样。
我们首先将1×105个b16-f10细胞植入c57bl/6小鼠的右胁。10天之后,按如下开始处理:i)盐溶液(模拟组),ii)裸露的溶瘤病毒(ad5d24-cpg),和iii)双包被的trp-2-hgp100-pepticrad。每两天瘤内施用处理,如图6a中的示意图所显示。在最后一轮注射之后2天,将3×105个b16-f10细胞注射入小鼠的左胁,并追踪黑素瘤的生长。与对照相比,用双包被的pepticrad处理的小鼠显示出显著降低的肿瘤生长(p<0.001)(在第11天;图16a)。继发的和未处理的肿瘤的分析揭示了双包被的pepticrad相对于所有其它组的优势。具体而言,在实验结束时,与接受了盐溶液或仅接受ad5d24-cpg的对照中的继发瘤相比,该组中的继发瘤显著更小(p<0.01;图16b)。
为了更好地阐明支撑这些结果的机制,我们进行了流式细胞术分析以研究针对两种表位的特异性t-细胞应答。在用trp-2-hgp100pepticrad处理的小鼠中,我们观察到比所有其它组中积累更多的表位特异性cd8+t细胞(图16c)。
总之,这些结果证实,pepticrad方法对更低免疫原性的和更具侵袭性的黑素瘤模型是有效的。此外,靶向多种抗原在处理的和未处理的肿瘤上都产生了强烈的作用。因此,有可能生成多价pepticrad,并且它们能为我们提供靶向不同的肿瘤抗原因此克服肿瘤的某些免疫逃逸的可能性。
pepticrad在荷人肿瘤的人源化小鼠中展现出增强的功效和抗肿瘤免疫力。
最后,我们想要评估pepticrad在模型中的功效,该模型能够提供关于将其转化至临床环境的可行性信息。因此,我们选择了更为精细的人源化小鼠模型。为此,三联基因敲除小鼠(nod.cg-prkdcscid-il2rgtm1wjl/szj,或nsg)首先被人黑素瘤细胞系sk-mel-2移入。当肿瘤达到明显的尺寸时,将来自健康供体的部分匹配的人外周血单核细胞(pbmc)移入相同的小鼠中。一天以后,将小鼠用pepticrad,未包被的病毒或盐溶液处理。对于该实验,我们选择了来源于黑素瘤相关抗原a1的肽(mage-a196-104;slfravitk)并对其进行修饰以允许与病毒衣壳相互作用(聚k-slfravitk)。在该实验中,由于我们在研究完全的人免疫系统,我们选择了表达人gm-csf的oad,我们之前已证明gm-csf在免疫活性系统包括在癌症患者中具有增强的活性(8)。
我们发现,mage-a1pepticrad与对照处理相比显示出增加的功效,如通过肿瘤体积快速减小所表明的(图17a和b)。最后,我们研究了更强的免疫应答能否解释pepticrad在该模型中增加的抗肿瘤功效。为此,我们通过五聚物染色研究了mage-a196-104-特异性cd8+t细胞的存在(图17c),并且我们发现了在用pepticrad处理的小鼠的脾中最大的人mage-特异性t细胞(cd8+mage-a1+)群体。
这些数据证实了我们之前的发现,即pepticrad利用溶瘤病毒的天然免疫原性刺激肿瘤特异性免疫应答,由此提高了癌症免疫病毒疗法的功效。
任何疾病上的mhc-i特异性多肽的分析和腺病毒衣壳的包被及其用途
通过比较个体的dc和感染的患病细胞所代表的mhc-i-限制性多肽来鉴定任何mhc-i特异性多肽。两个细胞组所呈递的一种或多种多肽被选择用于包被腺病毒载体。
选择任何腺病毒载体并根据方法2中所描述的任何方法进行包被。
包被的病毒用于治疗患者的疾病。
参考文献
1.mocellin,s(2012).peptidesinmelanomatherapy.currpharmdes18:820–831.
2.lipscomb,mfandmasten,bj.dendriticcells:immuneregulatorsinhealthanddisease.physrev.physiology.org.
3.degli-esposti,maandsmyth,mj(2005).closeencountersofdifferentkinds:dendriticcellsandnkcellstakecentrestage.natrevimmunol5:112–124.
4.trinchieri,g,aden,dpandknowles,bb(1976).cell-mediatedcytotoxicitytosv40-specifictumour-associatedantigens.nature261:312–314.
5.steinman,rm,hawiger,dandnussenzweig,mc(2003).tolerogenicdendriticcells.annu.rev.immunol.21:685–711.
6.wongthida,p,diaz,rm,galivo,f,kottke,t,thompson,j,melcher,a,etal.(2011).vsvoncolyticvirotherapyintheb16modeldependsuponintactmyd88signaling.molther19:150–158.
7.prestwich,rj,errington,f,diaz,rm,pandha,hs,harrington,kj,melcher,aa,etal.(2009).thecaseofoncolyticvirusesversustheimmunesystem:waitingonthejudgmentofsolomon.humgenether20:1119–1132.
8.cerullo,v,pesonen,s,diaconu,i,escutenaire,s,arstila,pt,ugolini,m,etal.(2010).oncolyticadenoviruscodingforgranulocytemacrophagecolony-stimulatingfactorinducesantitumoralimmunityincancerpatients.cancerres70:4297–4309.
9.heise,c,hermiston,t,johnson,l,brooks,g,sampson-johannes,a,williams,a,etal.(2000).anadenoviruse1amutantthatdemonstratespotentandselectivesystemicanti-tumoralefficacy.natmed6:1134–1139.
10.heise,c,sampson-johannes,a,williams,a,mccormick,f,hoff,von,ddandkirn,dh(1997).onyx-015,ane1bgene-attenuatedadenovirus,causestumor-specificcytolysisandantitumoralefficacythatcanbeaugmentedbystandardchemotherapeuticagents.natmed3:639–645.
11.nowak,ak,lake,ra,marzo,al,scott,b,heath,wr,collins,ej,etal.(2003).inductionoftumorcellapoptosisinvivoincreasestumorantigencross-presentation,cross-primingratherthancross-tolerizinghosttumor-specificcd8tcells.jimmunol170:4905–4913.
12.zitvogel,l,apetoh,l,ghiringhelli,fandkroemer,g(2008).immunologicalaspectsofcancerchemotherapy.natrevimmunol8:59–73.13.vandermost,rg,currie,aj,robinson,bwsandlake,ra(2008).decodingdangerousdeath:howcytotoxicchemotherapyinvokesinflammation,immunityornothingatall.celldeathdiffer15:13–20.
14.istrail,s,florea,l,halldórsson,bv,kohlbacher,o,schwartz,rs,yap,vb,etal.(2004).comparativeimmunopeptidomicsofhumansandtheirpathogens.procnatlacadsciusa101:13268–13272.
15.cerullo,v,pesonen,s,diaconu,i,escutenaire,s,arstila,pt,ugolini,m,etal.(2010).oncolyticadenoviruscodingforgranulocytemacrophagecolony-stimulatingfactorinducesantitumoralimmunityincancerpatients.cancerres70:4297–4309.
16.cerullo,v,seiler,mp,mane,v,brunetti-pierri,n,clarke,c,bertin,tk,etal.(2007).toll-likereceptor9triggersaninnateimmuneresponsetohelper-dependentadenoviralvectors.molther15:378–385.
17.suzuki,m,cerullo,bertin,t,cela,clarke,guenther,m,etal.(2009).myd88-dependentsilencingoftransgeneexpressionduringtheinnateandadaptiveimmuneresponsetohelper-dependentadenovirus.humgenetherdoi:10.1089/hum.2009.155.
18.suzuki,m,cela,r,bertin,tk,sule,g,cerullo,v,rodgers,jr,etal.(2011).nod2signalingcontributestotheinnateimmuneresponseagainsthelper-dependentadenovirusvectorsindependentlyofmyd88invivo.humgenether22:101082.
19.muruve,da,pétrilli,v,zaiss,ak,white,lr,clark,sa,ross,pj,etal.(2008).theinflammasomerecognizescytosolicmicrobialandhostdnaandtriggersaninnateimmuneresponse.nature452:103–107.
20.tewalt,ef,grant,jm,granger,el,palmer,dc,heuss,nd,gregerson,ds,etal.(2009).viralsequestrationofantigensubvertscrosspresentationtocd8+tcells.plospathog5:e1000457.
21.cerullo,v,seiler,mp,mane,vp,brunetti-pierri,n,clarke,c,bertin,tk,etal.(2007).toll-likereceptor9triggersaninnateimmuneresponsetohelper-dependentadenoviralvectors.molther15:378–385.
22.suzuki,m,cerullo,v,bertin,tk,cela,r,clarke,c,guenther,m,etal.(2010).myd88-dependentsilencingoftransgeneexpressionduringtheinnateandadaptiveimmuneresponsetohelper-dependentadenovirus.humgenether21:325–336.
23.seiler,mp,gottschalk,s,cerullo,v,ratnayake,m,mane,vp,clarke,c,etal.(2007).dendriticcellfunctionaftergenetransferwithadenovirus-calciumphosphateco-precipitates.molther15:386–392.
24.suzuki,m,cela,r,bertin,tk,sule,g,cerullo,v,rodgers,jr,etal.(2011).nod2signalingcontributestotheinnateimmuneresponseagainsthelper-dependentadenovirusvectorsindependentlyofmyd88invivo.humgenetherdoi:10.1089/hum.2011.002.
25.fortier,m-h,caron,e,hardy,m-p,voisin,g,lemieux,s,perreault,c,etal.(2008).themhcclassipeptiderepertoireismoldedbythetranscriptome.journalofexperimentalmedicine205:595–610.
26.fasbender,a,zabner,j,chillon,m,moninger,to,puga,ap,davidson,bl,etal.(1997).complexesofadenoviruswithpolycationicpolymersandcationiclipidsincreasetheefficiencyofgenetransferinvitroandinvivo.jbiolchem272:6479–6489.
27.croyle,ma,yu,qcandwilson,jm(2000).developmentofarapidmethodforthepegylationofadenoviruseswithenhancedtransductionandimprovedstabilityunderharshstorageconditions.humgenether11:1713–1722.
28.wonganan,pandcroyle,ma(2010).pegylatedadenoviruses:frommicetomonkeys.viruses2:468–502.
29.toyoda,k,ooboshi,h,chu,y,fasbender,al,davidson,bl,welsh,mj,etal.cationicpolymerandlipidsenhanceadenovirus-mediatedgenetransfertorabbitcarotidartery.stroke.ahajournals.org.
30.cerullo,v,diaconu,i,romano,v,hirvinen,m,ugolini,m,escutenaire,s,etal.(2012).anoncolyticadenovirusenhancedfortoll-likereceptor9stimulationincreasesantitumorimmuneresponsesandtumorclearance.molther20,2076.
31.cerullo,v,diaconu,i,romano,v,hirvinen,m,ugolini,m,escutenaire,s,etal.(2012).anoncolyticadenovirusenhancedfortoll-likereceptor9stimulationincreasesantitumorimmuneresponsesandtumorclearance.molther20,2076.
32.dias,jd,liikanen,i,guse,k,foloppe,j,sloniecka,m,diaconu,i,etal.(2010).targetedchemotherapyforheadandneckcancerwithachimericoncolyticadenoviruscodingforbifunctionalsuicideproteinfcu1.clincancerres16:2540–2549.
33.edukulla,r,woller,n,mundt,b,knocke,s,gurlevik,e,saborowski,m,etal.(2009).antitumoralimmuneresponsebyrecruitmentandexpansionofdendriticcellsintumorsinfectedwithtelomerase-dependentoncolyticviruses.cancerres69:1448–1458.
34.r.b.dell,s.holleran,r.ramakrishnan,samplesizedetermination.ilarjournal/nationalresearchcouncil,instituteoflaboratoryanimalresources43,207(2002).
35.m.w.moore,f.r.carbone,m.j.bevan,introductionofsolubleproteinintotheclassipathwayofantigenprocessingandpresentation.cell54,777(sep9,1988).
36.a.fasbenderetal.,complexesofadenoviruswithpolycationicpolymersandcationiclipidsincreasetheefficiencyofgenetransferinvitroandinvivo.thejournalofbiologicalchemistry272,6479(mar7,1997).
37.c.heiseetal.,anadenoviruse1amutantthatdemonstratespotentandselectivesystemicanti-tumoralefficacy.naturemedicine6,1134(oct,2000).
38.y.dengetal.,assemblyofmhcclassimoleculeswithbiosynthesizedendoplasmicreticulum-targetedpeptidesisinefficientininsectcellsandcanbeenhancedbyproteaseinhibitors.jimmunol161,1677(aug15,1998).
39.v.cerulloetal.,anoncolyticadenovirusenhancedfortoll-likereceptor9stimulationincreasesantitumorimmuneresponsesandtumorclearance.moleculartherapy:thejournaloftheamericansocietyofgenetherapy20,2076(nov,2012).
40.w.w.overwijketal.,gp100/pmel17isamurinetumorrejectionantigen:inductionof"self"-reactive,tumoricidaltcellsusinghigh-affinity,alteredpeptideligand.thejournalofexperimentalmedicine188,277(jul20,1998).
41.w.w.overwijk,n.p.restifo,b16asamousemodelforhumanmelanoma.currentprotocolsinimmunology/editedbyjohne.coligan...[etal.]chapter20,unit201(may,2001)。
序列表
<110>赫尔辛基大学
<120>用于癌症疫苗的包被的溶瘤腺病毒
<130>2140609pc
<160>7
<170>patentinversion3.5
<210>1
<211>8
<212>prt
<213>人工序列
<220>
<223>肽片段
<400>1
serileileasnpheglulysleu
15
<210>2
<211>7
<212>prt
<213>人工序列
<220>
<223>肽片段
<400>2
serileileasnpheaspleu
15
<210>3
<211>8
<212>prt
<213>人工序列
<220>
<223>肽片段
<400>3
pheileleulysserileasnglu
15
<210>4
<211>9
<212>prt
<213>人工序列
<220>
<223>肽片段
<400>4
serleupheargalavalilethrlys
15
<210>5
<211>9
<212>prt
<213>人工序列
<220>
<223>肽片段
<400>5
servaltyraspphephevaltrpleu
15
<210>6
<211>9
<212>prt
<213>人工序列
<220>
<223>肽片段
<400>6
lysvalproargasnglnasptrpleu
15
<210>7
<211>8
<212>prt
<213>人工序列
<220>
<223>肽片段
<400>7
serileileasnphegluaspleu
15
- 还没有人留言评论。精彩留言会获得点赞!