用于疼痛的破骨细胞抑制剂的制作方法
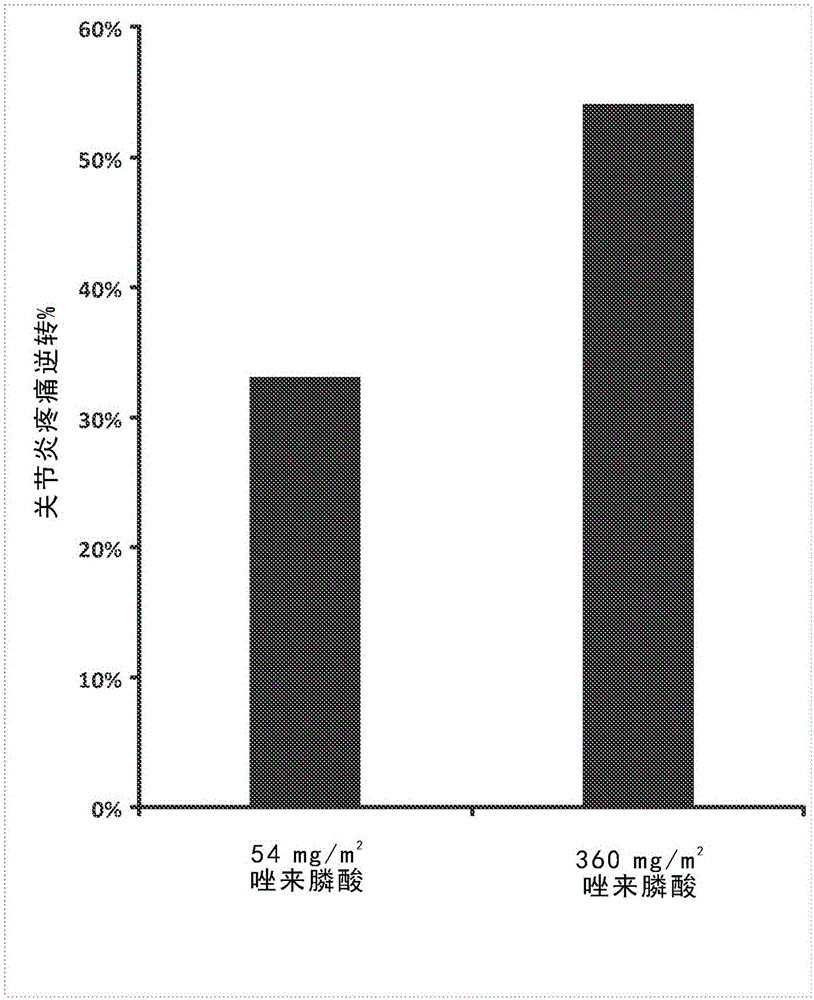
双膦酸类化合物(Bisphosphonates)是有效的破骨细胞活性抑制剂,在临床上用于治疗骨相关病症,例如骨质疏松症和骨的佩吉特氏病(Paget’sdisease);和癌症相关病症,包括多发性骨髓瘤和实体瘤骨转移。它们通常具有低口服生物利用率。斑片状骨质疏松症和骨髓水肿可起因于破骨细胞过度活跃。唑来膦酸(Zoledronicacid)是骨吸收和破骨细胞活性的有效抑制剂。含氮的双膦酸类化合物(例如唑来膦酸)还抑制破骨细胞中的甲羟戊酸通路,从而妨碍正常破骨细胞的功能。已发现双膦酸类化合物(例如唑来膦酸)的口服剂型可用于治疗或缓解疼痛或相关病症。一些实施方式包括提高唑来膦酸的口服生物利用率的方法,所述方法包括经口施用含二钠盐形式的唑来膦酸的剂型。一些实施方式包括含二钠盐形式的唑来膦酸的剂型,其中在哺乳动物中,二钠盐形式的唑来膦酸的生物利用率比相同剂型中二酸形式的唑来膦酸的生物利用率高。一些实施方式包括含唑来膦酸的剂型,其中所述剂型包含一定量的二钠盐形式的唑来膦酸,以使得向被施用所述剂型的人提供约4ng·h/mL至约2000ng·h/mL的唑来膦酸血浆浓度曲线下面积。一些实施方式包括含二钠盐形式的唑来膦酸的剂型,其中相较于唑来膦酸以二酸形式存在时的摩尔量,所述二钠盐形式以更低的摩尔量存在;且其中相较于二酸形式的唑来膦酸,二钠盐形式的唑来膦酸具有提高的生物利用率,以至于剂型中更低摩尔量的二钠盐不会减少递送至哺乳动物血浆的唑来膦酸的量。尽管可使用双膦酸类化合物生物利用率增强的口服剂型,但使用下述包含双膦酸类化合物(例如唑来膦酸)的口服剂型也可为有效的,其中双膦酸类化合物的生物利用率未增强或基本上未增强。一些实施方式包括减轻炎性疼痛的方法,所述方法包括将包含唑来膦酸的口服剂型施用至有此需要的哺乳动物,其中所述哺乳动物在施用所述剂型后超过3小时经历显著的疼痛减轻。一些实施方式包括减轻与关节炎相关的疼痛的方法,所述方法包括将包含唑来膦酸的口服剂型施用至有此需要的人。一些实施方式包括治疗复杂区域性疼痛综合征的方法,所述方法包括将包含唑来膦酸的口服剂型施用至有此需要的哺乳动物。一些实施方式包括包含唑来膦酸的口服剂型,其中唑来膦酸的口服生物利用率基本上未增强。例如,在一些实施方式中,剂型中的口服生物利用率为约0.01%至约4%。一些实施方式包括医药产品,其包含多于一个单位的本文所述口服剂型。在一些实施方式中,每单位所述口服剂型包含约1mg至约50mg唑来膦酸。一些实施方式包括减轻炎性疼痛的方法,所述方法包括将包含唑来膦酸的口服剂型施用至有此需要的哺乳动物。在一些实施方式中,哺乳动物接受约800mg/m2或更少的唑来膦酸月总剂量。在一些实施方式中,基于哺乳动物的体表面积,所述剂型包含约10mg/m2至约20mg/m2。一些实施方式包括减轻炎性疼痛的方法,所述方法包括将唑来膦酸经口施用至有此需要的哺乳动物。在一些实施方式中,基于哺乳动物的体表面积,每月施用约300mg/m2至约600mg/m2的唑来膦酸。在一些实施方式中,基于哺乳动物的体表面积,每月施用约50mg/m2至约600mg/m2的唑来膦酸。附图简介图1为使用三种不同剂量的唑来膦酸时炎性疼痛大鼠模型中疼痛受压阈值的图线。在指示的天数处,在基线(BL)处和给药后各个时间点处进行测量。图2A为示出两种不同剂量的唑来膦酸在关节炎疼痛大鼠模型中的关节炎疼痛逆转的图。图2B为示出两种不同剂量的唑来膦酸在关节炎疼痛大鼠模型中的疼痛阈值的图。图3为汇总用媒介物和唑来膦酸治疗的大鼠在复杂区域性疼痛综合征大鼠模型中的结果的图。图4示出用媒介物和唑来膦酸治疗的大鼠在复杂区域性疼痛综合征大鼠模型中的后爪疼痛阈值。图5示出用媒介物和唑来膦酸治疗的大鼠在复杂区域性疼痛综合征大鼠模型中的荷重。图6示出用媒介物和唑来膦酸治疗的大鼠在复杂区域性疼痛综合征大鼠模型中的爪厚度变化。图7示出唑来膦酸二钠四水合物与二酸形式的唑来膦酸相比的水溶性。图8示出:施用150mg二钠盐形式的唑来膦酸和二酸形式的唑来膦酸之后,随着时间推移,狗中唑来膦酸的血浆浓度。图9示出含二钠盐形式的唑来膦酸的剂型与含二酸形式的唑来膦酸的剂型相比的压缩性(compressibility)。图10示出:与安慰剂相比,在利用唑来膦酸治疗具有膝部骨关节炎、骨髓病变和不同程度关节间隙狭窄的患者3个月时,VAS疼痛评分的变化。图11示出:与基线相比,在利用唑来膦酸治疗具有膝部骨关节炎、骨髓病变和不同程度关节间隙狭窄的患者3个月时,VAS疼痛评分的变化。图12示出:与安慰剂相比,在利用唑来膦酸治疗不同亚组的具有膝部骨关节炎和骨髓病变的患者3个月时,VAS疼痛评分的变化。图13示出:与安慰剂相比,在利用唑来膦酸治疗具有膝部骨关节炎、骨髓病变和不同程度关节间隙狭窄的患者6个月时,BML病变大小的变化。详细说明破骨细胞活性抑制剂包括双膦酸类化合物,例如帕米膦酸盐或帕米膦酸、奈立膦酸盐或奈立膦酸、奥帕膦酸盐或奥帕膦酸、阿仑膦酸盐或阿仑膦酸、英卡膦酸盐或英卡膦酸、伊班膦酸盐或伊班膦酸、利塞膦酸盐或利塞膦酸、斯孟膦酸盐(cimadronate)或斯孟膦酸(cimadronicacid)、唑来膦酸盐或唑来膦酸、依替膦酸盐或依替膦酸、氯膦酸盐或氯膦酸、替鲁膦酸盐或替鲁膦酸等。RANK/RANKL拮抗剂可以是破骨细胞活性抑制剂,RANK/RANKL拮抗剂包括但不限于OPG(骨保护素)或其变体、抗-RANKL抗体例如狄诺塞麦(denosumab,一种单克隆抗-RANKL抗体)、小干扰RNA、微RNA、前体分子、核酶、反义核酸或适配子靶向RANKL。抗体例如AB-25E9、小分子、小干扰RNA、微RNA、前体分子、核酶、反义核酸或靶向细胞表面蛋白Siglec-15的适配子可以是破骨细胞抑制剂。一些布鲁顿氏酪氨酸激酶(Bruton′styrosinekinase,BTK)抑制剂可以是破骨细胞活性抑制剂。BTK抑制剂可包括ONO-4059;依鲁替尼(ibrutinib);苯并[b]噻吩-2-甲酰胺、N-[3-[6-[[4-[(2R)-1,4-二甲基-3-氧代-2-哌嗪基]苯基]氨基]-4,5-二氢-4-甲基-5-氧代-2-哌嗪基]-2-甲基苯基]-4,5,6,7-四氢-(GDC-0834);RN-486;苯甲酰胺、4-(1,1-二甲基乙基)-N-[3-[8-(苯基氨基)咪唑并[1,2-a]吡嗪-6-基]苯基]-(CGI-560);苯甲酰胺、N-[3-[4,5-二氢-4-甲基-6-[[4-(4-吗啉基羰基)苯基]氨基]-5-氧代-2-哌嗪基]-2-甲基苯基]-4-(1,1-二甲基乙基)-(CGI-1746CAS登记号:910232-84-7);HM-71224;2-丙烯酰胺、N-[3-[[5-氟-2-[[4-(2-甲氧基乙氧基)苯基]氨基]-4-嘧啶基]氨基]苯基]-(CC-292,CAS登记号:1202757-89-8);2-吡啶甲酰胺、4-[4-[[5-氟-4-[[3-[(1-氧代-2-丙烯-1-基)氨基]苯基]氨基]-2-嘧啶基]氨基]苯氧基]-N-甲基-(CNX-774,CAS登记号:1202759-32-7)、AVL-101(CAS登记号:1552307-34-2)、AVL-291(CAS登记号:1552307-35-3)、和AVL-292(CAS登记号:1552307-36-4)、[N-(2-氯-6-甲基苯基)-2-(6-(4-(2-羟乙基)哌嗪-1-基)-2-甲基嘧啶-4-基氨基)噻唑-5-甲酰胺](达沙替尼,dasatinib)、α-氰基-β-羟基-β-甲基-N-(2,5-溴苯基)丙烯酰胺(LFM-A13)、和ONO-WG-307。破骨细胞活性抑制剂可用于大量医疗用途,例如治疗不期望的病症或疾病,包括减轻疼痛。这在许多情况下可通过施用口服剂型来实现。一般而言,将包含双膦酸类化合物(例如唑来膦酸)的口服剂型经口施用至哺乳动物例如人至少一次,以治疗疾病或病症或减轻疼痛。以下化合物也可以是破骨细胞抑制剂:术语“治疗”广义上包括任何类型的治疗活动(包括诊断、治愈、缓解或预防人或其它动物的疾病)或以其它方式影响人或其它动物的身体结构或任何机能的任何活动。双膦酸类化合物(例如唑来膦酸)的口服剂型可用于治疗或减轻任何类型的疼痛,包括但不限于炎性疼痛、关节炎疼痛、复杂区域性疼痛综合征、腰尻痛、肌肉骨骼痛、神经性疼痛、慢性疼痛、癌症相关疼痛、急性疼痛、术后疼痛等。在一些情况下,疼痛减轻可为姑息性的,或提供疼痛减轻而与疾病或病症的改善或疾病或病症的基础原因无关。例如,尽管基础疾病可能不会改善或可能继续发展,但罹患该疾病的个体可经历疼痛减轻。在一些实施方式中,可通过施用包含二钠盐形式的唑来膦酸的剂型来治疗这些病症之一,从而实现提高的唑来膦酸生物利用率。这可允许与使用二酸形式相比,使用摩尔量减少的二钠盐。在一些实施方式中,接受治疗的哺乳动物未罹患骨转移。在一些实施方式中,接受治疗的哺乳动物未罹患癌症。在一些实施方式中,接受治疗的哺乳动物未罹患骨质疏松症。例如,唑来膦酸或另一双膦酸类化合物可经口施用以减轻肌肉骨骼痛,包括下背痛以及与以下各项相关的疼痛:类风湿性关节炎、幼年型类风湿性关节炎、骨关节炎、侵蚀性骨关节炎、血清阴性(非类风湿性)关节病、非关节性风湿病、关节周围疾病、中轴性脊柱关节炎(包括强直性脊柱炎)、佩吉特氏病、纤维性结构不良、SAPHO综合征、暂时性髋骨关节炎、椎骨粉碎性骨折、骨质疏松症等。在一些实施方式中,可通过施用包含二钠盐形式的唑来膦酸的剂型来治疗这些病症之一从而实现提高的唑来膦酸生物利用率。这可允许与使用二酸形式相比,使用摩尔量减少的二钠盐。破骨细胞抑制剂,例如双膦酸盐(例如唑来膦酸),还可用于治疗骨折或用于加快骨折愈合。在一些实施方式中,唑来膦酸或另一双膦酸类化合物还可经口施用以减轻神经性疼痛,包括糖尿病性周围神经病变、疱疹后神经痛、三叉神经痛、单一神经根病、幻肢痛和中枢性疼痛。其它神经性疼痛的原因包括癌症相关疼痛、腰神经根受压、脊髓损伤、中风后疼痛、中央多发性硬化症疼痛、HIV相关神经病变以及放射疗法或化学疗法相关的神经病变。在一些实施方式中,可通过施用包含二钠盐形式的唑来膦酸的剂型来治疗这些病症之一从而实现提高的唑来膦酸生物利用率。这可允许与使用二酸形式相比,使用摩尔量减少的二钠盐。在一些实施方式中,唑来膦酸或另一双膦酸类化合物可经口施用以减轻炎性疼痛,包括肌肉骨骼痛、关节炎疼痛和复杂区域性疼痛综合征。在一些实施方式中,可通过施用包含二钠盐形式的唑来膦酸的剂型来治疗这些病症之一,从而实现提高的唑来膦酸生物利用率。这可允许与使用二酸形式相比,使用摩尔量减少的二钠盐。肌肉骨骼痛的实例包括下背痛,以及与以下各项相关的疼痛:椎骨粉碎性骨折、纤维性结构不良、成骨不全症、骨的佩吉特氏病、暂时性骨质疏松症和暂时性髋骨质疏松症。关节炎是指可与疼痛相关的炎性关节疾病。关节炎疼痛的实例包括与以下各项相关的疼痛:骨关节炎、侵蚀性骨关节炎、类风湿性关节炎、幼年型类风湿性关节炎、血清阴性(非类风湿性)关节病、非关节性风湿病、关节周围疾病、神经性关节病(包括夏科氏足(Charcot’sfoot))、中轴性脊柱关节炎(包括强直性脊柱炎)和SAPHO综合征。在一些实施方式中,接受用破骨细胞抑制剂(例如双膦酸类化合物,例如唑来膦酸的口服剂型)治疗疾病或病症(例如炎性病症,例如关节炎)的人的年龄为约10岁至约90岁、约20岁至约80岁、约30岁至约75岁、约40岁至约70岁、约1岁至约16岁、或约80岁至约95岁。在一些实施方式中,接受用破骨细胞抑制剂(例如双膦酸类化合物,例如唑来膦酸的口服剂型)治疗疾病或病症(例如炎性病症,例如关节炎)的人已罹患关节炎至少1个月、至少2个月、至少6个月或至少1年。在一些实施方式中,关节炎影响膝、肘、指、腕、肩、踝、脊柱或髋。对于治疗关节炎或关节疼痛(例如膝痛),在一些实施方式中,接受治疗的人具有OARSI0级或者KellgrenandLawrence0或1级的关节间隙狭窄。在一些实施方式中,所述人具有病变,例如骨髓病变。在一些实施方式中,接受骨髓病变治疗的人具有正常关节间隙膝痛、OARSI0级或者KellgrenandLawrence0级或1级的关节间隙狭窄。在一些实施方式中,所述人具有使用0-10的数值评定量表(NRS)测量的5或者更高的基线疼痛强度,或者使用100mm视觉模拟量表(VAS)测量的50mm或更高的基线疼痛强度。在一些实施方式中,接受疼痛治疗的人具有正常关节间隙膝痛、OARSI0级或者KellgrenandLawrence0级或1级的关节间隙狭窄。基于磁共振成像(MRI),骨髓病变(BMLs)包括区域性骨髓信号强度改变。BMLs可存在于膝中并且可以是膝部骨关节炎的重要特征。BMLs还已在其它风湿性病症(例如类风湿性关节炎、骨坏死、强直性脊柱炎和髋关节暂时性骨质疏松症)中被描述且通常被称为骨髓水肿(BME)。在一些实施方式中,接受关节炎治疗(例如用唑来膦酸治疗)的人具有与骨髓病变相关的膝骨关节炎。在一些实施方式中,破骨细胞活性抑制剂可用于治疗骨髓病变。在一些实施方式中,破骨细胞活性抑制剂可用于治疗膝、肩、踝、腕、手、指、脊柱或髋的骨髓病变。疼痛强度的常用测量包括视觉模拟量表(VAS)和数值评定量表(NRS)。利用VAS方法,患者通过在10-cm(或100mm)VAS(0=无疼痛且10=可能最严重的疼痛)上标记点来评价他们的疼痛严重程度。利用NRS方法,患者通过口头应答10点NRS(0=无疼痛且10=可能的最严重的疼痛)来评价他们的疼痛严重程度。VAS评分和NRS评分显示出强烈的相关性(回归线斜率为1.01),这表明在10-cmVAS上的评分等同于在10点NRS上的相同评分(BijurPE等人AcadEmergMed2003;10:390-392)。例如,VAS评分为5cm(或50mm)等同于NRS评分为5。VAS评分为5cm或50mm或更高,或者NRS评分为5或更高的人的膝痛在本文中可被称为中度至重度膝痛。在一些实施方式中,罹患疼痛、炎症、类似病症或本文所述任何病症的患者具有5或更高的NRS,或者5cm或更高的VAS。在一些实施方式中,患者具有4或更高的NRS,或者4cm或更高的VAS。在一些实施方式中,患者具有6或更高的NRS,或者6cm或更高的VAS。在一些实施方式中,患者具有7或更高的NRS,或者7cm或更高的VAS。在一些实施方式中,患者具有约1、约2、约3、约4、约5、约6、约7、约8、约9或约10的NRS。在一些实施方式中,患者具有约1cm、约2cm、约3cm、约4cm、约5cm、约6cm、约7cm、约8cm、约9cm或约10cm的VAS。对于膝痛或者与骨髓病变相关的疼痛,在一些实施方式中,用含氮的双膦酸类化合物(例如唑来膦酸)治疗可使利用100mm量表测量的视觉模拟量表(VAS)疼痛评分减少至少约5mm、至少约8mm、至少约10mm、至少约15mm、至多约50mm、或至多约100mm。在一些实施方式中,相较于安慰剂,VAS评分可减少至少约5mm、至少约8mm、至少约10mm、至少约15mm、至多约50mm、或至多约100mm。用含氮的双膦酸类化合物(例如唑来膦酸)治疗可使利用0-10量表测量的数值评定量表(NRS)疼痛评分减少至少约0.1、至少约0.5、至少约0.8、至少约1、至少约1.5、至多约5、或至多约10。在一些实施方式中,相较于安慰剂,NRS评分可减少至少约0.1、至少约0.5、至少约0.8、至少约1、至少约1.5、至多约5、或至多约10。在一些实施方式中,破骨细胞活性抑制剂可用于减少骨髓病变的大小。病变面积可被测量为所有病变的总面积或者任何一种病变的面积。在一些实施方式中,总面积包括胫骨内侧面积、股骨内侧面积、胫骨外侧面积和股骨外侧面积。在一些实施方式中,骨髓病变位于髌骨中。在一些实施方式中,使用破骨细胞活性抑制剂实现了骨髓病变的总面积减少至少约240mm2。在一些实施方式中,总面积减少了至少约220mm2、至少约200mm2、至少约150mm2、至少约100mm2或至少约50mm2。在一些实施方式中,骨髓病变大小的减少表示相对于基线减少至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、或至少约100%。在一些实施方式中,骨髓病变面积的减少表示相对于安慰剂改善至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约100%、至少约120%、至少约150%、至少约170%、至少约200%、至少约250%、至少约300%、至少约350%、至少约400%或至少约450%。在一些实施方式中,使用破骨细胞活性抑制剂能够抑制骨髓病变的大小随时间增加。通常使用国际骨关节炎研究学会(OARSI)数据集标准或者KellgrenandLawrence(K/L)系统对关节间隙狭窄(JSN)进行评级。OARSI数据集标准使用0-3的量表对JSN进行评级,其中0级表示不存在JSN,1级、2级和3级分别表示轻度JSN、中度JSN和重度JSN(Altman和Gold,OsteoarthritisCartilage2007;15(SupplA):A1-A56)。K/L系统使用0-4的量表对JSN进行评级,其中0级表示不存在JSN,1级表示不确定的JSN,2级、3级和4级分别表示轻微JSN、中度JSN和重度JSN(Kellgren和Lawrence,AnnRheumDis1957;16:494-502)。基于这些标准,OARSI0级(不存在JSN)近似于K/L0-1级(不存在JSN或不确定是否存在JSN)。出现疼痛的膝中具有OARSI0级或K/L0-1级的JSN的人的膝痛在本文中可被称为“正常关节间隙膝痛”。在一些实施方式中,对于具有OARSI0级或K/L0-1级的JSN的患者,使用破骨细胞活性抑制剂实现了骨髓病变的总面积减少至少约240mm2。在一些实施方式中,总面积减少了至少约220mm2、至少约200mm2、至少约150mm2、至少约100mm2或至少约50mm2。在一些实施方式中,骨髓病变大小的减少表示相对于基线减少至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、或至少约100%。在一些实施方式中,骨髓病变面积的减少表示相对于安慰剂改善至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约100%、至少约120%、至少约150%、至少约170%、至少约200%、至少约250%、至少约300%、至少约350%、至少约400%或至少约450%。在一些实施方式中,使用破骨细胞活性抑制剂能够抑制骨髓病变的大小随时间增加。在一些实施方式中,对于具有OARSI1-2级或K/L2-4级的JSN的患者,使用破骨细胞活性抑制剂实现了骨髓病变的总面积减少至少约100mm2。在一些实施方式中,总面积减少了至少约50mm2、至少约60mm2、至少约80mm2、至少约85mm2、至少约90mm2、至少约100mm2、至少约105mm2、至少约110mm2或至少约115mm2。在一些实施方式中,骨髓病变大小的减少表示相对于基线减少至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、或至少约100%。在一些实施方式中,骨髓病变面积的减少表示相对于安慰剂改善至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约100%、至少约115%、至少约125%、至少约135%、至少约150%、至少约170%、至少约200%、至少约250%、至少约300%、至少约350%、至少约400%或至少约450%。在一些实施方式中,使用破骨细胞活性抑制剂能够抑制骨髓病变的大小随时间增加。在一些实施方式中,破骨细胞活性抑制剂(例如含氮的双膦酸类化合物,包括例如唑来膦酸、米诺膦酸等)被用于治疗纤维肌痛。根据一些实施方式,施用破骨细胞活性抑制剂能够实现疼痛减轻,所述疼痛减持续至少约1个月、2个月、3个月、4个月、6个月、或甚至至少约12个月。根据一些实施方式,施用破骨细胞活性抑制剂能够实现疼痛减轻,所述疼痛减轻是在施用破骨细胞活性抑制剂后大于3小时时、约1天时、约2天至约5天时、约1周时、约2周时、约3周时、约1个月时、约5周时、约6周时、约7周时、约2个月时、约9周时、约10周时、约11周时、约3个月时、约4个月时、约6个月时或约12个月时观察到的。根据一些实施方式,施用破骨细胞活性抑制剂能够实现疼痛减轻,所述疼痛减轻是在大于3小时时,但在1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、4个月、5个月或6个月时或之前观察到的。根据一些实施方式,施用破骨细胞活性抑制剂能够实现疼痛减轻,所述疼痛减轻是在大于3小时时观察到的,且持续时间不多于约3个月、不多于约4个月、不多于约5个月、或不多于约6个月。根据一些实施方式,施用破骨细胞活性抑制剂之后,骨髓病变的面积相对于施用之前的大小持续长达3个月、4个月、5个月、6个月、或甚至长达12个月或更久保持减少。根据一些实施方式,施用破骨细胞活性抑制剂之后,骨髓病变的面积相对于施用之前的大小在约3个月时、在约4个月时、在约5个月时、在约6个月时、或在约12个月时减少。根据一些实施方式,施用破骨细胞活性抑制剂之后,VESC或Modic变化的大小相对于施用之前的大小持续长达3个月、4个月、5个月、6个月、或甚至长达12个月或更久保持减少。根据一些实施方式,施用破骨细胞活性抑制剂之后,VESC或Modic变化的大小相对于施用之前的大小在约3个月时、在约4个月时、在约5个月时、在约6个月时、或在约12个月时减少。在一些实施方式中,可施用破骨细胞抑制剂(例如含氮的双膦酸类化合物,例如唑来膦酸、伊班膦酸或米诺膦酸)以减轻复杂区域性疼痛综合征例如I型复杂区域性疼痛综合征(CRPS-I)、II型复杂区域性疼痛综合征(CRPS-II)、CRPS-NOS、或另一类型的CRPS。在一些实施方式中,可经口施用唑来膦酸或其它双膦酸类化合物以减轻复杂区域性疼痛综合征例如I型复杂区域性疼痛综合征(CRPS-I)、II型复杂区域性疼痛综合征(CRPS-II)、CRPS-NOS、或另一类型的CRPS。CRPS为一种类型的炎性疼痛。CRPS也可具有神经性病变成分。复杂区域性疼痛综合征是一种衰竭性疼痛综合征。其特征在于肢体的严重疼痛,可伴随有浮肿、自主性变化、运动性变化和感觉变化。在一些实施方式中,对于罹患疼痛、炎症、类似病症或本文所述任何病症的患者,可使用破骨细胞抑制剂(例如含氮的双膦酸类化合物,例如唑来膦酸或米诺膦酸)以减少非类固醇抗炎药物(NSAID)、阿片类药物或其它疼痛药物的使用。例如,NSAID、阿片类药物或其它疼痛药物的使用相较于不施用破骨细胞抑制剂时NSAID、阿片类药物或其它疼痛药物的使用可减少至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约60%、至少约70%、至少约80%、或至少约90%、直至约100%。阿片类药物、NSAID或其它疼痛药物的使用相较于在基线时NSAID、阿片类药物或其它疼痛药物的使用可减少至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约60%、至少约70%、至少约80%、或至少约90%、直至约100%。在施用破骨细胞抑制剂之后约1周、约2周、约3周、约1个月、约2个月、约3个月、约4个月、约5个月、约6个月、约7个月、约8个月、约9个月、约10个月、约11个月、或约1年或更长时间时,可观察到NSAID、阿片类药物或其它疼痛药物的使用减少。对于使用口服唑来膦酸以减轻与炎性病症相关的疼痛而言,疼痛减轻可为短期的,例如施用剂型后持续几小时的时段,和/或疼痛减轻可为长期的,例如经口施用唑来膦酸后持续几天、几周或甚至几个月。在一些实施方式中,哺乳动物(例如人)在施用包含唑来膦酸的口服剂型后的至少约3小时、至少约6小时、至少约12小时、至少约24小时、至少约48小时、至少约1周、至少约2周、至少约3周经历显著的疼痛减轻。在一些实施方式中,哺乳动物(例如人)在施用包含唑来膦酸的口服剂型后的约3小时至约2周、约3小时至约3周、约3小时至约24小时、约6小时至约2周或约6小时至约24小时、约3天至约2周、约6天至约2周的时间的至少一部分期间经历显著的疼痛减轻。在一些实施方式中,接受治疗的人在施用最近剂量的破骨细胞抑制剂(例如唑来膦酸)之后的3个月、6个月、9个月、或1年时具有显著的疼痛减轻。对于治疗本文所述的任何病症而言,在一些实施方式中,施用包含唑来膦酸的第一口服剂型并施用包口服含唑来膦酸的第二口服剂型。施用两种剂型的时机可以是这样的以使得:相对于第一口服剂型,第二口服剂型相对于第一口服剂型,在5xTmax或更晚时(例如,如果Tmax为1小时,在5小时或更晚时)、至少10xTmax或更晚时、至少约15xTmax或更晚时、至少约20xTmax或更晚时、至少约50xTmax或更晚时、或至少约200xTmax或更晚时施用第二口服剂型,其中Tmax是第一口服剂型的最大血浆浓度的时间。一些实施方式包括治疗本文所述的病症,例如炎性疼痛、关节炎或复杂区域性疼痛综合征,其中治疗包括:向哺乳动物施用仅一种剂型以治疗病症;或者向哺乳动物施用第一剂型,随后向哺乳动物施用第二剂型。如果施用两种或更多种剂型,则在获得第一口服剂型的最大疼痛减轻效果之前,或者在接受第一口服剂型的哺乳动物经历该剂型的最大疼痛减轻效果之前,施用第二口服剂型。在一些实施方式中,在获得可察觉的疼痛减轻效果之前施用第二口服剂型。在一些实施方式中,在施用第一剂型后的约12小时至约60天、约24小时至约28天、约24小时至约7天、约24小时至约14天、或约24小时至约21天,施用第二口服剂型。一些实施方式包括治疗本文所述的病症,例如炎性疼痛、关节炎或复杂区域性疼痛综合征,其中治疗包括:向哺乳动物施用第一剂型,随后向哺乳动物施用第二剂型,其中在获得第一口服剂型的最大疼痛减轻效果之后施用第二剂型,且在哺乳动物仍然经历来自第一口服剂型的疼痛减轻时,或者在来自第一口服剂型的疼痛减轻效果可察觉时,施用第二口服剂型。在一些实施方式中,在施用第一剂型后的约12小时至约60天、约24小时至约28天、约24小时至约7天、约24小时至约14天、或约24小时至约21天,施用第二口服剂型。唑来膦酸或另一双膦酸类化合物还可经口施用以减轻癌症相关疼痛,包括与多发性骨髓瘤和实体瘤骨转移相关的疼痛。在一些实施方式中,唑来膦酸用于治疗并非癌症相关疼痛的疼痛。例如,唑来膦酸可用于治疗与以下各项不相关的疼痛:多发性骨髓瘤、实体瘤骨转移、恶性高钙血症、骨巨细胞瘤、血癌或白血病或实体瘤或癌症。在一些实施方式中,可通过施用包含二钠盐形式的唑来膦酸的剂型来治疗这些病症之一从而实现提高的唑来膦酸生物利用率。这可允许与使用二酸形式相比,使用摩尔量减少的二钠盐。除了减轻疼痛之外,经口施用唑来膦酸或另一双膦酸类化合物还可用于治疗包括或不包括疼痛成分的疾病或病症。例如,唑来膦酸或另一双膦酸类化合物可用于治疗上文列出的任何疼痛病症或病症类型,包括并非单纯减轻这些病症的疼痛的治疗,和以治疗病症而不发生疼痛减轻的方式进行的治疗。除了唑来膦酸或另一双膦酸类化合物可提供或不可提供的任何疼痛减轻之外,唑来膦酸或另一双膦酸类化合物可用于治疗诸如以下的疾病或病症:代谢疾病或病症;炎性疾病或病症,包括与疼痛不相关的炎性疾病或病症;癌症疾病或病症;神经疾病或病症;等等。在一些实施方式中,可通过施用包含二钠盐形式的唑来膦酸的剂型来治疗这些病症之一,从而实现提高的唑来膦酸生物利用率。这可允许与使用二酸形式相比,使用摩尔量减少的二钠盐。在一些实施方式中,经口施用唑来膦酸或其它双膦酸盐还可用于治疗复杂区域性疼痛综合征、类风湿性关节炎、骨关节炎、侵蚀性骨关节炎、中轴性脊柱关节炎(包括强直性脊柱炎)、急性椎骨粉碎性骨折、纤维性结构不良、SAPHO综合征、骨质疏松症、暂时性骨质疏松症或暂时性髋骨质疏松症。在一些实施方式中,可通过施用包含二钠盐形式的唑来膦酸的剂型来治疗这些病症之一,从而实现提高的唑来膦酸生物利用率。这可允许与使用二酸形式相比,使用摩尔量减少的二钠盐。在一些实施方式中,经口施用唑来膦酸或其它双膦酸盐还可用于治疗恶性高钙血症、多发性骨髓瘤、实体瘤骨转移、骨的佩吉特氏病、骨巨细胞瘤、血癌或白血病或实体瘤或癌症。在一些实施方式中,可通过施用包含二钠盐形式的唑来膦酸的剂型来治疗这些病症之一从而实现提高的唑来膦酸生物利用率。这可允许与使用二酸形式相比,使用摩尔量减少的二钠盐。一些含氮的双膦酸类化合物可以用式A表示:对于式A而言,R1为F、Cl、Br、H或OH。在一些实施方式中,R1为OH。对于式A而言,R2为氨基烷基,例如氨基乙基、氨基丙基、氨基戊基、二甲基氨基乙基、甲基戊基氨基乙基等;或任选取代的杂环烷基,例如任选取代的咪唑基甲基、任选取代的吡啶基甲基等。在一些实施方式中,R2为任选取代的咪唑基烷基。除非另外指明,当化合物或化学结构特征(例如杂环烷基)被称为“任选取代的”时,其包括无取代基的特征(即未取代的),或者经取代的特征,这意味着该特征具有一个或更多个取代基。术语“取代基”具有本领域普通技术人员已知的最广泛的含义,包括替代母体化合物或结构特征中的一个或多个氢原子的片段。术语“替代”在本文中仅仅是为了方便而使用,其不要求化合物是通过一个原子被另一个原子替代而形成的。在一些实施方式中,取代基可以是本领域已知的任何普通有机片段,其可以具有15g/mol至50g/mol、15g/mol至100g/mol、15g/mol至150g/mol、15g/mol至200g/mol、15g/mol至300g/mol或者15g/mol至500g/mol的分子量(例如取代基的原子的原子质量的总和)。在一些实施方式中,取代基包含:0-30、0-20、0-10或0-5个碳原子;和0-30、0-20、0-10或0-5个杂原子,或者由前述原子组成,其中每个杂原子可独立地为N、O、P、S、Si、F、Cl、Br或I;前提条件是取代基包含一个C、N、O、P、S、Si、F、Cl、Br或I原子。在一些实施方式中,取代基可独立地具有约15Da至约600Da的分子量并且可由2-5种化学元素组成,其中所述化学元素可独立地为C、H、O、N、P、S、Si、F、Cl或Br。在一些实施方式中,取代基是任选取代的烷基、-O-烷基(例如-OCH3、-OC2H5、-OC3H7、-OC4H9等)、-S-烷基(例如-SCH3、-SC2H5、-SC3H7、-SC4H9等)、-NR’R”、-OH、-SH、-CN、-CF3、-NO2、全氟烷基、任选取代的芳基、任选取代的杂芳基、任选取代的胺或卤素,其中R’和R”独立地为H或任选取代的烷基。只要取代基被描述为“任选取代的”,该取代基便可被上述取代基取代。为了方便起见,对于分子的片段或部分而言,使用术语“分子量”来表示分子的片段或部分中原子的原子质量的总和,即便它可能不是完整的分子亦是如此。含氮的双膦酸类化合物的实例包括但不限于帕米膦酸、英卡膦酸、伊班膦酸、利塞膦酸、米诺膦酸、斯孟膦酸、奈立膦酸、阿仑膦酸、奥帕膦酸、唑来膦酸等。唑来膦酸具有下面示出的结构,其也被称作唑来膦酸类化合物。除非另外指明,通过结构、名称或任何其它方式对本文中化合物(例如唑来膦酸)的提及包括:可药用的盐,例如二钠盐;替代性的固体形式,例如多晶型物、溶剂合物、水合物等;互变异构体;或在如本文所述使用化合物的条件下可迅速转化成该化合物的任何其它化学物质。在一些实施方式中,唑来膦酸以包含盐形式(例如唑来膦酸二价阴离子盐)的剂型施用。在一些实施方式中,唑来膦酸以包含唑来膦酸二钠盐形式的剂型施用。在一些实施方式中,唑来膦酸以钠盐形式(例如一钠盐、二钠盐、三钠盐等)施用。在一些情况下,使用二钠盐可能是期望的。例如,二钠盐与二酸形式相比更溶于水。因此,在一些工艺中,二钠盐与二酸形式相比更易于处理。另外,钠盐与二酸形式相比可具有更高的生物利用率和/或在口服时可被更迅速地吸收。下面示出了化合物1的盐的实例:其中X-为任何合适的阴离子,例如F-、Br-、Cl-、I-、OH-、乙酸根等;且M+为任何合适的阳离子,例如Na+、K+、NH4+等。也可以是许多其它盐形式。在一些实施方式中,可以另外用下式来表示化合物1:在一些实施方式中,化合物1可以呈水合物形式。在一些实施方式中,化合物1以包含化合物1的盐形式(例如,阳离子、单价阴离子、二价阴离子、三价阴离子的盐,或两性离子形式等)的剂型施用。化合物1可以以任何量存在,例如基于组合物中存在的唑来膦酸、化合物1和化合物2的总量,少于约100重量/重量%、少于约50重量/重量%、少于约20重量/重量%、少于约10重量/重量%、少于约1重量/重量%、少于约0.1重量/重量%、少于约0.07重量/重量%、少于约0.05重量/重量%、少于约0.04重量/重量%、少于约0.03重量/重量%、少于约0.02重量/重量%;且/或多于0重量/重量%、至少约0.00000001重量/重量%、至少约0.000001重量/重量%、或至少约0.00001重量/重量%。下面示出了化合物2的盐的实例:其中X-为任何合适的阴离子,例如F-、Br-、Cl-、I-、OH-、乙酸盐等;且M+为任何合适的阳离子,例如Na+、K+、NH4+等。也可以是许多其它盐形式。在一些实施方式中,可以另外用下式来表示化合物2:在一些实施方式中,化合物2可以呈水合物形式。在一些实施方式中,化合物2以包含化合物2的盐形式(例如,阳离子、单价阴离子、二价阴离子、三价阴离子的盐,或两性离子形式等)的剂型施用。化合物2可以以任何量存在,例如基于组合物中存在的唑来膦酸、化合物1和化合物2的总量,少于约100重量/重量%、少于约50重量/重量%、少于约20重量/重量%、少于约10重量/重量%、少于约1重量/重量%、少于约0.3重量/重量%、少于约0.2重量/重量%、少于约0.1重量/重量%、少于约0.08重量/重量%、少于约0.07重量/重量%、少于约0.05重量/重量%、少于约0.04重量/重量%、少于约0.03重量/重量%、少于约0.02重量/重量%;且/或多于0重量/重量%、至少约00000001重量/重量%、至少约0.000001重量/重量%、或至少约0.00001%重量/重量%。在一些实施方式中,化合物1和化合物2的存在量少于0.1重量/重量%。在一些实施方式中,向有此需要的患者或哺乳动物施用破骨细胞抑制剂(例如含氮的双膦酸类化合物,包括例如唑来膦酸、米诺膦酸等)影响Modic变化(MC)。例如,任何上述化合物均可用于治疗Modic变化、或利用磁共振成像(MRI)可见的骨髓变化和椎体终板信号变化(VESC)、或与Modic变化相关的颈痛或背痛。在本文中使用时,Modic变化包括其在本领域中的通常含义,指的是利用磁共振成像(MRI)可见的病理性椎体终板和骨髓变化。Modic变化也可被称为椎体终板信号变化(VESC)。Modic变化可被分成各种类型,包括1型(M1)、2型(M2)和3型(M3)病变或变化,其中任何一种均可使用破骨细胞抑制剂(例如含氮的双膦酸类化合物,包括例如唑来膦酸、米诺膦酸等)来治疗。同一患者中可存在不同类型的Modic变化,例如1型Modic变化和2型Modic变化(M1/2)。在某些情况下,M1变化而非其它类型的Modic变化与下背痛有关。VESC可在具有不同类型下背痛的患者中发现,所述下背痛包括但不限于脊椎炎、创伤、脊椎关节病(包括强直性脊柱炎)、许莫氏结节(Schmorl’snodes)、骨折、肿瘤和脊髓梗死。强直性脊柱炎病变包括骨炎和椎间盘炎,其可利用MRI或其它医学成像仪器来检测。Modic变化可在颈椎、胸椎、腰椎和骶椎中发现。Modic变化可被发现处于各种脊椎水平例如处于C1/2、C2/3、C3/4、C4/5、C5/6、C6/7、C7/T1、T1/2、T2/3、T3/4、T4/5、T5/6、T6/7、T7/8、T8/9、T9/10、T10/11、T11/12、T12/L1、L1/2、L2/3、L3/4、L4/5、L5/S1等,其中任何一种均可使用破骨细胞抑制剂(例如含氮的双膦酸类化合物,包括例如唑来膦酸、米诺膦酸等)来治疗。在一些实施方式中,接受治疗的Modic变化位于L2/3处。在一些实施方式中,接受治疗的Modic变化位于L3/4处。在一些实施方式中,接受治疗的Modic变化位于L4/5处。在一些实施方式中,接受治疗的Modic变化位于L5/S1处。在一些实施方式中,接受治疗的Modic变化位于C3/4处。在一些实施方式中,接受治疗的Modic变化位于C4/5处。在一些实施方式中,接受治疗的Modic变化位于C5/6处。在一些实施方式中,接受治疗的Modic变化位于C6/7处。在一些实施方式中,接受治疗的Modic变化位于T5/6处。在一些实施方式中,接受治疗的Modic变化位于T6/7处。在一些实施方式中,接受治疗的Modic变化位于T7/8处。在一些实施方式中,接受治疗的Modic变化位于T8/9处。在一些实施方式中,接受治疗的Modic变化位于T9/10处。在一些实施方式中,接受治疗的患者主要具有M1。在一些实施方式中,接受治疗的患者主要具有M1/M2。在一些实施方式中,接受治疗的患者主要具有M2。在一些实施方式中,接受治疗的患者主要具有M3。在一些实施方式中,接受治疗的患者具有的最坏病变类型为M1。在一些实施方式中,接受治疗的患者具有的最坏病变类型为M1/2。在一些实施方式中,接受治疗的患者具有的最坏病变类型为M2。在一些实施方式中,接受治疗的患者具有处于多于2个或更多个水平的Modic变化。在一些实施方式中,接受治疗的患者具有处于3个或更多个水平的Modic变化。在一些实施方式中,相较于治疗具有处于1个水平或2个水平的Modic变化的患者时获得的疼痛减轻,治疗具有处于2个水平或3个水平或更多个水平的Modic变化的患者时获得的疼痛减轻更多。在一些实施方式中,相较于治疗具有处于1个水平的Modic变化的患者时获得的疼痛减轻,治疗具有处于2个水平的Modic变化的患者时获得的疼痛减轻更多。在一些实施方式中,相较于治疗具有处于1个水平的Modic变化的患者时获得的疼痛减轻,治疗具有处于3个水平或更多个水平的Modic变化的患者时获得的疼痛减轻更多。在一些实施方式中,相较于治疗具有处于2个水平的Modic变化的患者时获得的疼痛减轻,治疗具有处于3个水平或更多个水平的Modic变化的患者时获得的疼痛减轻更多。在一些实施方式中,破骨细胞活性抑制剂可用于实现具有下背痛或本文所述的任何其它类型的疼痛或病症的患者的促炎性细胞因子水平降低。在一些实施方式中,当用破骨细胞活性抑制剂(例如含氮的双膦酸类化合物,包括例如唑来膦酸、米诺膦酸等)治疗时,具有较高促炎性细胞因子基线水平的患者可获得较多疼痛减轻。在一些实施方式中,当用破骨细胞活性抑制剂(例如含氮的双膦酸类化合物,包括例如唑来膦酸、米诺膦酸等)治疗时,经历促炎性细胞因子水平降低或较大较低的患者可获得较多疼痛减轻。促炎性细胞因子包括但不限于IL-1、IL-2、IL-3、IL-6、IL-8、IL-10、IL-12、肿瘤坏死α(TNF-α)、干扰素γ等。在一些实施方式中,对有此需要的患者或哺乳动物使用破骨细胞活性抑制剂(例如含氮的双膦酸类化合物,包括例如唑来膦酸、米诺膦酸等)能够实现相对于Modic变化或VESC的基线大小减少至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约30%、至少约90%、或至少约100%。在一些实施方式中,Modic变化或VESC的大小减少代表相对于安慰剂改善至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约100%、至少约120%、至少约150%、至少约170%、至少约200%、至少约250%、至少约300%、至少约350%、至少约400%或至少约450%。在一些实施方式中,使用破骨细胞活性抑制剂能够抑制Modic变化或VESC的大小随时间增加。通过经口施用二钠盐形式的唑来膦酸,可提高唑来膦酸的口服生物利用率。例如,相较于施用二酸形式的唑来膦酸,唑来膦酸的生物利用率可提高至少约10%、至少约20%、至少约30%、至少约50%、且/或直至约100%、或直至约200%。由于二钠盐的生物利用率提高,所以剂型可包含,或者哺乳动物(例如人)可接受,(在摩尔基础上)比以其它方式施用二酸形式的唑来膦酸时更少的二钠盐形式的唑来膦酸。例如,剂型可包含,或者哺乳动物可接受,相较于以其它方式施用二酸形式的唑来膦酸时的量(例如以二酸形式施用时的唑来膦酸的摩尔量),少至少约10摩尔%、少至少约20摩尔%、少至少约40摩尔%、少至少约50摩尔%、且/或直至少约90摩尔%或少约95摩尔%的二钠盐形式的唑来膦酸,以获得相同的唑来膦酸血浆水平。在一些实施方式中,剂型包含,或者哺乳动物(例如人)被施用一定量的二钠盐形式,(在摩尔基础上)所述量具有约0.8nd至约1.2nd或约0.9nd至约1.1nd的值,其中:nd=(ba/bd)(na)其中ba是二酸形式的生物利用率,bd是二钠盐形式的生物利用率,且na是以包含二酸形式的唑来膦酸的剂型施用的二酸的摩尔数。例如,如果二酸形式的生物利用率(ba)为0.01,二钠盐形式(bd)的生物利用率0.015,且剂型通常含有0.001摩尔二酸,则nd会是(0.01/0.015)(0.001摩尔)或者约0.00067摩尔。在一些实施方式中,二钠盐的施用量具有约为nd的值。对于包含比二酸形式的唑来膦酸减少的摩尔量的二钠盐形式的唑来膦酸的口服剂型而言,在一些实施方式中,二钠盐形式的唑来膦酸的生物利用率足够高以至于,如果向哺乳动物施用药物,则哺乳动物血液中存在的唑来膦酸与以二酸形式施用唑来膦酸时存在的唑来膦酸至少一样多。对于包含二钠盐形式的唑来膦酸的口服剂型而言,在一些实施方式中,存在的二钠盐形式的摩尔量比唑来膦酸处于二酸形式时存在的摩尔量更低;且相较于二酸形式的唑来膦酸,二钠盐形式的唑来膦酸具有提高的生物利用率,以至于剂型中更低摩尔量的二钠盐不会减少递送至哺乳动物血浆的唑来膦酸的量。包含唑来膦酸的一些口服剂型具有适合特定哺乳动物种(例如狗、大鼠、人等)的配置和唑来膦酸剂量。这种剂型可具有以一定量存在的唑来膦酸,所述量导致所述特定哺乳动物种中唑来膦酸的血浆浓度曲线下面积(AUC)的期望范围。例如,唑来膦酸剂量和口服剂型的配置可导致:向哺乳动物施用口服剂型之后,唑来膦酸的AUC为约1ng·hr/mL至约700ng·hr/mL、约3ng·hr/mL至约30ng·hr/mL、约3ng·hr/mL至约10ng·hr/mL、约50ng·hr/mL至约700ng·hr/mL、约130ng·hr/mL至约180ng·hr/mL、约300ng·hr/mL至约450ng·hr/mL、约300ng·hr/mL至约350ng·hr/mL、约300ng·hr/mL至约310ng·hr/mL、约340ng·hr/mL至约350ng·hr/mL、约370ng·hr/mL至约420ng·hr/mL、约380ng·hr/mL至约390ng·hr/mL、约405ng·hr/mL至约415ng·hr/mL、约140ng·hr/mL至约160ng·hr/mL、约140ng·hr/mL至约150ng·hr/mL、约150ng·hr/mL至约160ng·hr/mL、约140ng·hr/mL、142ng·hr/mL、约155ng·hr/mL、约305ng·hr/mL、304ng·hr/mL、约345ng·hr/mL、343ng·hr/mL、约385ng·hr/mL、384ng·hr/mL、约410ng·hr/mL、或在这些值中的任何值所界定的范围内或介于这些值中的任何值之间的任何AUC。除非另外指明,AUC指的是计算至最后测量的浓度(AUC(0-t))并外推至无穷(AUC(0-inf))的AUC。具有适合特定哺乳动物种的配置和唑来膦酸剂量的包含唑来膦酸的口服剂型可具有以一定量存在的唑来膦酸,所述量导致:向哺乳动物施用口服剂型之后,唑来膦酸的Cmax为约0.2ng/mL至约300ng/mL、约0.5ng/mL至约5ng/mL、约5ng/mL至约300ng/mL、约5ng/mL至约50ng/mL、约20ng/mL至约50ng/mL、约30ng/mL至约50ng/mL、约50ng/mL至约200ng/mL、约50ng/mL至约150ng/mL、约80ng/mL至约120ng/mL、约90ng/mL至约100ng/mL、约50ng/mL至约200ng/mL、约40ng/mL、约95ng/mL、约97ng/mL、或在这些值中的任何值所界定的范围内或介于这些值中的任何值之间的任何Cmax。具有适合特定哺乳动物种的配置和唑来膦酸剂量的包含唑来膦酸的口服剂型可被配置为使得:向特定哺乳动物种施用口服剂型导致唑来膦酸的Tmax为约0.4小时至约1小时、约0.5小时、或约0.75小时,或在这些值中的任何值所界定的范围内或介于这些值中的任何值之间的任何Tmax。在一些实施方式中,二钠盐形式的唑来膦酸以一定量存在,以使得每次施用二钠盐形式的唑来膦酸,口服剂型向哺乳动物提供约4ng·h/mL至约2000ng·h/mL的唑来膦酸血浆浓度曲线下面积。在一些实施方式中,唑来膦酸以一定量存在,以使得口服剂型在被施用该剂型的哺乳动物中提供约100ng·h/mL至约2000ng·h/mL、约100ng·h/mL至约1000ng·h/mL、约500ng·h/mL至约1000ng·h/mL、或约500ng·h/mL至约700ng·h/mL的唑来膦酸血浆浓度曲线下面积。这种量可适合约每3-4周施用口服剂型一次。在一些实施方式中,唑来膦酸以一定量存在,以使得口服剂型在被施用该剂型的哺乳动物中提供约20ng·h/mL至约700ng·h/mL、约50ng·h/mL至约500ng·h/mL、约50ng·h/mL至约400ng·h/mL、约50ng·h/mL至约300ng·h/mL、约50ng·h/mL至约200ng·h/mL、约100ng·h/mL至约500ng·h/mL、约100ng·h/mL至约400ng·h/mL、约100ng·h/mL至约300ng·h/mL、约100ng·h/mL至约200ng·h/mL、约125ng·h/mL至约500ng·h/mL、约125ng·h/mL至约400ng·h/mL、约125ng·h/mL至约300ng·h/mL、约125ng·h/mL至约200ng·h/mL、或约200ng·h/mL至约300ng·h/mL的唑来膦酸血浆浓度曲线下面积。这种量可适合每周施用口服剂型一次,或适合在一个月期间施用3-5次个体剂量。个体剂量可以每隔一定时间给予,在第一周中给予,或者以在一个月期间提供3-5次剂量的任何其它时间表给予。在一些实施方式中,唑来膦酸以一定量存在,以使得口服剂型在被施用该剂型的哺乳动物中提供约4ng·h/mL至约100ng·h/mL、约10ng·h/mL至约50ng·h/mL、约10ng·h/mL至约30ng·h/mL,20ng·h/mL至约700ng·h/mL、约50ng·h/mL至约500ng·h/mL、约50ng·h/mL至约400ng·h/mL、约50ng·h/mL至约300ng·h/mL、约50ng·h/mL至约200ng·h/mL、约100ng·h/mL至约500ng·h/mL、约100ng.h/mL至约400ng·h/mL、约100ng·h/mL至约300ng·h/mL、约100ng·h/mL至约200ng·h/mL、约125ng·h/mL至约500ng·h/mL、约125ng·h/mL至约400ng·h/mL、约125ng·h/mL至约300ng·h/mL、约125ng·h/mL至约200ng·h/mL、或约200ng·h/mL至约300ng·h/mL的唑来膦酸血浆浓度曲线下面积。这种量可适合每天施用口服剂型。在一些实施方式中,剂型可施用连续的2、3、4、5、6、7、8、9、或10、5-10、或6-10天。相较于肠胃外施用模型(例如静脉内的或皮下的),口服施用唑来膦酸,尤其是口服施用二钠盐形式的唑来膦酸,可导致更持久的药物血浆水平。例如,对于口服施用二钠盐,施用后约24小时或48小时或更长时间,血浆中唑来膦酸的量可显著更高。在一些实施方式中,口服唑来膦酸具有约1或者更高,例如约1至约10、约1至约5、约3至约5、或约3至约4的24小时持续血浆水平因子。在一些实施方式中,唑来膦酸的经口施用剂型具有更高的24小时持续血浆水平因子或48小时持续血浆水平因子,例如是静脉内施用的唑来膦酸的至少1.2倍、至少约2倍、至少约5倍、约1.2倍至约20倍、约2倍至约15倍、约5倍至约10倍、或约8倍至约15倍。通过以下等式来确定“持续血浆水平因子”pf:pf=1000(Ct/Cmax)其中Cmax是施用唑来膦酸之后,唑来膦酸的最大血浆浓度;Ct是感兴趣的时间(例如24小时)时,唑来膦酸的血浆浓度。对于肠胃外施用,Cmax可以为约C0,或者将所有量的药物注射入体内之后的即时浓度。通过使用上述等式中Ct的唑来膦酸血浆浓度,还可以针对其它时间(例如48小时)获得持续血浆水平因子。例如,如果施用后唑来膦酸的最高血浆水平为1000ng/mL且24小时时唑来膦酸的血浆水平为1ng/mL,则24小时持续血浆水平因子为1。具有适合特定哺乳动物种的配置和唑来膦酸剂量的包含唑来膦酸的口服剂型可被配置为使得:唑来膦酸具有约12至约50、约20至约40、约25至约30、约30至约35、约35至约40、约33、约30、约35的12小时持续血浆水平因子,或者在这些值中的任何值所界定的范围内或介于这些值中的任何值之间的任何12小时持续血浆水平因子。具有适合特定哺乳动物种的配置和唑来膦酸剂量的包含唑来膦酸的口服剂型可被配置为使得:唑来膦酸具有约10至约30、约10至约20、约10至约15、约12至约15或16、约15至约20、约14、约12、约15的24小时持续血浆水平因子,或者在这些值中的任何值所界定的范围内或介于这些值中的任何值之间的任何24小时持续血浆水平因子。具有适合特定哺乳动物种的配置和唑来膦酸剂量的包含唑来膦酸的口服剂型可被配置为使得:唑来膦酸具有约6至约20、约8至约15、约9至约12或13、约8至约10、约11至约13、约9、约13的36小时持续血浆水平因子,或者在这些值中的任何值所界定的范围内或介于这些值中的任何值之间的任何24小时持续血浆水平因子。具有适合特定哺乳动物种的配置和唑来膦酸剂量的包含唑来膦酸的口服剂型可被配置为使得:唑来膦酸具有约5至约20、约6至约15、约7或8至约12或13、约8至约10、约11至约13、约8、约12的48小时持续血浆水平因子,或者在这些值中的任何值所界定的范围内或介于这些值中的任何值之间的任何48小时持续血浆水平因子。具有适合特定哺乳动物种的配置和唑来膦酸剂量的包含唑来膦酸的口服剂型可被配置为使得:唑来膦酸具有约4至约20、约5至约10、约5或6至约10或11、约5至约6、约9至约10、约6、约10的72小时持续血浆水平因子,或者在这些值中的任何值所界定的范围内或介于这些值中的任何值之间的任何72小时持续血浆水平因子。具有适合特定哺乳动物种的配置和唑来膦酸剂量的包含唑来膦酸的口服剂型可被配置为使得:特定的哺乳动物种在12小时时具有约0.5ng/mL至约5ng/mL、约1ng/mL至约3ng/mL、约1ng/mL至约2ng/mL、约2ng/mL至约3ng/mL、约3ng/mL至约4ng/mL、约1.2ng/mL、约2.6ng/mL、约3.2ng/mL的唑来膦酸血浆浓度,或者在这些值中的任何值所界定的范围内或介于这些值中的任何值之间的任何血浆浓度。具有适合特定哺乳动物种的配置和唑来膦酸剂量的包含唑来膦酸的口服剂型可被配置为使得:特定的哺乳动物种在24小时时具有约0.2ng/mL至约2ng/mL、约0.5ng/mL至约1.5ng/mL、约0.5ng/mL至约1ng/mL、约1ng/mL至约1.5ng/mL、约0.5ng/mL、约1.0ng/mL、约1.4ng/mL的唑来膦酸血浆浓度,或者在这些值中的任何值所界定的范围内或介于这些值中的任何值之间的任何血浆浓度。具有适合特定哺乳动物种的配置和唑来膦酸剂量的包含唑来膦酸的口服剂型可被配置为使得:特定的哺乳动物种在36小时时具有约0.1ng/mL至约2ng/mL、约0.2ng/mL至约1.5ng/mL、约0.2ng/mL至约0.5ng/mL、约0.5ng/mL至约1ng/mL、约1ng/mL至约1.3ng/mL、约0.3ng/mL、约0.8ng/mL、约1.1ng/mL的唑来膦酸血浆浓度,或者在这些值中的任何值所界定的范围内或介于这些值中的任何值之间的任何血浆浓度。具有适合特定哺乳动物种的配置和唑来膦酸剂量的包含唑来膦酸的口服剂型可被配置为使得:特定的哺乳动物种在48小时时具有约0.1ng/mL至约2ng/mL、约0.2ng/mL至约1.5ng/mL、约0.2ng/mL至约0.5ng/mL、约0.5ng/mL至约0.9ng/mL、约0.9ng/mL至约1.3ng/mL、约0.3ng/mL、约0.7ng/mL、约1.1ng/mL的唑来膦酸血浆浓度,或者在这些值中的任何值所界定的范围内或介于这些值中的任何值之间的任何血浆浓度。具有适合特定哺乳动物种的配置和唑来膦酸剂量的包含唑来膦酸的口服剂型可被配置为使得:特定的哺乳动物种在72小时时具有约0.2ng/mL至约1ng/mL、约0.2ng/mL至约1.5ng/mL、约0.1ng/mL至约0.3ng/mL、约0.3ng/mL至约0.6ng/mL、约0.6ng/mL至约1ng/mL、约0.2ng/mL、约0.5ng/mL、约0.9ng/mL的唑来膦酸血浆浓度,或者在这些值中的任何值所界定的范围内或介于这些值中的任何值之间的任何血浆浓度。具有适合特定哺乳动物种的配置和唑来膦酸剂量的包含唑来膦酸的口服剂型可被配置为使得:特定哺乳动物种中唑来膦酸的消除半衰期为约30小时至约100小时、约40小时至约60小时、约40小时至约50小时、约50小时至约60小时、约42小时、约51小时、约59小时,或者在这些值中的任何值所界定的范围内或介于这些值中的任何值之间的任何半衰期。在本文中使用时,“消除半衰期”指的是使用Win-Nonlin通过非隔室分析获得的表观一级末端血浆消除半衰期(apparentfirst-orderterminalplasmaeliminationhalf-life)。末端血浆消除半衰期是达到伪平衡之后血浆浓度降低至一半所需的时间,而不是消除一半施用剂量所需的时间。对于经口施用的药物,末端血浆消除半衰期可受到药物吸收、以及血浆清除率和分布程度的影响。在一些实施方式中,相较于二酸形式的唑来膦酸,二钠盐形式的唑来膦酸提供生物利用率的提高,所述提高与剂型中的任何生物利用率提高剂所提供的生物利用率的任何提高相叠加。在一些实施方式中,相较于二酸形式的唑来膦酸,二钠盐形式的唑来膦酸提供生物利用率的提高,所述提高大于由剂型中的任何生物利用率提高剂所提供的生物利用率的任何提高。在一些实施方式中,二钠盐形式的唑来膦酸可以以基本上不含生物利用率提高剂的剂型施用。在一些实施方式中,包含唑来膦酸二钠盐的剂型是固体。在一些实施方式中,包含唑来膦酸二钠盐的剂型用于治疗炎性病症。在一些实施方式中,包含唑来膦酸二钠盐的剂型用于治疗关节炎。在一些实施方式中,包含唑来膦酸二钠盐的剂型用于治疗复杂区域性疼痛综合征。在一些实施方式中,唑来膦酸呈具有水溶性的形式,这意指水中溶解度大于1%(重量/体积)、为约5%(重量/体积)至约50%(重量/体积)、为约5%(重量/体积)至约20%(重量/体积)、为约10%(重量/体积)至约15%(重量/体积)或为约12%(重量/体积)至约13%(重量/体积)。二钠盐形式的唑来膦酸可比二酸形式的唑来膦酸更可压缩。这可使得使剂型更容易具有期望的硬度。这还可使得增加载药量更加容易,以便对于给定的剂量强度,可给予更小的片剂。在一些实施方式中,固体剂型的唑来膦酸(例如二酸形式的唑来膦酸或二钠盐形式的唑来膦酸)可具有约5kPa至约20kPa或约5kPa至约14kPa的硬度。唑来膦酸或另一双膦酸盐可与药物载体组合,所述药物载体基于所选施用途径和例如Remington′sPharmaceuticalSciences,2005中所述的标准药学实践进行选择,该文献的公开内容据此以全文引用的方式并入本文。可例如通过化合物的溶解度和化学性质、所选施用途径和标准药学实践来确定活性成分与载体的相对比例。唑来膦酸或另一双膦酸盐可通过可导致(多种)活性剂与患者体内的一个或多个期望作用位点接触的任何方式来施用。所述化合物可通过能够与药物联合使用的任何常规方式进行施用,作为单独的治疗剂或者治疗剂的组合施用。例如,它们可作为药物组合物中唯一的活性剂来施用,或它们可与其它治疗活性成分联合使用。在一些实施方式中,破骨细胞抑制剂与类固醇共同施用。合适的类固醇包括,例如,氢化可的松、醋酸氢化可的松、醋酸可的松、特戊酸硫氢可的松、泼尼松龙、甲基泼尼松龙、泼尼松、曲安奈德缩丙酮、曲安奈德醇、莫米松、安西奈德、布地奈德、地奈德、氟轻松醋酸酯、氟轻松缩丙酮、哈西奈德、倍他米松、倍他米松磷酸钠、地塞米松、地塞米松磷酸钠、氟可龙、17-戊酸氢化可的松、阿氯米松二丙酸酯、戊酸倍他米松、二丙酸倍他米松、泼尼卡酯、氯倍他松-17-丁酸酯、氯倍他索-17-丙酸酯、氟替卡松己酸酯(fluocortilonecaproate)、氟可龙特戊酸酯、和醋酸氟泼尼定、氢化可的松-17-丁酸酯、17-醋丙酯(17-aceponate)、17-丙丁酯(17-buteprate)和泼尼卡酯。可向人施用任何有效剂量的类固醇。在一些实施方式中,类固醇的剂量可以为约1mg至约500mg类固醇。在一些实施方式中,类固醇的剂量不超过25mg类固醇,且不少于5mg类固醇。类固醇可以通过单独的输注(例如,7.5mg甲基泼尼松龙)、与同一输注中的唑来膦酸混合而经口给予(例如,7.5mg泼尼松龙),或者肌内、皮下、通过直肠栓剂、通过吸入而施用,或直接注射到关节中。唑来膦酸或另一双膦酸类化合物可以以适于所选施用途径(如经口、经直肠或肠胃外)的多种形式施用给人患者。在这方面,肠胃外施用包括但不限于通过以下途径进行施用:经肺部、鞘内、静脉内、肌内、皮下、眼内、滑膜内、经上皮(包括透皮、舌下和经口腔);经局部;通过吹入法的鼻腔吸入;和经直肠全身。唑来膦酸或另一双膦酸类化合物的有效量将根据主治医师所知的各种因素而变化,例如待治疗病症的严重性、施用途径、配方和剂型、所用双膦酸类化合物的物理特性以及个体患者的年龄、体重和反应。唑来膦酸或另一双膦酸类化合物在治疗性组合物中的量可变化。例如,一些液体组合物可包含约0.0001%(重量/体积)至约50%(重量/体积)、约0.01%(重量/体积)至约20%(重量/体积)、约0.01%至约10%(重量/体积)、约0.001%(重量/体积)至约1%(重量/体积)、约0.1%(重量/体积)至约0.5%(重量/体积)、约1%(重量/体积)至约3%(重量/体积)、约3%(重量/体积)至约5%(重量/体积)、约5%(重量/体积)至约7%(重量/体积)、约7%(重量/体积)至约10%(重量/体积)、约10%(重量/体积)至约15%(重量/体积)、约15%(重量/体积)至约20%(重量/体积)、约20%(重量/体积)至约30%(重量/体积)、约30%(重量/体积)至约40%(重量/体积)或约40%(重量/体积)至约50%(重量/体积)的唑来膦酸。一些固体组合物可包含至少约5%(w/w)、至少约10%(w/w)、至少约20%(w/w)、至少约50%(w/w)、至少约70%(w/w)、至少约80%、约10%(w/w)至约30%(w/w)、约10%(w/w)至约20%(w/w)、约20%(w/w)至约30%(w/w)、约30%(w/w)至约50%(w/w)、约30%(w/w)至约40%(w/w)、约40%(w/w)至约50%(w/w)、约50%(w/w)至约80%(w/w)、约50%(w/w)至约60%(w/w)、约70%(w/w)至约75%(w/w)、约70%(w/w)至约80%(w/w)或约80%(w/w)至约90%(w/w)的唑来膦酸。可使用任何适当量的破骨细胞抑制剂(包括双膦酸类化合物,例如含氮的双膦酸类化合物,例如唑来膦酸、米诺膦酸或伊班膦酸)。一些固体或液体口服剂型或口服剂型单位(本文中统称为“口服剂型”)可包含约0.005mg至约20mg、约0.1mg至约10mg、约0.5mg至约10mg、约0.2mg至约5mg、约1mg至约500mg、约1mg至约50mg、约10mg至约250mg、约100mg至约300mg、约20mg至约200mg、约20mg至约150mg、约30mg至约100mg、约1mg至约1,000mg、约10mg至约50mg、约40mg至约60mg、约50mg至约60mg、约55mg、约10mg至约300mg、约10mg至约150mg、约10mg至约100mg、约40mg至约150mg、约10mg至约600mg、约40mg至约600mg、约40mg至约2000mg、约40mg至约800mg,约25mg至约800mg、约30mg至约800mg、约10mg至约500mg、约50mg至约150mg、约50mg、约100mg、约50mg至约500mg、约100mg至约2000mg、约300mg至约1500mg、约200mg至约1000mg、约100mg至约500mg或约150mg唑来膦酸或在这些值中的任何值所界定的范围内或介于这些值中的任何值之间的任何量的破骨细胞抑制剂。在一些实施方式中,口服破骨细胞抑制剂每天一次、每周一次、每月一次、每两个月或三个月一次、一年一次或一年两次进行施用。一些口服剂型可包含约0.005mg至约20mg、约0.1mg至约10mg、约0.5mg至约10mg、约0.2mg至约5mg、约1mg至约500mg、约1mg至约50mg、约10mg至约250mg、约100mg至约300mg、约20mg至约200mg、约20mg至约150mg、约30mg至约100mg、约1mg至约1,000mg、约10mg至约50mg、约40mg至约60mg、约50mg至约60mg、约55mg、约10mg至约300mg、约10mg至约150mg、约10mg至约100mg、约40mg至约150mg、约10mg至约600mg、约40mg至约600mg、约40mg至约2000mg、约40mg至约800mg、约25mg至约800mg、约30mg至约800mg、约10mg至约500mg、约50mg至约150mg、约50mg、约100mg、约50mg至约500mg、约100mg至约2000mg、约300mg至约1500mg、约200mg至约1000mg、约100mg至约500mg或约150mg破骨细胞抑制剂或在这些值中的任何值所界定的范围内或介于这些值中的任何值之间的任何量的破骨细胞抑制剂。在一些实施方式中,口服破骨细胞抑制剂每天一次、每周一次、每月一次、每两个月或三个月一次、一年一次或一年两次进行施用。在一些实施方式中,口服剂型可包含约10mg/m2至约20mg/m2、约15mg/m2至约20mg/m2、约18mg/m2、约80mg/m2至约150mg/m2、约90mg/m2至约150mg/m2、约100mg/m2至约150mg/m2的唑来膦酸或在这些值中的任何值所界定的范围内或介于这些值中的任何值之间的任何量的唑来膦酸。所有以mg/m2表示的剂量范围或量均基于哺乳动物的体表面积计。在一些实施方式中,破骨细胞抑制剂(包括双膦酸类化合物,例如含氮的双膦酸类化合物,例如唑来膦酸、米诺膦酸或伊班膦酸)的日口服剂量为约0.005mg至约20mg、约0.1mg至约10mg、约0.5mg至约10mg、约0.2mg至约5mg或在这些值中的任何值所界定的范围内或介于这些值中的任何值之间的任何量。在一些实施方式中,破骨细胞抑制剂的日口服剂量小于约35mg/m2、小于约30mg/m2、小于约25mg/m2、约1mg/m2至约35mg/m2、约1mg/m2至约30mg/m2、约1.5mg/m2至约25mg/m2、约1.8mg/m2至约20mg/m2、约10mg/m2至约20mg/m2、约10mg/m2至约30mg/m2、约15mg/m2至约20mg/m2、约18mg/m2或唑来膦酸在这些值中的任何值所界定的范围内或介于这些值中的任何值之间的任何量。在一些实施方式中,破骨细胞抑制剂(包括双膦酸类化合物,例如含氮的双膦酸类化合物,例如唑来膦酸、米诺膦酸或伊班膦酸)的日口服剂量为约0.005mg至约20mg、约0.1mg至约10mg、约0.5mg至约10mg、约0.2mg至约5mg或破骨细胞抑制剂在这些值中的任何值所界定的范围内或介于这些值中的任何值之间的任何量。在一些实施方式中,破骨细胞抑制剂的日口服剂量小于约35mg/m2、小于约30mg/m2、小于约25mg/m2、约1mg/m2至约35mg/m2、约1mg/m2至约30mg/m2、约1.5mg/m2至约25mg/m2、约1.8mg/m2至约20mg/m2、约10mg/m2至约20mg/m2、约10mg/m2至约30mg/m2、约15mg/m2至约20mg/m2、约18mg/m2或破骨细胞抑制剂在这些值中的任何值所界定的范围内或介于这些值中的任何值之间的任何量。在一些实施方式中,唑来膦酸的日口服剂量为约0.005mg至约20mg、约0.1mg至约10mg、约0.5mg至约10mg、约0.2mg至约5mg或唑来膦酸在这些值中的任何值所界定的范围内或介于这些值中的任何值之间的任何量。在一些实施方式中,唑来膦酸的日口服剂量小于约35mg/m2、小于约30mg/m2、小于约25mg/m2、约1mg/m2至约35mg/m2、约1mg/m2至约30mg/m2、约1.5mg/m2至约25mg/m2、约1.8mg/m2至约20mg/m2、约10mg/m2至约20mg/m2、约10mg/m2至约30mg/m2、约15mg/m2至约20mg/m2、约18mg/m2或唑来膦酸在这些值中的任何值所界定的范围内或介于这些值中的任何值之间的任何量。在一些实施方式中,破骨细胞抑制剂(包括双膦酸类化合物,例如含氮的双膦酸类化合物,例如唑来膦酸、米诺膦酸或伊班膦酸)的周口服剂量为约1mg至约1000mg、约1mg至约500mg、约10mg至约250mg、约100mg至约300mg、约10mg至约100mg、约10mg至约150mg、约10mg至约100mg、约10mg至约300mg、约20mg至约150mg、约20mg至约60mg、约30mg至约70mg、约40mg至约60mg、约50mg至约70mg、约50mg、约55mg、约100mg至约150mg或约30mg至约100mg。在一些实施方式中,破骨细胞抑制剂的周口服剂量小于约250mg/m2、小于约200mg/m2、小于约175mg/m2、约6mg/m2至约250mg/m2、约10mg/m2至约210mg/m2、约10mg/m2至约170mg/m2、约4mg/m2至约140mg/m2、约100mg/m2至约140mg/m2、约126mg/m2或在这些值中的任何值所界定的范围内或介于这些值中的任何值之间的任何量。周口服剂量可以单次剂量给予、周内给予一次或周内以2、3、4、5、6或7个单独计量给予。在一些实施方式中,唑来膦酸的周口服剂量为约1mg至约1000mg、约1mg至约500mg、约10mg至约250mg、约100mg至约300mg、约10mg至约100mg、约10mg至约150mg、约10mg至约100mg、约10mg至约300mg、约20mg至约150mg、约20mg至约60mg、约30mg至约70mg、约40mg至约60mg、约50mg至约70mg、约50mg、约55mg、约100mg至约150mg或约30mg至约100mg。在一些实施方式中,唑来膦酸的周口服剂量小于约250mg/m2、小于约200mg/m2、小于约175mg/m2、约6mg/m2至约250mg/m2、约10mg/m2至约210mg/m2、约10mg/m2至约170mg/m2、约4mg/m2至约140mg/m2、约100mg/m2至约140mg/m2、约126mg/m2或唑来膦酸在这些值中的任何值所界定的范围内或介于这些值中的任何值之间的任何量。周口服剂量可以单次剂量给予、周内给予一次或周内以2、3、4、5、6或7个单独计量给予。在一些实施方式中,破骨细胞抑制剂(包括双膦酸类化合物,例如含氮的双膦酸类化合物,例如唑来膦酸、米诺膦酸或伊班膦酸)的月剂量或在一个月的时段内施用的破骨细胞抑制剂的量为约5000mg或更少、约4000mg或更少、约3000mg或更少、约2000mg或更少、约1000mg或更少、约700mg或更少、约600mg或更少、约1mg至约4000mg、约1mg至约1000mg、约10mg至约1000mg、约50mg至约1000mg、约10mg至约600mg、约40mg至约600mg、约50mg至约600mg、约40mg至约400mg、约50mg至约200mg、约200mg至约300mg、约250mg至约350mg或约100mg至约600mg、约40mg至约2000mg、约40mg至约800mg、约50mg至约800mg或约100mg至约800mg、约40mg至约1000mg、约50mg至约1000mg或约100mg至约1000mg或在这些值中的任何值所界定的范围内或介于这些值中的任何值之间的任何月剂量。在一些实施方式中,破骨细胞抑制剂的月口服剂量小于约1000mg/m2、小于约800mg/m2、小于约600mg/m2、约10mg/m2至约1000mg/m2、约50mg/m2至约800mg/m2、约70mg/m2至约700mg/m2、约100mg/m2至约700mg/m2、约100mg/m2至约600mg/m2、约50mg/m2至约200mg/m2、约300mg/m2至约600mg/m2、约450mg/m2至约600mg/m2、约300mg/m2至约1000mg/m2、约400mg/m2至约1000mg/m2、约500mg/m2至约1000mg/m2、约400mg/m2至约700mg/m2、约500mg/m2至约600mg/m2、约540mg/m2或在这些值中的任何值所界定的范围内或介于这些值中的任何值之间的任何量。月剂量可以单次剂量给予或在月内以两个或更多个单独剂量施用。在一些实施方式中,月剂量以2或3个周剂量施用。在一些实施方式中,月剂量以4或5个周剂量施用。在一些实施方式中,月剂量以28至31日剂量施用。在一些实施方式中,月剂量在月内以5至10个单独剂量施用。月剂量可施用仅1个月或可重复施用2个或更多个月。在一些实施方式中,唑来膦酸的月剂量或在一个月的时段内施用的唑来膦酸的量为约5000mg或更少、约4000mg或更少、约3000mg或更少、约2000mg或更少、约1000mg或更少、约700mg或更少、约600mg或更少、约1mg至约4000mg、约1mg至约1000mg、约10mg至约1000mg、约50mg至约1000mg、约10mg至约600mg、约40mg至约600mg、约50mg至约600mg、约40mg至约400mg、约50mg至约200mg、约200mg至约300mg、约250mg至约350mg或约100mg至约600mg、约40mg至约2000mg、约40mg至约800mg、约50mg至约800mg或约100mg至约800mg、约40mg至约1000mg、约50mg至约1000mg或约100mg至约1000mg或在这些值中的任何值所界定的范围内或介于这些值中的任何值之间的任何月剂量。在一些实施方式中,唑来膦酸的月口服剂量小于约1000mg/m2、小于约800mg/m2、小于约600mg/m2、约10mg/m2至约1000mg/m2、约50mg/m2至约800mg/m2、约70mg/m2至约700mg/m2、约100mg/m2至约700mg/m2、约100mg/m2至约600mg/m2、约50mg/m2至约200mg/m2、约300mg/m2至约600mg/m2、约450mg/m2至约600mg/m2、约300mg/m2至约1000mg/m2、约400mg/m2至约1000mg/m2、约500mg/m2至约1000mg/m2、约400mg/m2至约700mg/m2、约500mg/m2至约600mg/m2、约540mg/m2或唑来膦酸在这些值中的任何值所界定的范围内或介于这些值中的任何值之间的任何量。月剂量可以单次剂量给予或在月内以两个或更多个单独剂量施用。在一些实施方式中,月剂量以2或3个周剂量施用。在一些实施方式中,月剂量以4或5个周剂量施用。在一些实施方式中,月剂量以28至31日剂量施用。在一些实施方式中,月剂量在月内以5至10个单独剂量施用。月剂量可施用仅1个月或可重复施用2个或更多个月。对于向哺乳动物(例如狗、大鼠、兔子、猴、猿或人)经口施用唑来膦酸而言,对于重复经口施用,例如每天一次给药至每年一次给药、每天一次给药至每年两次给药、每天一次给药至每年三次给药、每天一次给药至每三个月一次给药、每天一次给药至每两个月一次给药、每天一次给药至每两个月一次给药、每天一次给药至每月一次给药、每天一次给药至每2-4周一次给药、每天一次给药至每周一次给药等,安全剂量可以是约0.03mg/kg至约10mg/kg、或在该范围内的任何更小范围,例如约0.4mg/kg至约3mg/kg、约0.4mg/kg至约1.5mg/kg、约0.4mg/kg至约0.5mg/kg、约0.5mg/kg至约0.6mg/kg、约0.6mg/kg至约0.7mg/kg、约0.7mg/kg至约0.8mg/kg、约0.8mg/kg至约0.9mg/kg、约0.9mg/kg至约1mg/kg、约1mg/kg至约1.1mg/kg、约1.1mg/kg至约1.2mg/kg、约1.2mg/kg至约1.3mg/kg、约1.3mg/kg至约1.4mg/kg、约1.4mg/kg至约1.5mg/kg、约1.5mg/kg至约1.6mg/kg、约1.6mg/kg至约1.7mg/kg、约1.7mg/kg至约1.8mg/kg、约1.8mg/kg至约1.9mg/kg、约1.9mg/kg至约2mg/kg、约2mg/kg至约2.1mg/kg、约2.1mg/kg至约2.2mg/kg、约2.2mg/kg至约2.3mg/kg、约2.3mg/kg至约2.4mg/kg、约2.4mg/kg至约2.5mg/kg、约2.5mg/kg至约2.6mg/kg、约2.6mg/kg至约2.7mg/kg、约2.7mg/kg至约2.8mg/kg、约2.8mg/kg至约2.9mg/kg、约2.9mg/kg至约3mg/kg、约3mg/kg至约3.1mg/kg、约3.1mg/kg至约3.2mg/kg、约3.2mg/kg至约3.3mg/kg、约3.3mg/kg至约3.4mg/kg、约3.4mg/kg至约3.5mg/kg、约3.5mg/kg至约3.6mg/kg、约3.6mg/kg至约3.7mg/kg、约3.7mg/kg至约3.8mg/kg、约3.8mg/kg至约3.9mg/kg、约3.9mg/kg至约4mg/kg、约0.4mg/kg至约0.6mg/kg、约0.6mg/kg至约0.8mg/kg、约0.8mg/kg至约1mg/kg、约1mg/kg至约1.2mg/kg、约1.2mg/kg至约1.4mg/kg、约1.4mg/kg至约1.6mg/kg、约1.6mg/kg至约1.8mg/kg、约1.8mg/kg至约2mg/kg、约2mg/kg至约2.2mg/kg、约2.2mg/kg至约2.4mg/kg、约2.4mg/kg至约2.6mg/kg、约2.6mg/kg至约2.8mg/kg、约2.8mg/kg至约3mg/kg、约3mg/kg至约3.2mg/kg、约3.2mg/kg至约3.4mg/kg、约3.4mg/kg至约3.6mg/kg、约3.6mg/kg至约3.8mg/kg、约3.8mg/kg至约4mg/kg、约0.4mg/kg至约0.7mg/kg、约0.7mg/kg至约1mg/kg、约1mg/kg至约1.3mg/kg、约1.3mg/kg至约1.6mg/kg、约1.6mg/kg至约1.9mg/kg、约1.9mg/kg至约2.2mg/kg、约2.2mg/kg至约2.5mg/kg、约2.5mg/kg至约2.8mg/kg、约2.8mg/kg至约3mg/kg、约3.3mg/kg至约3.6mg/kg、约3.6mg/kg至约4mg/kg、约0.4mg/kg至约1mg/kg或约0.5mg/kg至约1mg/kg。上一段中关于向哺乳动物施用唑来膦酸提到的剂量可每天一次或更长时间一次(例如每周一次、每两周一次、每月一次等)地安全施用2次、3次、4次、5次、6次、7次、8次、9次、10次、11次、12次、13次、14次或15次,或者约3次至约10次。对于向哺乳动物(例如小鼠、大鼠、狗、灵长类或人)每天一次至每周一次经口施用唑来膦酸而言,在一些实施方式中,安全重复剂量可以是约0.03mg/kg至约4mg/kg、或在该范围内的任何更小范围,例如约0.01mg/kg至约0.02mg/kg、约0.02mg/kg至约0.03mg/kg、约0.03mg/kg至约0.04mg/kg、约0.04mg/kg至约0.05mg/kg、约0.05mg/kg至约0.06mg/kg、约0.06mg/kg至约0.07mg/kg、约0.07mg/kg至约0.08mg/kg、约0.08mg/kg至约0.09mg/kg、约0.09mg/kg至约0.1mg/kg、约0.1mg/kg至约0.11mg/kg、约0.11mg/kg至约0.12mg/kg、约0.12mg/kg至约0.13mg/kg、约0.13mg/kg至约0.14mg/kg、约0.14mg/kg至约0.15mg/kg、约0.15mg/kg至约0.16mg/kg、约0.16mg/kg至约0.17mg/kg、约0.17mg/kg至约0.18mg/kg、约0.18mg/kg至约0.19mg/kg、约0.19mg/kg至约0.2mg/kg、约0.2mg/kg至约0.21mg/kg、约0.21mg/kg至约0.22mg/kg、约0.22mg/kg至约0.23mg/kg、约0.23mg/kg至约0.24mg/kg、约0.24mg/kg至约0.25mg/kg、约0.25mg/kg至约0.26mg/kg、约0.26mg/kg至约0.27mg/kg、约0.27mg/kg至约0.28mg/kg、约0.28mg/kg至约0.29mg/kg、约0.29mg/kg至约0.3mg/kg、约0.3mg/kg至约0.31mg/kg、约0.31mg/kg至约0.32mg/kg、约0.32mg/kg至约0.33mg/kg、约0.33mg/kg至约0.34mg/kg、约0.34mg/kg至约0.35mg/kg、约0.35mg/kg至约0.36mg/kg、约0.36mg/kg至约0.37mg/kg、约0.37mg/kg至约0.38mg/kg、约0.38mg/kg至约0.39mg/kg、约0.39mg/kg至约0.4mg/kg、约0.05mg/kg至约0.2mg/kg、约0.05mg/kg至约0.15mg/kg、约0.06mg/kg至约0.15mg/kg、约0.07mg/kg至约0.15mg/kg、约0.08mg/kg至约0.15mg/kg、约0.09mg/kg至约0.15mg/kg、约0.1mg/kg至约0.15mg/kg、约0.03mg/kg至约0.5mg/kg、约0.06mg/kg至约0.2mg/kg、约0.07mg/kg至约0.2mg/kg、约0.08mg/kg至约0.2mg/kg、约0.09mg/kg至约0.2mg/kg、约0.1mg/kg至约0.2mg/kg、约0.4mg至约4mg、约0.4mg/kg至约0.6mg/kg、约0.6mg/kg至约0.8mg/kg、约0.8mg/kg至约1mg/kg、约1mg/kg至约1.2mg/kg、约1.2mg/kg至约1.4mg/kg、约1.4mg/kg至约1.6mg/kg、约1.6mg/kg至约1.8mg/kg、约1.8mg/kg至约2mg/kg、约2mg/kg至约2.2mg/kg、约2.2mg/kg至约2.4mg/kg、约2.4mg/kg至约2.6mg/kg、约2.6mg/kg至约2.8mg/kg、约2.8mg/kg至约3mg/kg、约3mg/kg至约3.2mg/kg、约3.2mg/kg至约3.4mg/kg、约3.4mg/kg至约3.6mg/kg、约3.6mg/kg至约3.8mg/kg、约3.8mg/kg至约4mg/kg、约0.5mg/kg至约2mg/kg、约0.6mg/kg至约2mg/kg、约0.7mg/kg至约2mg/kg、约0.8mg/kg至约2mg/kg、约0.5mg/kg至约1.5mg/kg、约0.6mg/kg至约1.5mg/kg、约0.7mg/kg至约1.5mg/kg、约0.8mg/kg至约1.5mg/kg、约0.5mg/kg至约0.9mg/kg、约0.6mg/kg至约0.9mg/kg、约0.7mg/kg至约0.9mg/kg、约0.5mg/kg至约1mg/kg、约0.6mg/kg至约1mg/kg、约0.7mg/kg至约1mg/kg、约0.8mg/kg至约1mg/kg或约0.8mg/kg至约0.9mg/kg。对于向哺乳动物(例如小鼠、大鼠、狗、灵长类或人)每周一次或更低频率的经口施用唑来膦酸而言,在一些实施方式中,安全重复剂量可以是约0.4mg至约10mg,或在该范围内的任何更小范围,例如约0.4mg/kg至约0.6mg/kg、约0.6mg/kg至约0.8mg/kg、约0.8mg/kg至约1mg/kg、约1mg/kg至约1.2mg/kg、约1.2mg/kg至约1.4mg/kg、约1.4mg/kg至约1.6mg/kg、约1.6mg/kg至约1.8mg/kg、约1.8mg/kg至约2mg/kg、约2mg/kg至约2.2mg/kg、约2.2mg/kg至约2.4mg/kg、约2.4mg/kg至约2.6mg/kg、约2.6mg/kg至约2.8mg/kg、约2.8mg/kg至约3mg/kg、约3mg/kg至约3.2mg/kg、约3.2mg/kg至约3.4mg/kg、约3.4mg/kg至约3.6mg/kg、约3.6mg/kg至约3.8mg/kg、约3.8mg/kg至约4mg/kg、约4mg/kg至约4.2mg/kg、约4.2mg/kg至约4.4mg/kg、约4.4mg/kg至约4.6mg/kg、约4.6mg/kg至约4.8mg/kg、约4.8mg/kg至约5mg/kg、约5mg/kg至约5.2mg/kg、约5.2mg/kg至约5.4mg/kg、约5.4mg/kg至约5.6mg/kg、约5.6mg/kg至约5.8mg/kg、约5.8mg/kg至约6mg/kg、约6mg/kg至约6.2mg/kg、约6.2mg/kg至约6.4mg/kg、约6.4mg/kg至约6.6mg/kg、约6.6mg/kg至约6.8mg/kg、约6.8mg/kg至约7mg/kg、约7mg/kg至约7.2mg/kg、约7.2mg/kg至约7.4mg/kg、约7.4mg/kg至约7.6mg/kg、约7.6mg/kg至约7.8mg/kg、约7.8mg/kg至约8mg/kg、约8mg/kg至约8.2mg/kg、约8.2mg/kg至约8.4mg/kg、约8.4mg/kg至约8.6mg/kg、约8.6mg/kg至约8.8mg/kg、约8.8mg/kg至约9mg/kg、约9mg/kg至约9.2mg/kg、约9.2mg/kg至约9.4mg/kg、约9.4mg/kg至约9.6mg/kg、约9.6mg/kg至约9.8mg/kg、约9.8mg/kg至约10mg/kg、约0.5mg/kg至约2mg/kg、约0.6mg/kg至约2mg/kg、约0.7mg/kg至约2mg/kg、约0.8mg/kg至约2mg/kg、约0.5mg/kg至约1.5mg/kg、约0.6mg/kg至约1.5mg/kg、约0.7mg/kg至约1.5mg/kg、约0.8mg/kg至约1.5mg/kg、约0.5mg/kg至约1mg/kg、约0.6mg/kg至约1mg/kg、约0.7mg/kg至约1mg/kg、约0.8mg/kg至约1mg/kg,orabout0.8mg/kg至约0.9mg/kg。在一些实施方式中,破骨细胞抑制剂包括唑来膦酸,且口服唑来膦酸或其二钠盐可与肠胃外(例如静脉内)施用的约0.1mg至约10mg唑来膦酸或其盐联合施用。在一些实施方式中,联合肠胃外(例如静脉内)施用的1mg唑来膦酸,经口施用约50mg、约100mg或约150mg唑来膦酸二钠盐。在一些实施方式中,唑来膦酸的肠胃外剂量为约0.25mg至约25mg、约0.25mg至约10mg或约0.5mg至约7.5mg。对于经口施用破骨细胞抑制剂(例如唑来膦酸、米诺膦酸或伊班膦酸,或用于治疗与炎症、关节炎、CRPS或本文所述任何其它病症相关的疼痛的另一双膦酸类化合物)而言,如果被施用破骨细胞抑制剂的哺乳动物或人在施用破骨细胞抑制剂之前的至少约1小时、至少约2小时、至少约4小时、至少约6小时、至少约8小时、至少约10小时或至少约12小时(除吞咽口服剂型所需的任何水分之外)不吃食物且不喝饮料,这可以是有益的。如果被施用破骨细胞抑制剂的哺乳动物或人在施用破骨细胞抑制剂之后的至少约30分钟、至少约1小时、至少约2小时、至少约3小时或至少约4小时不吃食物且不喝饮料,也可以是有益的。在一些实施方式中,被施用唑来膦酸的人在接受含破骨细胞抑制剂的剂型之后的至少约30分钟或约1小时避免躺下,或者保持直立或坐直。在经口施用破骨细胞抑制剂之前或之后避免食物或饮料可提高破骨细胞抑制剂的生物利用率。剂型中破骨细胞抑制剂的口服生物利用率可变化。一些剂型可添加有增强生物利用率的成分。然而,生物利用率增强对于使口服剂型有效而言并非必需。在一些实施方式中,剂型基本上不含生物利用率提高剂。在一些实施方式中,口服剂型可具有约0.01%至约10%、约0.1%至约7%、约0.1%至约5%等的破骨细胞抑制剂(例如唑来膦酸、米诺膦酸、伊班膦酸)的口服生物利用率。不采用增强生物利用率的成分或其它方法时,双膦酸类化合物(例如唑来膦酸)在口服剂型中通常具有低生物利用率。在一些实施方式中,唑来膦酸的口服生物利用率未增强或基本上未增强。例如,唑来膦酸的口服生物利用率可为约0.01%至约5%、约0.01%至约4%、约0.1%至约3%、约0.1%至约2%、约0.2%至约2%、约0.2%至约1.5%、约0.3%至约1.5%、约0.3%至约1%、约1%至约3%、约1.2%至约3.5%、约1.2%至约3%、约1%至约4%、约1.5%至约4.5%、约0.1%至约0.5%、约0.3%至约0.5%、约0.5%至约1%、约0.6%至约0.7%、约0.7%至约0.8%、约0.8%至约0.9%、约0.9%、约1%至约1.1%、约1.1%至约1.2%、约1.2%至约1.3%、约1.3%至约1.4%、约1.4%至约1.5%、约1.5%至约1.6%、约1.6%至约1.8%、约1.8%至约2%或约2%至约2.5%。一个实施方式为包含破骨细胞抑制剂(例如唑来膦酸、米诺膦酸或伊班膦酸)的药物组合物,其中剂型中唑来膦酸的口服生物利用率为约0.01%至约10%。在一些实施方式中,剂型中破骨细胞抑制剂的口服生物利用率为约0.01%至约5%、约0.1%至约7%、约0.1%至约5%、约0.1%至约3%、约0.1%至约2%、约0.2%至约2%、约0.2%至约1.5%、约0.3%至约1.5%或约0.3%至约1.0%。在一些实施方式中,剂型中唑来膦酸的口服生物利用率为约0.01%至约5%。在一些实施方式中,剂型中唑来膦酸的口服生物利用率为约0.1%至约7%。在一些实施方式中,剂型中唑来膦酸的口服生物利用率为约0.1%至约5%。在一些实施方式中,剂型中唑来膦酸的口服生物利用率为约0.1%至约3%。在一些实施方式中,剂型中唑来膦酸的口服生物利用率为约0.1%至约2%。在一些实施方式中,剂型中唑来膦酸的口服生物利用率为约0.2%至约2%。在一些实施方式中,剂型中唑来膦酸的口服生物利用率为约0.2%至约1.5%。在一些实施方式中,剂型中唑来膦酸的口服生物利用率为约0.3%至约1.5%。在一些实施方式中,剂型中唑来膦酸的口服生物利用率为约0.3%至约1.0%。在一些实施方式中,口服剂型包含约10mg至约300mg唑来膦酸、米诺膦酸或伊班膦酸,并且每天施用一次,连续施用约2至约15天。此方案可每月重复一次、每两个月重复一次、每三个月重复一次、每四个月重复一次、每五个月重复一次、每六个月重复一次、每年重复一次或每两年重复一次。在一些实施方式中,口服剂型包含约10mg至约150mg或约10mg至约100mg唑来膦酸、米诺膦酸或伊班膦酸,并且每天施用一次,连续施用约2至约15天。此方案可每月重复一次、每两个月重复一次、每三个月重复一次、每四个月重复一次、每五个月重复一次、每六个月重复一次、每年重复一次或每两年重复一次。在一些实施方式中,口服剂型包含约10mg至约150mg或约10mg至约100mg唑来膦酸、米诺膦酸或伊班膦酸,并且每天施用一次,连续施用约5至约10天。此方案可每月重复一次、每两个月重复一次、每三个月重复一次、每四个月重复一次、每五个月重复一次、每六个月重复一次、每年重复一次或每两年重复一次。在一些实施方式中,口服剂型包含约40mg至约150mg唑来膦酸、米诺膦酸或伊班膦酸,并且每天施用一次,连续施用约5至约10天。此方案可每月重复一次、每两个月重复一次、每三个月重复一次、每四个月重复一次、每五个月重复一次、每六个月重复一次、每年重复一次或每两年重复一次。在一些实施方式中,口服唑来膦酸、米诺膦酸或伊班膦酸可以作为约100mg至约2000mg的一剂施用。在一些实施方式中,口服唑来膦酸、米诺膦酸或伊班膦酸可以作为约300mg至约1500mg的一剂施用。在一些实施方式中,口服唑来膦酸、米诺膦酸或伊班膦酸可以作为约200mg至约1000mg的一剂施用。唑来膦酸、米诺膦酸或伊班膦酸的剂量可以单剂量或分剂量施用。破骨细胞抑制剂(例如唑来膦酸、米诺膦酸或伊班膦酸)可例如用惰性稀释剂或可食用载体来配制以供经口施用,或其可包封在硬壳或软壳明胶胶囊中、压缩成片剂或直接混入饮食中。对于治疗性经口施用,活性化合物可结合赋形剂使用并且以以下形式使用:可吸收片剂、口含片、包衣片、锭剂、胶囊剂、酏剂、分散剂、混悬剂、溶液剂、浆剂、糯米纸囊剂(wafer)、贴剂等等。片剂、锭剂、丸剂、胶囊剂等也可包含一种或多种下列组分:粘合剂,例如黄蓍树胶、阿拉伯胶、玉米淀粉或明胶;赋形剂,例如磷酸二钙;崩解剂,例如玉米淀粉、马铃薯淀粉、海藻酸等;润滑剂,诸如硬脂酸镁;甜味剂,例如蔗糖、乳糖或糖精;或调味剂,例如薄荷、冬青油或樱桃调味剂。当单位剂型是胶囊剂时,除了上述类型的材料以外,其可包含液体载体。各种其它材料可以作为包衣存在,例如可用紫胶、糖或两者对片剂、丸剂或胶囊剂进行包衣。浆剂或酏剂可包含活性化合物、作为甜味剂的蔗糖、作为防腐剂的对羟基苯甲酸甲酯和对羟基苯甲酸丙酯、染料和调味剂(例如樱桃或柑橘调味剂)。剂型或药物组合物中的材料可有利地为药学纯的并且在所采用量内基本上无毒性。一些组合物或剂型可为液体或可包含分散在液体中的固相。破骨细胞抑制剂(例如唑来膦酸、米诺膦酸或伊班膦酸)可配制为供肠胃外或腹膜内施用。呈游离酸或药理学上可接受的盐的活性化合物溶液可在适当混合有表面活性剂(例如羟丙基纤维素)的水中进行制备。分散体还可具有分散在甘油、液体聚乙二醇或其混合物之内或之中的油。在普通储存和使用条件下,这些制剂可包含防止微生物生长的防腐剂。在一些实施方式中,口服剂型可包含诸如Prosolv的硅化微晶纤维素。例如,约20%(重量/重量)至约70%(重量/重量)、约10%(重量/重量)至约20%(重量/重量)、约20%(重量/重量)至约40%(重量/重量)、约25%(重量/重量)至约30%(重量/重量)、约40%(重量/重量)至约50%(重量/重量)或约45%(重量/重量)至约50%(重量/重量)的硅化微晶纤维素可存在于口服剂型或口服剂型单位中。在一些实施方式中,口服剂型可包含交联聚乙烯基吡咯烷酮,例如交聚维酮。例如,约1%(重量/重量)至约10%(重量/重量)、约1%(重量/重量)至约5%(重量/重量)或约1%(重量/重量)至约3%(重量/重量)的交联聚乙烯基吡咯烷酮可存在于口服剂型或口服剂型单位中。在一些实施方式中,口服剂型可包含诸如Aerosil的气相法二氧化硅(fumedsilica)。例如,约0.1%(重量/重量)至约10%(重量/重量)、约0.1%(重量/重量)至约1%(重量/重量)或约0.4%(重量/重量)至约0.6%(重量/重量)气相法二氧化硅可存在于口服剂型或口服剂型单位中。在一些实施方式中,口服剂型可包含硬脂酸镁。例如,约0.1%(重量/重量)至约10%(重量/重量)、约0.1%(重量/重量)至约1%(重量/重量)或约0.4%(重量/重量)至约0.6%(重量/重量)硬脂酸镁可存在于口服剂型或口服剂型单位中。包含唑来膦酸或另一双膦酸类化合物或破骨细胞抑制剂的口服剂型可包含在医药产品中,所述医药产品包含多于一个单位的口服剂型。供每日使用的包含口服剂型的医药产品可包含28、29、30或31个单位的口服剂型以用于月供给。大约6周的日供给可包含40至45个单位的口服剂型。大约3月的日供给可包含85至95个单位的口服剂型。大约6个月的日供给可包含170至200个单位的口服剂型。大约一年的日供给可包含350至380个单位的口服剂型。供每周使用的包含口服剂型的医药产品可包含4或5个单位的口服剂型以用于月供给。大约2月的周供给可包含8或9个单位的口服剂型。大约6周的周供给可包含约6个单位的口服剂型。大约3月的周供给可包含12、13或14个单位的口服剂型。大约6个月的周供给可包含22至30个单位的口服剂型。大约一年的周供给可包含45至60个单位的口服剂型。医药产品可适于其它给药方案。例如,医药产品可包含5至10个单位的口服剂型,其中每个单位的口服剂型包含约40mg至约150mg唑来膦酸、米诺膦酸或伊班膦酸。一些医药产品可包含1至10个单位的口服剂型,其中所述产品包含约200mg至约2000mg唑来膦酸、米诺膦酸或伊班膦酸。对于此类产品,每个单位的口服剂型可每天服用一次,一个月内持续1至10天或5至10天,例如在月初。包含破骨细胞抑制剂(例如合适的双膦酸类化合物如唑来膦酸、米诺膦酸或伊班膦酸或其盐)的一些口服剂型可具有肠溶包衣或膜包衣。在一些实施方式中,破骨细胞抑制剂的口服剂型包含具有肠溶包衣的片剂。在一些实施方式中,破骨细胞抑制剂的口服剂型包含具有肠溶包衣的胶囊剂。在一些实施方式中,破骨细胞抑制剂的口服剂型包含具有膜包衣的片剂。在一些实施方式中,破骨细胞抑制剂的口服剂型包含具有膜包衣的胶囊剂。基于哺乳动物的体重,抗RANK或RANKL的抗体(例如狄诺塞麦(denosumab))的有用剂量可在以下范围内:约0.1mg/kg至约20mg/kg、约0.75mg/kg至约7.5mg/kg、约0.1mg/kg至约5mg/kg、约1mg/kg至约2mg/kg、约10mg/kg至约20mg/kg、约12至约17mg/kg、约15mg/kg至约20mg/kg、约1mg/kg、约1mg/kg至约10mg/kg,或者这些范围所界定的或介于这些范围之间的任何值。所选剂量可以重复施用,对于慢性病症尤其如此,或者可随着治疗进行增加或减少每一剂量的量。所选剂量可每周、每月、每2个月、每3个月、每6个月或每年施用一次或更多次。在一些实施方式中,向需要治疗的患者皮下施用60mg狄诺塞麦。每6个月重复施用一次。存在一些方法可从唑来膦酸产物中除去化合物1和/或化合物2的某部分。例如,可以利用HPLC、制备TLC、结晶、升华或区域纯化。HPLC、TLC或结晶中可以使用的溶剂可包括但不限于,水或有机溶剂,例如已烷、二乙醚、乙酸乙酯、乙酸甲酯、丙酮、乙酸、乙腈、四氢呋喃、乙醇、甲醇、异丙醇、氯仿、二乙醚、甲苯、二甲基甲酰胺、苯等。也可以应用梯度或双溶剂体系。例如,HPLC分离可以从用水洗脱开始,用水洗脱一段时间之后,有机溶剂(例如乙腈、甲醇、乙醇、乙酸乙酯、丙酮、乙酸、乙酸甲酯)或其它溶剂可逐渐加入水中,或者可完全替代水。类似地,结晶或重结晶可利用一种溶剂或多种溶剂的组合。例如,唑来膦酸或其盐(例如二钠盐)可从水、乙醇、甲醇、二乙醚、乙酸甲酯、乙酸等或者这些溶剂的组合或者其它溶剂中重结晶。在一些实施方式中,唑来膦酸或其盐(例如二钠盐)可溶解在一种溶剂(例如水或乙酸)中,然后通过第二溶剂或溶剂体系(例如,己烷、二乙醚、氯仿、二氯甲烷、乙酸乙酯、乙酸甲酯、乙酸、乙醇、甲醇或其组合)结晶。在一些实施方式中,将唑来膦酸的二钠盐溶解在水中,然后通过添加己烷来结晶。在一些实施方式中,将唑来膦酸的二钠盐溶解在水中,然后通过添加二乙醚来结晶。在一些实施方式中,将唑来膦酸的二钠盐溶解在水中,然后通过添加氯仿来结晶。在一些实施方式中,将唑来膦酸的二钠盐溶解在水中,然后通过添加二氯甲烷来结晶。在一些实施方式中,将唑来膦酸的二钠盐溶解在水中,然后通过添加乙酸乙酯来结晶。在一些实施方式中,将唑来膦酸的二钠盐溶解在水中,然后通过添加乙酸甲酯来结晶。在一些实施方式中,将唑来膦酸的二钠盐溶解在水中,然后通过添加乙酸来结晶。在一些实施方式中,将唑来膦酸的二钠盐溶解在水中,然后通过添加乙醇来结晶。在一些实施方式中,将唑来膦酸的二钠盐溶解在水中,然后通过添加甲醇来结晶。对于使用水和第二溶剂的实施方式,水与第二溶剂的比值(水∶第二溶剂)可以为约1∶100至约100∶1、约1∶10至约1∶5、约1∶5至约1∶4、约1∶4至约1∶3、约1∶3至约1∶2、约1∶2至约1∶1、约1∶1至约2∶1、约2∶1至约3∶1、约3∶1至约4∶1、约4∶1至约5∶1或约1∶1至约10∶1。在一些实施方式中,可以利用上一段中所述的两种方法的组合,例如HPLC或TLC和结晶。在一些实施方式中,可以重复方法,例如HPLC、制备TLC、结晶、升华或区域纯化。在一些实施方式中,可将上一段中所述的纯化方法进行两次。在一些实施方式中,可以将上一段中所述的纯化方法进行3次或4次。在下面的实施例中,唑来膦酸作为唑来膦酸二钠四水合物,以二钠盐形式进行施用。在测试组合物中不使用生物利用率提高剂。实施例1经口施用的唑来膦酸在炎性疼痛大鼠模型中的效果方法:使用大鼠完全弗氏佐剂(CFA)模型来检验经口施用的唑来膦酸对炎性疼痛的效果。通过在第0天将75μL体积的100%CFA注射到斯普拉-道来(Sprague-Dawley)大鼠的左后爪中来诱发炎性疼痛,然后在1-3天进行评估。在1-3天,动物每天一次经口施用媒介物(对照)、唑来膦酸18mg/m2(或3mg/kg)、唑来膦酸120mg/m2(或20mg/kg)或唑来膦酸900mg/m2(或150mg/kg)。将药物溶解于蒸馏水中并且每天新鲜制备。动物在给药之前进行禁食。在关于从动物向人外推起始剂量的现行FDA指南下,认为以mg/m2表示的剂量在哺乳动物物种间是相等的。因此,例如,认为大鼠中的18mg/m2相当于人中的18mg/m2,而大鼠中的3mg/kg可能不等于人中的3mg/kg。在CFA注射前第0天以及在1-3天的基线和治疗后时间点获得经媒介物和经药物治疗的动物中的炎性疼痛(机械痛觉过敏)的值。使用Randall-Selitto数字设备(dRS;IITCLifeSciences、WoodlandHills、CA)来评估疼痛。将动物置于悬吊动物的约束悬带中,保持后肢可用于测试。通过用放置在第3跖骨和第4跖骨之间的圆顶形尖端向后爪跖面施加不断增加的压力来测量爪受压阈值。在大约10秒内逐渐施加压力。从第一次观察到的发声、挣扎或回缩的防伤害行为(nocifensivebehavior)进行测量。使用300g的截止值来防止对动物的伤害。炎性疼痛的逆转根据下式来计算:%逆转=(治疗后-CFA后基线)/(CFA前基线-CFA后基线)x100。使用9-10只动物为一组进行实验。结果:经口施用唑来膦酸与媒介物相比显著改善了炎性疼痛阈值。图1示出在各个时间进行的疼痛阈值测量值。在开始治疗后30分钟的整个测量期间,18mg/m2组的爪受压阈值高于媒介物组。在第三天,18mg/m2组和900mg/m2组的爪受压阈值均高于媒介物组。观察到18mg/m2组和900mg/m2组的疼痛阈值自基线起分别提高49%和83%。经口施用的唑来膦酸在18mg/m2剂量下产生29%的炎性疼痛逆转,在900mg/m2剂量下产生48%的逆转。此效果量级相当于在类似的炎性疼痛模型中测试时通过临床剂量的市售NSAID所获得的量级。在现行FDA指南下,成人的参考体表面积为1.62m2。因此,18mg/m2的日剂量相当于约500-560mg/m2的月剂量或约800-900mg的人剂量。意外的是,这两个较高剂量在给药前两天时所导致的阈值比媒介物要低。在评估期间的所有时间点,120mg/m2组近似等于或次于媒介物。虽然900mg/m2组在第3天显示出有效性,但此结果伴随显著的毒性,使得需要在停止给药后两天对该组的所有动物实施安乐死。实施例2经口施用的唑来膦酸在关节炎疼痛大鼠模型中的效果方法:在关节炎疼痛的大鼠完全弗氏佐剂(CFA)模型中检验经口施用的唑来膦酸对关节炎疼痛的效果。在此模型中,将75μL体积的100%完全弗氏佐剂(CFA)注射到左后爪中,然后利用10-14天的时间发展出关节炎疼痛。在CFA注射之后的前三天,动物经口施用分成三个相同日剂量的媒介物(对照)、唑来膦酸54mg/m2(或9mg/kg)或唑来膦酸360mg/m2(或60mg/kg)。将药物溶解于蒸馏水中并且每天新鲜制备。动物在给药之前进行禁食。在CFA注射后第14天使用Randall-Selitto数字设备(dRS;IITCLifeSciences、WoodlandHills、CA)来评估经媒介物和经药物治疗的动物中的关节炎疼痛(机械痛觉过敏)。将动物置于悬吊动物的约束悬带中,保持后肢可用于测试。通过用放置在第3跖骨和第4跖骨之间的圆顶形尖端向后爪跖面施加不断增加的压力来测量爪受压阈值。在大约10秒内逐渐施加压力。从第一次观察到的发声、挣扎或回缩的防伤害行为起进行测量。使用300g的截止值来防止对动物的伤害。同侧(注射CFA的)爪中关节炎疼痛的逆转根据下式来计算:%逆转=(同侧药物阈值-同侧媒介物阈值)/(对侧媒介物阈值-同侧媒介物阈值)x100。使用7-10只动物为一组进行实验。结果:经口施用唑来膦酸与媒介物相比显著改善了关节炎疼痛阈值。如图2A和2B中所示,经口施用的唑来膦酸产生了关节炎疼痛的剂量依赖性逆转。在54mg/m2组中观察到33%的逆转,在360mg/m2组中观察到54%的逆转。在现行FDA指南下,成人的参考体表面积为1.62m2。因此,大鼠中的54mg/m2相当于默示的约87mg的人剂量,大鼠中的360mg/m2相当于默示的约583mg的人剂量。实施例3用经口施用的唑来膦酸来治疗复杂区域性疼痛综合征。在复杂区域性疼痛综合征(CRPS)的大鼠胫骨骨折模型中检验经口施用的唑来膦酸的效果。通过使动物的右胫骨远端发生骨折并将骨折的后爪打石膏(casting)4周来诱发大鼠中的CRPS,如GuoTZ等人在(Pain.2004;108:95-107)中所述。已证实此动物模型可再现在人CRPS患者中观察到的刺激创伤、自然病史、病征、症状和病变(KingeryWS等人,Pain.2003;104:75-84)。从骨折和打石膏当天开始,动物以18mg/m2/天(3mg/kg/天)的剂量经口施用媒介物(对照)或唑来膦酸,持续28天。将药物溶解于蒸馏水中并通过管饲法施用。在给药前4小时和给药后2小时对动物进行禁食。在28天周期结束时,移除石膏模,在第二天测试大鼠的后爪疼痛、浮肿和发热。疼痛评估通过测量痛觉过敏和荷重来评估疼痛。为测量痛觉过敏、可使用上下冯·弗雷测试范例(up-downvonFreytestingparadigm)。将大鼠置于具有丝网底部的透明塑料圆筒(直径为20cm)中并使其适应15分钟。使用一系列八根硬度范围从0.41g至15.14g的冯·弗雷毛发中的一根对爪进行测试。紧靠在后爪跖皮肤的大致中底(midsole)处施加冯·弗雷毛发,注意避开隆起足垫(toripads)。推挤毛须直至其略微弯曲,然后使其在所述位置处轻晃6秒。以数秒的间隔提供刺激。毛须导致的后爪回缩被认为是阳性响应。初始毛须呈递为2.1g,并且根据Dixon的上下方法呈递毛须以产生六个紧邻50%阈值的响应。以数秒的间隔提供刺激。使用双足平衡测痛设备(incapacitancedevice)(IITCInc.LifeScience、Woodland、CA、USA)来测量后爪荷重(一种疼痛体位效应)。将大鼠手动保持在设备上方的垂直位置处,其中后爪停靠在单独的金属刻度板上,大鼠全身的重量靠后爪支承。每次测量的持续时间为6秒,以60秒间隔进行10次连续测量。对八次读数(除去最高读数和最低读数)进行平均以计算两侧后爪负重值。根据右后爪(骨折)和左后爪荷重值之间的比率((2R/(R+L))×100%)来分析荷重数据。浮肿评估使用激光传感器技术来测定后爪的背腹厚度。在基线测试前,在两侧后爪的第三跖骨中点上方的背侧皮肤上纹刻2至3mm的斑痕。对于激光测量,将每只大鼠用异氟烷进行简单麻醉并且垂直固定,使得后爪停靠在激光器下方的工作台面上。用施加在踝关节顶部的小金属棒将爪轻轻平坦保持在工作台上。采用配备距离测量传感器的激光器通过光学三角测量来测定距离工作台面和距离后爪纹刻部位顶面的距离,使用差值来计算背腹爪厚度。用于这些实验中的测量传感器装置(4381Precicura、Limab、Goteborg、Sweden)的测量范围为200mm,分辨率为0.01mm。后爪温度测量使用施加至爪皮肤的细丝热电偶(Omega、Stanford、CT、USA)来测量后爪温度。每个后爪测试六个部位。对每个后爪的六个测量值进行平均得到平均温度。结果如图3中所示,与经媒介物治疗的动物相比,用经口施用的唑来膦酸进行治疗可逆转疼痛、恢复荷重和防止浮肿。如图4中所示,相对于经媒介物治疗的动物的对侧(正常)后爪,右(骨折)后爪的冯·弗雷疼痛阈值降低72%。与媒介物治疗相比,唑来膦酸盐治疗将骨折诱发的疼痛逆转77%。如图5中所示,与经唑来膦酸治疗的组相比,经媒介物治疗的组中的荷重(疼痛的一种体位效应)降低显著较高。骨折后肢上的荷重在经媒介物治疗的组中降至正常值的55%。与媒介物治疗相比,唑来膦酸盐治疗显著恢复了后肢荷重(正常值的86%)。如图6中所示,与经唑来膦酸治疗的组相比,后爪厚度的预期增加在经媒介物治疗的组中较大,反映出浮肿的发展。相对于媒介物治疗,唑来膦酸盐治疗将后爪浮肿降低60%。相对于媒介物治疗,唑来膦酸将后爪发热降低5%。上述实验的日剂量为18mg/m2/天。在现行FDA指南下,成人的参考体表面积为1.62m2。因此,18mg/m2的日剂量相当于约500-560mg/m2的月剂量或约800-900mg的人剂量。实施例6.唑来膦酸二钠盐的溶解度测定唑来膦酸和唑来膦酸二钠四水合物的水溶性。向烧杯中量取1克测试化合物。然后将软化水(pH5.5)以少量递增的方式添加到测试化合物中,并向混合物施加超声处理。持续此工序直至实现完全溶解。当出现无可见物质的澄清溶液时,则判断已达到完全溶解。使用达到完全溶解所需水的体积来计算以g/100mL计的溶解度值。对每种化合物都进行此工序。结果如图7中所示,唑来膦酸二钠四水合物的水溶性为唑来膦酸的近似50倍。与唑来膦酸的仅0.25g/100相比,唑来膦酸二钠四水合物的溶解度为12.5g/100mL。实施例7.经口施用的唑来膦酸和唑来膦酸二钠的生物利用率制造含纯唑来膦酸或唑来膦酸二钠盐(唑来膦酸二钠四水合物)的片剂。两种类型的片剂均每片含50mg唑来膦酸当量。在两种类型的片剂中使用相同的赋形剂,并将赋形剂的量调整为占据唑来膦酸与唑来膦酸二钠盐之间的分子量差异。对比格犬经口施用包含150mg唑来膦酸二钠(第1组)或纯唑来膦酸(第2组)形式的唑来膦酸当量的片剂。给予每只动物3个50mg当量片剂(总计150mg),这些片剂是同时施用的。用水将动物的口腔润湿,然后将片剂放在动物舌头后面。在给药之前和给药之后,使动物禁食。在给药之日,动物6-9月龄且重6-10kg。每组有三只狗。通过在给药后的各个点静脉穿刺颈静脉,从每只动物采集连续的血液样品以测量唑来膦酸的血浆浓度。将血液样品采集到冷冻管中,所述冷冻管含有K2EDTA作为抗凝剂。然后以约3000rpm在+4℃下离心样品10分钟用于血浆分离。利用LC/MS/MS方法测量唑来膦酸的血浆浓度。结果每组狗的平均唑来膦酸血浆浓度总结于表1中并阐释于图8中。在测量唑来膦酸血浆水平的整个48小时期间均观察到可检测的唑来膦酸血浆水平。表1相较于纯唑来膦酸,唑来膦酸二钠产生了显著更高的唑来膦酸血浆水平,表明盐形式具有提高的口服吸收。使用峰血浆浓度(Cmax)衡量时,相较于纯唑来膦酸,二钠盐导致生物利用率的实际提高为119%且重量调整后提高为74%。使用血浆浓度曲线下面积(AUC0-∞)衡量时,在实际基础和重量调整后基础上,二钠盐的生物利用率比纯唑来膦酸的生物利用率分别高84%和46%。二钠盐的平均AUC0-∞为4073ng·hr/mL,二酸的平均AUC0-∞为2217ng·hr/mL。发现AUC0-∞与剂量成比例。因此,对于与所检测那些相似的比格犬,预期约3mg至约4mg二钠盐将导致约100ng·hr/mL的AUC0-∞,并预期约7mg至约8mg二钠盐将导致约200ng·hr/mL的AUC0-∞。实施例8通过将游离酸形式或二钠盐形式的唑来磷酸与相同的赋形剂共混来制备片剂。对于具有较大量活性物的剂型,按比例减少赋形剂的量以将片剂的重量保持在约100mg。共混之后,在不同压力下压缩成分,随后是膜包衣。然后使用Dr.SchleunigerPharmatron8M片剂硬度测定仪检测所产生片剂的硬度。结果显示于表2和图9中。表2实施例9作为分析临床研究数据的结果,构思了与关节疼痛、骨髓病变和骨关节炎有关的一些实施方式。Laslett等人在AnnRheumDis2012;71:1322-1328报告了该研究的一些结果。以下报告的数据和说明中的一些在递交本申请之前未公开。将具有临床膝部骨关节炎和膝部骨髓病变(BML)的五十二(52)个患者随机化,从而以双盲形式接受静脉内唑来膦酸(5mg)或安慰剂。基于磁共振成像(MRI),所有患者的受影响膝中必须具有至少一种骨髓病变。所有患者均接受膝部的x-射线以确定关节间隙狭窄(JSN),关节间隙狭窄(JSN)是根据国际骨关节炎研究学会(OARSI)数据集进行评级的。患者要么不具有关节间隙狭窄(OARSI0级),要么具有较高程度的关节间隙狭窄(OARSI1级和2级)。26位患者(8位患者具有OARSI0级,6位患者具有OARSI1级,12位患者具有OARSI2级)用唑来膦酸治疗。26位患者(8位患者具有OARSI0级,8位患者具有OARSI1级,10位患者具有OARSI2级)接受安慰剂。使用100mm视觉模拟量表(VAS),其中0代表没有疼痛且100代表极度疼痛,在基线和3个月时评估疼痛强度。计算从基线到3个月的疼痛强度变化。相较于安慰剂,利用唑来膦酸治疗时,在不具有关节间隙狭窄(OARSI0级)的患者中,疼痛显著减轻,但在具有关节间隙狭窄(OARSI1-2级)的患者中,情况并非如此。如表3和图10中所示,相较于安慰剂,在OARSI0级组中,平均VAS评分减少15mm;但相较于安慰剂,在具有OARSI1-2级的患者中,平均VAS评分仅减少0.28。在唑来膦酸组中,在具有OARSI0级和1级的患者中,3个月时的平均VAS评分自基线分别减少约25mm和21mm;但在OARSI2级的患者中,3个月时的平均VAS评分自基线仅减少9mm(图11)。表3.以OARSI等级(mm)计的3个月时的VAS疼痛评分变化OARSI0级1-2级OARSI唑来膦酸-24.6-13.2安慰剂-9.6-12.9与安慰剂的差异-15.0-0.28相较于安慰剂,利用唑来膦酸治疗时,在基线VAS疼痛强度评分为50mm或更高的患者中,疼痛显著减轻,但在基线VAS评分低于50mm的患者中,情况并非如此。如表4中所示,相较于安慰剂,在基线VAS≥50mm的患者中,平均VAS评分减少9mm;但相较于安慰剂,在基线VAS<50mm的患者中,平均VAS评分仅减少0.6mm。表4.以基线VAS(mm)计的3个月时的VAS疼痛评分变化基线VAS≥50mm基线VAS<50mm唑来膦酸-26.2-7.3安慰剂-17.2-6.7与安慰剂的差异-9.0-0.6如表5中所总结和图12中所阐释,疼痛减轻在基线VAS≥50mm的患者中较大,在具有OARSI0级关节间隙狭窄的患者中仍然较大,且在基线VAS≥50mm并具有OARSI0级关节间隙狭窄的患者中最大。表5.3个月时相较于安慰剂的疼痛减轻(mm)VAS变化所有患者-4.8基线VAS≥50mm-9.0OARSI0级-15.0基线VAS≥50mm+OARSI0级-19.4使用质子密度加权脂肪饱和MR图像评价BML。使用Osiris软件(瑞士,日内瓦,日内瓦大学)对BML进行评分。使用应用于每一病变的最大面积的软件光标以mm2测量最大尺寸。如果同一位点存在多处病变,则使用具有最高评分的病变。在四个位点(胫骨内侧位点、股骨内侧位点、胫骨外侧位点和股骨外侧位点)中的每一个给予每位患者BML评分(mm2)并合计这些BML评分以产生总BML评分(mm2)。计算从基线至6个月的BML总面积变化。利用唑来膦酸治疗减小了BML的尺寸。如图13和表6中所示,相较于安慰剂,在OARSI0级组中,平均BML面积减少约190mm2;但相较于安慰剂,在具有OARSI1-2级的患者中,平均BML面积仅减少约33mm2。表6.BML尺寸变化(mm2)OARSI0级1-2级OARSI唑来膦酸-244-117安慰剂-55-84与安慰剂的差异-190-33实施例10方法在具有慢性下背痛(LBP)和MRI检查时有Modic变化的患者中进行研究,以评价与静脉内安慰剂输注相比单次静脉输注5mgZA的效力。该研究是在具有下背痛(LBP)的患者中的双盲、随机化、安慰剂对照的临床试验。如果患者持续至少3个月具有下背症状,在10-cm视觉模拟量表(VAS)上的LBP为至少六(6)或者Oswestry功能障碍指数(ODI)为至少30%,且基于在参与前至多6个月内进行的MRI具有M1、混合的M1/2或M2型变化,则其被包括在该研究中。如果患者具有肌酐清除率降低(被定义为估算肾小球滤过率(eGFR)低于40ml/min)的肾损害、低血钙症、已知对唑来膦酸或其它双膦酸类化合物或输注产品的成分的超敏性、危险信号存在、神经根压迫症或提前退出意愿,则其被排除出该研究。具有生育可能的绝经前期妇女也被排除在外。在输注之前取得血液样品以评估钙和肌酸酐的血清浓度。临床检查包括病史和腰椎柔韧性、肌腱征(tendonsign)及运动的临床评估,以及感官检验。确认合格之后,将患者随机化以接受单次静脉内输注5mg唑来膦酸(n=20)或作为安慰剂的100ml生理盐水(n=20),历时15分钟。记录关于入院和合并用药使用的信息。在基线、一个月和一年时取得血液样品以评估安全性、炎性介质和骨转换标记物。在参与前14天进行临床评估(筛选访视),然后在输注后一个月和一年时进行随访。主要结果是基于VAS的LBP强度变化。次要结果包括腿疼强度、ODI、利用RAND-36评估的健康相关生活质量、患者报告的病假和腰椎柔韧性。在基线和每次随访时评估这些结果测量值。使用手指到地板和躯干侧向弯曲测量值(以cm计)来评价腰椎柔韧性。还评估经受20%相对改善的患者的百分比、在主要结果中VAS评分达到40或更低的患者的比例和患者可接受的症状状态(PASS)。在随访期间询问疼痛药物使用。结果相较于安慰剂治疗,唑来膦酸治疗导致一个月时的LBP强度更大的改善。此外,在一年时,接受唑来膦酸的患者比安慰剂组中的患者报告显著更少的NSAID使用。总而言之,在整个随访阶段,唑来膦酸组中大部分所评价参数的改善更大。表6中展示了在基线时研究参与者的临床特征。平均LBP持续时间为293天,基于VAS的初始LBP强度为6.7,基于VAS的腿痛为2.9,且ODI评分为32%。总共ZA组中的19位患者和安慰剂组中的18位患者具有M1/2病变。Modic变化最常(70%)位于L4/5或L5/S1处。唑来膦酸组和安慰剂组在基线时所有患者的人口统计学特征和背景特征相似(表6)。在一个月时,治疗组之间主要结果(LBP强度)的平均差异(MD)显著有利于唑来膦酸(MD1.4;95%CI0.01至2.9);而在一年时,未观察到明显差异(MD0.7;95%CI-1.0至2.4;表7)。在一个月时,LBP和PASS强度改善至少20%的患者的比例均有利于唑来膦酸治疗,所述比例分别为:唑来膦酸55%相对于安慰剂25%(p=0.105)和唑来膦酸50%相对于安慰剂20%(p=0.096)。如表9中所示,对于用唑来膦酸治疗的患者,具有更高基线疼痛强度的那些患者的疼痛强度减小更多。对于基线疼痛强度≥7的患者,自基线的平均疼痛减轻了3.4;相较之下,对于基线疼痛强度<6的患者,自基线的平均疼痛减轻仅为0.1。在次要结果中,在一个月时,ODI改善有利于唑来膦酸,经调整的组间差异为6.0%(95%CI-0.6至13),但在一年时并非如此(表7)。类似地,在一个月时,侧向弯曲(向右和向左)有利于唑来膦酸治疗,但在一年时并非如此(表7)。表8中显示了总RAND-36的变化和RAND-36的物理组分和精神组分的变化。在基线时,治疗组之间自我报告的非类固醇抗炎药物(NSAID)使用没有差异;然而在一年时,相对于安慰剂组中60%的患者使用NSAID,ZA组中仅20%的患者使用NSAID。表6:根据治疗组的研究群体的基线特征BMI=身体质量指数,MC=Modic变化,LBP=下背痛,SD=标准偏差,IQ=四分位数。*每天至少抽一支烟。**如果不同的MC类型处于两个或更多个水平,则分类基于类型的假设严重程度,即I型>I/II混合型>II型。***使用10cm视觉模拟量表(VAS)评估。表7:治疗组在基线、1个月和12个月时的下背症状和腰椎柔韧性,以及从基线到1个月和12个月的差异的组间比较SD=标准偏差,CI=置信区间,ZA=唑来膦酸,LBP=下背痛。*ANCOVA:随访和基线之间的差异,治疗效果针对基线值进行了调整。a在基线时,安慰剂组中和ZA组中有一个受试者缺失;在1个月时,ZA组中有一个受试者缺失。表8:治疗组在基线、1个月和12个月时使用RAND-36评估的健康相关生活质量,以及从基线到1个月和12个月的差异的组间比较SD=标准偏差,CI=置信区间,ZA=唑来膦酸。*ANCOVA:随访和基线之间的差异,治疗效果针对基线值进行了调整。表9:接受唑来膦酸治疗的患者的疼痛减轻(cm)从基线的VAS变化基线VAS<6-0.1基线VAS≥6且<7-2.3基线VAS≥7-3.4实施例111,3-双(2-甲氧基-2-氧代乙基)-1H-咪唑-3-氯化鎓(9)。将氯乙酸甲酯(2;29.8mL,338.6mmol,2.0当量)逐滴加入1-(三甲基甲硅烷基)-1H-咪唑(8;25.0mL,169.3mmol)中。在60℃下加热混合物24小时。将混合物冷却至室温,然后用Et2O(3x500mL)洗涤并在真空中干燥,产生了白色固体形式的9(41.97g,168.8mmol,99.7%)。1,3-双(羧甲基)1H-咪唑-3-氯化鎓(10)。向1,3-双(2-甲氧基-2-氧代乙基)-1H-咪唑-3-氯化鎓(9;41.00g,164.88mmol,1当量)中加入37%的HCl水溶液(30.03mL,362.74mmol,2.2当量)。在回流条件下搅拌混合物0.5小时。浓缩混合物并用丙酮(2x200mL)和Et2O(3x200mL)洗涤剩余固体。在真空中干燥产生了白色固体形式的10(31.89g,144.55mmol,87.7%)。化合物1:使化合物10与等摩尔量的亚磷酸反应,随后与等摩尔量的三氯化磷和过量的水反应以形成化合物1,化合物1是从乙醇中析出的。化合物2:将1,3-双(羧甲基)-1H-咪唑-3-氯化鎓(10,2.00g,9mmol,1.0当量)和H3PO3(7.37g,90mmol,10当量)溶解在甲苯(10mL)中并加热至70℃。在该温度下搅拌反应混合物20分钟,然后在30分钟内加入PCl3(16mL,180mmol,20当量)。然后将反应混合物加热至95℃并在该温度下搅拌2小时。之后,加入HCl水溶液(30mL,37%HCl和5mLH2O)。将反应混合物加热至100℃并在该温度下搅拌7小时,接着在室温下搅拌2天,然后过滤。将滤液在冰浴中冷却并在45分钟内加入无水EtOH(90mL)中。在室温下搅拌产生的浑浊溶液1小时,然后滤出固体。分离滤饼(46-1)并通过2D-NMR核磁共振和质谱(m/z=477)对其进行分析。在真空中浓缩滤液以产生残渣46-2。用NaOH水溶液(150mg在3.5mLH2O中)处理500mg这种残渣并向其中加入EtOH(7mL)。静置过夜后,滗析液体并通过NMR和质谱(m/z=477)分析产生的固体(46-M4)。特别考虑以下实施方式。实施方式1.减轻炎性疼痛的方法,所述方法包括将包含唑来膦酸的口服剂型施用至有此需要的哺乳动物,其中所述哺乳动物接受的唑来膦酸月总剂量基于所述哺乳动物的体表面积为约800mg/m2或更少。实施方式2.根据实施方式1所述的方法,其中所述哺乳动物为人,其接受的唑来膦酸月总剂量为约30mg/m2至约700mg/m2。实施方式3.根据实施方式2所述的方法,其中所述月总剂量以4或5个周剂量施用。实施方式4.根据实施方式2所述的方法,其中所述月总剂量以28至31个日剂量施用。实施方式5.根据实施方式2所述的方法,其中所述月总剂量在月内以5至10个单独剂量施用。实施方式6.根据实施方式1所述的方法,其中所述哺乳动物为人,其接受的唑来膦酸周总剂量为约10mg至约300mg。实施方式7.根据实施方式6所述的方法,其中所述周总剂量为单次剂量,每周施用一次。实施方式8.根据实施方式6所述的方法,其中所述周总剂量在周内以2至7个单独剂量施用。实施方式9.根据实施方式1所述的方法,其中所述哺乳动物为人,其接受的唑来膦酸周总剂量为约10mg至约150mg。实施方式10.根据任一种前述实施方式所述的方法,其中所述哺乳动物在施用所述剂型后超过3小时经历显著的疼痛减轻。实施方式11.根据实施方式10所述的方法,其中所述哺乳动物在施用所述剂型后的约3小时至约24小时的时间的至少一部分期间经历显著的疼痛减轻。实施方式12.根据实施方式10所述的方法,其中所述哺乳动物在施用所述剂型后的约3小时至约3周的时间的至少一部分期间经历显著的疼痛减轻。实施方式13.减轻炎性疼痛的方法,所述方法包括将包含唑来膦酸的口服剂型施用至有此需要的哺乳动物,其中所述口服剂型包含基于所述哺乳动物的体表面积计约10mg/m2至约20mg/m2的唑来膦酸。实施方式14.根据权利要13求所述的方法,其中所述口服剂型包含基于所述哺乳动物的体表面积计约15mg/m2至约20mg/m2的唑来膦酸。实施方式15.减轻炎性疼痛的方法,所述方法包括每月将基于哺乳动物的体表面积计约300mg/m2至约600mg/m2的唑来膦酸经口施用至有此需要的哺乳动物。实施方式16.根据实施方式15所述的方法,所述方法包括每月将基于所述哺乳动物的体表面积计约450mg/m2至约600mg/m2的唑来膦酸经口施用给所述哺乳动物。实施方式17.根据任一种前述实施方式所述的方法,其中所述哺乳动物未罹患骨转移。实施方式18.根据任一种前述实施方式所述的方法,其中所述哺乳动物未罹患癌症。实施方式19.根据任一种前述实施方式所述的方法,其中所述唑来膦酸以唑来膦酸二价阴离子盐施用。实施方式20.减轻与关节炎相关的疼痛的方法,所述方法包括将包含唑来膦酸的口服剂型施用至有此需要的人。实施方式21.根据实施方式20所述的方法,其中所述人接受的唑来膦酸月总剂量为约40mg至约2000mg。实施方式22.根据实施方式21所述的方法,其中所述月总剂量以4或5个周剂量施用。实施方式23.根据实施方式21所述的方法,其中所述月总剂量以28至31个日剂量施用。实施方式24.根据实施方式21所述的方法,其中所述月总剂量在月内以5至10个单独剂量施用。实施方式25.根据实施方式20所述的方法,其中所述人接受的唑来膦酸周总剂量为约100mg至约300mg。实施方式26.根据实施方式25所述的方法,其中所述周总剂量为单次剂量,每周施用一次。实施方式27.根据实施方式25所述的方法,其中所述周总剂量在周内以2至7个单独剂量施用。实施方式28.根据实施方式20所述的方法,其中所述人接受的唑来膦酸周总剂量为约10mg至约100mg。实施方式29.根据实施方式20至28中任一种所述的方法,其中所述人在施用所述剂型后超过3小时经历显著的疼痛减轻。实施方式30.根据实施方式29所述的方法,其中所述人在施用所述剂型后的约3小时至约24小时的时间的至少一部分期间经历显著的疼痛减轻。实施方式31.根据实施方式29所述的方法,其中所述人在施用所述剂型后的约3小时至约3周的时间的至少一部分期间经历显著的疼痛减轻。实施方式32.根据实施方式20至31中任一种所述的方法,其中所述剂型包含基于所述人的体表面积计约10mg/m2至约20mg/m2的唑来膦酸。实施方式33.根据实施方式32所述的方法,其中所述剂型包含基于所述人的体表面积计约15mg/m2至约20mg/m2的唑来膦酸。实施方式34.根据实施方式20至33中任一种所述的方法,其中每月经口施用基于所述人的体表面积计约50mg/m2至约200mg/m2的唑来膦酸。实施方式35.根据实施方式20至31中任一种所述的方法,其中所述剂型包含基于所述人的体表面积计约80mg/m2至约150mg/m2的唑来膦酸。实施方式36.根据实施方式35所述的方法,其中每月经口施用基于所述人的体表面积计约300mg/m2至约1000mg/m2的唑来膦酸。实施方式37.根据实施方式20至36中任一种所述的方法,其中所述人未罹患骨转移。实施方式38.根据实施方式20至37中任一种所述的方法,其中所述人未罹患癌症。实施方式39.根据任一种前述实施方式所述的方法,其中所述唑来膦酸呈二钠盐形式。实施方式40.包含唑来膦酸的口服剂型,其中所述剂型中所述唑来膦酸的口服生物利用率为约0.01%至约4%。实施方式41.根据实施方式40所述的口服剂型,其中所述口服剂型包含约10mg至约300mg唑来膦酸。实施方式42.根据实施方式40所述的口服剂型,其中所述口服剂型包含约10mg至约50mg唑来膦酸。实施方式43.根据实施方式40至42中任一种所述的口服剂型,其中所述剂型中所述唑来膦酸的口服生物利用率为约0.1%至约2%。实施方式44.医药产品,其包含多于一个单位的根据实施方式40所述的口服剂型。实施方式45.根据实施方式44所述的医药产品,其中每个单位的所述口服剂型包含约1mg至约50mg唑来膦酸。实施方式46.根据实施方式45所述的医药产品,其包含28、29、30或31个单位的所述口服剂型,以在约1个月内施用总共约28mg至约1600mg唑来膦酸。实施方式47.根据实施方式45所述的医药产品,其包含85至95个单位的所述口服剂型,以在约3个月内施用总共约85mg至约4800mg唑来膦酸。实施方式48.根据实施方式45所述的医药产品,其包含170至200个单位的所述口服剂型,以在约6个月内施用总共约170mg至约10,000mg唑来膦酸。实施方式49.根据实施方式45所述的医药产品,其包含350至380个单位的所述口服剂型,以在约1年内施用总共约350mg至约19,000mg唑来膦酸。实施方式50.根据实施方式44所述的医药产品,其中每个单位的所述口服剂型包含约10mg至约300mg。实施方式51.根据实施方式50所述的医药产品,其包含4或5个单位的所述口服剂型,以在约1个月的时段内施用总共约40mg至约1500mg唑来膦酸。实施方式52.根据实施方式50所述的医药产品,其包含8或9个单位的所述口服剂型,以在约2个月内施用总共约80mg至约2700mg唑来膦酸。实施方式53.根据实施方式50所述的医药产品,其包含12、13或14个单位的所述口服剂型,以在约3个月内施用约120mg至约4200mg唑来膦酸。实施方式54.根据实施方式50所述的医药产品,其包含22至30个单位的所述口服剂型,以在约6个月内施用总共约220mg至约9000mg唑来膦酸。实施方式55.根据实施方式50所述的医药产品,其包含45至60个单位的所述口服剂型,以在约1年内施用总共约450mg至约18000mg唑来膦酸。实施方式56.根据实施方式44所述的医药产品,其包含1至10个单位的所述口服剂型,其中所述产品包含约200mg至约2000mg唑来膦酸。实施方式57.根据任一种前述实施方式所述的口服剂型,其中所述唑来膦酸呈钠盐形式。实施方式58.根据任一种前述实施方式所述的口服剂型,其中所述唑来膦酸呈水溶性大于1%(重量/体积)的形式。实施方式59.根据任一种前述实施方式所述的口服剂型,其中所述唑来膦酸呈水溶性为约5%(重量/体积)至约50%(重量/体积)的形式。实施方式60.口服剂型,其包含唑来膦酸和赋形剂,其中所述唑来膦酸呈水溶性大于1%(重量/体积)的形式。实施方式61.根据实施方式60所述的口服剂型,其中所述唑来膦酸呈水溶性为约5%(重量/体积)至约50%(重量/体积)的形式。实施方式62.治疗复杂区域性疼痛综合征的方法,所述方法包括将包含唑来膦酸的口服剂型施用至有此需要的哺乳动物。实施方式63.根据实施方式62所述的方法,其中所述哺乳动物为人,其在一个月或更少的时段内接受的唑来膦酸量为约30mg/m2至约700mg/m2。实施方式64.根据实施方式63所述的方法,其中在一个月或更少的时段内施用4或5个周剂量。实施方式65.根据实施方式63所述的方法,其中在一个月或更少的时段内施用28至31个日剂量。实施方式66.根据实施方式63所述的方法,其中在一个月或更少的时段期间施用5至10个单独剂量。实施方式67.根据实施方式63所述的方法,其中在仅一个月期间施用约30mg/m2至约700mg/m2的唑来膦酸。实施方式68.根据实施方式63所述的方法,其中在一个月或更少的时段内施用约30mg/m2至约700mg/m2的唑来膦酸,连续施用2个月或更多个月。实施方式69.根据实施方式62所述的方法,其中所述哺乳动物每天接受约10mg/m2至约30mg/m2的唑来膦酸。实施方式70.根据实施方式62所述的方法,其中所述哺乳动物为人,其接受的唑来膦酸周总剂量为约10mg至约300mg。实施方式71.根据实施方式70所述的方法,其中所述周总剂量为单次剂量,每周施用一次。实施方式72.根据实施方式70所述的方法,其中所述周总剂量在周内以2至7个单独剂量施用。实施方式73.根据实施方式62至72中任一种所述的方法,其中所述复杂区域性疼痛综合征为I型复杂区域性疼痛综合征。实施方式74.根据实施方式62至72中任一种所述的方法,其中所述复杂区域性疼痛综合征为II型复杂区域性疼痛综合征。实施方式75.根据任一种前述实施方式所述的方法,其中所述唑来膦酸为盐形式。实施方式76.根据实施方式62至75中任一种所述的方法,其中所述剂型包含基于所述哺乳动物的体表面积计约10mg/m2至约20mg/m2的唑来膦酸。实施方式77.根据实施方式76所述的方法,其中所述剂型包含基于所述哺乳动物的体表面积计约15mg/m2至约20mg/m2的唑来膦酸。实施方式78.治疗复杂区域性疼痛综合征的方法,所述方法包括将帕米膦酸施用至有此需要的人。实施方式79.治疗复杂区域性疼痛综合征的方法,所述方法包括将奈立膦酸施用至有此需要的人。实施方式80.治疗复杂区域性疼痛综合征的方法,所述方法包括将奥帕膦酸施用至有此需要的人。实施方式81.治疗复杂区域性疼痛综合征的方法,所述方法包括将阿仑膦酸施用至有此需要的人。实施方式82.治疗复杂区域性疼痛综合征的方法,所述方法包括将英卡膦酸施用至有此需要的人。实施方式83.治疗复杂区域性疼痛综合征的方法,所述方法包括将伊班膦酸施用至有此需要的人。实施方式84.治疗复杂区域性疼痛综合征的方法,所述方法包括将利塞膦酸施用至有此需要的人。实施方式85.治疗疼痛的方法,所述方法包括将帕米膦酸施用至有此需要的人。实施方式86.治疗疼痛的方法,所述方法包括将奈立膦酸施用至有此需要的人。实施方式87.治疗疼痛的方法,所述方法包括将奥帕膦酸施用至有此需要的人。实施方式88.治疗疼痛的方法,所述方法包括将阿仑膦酸施用至有此需要的人。实施方式89.治疗疼痛的方法,所述方法包括将英卡膦酸施用至有此需要的人。实施方式90.治疗疼痛的方法,所述方法包括将伊班膦酸施用至有此需要的人。实施方式91.治疗疼痛的方法,所述方法包括将利塞膦酸施用至有此需要的人。实施方式92.治疗关节炎疼痛的方法,所述方法包括将帕米膦酸施用至有此需要的人。实施方式93.治疗关节炎疼痛的方法,所述方法包括将奈立膦酸施用至有此需要的人。实施方式94.治疗关节炎疼痛的方法,所述方法包括将奥帕膦酸施用至有此需要的人。实施方式95.治疗关节炎疼痛的方法,所述方法包括将阿仑膦酸施用至有此需要的人。实施方式96.治疗关节炎疼痛的方法,所述方法包括将英卡膦酸施用至有此需要的人。实施方式97.治疗关节炎疼痛的方法,所述方法包括将伊班膦酸施用至有此需要的人。实施方式98.治疗关节炎疼痛的方法,所述方法包括将利塞膦酸施用至有此需要的人。实施方式99.治疗炎性疼痛的方法,所述方法包括将帕米膦酸施用至有此需要的人。实施方式100.治疗炎性疼痛的方法,所述方法包括将奈立膦酸施用至有此需要的人。实施方式101.治疗炎性疼痛的方法,所述方法包括将奥帕膦酸施用至有此需要的人。实施方式102.治疗炎性疼痛的方法,所述方法包括将阿仑膦酸施用至有此需要的人。实施方式103.治疗炎性疼痛的方法,所述方法包括将英卡膦酸施用至有此需要的人。实施方式104.治疗炎性疼痛的方法,所述方法包括将伊班膦酸施用至有此需要的人。实施方式105.治疗炎性疼痛的方法,所述方法包括将利塞膦酸施用至有此需要的人。实施方式106.治疗复杂区域性疼痛综合征的方法,所述方法包括将依替膦酸施用至有此需要的人。实施方式107.治疗疼痛的方法,所述方法包括将依替膦酸施用至有此需要的人。实施方式108.治疗关节炎疼痛的方法,所述方法包括将依替膦酸施用至有此需要的人。实施方式109.治疗炎性疼痛的方法,所述方法包括将依替膦酸施用至有此需要的人。实施方式110.治疗复杂区域性疼痛综合征的方法,所述方法包括将氯膦酸施用至有此需要的人。实施方式111.治疗疼痛的方法,所述方法包括将氯膦酸施用至有此需要的人。实施方式112.治疗关节炎疼痛的方法,所述方法包括将氯膦酸施用至有此需要的人。实施方式113.治疗炎性疼痛的方法,所述方法包括将氯膦酸施用至有此需要的人。实施方式114.治疗复杂区域性疼痛综合征的方法,所述方法包括将替鲁膦酸施用至有此需要的人。实施方式115.治疗疼痛的方法,所述方法包括将替鲁膦酸施用至有此需要的人。实施方式116.治疗关节炎疼痛的方法,所述方法包括将替鲁膦酸施用至有此需要的人。实施方式117.治疗炎性疼痛的方法,所述方法包括将替鲁膦酸施用至有此需要的人。实施方式118.根据实施方式78至117中任一种所述的方法,其中活性化合物经口施用。实施方式119.根据实施方式78至117中任一种所述的方法,其中活性化合物经肠胃外施用。实施方式120.提高唑来膦酸的口服生物利用率的方法,所述方法包括经口施用含二钠盐形式的唑来膦酸的剂型。实施方式121.根据实施方式120所述的方法,其中相较于二酸形式的唑来膦酸,所述二钠盐形式的唑来膦酸提供生物利用率的提高,所述提高累积到由所述剂型中的任何生物利用率提高剂所提供的生物利用率的任何提高之上。实施方式122.根据实施方式120所述的方法,其中所述剂型基本上不含生物利用率提高剂。实施方式123.根据实施方式120所述的方法,其中向哺乳动物施用一定量的所述二钠盐形式的唑来膦酸,以使得每次施用所述二钠盐形式的唑来膦酸向所述哺乳动物提供约4ng·h/mL至约2000ng·h/mL的唑来膦酸血浆浓度曲线下面积。实施方式124.根据实施方式123所述的方法,其中间隔约3周至约4周施用一定量的所述二钠盐形式的唑来膦酸,以使得每次施用所述二钠盐形式的唑来膦酸向所述哺乳动物提供约100ng·h/mL至约2000ng·h/mL的唑来膦酸血浆浓度曲线下面积。实施方式125.根据实施方式123所述的方法,其中每周一次或一个月3-5次施用一定量的所述二钠盐形式的唑来膦酸,以使得每次施用所述二钠盐形式的唑来膦酸时向所述哺乳动物提供约20ng·h/mL至约700ng·h/mL的唑来膦酸血浆浓度曲线下面积。实施方式126.根据实施方式123所述的方法,其中每天一次施用一定量的所述二钠盐形式的唑来膦酸,以使得每次施用所述二钠盐形式的唑来膦酸向所述哺乳动物提供约4ng·h/mL至约100ng·h/mL的唑来膦酸血浆浓度曲线下面积。实施方式127.根据实施方式120所述的方法,其中所述剂型是固体。实施方式128.根据实施方式120、121、122、123、124、125、126或127所述的方法,其中相较于施用二酸形式的唑来膦酸,唑来膦酸的生物利用率提高至少约20%。实施方式129.根据实施方式120、121、122、123、124、125、126、127或128所述的方法,所述方法还包括施用(在摩尔基础上)比施用的二酸形式的唑来膦酸更少的二钠盐形式的唑来膦酸,以获得相同的唑来膦酸血浆水平。实施方式130.根据实施方式129所述的方法,其中施用比施用的二酸形式的唑来膦酸的量少至少约10摩尔%的二钠盐形式,以获得相同的唑来膦酸血浆水平。实施方式131.根据实施方式129所述的方法,其中施用一定量的二钠盐形式,在摩尔基础上所述量具有约0.8nd至约1.2nd的值,其中:nd=(ba/bd)(na)其中ba是所述二酸形式的生物利用率,bd是所述二钠盐形式的生物利用率,且na是为了获得相同的唑来膦酸血浆水平要施用的二酸形式的唑来膦酸的摩尔数。实施方式132.根据实施方式131所述的方法,其中施用一定量的二钠盐,所述量具有约nd的值。实施方式133.根据实施方式120-132中任一种所述的方法,其中所述唑来膦酸用于治疗炎性病症。实施方式134.根据实施方式133所述的方法,其中所述唑来膦酸用于治疗关节炎。实施方式135.根据实施方式133所述的方法,其中所述唑来膦酸用于治疗复杂区域性疼痛综合征。实施方式136.根据实施方式1-39、62-77和120-135中任一种所述的方法,其中:施用第一口服剂型;并施用第二口服剂型;其中,相对于所述第一口服剂型,在10xTmax或更晚时施用所述第二口服剂型,其中Tmax是所述第一口服剂型的最大血浆浓度的时间。实施方式137.包含二钠盐形式的唑来膦酸的剂型,其中在哺乳动物中,二钠盐形式的唑来膦酸的生物利用率比相同剂型中二酸形式的唑来膦酸的生物利用率高。实施方式138.包含二钠盐形式的唑来膦酸的剂型,其中所述剂型包含一定量的二钠盐形式的唑来膦酸,以使得向被施用所述剂型的人提供约4ng·h/mL至约2000ng·h/mL的唑来膦酸血浆浓度曲线下面积。实施方式139.根据实施方式138所述的剂型,其中所述剂型包含一定量的二钠盐形式的唑来膦酸,以使得向被施用所述剂型的人提供约100ng·h/mL至约2000ng·h/mL的唑来膦酸血浆浓度曲线下面积。实施方式140.根据实施方式138所述的剂型,其中所述剂型包含一定量的二钠盐形式的唑来膦酸,以使得向被施用所述剂型的人提供约20ng·h/mL至约700ng·h/mL的唑来膦酸血浆浓度曲线下面积。实施方式141.根据实施方式138所述的剂型,其中所述剂型包含一定量的二钠盐形式的唑来膦酸,以使得向被施用所述剂型的人提供约4ng·h/mL至约100ng·h/mL的唑来膦酸血浆浓度曲线下面积。实施方式142.包含二钠盐形式的唑来膦酸的剂型,其中相较于唑来膦酸以二酸形式存在时的摩尔量,所述二钠盐形式以更低的摩尔量存在;且其中相较于二酸形式的唑来膦酸,所述二钠盐形式的唑来膦酸具有提高的生物利用率,以至于所述剂型中更低摩尔量的二钠盐不会减少递送至哺乳动物血浆的唑来膦酸的量。实施方式143.根据实施方式137、138、139、140、141或142所述的剂型,其中所述剂型是固体。实施方式144.根据实施方式142或143所述的剂型,其中二钠盐形式的唑来膦酸的生物利用率相较于含二酸形式的唑来膦酸的在其它方面相同的剂型的生物利用率提高至少约10%。实施方式145.根据实施方式142、143或144所述的剂型,所述剂型包含比唑来膦酸为二酸形式时会存在的二酸形式的唑来膦酸的量少至少约20摩尔%的二钠盐形式。实施方式146.根据实施方式142所述的剂型,其中存在一定量的所述二钠盐形式,在摩尔基础上所述量具有约0.9nd至约1.1nd的值,其中:nd=(ba/bd)(na)其中ba是所述二酸形式的生物利用率,bd是所述二钠盐形式的生物利用率,且na是唑来膦酸为二酸形式时会存在的二酸形式的摩尔数。实施方式147.根据实施方式146所述的剂型,其中施用一定量的二钠盐,所述量具有约nd的值。实施方式148.根据实施方式1-39、62-77和120-136中任一种所述的方法,其中:仅施用一种口服剂型;或者施用第一口服剂型,并在所述第一口服剂型之后施用第二口服剂型,其中在获得所述第一口服剂型的最大疼痛减轻效果之前施用所述第二口服剂型,或者在获得可察觉的疼痛减轻效果之前施用所述第二口服剂型。实施方式149.根据实施方式148所述的方法,其中在获得可察觉的疼痛减轻效果之前施用所述第二口服剂型。实施方式150.根据实施方式1-39、62-77和120-132中任一种所述的方法,其中施用第一口服剂型,随后施用第二口服剂型,其中在获得所述第一口服剂型的最大疼痛减轻效果之后施用所述第二口服剂型,并在可察觉来自所述第一口服剂型的疼痛减轻效果时施用所述第二口服剂型。实施方式151.根据实施方式148、149或150所述的方法,其中在施用所述第一剂型后的约24小时至约28天施用所述第二口服剂型。实施方式152.根据实施方式20-39中任一种所述的方法,其中所述人为约30岁至约75岁。实施方式153.根据实施方式20-39中任一种所述的方法,其中所述人为约1岁至约16岁。实施方式154.根据实施方式20-39中任一种所述的方法,其中所述人为约80岁至约95岁。实施方式155.根据实施方式20-39中任一种所述的方法,其中所述人已罹患关节炎至少2个月。实施方式156.根据实施方式20-39中任一种所述的方法,其中所述关节炎影响膝、肘、腕、肩或髋部。实施方式157.根据实施方式1-44、62-133和144-156中任一种所述的方法,其中被施用唑来膦酸的哺乳动物或人在施用唑来膦酸之前的至少1小时不吃食物且不喝饮料。实施方式158.根据实施方式157所述的方法,其中被施用唑来膦酸的哺乳动物或人在施用唑来膦酸之前的至少2小时不吃食物且不喝饮料。实施方式159.根据实施方式158所述的方法,其中被施用唑来膦酸的哺乳动物或人在施用唑来膦酸之前的至少4小时不吃食物且不喝饮料。实施方式160.根据实施方式159所述的方法,其中被施用唑来膦酸的哺乳动物或人在施用唑来膦酸之前的至少6小时不吃食物且不喝饮料。实施方式161.根据实施方式157-160中任一种所述的方法,其中被施用唑来膦酸的哺乳动物或人在施用唑来膦酸之后的至少30分钟不吃食物且不喝饮料。实施方式162.根据实施方式161所述的方法,其中被施用唑来膦酸的哺乳动物或人在施用唑来膦酸之后的至少1小时不吃食物且不喝饮料。实施方式163.根据实施方式161所述的方法,其中被施用唑来膦酸的哺乳动物或人在施用唑来膦酸之后的至少2小时不吃食物且不喝饮料。实施方式164.根据任何在前实施方式所述的方法、剂型或产品,其中所述口服剂型中的唑来膦酸具有约1或更高的24小时持续血浆水平因子。实施方式165.根据任何在前实施方式所述的方法、剂型或产品,其中所述口服剂型中的唑来膦酸的24小时持续血浆水平因子比静脉内施用的唑来膦酸的24小时持续血浆水平因子高。实施方式166.根据任何在前实施方式所述的方法、剂型或产品,其中所述口服剂型是硬度为约5kPa至约20kPa的固体。实施方式167.治疗骨髓病变的方法,所述方法包括:选择具有骨髓病变和OARSI0级关节间隙狭窄的患者,和向所述患者施用破骨细胞活性抑制剂以治疗所述骨髓病变。实施方式168.根据实施方式167所述的方法,其中施用所述破骨细胞活性抑制剂至少两次。实施方式169.根据实施方式167所述的方法,其中约每3个月一次或更频繁地施用所述破骨细胞活性抑制剂。实施方式170.根据实施方式167所述的方法,其中所述破骨细胞活性抑制剂包括含氮的双膦酸类化合物。实施方式171.根据实施方式167-170中任一种所述的方法,其中所述破骨细胞活性抑制剂是或者包括唑来膦酸。实施方式172.根据实施方式167-170中任一种所述的方法,其中所述破骨细胞活性抑制剂是或者包括帕米膦酸。实施方式173.根据实施方式167-170中任一种所述的方法,其中所述破骨细胞活性抑制剂是或者包括奈立膦酸。实施方式174.根据实施方式167-170中任一种所述的方法,其中所述破骨细胞活性抑制剂是或者包括奥帕膦酸。实施方式175.根据实施方式167-170中任一种所述的方法,其中所述破骨细胞活性抑制剂是或者包括阿仑膦酸。实施方式176.根据实施方式167-170中任一种所述的方法,其中所述破骨细胞活性抑制剂是或者包括英卡膦酸。实施方式177.根据实施方式167-170中任一种所述的方法,其中所述破骨细胞活性抑制剂是或者包括伊班膦酸。实施方式178.根据实施方式167-170中任一种所述的方法,其中所述破骨细胞活性抑制剂是或者包括利塞膦酸。实施方式179.根据实施方式167-178中任一种所述的方法,其中经口施用所述破骨细胞活性抑制剂。实施方式180.根据实施方式167-178中任一种所述的方法,其中静脉内施用所述破骨细胞活性抑制剂。实施方式181.根据实施方式167-180中任一种所述的方法,其中患者经历的骨髓病变大小减少比利用安慰剂获得的骨髓病变大小减少多至少约100%。实施方式182.根据实施方式167-180中任一种所述的方法,其中患者经历的骨髓病变大小减少比利用安慰剂获得的骨髓病变大小减少多至少约150%。实施方式183.根据实施方式167-182中任一种所述的方法,其中在至少4周期间施用所述破骨细胞活性抑制剂至少2次。实施方式184.根据实施方式167-183中任一种所述的方法,其中每周施用所述破骨细胞活性抑制剂一次,持续6周。实施方式185.根据实施方式167-184中任一种所述的方法,其中所述破骨细胞活性抑制剂包括唑来膦酸,且周剂量为约25mg至约75mg。实施方式186.治疗膝痛的方法,所述方法包括:选择具有膝痛和OARSI0级关节间隙狭窄的患者,和向所述患者施用破骨细胞活性抑制剂以治疗所述膝痛。实施方式187.根据实施方式186所述的方法,其中施用所述破骨细胞活性抑制剂至少两次。实施方式188.根据实施方式186-187中任一种所述的方法,其中约每3个月一次或更频繁地施用所述破骨细胞活性抑制剂。实施方式189.根据实施方式186-188中任一种所述的方法,其中所述破骨细胞活性抑制剂包括含氮的双膦酸类化合物。实施方式190.根据实施方式186-189中任一种所述的方法,其中施用所述破骨细胞活性抑制剂之后3个月,所述患者经历疼痛减轻。实施方式191.根据实施方式186-190中任一种所述的方法,其中所述破骨细胞活性抑制剂是或者包括唑来膦酸。实施方式192.根据实施方式186-190中任一种所述的方法,其中所述破骨细胞活性抑制剂是或者包括帕米膦酸。实施方式193.根据实施方式186-190中任一种所述的方法,其中所述破骨细胞活性抑制剂是或者包括奈立膦酸。实施方式194.根据实施方式186-190中任一种所述的方法,其中所述破骨细胞活性抑制剂是或者包括奥帕膦酸。实施方式195.根据实施方式186-190中任一种所述的方法,其中所述破骨细胞活性抑制剂是或者包括阿仑膦酸。实施方式196.根据实施方式186-190中任一种所述的方法,其中所述破骨细胞活性抑制剂是或者包括英卡膦酸。实施方式197.根据实施方式186-190中任一种所述的方法,其中所述破骨细胞活性抑制剂是或者包括伊班膦酸。实施方式198.根据实施方式186-190中任一种所述的方法,其中所述破骨细胞活性抑制剂是或者包括利塞膦酸。实施方式199.根据实施方式186-198中任一种所述的方法,其中当使用100mm视觉模拟量表时,所述患者经历至少约20的疼痛强度减小。实施方式200.治疗膝骨髓病变的方法,所述方法包括:选择具有膝骨髓病变和OARSI0级或者KellgrenandLawrence0级或1级关节间隙狭窄的患者,和向所述患者施用破骨细胞活性抑制剂以治疗所述骨髓病变。实施方式201.根据实施方式200所述的方法,其中施用所述破骨细胞活性抑制剂至少两次。实施方式202.根据实施方式201所述的方法,其中约每3个月一次或更频繁地施用所述破骨细胞活性抑制剂。实施方式203.根据实施方式200所述的方法,其中所述破骨细胞活性抑制剂包括含氮的双膦酸类化合物。实施方式204.根据实施方式203所述的方法,其中所述破骨细胞活性抑制剂是唑来膦酸。实施方式205.根据实施方式203所述的方法,其中所述破骨细胞活性抑制剂是帕米膦酸。实施方式206.根据实施方式203所述的方法,其中所述破骨细胞活性抑制剂是奈立膦酸。实施方式207.根据实施方式203所述的方法,其中所述破骨细胞活性抑制剂是奥帕膦酸。实施方式208.根据实施方式203所述的方法,其中所述破骨细胞活性抑制剂是米诺膦酸。实施方式209.根据实施方式203所述的方法,其中所述破骨细胞活性抑制剂是英卡膦酸。实施方式210.根据实施方式203所述的方法,其中所述破骨细胞活性抑制剂是伊班膦酸。实施方式211.根据实施方式203所述的方法,其中所述破骨细胞活性抑制剂是利塞膦酸。实施方式212.根据实施方式203所述的方法,其中所述破骨细胞活性抑制剂是阿仑膦酸。实施方式213.根据实施方式200所述的方法,其中经口施用所述破骨细胞活性抑制剂。实施方式214.根据实施方式200所述的方法,其中静脉内施用所述破骨细胞活性抑制剂。实施方式215.根据实施方式200所述的方法,其中在向所述患者施用所述破骨细胞活性抑制剂之后的约6个月内,所述患者经历至少约15%的骨髓病变大小减少。实施方式216.根据实施方式200所述的方法,其中在向所述患者施用所述破骨细胞活性抑制剂之后的约6个月内,所述患者经历至少约25%的骨髓病变大小减少。实施方式217.根据实施方式201所述的方法,其中在至少4周期间施用所述破骨细胞活性抑制剂至少2次。实施方式218.根据实施方式201所述的方法,其中每周施用所述破骨细胞活性抑制剂一次持续6周。实施方式219.根据实施方式218所述的方法,其中所述破骨细胞活性抑制剂包括唑来膦酸,且周剂量为约25mg至约75mg。实施方式220.治疗膝痛的方法,所述方法包括:a.选择具有膝痛的患者,所述患者还具有:i.OARSI0级或者KellgrenandLawrence0级或1级关节间隙狭窄,或者ii.使用0-10NRS测量为5或者更高的疼痛强度或者使用10cmVAS测量为5cm或者更高的疼痛强度;和b.向所述患者施用破骨细胞活性抑制剂。实施方式221.根据实施方式220所述的方法,所述方法包括:选择具有OARSI0级或者KellgrenandLawrence0级或1级关节间隙狭窄的患者。实施方式222.根据实施方式220或221所述的方法,所述方法包括:选择具有使用0-10NRS测量为5或者更高的疼痛强度或者使用10cmVAS测量为5cm或者更高的疼痛强度的患者。实施方式223.根据实施方式220所述的方法,其中施用所述破骨细胞活性抑制剂至少两次。实施方式224.根据实施方式223所述的方法,其中约每3个月一次或更频繁地施用所述破骨细胞活性抑制剂。实施方式225.根据实施方式220所述的方法,其中所述破骨细胞活性抑制剂包括含氮的双膦酸类化合物。实施方式226.根据实施方式220所述的方法,其中向所述患者施用所述破骨细胞活性抑制剂之后约3个月内,所述患者经历疼痛减轻。实施方式227.根据实施方式226所述的方法,其中向所述患者施用所述破骨细胞活性抑制剂之后至少24小时,所述患者经历疼痛减轻。实施方式228.根据实施方式220所述的方法,其中所述破骨细胞活性抑制剂是唑来膦酸。实施方式229.根据实施方式220所述的方法,其中所述破骨细胞活性抑制剂是米诺膦酸。实施方式230.根据实施方式220所述的方法,其中所述破骨细胞活性抑制剂是奈立膦酸。实施方式231.根据实施方式220所述的方法,其中所述破骨细胞活性抑制剂是奥帕膦酸。实施方式232.根据实施方式220所述的方法,其中所述破骨细胞活性抑制剂是阿仑膦酸。实施方式233.根据实施方式220所述的方法,其中所述破骨细胞活性抑制剂是英卡膦酸。实施方式234.根据实施方式220所述的方法,其中所述破骨细胞活性抑制剂是伊班膦酸。实施方式235.根据实施方式220所述的方法,其中所述破骨细胞活性抑制剂是利塞膦酸。实施方式236.根据实施方式220所述的方法,其中当使用100mm视觉模拟量表时,所述患者经历至少约5的疼痛强度减小。实施方式237.根据实施方式220所述的方法,其中在至少4周期间施用所述破骨细胞活性抑制剂至少2次。实施方式238.根据实施方式220所述的方法,其中每周施用所述破骨细胞活性抑制剂一次持续6周。实施方式239.根据实施方式238所述的方法,其中所述破骨细胞活性抑制剂包括唑来膦酸,且周剂量为约25mg至约75mg。实施方式240.治疗中度至重度膝痛的方法,所述方法包括:向罹患中度至重度膝痛的人施用破骨细胞活性抑制剂。实施方式241.根据实施方式240所述的方法,其中所述罹患中度至重度膝痛的人的膝部具有正常关节间隙。实施方式242.根据实施方式240所述的方法,其中施用所述破骨细胞活性抑制剂至少两次。实施方式243.根据实施方式240所述的方法,其中约每3个月一次或更频繁地施用所述破骨细胞活性抑制剂。实施方式244.根据实施方式240所述的方法,其中所述破骨细胞活性抑制剂包括含氮的双膦酸类化合物。实施方式245.根据实施方式240所述的方法,其中向所述患者施用所述破骨细胞活性抑制剂之后约3个月内,所述患者经历疼痛减轻。实施方式246.根据实施方式245所述的方法,其中向所述患者施用所述破骨细胞活性抑制剂之后至少24小时,所述患者经历疼痛减轻。实施方式247.根据实施方式240所述的方法,其中所述破骨细胞活性抑制剂是唑来膦酸。实施方式248.根据实施方式240所述的方法,其中所述破骨细胞活性抑制剂是米诺膦酸。实施方式249.根据实施方式240所述的方法,其中所述破骨细胞活性抑制剂是奈立膦酸。实施方式250.根据实施方式240所述的方法,其中所述破骨细胞活性抑制剂是奥帕膦酸。实施方式251.根据实施方式240所述的方法,其中所述破骨细胞活性抑制剂是阿仑膦酸。实施方式252.根据实施方式240所述的方法,其中所述破骨细胞活性抑制剂是英卡膦酸。实施方式253.根据实施方式240所述的方法,其中所述破骨细胞活性抑制剂是伊班膦酸。实施方式254.根据实施方式240所述的方法,其中所述破骨细胞活性抑制剂是利塞膦酸。实施方式255.根据实施方式240所述的方法,其中当使用100mm视觉模拟量表时,所述患者经历至少约5的疼痛强度减小。实施方式256.根据实施方式240所述的方法,其中在至少4周期间施用所述破骨细胞活性抑制剂至少2次。实施方式257.根据实施方式240所述的方法,其中每周施用所述破骨细胞活性抑制剂一次持续6周。实施方式258.根据实施方式257所述的方法,其中所述破骨细胞活性抑制剂包括唑来膦酸,且周剂量为约25mg至约75mg。实施方式259.通过重复口服施用向哺乳动物的血安全递送唑来膦酸的方法,所述方法包括:以不高于每天一次且高于每周一次的频率向所述哺乳动物经口施用约0.4mg/kg至约4mg/kg唑来膦酸;或者每周一次或者以更低频率向所述哺乳动物经口施用约0.4mg/kg至约10mg/kg唑来膦酸。实施方式260.根据任何在前实施方式例如实施方式259所述的方法,其中每天一次向所述哺乳动物经口施用约0.5mg/kg至约2mg/kg唑来膦酸。实施方式261.根据任何在前实施方式例如实施方式260所述的方法,其中每天一次向所述哺乳动物经口施用约0.6mg/kg至约0.9mg/kg唑来膦酸。实施方式262.根据任何在前实施方式例如实施方式259所述的方法,其中每周一次向所述哺乳动物经口施用约0.5mg/kg至约2mg/kg唑来膦酸。实施方式263.根据任何在前实施方式例如实施方式263所述的方法,其中每周一次向所述哺乳动物经口施用约0.6mg/kg至约0.9mg/kg唑来膦酸。实施方式264.根据任何在前实施方式例如实施方式259、260、261、262或263所述的方法,其中经口施用唑来膦酸约3次至约10次。实施方式265.根据任何在前实施方式例如实施方式259、260、261、262、263或264所述的方法,其中以包含多于约10重量%唑来膦酸的剂型经口施用唑来膦酸。实施方式266.根据任何在前实施方式例如实施方式259、260、261、262、263、264或265所述的方法,其中以一定的方式和量施用唑来膦酸,以使得每次施用唑来膦酸,所述哺乳动物具有约50ng·h/mL至约500ng·h/mL的唑来膦酸的AUC0-24。实施方式267.根据任何在前实施方式例如实施方式266所述的方法,其中以一定的方式和量施用唑来膦酸,以使得每次施用唑来膦酸,所述哺乳动物具有约100ng·h/mL至约500ng·h/mL的唑来膦酸的AUC0-24。实施方式268.制备对于向哺乳动物重复施用而言是安全的口服剂型的方法,所述方法包括:将唑来膦酸与对于所述哺乳动物而言可药用的赋形剂组合,其中与所述赋形剂组合的唑来膦酸的量是这样的,其使得唑来膦酸在所述口服剂型中的存在量基于所述哺乳动物的重量计为0.4mg/kg至约10mg/kg。实施方式269.根据任何在前实施方式例如实施方式268所述的方法,其中与所述赋形剂组合的唑来膦酸的量是这样的,其使得所述口服剂型包含不多于约10重量%唑来膦酸。实施方式270.根据任何在前实施方式例如实施方式268或269所述的方法,其中与所述赋形剂组合的唑来膦酸的量是这样的,其使得唑来膦酸在所述口服剂型中的存在量基于所述哺乳动物的重量计为0.4mg/kg至约3mg/kg。实施方式271.根据任何在前实施方式例如实施方式270所述的方法,其中与所述赋形剂组合的唑来膦酸的量是这样的,其使得唑来膦酸在所述口服剂型中的存在量基于所述哺乳动物的重量计为0.4mg/kg至约1.5mg/kg。实施方式272.根据任何在前实施方式例如实施方式270所述的方法,其中与所述赋形剂组合的唑来膦酸的量是这样的,其使得唑来膦酸在所述口服剂型中的存在量基于所述哺乳动物的重量计为0.6mg/kg至约0.9mg/kg。实施方式273.根据任何在前实施方式例如实施方式268、269、270、271或272所述的方法,其中所述口服剂型对于持续约3天至约10天每天一次施用所述口服剂型是安全的。实施方式274.根据任何在前实施方式例如实施方式268、269、270、271或272所述的方法,其中所述口服剂型对于持续约3周至约10周每周施用所述口服剂型一次而言是安全的。实施方式275.通过重复口服施用向哺乳动物的血安全递送唑来膦酸的方法,所述方法包括:以不高于每天一次且高于每周一次的频率向所述哺乳动物经口施用约0.05mg/kg至约4mg/kg唑来膦酸;或者每周一次或者以更低频率向所述哺乳动物经口施用约0.1mg/kg至约10mg/kg唑来膦酸,其中经口施用唑来膦酸至少5次。实施方式276.根据任何在前实施方式例如实施方式275所述的方法,其中经口施用唑来膦酸约5次至约10次。实施方式277.根据任何在前实施方式例如实施方式275或276所述的方法,其中以包含多于约10重量%唑来膦酸的剂型经口施用唑来膦酸。实施方式278.根据任何在前实施方式例如实施方式259、260、261、262、263、264、265、266、267、268、269、270、271、272、273、274、275、276或277所述的方法,其中所述哺乳动物是人。实施方式279.根据任何在前实施方式例如实施方式259、260、261、262、263、264、265、266、267、268、269、270、271、272、273、274、275、276、277或278所述的方法,其中每个月向所述哺乳动物施用约50mg至约350mg口服唑来膦酸。实施方式280.通过根据任何在前实施方式例如实施方式259、260、261、262、263、264、265、266、267、268、269、270、271、272、273、274、275、276、277、278或279所述的方法制备的口服剂型。除另指出外,在所有情况下,说明书和权利要求中所使用的所有表示成分数量、性质(如分子量)、反应条件等的数值均应理解成同时指示所示精确值和受术语“约”修饰。因此,除非有相反的说明,说明书和所附权利要求中列出的数值参数均为近似值,其可根据想要获得的期望性质而改变。在最低程度上,且并不旨在将等同原则的应用限制于权利要求保护的范围,每个数字参数至少应该根据所报告数字的有效数位和通过惯常的四舍五入法来理解每一个数字参数。描述本发明的内容时,不使用数量词时(尤其在权利要求书的上下文中)应解释为涵盖单数和复数,除非另外指明或者与上下文明显矛盾。除非在本文中另外指明或同上下文明显抵触,否则本文所述的所有方法均可以任何适当的顺序进行。本文中所提供的任何和所有实例或示例性语句(如″例如″)的使用仅意欲用来更好地阐述本发明,而非对任何权利要求的范围进行限制。说明书中的任何语言均不应理解为指示任何未要求保护的要素对于本发明的实施而言是必须的。本文公开的替代要素或实施方式的分组不应理解为限制性的。各个组组员可以单独地或者以与所述组的其它组员或者本文内的其它要素任意组合被指代且要求保护。应当预期,组的一个或更多个组员可以由于方便和/或专利性的原因包含在组中或从组中删除。当出现任何这类包含或删除时,认为说明书包含所改写的组,从而满足用于所附权利要求中的所有马库什组的书面描述。本文描述了本发明的某些实施方式,包括本发明的发明人已知的实现本发明的最佳模式。当然,本领域普通技术人员阅读上述描述后将意识到这些描述的实施方式的变型。发明人预期熟练的技术人员可适当地采用此类变型,并且发明人意欲使得本发明以与本文具体描述不同的方式实施。因此,权利要求在适用法律允许的条件下包括权利要求中所提及主题的所有修改形式和等效形式。此外,除非在本文中另外指明或同上下文明显抵触,否则还涵盖上述要素以所有可能方式的任意组合。最后,应理解本文所公开的实施方式仅用于阐述权利要求的原则。其它可用的修改也在本发明的范围内。因此,通过示例而非限制方式,可根据本文的教导利用本发明的替代实施方式。因此,权利要求并不限于如精确所示和所述的实施方式。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1