包含与血浆蛋白缀合的肝素的治疗性APAC分子的制作方法
本发明涉及具有抗血小板和抗凝(APAC)活性的抗血栓分子;其作为药物的用途;其作为抗凝剂和血小板抑制剂的选择性配置和用途,或者其主要作为抗凝剂或血小板抑制剂的选择性配置和用途;以及其产生方法。本发明在医疗和兽医行业均有应用。
发明背景
循环的血液从液态转变为凝胶样基质的这一凝结的生理过程是复杂的,并且涉及依次进行的多个生化反应。
凝血的生理过程涉及血小板的血管损伤特异性的活化、粘附和聚集,以产生最初的栓状物或密封物,随后纤维蛋白沉积并成熟以产生稳定的凝块。前面的血小板活性能够被血小板抑制剂抑制,而后面的纤维蛋白沉积能够被抗凝剂抑制。
差不多在血管损伤破坏血管的内皮衬和/或更深层之后立即开始凝血过程。血液暴露于内皮下的空间启动了两个过程:血小板改变和内皮下组织因子暴露于血浆凝结因子VII,在其它凝结因子中,凝结因子VII显著促进凝血酶生成和纤维蛋白形成。
当内皮被破坏时,下面的胶原蛋白暴露于循环的血小板,其经由胶原蛋白特异性的糖蛋白表面受体与胶原蛋白直接结合。间接地,血管性假血友病因子将血小板束缚至与胶原蛋白紧密接触,并且还将血小板与胶原蛋白桥接。血小板定位至细胞外基质促进胶原蛋白与血小板糖蛋白VI的相互作用,引发信号级联,导致血小板整合蛋白的活化并引起血小板随后粘附至损伤部位。这在损伤部位产生了直接的血小板形成的栓状物,称为初级止血。
次级止血同时发生,并且涉及所谓的‘凝结级联’。除了因子VII,还有其它的凝结因子或凝血因子在复杂的级联中响应,导致纤维蛋白原的酶切,从而形成增强血小板栓状物的纤维蛋白链。凝结级联由一系列步骤组成,其中蛋白酶切割并随后活化酶原,酶原然后按次序充当下一种蛋白酶。这些反应的结果是纤维蛋白原(一种可溶蛋白)在活化的血小板表面转变成不溶的纤维蛋白线状物。纤维蛋白线状物与聚集的血小板一起形成稳定的血块。关键性的血管性假血友病因子和纤维蛋白原由血小板以及其它血浆提供。
凝结级联被典型地(并且有点人为地)分成三条通路,首先为组织因子,然后为接触活化通路,其均活化因子X和凝血酶的第三“最终共同的通路”,导致纤维蛋白形成。组织因子通路的主要作用是生成“凝血酶爆发”,其为这样一个过程:通过该过程,凝血酶(就其反馈活化作用而言是凝结级联最重要的成分)被非常快速地形成。有趣的是,凝血酶是血小板活化和凝结之间的纽带,因为其尽管由凝结级联产生,但是其是最强有力的血小板活化剂,因而能够靶向该分子的治疗剂可能是极其有效的抗血栓剂。
凝结级联是旨在预防血管损伤之后大量的失血或出血的正常的生理过程。最终,血块被称为纤维蛋白溶解的过程再组织和再吸收。负责该过程的主要的酶(纤维蛋白溶解酶)由多种活化剂和抑制剂调控。此外,凝结系统与免疫和补体系统重叠,以便物理捕获血块中的入侵微生物,增加血管通透性并为吞噬细胞提供趋化剂。此外,凝结系统的一些产物直接就是抗微生物的。
然而,有时候,血块(还称为血栓)将在其不需要时形成。例如,一些高风险病况如急性内科疾病、长期卧床、外科手术或癌症能够增加出现血块的风险。此外,与凝结过程相关的生理问题可能使个体倾向于发生出血、血栓形成以及偶尔两者均发生,这可能具有与动脉粥样硬化的心血管疾病和/或心律失常相关的重大后果。
抗血小板剂和抗凝剂用于治疗凝血病症。抗血小板剂包括阿司匹林、双嘧达莫、噻氯匹啶、氯吡格雷、替格瑞洛和普拉格雷;肠胃外糖蛋白IIb/IIIa抑制剂在冠状动脉介入术(血管成形术和支架术)中使用。在抗凝剂中,华法林(和相关的香豆素类)以及肝素是最常使用的,但是直接口服的抗凝剂还包括凝血酶抑制剂达比加群和活化因子X的抑制剂,诸如利伐沙班、阿哌沙班和依度沙班。
抗凝血酶(AT)是丝氨酸蛋白酶抑制剂并且是凝结蛋白酶的主要血浆抑制剂之一。AT通过例如抑制凝血酶(因子IIa)和活化因子X(因子Xa)阻断/调控凝结级联。AT与这些因子的相互作用因肝素(未分级肝素;UFH)和低分子量肝素(LMWH;分级肝素)的存在而增加,所述肝素(未分级肝素;UFH)和低分子量肝素(LMWH;分级肝素)通过经由特异性戊多糖序列与AT的结合而抑制凝结过程。这种结合导致AT构象变化,这加速了其对因子IIa、Xa和参与凝血的其它蛋白酶的抑制。一旦解离,肝素和LMWH自由结合其它AT分子,然后抑制更多的凝血酶和因子Xa。
除了AT之外,还有其它天然存在的抗凝剂,其中蛋白C和S,组织因子通路抑制剂和肝素辅因子II起重要的作用。这些分子的活性也被肝素增强。
重要的是,标准肝素制剂用于血栓形成的全身治疗。它们在凝结活性盛行的缺乏血小板的血栓如静脉血栓中最有效。临床上使用的标准肝素尽管通过阻断血栓形成的进一步生长而在血栓形成的全身治疗中有效,但是单独并不足以有效预防与内源的粥样斑块破裂或外源的血管成形术或血管或微血管外科手术相关的血小板驱动的动脉血栓性并发症。
伴有或不伴有支架术的动脉介入术如血管成形术[PT(C)A=经皮腔内(冠状动脉)血管成形术]以及血管或微血管外科手术,以及(定向的)斑块切除术和外周或肺动脉内膜血栓切除术,代表了针对心血管疾病的发展的治疗方式。因此,伴随内源的血管或微血管损伤和/或外源的介入术如动静脉瘘或动静脉移植物的插入和维持而发生的血小板驱动的动脉血栓形成是经常遇到的问题,并且在这些情况下,血栓形成的传统的全身抗凝结治疗通常功效有限。
目前与动脉介入术相关的全身抗血栓治疗包括抗凝剂如UFH(平均15kDa)或LMWH(平均7.5kDa)与抗血小板药如乙酰水杨酸(环氧酶抑制剂)、氯吡格雷或其它ADP拮抗剂的组合。其它进展还表现为强有力的血小板糖蛋白IIb/IIIa、血管性假血友病因子和纤维蛋白原受体拮抗剂如阿昔单抗、替罗非班和依替巴肽。这些相对新的静脉内施用的组合治疗已成功预防30-35%的介入性治疗的血栓易发血管的急性血栓封闭。最初的需要输入血制品的住院患者的流血风险(大出血)为约6-7%,并且随着强有力的血小板ADP受体阻断剂的使用,在第一个月期间,门诊患者背景下,大出血增加至12-15%。如果在第一个月的随访期间自发流血,死亡的相关风险为15-30倍。
可惜的是,用未分级肝素的全身治疗有劣势,如不可预期的生物利用度、短半衰期、与蛋白的非特异性结合,导致受损的抗凝血酶/AT功能和免疫原性效应,其与血小板因子4(PF4)一起,导致血小板减少和血栓形成。这些有害效应已通过使用低分子量分级肝素而缓和,可惜的是,低分子量分级肝素由于对纤维蛋白结合的凝血酶和血小板结合的因子Xa的有限的作用以及由于血小板分泌的PF4对肝素活性的部分中和而对动脉血栓形成也功效有限。因此,对开发有效、可靠且安全的预防和/或治疗与血管或微血管损伤和介入术相关的血栓形成的治疗剂存在重大需求。
我们之前已发现(WO9926983),包含大链(75±25KDa)天然肝素蛋白聚糖(HEP-PG,可获自哺乳动物肥大细胞)的合成分子,当连接至蛋白核心时,表现出强有力的抗血栓特性,这基于其对经由血小板粘附至胶原蛋白所引发的血小板活化的强烈抑制而抑制血小板-胶原蛋白相互作用的能力。该分子因此被有效用作抗血小板治疗,最适合于局部应用,并且理想地与全身抗血小板药结合使用。有利的是,当局部施用时,该分子至少维持全身血小板功能,这确保了正常的止血反应。
其他研究人员(US 5,529,986)已制备了合成的抗血栓分子,其包含连接至直链聚酰胺如聚赖氨酸的未分级肝素链(约20-100条链)。该分子与上文WO9926983中所述的分子相比具有不同的作用机制,因为其结合抗凝血酶并增强其活性。因此,该分子作为抗凝剂是有效的。
我们正在进行的研究已引导我们开发出基于肝素使用的另一类合成的抗血栓分子。然而,我们已惊奇地发现,我们的新分子类别有利地具有抗血小板活性和抗凝活性。据我们所知,这是首次鉴定出这样的双重分子。而且,我们已经发现,我们的新颖的分子类别主要或者在较大程度上以抗血小板或抗凝方式起作用的倾向可以根据连接至各分子或包含在各分子中的肝素的量来操纵/设计。最后,我们还发现,我们的新颖的分子类别有利地具有局部作用,所以能够以靶向方式使用而不必担心全身效应。
发明概述
根据本发明的第一方面,提供了具有抗血小板和抗凝(APAC)活性的抗血栓分子,其包含血浆蛋白,所述血浆蛋白经由多个接头分子连接了多条肝素链,各条肝素链具有10-21KDa的MW,并且其中与所述血浆蛋白连接的所述肝素链的数目选自4、5、6、7、8、9、10、11、12、13、14、15和16。
利用指定浓度的肝素标准品(其提供可以读取/确定测试样品所针对的校正曲线),根据比色硫酸糖胺聚糖测定,Blyscan测定试剂盒(例如Biocolor Ltd.,UK)来确定本文提及的连接至所述血浆蛋白的肝素链的数量。因此,在发明的主要概述中提及的肝素链与表I的第1列相关。所用的具体测定在本文中描述。
抗血小板(AP)和抗凝(AC)活性是独特且极其有利的,因为其使得分子能够处理这样的情况:其中诸如在弯曲的血管或狭窄的血管(在狭窄部位需要AP)中以及远端和近端(当存在紊流并且血栓生长由凝血酶介导时需要AC作用)需要抗血小板活性和/或需要抗凝活性。
除了有利的双重功能性之外,我们还发现,本发明的分子对细胞外基质包括胶原蛋白和血管性假血友病因子具有强烈的结合能力,并且因此,它们具有靶向的局部抗血栓作用。这是相当可取的特性,因为其意味着分子能够在特定部位使用以治疗特定病况,而不必担心它们可能具有有害的全身抗血栓效应,这可能潜在地造成流血或出血。不管施用方式如何,即局部的还是全身的,存在这种有利的靶向。
本文提及靶向的抗血栓作用是指在应用部位保留本发明的分子持续显著的时段,例如24小时以上,并且此外,理想地,48小时以上、或50小时以上并且甚至高达120小时。值得注意的是,在血管外和血管内施用时均发生这种在应用部位的保留。
在本发明的优选实施方案中,所述血浆蛋白是白蛋白、球蛋白或纤维蛋白原,理想地,其是血清白蛋白或α2-巨球蛋白,并且更理想地是人血清白蛋白(HSA)或人α2-巨球蛋白。如通常所了解的,血清白蛋白由肝脏产生,在血浆中溶解并且是哺乳动物中最丰富的血液蛋白。血清白蛋白是约66,000道尔顿分子量的球形水溶性蛋白。还如所了解的,α2-巨球蛋白(α2M和A2M)是大的血浆蛋白,事实上,其是血浆中最大的主要的非免疫球蛋白性的蛋白,并且主要由肝脏产生。α2-巨球蛋白充当抗-蛋白酶,并且能够使很多种蛋白酶失活。
在本发明的另一优选实施方案中,所述血浆蛋白是重组的。
在本发明的另一优选实施方案中,所述肝素是未分级肝素。更理想地,所述肝素是哺乳动物来源的,理想地,是人的、或猪的。在血浆蛋白是人的,而肝素是猪或牛的肝素的情况下,所述APAC分子代表嵌合分子。
优选地,肝素具有选自以下的MW:10、11、12、13、14、15、16、17、18、19、20或21KDa,理想地15或16或17KDa。
在本发明的另一优选实施方案中,所述肝素是重组的。
在本发明的更优选的实施方案中,至少当所述肝素与所述血浆蛋白的连接是完全的时候,所述接头分子是结合一分子肝素的单个接头分子,因此,一个接头分子与所述血浆蛋白的连接导致一分子肝素与所述血浆蛋白的连接。因此,所述接头与所述肝素的化学计量为1:1。优选地,所述接头是胺接头,并且所以与所述肝素和血浆蛋白上的氨基连接,理想地但不排除地,所述接头与肝素链上的丝氨酸(理想地,所述丝氨酸位于所述链的末端或末端附近),以及理想地但不排除地,血浆蛋白上的赖氨酸缀合。更理想地,所述接头通过使用二硫键将所述肝素与血浆蛋白缀合。更优选地,所述接头是异型双功能交联接头如SPDP接头或同型双功能交联接头如DTSP接头。
SPDP(可从例如Sigma-Aldrich或Thermo Scientific Pierce商购获得)是用于经由N-羟基丁二酰亚胺(NHS)–酯和吡啶基二硫基反应基的胺与巯基缀合的短链交联接头,并且其与半胱氨酸的巯基形成可切割的(可还原的)二硫键。其可获得短链和长链版本。长链版本可以磺化形式获得并且是水溶性的。我们优选使用3-(2-吡啶基二硫基)丙酸N-羟基丁二酰亚胺酯。尽管所有SPDP均含有胺-反应性N-羟基丁二酰亚胺(NHS)酯,其将与赖氨酸残基反应以形成稳定的酰胺键,在接头的另一端,存在吡啶基二硫基,其将与巯基反应以形成可逆二硫键。
DTSP(3,3’-二硫代二丙酸二(N-羟基丁二酰亚胺(NHS)-酯),可从例如Sigma-Aldrich或Thermo Scientific Pierce商购获得)是用于经由N-羟基丁二酰亚胺(NHS)酯基的胺与胺缀合的短链交联接头。其可获得短链和长链版本。长链版本可以磺化形式(N-羟基琥珀酰亚胺(硫代-NHS)酯)获得并且是水溶性的。DTSP含有两个胺-反应性N-羟基丁二酰亚胺(NHS)酯基和在间隔臂中的二硫键。N-羟基丁二酰亚胺酯与含有伯胺的残基反应以形成稳定的酰胺键,其在接头分子中有可切割的二硫键。
因此,我们优选的合成分子的通式可按下文书写:
(Hep-接头)n-PlPr
其中n=4-16;
PlPr为血浆蛋白如人血清白蛋白或人α2-巨球蛋白;并且
肝素链为10-21KDa。
更具体地,当我们使用我们优选的接头3-(2-吡啶基二硫基)丙酸N-羟基丁二酰亚胺酯(SPDP)或(3,3’-二硫代二丙酸二(N-羟基丁二酰亚胺酯)(DTSP)时,我们优选的合成分子可以按如下书写:
(Hep-NH-CO-CH2-CH2-S-S-CH2-CH2-CO-NH)n-PlPr
其中n=4-16;
PlPr为血浆蛋白如人血清白蛋白或人α2-巨球蛋白;并且
肝素链为10-21KDa。
尽管可能将高达36条肝素链连接至各血浆蛋白如白蛋白,尤其是HSA,我们发现,4-16条肝素链与各血浆蛋白的连接提供了满意的抗血小板活性和抗凝活性的双功能性。此外,如本文的数据所显示的,我们还发现,6条以下的肝素链,理想地4-6条肝素链与各血浆蛋白的连接主要或在较大程度上提供了满意的抗凝活性,而8条以上的肝素链,理想地8-16条肝素链与各血浆蛋白的连接主要或在较大程度上提供了满意的抗血小板活性。
因此,在本发明的另一优选实施方案中,当所述APAC分子将主要或在较大程度上用作抗凝剂时,所述分子具有6条或更少的,例如4-6条与所述血浆蛋白连接的肝素链。
因此,在本发明的另一优选实施方案中,当所述APAC分子将主要或在较大程度上用作抗血小板剂/血小板抑制剂时,所述分子具有8条或更多的,例如8-16条与所述血浆蛋白连接的肝素链。
因此,在本发明的另一优选实施方案中,当所述APAC分子将主要或在较大程度上用作抗血小板剂/血小板抑制剂时,所述分子具有8条与所述血浆蛋白连接的肝素链。
因此,在本发明的另一优选实施方案中,当所述APAC分子将主要或在较大程度上用作抗血小板剂/血小板抑制剂时,所述分子具有11条与所述血浆蛋白连接的肝素链。
因此,优选连接一定数量的肝素链至各血浆蛋白核心能够影响合成分子的主要功能。该显著的特性具有技术应用,因为尽管使用我们的分子时,待实现的结果是抗血栓的,但是存在需要强调抗血小板活性的情况和需要另外强调抗凝活性的其它情况。例如,当正在治疗其中剪切率相对低的,即较大的血管腔和较低的血液流速的,诸如静脉的血管时,抗凝结占优势或强调抗凝结的抗血栓剂是高度可取的。而当正在治疗例如其中剪切率相对较高的,即较高的血液流速或具有较小血管腔的血管的,诸如动脉的血管或动静脉瘘时,抗血小板活性占优势或强调抗血小板活性的抗血栓剂是高度可取的。类似地,当使用植入物如导管、支架或用于进行气囊血管成形术的装置时,它们可以用本发明的APAC分子包被,并且所使用的APAC分子的类型理想地将根据待插入植入物的血管的性质确定。
根据本发明的第二方面,提供了用作药物的具有抗血小板和抗凝(APAC)活性的抗血栓分子,其包含血浆蛋白,所述血浆蛋白经由多个接头分子连接了多条肝素链,各条肝素链具有10-21KDa的MW,并且其中与所述血浆蛋白连接的所述肝素链的数目选自4、5、6、7、8、9、10、11、12、13、14、15和16。
根据本发明的第三方面,提供了用作抗血栓剂的具有抗血小板和抗凝(APAC)活性的抗血栓分子,其包含血浆蛋白,所述血浆蛋白经由多个接头分子连接了多条肝素链,各条肝素链具有10-21KDa的MW,并且其中与所述血浆蛋白连接的所述肝素链的数目选自4、5、6、7、8、9、10、11、12、13、14、15和16。
在本发明的该方面的优选实施方案中,所述抗血栓剂局部起作用。据此,我们意指,抗血栓剂结合细胞外基质,并且因此其被保留在应用部位或预期起作用的部位,具有延长的局部活性。的确,这种局部作用活性是有利的,因为其意味着,本发明的分子被有效靶向最需要它们的部位,即可能出现血栓形成的部位,换句话说,存在胶原蛋白和血管性假血友病因子的细胞外基质/整体部分。
根据本发明的第四方面,提供了具有抗血小板和抗凝(APAC)活性的抗血栓分子在制备用于治疗血栓形成或疑似血栓形成的药物中的用途,所述抗血栓分子包含血浆蛋白,所述血浆蛋白经由多个接头分子连接了多条肝素链,各条肝素链具有10-21KDa的MW,并且其中与所述血浆蛋白连接的所述肝素链的数目选自4、5、6、7、8、9、10、11、12、13、14、15和16。
本文提及疑似血栓形成是指可能导致血栓形成的任何情况、环境或状况,例如(不限于)外科介入例如外科血栓切除术的实施,在本实例中,可以将本发明的分子施用于手术部位,或注入已被手术的血管中,或注入邻近的下游血管,其血液供应将流经/流至所述手术部位。
在本发明的该方面的优选实施方案中,所述药物是抗血栓剂,理想地为局部起作用的抗血栓剂。通过局部起作用,我们意指抗血栓剂结合细胞外基质,并且因此其被保留在应用部位,具有延长的局部活性。的确,这种局部作用活性是有利的,因为其意味着,本发明的分子被有效靶向最需要它们的部位,即可能出现血栓形成的部位,换句话说,存在胶原蛋白和血管性假血友病因子的细胞外基质/整体部分。
在本发明的上述方面当中,当所述APAC分子将主要或在较大程度上用作抗凝剂时,所述分子优选具有6条或更少的,诸如4-6条经由所述接头与所述血浆蛋白连接的肝素链。
类似地,在本发明的上述方面当中,当所述APAC分子将主要或在较大程度上用作抗血小板剂/血小板抑制剂时,所述分子优选具有8条或更多的,诸如8-16条经由所述接头与所述血浆蛋白连接的肝素链。
在本发明的另外的优选实施方案中,所述APAC分子能够用于治疗或预防血栓性并发症,诸如与以下相关的并发症:内源的粥样斑块破裂;或预防再闭塞的血栓溶解疗法之后;或外源的血管成形术;或血管或微血管外科手术;动脉介入术如血管成形术,尤其是伴有或不伴有支架术的经皮腔内(冠状动脉)血管成形术;(定向的)斑块切除术;外周或肺动脉内膜血栓切除术;血小板驱动的动脉血栓形成;血管或微血管损伤;血栓性血小板减少性紫癜或外源的介入术,如动静脉瘘或动静脉移植物的插入和维持以及抗凝血酶(AT)缺陷。
根据本发明的第五方面,提供了具有抗血小板和抗凝(APAC)活性的抗血栓分子用于治疗缺血再灌注损伤或急性肾损伤或心肌梗死或卒中或外周动脉闭塞性疾病或肠系膜缺血的用途,所述抗血栓分子包含血浆蛋白,所述血浆蛋白经由多个接头分子连接了多条肝素链,各条肝素链具有10-21KDa的MW,并且其中与所述血浆蛋白连接的所述肝素链的数目选自4、5、6、7、8、9、10、11、12、13、14、15和16。
可选地,根据本发明的第六方面,提供了具有抗血小板和抗凝(APAC)活性的抗血栓分子在制备用于治疗缺血再灌注损伤或急性肾损伤或心肌梗死或卒中或外周动脉闭塞性疾病或肠系膜缺血的药物中的用途,所述抗血栓分子包含血浆蛋白,所述血浆蛋白经由多个接头分子连接了多条肝素链,各条肝素链具有10-21KDa的MW,并且其中与所述血浆蛋白连接的所述肝素链的数目选自4、5、6、7、8、9、10、11、12、13、14、15和16。
根据本发明的第七方面,提供了制备具有抗血小板和抗凝(APAC)活性的抗血栓分子的方法,其包括:
i)修饰未分级肝素(Hep)链以产生具有巯基(-SH)基团的反应产物;
ii)修饰诸如血清白蛋白的血浆蛋白以产生具有吡啶基二硫基(-PDP)基团的反应产物;以及
iii)利用异型双功能交联接头连接i)的反应产物与ii)的反应产物。
在本发明的优选方法中,所述接头是3-(2-吡啶基二硫基)丙酸N-羟基丁二酰亚胺酯SPDP接头(可从例如Sigma-Aldrich或Thermo Scientific Pierce商购获得(任选地,GMP质量))。
根据本发明的第八方面,提供了制备具有抗血小板和抗凝(APAC)活性的抗血栓分子的方法,其包括:
i)修饰未分级肝素(Hep)链以产生具有N-羟基丁二酰亚胺酯(-NHS)基团的反应产物;
ii)利用同型双功能交联接头连接i)的反应产物与含有伯胺的诸如血清白蛋白的血浆蛋白。
在本发明的优选方法中,所述接头是3,3’-二硫代二丙酸二(N-羟基丁二酰亚胺酯DTSP接头(可从例如Sigma-Aldrich或Thermo Scientific Pierce商购获得(任选地,GMP质量))。
根据本发明的第九方面,提供了治疗选自以下的疾病或病况的方法:血栓性并发症,诸如与以下相关的并发症:内源的粥样斑块破裂;预防再闭塞的血栓溶解疗法;血小板驱动的动脉血栓形成;血管或微血管损伤;血栓性血小板减少性紫癜;缺血再灌注损伤;急性肾损伤;心肌梗死;卒中;外周动脉闭塞性疾病、肠系膜缺血和抗凝血酶(AT)缺陷;
其中向待治疗的个体施用有效量的具有抗血小板和抗凝(APAC)活性的抗血栓分子,其包含血浆蛋白,所述血浆蛋白经由多个接头分子连接了多条肝素链,各条肝素链具有10-21KDa的MW,并且其中与所述血浆蛋白连接的所述肝素链的数目选自4、5、6、7、8、9、10、11、12、13、14、15和16。
在本发明的该方面的优选实施方案中,在预防再闭塞的血栓溶解疗法之后,施用所述抗血栓分子。
更优选地,肝素链的所述数目选自8、9、10、11和12。
根据本发明的第十方面,提供了选自以下的治疗方法:
外源的血管成形术;血管或微血管外科手术;动脉介入术;血管成形术,尤其是伴有或不伴有支架术的经皮腔内(冠状动脉)血管成形术;(定向的)斑块切除术;外周或肺动脉内膜血栓切除术;以及外源的介入术,如动静脉瘘或动静脉移植物的插入和维持;
其中在所述治疗之前、期间或之后,向待治疗的个体施用有效量的具有抗血小板和抗凝(APAC)活性的抗血栓分子,其包含血浆蛋白,所述血浆蛋白经由多个接头分子连接了多条肝素链,各条肝素链具有10-21KDa的MW,并且其中与所述血浆蛋白连接的所述肝素链的数目选自4、5、6、7、8、9、10、11、12、13、14、15和16。
在本发明的该方面的优选实施方案中,在实施任何一项或多项上述治疗之前,施用所述抗血栓分子。
更优选地,肝素链的所述数目选自8、9、10、11和12。
更优选地,具有抗血小板和抗凝(APAC)活性的抗血栓分子通过层析法诸如利用丁基琼脂糖介质(GE Healthcare,USA)的疏水作用层析(HIC)和/或超滤/渗滤纯化。然而,APAC分子可以通过其它方式,诸如阴离子交换层析或本领域技术人员已知的其它方法来纯化。
在随后的权利要求书以及本发明的前述描述中,除了由于表达语言或必要的含义上下文有另外的要求,词语“包含(comprises)”或变型如“包含(comprises)”或“包含(comprising)”以包括性意义使用,即指定存在所陈述的特征,但不排除存在或增加本发明的多个实施方案中的其它特征。
本说明书中引用的所有参考文献包括任何专利或专利申请均在此通过引用并入。并没有承认任何参考文献构成了现有技术。此外,没有承认任何现有技术构成了本领域公知常识的一部分。
本发明各方面的优选特征可以同结合任何其它方面所描述的一样。
从以下实施例中,本发明的其它特征将变得更加明显。一般而言,本发明扩展至本说明书(包括随附的权利要求书和附图)所公开的特征的任何新的一个或任何新的组合。因此,结合本发明具体方面、实施方案或实例所描述的特征、整数、特性、化合物或化学部分应被理解为适用于本文描述的任何其它方面、实施方案或实例,除非与其不相容。
此外,除非另有说明,本文公开的任何特征可以被用于相同或相似目的的备选特征替换。
现将具体参照以下附图仅通过示例的方式来描述本发明,其中:
图1.显示了在混合血浆中,在存在1.0和1.75μg/mL肝素(Hep)[C]的两种浓度的第一代APAC1(批次1.1,4条Hep链)、第二代APAC2(批次2.1,11条Hep链)和第三代APAC-CL6至CL16(批次:3.1;3.2;3.3;3.4;3.5和3.6,分别为8条;8条;10条;13条;16条和6条Hep链)的情况下,对凝血酶时间(TT)的影响的筛查。TT基线为28s。
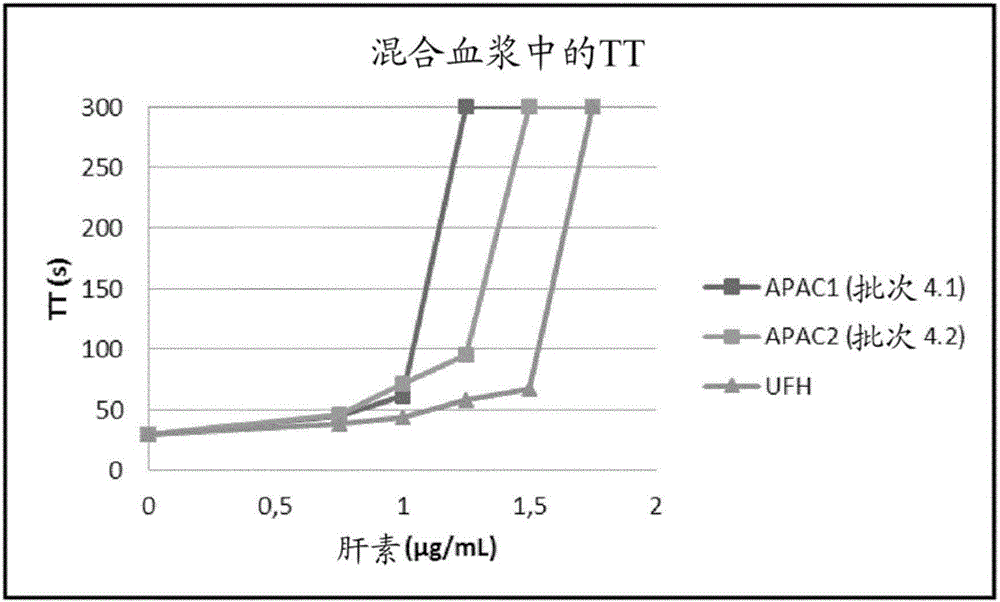
图2.显示了在混合血浆中,在存在0.75;1.0和1.75μg/mL Hep[C]的三至五种浓度的第四代APAC1(批次4.1,4条Hep链)和APAC2(批次4.2,8条Hep链)的情况下的凝血酶时间(TT)。TT基线为31s。
图3.显示了在混合血浆中,在存在1;2;3;6和8μg/mL Hep[C]的五种浓度的第一代APAC1(批次1.1,4条Hep链)、第二代APAC2(批次2.1,11条Hep链)和第三代APAC-CL8至-16(批次3.1;3.2;3.3;3.4和3.5,分别为8条、8条、10条、13条和16条Hep链)的情况下的活化部分凝血激酶时间(APTT)。APTT基线为30s。
图4.显示了五种不同的肝素浓度的APAC中的肝素缀合水平对APTT延长(1倍至10倍)的比较。显示了混合血浆中,利用1;2;3;6;8μg/mL Hep[C]的APAC1(批次1.1,4条Hep链)、APAC-CL8(批次3.1和3.2,8条Hep链)、APAC-CL10(批次3.3,10条Hep链)、APAC2(批次2.1,11条Hep链)、APAC-CL13(批次3.4,13条hep链)、APAC-CL16(批次3.5,16条Hep链)对APTT的结果。APTT基线为30s。
图5.显示了在混合血浆中,在存在1;2;3;6和8μg/mL Hep[C]的五种浓度的第四代APAC1(批次4.1,4条Hep链)和APAC2(批次4.2,8条Hep链)的情况下的APTT。APTT基线为30s。
图6.显示了在补充有5pM组织因子(TF)和4μM磷脂(PPL)的混合血浆(PP)中,与UFH和磷酸盐缓冲盐水(PBS)相比,在存在A)0.25μg/mL和B)0.5μg/mL第一代APAC1(批次1.1,4条Hep链)、第二代APAC2(批次2.1,11条Hep链)的情况下,通过自动校正凝血酶曲线法的延迟的凝血酶生成。
图7.显示了在补充有5pM TF和4μM PPL的混合血浆(PP)中,与UFH和PBS相比,在存在A)1.0μg/mL和B)1.5μg/mL第一代APAC1(批次1.1,4条Hep链)、第二代APAC2(批次2.1,11条Hep链)的情况下,通过自动校正凝血酶曲线法的延迟的凝血酶生成。
图8.显示了在补充有5M TF和4μM PPL的混合血浆(PP)中,在存在A)0.25μg/mL和B)0.5μg/mL第三代APAC-CL6至-CL16(8条、8条、10条、13条、16条和6条Hep链)和PBS的情况下,通过自动校正凝血酶曲线法的凝血酶生成。APAC-CL8(批次3.1和3.2,8条Hep链)、APAC-CL10(批次3.3,10条Hep链)、APAC-CL13(批次3.4,13条hep链)、APAC-CL16(批次3.5,16条Hep链)和APAC-CL6(批次3.6,6条Hep链)。
图9.显示了在补充有5M TF和4μM PPL的混合血浆(PP)中,在存在A)1.0μg/mL和B)1.5μg/mL APAC-CL6至-CL16(8条、8条、10条、13条、16条和6条Hep链)和PBS的情况下,通过自动校正凝血酶曲线法的凝血酶生成。APAC-CL8(批次3.1和3.2,8条Hep链)、APAC-CL10(批次3.3,10条Hep链)、APAC-CL13(批次3.4,13条hep链)、APAC-CL16(批次3.5,16条Hep链)和APAC-CL6(批次3.6,6条Hep链)。
图10.显示了在补充有1pM TF,供应PPL的血小板的富血小板血浆(PRP)中,在存在0.25;0.5;1.0;和1.5μg/mL UFH的情况下,通过自动校正凝血酶曲线法的凝血酶生成。
图11.显示了在补充有1pM TF,供应PPL的血小板的PRP(供体是高响应者)中,在存在A)0.25μg/mL和B)0.5μg/mL APAC1(批次1.1,4条Hep链)和APAC2(批次2.1,11条Hep链)和UFH的情况下,通过自动校正凝血酶曲线法的凝血酶生成。
图12.显示了在补充有1pM TF,供应PPL的血小板的PRP(供体是中等响应者)中,在存在A)0.25μg/mL、B)0.5μg/mL和C)1.0μg/mL APAC1(批次4.1,4条Hep链)和APAC2(批次4.2,8条Hep链)的情况下,通过自动校正凝血酶曲线法的凝血酶生成。
图13.显示了在存在第三代APAC,即APAC-CL6至-CL-16(8条、8条、10条、13条、16条和6条Hep链)的情况下,PRP中的胶原蛋白诱导的聚集。给出了在A)1、B)10和C)30μg/mL的Hep[C]时,对APAC的低响应者的实例。通道1:APAC-CL8(批次3.1,8条Hep链),通道2:APAC-CL8(批次3.2,8条Hep链),通道3:APAC-CL10(批次3.3,10条Hep链),通道4:APAC-CL13(批次3.4,13条Hep链),通道5:APAC-CL16(批次3.5,16条Hep链),通道6:APAC-CL6(批次3.6,6条Hep链)和通道7:APAC-CL10和-16(10条Hep链和16条Hep链)的混合物。胶原蛋白的[C]为0.5μg/mL。
图14.显示了在对APAC的代表性高(空的圆形)和中等(空的方形)响应者的PRP中,在存在3;10;30;60和90μg/mL的APAC1(批次1.1,4条Hep链)的情况下,胶原蛋白诱导的最大血小板聚集的抑制。还显示了在存在UFH(黑色三角形)的情况下,供体中的平均血小板聚集抑制。相对于介质(PBS),最大血小板聚集的抑制显示为百分比(%)。
图15.显示了在改良的Folt的狒狒急性血栓形成模型中,在新鲜的损伤部位局部应用UFH和APAC1(批次1.1,4条Hep链)(均为4mg/mL;总共2mg)之后循环流量减少(CFR)的图。在返回基线血流之后,动脉立即狭窄(30%)至100mL/min的流速。在用UFH(黑色三角形)处理损伤部位之后观察到重复的闭塞(25min内5个CFR)。在再次实施狭窄(在20-50min时)和增加狭窄(在180min时)之前,用磷酸盐缓冲盐水(PBS)冲洗处理的损伤部位。
相比之下,用APAC处理(空的圆形),新鲜的损伤部位对于整个实验的持续时间均保持开放:首先以100mL/min的动脉血流持续120min(空的圆形),其次以50mL/min的动脉血流伴随收紧的狭窄(60%)持续14min(黑色交叉),最后30mL/min的血流在严酷的狭窄(90%)下相继持续10和15min的时段(黑色星形)。
图16.显示了APAC1(批次1.1,4条Hep链)和UFH(均为4mg/mL)在狒狒模型(n=4)的流动血液的胶原蛋白诱导的血栓形成中的比较。对于以下观察到降低的血小板沉积:A)在应用部位的胶原蛋白表面,其中与UFH相比,在存在APAC1的情况下血小板沉积降低34±13%(平均值和SD,n=4)(p=0.01),和B)向胶原蛋白节段远端扩散10-cm的血栓,其中与UFH相比,在存在APAC1的情况下血小板沉积降低63±11%(平均值和SD,n=4)(p=0.19)。与未处理的对照相比,利用APAC1,纤维蛋白形成也降低45%±14%(平均值和SD,n=4)(p=0.01),符合血小板和凝结抑制的双重作用。
图17.显示了APAC和UFH在大鼠血浆中的直接抗凝作用。以16、32或80μg使用来研究缺血再灌注损伤或急性肾损伤,当利用APTT测定测量时APAC2(批次2.1,11条Hep链)是有效的抗凝剂。作为比较物,未分级肝素(UFH,带点的黑线)以相同的浓度范围16、32或80μg使用。能够看出,两种治疗剂在16μg时表现比较一致,但是在32μg时,UFH延长APTT略大于APAC2,而在80μg时,UFH延长APTT显著大于APAC2(实黑线)。
静脉内施用剂量为16μg(0.06mg/kg)、32μg(0.13mg/kg)和80μg(0.32mg/kg)的APAC2或UFH之后10min的作为平均值±SD的APTT。n=5-8只/组,***P<0.001。在16μg的剂量时,利用APAC,APTT为18.0±6.6(n=7),而利用UFH,APTT为27±6.2(n=4)。在32μg的剂量时,利用APAC,APTT为17.4±4.0(n=10),而利用UFH,APTT为25.2±2.0(n=5)。在80μg的剂量时,利用APAC,APTT为42.2±18(n=8),而利用UFH,APTT为72-180>(n=5)。红色虚线为APTT的基线参照。在Blyscan硫酸化糖胺聚糖测定中利用UFH作为标准品来确定肝素剂量。
图18.显示了30-min双侧肾缺血-再灌注-损伤之后的肾功能和肾小管间质损伤。与仅有盐水介质(静脉内)的对照相比,当利用建立的标志物测定时,16或32μg APAC2(批次2.1,11条Hep链)对肾功能的作用。在30min可逆缺血再灌注损伤之后的三天时间内测定肾功能标志物肌酐、尿素和中性粒细胞明胶酶相关脂质运载蛋白(NGAL),并且32μg的APAC2浓度在各时间间隔显著降低各标志物的水平,暗示32μg APAC2的保护作用。
为了分析肾缺血之后的肾功能和肾小管间质损伤,在再灌注之后每天收集大鼠血清,持续3天。在APAC 16μg(0.06mg/kg)和32μg(0.13mg/kg)静脉内预处理的大鼠中,(A)肌酐、(B)尿素氮和(C)NGAL(肾小管间质损伤的生物标志物)的血清水平。对照大鼠接受静脉内盐水介质。n=8只/组,**P<0.01。在Blyscan硫酸化糖胺聚糖测定中利用UFH作为标准品来确定肝素剂量。
图19.显示了30-min双侧肾缺血-再灌注–损伤之后的先天免疫活化和组织病理学。与盐水介质(静脉内)对照相比,30min可逆损伤之后缺血再灌注损伤的明显影响通过使用16或32μg的APAC2(批次2.1,11条Hep链)而改善。研究肾的A)先天免疫配体透明质酸(HA),B)通过肾小管间质损伤标志物Kim-1的肾小管伤害以及C)利用苏木精和曙红(H&E)染色的肾小管损伤(压扁、扩张、管型和坏死)。
为了评估再灌注之后3天时的先天免疫活化和肾损伤,对于APAC 16μg(0.06mg/kg)和32μg(0.13mg/kg)静脉内预处理的大鼠的组织病理学,将肾石蜡包埋的横切片针对(A)先天免疫配体透明质酸,(B)肾小管间质损伤标志物Kim-1和(C)H&E染色。(A)透明质酸阳性区域用计算机辅助的成像来测量。(C)C=上皮管型;D=肾小管扩张;箭头=上皮压扁;箭号=上皮坏死。对照大鼠接受静脉内盐水介质。IgG对照在插图中。n=8只/组,*P<0.05。在Blyscan硫酸化糖胺聚糖测定中利用UFH作为标准品来确定肝素剂量。
图20.显示了在重度1小时双侧肾缺血-再灌注-损伤之后的肾功能和总存活。在夹持两个肾动脉1小时中,肾遭受重度IRI。为了分析缺血后肾存活和功能,在再灌注之后每天收集大鼠血清,持续3天。用APAC(批次2.1,11条肝素链)32μg处理能够使组织存活(A)三天监视期内的大鼠存活%,此外,APAC 32μg(0.13mg/kg)静脉内预处理的大鼠中的(B)肌酐和(C)尿素氮的血清水平也显示阳性结果;大鼠血清肌酐和尿素降低,提示肾功能的保留。对照大鼠接受静脉内盐水介质。n=8只/组,*P<0.05,**P<0.01,***P<0.001。在GAG测定中利用UFH作为标准品来确定肝素剂量。
图21.显示了在抗凝血酶耗尽的血浆中,在存在1.0和2μg/mL Hep[C]的第五代APAC1(批次5.1,4条Hep链)以及2μg/mL Hep[C]的APAC2(批次5.2,8条Hep链)的情况下的凝血酶时间(TT)。在GAG测定中利用UFH作为标准品来确定肝素剂量。
图22.显示了在抗凝血酶耗尽的血浆中,在存在4和5μg/mL Hep[C]的第五代APAC1(批次5.1,4条Hep链)以及4μg/mL Hep[C]的APAC2(批次5.2,8条Hep链)和UFH的情况下的活化部分凝血激酶时间(APTT)。在GAG测定中利用UFH作为标准品来确定肝素剂量。
方法
缀合
经由通过两种备选的交联接头和利用以下的反应途径产生的二硫键将未分级肝素(Hep)链与人血清白蛋白(HSA)缀合:
i)异型双功能交联接头3-(2-吡啶基二硫基)丙酸N-羟基丁二酰亚胺酯(SPDP)。为了缀合,利用Hep接头区的Ser和HSA的Lys上的游离胺。Hep和HSA在单独的反应中被分别修饰成巯基(-SH)–和吡啶基二硫基(-PDP)-衍生物。在最后的缀合反应中,HSA的吡啶基二硫基基团与Hep的巯基基团反应,导致二硫键复合物的形成和吡啶2-硫酮的释放。
ii)同型双功能交联接头3,3’-二硫代二丙酸二(N-羟基丁二酰亚胺(NHS)-酯)(DTSP)。为了缀合,利用Hep接头区的Ser和HSA的Lys上的游离胺。Hep首先被修饰成N-羟基丁二酰亚胺(NHS)-酯-衍生物,伴随第一NHS-基团的释放。在最后的缀合反应中,HSA的Lys与衍生的Hep的N-羟基丁二酰亚胺(NHS)-酯基团反应,导致复合物(在接头区具有可切割的二硫键)的形成和第二N-羟基-丁二酰亚胺基团的释放。
Hep-HSA复合物通过利用丁基琼脂糖介质(GE Healthcare,USA)的疏水作用层析(HIC)或超滤/渗滤纯化。在结束时,将Hep-HSA复合物洗脱入pH 7.4的磷酸盐缓冲盐水(PBS)。将复合物命名为APAC-标明Hep链与HSA的缀合水平的下标后缀。
示例本发明的APAC复合物的通式为
(Hep-NH-CO-CH2-CH2-S-S-CH2-CH2-CO-NH)n-HSA
其中与HSA结合的未分级肝素链的平均数目被定义为n。
利用Hep和HSA的浓度及其平均分子量,通过以下公式确定Hep与HSA的平均缀合水平(CL):
Hep的mol数=Hep[C]/平均Hep MW
HSA的mol数=HSA[C]/HSA MW
CL=Hep的mol数/HSA的mol数
Hep MW=15800
HSA MW=66472
Hep聚合物的平均MW基于从肝素生产商获得的信息。HSA MW基于来自UniProtKB/Swiss-Prot的ALBU_HUMAN,P02768,无信号肽和前肽的同种型1。
APAC复合物,参见表I。
APAC1具有4-6mol Hep/1mol HSA的平均CL。
APAC2具有8-16mol Hep/1mol HSA的平均CL。
在2010年,以相对大(1g)的规模制备了第一代APAC,即APAC1,其具有6mol Hep/1mol HSA的平均CL(CL 6:1;批次1.1)。APAC1显示出体外抗凝功效和抗血小板功效。在两个不同的急性血栓形成的狒狒模型中,其相对于未分级肝素(UFH)的对照,即未与HSA结合的肝素,维持血管通畅并降低血栓形成和纤维蛋白累积。另外,与对照即UFH相比,放射性(Cu-64)标记的APAC1在新鲜的大鼠吻合术上在局部施用部位具有延长的定位(在IPS Therapeutics,Canada的研究)。
在2011年,制备了称为APAC2的第二代APAC(批次2.1),其与APAC1相比,具有几乎二倍的Hep与HSA的平均CL(11:1)。当与APAC1相比时,APAC2在相同的肝素浓度时,在抑制富血小板血浆(PRP)中胶原蛋白诱导的血小板聚集中更加有效。在大鼠吻合术模型中,Cu-64标记的APAC2被施用在血管内,并且可检测到持续UFH对照时间的二倍(IPST,Canada)。
在2012年,制备第三代APAC(这次以多个批次3.1至3.6)。小规模(~50mg的批量)地制备了6种不同的APAC复合物(CL 6:1至16:1),以便研究缀合反应(CR)自身的可再现性。这些APAC复合物根据制备顺序命名(CR1至6),因此这些名字并不反映产物的具体CL。由于制备方案针对小规模而调整,相应的变化可能轻微地改变了产物的最终特性。有趣且一致的是,具有较高CL的化合物在抑制PRP中胶原蛋白诱导的血小板聚集中比具有较低CL的化合物更加有效。另一方面,较低CL的抗凝功效似乎更加明显。
在2013年,制备了第四代APAC,即APAC1(CL 4:1;批次4.1)和APAC2(CL 8:1;批次4.2)。
在2014年,制备了第五代APAC,即APAC1(CL 4:1;批次5.1)和APAC2(CL 8:1;批次5.2)。2014批次的分析在持续。
定量
由于缀合分子,即具有HSA蛋白和高度硫酸化的肝素部分的缀合分子的性质,已要求确定APAC产物的CL。用二辛可宁酸(BCA)蛋白测定,根据生产商的说明书(Pierce Biotechnology,USA)确定HSA浓度。在2013年,还进行在280nm处的直接的UV测量来验证BCA测定,因为BCA测定似乎会高估蛋白。用Blyscan硫酸糖胺聚糖测定,即Blyscan测定,根据生产商的说明书(Biocolor Ltd.,UK)确定Hep(Heparin Leo,Leo Pharma,Denmark)。
在2010和2012年,针对糖胺聚糖(GAG)标准品(牛气管软骨素4-硫酸)测定Hep。利用该GAG标准品,Hep浓度通常被高估。因此,在2013年,包括肝素起始材料作为Blyscan测定的新的标准品。为了充分和比较的原因,GAG和肝素用于后续分析。CL的确定受肝素测定中所用的具体标准品(表I)的影响,并且还受HSA分析的影响。然而,在比较不同APAC和对照UFH的所有的研究中,用相同的测定确定Hep浓度,GAG或更新的Hep标准品(硫酸糖胺聚糖测定,Blyscan测定试剂盒,Biocolor Ltd.,UK)。
简而言之,将待定量的试样添加到微量离心管中,并用水将体积调整至100μl。对于各测定,还以指定的浓度范围运行Blyscan测定试剂盒硫酸GAG标准品或已知的肝素标准品,除了试剂空白(0μg;水或PBS)。为了开始测定,添加1.0ml Blyscan染料试剂(1,9-二甲基-亚甲蓝于无机缓冲液中),并混合至少30min。含有硫酸肝素的管变成紫色/粉红色。通过离心(>10,000×g,持续10分钟)将得到的GAG-染料复合物与未结合的染料分离。弃去上清液,添加1.0ml Blyscan解离试剂并涡旋。然后通过在656nm处的分光光度读数来测定得到的溶液。标准品与试剂空白一起用于产生校正曲线,其被用于确定肝素浓度。吸光度值为0.05至1.5单位,否则样品被分别复原或稀释。
分子量
APAC的分子量(MW)尚未被敲定,并且溶液的摩尔浓度只能是近似的。利用常规的尺寸排阻层析(SEC)以及联合高压SEC和三重探测器阵列(TDA;利用折射计、粘度计以及左右角光散射探测器)技术的研究粗略地表明APAC1(批次1.1)和APAC2(批次2.1)之间MW的两倍增加。
体外APAC功能的评估
材料和方法
血液收集
使用来自健康供体的血液,该健康供体在样品收集至少6-7天之前没有服用过任何药物。在通宵禁食之后经由静脉穿刺将样品从肘前静脉收集至标准的真空血液收集管(0.109M枸橼酸钠,Vacuette 455322,Greiner Bio-one)中。在血液收集之后的4小时内,样品被认为是有效的。
富血小板血浆和贫血小板血浆
将血液在22摄氏度以180×g离心12min以分离富血小板血浆(PRP)。对于贫血小板血浆(PPP)收集,将剩余的血液在22摄氏度以1500×g再次离心10min。用细胞计数仪Sysmex KX-21(Sysmex Corporation,Japan)测量PRP中的血小板(PLT)数并用PPP调整至150×10610%PLT/mL(用于自动校正凝血酶曲线法(CAT)分析)和300×106±10%PLT/mL(用于激动剂诱导的PRP聚集)。对于内部的混合血浆,收集来自11名供体的血液并于2000×g下离心10min。将PPP于10000×g再离心10min以去除任何残留的血小板。将血浆合并,以等分式样储存并冷冻直至使用。对于CAT,将血浆离心两次。
血浆
测试相等肝素浓度的APAC复合物和UFH对照的抗凝功效(Blyscan GAG研究)。使用三种不同的血浆:实验室对照血浆,即标准的人血浆(SHP,Siemens,Germany)、溶剂/洗涤剂(S/D)–处理的血浆(Octaplas,Octapharma,Switzerland)和内部混合血浆(PP,11名健康供体)。在该概述中,得到的内部混合血浆作为实例显示。
抗凝血酶(AT)–耗尽的血浆(American Diagnostica,USA)用于研究APAC以及APTT测定中的UFH的AT依赖性的抗凝功效。
凝结
肝素结合抗凝血酶和凝血酶(IIa)的复合物并增强抗凝血酶失活凝血酶和凝结因子Xa以及凝结内在和外在途径上游的数种其它凝结因子的能力。相比之下,低分子量肝素(LMWH)仅结合几乎专门抑制因子Xa的抗凝血酶。凝血酶靶向要求更长的链长;需要肝素中至少18个戊多糖单位序列。通过缺乏血小板和其它血细胞的PPP中纤维蛋白凝块形成的时间常规地测试含有肝素的血浆样品的抗凝功效。肝素是高度硫酸化的并具有强负电荷。因此,与循环的血浆蛋白或血管内皮的非特异性结合可诱导在此处未探究的其它相互作用。
凝血酶时间
在凝血酶时间(TT)(凝血酶BC试剂,Siemens,Germany)测定中,稀释的(40μL血浆和100μL凝血酶BC)枸橼酸钠血浆补充有标准化的高剂量凝血酶(0.8IU/ml),并在凝度计(KC-4,Sigma-Amelung,USA)中测量纤维蛋白原转变为纤维蛋白凝块的时间。
活化部分凝血激酶时间
在活化部分凝血激酶时间(APTT,试剂Dade Actin FSL,Siemens,USA)测定中,凝块形成由代表接触活化的内在途径(I、II、V、VIII、IX、X、XI、XII)的凝结因子和血浆的再钙化诱导。在实验中,将50μL血浆用50μL Actin FSL(大豆和兔脑磷脂,在100μM鞣花酸中)稀释并用50μL 25mM CaCl2再钙化。在存在足量肝素的情况下,TT和APTT开始剂量依赖地延长。临床上主要用APTT监测静脉内施用的肝素的抗凝程度。为了达到治疗水平的抗凝,靶向对照样品的1.5倍至3倍的延长。APTT测定依赖于所用的试剂和凝度计,但是基线范围通常为20-40s。
自动校正凝血酶曲线法
凝血酶生成在实验上用于估计与流血或血栓形成的风险相关的状况(Hemker et al.Pathophysiol Haemost Thromb 2002;32:249-53)。尽管凝血酶在整个凝结过程中形成,但是对于在体外纤维蛋白至凝块仅需要总凝血酶的2至5%。因此,传统的凝结时间(即TT和APTT)忽视凝结过程中的大部分凝血酶活性,其能够被Hemker的方法自动校正凝血酶曲线法(CAT)捕获。CAT评估组织因子引发的凝血酶生成,其通过检测荧光凝血酶底物的分裂并平行比较样品与具有已知凝血酶活性的对照来监测。在凝血酶生成的过程中,抗凝因子和促凝因子影响凝血酶曲线的可测量的特性。滞后时间反映纤维蛋白凝块形成的时间,其反映PT(由组织因子(TF)引发)/APTT(由鞣花酸引发)。曲线的峰值显示最大的净凝血酶生成速率和达到它的时间(tt峰值)。曲线下面积,即内源性凝血酶潜能(ETP),测量了所形成的总的凝血酶。在CAT中,凝血酶生成能够在枸橼酸钠PPP或PRP中评估。通过用TF(5pM)和磷脂(PPL)(4μM)(PPP试剂,Stago,France)或者用TF(1pM,PRP试剂,Stago,France)(分别对于PPP和PRP)引发和补充样品使凝血酶在再钙化血浆中活化。CAT能够检测凝血因子的不足或过度活性,以及抗凝剂(像肝素或直接的凝血酶抑制剂)的使用,或如果发生流血病症的替代疗法。
PRP中的血小板聚集
采用Born的浊度方法(J Physiol 1962;162:67-68),利用Aggram聚集计(Helena Laboratories Inc.,USA),在37℃以1000r.p.m的搅拌子速度研究血小板聚集。以0.5μg/mL终浓度的胶原蛋白(I型原纤维,Kollagenreagens-Horm,Nycomed Pharma,Austria或Chronolog胶原蛋白,Chronolog Ltd.,USA)用作主要的激动剂。在诱导血小板聚集之前,将测试物质与PRP在22℃孵育2min并在37℃孵育1min。当可应用时,测量5min时的最大聚集(光传导的变化%)、斜率和曲线下面积。
在所有测定中,用与测试物质等体积的介质(PBS,pH7.4)测量基线。我们还研究了其它激动剂:腺苷二磷酸(ADP),瑞斯西丁素和胶原蛋白相关的肽(CRP)。APAC并不抑制ADP诱导的血小板聚集,而在高浓度时,瑞斯西丁素诱导的聚集被抑制(数据未显示)。APAC针对胶原蛋白的抗血小板活性是血小板聚集测试中最突出的特点。
狒狒急性血栓形成模型
APAC1(批次1.1.)和UFH与介质相比的抗血栓功效在两个完善建立的麻醉狒狒的急性血栓形成模型中进行研究。在改良的Folts模型中,在股动脉和静脉之间产生体外AV-分路。通过放置在动脉上的外部缩窄器控制血流,并用探测器监测流动。通过用Martin持针器(Hegar-Baumgartner TC Gold 14cm)横向夹持10s两次,从外部使动脉损伤。损伤近端的所有侧支被结扎。用针(26G)在血管通路近端1cm处刺破分路,用于注射APAC1或UFH或磷酸盐缓冲盐水(PBS)的推注(4mg/mL)。在暴露于血流之前,用研究物质处理损伤3min。在恢复基线血流之后立即将外部缩窄器放置于损伤处,流动降低至30-100mL/min(90至30%的狭窄)。通过降低的血流来检测狭窄的动脉处血小板的累积,并记录为循环流量减少(CFR)。在5mL/min时,动脉被认为是闭塞的,并且通过释放缩窄器并用磷酸盐缓冲盐水(PBS)冲洗来驱逐血栓。在恢复基线血流之后,再应用狭窄并重复实验。
在第二个狒狒模型中,通过将胶原蛋白包被的PTFE移植物(2cm,4mm腔)放置于外露的动静脉分路来诱导血栓形成。形成血栓的胶原蛋白表面用APAC或UFH(均为4mg/mL)处理10min。启动血流(100mL/min;265-1),定量111-铟标记的血小板和纤维蛋白(125-碘-纤维蛋白原的累积)的沉积60min。
损伤部位的保留
通过对大鼠中部分结扎的(2根宽松的缝合线,分开1cm)股动脉吻合术PET成像50h来评估局部施用的64-Cu-标记的APAC或UFH(3mg/Kg)的功效、分布和原位保留。
缺血再灌注损伤和急性肾损伤模型
动物.使用重235-250g的特定的、无病原体的远交系雄性Sprague Dawley(SD)大鼠(Harlan Laborato-ries;Horst,Nederland)。大鼠接受规律的鼠粮和任意的自来水,并且以12-h光/夜循环饲养。动物接受符合国家卫生研究院和动物护理和使用办公室出版的实验室动物资源的护理和使用指南(National Research Council,Washington DC,National Academy Press,1996)的人文关怀。
血细胞计数和凝结谱.SD大鼠被静脉内施用(n=8只/组)用PBS(10mM磷酸钠、137mM氯化钠、2.7mM氯化钾,pH 7.4)稀释至合适浓度的APAC2(批次2.1;16μg、32μg或80μg或UFH 32μg(输注溶液5000IU/mL;200IU/mg;Leo Pharma,Denmark)。对照大鼠接受静脉内盐水介质。在10分钟时,处死大鼠,用于血细胞计数和凝结谱分析。将第一份血液样品吸入预充3.8%枸橼酸钠抗凝剂的2mL注射器中,并放置于3mL聚丙烯样品管中。将第二份样品立即吸入另一个用于收集大鼠血清的2mL空注射器中。分别处理样品用于血细胞计数、PPP和血浆以及血清。用细胞计数器Sysmex KX-21在枸橼酸钠血液样品中确定血细胞计数。对于PPP,将血液于1200×g离心15min(22℃)以分离白细胞和红血细胞。小心不要扰动血沉棕黄层,同时将PPP吸量至新管中。将PPP于16100×g再次离心5min,之后将PPP收集至新管中。如果不立即使用将PPP于-40℃储存。
肾动脉夹持模型.取决于研究模型,SD大鼠在热缺血发作之前或之后10min静脉内接受(n=8只/组)用PBS稀释至合适浓度的APAC2(批次2.1)16μg、32μg或80μg或UFH 32μg(输注溶液5000IU/mL,200mg/IU)。对照大鼠接受静脉内盐水介质。用吸入性异氟烷麻醉大鼠并实施中线剖腹术。取决于研究模型,将两个肾动脉夹持30或60min。在去除夹具之后,检查肾脏的血流恢复,并缝合腹部。将大鼠施用1mL PBS和0.1mL丁丙诺啡(Temgesic 0.3mg/ml,Schering-Plough,Kenilworth,NJ),分别用于手术后维持液体平衡和止疼。
肾功能和急性肾损伤的评估.为了评估肾功能和肾损伤,在肾损伤之后第1天、第2天和第3天在麻醉下收集大鼠尾静脉血液样品。血清于-20℃冷冻直至在芬兰赫尔辛基的赫尔辛基大学医院的HUSLAB临床化学部门进一步分析肌酐和尿素氮活性。作为急性肾损伤的生物标志物,我们使用大鼠中性粒细胞明胶酶相关脂质运载蛋白(NGAL)。在双侧肾动脉夹持之后3天,利用小鼠单克隆抗-NGAL(来自BioPorto Diagnostics A/S,Gentofte,Denmark的ABS 039-08),通过ELISA估算NGAL血清水平。
免疫组织化学.对于免疫组织化学,在载玻片上连续切下4mm厚石蜡包埋的或冷冻的横切片,并利用过氧化物酶ABC方法(Vectastain Elite ABC Kit,Vector Laboratories)染色。通过3-氨基-9-乙基咔唑(AEC,Vector Laboratories)显示反应。对于免疫染色,将样本通过以下来封闭:与pH 7.40的1.5%正常的山羊血清/PBS孵育20min,随后与最佳稀释度的一抗在室温下孵育30min(单克隆抗体)或于+4℃孵育15小时(多克隆抗体)。一抗用0.1%牛血清白蛋白/PBS溶液稀释。在PBS中洗涤之后,用与0.1%过氧化氢酶(30%)/PBS溶液孵育10-min来封闭内源过氧化物酶活性。伴随着间插的在PBS中洗涤,将样本进一步与于PBS缓冲液中的生物素化抗体在RT下孵育30min;用于PBS缓冲液中的亲和素-生物素化辣根复合物在RT下检测30min,并通过AEC(Vector Laboratories)显示反应。载玻片用Mayer的苏木精明矾复染。为了确定阳性细胞的密度,用40倍的放大率计数横切片每个象限的四个随机的视野,评分提供成1mm2的总数。所用的抗体和稀释物为来自BD Pharmingen,San Diego,CA的CD8+T细胞(5mg/mL,22071D)和来自R&D systems,Abingdon,UK的KIM-1(8mg/mL,AF3689)。
利用特异性的生物素化bHABC透明质酸结合复合物对来自石蜡切片的透明质酸(HA)进行染色,如所描述的,利用0.05%3,3-二氨基联苯胺(DAB)(Sigma Chemical Co.,St.Louis,MO)通过亲和素-生物素-过氧化物酶检测(Vector Laboratories;1:200稀释),该复合物含有由牛关节软骨制备的聚集蛋白聚糖的生物素化G1结构域和连接蛋白。染色的特异性通过以下来控制:在染色之前在存在蛋白酶抑制剂的情况下用链霉菌透明质酸酶消化一些切片,或用透明质酸寡糖预孵育bHABP探针。从每个样品采集10张40倍放大率的照片,并且用计算机辅助的成像(Zeiss Axionvision 4.4,Carl Zeiss International)来测量透明质酸为阳性的区域。将这10次测量的平均区域用于统计学分析中。由两个独立的观察员以盲法进行所有分析。
肾组织学.如下进行组织伤害的半定量评估:2mm厚石蜡包埋的肾样品用苏木精和曙红染色。肾小管损伤的以下参数的严重程度(压扁、扩张、管型和坏死)在如下的0至3的范围上分级:0级=无伤害,1级=轻微伤害,2级=中度伤害,3级=重度伤害,并且表示为总的肾小管损伤评分(0-12)。
统计学.所有数据为平均值+/-SEM,并且通过Windows,15.0版本的SPSS(SPSS Inc,Chicago,IL)分析。对于双组比较,应用非参数的曼-惠特尼U检验和参数的学生t-检验。对于多组比较,应用利用邓恩事后检验的非参数的克鲁斯卡尔-沃利斯检验以及利用Dunnett校正的参数的ANOVA。对于存活,应用利用对数秩的Kaplan–Meier分析(Mantel-Cox)。P<0.05被认为是统计学显著的。
结果
凝血酶时间
在存在来自2010年至2012年的APAC复合物(CL 6:1至16:1)的情况下,混合血浆中TT量值的实例显示在图1中,并且对于APAC1(批次4.1)和APAC2(批次4.2),混合血浆中TT量值的实例显示在图2中。
图1
在1μg/mL时,所有APAC使TT延长到基线(30s)的至少1.5倍,而UFH使TT延长到基线的1.3倍。APAC1(批次1.1,4条Hep链)达到了所测量的最大TT(300s),而APAC2(批次2.1,11条Hep链)使TT延长到基线的2.5倍(图1)。APAC-CL6(6条Hep链)使TT延长到基线值的5.5倍,APAC-CL8,批次3.2(8条Hep链)延长到基线值的5.8倍和批次3.1(8条Hep链)延长到基线值的4.3倍,APAC-CL10(10条Hep链)延长到基线值的2.4倍,APAC-CL13(13条Hep链)延长到基线值的2.5倍并且APAC-CL16(16条Hep链)延长到基线值的3.7倍(图1)。在1.5μg/mL时,所有APAC和UFH均达到了最大测量时间。
图2
APAC1(批次4.1,4条Hep链)和APAC2(批次4.2,8条Hep链)分别使TT延长到2.1倍至2.4倍(图2)。在1.25μg/mL时,APAC1(批次4.1,4条Hep链)达到了所测量的最大时间(300s),而APAC2(批次4.2,8条Hep链)使TT延长到3.2倍(图2)。
活化部分凝血激酶时间
图3
在存在APAC1(批次1.1,4条Hep链)、APAC2(批次2.1,11条Hep链)和来自批次3.1至3.5的具有CL 6:1至16:1的APAC(8条、8条、10条、13条、16条Hep链)的情况下,混合血浆中APTT量值的实例显示在图3中。
与APTT基线(30s)相比,在1μg/mL时,APAC1(批次1.1)使APTT延长到1.4倍,而其它APAC和UFH使APTT延长到1.1至1.2倍。在2μg/mL时,APAC1(批次1.1)使APTT延长到2.0倍,而其它APAC和UFH展现出较低的,即1.4倍至1.6倍的延长。在3μg/mL时,与基线相比,APAC1(批次1.1,4条Hep链)使APTT延长到2.6倍,APAC-CL8(批次3.1和3.2,8条Hep链)延长到2.1倍,APAC-CL10(批次3.3,10条Hep链)延长到2.0倍,APAC2(批次2.1,11条Hep链)延长到1.9倍,APAC-CL13(批次3.4,13条Hep链)、APAC-CL16(批次3.5,16条Hep链)和UFH均延长到1.8倍。在6μg/mL时,APAC1(批次1.1,4条Hep链)使APTT延长到6.7倍,APAC-CL8(批次3.1和3.2,8条Hep链)延长到5.4倍至4.7倍,APAC-CL10(批次3.3,10条Hep链)延长到4.5倍,APAC2(批次2.1,11条Hep链)延长到4倍,APAC-CL13(批次3.4,13条hep链)延长到3.8倍,APAC-CL16(批次3.5,16条Hep链)延长到3.6倍并且UFH延长到3.1倍。在8μg/mL时,APAC1(批次1.1,4条Hep链)使APTT延长到9.8倍,APAC-CL8(批次3.1和3.2,8条Hep链)延长到9.3倍至8.7倍,APAC-CL10(批次3.3,10条Hep链)延长到7.4倍,APAC-CL13(批次3.4,13条hep链)延长到6.0倍,APAC2(批次2.1,11条Hep链)延长到5.4倍,APAC-CL16(批次3.5.16条Hep链)延长到5.8倍,并且UFH延长到至少4.2倍。在所用的最高浓度时,APAC1(批次1.1,4条Hep链)和APAC-CL10(批次3.3,10条Hep链)之间APTT的差异为25%,并且与APAC2(批次2.1,11条Hep链)之间为45%。总之,在存在最低CL的第一和第二代APAC(批次1.1和2.1,4条和11条Hep链)的情况下,与基线相比,APTT通常被延长的最多。
第四代APAC(APAC1对比APAC2)不同于以前的批次在于APTT延长相当类似,直至使用较高剂量(6μg/mL以上)的Hep。而且,抗凝结受益于较低结合CL的肝素。与基线值(29s)相比,在1μg/mL时,APAC1(批次4.1,4条Hep链)和APAC2(批次4.2,8条Hep链)均使APTT延长到1.2倍。在2μg/mL时,APAC1(批次4.1)和APAC2(批次4.2)类似地分别使APTT延长到1.4倍和1.3倍。在3μg/mL时,APAC1(批次4.1)和APAC2(批次4.2)再次类似地分别使APTT延长到1.8倍和1.7倍。在6μg/mL时,APAC1(批次4.1)和APAC2(批次4.2)分别使APTT延长到3.9倍和3.4倍。在8μg/mL时,APAC1(批次4.1)和APAC2(批次4.2)分别使APTT延长到7.5倍和6.0倍。在所用的最高浓度时,APAC1(批次4.1)和APAC-2(批次4.2)之间APTT的差异为21%。
图4
具有不同肝素结合度,即CL的APAC的APTT评估的抗凝作用显示于图4中。
图5
在存在第四代APAC1(批次4.1,4条Hep链)和APAC2(批次4.2,8条Hep链)的情况下的APTT显示在图5中。
PPP中的自动校正凝血酶曲线法(CAT)
图6-9
CAT,其由组织因子(外在途径活化剂,5pM)引发,显示了利用低于延长APTT所需的浓度的APAC的抗凝作用。在0.25-1.5μg/mL的低肝素浓度时,APAC在所测试的所有三种不同的血浆(PP、SHP和Octaplas)中剂量依赖地降低峰值和ETP并延长tt峰值。描绘混合血浆中第一代APAC1(批次1.1,4条Hep链)、第二代APAC2(批次2.1,11条Hep链)、UFH和第三代APAC-CL6至CL16的影响的凝血酶曲线作为实例显示在图7-12中,APAC1(批次1.1,4条Hep链)和APAC2(批次2.1,11条Hep链)的滞后时间(s)、ETP(nM)、峰值(nM)和tt峰值(s)在表II中总结,并且对于APAC-CL6至APAC-CL16在表III中。显示了与介质对照相比,数值的相对变化(%)。如果凝血酶生成被完全抑制,滞后时间(s)、ETP(nM)、峰值(nM)、tt峰值(s)表示为0。
与UFH相比,滞后时间和tt峰值明显被所测试的所有浓度的所有APAC延长。与UFH相比,ETP被所有浓度的APAC降低,除了1.0μg/mL的APAC-CL6(批次3.6,6条Hep链),其中ETP与UFH类似。与UFH相比,峰值被所有浓度的APAC降低,除了1.0μg/mL的APAC2(批次2.1,11条Hep链),其中峰值与UFH类似。利用1.5μg/mL的APAC,凝血酶生成被完全废除,除了APAC-CL6(批次3.6,6条Hep链),其展现出15%的基线峰值。总之,APAC1(批次1.1,4条Hep链)和APAC2(批次2.1,11条Hep链)具有相对类似的凝血酶生成的抑制作用。在第三代中,相比CL<10的APAC,具有CL 13:1和16:1的APAC是更强效的抑制剂。
PRP中的自动校正凝血酶曲线法
图10-12
这些图探讨血小板依赖的凝血酶生成,即促凝活性(以估计流血或血栓形成的风险),并显示APAC抑制凝血酶生成。在存在血小板的情况下,使用低(1pM)的TF引发剂,并且由此添加了PPL的血浆CAT中凝血酶生成也低。在0.25-1.5μg/mL的低Hep浓度时,在所测试的单独的健康供体的PRP中,APAC剂量依赖地降低峰值和ETP并延长tt峰值。
图10中描绘UFH浓度的影响的凝血酶曲线,图11中描绘第一代APAC1(批次1.1,4条Hep链)、第二代APAC2(批次2.1,11条Hep链)的影响的凝血酶曲线,以及图12中描绘第四代APAC1(批次4.1,4条Hep链)和APAC2(批次4.2,8条Hep链)的影响的凝血酶曲线显示为反映研究结果利用所选浓度的实例。在0.5μg/mL时,APAC作为凝血酶生成的强效抑制剂是UFH的至少两倍。具有CL 8:1和11:1的APAC是更强的血小板促凝活性抑制剂,并且降低峰值和tt峰值超过具有CL 6:1的APAC。在1.0μg/mL时,所有APAC相对于UFH的功效差异更加明显。
综上,与UFH相比,利用APAC,UFH凝血酶生成被延迟并且血小板活性被明显抑制。所缀合的肝素链的数目越高,抑制越强。
胶原蛋白诱导的血小板聚集
图13-14.在对APAC具有高(50%的供体),中等(30%的供体)和低敏感性的供体中的代表性聚集曲线(图13)以及APAC1在高和中等响应者中的混合剂量-响应分析(图14)。
图13.在来自3名独立供体的枸橼酸盐抗凝PRP中测试APAC,即APAC-CL6至-CL16(在Hep[C]1;3;10;30和90μg/mL),各供体具有不同的敏感性(定义为在30μg/mL的肝素浓度时的抑制%(总的ED50)):在胶原蛋白(coll;0.5μg/mL)诱导的血小板聚集中对APAC的高>60%、低<40%和中等40-60%响应者。检测到在6min时最大聚集%和曲线斜率(聚集速度)的结果。
APAC-CL6至APAC-CL16(8条、8条、10条、13条、16条和6条Hep链)和APAC1(批次1.1,4条Hep链)降低血小板聚集率和最大血小板聚集,而UFH则没有。具有较高结合度CL 11至16:1的APAC与具有较低的CL 6至10:1的分子相比是更强效抑制剂。对于APAC-CL6至APAC-CL16,利用低响应者在1、10和30μg/mL时的结果呈现在图13中。利用所有APAC变体,聚集曲线(与聚集速度相关)剂量依赖地下降,尽管最大聚集被影响较小。APAC-CL16(批次3.5,16条Hep链)在该低响应者(供体2)中是最佳的抑制剂,并将最大聚集%从92%降低至38%。
图14.APAC1(批次1.1,4条Hep链)在10μg/mL时在高响应者PRP中抑制了最大血小板聚集的90%,而在中等响应者PRP中抑制聚集的75%需要90μg/mL。呈现了利用高和中等响应者在3;10;30;60和90μg/mL APAC1时的结果。
狒狒急性血栓形成模型
图15-16
在狒狒急性血栓形成模型中,将APAC和UFH以4mg/mL局部施用到损伤处(图15)。在存在UFH的情况下,动脉以100mL/min(30%狭窄)的流速反复(5CFR/27min)闭塞。相比之下,120min的随访时间后,APAC1(批次1.1,4条Hep链)有效地抑制血栓形成直至实验中断。在实验结束时,在时间点180min时,动脉先被再狭窄至50mL/min(60%狭窄)并最终至30mL/min(90%狭窄),而对于所选择的测试时段(分别为10和15min),APAC持续抑制闭塞。在利用UFH和磷酸盐缓冲盐水(PBS)的对照实验中,发生反复CFR(结果未显示)。在狒狒血栓形成模型中,在体外胶原蛋白移植物上(图16),与UFH相比,APAC1使胶原蛋白上的血小板沉积降低了34±13%(平均值和SD,n=4,p=0.01)。远端血栓传播也减少了63±11%(n=4,p=0.19)。利用UFH的结果与未处理对照值类似(n=21)。纤维蛋白累积被APAC1降低(45±14%),但是并未被UFH降低(1.1±0.1%,n=4,p=0.01)。
与强保留潜能和慢降解相容,PET在50h(-120h)内在大鼠的吻合术部位检测到未降解的APAC,而UFH在24h后已检测不到(n=2)。约10%APAC直接附着至血管应用部位。APAC和UFH通过泌尿途径清除。
缺血再灌注损伤和急性肾损伤模型
图17-20
显著地,尽管缺血再灌注损伤已在急性肾损伤模型中证实,本发明的治疗剂具有与任何其它再灌注损伤相关的用途,并且能够用于预防、减轻或治疗其它如心肌梗死或卒中或外周动脉闭塞性疾病或肠系膜缺血所示例的损伤。
分析了从IRI的肾功能恢复。16或32μg APAC2(批次2.1,11条Hep链)的剂量基于大鼠中的血液分析。APAC2的临床相关的剂量范围和UFH的比较临床剂量基于之前的动物模型。在静脉内(i.v.)注射之后10min通过APTT显示与APAC2和UFH的抗凝功效相关的剂量(图17),其中UFH使APTT延长到3倍,超过最高剂量(80μg)的APAC2。在两个肾动脉被夹持30min之前10min,用盐水介质(静脉内)或APAC2 16或32μg(静脉内)处理SD大鼠。为了估计缺血之后的肾功能,在再灌注之后3天收集大鼠血清和血浆。与介质处理的大鼠相比,在APAC2 32μg处理的大鼠中,血清肌酐(**P<0.01,图18A)和尿素氮(**P<0.01,图18B)水平降低。中性粒细胞明胶酶相关脂质运载蛋白(NGAL)血清水平(肾损伤的生物标志物)的ELISA分析显示,APAC2 32μg预处理也降低了肾小管间质损伤(**P<0.01,图18C)。
在30-min双侧肾动脉夹持模型中,APAC2预处理降低了危险相关的先天免疫配体透明质酸表达和炎性细胞浸润。在再灌注之后3天取出右肾。肾小管间质损伤标志物Kim-1的密度描绘了,与介质处理的相比,APAC2 32μg预处理的大鼠肾中损伤的免疫反应性小管的数目显著降低(*P<0.05,图19B)。由于IRI诱导先天免疫配体透明质酸(HA)的肾皮质累积,我们分析了APAC2预处理对IRI之后HA蛋白表达的影响。当与介质处理的肾相比时,在进行30-min热缺血和3天再灌注的肾中,APAC2 32μg预处理显著减小了HA免疫反应性区域(*P<0.05,图19A)。
肾小管损伤的半定量评估,包括肾小管扩张、上皮坏死、压扁和管型的分析,显示在第3天时介质处理的肾中重度的肾小管损伤(图19)。APAC2 16和32μg预处理降低了总肾小管损伤评分,因为在分离的肾小管横切片中仅观察到轻微的肾小管扩张和上皮的压扁(*P<0.05,图19)。
在1小时双侧肾动脉夹持模型中,APAC预处理预防了急性肾损伤。
最后,我们研究了APAC(批次2.1,11条肝素链)预处理在重度、几乎不可逆的IRI模型中的作用。两个肾动脉均被夹持1小时。在诱导热缺血之前10min,SD大鼠接受盐水介质(静脉内)或32μg(静脉内)。在介质处理当中,大鼠存活为75%(8只中的6只),并且在APAC2 32μg组中为100%(8只中的8只)(*P<0.05,图20A)。
然后,我们用血清肌酐和尿素氮量值分析肾功能。当与介质处理的肾相比时,APAC2预处理降低了血清肌酐和尿素氮水平(红色虚线,**P<0.01和***P<0.001,图20B&C)。
抗凝血酶耗尽的血浆中的凝血酶时间和活化部分凝血激酶时间
在存在APAC1(批次5.1,4条Hep链)和APAC2(批次5.2,8条Hep链)的情况下,AT耗尽的血浆中TT和APTT量值的实例分别显示在图21和22中。用肝素起始材料作为标准品来确定肝素浓度。
图21
在1μg/mL时,APAC1(批次5.1,4条Hep链)使TT延长到基线的至少2倍,并且在2μg/mL时,TT达到了所测量的最大时间(250s)。在2μg/mL时,APAC2(批次5.2,8条Hep链)使TT延长到基线的4.6倍(图21)。
图22
在4μg/mL时,所有APAC1(批次5.1,4条Hep链)使APTT延长到基线的1.4倍,并且在5μg/mL时延长到1.7倍。在4μg/mL时,APAC2(批次5.2,8条Hep链)使APTT延长到基线的1.9倍(图22)。在4μg/mL时,UFH使APTT延长到基线的1.5倍。
Hep的缀合水平(CL)及其与抗凝和抗血小板作用的关联的结论
所有变体表现出双重的抗凝和抗血小板(胶原蛋白诱导的聚集和血小板促凝活性)作用。
具有CL 6-16:1的APAC共享以下抗凝特性:
(在Blyscan GAG标准品上估算肝素浓度)
●在临床剂量(约3μg/mL)时与UFH类似的APTT的延长
●在高临床剂量(约6-8μg/mL)时比UFH更有效的APTT的延长
●具有Hep CL 6:1的APAC似乎是比具有CL≥8:1的APAC更强效的抗凝剂,尤其在较高浓度时
●在低于APTT延长(1.0μg/mL)所需的浓度时,CAT中的凝血酶生成在PPP和PRP中均被延迟并且降低,至少与UFH同样有效
●具有CL≥8:1的APAC在抑制PRP的凝血酶生成中似乎比具有较低CL的种类更强效
APAC具有抗血小板特性:
●降低枸橼酸钠PRP中胶原蛋白诱导的血小板聚集率和最大血小板聚集,而UFH则没有
●相比具有CL 4-6:1的分子,具有CL(8-16:1)的APAC一致地是更强效的胶原蛋白诱导的血小板聚集的抑制剂
APAC
具有CL≤6:1的APAC延长TT超过具有CL≥8的APAC
具有CL≤6:1的APAC延长APTT超过具有CL≥8的APAC
具有CL≥8:1的APAC抑制CAT中尤其是PRP中的凝血酶生成超过具有CL 4-6:1的APAC
具有CL≥8:1的APAC抑制胶原蛋白诱导的PRP聚集超过具有CL 4-6:1的APAC
总之,血小板聚集和血小板促凝活性的抑制得益于与HSA缀合的高数目的肝素链。
表I.APAC以及Hep与HSA的缀合水平。
两种不同的方法用于分析确定与HSA缀合水平(CL)的Hep[C],即mol Hep/mol HSA:
1.肝素起始材料(Hep st.);和
2.糖胺聚糖标准品(GAG st.)。
用BCA测定测量HSA[C]。
表II.在用5pM TF和4μM磷脂(PPL)引发的混合血浆(PP)中,在存在第一代APAC1(批次1.1)、第二代APAC2(批次2.1)、UFH和PBS的情况下,CAT中的凝血酶生成。Hep浓度基于测定中的Blyscan(GAG st.)估算。
表III.在用5pM TF和4μM PPL引发的混合血浆(PP)中,在存在APAC-CL6至APAC-CL16和PBS的情况下,CAT中的凝血酶生成。Hep浓度基于Blyscan(GAG st.)估算。
- 还没有人留言评论。精彩留言会获得点赞!