人参皂苷RO在制备肿瘤转移预防药物中的应用的制作方法
本发明涉及医药技术领域,具体涉及人参皂苷R0 制备预防肿瘤转移药物的应用。
背景技术:
肿瘤转移是指恶性肿瘤细胞脱离原发肿瘤,通过各种转移方式,到达继发组织或器官得以继续增殖生长,形成与原发肿瘤相同性质的继发肿瘤的全过程。肿瘤转移过程十分复杂,即肿瘤细胞会随机的从原发母体瘤灶中脱离出来;随后分泌出的某些酶将基底膜降解掉之后浸入并在血管的内皮细胞中稍作停留;进入人体的血液循环系统,并随着血液到达其他部位的血管壁并且会停留在此处;之后某些肿瘤细胞再透过血管进入到细胞外的基质中去,最终在某些组织或者器官处形成能够转移的肿瘤转移灶。因此,肿瘤手术后的“亚健康人”体内残留的循环肿瘤细胞是将来肿瘤发生转移的致命根源。
据世界卫生组织最近公布的统计资料,目前全世界癌症患者约达1400万,每年新发病人数约700万,每年约有500万人死于癌症,即约每6秒钟就有1人死于癌症。目前,大多数肿瘤的治疗都以手术为首选,一些早期癌症可通过手术得到治愈。但是在外科手术切除原发性肿瘤(肺癌、肠癌、乳腺癌和前列腺癌)后的5年内,一旦肿瘤转移,90%以上的病人将死于肿瘤转移,而不是原发性肿瘤。因此,肿瘤转移是癌症患者死亡的最主要原因,它是肿瘤发生和演变过程中最危险的阶段,原发性肿瘤在手术切除后的5年内是癌症转移、扩散的高风险期。根据2万以上结肠癌患者的术后统计,2期和3期结肠癌患者手术后3年内的再复发率分别为74%和82%(Sargent等,J. Clin. Oncol. 25:4569-73,2007)。针对手术后的肿瘤患者,在癌症治疗中当务之急是发现和消除肿瘤转移。
当今许多“抗癌药”本身并不能预防肿瘤的转移,主要是使癌细胞的复制和生长受阻断而死亡。目前已发现的抑制肿瘤细胞复制生长的靶点有200多个,而“抗癌药”只针对性的抑制其中几个,必定会引起其他靶点的连带效应。并且肿瘤一旦发生转移,“抗癌药”根本无法逆转病人的死亡,反而会因其毒副作用大而造成病人身体机能的下降。目前,肿瘤病人在手术切除后的早期并没有专门抑制循环肿瘤细胞的激活、粘附、外渗,和根除循环肿瘤细胞的药物。因此,现在急需研发各种能可靠预警和有效干预原发性肿瘤在手术后再转移的技术和产品,用来解决人类对肿瘤转移的恐惧和降低人类因肿瘤的转移造成的死亡。
人参皂苷R0为五环三萜的齐墩果烷型化合物,可以从牛膝、人参、西洋参等植物中提取获得,也可人工合成。人参皂苷R0的化学结构式如下:
。
人参皂苷R0具有消炎、解毒、抗血栓、抑制血小板凝集以及抗肝炎、活化巨噬细胞等作用。近期有研究发现,人参皂苷R0有自噬抑制作用,可在联合治疗中作为一种有效的抗癌剂用于克服耐药( Autophagy, 2016, 1-21) 。
但目前没有关于人参皂苷R0用于预防肿瘤转移的研究,而本发明首次提供了人参皂苷R0在肿瘤转移预防中的应用。
技术实现要素:
本发明提供一种人参皂苷R0在制备肿瘤转移预防药物中的应用,为预防肿瘤转移和降低因肿瘤的转移造成的死亡率提供一个新的方向。
所述的人参皂苷R0化合物,其来源可为人工合成、植物提取(如提取自牛膝、人参、西洋参等)等。可以作为单一剂型、或与其他药合用构成组合物,以达到预防原发性肿瘤在手术切除后再转移的目的。可与其他抗癌药合用,以达到辅助治疗癌症的目的。可用于治疗其他一些与细胞粘附、迁移和侵袭相关的疾病。
本发明中的人参皂苷R0对结肠癌细胞HT-29和人脐静脉内皮细胞HUVECs的存活率无明显的抑制作用。进一步采用流式细胞仪检测人参皂苷R0并未显著性的引起结肠癌细胞HT-29的凋亡。在体实验中也未发生小鼠体重显著下降的药物毒副作用。表明人参皂苷R0无明显的毒副作用,病人可长期服用。
本发明中人参皂苷R0在低毒浓度下具有以下优点:1.明显的干预肿瘤细胞与基质成分Fn(粘连蛋白)的粘附及其与内皮细胞HUVECs粘附;2.明显的干预肿瘤细胞迁移与侵袭能力;3.在HT29细胞人工肺转移小鼠模型中,显著的预防肿瘤细胞的肺部转移。因此可用于制备预防肿瘤转移的药物及治疗其他与细胞粘附、迁移和侵袭相关的疾病。
附图说明
图1人参皂苷R0对结肠癌细胞HT-29活性的影响(A);人参皂苷R0对人脐静脉内皮细胞HUVECs活性的影响(B); 人参皂苷R0对结肠癌细胞HT-29凋亡的影响(C)。
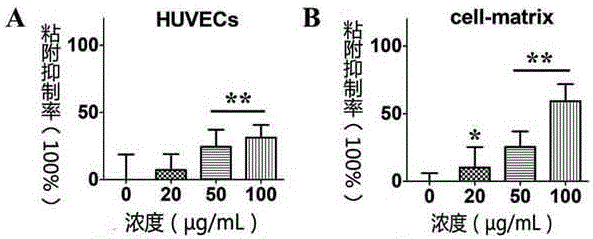
图2人参皂苷R0(0,20,50,100 μg/mL)对结肠癌细胞HT-29与人脐静脉内皮细胞HUVECs粘附的抑制作用(*p<0.05,**p<0.01)(A)。人参皂苷R0(0,20,50,100 μg/mL)对结肠癌细胞HT-29与Fn(粘连蛋白)粘附的抑制作用(*p<0.05,**p<0.01)(B)。
图3人参皂苷R0对结肠癌细胞HT-29迁移能力的抑制作用和柱状图(*p<0.05,**p<0.01)。
图4人参皂苷R0(0,20,50 μg/mL)对结肠癌细胞HT-29侵袭能力的抑制作用和柱状图(**p<0.01)。
图5人参皂苷R0(0,25mg/kg,250mg/kg)对荷瘤小鼠体重的影响。
图6人参皂苷R0对肺表面肿瘤结点数的影响(A),各用药组小鼠肺部代表性图(B)。
具体实施方式
下面结合附图和实施例对本发明作进一步的阐述,但本发明的保护范围并不限于此。
实施例1人参皂苷R0对结肠癌细胞HT-29和人脐静脉内皮细胞HUVECs的增殖抑制作用
方法:选取处于对数生长期且状态良好的细胞,胰酶消化后,细胞浓度调整为8×104~1×105个/mL,然后在96孔板中每孔加入100 µL稀释液,于37 ℃、5 % CO2培养箱中培养24 h;人参皂苷R0用DMSO溶解,并经过0.22 μm的滤膜过滤除菌。再用培养基将一级母液稀释100倍得到加药终浓度,溶液中DMSO的浓度为1 wt%。去除旧的培养基,每孔加入100 µL含不同浓度目标药物的培养基,设置空白对照组,溶剂对照组,每组设6个复孔,培养箱中继续孵育24 h;移除含药培养基,每孔加入100 µL无血清无酚红的RPMI 1640培养基与10 µL 5mg/mL的MTT溶液,培养箱中继续培养4 h;吸去各孔上清液并加入100 µL DMSO,摇匀20 min,充分溶解,用酶标仪于554 nm波长处测定每孔的OD值。存活率(%)=(实验组光吸收值-溶剂对照组光吸收值)/(空白对照组光吸收值-溶剂对照组光吸收值)×100%。
如图1A和1B所示,不同药物浓度作用24 h后,人参皂苷Ro并没有显著抑制HT29细胞和HUVECs细胞的存活和增殖。证明人参皂苷Ro没有呈现出明显的细胞毒性。在后续的体外粘附、迁移和侵袭实验中,可排除因药物的毒性作用而对实验结果产生的干扰。
实施例2人参皂苷R0对结肠癌细胞HT-29凋亡的影响
方法:取对数生长期且状态良好的HT-29 细胞,消化后,加入到6孔板中,置于培养箱孵育24 h;吸弃培养基,用PBS溶液清洗3次,分别加入配好的不同药物浓度培养基,在培养箱中孵育24 h。吸弃培养基,经胰酶消化,用PBS 吹打成分散的细胞悬液, 1500 rpm 离心 5 min,吸弃溶液,加入PBS吹打混悬;调整细胞浓度,吸取100 μL的细胞悬液加入到5 mL Ep管中,各管分别加入 5 μL 7-AAD 和 5 μL Annexin V-PE,并设定阴性对照管,两个染料的单阳管;吹打混匀后,在避光环境下15-25 ℃孵育15 min;每管加入500 μL binding buffer 缓冲液吹打混匀,经流式细胞仪488 nm波长检测分析。
如图1C所示,采用流式细胞术,检测人参皂苷R0引起的细胞凋亡作用,得到由四个象限组成细胞直方图,Q1区域表示实验操作过程中出现机械损伤的细胞,Q2区域表示在药物作用下发生坏死或晚期凋亡的细胞,Q3区域表示功能形态正常的细胞,Q4区域表示发生早期凋亡的细胞。从图中可以看出,Q2和Q4区域细胞的百分数(即发生凋亡的细胞百分比),随着药物浓度的升高呈现增大趋势,但与空白组相比没有显著性差异。进一步证明人参皂苷R0无明显毒副作用。
实施例3人参皂苷R0对结肠癌细胞HT-29与人脐静脉内皮细胞HUVECs粘附的影响
方法:选取对数生长期、状态良好的HUVECs,经消化,混悬于配好的M199培养基。按每孔500 µL混悬液接种于24孔板,在37 ℃,5 % CO2环境中培养,当其生长覆盖区域达各孔底部80%-90%以上时,吸弃培养基,经PBS溶液洗涤2次。按每孔加入500 µL含浓度为1 ng/mL的刺激因子IL-1β培养基,以刺激内皮细胞表面粘附分子的表达,设置空白对照组,每组3个复孔,在37 ℃,5 % CO2环境中继续孵育4 h;取HT-29细胞经胰酶消化后,混悬于培养基。按1000 rpm离心5 min,吸弃培养基,加入1 mL PBS溶液将底部细胞吹打均匀后加入10 µL罗丹明-123溶液反复吹打混匀,在避光条件下染色15 min;按1000 rpm 离心5 min,吸去溶液,加入 PBS洗涤,再离心吸去溶液,如此重复两次。加入无酚红RPMI 1640培养基将细胞悬液吹打均匀,经计数板计数,加入培养基稀释细胞悬液浓度为6×105细胞/mL;在避光条件下,按每孔500 µL细胞悬液加入24孔板内,再分别加入目标药物使作用浓度达到0、20、50、100 μg/mL,其中未加刺激因子组加入不含药物的HT29细胞悬液,置于培养箱内孵育1 h;各孔吸去残留培养基,经PBS轻柔洗涤2次,去除未产生粘附的细胞。加入500 µL无酚红的RPMI 1640培养基,经荧光显微镜拍摄(10×)。每孔独立选取10个随机视野,经ImagJ软件计算粘附细胞数,按以下公式计算粘附抑制率。粘附抑制率(%)=1-加药组粘附细胞数/对照组粘附细胞数×100 %。
如图2A所示,人参皂苷Ro抑制了HT29细胞对内皮细胞层的粘附,且呈现剂量依赖性。相对于未加药组,50 µg/mL和100 µg/mL药物会引起28.7%和37.3%的内皮粘附抑制率。
实施例4人参皂苷R0对结肠癌细胞HT-29与基质成分Fn(粘连蛋白)粘附的影响
方法:包被基质膜:将Fn溶液用无血清培养液稀释为10 μg/mL的工作液,于96孔板中每孔加入包被液100 μL,在37 ℃、5 % CO2(V/V)的培养箱中继续培养24 h; BSA封闭;吸出培养板中工作液,将要测试孔每孔加入100 μL 1 wt% BSA溶液,置于37 ℃、5 % CO2(V/V)的培养箱中封阻1 h后,用无菌PBS溶液清洗3次,彻底吸弃PBS;接种细胞:取对数生长期HT-29细胞,消化后并调整细胞浓度为2×105 / ml,与目标药物混合使之终浓度分别为0、1、10、30 μg/mL,在已经包被过Fn的96孔培养板中,每个孔分别加入100 µL,另设空白对照组、溶剂对照组,每组设6个复孔,在常规培养箱中培养1 h; MTT比色法检测:小心吸弃培养液,PBS清洗3次,除去未粘附细胞,于96孔板中每孔加入含10 µL 5 mg/mL MTT的无血清无酚红培养液100 µL,继续孵育4 h,弃去上清,每孔加入100 µL DMSO,振荡摇匀20 min,溶解后使用酶标仪检测554 nm处的OD值。相对粘附率(%)=用药组OD值/空白对照组OD值×100%。
肿瘤细胞对胞外基质的粘附,在蛋白依赖性细胞迁移过程中是十分关键的步骤,对于肿瘤的进一步侵袭也同样重要。如图2B所示,经药物作用1 h后,HT29细胞的粘附能力受到显著削弱,其加药组的粘附抑制率在50 µg/mL、100 µg/mL时分别达到29.2%和61.5%。
实施例5人参皂苷R0对结肠癌细胞HT-29迁移能力的影响
方法:取12孔板,每孔背后划上5条平行线,加入配好的Fn溶液,放置培养箱中24 h。取状态良好的HT29细胞,经胰酶消化后,调整悬液浓度为3×105个/mL。每孔加入1 mL细胞悬液于12孔板中,放置于37℃,5% CO2培养箱内孵育观察。细胞生长区域在板内面积占90%以上,且状态良好时,用移液枪在各孔内画两条平行线,用PBS清洗漂浮的细胞3次。将事先配好的溶解有各浓度(100 µg/mL、50 µg/mL、20 µg/mL、0 µg/mL)药物的McCoy’s 5A培养基加入到各孔内,放入培养箱中。在0 h、24 h时间点,对各划痕交叉点进行拍照。
如图3所示,经过24 h孵育,加药组HT29细胞的定向运动和播散距离明显小于空白组。对比不同药物浓度组的划痕宽度可知HT29细胞迁移能力受到人参皂苷R0的影响,且呈浓度依赖性。
实施例6人参皂苷R0对结肠癌细胞HT-29侵袭能力的影响
方法:用浓度为1mg/mL Matrigel稀释液,包被transwell小室底部膜的上室面,放置于冰箱4℃风干,使用前需进行基底膜水化:吸去培养板里残留的溶液,每孔加入50 µL 10 mg/mL BSA的培养液,37 ℃,孵育30 min。取状态良好的HT29细胞,用无血清培养基轻柔漂洗两次后,经消化,混悬于无血清培养基,调整浓度为1×106细胞/mL,小室中加入100 µL含不同药物浓度的细胞悬液,在各孔底部加入600 µL含20% FBS的DMEM培养基, 37 ℃,5% CO2培养箱中继续培养24 h。取出tanswell小室,吸去孔中残留的培养液,用PBS洗涤3遍,加入甲醇固定细胞40 min。吸弃甲醇,待小室风干后,用PBS清洗2遍,加入0.1%结晶紫溶液染色20 min,再用PBS洗净多余染料,最后用湿棉签缓慢擦拭除去上层未穿膜的细胞。采用倒置显微镜下,随机取5个独立视野拍照计数。
如图4所示,Transwell侵袭实验结果显示,加药组穿膜细胞数都明显少于空白组,随机拍摄几个独立视野,进一步分析比较显示:在较低浓度20 µg/mL药物作用下,细胞的侵袭抑制率即高于50%(P<0.01)。
实施例7人参皂苷Ro体内预防肿瘤转移的作用
方法:选用5~6周龄的雌性Balb/c小鼠(清洁级),每只小鼠体重在18-22 g,在实验前安排大约1-2周适应动物室。取处于对数生长期、状态良好的HT29细胞,经不含EDTA胰酶消化后混悬于无血清McCoy’s 5A培养基,调整浓度为1×107细胞/mL,取Balb/c小鼠实施尾静脉注射,每只小鼠注射200 µL单细胞悬液,另外设定对照组,只注射200 µL无血清McCoy’s 5A培养基。将注射后的Balb/c小鼠随机分为无血清培养基组,人参皂苷Ro高、低剂量实验组,共计3组,每组8只。并于接种肿瘤细胞前四天开始给药,对照组给予生理盐水,高剂量组给予250mg/kg人参皂苷溶液,低剂量组给予25 mg/kg人参皂苷溶液。小鼠灌胃给药,每天每只0.2 mL,连续给药40天。同时每隔两天称取每只小鼠体重,并记录。40天给药结束后的次日采用脱颈椎的方式处死小鼠,解剖后取小鼠的肺组织放置于Bouin氏液中进行固定染色。放入Bouin氏液24 h左右将裸鼠肺组织从Bouin氏液中取出,浸泡于75%乙醇溶液中,之后每过24 h对浸泡的乙醇溶液进行一次更换,连续换液一周。乙醇清洗结束后,将肺部组织拍照。
小鼠的体重变化如图5所示,给药40天后,各给药组小鼠与空白组相比,小鼠的体重均无显著性差异,且没有发生小鼠消瘦或死亡的情况。该实验结果初步表明人参皂苷Ro在25 mg/kg和250 mg/kg给药剂量下对小鼠无明显毒副作用。
如图6B所示,Bouin氏液染色后经过75%乙醇脱色处理,肺脏正常组织呈黄色,转移灶部位呈浅黄色或白色。通过每日灌胃给药,影响血液循环系统中的HT29肿瘤细胞对肺组织的转移。高浓度组的8只裸鼠的肺脏在其表面及内部观察到1-2 处转移灶;低浓度组的8只裸鼠,在肺脏表面出现7-8颗直径1-2 mm的转移灶;对照组8只裸鼠中,裸鼠肺脏表面出现10-18颗直径大于2 mm转移灶,且部分转移灶直径大于4 mm。通过对比各组小鼠肺部转移灶直径,可大概推测肿瘤细胞成功发生转移的时间,结合转移灶的数量可知人参皂苷Ro可以显著抑制HT29细胞的体内肺转移,且呈剂量依赖性。
综上所述,人参皂苷R0在体外具有显著的干预HT29细胞粘附、迁移和侵袭的活性而不影响细胞的生长,这符合肿瘤转移预防药物的一般特性。体内实验表明,在HT29细胞人工肺转移小鼠模型中,人参皂苷R0可以显著的预防肿瘤细胞的肺部转移。在实验过程中,未发生小鼠体重显著下降的药物毒副作用。因此,人参皂苷R0可以作为肿瘤转移预防的药物,为开发利用天然植物资源提供了科学依据。
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
- 还没有人留言评论。精彩留言会获得点赞!