多不饱和脂肪酸的衍生物作为药物的用途的制作方法
发明领域
本发明涉及1,2-多不饱和脂肪酸衍生物作为药物的用途,所述药物优选地用于治疗其病因基于细胞膜脂的变化的疾病,例如:这些脂质和与它们相互作用的蛋白的水平的变化、组成或结构的变化;以及用于治疗其中脂质组成和膜结构的调节以及与它们相互作用的蛋白的调节导致病理状态的逆转的疾病。
因此,由于本发明具有宽的应用范围,其可能通常被包括在药物和药剂学的领域中。
背景技术:
细胞膜是界定细胞和细胞包含的细胞器的组织的结构。大部分生物学过程在膜中或在膜附近发生。脂质不仅具有结构作用而且调节重要过程的活性。而且,调节膜脂组成还影响参与控制细胞的生理学的重要蛋白诸如G蛋白或PKC的位置或功能(Escribá等人,1995,1997,Yang等人,2005,Martinez等人,2005)。这些和其他研究证明了脂质在控制重要的细胞功能上的重要性。实际上,许多人类疾病例如癌症、心血管疾病、神经变性疾病、肥胖症、代谢病症、瘤和炎症性疾病、传染病或自身免疫病以及其他的与生物膜中的脂质的水平或组成的变化有关,进一步证明了除了调节膜脂的组成和结构的本发明的脂肪酸之外,用脂肪酸治疗可用于逆转这些疾病的有益效果(Escribá,2006)。
在饮食中被消耗的脂质调节细胞膜的脂质组成(Alemany等人,2007)。此外,多种生理和病理状态可以改变细胞膜中的脂质(Buda等人,1994;Escribá,2006)。作为诱导膜脂中生理学变化的状态的一个实例,可以提及在具有可变温度的江中生活的鱼,其中,当温度从20℃(夏天)下降到4℃(冬天)时,鱼的脂质经历重要的变化(膜脂的量和类型的变化)(Buda等人1994)。这些变化允许维持它们在不同性质的细胞类型中的功能。可以影响脂质组成的病理学过程的实例是神经病症或药品诱导的疾病(Rapoport,2008)。因此,可以说,膜脂可以决定细胞信号传导的多种机理的正确活动。
膜脂组成的变化影响细胞信号传导且可以导致疾病的发展或逆转疾病(Escribá,2006)。过去几年的各种研究表明,膜脂起到比它们迄今已经被指定的作用更有关的作用(Escribá等人,2008)。细胞膜的传统观点是指定脂质纯粹结构的作用,作为膜蛋白的载体,膜蛋白被认为是膜的唯一功能要素。质膜将具有另外的作用,避免水、离子和其他分子进入细胞。然而,膜在维持健康、疾病出现和愈合方面具有非常重要的其他功能。由于因为身体的细胞患病而身体患病,所以膜脂的变化产生细胞的变化,而这些可以导致疾病的出现。同样地,目的在于调节膜脂的水平的治疗的、营养的或化妆的干预可以预防和逆转(治愈)病理学过程。此外,大量的研究表明,消耗饱和的和反式单不饱和脂肪与健康的恶化有关。除了上述神经疾病之外,血管疾病、癌症和其他疾病也直接与膜脂相关(Stender和Dyerberg,2004)。机体的恶化表现在该类型和其他类型的疾病的出现,疾病可以包括代谢疾病、炎症、神经变性等。
细胞膜是细胞通过其接收代谢物和来自其他细胞和围绕其的细胞外环境的信息的选择性屏障。然而,膜在细胞中起到其他非常重要的功能。在一个方面,它们用作参与接收或发出控制重要的器官功能的信息的蛋白的载体。由许多激素、神经递质、细胞因子、生长因子等介导的这些信息会激活膜蛋白(受体),膜蛋白(受体)通过其他蛋白(外周膜蛋白)将所接收的信号传播到细胞中,其他蛋白(外周膜蛋白)中的一些也位于膜中。因为(1)这些系统以放大级联起作用,和(2)膜脂可以调节这些外周蛋白的定位和活性,所以膜的脂质组成可以对细胞的生理学具有主要的影响。具体地,某些外周蛋白诸如G蛋白、蛋白激酶C、Ras蛋白等与细胞膜的相互作用取决于其脂质组成(Vogler等人,2004,Vogler等人,2008)。此外,细胞膜的脂质组成受饮食中的脂质的类型和量影响(Escribá等人,2003)。实际上,营养物或药物脂质干预可以调节膜的脂质组成,这又可以控制重要的细胞信号传导蛋白的相互作用(和因此活性)(Yang等人,2005)。
膜脂能够控制细胞信号传导的事实还可以假定它们能够调节细胞的生理学状态,且因此能够调节一般的健康状态。实际上,已经描述了脂质对健康的负面的和正面的影响(Escribá等人,2006;Escribá等人,2008)。初步研究已经表明,一种单不饱和的脂肪酸2-羟基油酸能够逆转某些病理学过程,例如超重、高血压或癌症(Alemany等人,2004,Martinez等人,2005;Vogler等人,2008)。
心血管疾病常常与构成心脏和脉管组织的细胞的过度增殖相关。该过度增殖产生在脉管的内腔和心血管系统的腔内的心血管沉积物,导致许多疾病,例如高血压、动脉粥样硬化、缺血、动脉瘤、猝发、梗塞形成、咽峡炎、中风(脑血管意外)等(Schwartz等人,1986)。实际上,已经提出,预防细胞增殖的药品的开发将是预防和治疗心血管疾病的良好替代方案(Jackson和Schwartz,1992)。
肥胖症由在摄取和能量消耗之间的改变的平衡引起,部分由于调节这些过程的机理的变化。另一方面,该疾患的特征在于,脂肪细胞(fat cell)、脂肪细胞(adipocyte)的增生(细胞数量的增加)或肥大(增加的大小)。大量的研究表明,不含其他分子或作为其他分子的一部分的脂肪酸,可以影响与能量稳态相关的许多参数,例如体脂质量、脂质代谢、热产生和食物摄取以及其他的(Vogler等人,2008)。在该意义上说,脂肪酸的改性可以是调节能量稳态,即在摄取和能量消耗之间的平衡,和因此调节相关过程诸如食欲或体重的策略。
神经变性过程导致许多具有不同表现,但具有由中枢和/或周边神经系统细胞的变性或功能障碍引起的共同的特征的疾病。这些神经变性过程中的一些涉及患者的认知能力的显著降低或他们的运动能力的变化。神经变性病症、神经病症和神经精神病症具有神经元变性或神经元的组分例如脂质(例如,髓磷脂)或膜蛋白(例如,肾上腺素受能受体、5-羟色胺受体等)的变化的共同基础。这样的中枢神经系统尤其包括阿尔茨海默病、帕金森病、多发性硬化、ALS、海马硬化和其他类型的癫痫、灶性硬化、肾上腺脑白质营养不良和其他脑白质营养不良、血管性痴呆、老年性痴呆、包括偏头痛的头痛、中枢神经系统创伤、睡眠障碍、头晕、疼痛、中风(脑血管意外)、抑郁、焦虑或成瘾。此外,某些神经疾病和神经变性疾病可以导致以失明、听觉问题、定向障碍、情感变化等结局的过程。
充分表征的神经变性病症的实例是阿尔茨海默病,其特征在于,形成主要起源于错误的肽加工的膜蛋白片段(例如,β淀粉样肽)组成的寿斑,随后在细胞的外部上累积,和Tau蛋白的神经纤维缠结。该过程与胆固醇的代谢的变化和随后的某些膜脂诸如胆固醇和二十二碳六烯酸的水平变化相关(Sagin和Sozmen,2008,Rapoport,2008)。此外,若干神经变性疾病例如帕金森病、阿尔茨海默病、老年性痴呆(或路易体)与α突触核蛋白的纤维状聚集体的病理积累相关,这导致甘油三酯的细胞代谢的显著变化(Coles等人,2001)。实际上,这些和其他神经变性疾病的发展与血清或细胞脂质例如胆固醇、甘油三酯、鞘磷脂、磷脂酰乙醇胺等的变化相关。这又表明,脂质在神经元、神经、大脑、小脑和脊髓的正确活动中起到至关重要的作用,这在逻辑上提供了脂质在中枢神经系统中的丰度。本发明的分子具有高的或非常高的逆转与神经病症、神经变性病症和神经精神病症相关的许多过程的潜力。
而且,不同类型的硬化和其他神经变性疾病涉及“脱髓鞘”,其最终结果是损失在神经元轴突的覆盖物上的脂质,伴随随后的脂质参与的电信号的传播过程的变化。髓磷脂是围绕许多神经元的轴突和由神经胶质细胞(Schwann细胞)的质膜的一系列螺旋折叠形成的脂肪层。因此,清楚的是,脂质在神经变性疾病的发展中起到重要的作用。而且,发现未改性的天然的PUFA对神经变性过程的发展具有适当的预防效果(Lane和Farlow,2005)。实际上,中枢神经系统中大部分重要的脂质是二十二碳六烯酸、天然的PUFA,且其丰度在许多神经变性过程中改变。
代谢疾病形成以某些分子的累积或缺乏为特征的一组疾病。典型的实例是葡萄糖、胆固醇和/或甘油三酯高于正常水平的累积。全身性的(例如,增加血浆水平)和细胞水平(例如,在细胞膜中)的葡萄糖、胆固醇和/或甘油三酯的增加水平与导致不同水平的功能障碍的细胞信号传导的变化相关,且通常是由于某些酶的活动的错误或由于对这些蛋白的不适当的控制。最重要的代谢疾病包括高胆固醇血症(高胆固醇)和高甘油三酯血症(高甘油三酯)。这些疾病具有较高的发生率、发病率和死亡率,所以它们的治疗是首位必要性的。其他重要的代谢疾病包括糖尿病和胰岛素抵抗力,以葡萄糖水平的控制问题为特征。这些代谢疾病涉及到其他疾病的出现,比如癌症、高血压、肥胖症、动脉粥样硬化等。近来,已经定义了与上述代谢病症密切相关且其本身可以构成新类型的代谢病理学(metabolopathy)的另一种疾病过程,其是代谢综合征。
某些多不饱和脂肪酸(PUFA)对某些疾病的保护作用已经由不同的研究者进行描述。例如,PUFA减慢了癌症的发展且具有对抗心血管疾病、神经变性疾病、代谢病症、肥胖症、炎症等的发展的积极效果(Trombetta等人,2007,Jung等人,2008,Florent等人,2006)。这些刺激表明脂质(PUFA)在多种疾病的病因和在其治疗上的重要作用。然而,这些化合物(PUFA)的药理学活性是非常有限的,这是由于在血液中快速的代谢和短的半衰期。因此,有必要开发具有与到目前为止所使用的PUFA相比更慢的代谢而导致在细胞膜中增加的存在的PUFA,利于细胞信号传导外周蛋白的相互作用。本发明的分子是PUFA的合成衍生物,具有与天然的PUFA相比更慢的代谢以及显著的和明显优良的治疗效果。
因为在位于细胞膜中的脂质的结构的和功能的变化与不同类型的但具有与膜细胞中的脂质的结构的和/或功能的变化单一相关的病因的多种疾病诸如癌症、心血管疾病、肥胖症、炎症、神经变性和代谢疾病的发展之间的关系,所以本发明集中在使用能够解决与上述已知的脂肪酸相关的技术问题的新的合成的多不饱和脂肪酸,且因此,它们可有效地用于治疗这些疾病。
发明描述
发明简述
本发明集中在用于治疗常见疾病的多不饱和脂肪酸的1,2-衍生物(在下文:D-PUFA),常见疾病的病因与细胞膜脂的结构的和/或功能的变化或与细胞膜脂相互作用的蛋白的结构的和/或功能的变化有关,常见疾病特别地选自:癌症、血管疾病、神经变性和神经病症、代谢疾病、炎症性疾病、肥胖症和超重。D-PUFA与天然的多不饱和脂肪酸(在下文:PUFA)相比具有更低的代谢速率,这是因为碳1和/或2处的不同于氢(H)的不同原子的存在妨碍了其通过β-氧化的降解。这导致膜的组成的显著变化,调节了细胞信号传导外周蛋白的相互作用。这可以导致,例如,膜的表面的包装的差异,调节了参与细胞信息的传播的外周蛋白的锚固。因此,为本发明主题的D-PUFA分子具有比PUFA更大的活性,显示了对于所确定的疾病的药理学治疗的显著更高的效应。
如上所述,用本发明的D-PUFA分子治疗的疾病共有相同的病因,其与细胞膜脂的结构的和/或功能的(或任何其他来源)变化或与细胞膜脂相互作用的蛋白的结构的和/或功能的(或任何其他来源)变化有关。以下疾病作为实例被列出:
·癌症:肝癌、乳腺癌、白血病、脑癌、肺癌等。
·血管疾病:动脉粥样硬化、缺血、动脉瘤、猝发、心肌病、血管生成、心肌增生(cardiac hyperplasia)、高血压、梗塞形成、咽峡炎、中风(脑血管意外)等。
·肥胖症、超重、食欲控制和蜂窝组织。
·代谢疾病:高胆固醇血症、高甘油三酯血症、糖尿病、胰岛素抵抗力等。
·神经变性疾病、神经病症和神经精神病症:阿尔茨海默病、血管性痴呆、Zellweger综合征、帕金森病、多发性硬化、肌萎缩侧索硬化、海马硬化和其他类型的癫痫、灶性硬化、肾上腺脑白质营养不良和其他类型的脑白质营养不良、血管性痴呆、老年性痴呆、路易体痴呆、多系统萎缩、朊病毒疾病、包括偏头痛的头痛、中枢神经系统损伤、睡眠障碍、头晕、疼痛、中风(脑血管意外)、抑郁、焦虑、成瘾、记忆、学习或认知问题和需要通过用本发明的化合物治疗引起神经变性或神经再生的停止的一般疾病。
·炎症性疾病,包括炎症、心血管炎症、肿瘤诱发的炎症、类风湿起源的炎症、传染性起源的炎症、呼吸炎症、急性炎症和慢性炎症、炎症性质的痛觉过敏、水肿、由创伤或烧伤引起的炎症等。
本发明的D-PUFA化合物的特征在于下式(I):
COOR1-CHR2-(CH2)a-(CH=CH-CH2)b-(CH2)c-CH3
(I)
其中a、b和c可以具有在0和7之间的独立的值,且R1和R2可以是离子、原子或具有独立地不超过200Da的分子量的原子团。
在本发明的一个优选的结构中,a、b和c可以具有在0和7之间的独立的值,R1是H且R2是OH。
在本发明的另一个优选的结构中,a、b和c可以具有在0和7之间的独立的值,R1是Na且R2是OH。
在本发明的另一个优选的结构中,a和c可以具有在0和7之间的独立的值,b可以具有在2和7之间的独立的值,且R1和R2可以是离子、原子或其分子量独立地等于或低于200Da的原子团。
本发明的脂肪酸的施用可以通过任何方式来进行,例如经肠地(IP)、口服地、直肠地、局部地、通过吸入或通过静脉内、肌肉内或皮下注射。此外,施用可以是根据上面的式或以来自上面的式的任何药学上可接受的衍生物,例如:酯、醚、烷基、酰基、磷酸酯、硫酸酯、乙基、甲基、丙基、盐、复合物等。
此外,本发明的脂肪酸可以被单独施用或被配制在彼此组合和/或与赋形剂组合的药物组合物和/或营养物组合物中,赋形剂例如:粘合剂、填料、崩解剂、润滑剂、包衣(coater)、增甜剂、调味赋形剂、着色赋形剂、运载体(transporter)等以及它们全部的组合。,并且,本发明的脂肪酸可以是与其他活性成分组合的药物组合物和/或营养物组合物的一部分。
为了本发明的目的,术语“营养物”被定义为在进食期间定期摄取的且用来预防疾病的化合物,在该情形中疾病的病因与细胞膜脂的变化有关联。
为了本发明的目的,术语“治疗有效量”是逆转或预防疾病而没有显示出不良副作用的量。
附图简述
图1.表1中的化合物对肿瘤细胞生长的效应。在y轴上表示活细胞的数量(%对照),活细胞的数量取决于所使用的化合物(x轴)。将人类肺癌(A549)细胞在具有10%血清的RPMI-1640中在不存在(对照)或存在250μM的本发明化合物下培养48小时。曲线表示活细胞的数量(三次实验的平均值的平均误差和标准误差)。虚线表示细胞的完全消除(0%生存力)。
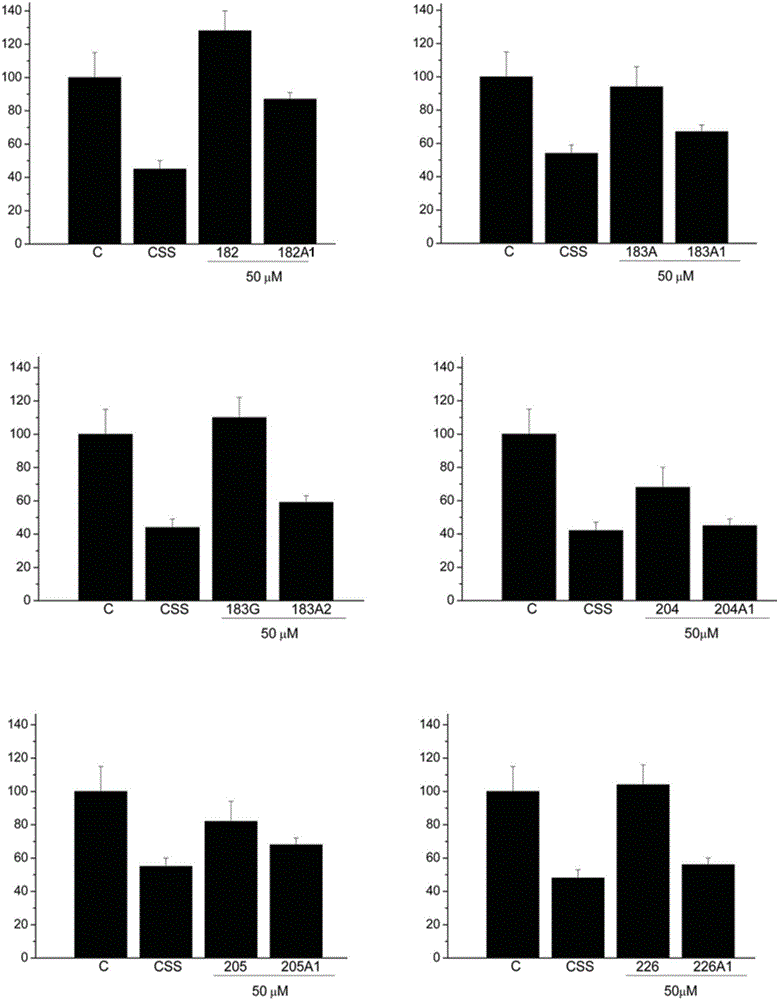
图2.本发明的某些PUFA和D-PUFA分子对A10血管细胞的增殖的效应。在y轴上表示细胞的数量(%对照),细胞的数量取决于所使用的脂肪酸(横轴)。将细胞在完全培养基(对照,C)中、在没有补充物(CSS)的不完全培养基中或在PUFA(182、183A、183G、204、205和226)或D-PUFA(182A1、183A1、183A2、204A1、205A1和226A1)的存在下的完全培养基中温育。增殖的减少,但仍高于CSS的值,表明这些分子具有调节心血管细胞的异常增殖的能力,且没有毒性。
图3
A.在不存在(对照,C)或存在不同的D-PUFA和PUFA下培养的脂肪细胞的增殖。在y轴上表示细胞的数量(%对照),细胞的数量取决于所使用的脂肪酸(x轴)。作为非增殖对照,使用缺乏血清的培养基(具有低血清百分数的培养基,MSB)。
B.在Y-轴表示体重(未处理的对照的%)且在横轴表示用于处理实验动物的化合物。在X轴,从左到右,表示首先用媒介物(C)处理,然后用若干种本发明化合物处理。SHR大鼠用200mg/kg的在图中示出的24种化合物中的每一种处理一个月。每个实验组由六个动物组成,且对于每个系列,使用用媒介物(水)处理的一组动物,且将结果与没有接受任何处理的动物的重量进行比较。字母A、B、N和P表明根据表3的基团R1和R2的组合。
图4
A.在不存在外部因子(对照,C:0%神经元死亡)和存在NMDA(100%神经元死亡)下培养的P19细胞的死亡。在纵轴上表示神经元死亡(对照的%),其取决于所使用的脂肪酸(x轴)。在存在NMDA下,PUFA的存在引起P19细胞的成活率的适度增加。D-PUFA引起细胞成活率值的显著增加,在226A1的情况下超过多于200%。因为培养处理的细胞的细胞数量高于对照细胞的细胞数量,所以可以肯定这些化合物不仅预防由NMDA引起的神经元死亡(抗神经变性)而且还是神经再生剂。
B.D-226B1PUFA改进阿尔茨海默病的动物模型在径向迷宫(radial maze)中的训练表现的效果。在左图的Y轴示出完成训练所花费的时间,且在右图的纵向Y轴示出在执行按程序的训练所犯的错误的总数(平均值±平均值的标准误差)(运行时间)。在两个图中,从左到右,在X轴表示健康的小鼠(对照)中的结果(第一列)、在患有诱发的阿尔茨海默病并用作为媒介物的水处理的小鼠中的结果(第二列)或在用化合物226B1处理的小鼠中的结果(第三列)。患有阿尔茨海默病的动物比健康的小鼠花费更长的时间且犯更多次错误,是统计学显著性差异(*,P<0.05)。相比之下,用化合物226B1处理的患有阿尔茨海默病的小鼠与健康的动物没有显示显著性差异。
图5
A.上图是示出本发明的不同的D-PUFA对促炎症COX-2蛋白的表达的抑制的免疫印迹,促炎症COX-2蛋白先前由源自单核细胞U937的人类巨噬细胞中的细菌脂多糖(LPS)(C+,100%)诱发。在下图中,示出以下化合物(X轴)的以对照的%(Y轴)表示的COX-2/COX-1关系:OOA(2-羟基-油酸)、OLA(182A1)、OALA(183A1)、OGLA(183A2)、OARA(204A1)、OEPA(205A1)、ODHA(226A1)。
B.示出了本发明的不同的D-PUFA化合物在炎症动物模型中的抗炎功效。示出了本发明的不同的化合物(X轴)对由小鼠中的LPS诱发的TNFα的血清水平(pg/ml)(y轴)的抑制效果。该因子的降低直接与抗炎药物相关。化合物与在左图中的化合物相同。
图6.3 T3-L1细胞中的胆固醇水平(A)和总甘油三酯(B)。在纵轴上表示胆固醇(A)或甘油三酯(B)(%总脂质)的水平,其取决于所使用的脂肪酸(x轴)。所示出的值是通过光谱分析法(胆固醇)或薄层色谱法随后气相色谱法(甘油三酯)测量的与细胞膜中的总脂质相比的胆固醇和甘油三酯的平均值±平均值的标准误差。该图示出在不存在(对照)或存在上文列出的D-PUFA或PUFA下培养的细胞中的量化值。
图7
A.在膜的结构和由D-PUFA引起的细胞效应之间的关系。在纵轴表示相对于HII转变温度(X轴)的细胞效应(%对照)。确定D-PUFA分子中的每一种的效应的平均值(所研究的所有疾病模型中的每种脂质的平均效应和双键的数量),并将其对转变温度进行绘图。HII转变温度的降低表明更大地诱导的膜不连续性,这导致膜中存在外周蛋白的锚固部位,并产生细胞信号传导的更好的调节且因此更有效地控制某些疾病。
B.在PUFA的治疗功效(空心圆)和D-PUFA的治疗功效(实心圆)之间的关系。每个点是对所有被研究的疾病所观察的效应的平均值(Y轴:相对于对照%的变化),这取决于由每个分子提供的双键的数量(横轴)。在两种情况下,相关性是显著的(P<0.05)。观察到治疗效果取决于分子具有的双键的数量,双键的数量又与调节膜结构的能力相关。在该意义上说,在D-PUFA而非PUFA中存在的碳1和2中的基团的存在对增强这些分子的治疗效果是必需的。
这些结果表明本发明中包含的脂质的效果具有共同的基础。这些相关性(在两种情况下,对于D-PUFA,具有0.77和0.9的r2值且P<0.05)清楚地表明所使用的脂质的结构是其效应的基础,且其通过由每种脂质的结构功能关系引起的膜结构的调节而发生。实际上,存在人类疾病与PUFA的水平的上述变化相关的许多研究工作,证明了脂质在细胞生理学中的重要作用。
发明详述
由本发明的D-PUFA分子提供的广谱的治疗应用导致广泛地假定,这些D-PUFA分子给予膜特定的结构性质,该特定的结构性质允许在这些膜中和通过这些膜进行活性的适当处理。换句话说,导致不同种类的疾病的异常中许多由用于细胞功能的某些重要的脂质的水平的显著变化和/或与膜相互作用的蛋白的水平的显著变化引起和/或与脂质的产生相关。可以导致不同种类的疾病的这些病理变化可以通过本发明中描述的合成的脂肪酸来预防或逆转,合成的脂肪酸可以有效地用于治疗或预防其病因与生物膜脂的水平、组成、结构的变化或任何其他变化相关或与生物膜中的这些脂质的这些变化引起的细胞信号传导的反调节相关的任何疾病。另外,当由于另一种变化而出现疾病时,本发明中包含的脂质还可以用作药物,只要性质和/或膜功能的调节的结果能够逆转病理学过程。
对于本发明的脂肪酸的治疗效果的这一研究,使用培养的细胞系和不同疾病的动物模型,且研究D-PUFA和PUFA治疗不同疾病的活性。
在表1、表2和表3示出本发明的分子的结构。假定式I,本发明的化合物优选地呈现表1中示出的a、b和c的值的组合。
此外,在本发明中,用三个数字编号且后面是符号X1或X2来命名化合物。编号1表示所使用的所有D-PUFA,除了基于C18:3ω-6(γ-亚麻酸)的系列之外,基于C18:3ω-6(γ-亚麻酸)的系列以编号2出现。该编号的前两位数字表示分子的碳的数量。该编号的第三位数字表示双键的数量。字母X由A至W的字母中的任一个代替(表3),这些字母A至W表示式I的R1和R2的特定组合。
因此,本发明的特别优选的化合物根据以下缩写来识别:182X1、183X1、183X2、204X1、205X1、226X1且应根据上面说明来解释。
表1
表2示出本发明的D-PUFA分子中的一些和源自它们的PUFA的结构。如可以看到的,表阐明具有a、b和c的值的不同组合的一些本发明化合物,且其中基团R1和R2用字母A标记,这意味着,如上所述,R1是H且R2是OH(参见表3)。
表2
Prop:性质。S:合成的。N:天然的。OH:碳2(α碳)上羟基化。
表3示出可以与表1中列出的a、b和c的值组合的基团R1和R2的不同组合。
表3
实施例
实施例1。用D-PUFA和PUFA处理的细胞的膜中总PUFA的百分数
合成的D-PUFA分子是疏水性的,且因此暴露于这些D-PUFA的细胞在它们的表面上具有高水平的这些脂肪酸。
表4示出用100μM的这些脂肪酸处理48小时的3T3细胞的膜中PUFA的总百分数。为了进行这些实验,提取膜并通过在碱性培养基中水解获得总脂肪酸。这些脂肪酸的甲醇盐基(Methanolic basc)通过气相色谱法来量化。所示出的数据是PUFA的质量除以总脂肪酸的四次独立测量的平均值且被表示为百分数。还示出平均值的标准误差。在细胞培养物中,在这些脂肪酸的存在下温育的3T3细胞显示出较高水平的PUFA(包括D-PUFA)和较低水平的饱和脂肪酸。
对照对应于不存在所加入的天然的或合成的脂肪酸的培养物。以它们天然形式的细胞在它们的膜中呈现PUFA,但在培养基中存在本发明的D-PUFA分子增加细胞膜中PUFA的这些水平。因此这些结果表明,本发明的这些化合物的营养物干预或药物干预可以有效地调节细胞膜的组成。
表4
实施例2.在DEPE(二反油酰基磷脂酰乙醇胺(dielaidoil phosphatidylethanolamine))细胞膜中L(层状的)到HII(六角形的)转变
表5和表6示出DEPE模型膜中层状到六角形(HII)转变温度。转变温度通过差示扫描量热法来确定。在所有情况下DEPE:D-PUFA的比例是10∶1(mol∶mol)。层状到六角形转变是反映细胞膜的相关的信号传导性质的重要参数。当该转变的温度降低时较高的形成HII相的倾向表明膜表面压力是较低的,意味着磷脂的极性头部形成不比由层状结构形成的网络更稠密或紧密的网络(Escribá等人,2008)。当出现这种情况时,某些外周膜蛋白(例如G蛋白、蛋白激酶C或Ras蛋白)可以更容易地结合到膜,而其他的具有弱的相互作用(例如,Gα-蛋白),所以HII转变温度的变化在调节与健康和人类治疗相关的细胞功能方面是重要的(Escriba等人,1995,Vogler等人,2004;Escriba,2006)。
对照值对应于不存在脂肪酸的模型膜。通过使用本发明的D-PUFA获得的HII转变温度的降低表明膜不连续性的诱导增加,在外周蛋白的膜中产生了锚固部位,并导致更好地调节细胞信号传导,且因此控制某些疾病的效力更大。
因此,表5示出在存在或不存在200μM的系列A的本发明各种化合物下在DEPE膜(4mM)中的转变温度TH(层状至六角形HII)。
表5
表6示出在存在来自若干系列的D-PUFA下在DEPE膜中层状到六角形转变的温度。
表6
实施例3.Gi1蛋白(三聚体)与模型细胞膜的结合
调节膜脂组成导致膜结构的变化,如通过差示扫描量热法测量的,这导致模型细胞膜中的G蛋白的定位的变化,如表7中示出的。最终结果是调节细胞信号传导,导致多种病变过程的逆转,如稍后示出的。表7示出杂三聚体Gi1蛋白与磷脂酰胆碱:磷脂酰乙醇胺(6∶4,mol∶mol)的模型膜的结合,这是通过离心机分析,随后免疫印迹,通过化学发光显影和通过图像分析量化来测量。对于这些实验,使用2mM的磷脂和0.1μM的在表7中表明的不同的D-PUFA。对照是不存在脂肪酸下的模型膜样品。
这些结果表明当不饱和数增加时,膜的结构的和功能的性质中引起的改性增加。不饱和的存在和碳1和2处的变化都降低PUFA的代谢速率。该事实与这些脂质对膜结构的具体效果有关系,该事实表明对异常细胞的作用共有共同的起因。
实际上,在药理学效应和它们对脂质膜结构的效应之间存在良好的相关性。
表7
实施例4. 1,2-PUFA衍生物用于治疗癌症的用途
癌症是以转化细胞的不受控制的增殖为特征的疾病。如上所表明,除了某些遗传变化之外,癌症以存在可能影响细胞信号传导的膜脂的改变水平为特征。在该意义上说,天然的PUFA在该研究中使用的浓度下显示出对抗人类癌细胞(A549)的发展的一些功效,尽管其代谢用途可能阻止更大的功效(图1)。然而,D-PUFA比在相同的浓度下的在碳1和2处未修饰的分子(图1和表8)显示出显著的和明显更高的功效。这些结果表明天然的多不饱和脂肪酸的变化产生具有强的和显著大于天然的PUFA的抗癌潜力的抗癌潜力的分子,且因此在通过药物和营养物方法治疗和预防人类和动物中的肿瘤疾病方面具有很多效用。
对于图1中示出的实验,使用在补充有10%胎牛血清和抗生素的RPMI1640中在37℃和5%CO2下培养的人类非小细胞肺癌细胞(A549)。在存在或不存在250μM浓度的在表2中示出的D-PUFA和PUFA下,将细胞保持在培养物中48小时。在处理之后,进行细胞计数,并通过流式细胞仪评估在化合物的抗癌活性中涉及的机理的研究。图1示出细胞成活率的百分数(100%指示给未处理的肿瘤细胞)。这些值对应于三个独立实验的平均值。
在不同的系列中,使用表3中列出的化合物对抗表8A、表8B和表8C中示出的不同的肿瘤类型。这些图示出本发明的化合物对抗乳腺癌细胞、脑癌(胶质瘤)和肺癌的生长的抗癌功效。功效数据被表示为温育72小时之后的IC50值(产生50%的肿瘤细胞的死亡的μM浓度值)。其他实验条件与在前段中描述的实验条件相同。
结果清楚地表明,所有D-PUFA对抗癌发展是高度有效的。总体上,可以看到,化合物A和B的系列是最好的,所以测试了这些系列对抗白血病和肝癌的发展的效力(表9和表10)。并且,可以表明系列204和226的化合物,即,用在大小上较高的恢复(instauration)的偶数(pair number)编号的D-PUFA,是最有效的。这些结果表明本发明的药理学活性中存在结构功能关系,这还有利于与每种化合物的结构相关的共同的作用机理的命题且因此有利于在本部分中发明的单一性。
表8A示出本发明的化合物控制乳腺癌细胞MDA-MB-231的生长的功效,用微摩尔IC50值表示。
表8A
表8B示出本发明的化合物对抗脑癌细胞生长(胶质瘤)U118的功效,用微摩尔IC50值表示。
表8B
表8C示出本发明的化合物对抗肺癌细胞A549的生长的功效,用微摩尔IC50值表示。
表8C
表9示出本发明的化合物对抗人类白血病(Jurkat细胞)的发展的功效,在72小时的IC50微摩尔的值。
表9
表10示出本发明的化合物对抗肝癌(HepG2细胞)的发展的功效。在72小时的IC50微摩尔的值。
表10
所有这些结果表明,被包括在人类和动物的营养物和药物组合物中的D-PUFA可用于预防和治疗癌症。还发现,D-PUFA的作用的潜力与增加的双键数量相关联,且存在碳1和2处的变化对于处在治疗水平的有关的脂质的抗癌潜力是必需的。因为这些化合物具有对抗宽范围的肿瘤细胞的抗癌效应,所以可以肯定,它们是具有广泛的抗癌谱的分子且可以具有对抗任何癌症的发展的一般应用。
实施例5. 1,2-PUFA衍生物用于治疗心血管疾病的用途
为了研究D-PUFA用于治疗心血管疾病的有效性,使用若干实验方法。首先,研究了本发明的化合物对培养物中的主动脉细胞(细胞系A-10)的功效。将这些细胞保持在具有完全培养基(C,补充有10%胎牛血清和PDGF)和不完全培养基(CSS,补充有1%胎牛血清,没有PDGF)的培养物中。以在如前段中所描述的相似的方式进行培养72小时的时段。在该温育时段之后,通过流式细胞仪进行细胞计数。
在不完全培养基(CSS,没有额外的对照PDGF)中,细胞具有与在健康的身体中产生的增殖行为相似的增殖行为。完全培养基中出现的增殖行为将是与病变机体中出现的状态相似的状态。在具有被包括在培养基中的胎儿血清中存在的增殖剂的完全培养基中,D-PUFA的存在产生正常主动脉(A-10)细胞的增殖的显著降低。在存在增殖剂(细胞因子、生长因子等)下,A10细胞计数与在存在本发明的D-PUFA的不完全培养基(CSS)中获得的那些计数相似(图2)。相比之下,PUFA显示很少的抗增殖功效或显示出无抗增殖功效,证明了在这些脂肪酸上进行的变化实质上增加它们用于治疗心血管疾病的药理学潜力,心血管疾病例如高血压、动脉粥样硬化、缺血、心肌病、动脉瘤、猝发、血管生成、心肌增生、梗塞形成、咽峡炎、中风(脑血管意外)等。
该细胞系的效应由于以下两个原因而不能被认为是有毒的:(1)在完全培养基中,D-PUFA从未将细胞增殖诱导降低到低于在完全培养基中温育的细胞的水平,和(2)用D-PUFA处理的主动脉(A10)细胞显示出无分子或细胞坏死、细胞调亡或任何其他类型的细胞死亡的症状。因为血管细胞的增殖与许多心血管疾病的发展有关,所以D-PUFA可用于通过营养物和药物方法预防和治疗人类和动物中的这些疾病。
在不同的系列中,分离大鼠心肌细胞并将其在体外培养24小时,之后,测量若干参数。首先,测量培养物中细胞的数量、长度和宽度。观察到系列A和B的所有化合物(182-226)能够增加在培养物中存活的细胞的数量(在12%和33%之间)以及它们的长度和宽度(在18%和42%之间)。此外,这些化合物引起由缺氧引起的乳酸脱氢酶(LDH)的释放的减少(对于系列A和B的所有化合物,减少在9%和68%之间)。这些结果表明,本发明的D-PUFA分子对心血管细胞具有保护效应并增加它们的弹性,这可用于预防和治疗不同种类的心脏病和血管疾病,例如高血压、动脉粥样硬化、缺血、心肌病、动脉瘤、猝发、血管生成、心肌增生、梗塞形成、咽峡炎、中风(脑血管意外)、出故障的血液循环(faulty blood circulation)等。
在不同的实验系列中,研究了本发明的D-PUFA分子对SHR大鼠的血压的影响。在这些动物中,测量了血压和载脂蛋白AI(apoA-I)的水平两者。对于这些实验,自发性高血压大鼠(SHR)用媒介物(水对照)或本发明的化合物(200mg/kg天,口服)处理30天。在该时段结束,测量动物的血压和apoA-I的血清水平。结果显示本发明的化合物降低血压和诱导apoA-I的表达的能力,表明这些分子可用于治疗高血压和动脉粥样硬化(表11)。对于这些实验,使用无创伤方法确定血压(袖口尾(cuff-tail)方法)和文献(Terés等人,2008)中描述的apoA-I的基因表达(RT-PCR)。本发明的分子用于治疗心血管疾病的有效性通过其降低血清胆固醇和甘油三酯的水平的能力来加强(参见下文)。
表11示出SHR大鼠中的血压(mm Hg)和apoA-I的水平(%)。治疗之前的SHR的平均值分别为214mmHg和100%。
表11
实施例6. 1,2-PUFA衍生物用于治疗肥胖症的用途
图3A示出PUFA(天然的PUFA和合成的PUFA两者)如何能够抑制脂肪细胞的增生和肥大。对于该研究,使用3T3-L1脂肪细胞。该效应早已知道且先前已经对未改性的天然的PUFA进行描述(Hill等人,1993)。然而,D-PUFA具有增加的抑制脂肪细胞的增殖的潜力(图3A)。该效应在任何情况下都是无毒的,因为脂肪细胞的生长的抑制不会使细胞增殖减少到低于在不完全培养基(具有1%血清)中培养的细胞的水平。所使用的细胞培养基和条件与上述那些相似。
这些结果证明,D-PUFA具有高的抑制脂肪细胞的生长的潜力,且因此,用于通过营养物或药物方法预防和治疗动物和人类的肥胖症和与身体脂肪细胞(例如,蜂窝组织)的累积或食欲变化有关的其他过程。所观察的效应再次表明与所使用的分子的双键的数量和脂质分子中碳1和2处的修饰的存在明显相关。
此外,使用与本发明有关的若干化合物来研究它们对大鼠的体重的效应(图3B)。在这点上,用化合物182-226(系列A、B、N和P)治疗的自发性高血压大鼠(SHR)在用200mg/kg治疗1个月之后显示体重的减少(减少3.2%至6.9%),这部分是由食物摄取的减少和部分由脂肪细胞的增殖的抑制引起(在用相同量的食物喂养的未治疗的动物中,重量下降不如被治疗的动物中那么显著)。这些结果证明,这些化合物可用于体重的控制(肥胖症和超重)、食欲控制和身体脂肪(蜂窝组织)调节。
实施例7. 1,2-PUFA衍生物用于治疗神经变性疾病的用途
在这些研究中,使用不同的神经变性模型。首先,研究P19细胞,其中用反式视黄酸来诱发神经元分化。为了这样做,在37℃下且在5%CO2的存在下,在用10%胎牛血清和2μM反式视黄酸补充的最小必须培养基(α-MEM)中温育P19细胞。在以不同浓度的若干D-PUFA或PUFA的存在或不存在下温育细胞24小时。用1μM NMDA诱发神经毒性。随后,在台盼蓝的存在下通过光学显微法对细胞的数目计数。这些实验显示,PUFA对神经元变性具有保护效应,尽管由D-PUFA介导的效应要高得多(图4A和表12)。在该图和该表中明显的是,本发明的D-PUFA分子避免了神经元死亡,这是因为它们抑制了NMDA诱发的神经元死亡,使得这些物质可以用于预防和治疗神经变性疾病,例如阿尔茨海默病、硬化、帕金森病、脑白质营养不良等。还显示,经处理的培养物中的细胞的数量高于没有添加神经变性剂的培养物中的细胞的数量。具体地,细胞死亡的负值表明,P19细胞的数量高于对照情况。因此,本发明的D-PUFA化合物可以用于促进神经再生过程,例如由创伤过程(事故)或毒性剂产生的神经再生过程。
表12示出对抗P19细胞中的神经元死亡的保护效应:在用NMDA处理(100%死亡)之后用本发明的D-PUFA抑制神经元死亡(P19细胞)。不具有NMDA的对照细胞显示出0%的细胞死亡水平。低于100%的所有百分数表明防止了神经元死亡。负值表明除了保护神经元死亡之外还存在神经元增殖的水平。此外,本发明的化合物降低了α-突触核蛋白的水平(表13),α-突触核蛋白是与诸如帕金森病、阿尔茨海默病、路易体痴呆、多系统萎缩、朊病毒疾病等的神经变性过程相关的蛋白。因此,本发明的分子可以应用于预防和治疗神经变性过程、神经再生过程、神经过程和神经精神过程。
表12
表13示出神经元培养物(细胞P19)中α-突触核蛋白的表达。C(对照)表示未经治疗的细胞中的α-突触核蛋白的%(100%)。
表13
为了测试本发明的化合物诱发神经再生或抑制神经变性的功效,使用阿尔茨海默病的动物模型。在该模型中,小鼠发展神经变性,因为它们表达出导致大脑损伤的一系列突变蛋白(Alzh小鼠)。B6小鼠被用作健康动物对照。两组动物都从它们3个月大开始用媒介物(水)或用各种D-PUFA(20mg/kg,每日口服)治疗3个月的时间。为了判断在治疗之后是否发生认知改善,在径向迷宫中监视动物行为。对动物保持严格的限制膳食,以便具有食欲。在对称的8臂径向迷宫中,放置视觉标记以便利于动物的定向,且在四个臂中放置食物(15mg的小块)。使用附接于计算机系统的摄像机测量每一动物完成训练花费的时间以及错误次数。在该意义上说,根据执行训练所花费的时间和所犯错误的次数两者,阿尔茨海默动物具有比健康动物高约50%的值(图4B)。相反,用226B1治疗的患阿尔茨海默的小鼠(Alzh+LP226)呈现出与对照动物的行为参数类似的行为参数,且显著地(P<0.05)低于用媒介物治疗的动物(Alzh)。在这一点上,还测试了化合物183B1、205A1、205B1、226A1、226V1的效力,显示出患有阿尔茨海默病的动物中的改善(分别地为98、92、93、86和89秒的时间)。另一方面,还有趣的是,这些相同的化合物(183B1、205A1、205B1、226A1、226B1和226V1)还在对照动物(B6健康的小鼠)中产生完成实验所花费的时间的减少,分别为8s、11s、12s、18s、16s和14s。因此,可以得出结论,这些化合物具有防止神经变性和神经再生的显著活性。可以用本发明的D-PUFA分子预防和治疗的神经变性包括阿尔茨海默病、帕金森疾病、Zellweger综合征、多发性硬化、肌萎缩侧索硬化、海马硬化和其他类型的癫痫、灶性硬化、肾上腺脑白质营养不良和其他类型的脑白质营养不良、血管性痴呆、老年性痴呆、路易体痴呆、多系统萎缩、朊病毒疾病等。此外,由患有阿尔茨海默的小鼠和健康的B6小鼠两者中的效应证明的神经再生活性,治疗可以被应用于其中作为事故、手术、不同性质的创伤的结果或者由于某些毒素已经发生神经元损失的过程。本发明的D-PUFA分子还可以用于预防或治疗不同的神经问题和/或神经精神问题,例如包括偏头痛的头痛、中枢神经系统损伤、睡眠病症、头晕、疼痛、中风(脑血管意外)、抑郁、焦虑、成瘾、记忆、学习或认知问题,且用于增强人类的记忆和认知能力。
实施例8. 1,2-PUFA衍生物用于治疗炎症性疾病的用途
环加氧酶(COX)是可以结合到膜的酶,从中取出某些脂质,并催化其转换成可以具有炎症活性的分子。该酶与膜脂的结合部分由于膜脂结构。COX 1和COX 2同工型的增加的活性已经与多种炎症性疾病的发病机理相关联,该发病机理是通过抑制花生四烯酸代谢以产生促炎症脂质介体。本发明的D-PUFA化合物产生改变花生四烯酸的代谢的一系列细胞信号,结果,它们抑制了培养物中单核细胞中的COX的活性和表达(表14和图5)。进一步,本发明的D-PUFA抑制了体内促炎症细胞因子(TNF-α)的产生(表15和图5)。出于该目的,在通过腹膜内注射20μg的细菌脂多糖(LPS)来在C57BL6/J小鼠中诱发炎症反应之后,用各种衍生物(200mg/kg,口服)治疗这些小鼠。这些结果清楚地表明本发明的D-PUFA预防或逆转炎症过程和病理学的效力。
表14示出在培养物中的单核细胞中的COX-2表达。在单核细胞中COX-2表达的抑制。各种脂肪酸衍生物对COX-2蛋白水平(表达)的抑制的百分数(相比于在LPS存在下的阳性对照,100%)。
表14
表15示出小鼠中TNF-α(%)的产生:在C57BL6/J小鼠中腹膜内注射LPS(20μg)之后血清中TNF-α的百分数(100%)。
表15
这些结果示出,本发明的分子可以用采预防或治疗炎症性疾病,包括炎症、心血管炎症、由肿瘤引起的炎症、风湿症起源的炎症、由传染引起的炎症、呼吸炎症、急性炎症和慢性炎症、炎症性质的痛觉过敏、水肿、由创伤或烧伤引起的炎症等。
实施例9. 1,2-PUFA衍生物用于治疗代谢疾病的用途
脂质是维持代谢功能的关键分子。PUFA治疗产生了3T3-L1细胞中胆固醇水平和甘油三酯水平的一些适度的减少。然而,D-PUFA治疗引起这些细胞中的胆固醇水平和甘油三酯水平的明显的和显著的减小。对于这些实验,在37℃和5%CO2,在10%胎牛血清的存在下,且在存在或不存在150μM的不同的PUFA或D-PUFA下,在RPMI 1640培养基中温育上述细胞。温育细胞24h,且然后使其经受脂质提取,且按照先前所描述的过程(Folch等人,1951)测量胆固醇水平和甘油三酯水平。
在不同的实验系列中,用本发明的各种化合物治疗SHR大鼠(200mg/kg每日,28天,口服),且通过比色法测量血清中胆固醇、甘油三酯和葡萄糖的水平。观察到这些化合物诱发了这些代谢物的水平的显著的(且在许多情况中是明显的)减少(表16)。
图6和表16中示出的结果清楚地表明,D-PUFA可以用作用于通过药物和营养物方法治疗或预防人类和动物中的诸如高胆固醇血症、高甘油三酯血症、糖尿病和胰岛素抵抗力等的代谢疾病的药品。高水平的胆固醇和甘油三酯、高葡萄糖与心血管变化和/或体重变化的组合引起开始在西方社会增加的“代谢综合征”。本发明的化合物具有用于治疗代谢综合征的巨大潜力。
表16示出SHR大鼠中胆固醇、甘油三酯和葡萄糖的水平。该表示出用上述分子治疗(每目200mg/kg,口服,28天)的SHR的血清中的胆固醇的值(顶部数)、甘油三酯的值(中部数)和葡萄糖的值(底部数)。各值以百分数来表示,且在未经治疗的(对照)大鼠中的值总被认为是100%。
表16
实施例10.PUFA的1,2-衍生物的治疗效果的结构基础
大量研究已经表明,脂质的摄取或治疗导致细胞膜的脂质组成的变化。此外,这样的组成对膜脂结构具有直接效应,膜脂结构又调整细胞信号传导并与许多疾病的发生有关。图7示出在由不同的D-PUFA产生的膜的结构的变化(如通过HII转变温度测量的)和该研究中所观察的细胞效应之间的相关性。出于该目的,我们确定每种D-PUFA的平均效应(对于相对于双键数量而研究的所有疾病,每种脂质的平均值)且将该结果对转变温度作图。HII转变温度的减少表明更大地诱导膜中的不连续性,这产生了引起细胞信号传导的更好的调节且因此引起某些疾病的更有效的控制的外周膜蛋白的停靠位点。在某种程度上,复杂机体可以代谢药品且一些附加机理可以在一些类型(子类型)疾病中运行的事实表明,具有较少的双键的一些分子可以具有更大的药理学活性。然而,通常,似乎治疗效果取决于分子的双键的数量,分子的双键的数量本身与调节膜的结构的能力有关。在该意义上说,出现在本发明的D-PUFA化合物而非天然PUFA中的碳l和/或2中的基团的存在,是增强这些分子的治疗效果的关键。
这些结果表明,本发明中包含的脂质的效应具有共同基础。这些相关性(在两种情况中,对于D-PUFA,具有0.77和0.9的r2值,且P<0.05)清楚地表明,所使用的脂质的结构是其效应的基础,且它通过膜结构的调节而发生,由每一脂质的结构功能关系引起。
因此,本发明在第一方面涉及式(T)的化合物或药学上可接受的衍生物,其中a、b和c可以独立地具有从0至7的值,且R1和R2可以是离子、原子或独立地具有不超过200Da的分子量的原子团,用于治疗基于细胞膜脂的结构变化和/或功能特征的疾病,这些疾病选自:癌症、血管疾病、炎症、代谢疾病、肥胖症、神经变性疾病和神经病症。
本发明的第二方面涉及至少一种式(I)的化合物或其药学上可接受的衍生物用于制备用于治疗基于细胞膜中的脂质的结构变化和/或功能变化的疾病的药物组合物和/或营养物组合物的用途,其中a、b和c可以独立地具有从0至7的值,且R1和R2可以是离子、原子或独立地具有不超过200Da的分子量的原子团,所述疾病选自:癌症、血管疾病、炎症、代谢疾病、肥胖症、神经变性疾病和神经病症。
本发明的最后方面涉及用于常见病因与位于细胞膜中的脂质的结构变化和/或功能变化有关的人类和动物的疾病的治疗处理的方法,这些疾病选自:癌症、血管疾病、炎症、代谢疾病、肥胖症、神经变性和神经疾病,该方法包括向患者施用治疗有效量的至少一种式(I)的化合物和/或其药学上可接受的盐或衍生物,其中a、b和c可以具有在0和7之间的独立的值,且R1和R2可以是离子、原子或独立地具有不超过200Da的分子量的原子团。
参考文献
·Alemany等人,2004.Hypertension,43 249
·Alemany等人,2007.Biochim Biophys Acra,1768,964
·Buda等人,1994.Proc Natl Acad Sci U.S.A.,91,8234
·Coles等人2001.J Biol Chem,277,6344
·Escribá等人1995.Proc Natl Acad Sci U.S.A.,92,7595
·Mail等人1997.Proc.Natl.Acad.Sci USA.,94,11 375
·Escriba等人2003.Hypertension,41,176
·Escriba 2006.Trends Mol Med,12,34
·Escriba等人2008.J Cell Mol Med,12,829
·Florent等人2006.J Neurochem.,96,385
·Folch等人1951.J Biol Chem,191.83
·Jackson和Schwartz1992.Hypertension,20,713
·Jung等人2008.Am J Clin Nutr 87,2003S
·Lane和Farlow 2005.J Lipid Res,46,949
·Martinez等人2005.Mol Pharmacol.,67,531
·Rapoport2008.Postraglandins Leukot.Essent.Fatty Acids 79,153-156
·Sagin和Sozmen,2008.J Lipid Res,46,949
·Schwartz等人1986.Circ Res 58,427
·Stender和Dyerberg 2004.Ann Nutr Metab.,48,61
·Terés等人2008.Proc.Natl.Acad.Sci USA,105,13 811
·Trombetta等人2007.ChemBiol Interact.,165,239
·Vogler等人2004.J.Biol Chem,279,36 540
·Vogler等人2008.Biochim Biophys Act,1778,1640
·Yang等人2005.Mol Pharmacol.,68,210.
- 还没有人留言评论。精彩留言会获得点赞!