用于生物活性剂的口腔递送系统的制作方法
1.发明领域
本发明涉及一种口腔递送系统、以口腔递送系统形式使用的海藻酸乙二铵以及一种如独立权利要求的介绍部分中所定义的功能性饲料。此外,本发明涉及一种制备海藻酸乙二铵粒子的方法以及制备包含至少一种生物活性剂的呈球粒形式的功能性饲料的方法。
2.发明背景
对用于治疗和预防目的的具药学活性或生物活性的药物、化合物以及组合物的口腔递送系统存在高度需要。
这些生物活性剂的最佳施用对其随后在有机体中的吸收和功效来说为重要的。因此,如何施用此类生物活性剂为极其重要的。口腔药物递送为吞咽药物化合物,以使其释放至人类和动物的胃肠道中的方法。
近年来,在水产养殖业中使用功能成分已显著增多,并且广泛范围的功能性饲料现在广泛可用于鱼类养殖。与此结合,正在进行关于研发用于向鱼类递送敏感生物活性剂的口腔递送系统的研究。最方便且压力最小的向养殖鱼类施用药物和其他药学活性剂的方法是经由饲料。
在经口施用期间,一个挑战为活性剂在其可在肠道中被吸收之前可能在胃中钝化或分解。许多生物活性剂为热敏感性的并且倾向于在胃肠道中发生酸降解和蛋白水解降解。对于蛋白质来说尤其如此。另一个问题是递送至正确的靶器官供吸收以及高效吸收。
因此,对鱼类的消化生理学的了解对经由口服途径递送诸如治疗性蛋白质等生物活性剂来说是非常重要的。大西洋鲑(安大略鲑(salmosalar))对于水产养殖业来说为一种在经济上重要的物种,为具有相当短的消化系统的有胃鱼。作为肉食性鱼的鲑鱼的消化道可再分成前肠(口腔、食管以及胃)、中肠(幽门盲囊或近端肠和中间肠)以及后肠或在直肠中终止的远端肠。消化为使营养物溶解和降解成更容易吸收至血流中的更小组分的分解代谢过程。
胃中分泌的主要消化组分为胃蛋白酶原和盐酸(hcl),并且它们两者的分泌均由饲料摄入刺激。已证实当鲑鱼虹鳟(麦奇钩吻鳟(oncorhynchusmykiss))从饥饿变到餐后状态时平均胃部ph值从2.7增加至4.9(bucking,c.和wood,c.m.2009.theeffectofpostprandialchangesinphalongthegastrointestinaltractonthedistributionofionsbetweenthesolidandfluidphasesofthechymeinrainbowtrout.aquaculturenutrition,第15卷,第3期,第282-296页)。在饲喂后增加的ph值维持八个小时。
大多数蛋白质因胃中的hcl和胃蛋白酶的作用而降解。在胃中加工之后,溶解的营养物和部分消化的饲料的混合物传送至幽门盲囊中。幽门盲囊构成一个区室,在所述区室中其他蛋白水解酶,如胰蛋白酶、糜蛋白酶以及氨基肽酶完成肽水解。熟知在幽门区中大部分蛋白质以游离氨基酸和短肽的形式被吸收至血流中。当酸性食糜到达近端肠时,它被胆汁和胰液中的碳酸氢盐(hco3-)快速中和。bucking和wood(2009)在空腹鱼的整个肠道部分中观测到8.2的平均ph值。在饲喂之后,在近端和中间肠中ph值降至7.5,而在远端部分中它几乎保持不变。然而,在饲喂之后的时间内在肠中ph值再次增加,在八小时之后达到其最高值。在此时,在整个肠道中ph值可超过8.5,并且朝向远端部分有增加趋势。
尽管在前肠和中肠中蛋白水解环境恶劣,但一些蛋白质一直来到远端肠,在其中它们可被吸收。远端肠被视为是包括口服疫苗中所用的抗原的大肽的最重要的吸收位置。因此,重要的是,要向鱼类施用的诸如蛋白质等大分子药剂实际上到达肠的远端部分以获得其高效吸收。为防止大分子生物活性药物在胃中分解,典型地例如通过封装于适合的聚合物中来使其与口腔递送系统相关联。
递送药剂的另一挑战为饲料材料穿过肉食性鱼类的整个消化系统的时间可能非常短。运送时间取决于摄食量、饲料组成以及结构,并且它可为饲料摄入之后5至35小时的任何时间。
因此,适合递送药剂的正确选择为极其重要的。口腔递送系统的适合性的重要特征为递送药剂适当溶解以在肠道系统中在适当的时间和位置释放生物活性组合物。
交联的海藻酸盐为聚合物,所述聚合物典型地用于口腔递送系统中。海藻酸盐的交联性质形成包括挤出与乳液工艺的各种封装技术的基础。可使用多种已知交键剂来交联海藻酸盐。最常用的交联剂为ca2+。
可将多种产品(营养物、药物以及疫苗)合并至海藻酸盐基质中以避免由低ph值和蛋白水解酶引起的破坏。海藻酸盐为从存在于全球沿岸水域中的诸如泡叶藻(ascophyllumnodosum)、公牛藻属(durvillaeasp.)、昆布属(eckloniasp.)、海带属(laminariasp.)、巨藻属(lessoniasp.)、马尾藻属(sargassumsp.)以及巨藻(macrocystispyrifera)等褐藻分离的多糖。海洋海藻酸盐由两种形式的糖醛酸组成:甘露糖醛酸(m)和古罗糖醛酸(guluronic)(g)。两小段邻近聚合物链可通过与糖醛酸中的羧基的相互作用与多价阳离子(例如ca2+或ba2+)交联,这引起凝胶网络的形成。所得交联海藻酸盐在宿主组织内具有优良生物相容性并且能够以可控方式生物降解。典型地在交联过程中特别是通过封装至小海藻酸盐珠粒中将用于口腔递送的生物活性剂封装或包埋于海藻酸盐中。交联的海藻酸盐珠粒典型地在低ph值下为稳定的,而在较高ph值下溶解。因此,在珠粒已穿过胃部的蛋白水解和酸性环境之后,在肠(碱性条件)中发生更快的从海藻酸盐珠粒释放。这些属性使得海藻酸盐为在人类和哺乳动物中以口腔递送系统形式使用的有效化合物。
迄今为止进行的大部分研究集中于在与人类消化系统相关的条件下(诸如ph1.1-2.0和ph6.8-7.4,在37℃的温度下)溶解海藻酸盐基质。正如前面提到的那样,可见ph>2.7在鲑鱼的胃中为最常见的。同时,在肠道部分中ph>7.5为普遍的,不过ph>8.5也不是反常条件。此外,与诸如哺乳动物等恒温有机体相比,在变温动物中消化过程中的肠道传送速率和温度条件非常不同。作为实例,在养殖大西洋鲑的挪威海水中,冬季温度可低于4℃,而夏季温度在最极端情况下可超过18℃。
通常已知的海藻酸盐基质不适合用于将生物活性剂递送至具有短肠的动物的较低位胃肠道或不高效。通常已知的口腔递送系统的主要缺点包括在长度有限的肠道系统中海藻酸盐不完全或不充分溶解。在典型地具有短肠的偏向于动物材料的有胃鱼、肉食性鱼以及杂食性鱼中尤其是这样,诸如鲑鱼、鲈鱼、鳊鱼、鳕鱼、大比目鱼、大菱鲆、鲆鲽鱼、巨鲶属以及石斑鱼。归因于其短肠,饲料材料的滞留时间以及用于释放和吸收活性成分的时间窗相当有限。
因此,本发明的客观技术问题为提供一种媒介物,用于将生物活性剂,特别是大分子药物和治疗性蛋白质口腔递送至动物的肠。
具体地说,本发明具有提供特别是用于生活在冷水中的物种的快速溶解和非温度依赖性口腔递送系统的目标。
更具体地说,本发明具有提供用于鱼类,特别是用于具有胃和短肠道的鱼类的口腔递送系统的目标。
此外,本发明具有提供用于有胃鱼、肉食性鱼以及杂食性鱼,并且特别是用于诸如鲑鱼等冷水鱼的口腔递送系统的目标。
本发明的另一目标在于提供一种口腔递送系统,所述口腔递送系统防止生物活性剂在胃中发生酸降解和蛋白水解降解并且然后在肠道区中在碱性ph值下将其释放。
3.发明概要
根据第一方面,本发明涉及一种包含海藻酸乙二铵和至少一种生物活性剂的口腔递送系统,所述口腔递送系统用于在治疗和/或预防性处理中使用。这种口腔递送系统由于其有利的溶解性质而特别适合用于动物,尤其是具有短肠道的动物,诸如偏好于动物材料的肉食性和杂食性鱼类。特别地,所述口腔递送系统非常适合用于将生物活性物质口腔递送至可能在低温下进行消化的变温动物。
优选地,将所述生物活性剂封装或包埋于海藻酸乙二铵中。
进一步优选的是,所要递送的生物活性剂选自由以下项组成的组:蛋白质、肽、疫苗、抗体、抗原、激素、酶、免疫刺激剂、药物、益生菌、益生元、多核苷酸、核苷酸以及氨基酸。
在一个优选实施方案中,口腔递送系统是用于具有包含肠和胃的胃肠道的变温动物,优选用于冷水物种,更优选用于鱼类。
在另一优选实施方案中,本发明涉及一种用于选自由杂食性和肉食性物种组成的组,优选选自冷水鱼物种的鱼类物种的口腔递送系统。
特别地,口腔递送系统适合用于鱼类,优选用于有胃鱼,更优选用于具有短肠道的鱼,最优选用于选自由以下项组成的组的物种:鲑鱼、鲈鱼、鳊鱼、鳕鱼、大比目鱼、大菱鲆、鲆鲽鱼、石斑鱼、金枪鱼、罗非鱼以及巨鲶属。
在第二方面中,本发明涉及在治疗和/或预防性处理中以口腔递送系统形式使用的海藻酸乙二铵。优选用途为用于鱼类,更优选用于杂食性或肉食性物种。甚至更优选为用于冷水鱼。
优选地,海藻酸盐基质呈粒子形式,优选呈珠粒形式,并且最优选呈球形珠粒形式。优选海藻酸乙二铵珠粒的平均粒度在1μm至10mm范围内,更优选在300μm至2000μm范围内。在本发明的另一优选实施方案中,平均粒度不超过300μm,优选不超过200μm,更优选不超过100μm并且最优选不超过25μm。当在真空涂布机中与饲料球粒缔合时这是优点。虽然对于挤出前添加来说优选平均尺寸小于300μm,但300μm与2000μm之间的尺寸同样为可行的。此外,对于独立经口施用来说海藻酸盐珠粒的优选平均尺寸大于100μm并且将取决于有机体与目标剂量两者的大小。
在第三方面中,本发明涉及一种包含封装或包埋于海藻酸乙二铵中的至少一种生物活性剂的功能性饲料。当提到动物饲料,尤其鱼类饲料时,将海藻酸盐封装的生物活性剂合并至饲料球粒中为必需的操作。有效合并至饲料球粒中使生物活性成分归因于处理饲料而造成的损失减少并且确保规定剂量的不断供应。
优选地,功能性饲料中的包含生物活性剂的海藻酸盐呈珠粒形式。
优选地,海藻酸乙二铵被成形成粒子形式,优选为珠粒形式并且最优选呈球形珠粒形式。在根据本发明的一个优选实施方案中,海藻酸盐珠粒的平均粒度不超过2000μm,优选不超过1000μm,更优选不超过300μm,并且最优选不超过25μm。
在另一个方面中,本发明涉及一种包含封装于海藻酸乙二铵中的至少一种生物活性剂的功能性饲料,所述功能性饲料用于在治疗和/或预防性处理中使用。功能性饲料的优选用途为用于鱼类。
在另一个方面中,本发明涉及一种制备包含至少一种生物活性剂的海藻酸乙二铵粒子的方法,所述方法是通过以下过程来进行:使海藻酸盐与乙二铵交联,借此通过以下手段形成所需海藻酸盐形状:(i)先是挤出法,然后在乙二铵溶液中固化;或(ii)乳液法。在所述过程中,借助于先是挤出法,然后在乙二铵溶液中固化或通过乳液法与所述乙二铵组合来形成所需海藻酸盐形状和尺寸。
挤出法(i)可选自由以下项组成的组:空气动力学辅助喷射、电磁层流射流破碎、喷墨印刷、3d印刷、电喷雾以及同轴空气流诱导滴落,并且其中乳液法(ii)可为选自由凝聚、内部凝胶化以及外部凝胶化组成的组的方法。
所述方法可包括以下步骤:
(i)通过将海藻酸盐溶解于包含所要递送的至少一种生物活性剂的溶液中来制备封装制剂,
(ii)在空气压力的辅助下通过经由相关尺寸的喷嘴将(i)的溶液挤出来形成海藻酸盐微滴的射流,所述喷嘴位于装配有尺寸与所述喷嘴相符的出口孔的加压腔室中,
(iii)使(ii)的微滴的射流集中于包含乙二胺二盐酸盐的交联溶液上,随后
(iv)过滤出所获得的海藻酸盐珠粒。
此外,本发明涉及一种制备包含至少一种生物活性剂的功能性饲料的方法,其中所述方法包括以下步骤:
(i)制备包含其中已包埋或封装生物活性剂的海藻酸乙二铵珠粒的油悬浮液,
(ii)在真空涂布机中将(i)的悬浮液与饲料球粒混合,
(iii)从涂布机中抽出空气,从而形成减压环境,以及
(iv)通过使空气返回到涂布机中来逐渐恢复大气压,此举将(i)的悬浮液推动至饲料球粒的空孔隙中。
除饲料中所述封装的生物活性剂的挤出后纳入之外,所述封装的生物活性剂的挤出前纳入也是可能的。
在另一方面中,本发明涉及一种制备含有至少一种生物活性剂的功能性饲料的方法,其中所述方法包括以下步骤:
(i)通过将含有至少一种生物活性剂的海藻酸乙二铵珠粒与包含其他非油饲料成分的饲料粉混合来制备干混合物,
(ii)通过使用挤出机或通过使用压粒机将(i)的干混合物挤出来制备挤出物,
(iii)通过在干燥器中干燥(ii)的挤出物来制备基础球粒,以及
(iv)通过以真空注入涂布工艺对(iii)的基础球粒进行油涂布来制备最终饲料。
附属权利要求中也定义了优选实施方案。
4.发明描述
现将参考以下图式借助于实例描述本发明的实施方案,在所述图式中:
图1示出了a)负载有蓝色右旋糖酐的ca-海藻酸盐珠粒(bd-ca-alg;d平均=3.0mm),b)负载有蓝色右旋糖酐的eda-海藻酸盐珠粒(bd-eda-alg;d平均=3.7mm)的立体显微镜(smz)图像(leicamz10f);
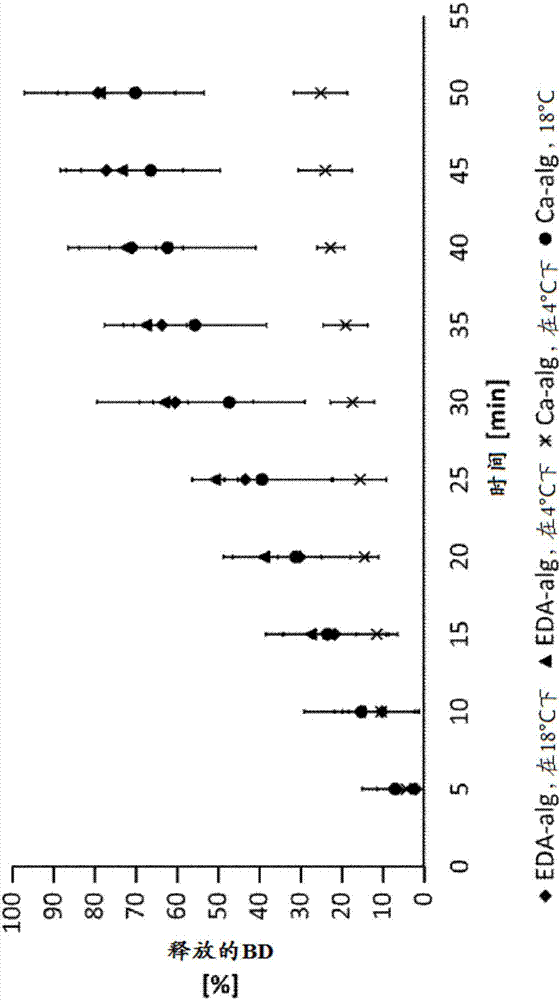
图2以随时间推移从海藻酸盐珠粒释放的累积蓝色右旋糖酐(bd)的平均百分比的曲线的形式示出了溶解型态。在苯二甲酸氢钾/hcl缓冲液(ph3.0)中进行15min溶解测试,随后在磷酸盐缓冲液(ph8.0)中再进行50min。在酸性介质中释放低于loq(3.9×10-3mgml-1),因此该图仅展示在碱性溶解介质中的释放。误差线代表在各个点基于五个样品的标准偏差(sd)。bd-eda-alg表示负载有bd的海藻酸乙二铵珠粒;bd-ca-alg意指负载有bd的海藻酸钙珠粒;
图3示出了三组大西洋鲑(ca-海藻酸盐、eda-海藻酸盐以及对照)的四个胃肠道区室(胃、幽门盲囊、中间以及远端肠)中的hrp浓度。误差线代表95%置信区间。ca-海藻酸盐组接受海藻酸钙封装的hrp(hrp-ca-alg)。eda-海藻酸盐组接受海藻酸乙二铵封装的hrp(hrp-eda-alg)。对照组未接受任何hrp。
本发明提供一种用于将生物活性剂递送至肠的新颖口腔递送系统。这种口腔递送系统特别适合用于诸如肉食性鱼等具有短肠道的有机体。特别地,所述口腔递送系统适合用于在可能在低温下进行消化的变温动物中口腔递送生物活性物质。
在本发明中,使海藻酸钠与乙二胺二盐酸盐交联以形成海藻酸乙二铵。这种方法的优点为不涉及其他化学品。此外,所描述的使海藻酸盐与乙二铵盐酸盐交联的方法与其他已知方法相比为更快、更容易、更不昂贵的并且不涉及危险化学品。
根据本发明,海藻酸乙二铵是以生物活性剂的口腔递送系统的形式使用,特别是用于鱼类。在使海藻酸盐与乙二铵双阳离子交联的过程期间将药剂封装或包埋于海藻酸乙二铵的基质中。优选地,在由两个主要步骤组成的此交联过程期间制备小海藻酸盐微珠粒:1)通过诸如如存在于空气动力学辅助喷射中的那些装置的装配有喷嘴的喷雾或喷射头等装置或通过熟练人员已知用于产生液体微滴的其他方法(例如空气动力学辅助喷射、电磁层流射流破碎、喷墨印刷、3d印刷、电喷雾、同轴空气流诱导滴落等)来产生海藻酸盐微滴;2)将海藻酸盐微滴收集于含有乙二铵的交联溶液中。或者,可将乳液法(例如凝聚、内部以及外部凝胶化等)与乙二铵组合使用。
海藻酸乙二铵基质的粒子可典型地具有任何几何粒子形状的形式,例如纤维、球形、环形、椭圆形并且还包括纤维和薄片。优选地,粒子为规则形状的,不过所述海藻酸盐基质还可呈不规则形状粒子形式。在一个优选实施方案中,所述基质呈珠粒形式,更优选呈球形珠粒形式。
可在饲料中或饲料外(独立地,与饲料无关)将包含生物活性剂的所得海藻酸盐珠粒肠内施用至目标有机体。海藻酸盐珠粒的优选平均粒度在1μm至10mm范围内。对于在真空涂布机中与饲料球粒缔合,海藻酸盐珠粒的平均尺寸可典型地在300μm与2000μm范围内。然而,对于挤出前添加来说优选平均尺寸小于300μm。优选粒度小于300μm,更优选小于100μm并且最优选小于25μm。对于独立施用(不合并在饲料中)来说海藻酸盐珠粒的优选平均尺寸大于100μm。对于此用途,珠粒的优选尺寸将典型地取决于动物与目标剂量的大小两者,并且可相应进行调整。然而,对鱼类来说优选施用途径为使海藻酸盐珠粒含于饲料中的口服途径。
优选通过诸如真空注入涂布等适合的方法将包含生物活性剂的小海藻酸盐珠粒合并至饲料球粒中,然后将其经口施用给目标有机体,诸如鱼类。或者,可在球粒化之前将珠粒与其他饲料成分混合。这些成分可例如为熟练人员已知的常规饲料组分。优选地,在挤出或制备饲料球粒的任何其他手段之前将包含一种或若干种生物活性成分的海藻酸盐珠粒与初始粉末(由除油以外的所有饲料成分组成的干混合物)混合。
以下实验部分中提供与本发明一致的用于使海藻酸盐与乙二胺二盐酸盐交联的优选方法以及用于制备负载有一种或多种生物活性剂的小海藻酸乙二铵珠粒的优选方法的详细描述。此外,所述实验部分中提供根据本发明用于将海藻酸盐珠粒合并至饲料球粒中的优选方法。
实验部分:
测试海藻酸乙二铵(eda-海藻酸盐)的功效并且在体外和体内两个不同实验设定中加以证实。将所获得的结果与基于与ca2+交联的海藻酸盐(ca-海藻酸盐)的常用口腔递送系统相比较。
如上文所描述,变温的鱼中以及尤其具有短肠的肉食性鱼中的消化条件不同于许多其他有机体,尤其不同于哺乳动物和人类。因此,在本发明中,在已知标准溶解测试中以及已适合于对变温鲑鱼来说具代表性的消化条件的测试中对根据本发明的口腔递送系统加以测试。首先,在体外在标准溶解测试(ph1.2和ph6.8,在37℃下)中评估蓝色右旋糖酐从ca-海藻酸盐和eda-海藻酸盐的释放。其次,在18℃下在ph8.0和ph8.6的碱性溶解介质中测试从相同海藻酸盐的释放。基于先前测试的结果,研发新的溶解测试策略(ph3.0,随后ph8.6,在4℃下或在18℃下)。最后,在体内在饲喂试验中评估辣根过氧化物酶(hrp)从ca-海藻酸盐与eda-海藻酸盐两者的释放,以证实海藻酸乙二铵在鱼类中作为大分子的口腔递送系统的适合性。
4.1实验中所用的材料
海藻酸钠(protanallf20/40)是从fmcbiopolymeras(norway)获得。辣根过氧化物酶(hrp,p/n31491,thermofisherscientific)是从perbioscienceukltd.取得。去离子水(di水,分析试剂)是购自fishechemicalltd.(uk)。以下试剂是购自vwrltd(uk):二水合氯化钙(analar
储备溶液:
蓝色右旋糖酐封装制剂(bd-encform)是通过在周围温度下将海藻酸钠(2.0%w/v)溶解于bd溶液(50.0mgml-1)中来制备。
缓冲液ph1.2:氯化钠/盐酸(nacl/hcl,ph1.2)缓冲液是通过将nacl溶液(250ml,23.38gl-1,0.4mnacl)与0.4mhcl溶液(425ml)混合来制备。在用di水将体积补足至1000ml之前,将缓冲溶液的ph值调节至1.2。
缓冲液ph3.0:将苯二甲酸氢钾溶液(500ml,81.69gl-1,0.4mkph)与hcl溶液(223ml,0.4mhcl)组合以制备kph/hcl缓冲液(ph3.0)的储备溶液。用di水将缓冲溶液补充至1000ml的总体积。
缓冲液ph6.8:将二水合磷酸单钠溶液(255ml,62.40gl-1,0.4mnah2po4·2h2o)与二水合磷酸二钠溶液(245ml,71.20gl-1,0.4mna2hpo4·2h2o)混合以形成磷酸盐缓冲液(ph6.8)。在用di水将体积调平至1000ml之前将所得缓冲液调节至ph6.8。
缓冲液ph8.0:磷酸盐缓冲液(ph8.0)是通过将二水合磷酸单钠溶液(26.5ml,62.40gl-1,0.4mnah2po4·h2o)与二水合磷酸二钠溶液(473.5ml,71.20gl-1,0.4mna2hpo4·2h2o)组合来制备。将所得缓冲溶液调节至ph8.0并且然后用di水稀释至1000ml的最终体积。
缓冲液ph8.6:将甘氨酸溶液(250ml,30.03gl-1,0.4mgly)与氢氧化钠溶液(20ml,16gl-1,0.4mnaoh)混合以制备gly/naoh缓冲液。在将ph值调节至8.6之后,用di水将所产生的缓冲溶液稀释至1000ml的体积。
将碳酸氢钠(150gl-1,nahco3)溶解于di水中以制备饱和nahco3溶液。在使用之前过滤掉任何未溶解的nahco3晶体。
辣根过氧化物酶(hrp)封装制剂(hrp-encform)是通过在4℃下将海藻酸钠(2.0%w/w)溶解于hrp溶液(每毫升di水400μg)中来制备。
hrp储备溶液(5mgml-1)是通过将hrp粉末(10.0mg)溶解于di水(2.0ml)中来制备。在酶分析中构建标准曲线之前,将此hrp溶液(20.0μl)的等分试样储存在-20℃下。
交联溶液(cacl2溶液和eda·2hcl溶液)是通过分开地将二水合氯化钙(36.8gl-1,0.25mcacl2·2h2o)和乙二胺二盐酸盐(33.3gl-1,0.25meda·2hcl)溶解于di水中来制备。
4.2海藻酸盐微珠粒的溶解的体外测试
选择蓝色右旋糖酐(bd)作为模型化合物来进行活性药物成分(api)从海藻酸盐基质的模拟释放。
负载有蓝色右旋糖酐的海藻酸盐珠粒的制备
由60ml塑料注射器(bdplastipaktm)通过针头(内径=2.0mm)将bd-encform([bd]=50.0mgml-1)挤至交联溶液中。通过以体积模式(目标体积=1.50ml)工作的注射器泵(harvardphd4400,harvardapparatusltd,edenbridge,uk)使流速(50.00mlh-1)维持恒定。使用此设置来挤出80批bd-encform,每批1.50ml。分别使用交联溶液cacl2溶液(40×10.0ml)和eda·2hcl溶液(40×10.0ml)来产生bd-ca-alg(40批)和bd-eda-alg珠粒(40批)。每一批的共同点在于在产生最后的珠粒之后10min,将海藻酸盐珠粒与交联溶液分离。此后,将回收的负载有bd的海藻酸盐珠粒用di水(3×5ml)洗涤。使用bd-ca-alg(10批)和bd-eda-alg珠粒(10批)来测定封装效率,而将剩余的批次用在溶解测试中。通过立体显微镜(leicamz10f,leicamicrosystems,wetzlar,germany)测定粒度分布和形状。
蓝色右旋糖酐的封装效率
将bd-ca-alg(10批)和bd-eda-alg(10批)珠粒添加至饱和nahco3溶液(20×9.0ml,ph=8.0)中。结果,在搅拌下在两小时之后所有珠粒完全溶解。为平衡所有样品体积,用di水将所得溶液的水平调节至10ml。通过针筒过滤器(0.45μm,vwr)过滤这些新形成的溶液(n=20),然后施加至96-孔聚苯乙烯板(nunctm,sigma-aldrich)上用于终点分析。在610nm和24℃下使用versamax微板读数器(moleculardevicesllc,sunnyvale,ca,usa)测量bd的吸收率。通过使用在1.0至3.9×10-3mgml-1范围内的标准曲线测定样品的bd浓度。通过绘制bd溶液(1.0mgml-1)的九份两倍连续稀释液的bd浓度对吸收率的曲线来产生标准曲线。使用饱和nahco3溶液作为稀释剂从bd-encform([bd]=50.0mgml-1)得到bd溶液(1.0mgml-1)。
a.标准溶解测试
使用配备有溶解容器(v=1000ml)和旋转不锈钢篮筐(40目)的溶解测试器(caleva8st,calevainternationalltd,uk)来评估bd从两种不同类型的海藻酸盐珠粒的释放。此设置符合由美国药典(unitedstatespharmacopoeia,usp)设定并且在综合章节<711>中描述的设备1的标准要求。
将溶解介质(300ml;nacl/hcl缓冲液,ph1.2或磷酸盐缓冲液,ph6.8)添加至每一个容器中并且然后使其在37℃下静置过夜。在根据上文所描述的方法制备海藻酸盐珠粒之后2h内开始溶解实验。将海藻酸盐珠粒(bd-ca-alg或bd-eda-alg)放入旋转篮筐(100rpm)中并且然后浸没至溶解容器中。在37℃下一式五份地进行以下实验:测试1)bd-ca-alg,在ph1.2下,测试2)bd-eda-alg,在ph1.2下,测试3)bd-ca-alg,在ph6.8下以及测试4)bd-eda-alg,在ph6.8下。
按五分钟时间间隔从容器中获取样品(每一样品1.0ml)持续50分钟。然后添加相等体积的溶解介质(1.0ml,37℃)以使容器中的液体水平保持恒定。通过针筒过滤器(0.45μm,vwr)过滤所有样品,然后将其放至96-孔聚苯乙烯板(nunctm,sigma-aldrich)上用于终点分析。在610nm和24℃下通过versamax微板读数器(moleculardevicesllc,sunnyvale,ca,usa)进行板的读取。通过应用标准曲线法来测定所释放的bd的量。通过在1.0至3.9×10-3mgml-1范围内绘制bd溶液(1.0mgml-1)的九份两倍连续稀释液的bd浓度对吸收率的曲线来产生标准曲线。使用实验缓冲液作为稀释剂从bd-encform([bd]=50.0mgml-1)得到bd溶液(1.0mgml-1)。
b.碱性溶解介质的评估
为选择就温度和ph值来说对鲑鱼肠来说具代表性的碱性溶解介质,如先前部分中所描述进行四个溶解测试。在18℃下各重复五次在溶解介质(磷酸盐缓冲液,ph8.0和gly/naoh缓冲液,ph8.6)中进行以下实验:测试5)bd-ca-alg,在ph8.0下,测试6)bd-eda-alg,在ph8.0下,测试7)bd-ca-alg,在ph8.6下,以及测试8)bd-eda-alg,在ph8.6下。以与先前在标准溶解测试中所描述相同的方式测定样品中的bd的浓度。
c.适合于鱼类的新的溶解测试策略
此测试中所应用的条件与海藻酸盐珠粒在其穿过大西洋鲑的胃肠道期间可典型地暴露的条件一致。因此,首先将海藻酸盐珠粒浸没至酸性溶解介质(kph/hcl缓冲液,ph3.0)中持续15min,并且然后将酸性缓冲液溶液换成碱性溶解介质(磷酸盐缓冲液,ph8.0)。在此测试中,使用与先前所描述相同的ups设备1。为尽可能充分地复制大西洋鲑所生活的自然条件,测试中应用两种不同的温度(4℃和18℃)。所选温度典型地对应于挪威海岸夏季和冬季期间的水温。为此,一式五份地进行以下四个溶解测试:测试9)bd-ca-alg,在ph3.0-8.0和4℃下,测试10)bd-eda-alg,在ph3.0-8.0和4℃下,测试11)bd-ca-alg,在ph3.0-8.0和18℃下,测试12)bd-eda-alg,在ph3.0-8.0和18℃下。在15min之后在kph/hcl缓冲液(ph3.0)中获取第一个样品。在更换溶解介质之后5min开始进一步取样,如先前在标准方法中所描述来进行。类似地,根据在前面部分中所描述的方法进行终点分析。当计算从海藻酸盐珠粒释放的百分比时,将bd的封装效率考虑在内。
统计分析
使用微软excel2010中的数据分析和散布点图功能产生如具有误差线(95%置信区间)的累积bd释放的平均百分比随时间推移的曲线所示的bd溶解型态。
结果
bd-ca-alg和bd-eda-alg中的bd的平均封装效率分别为90%(sd=4%)和70%(sd=4%)。ca-海藻酸盐珠粒的平均尺寸为3.0mm,而eda-海藻酸盐珠粒的平均尺寸为3.7mm。两种类型的珠粒的珠粒形状均为球形(图1)。
在标准溶解测试中,bd从ca-海藻酸盐与eda-海藻酸盐珠粒的释放均低于分析的定量限制(loq=3.9×10-3mgml-1)(测试1和2在ph1.2中在37℃下进行;测试3和4在ph6.8中在37℃下进行)。
类似地,在碱性溶解介质中所进行的测试中,bd从两种海藻酸盐珠粒的释放均低于loq(测试5和测试6在ph8.0中在18℃下进行;测试7和测试8在ph8.6中在18℃下进行)。由体外研究所呈现的结果可见,在37℃下ph1.2、在37℃下ph6.8、在18℃下ph8.0以及在18℃下ph8.6的情况下,在50分钟的时间框内,ca-海藻酸盐与eda-海藻酸盐基质两者均不太可溶于缓冲液。
在适合于鲑鱼消化海藻酸盐的条件的溶解测试(测试9-12)中,在所有四个实验中均观测到bd的显著释放。在将ph值从ph3.0增加至ph8.0之后释放相当快,所述释放在ph3.0下低于loq。由在18℃下的测试12(图2),可见在23min之后从bd-eda-alg释放50%的bd,而在40min之后释放85%的bd。如在4℃下进行的使用相同bd-eda-alg珠粒的测试10中可见,在19和39min之后分别记录到50%和85%释放。与在4℃和18℃下从bd-eda-alg释放的速率相比,在18℃下bd-ca-alg(测试11)的溶解速率略微更低。因此,在26min之后在溶液中50%的bd为游离的。此外,在48min内释放85%的bd。然而,与其他三个测试相比,在4℃下(测试9)bd-ca-alg的溶解速率低得多,在49min之后仅30%的bd溶解。前面对溶解速率的评估是使用表1中所示的二阶近似型式来计算。
表1:与在4℃和18℃下蓝色右旋糖酐释放(bd)从钙(bd-ca-alg)和海藻酸乙二铵(bd-eda-alg)的释放有关的溶解曲线。示出了溶解曲线的一阶和二阶近似型式以及对应决定系数(r2)。在改变溶解介质之后0至50分钟的时间间隔内数据与线性与非线性函数均拟合得非常好。
封装于海藻酸盐基质中的药物主要通过两种机制释放:1)药物通过聚合物网络的孔隙扩散以及2)聚合物网络的降解。不同于低分子量药物,蓝色右旋糖酐(m.w.=2,000,000)如此大,以致于它不能在海藻酸盐基质的孔隙不进一步扩大的情况下通过其扩散(kim,c.和lee,e.,1992.thecontrolledreleaseofbluedextranfromalginatebeads.int.j.pharm.79,11-19)。因此,大多数bd从海藻酸盐基质释放大概是归因于聚合物网络的降解而发生。在更早的研究中,在ph7.4下在第一个小时内观测到异硫氰酸荧光素右旋糖酐(m.w.=145,000)的非常低的释放速率。
预期在ph3.5-7.0下极少发生eda-海藻酸盐的降解,因为在ph<7.0下大多数的乙二胺(不带电荷的形式)将以乙二铵(带正电荷)的形式存在,而在ph>3.5下大多数的海藻酸盐(海藻酸)将去除质子化(带负电荷)。
根据本发明中所呈现的实验结果,一种减弱海藻酸盐基质的交联结构的有效方式为使用酸性溶解介质(ph<3.5),然后应用碱性介质(ph>7.0)。在不受理论限制的情况下,以下机制可适用:在低于3.5的ph值下(海藻酸,pka=1.5-3.5),氢离子(h+)似乎置换海藻酸盐网络中的乙二铵,从而产生解开的海藻酸结构。虽然海藻酸不太具水溶性,但它在较高的ph值下容易转化为水溶性形式(例如海藻酸钠)。同时,增加碱性ph值(ph>7.0)通过胺基的去质子化和转化成不带电荷形式的乙二胺使乙二铵的交联强度降低。因此,与用碱性介质(ph>7.0)直接处理相比,前面用酸性介质(ph<3.5)进行处理可给出快得多的释放速率。因此,溶解测试中通常应用的标准条件(ph=1.2和6.8,在37℃下)经常产生非常缓慢的溶解速率。
通过后续依次应用ph=3.0和ph=8.0的介质,实现了图2中所示的高释放速率。如上文所提到,短时间将海藻酸盐珠粒放入酸性缓冲液(ph=3.0)中似乎使一些eda-海藻酸盐转化为海藻酸。因此,当将酸性缓冲液换成碱性缓冲液(ph=8.0)同时eda将变得带较少电荷时,海藻酸和任何剩余的eda-海藻酸盐将容易溶解。以相同方式,在增加溶解介质的ph值的情况下ca-海藻酸盐基质的崩解速率加快。同时,当ph值大于8时,带电荷的钠(na+)朝向海藻酸盐的羧基的吸引增加(oberyukhtina,i.,bogolitsyn,k.,popova,n.,2001.physicochemicalpropertiesofsolutionsofsodiumalginateextractedfrombrownalgaelaminariadigitata.russ.j.appl.,74,1645–1649)。另一方面,在ph>6.7下磷酸钙可能已开始从含有ca2+和磷酸盐缓冲液的系统沉淀析出(feenstra,t.p.,debruyn,p.l.,1979.formationofcalciumphosphatesinmoderatelysupersaturatedsolutions.j.phys.chem.83,475–479)。通过本发明和新研发的溶解测试策略,可证实eda-海藻酸盐在典型地存在于鱼类中的条件下作为口腔递送系统具有高的效率和潜能,在所述条件中胃部ph值为2.7-4.9并且肠道ph值为7.5-8.5。
通常已知交联海藻酸盐的溶解为ph依赖性的和温度依赖性的。由图2,可得出以下结论:eda-海藻酸盐的溶解为ph依赖性的,但令人惊讶地的是,在4-18℃范围内未受温度影响。相比之下,bd从ca-海藻酸盐基质释放的速率显著低于在4℃下从eda-海藻酸盐与在18℃下从ca-海藻酸盐释放的速率。这与在5℃下进行的体内试验(参见下文)的结果相符合。因此,通过本发明,可证明海藻酸乙二铵特别适合在诸如鱼类等变温动物中作为口腔递送系统。
4.3海藻酸盐微珠粒的溶解的体内测试
用大西洋鲑(安大略鲑)在体内实验中进一步测试了海藻酸乙二铵作为根据本发明的口腔递送系统的性能。
负载有hrp的海藻酸盐微珠粒的制备:
以称为空气动力学辅助喷射的封装工艺制备负载有hrp的海藻酸钙(hrp-ca-alg)和海藻酸乙二铵(hrp-eda-alg)微珠粒。在空气动力学辅助喷射的工艺中,通过借助于空气压力经由喷射头将hrp-encform(2×240.0g)挤出来产生海藻酸盐微滴的射流。喷射头配备有喷嘴
如果所获得的珠粒应经由表面合并至饲料球粒中,那么微珠粒的直径必须对应于球粒的孔径。这可通过上文所描述的方法来实现。
实验饲料的制备
通过以真空注入涂布工艺将悬浮于鱼油(1210.0g)中的hrp-alg微珠粒(d中值=25-26μm)涂覆至ewosopal200基础球粒(bp)(表2)来制备两种包含hrp的实验饲料(每批5.0kg)。
表2:实验饲料hrp-ca-饲料、hrp-eda-饲料以及对照-饲料的组成
ihrp-ca-alg–通过将hrp溶液封装至ca-海藻酸盐基质中产生的产物
iihrp-eda-alg–通过将hrp溶液封装至eda-海藻酸盐基质中制得的产物
iiibp–基础球粒为半成品鱼类饲料产品、缺乏油混合物的干挤出物
通过用含有hrp-ca-alg(81.54g)的油悬浮液涂布bp(3708.46g)来制备hrp-ca-饲料,同时通过在真空涂布机中将含有hrp-eda-alg(78.29g)油悬浮液涂覆至bp(3711.71g)来准备好hrp-eda-饲料。通过仅用鱼油(1210.00g)涂布bp(3790.00g)来制备不含hrp的对照饲料(对照-饲料)。
鱼类试验
在开始试验之前九周时,在ewosinnovationas(dirdal,norway)将大西洋鲑安大略鲑(总数目:n=495,m平均=394g)随机分配于九个圆形海水罐(d=1m,v=0.5m3,t水=5℃)中。将各罐随机分成三组(ca-海藻酸盐、eda-海藻酸盐以及对照),每一组分配三个罐。在九周长的适应阶段之后,将ca-海藻酸盐和eda-海藻酸盐组的鱼分别用hrp-ca-饲料和hrp-eda-饲料处理。对照组饲喂对照-饲料。处理持续两周,此后进行取样。在11周长跨度的试验期间,鱼的健康状态很好。
取样
在取样之前,将鱼(n=每个罐15条鱼)用
样品分析
在使用之前将样品解冻并且在4000rpm下四分钟离心下来。胃和幽门盲囊样品未稀释即应用,而中间和远端肠样品在分析之前用di水(4℃)1:200稀释。由于稀释过的中间和远端肠样品(1:200)低于定量限制(0.391ngml-1),使用像1:10和1:100等较低稀释倍数或不稀释来增加灵敏度。通过将样品的等分试样(50μl)移液至96-孔聚苯乙烯板(nunctm,sigma-aldrich)上来进行动力学分析。通过添加3,3′,5,5′-四甲基联苯胺(tmb)液体底物(50μl,37℃)来起始反应。在655nm下使用versamax微板读数器(moleculardevicesllc,sunnyvale,ca,usa)进行吸收率测量。在37℃下每20秒记录动力学速率持续总共10分钟。通过使用标准曲线作为定量工具在0.391至200ngml-1范围内测定样品的hrp浓度。通过绘制hrp溶液(200ngml-1)的10份两倍连续稀释液的hrp浓度对其动力学速率(吸收率与时间曲线的斜率)的曲线来产生标准曲线。
统计分析
使用用于windows版本22.0的ibmspssstatistics计算存在于不同胃肠道区室中的具有误差线(95%置信区间)的平均hrp浓度并且呈现于图中。
结果
在本试验中,在用含有海藻酸盐封装的hrp的饲料处理期间鱼平均消耗12-13g饲料。因此,所处理的鱼(m平均=490-500g)在该时段内接受了230与240μg之间的hrp(表3)。
表3:与鱼大小(质量单位)和每条鱼的每周饲料摄入(fi)有关的hrp剂量。以每条鱼的每周hrp剂量(每条鱼每周微克数)和每单位鱼质量的每周hrp剂量(每条鱼每周微克数)的形式示出剂量。所用饲料:不含hrp(对照-饲料)、含海藻酸钙封装的hrp(hrp-ca-饲料)、海藻酸乙二铵封装的hrp(hrp-eda-饲料)。
ihrp剂量为理论剂量并且假设归因于加工的损失极少。
饲喂hrp-ca-饲料的一组鱼(ca-海藻酸盐)与其他胃肠道(gi)区室相比在远端肠中显示显著更高的hrp浓度(图3)。另一方面,饲喂hrp-eda-饲料的鱼在中间肠中具有比其他gi部分中显著更高的hrp浓度。另外,该组还在远端肠中具有明显更高的hrp浓度。与hrp处理组相比之下,在对照组中过氧化物酶活性相当低。
由图3,可见hrp从eda-海藻酸盐比从ca-海藻酸盐珠粒释放显著更快。根据本实验的结果,预期药物从eda-海藻酸盐释放不受大西洋鲑栖息地的季节性温度变化的影响。这些在本研究中被证实的属性令人惊讶地使得基于eda-海藻酸盐的口腔递送系统相对于诸如大西洋鲑等鱼类来说非常高效。
总之,通过本发明,不仅证实了不同交联的海藻酸盐基质之间存在差异,而且可鉴定一种新颖的更高效的口腔递送系统。就在低温下的溶解速率来说,eda-海藻酸盐与ca-海藻酸盐之间的差异特别明显。这与诸如大西洋鲑等生活在低温下的变温有机体高度相关。为识别海藻酸盐珠粒的这些特征,已研发上文所提到的新的溶解测试策略。这种新策略使得溶解测试对于存在于具有胃的鱼类中的胃肠道条件来说具高度代表性。因此,由重新设计的溶解测试产生的结果与从本体内研究获得的结果密切相关。大体上,eda-海藻酸盐为大分子药物到达像鲑鱼等变温动物的优良递送系统。此外,存在令人信服的证据证明这种递送系统在鲑鱼生命栖息地的温度范围内令人惊讶地为非温度依赖性的。本研究的结果的实际暗示为当使用这种新颖口腔递送系统时所递送的药物的量与环境温度无关。
当合并在鱼类饲料中并且经口施用给鱼类时,海藻酸乙二铵微珠粒作为口腔递送系统的优点为在如典型地存在于鱼类中的消化条件下珠粒高效地溶解于鱼类肠中并且将内容物递送至正确的位置供吸收。然而,尽管本发明被发现特别适合用于鱼类,但其不限于这组有机体,并且同样还可在包括人类、两栖动物、爬行动物、鸟类、甲壳动物、软体动物等的哺乳动物中用作大分子的口腔递送系统。
根据本发明的生物活性剂包括任何药物、物质、化合物、组合物或其混合物,这些物质在有机体的治疗或预防处理中为有效的,并且适合用于封装于海藻酸盐中以及随后的口腔递送。这种生物活性剂包括诸如以下的药剂:蛋白质、肽、疫苗、抗体、抗原、激素、药物(特别是大分子药物)、氨基酸、核苷酸、多核苷酸、酶、任何生理活性物质、营养物、益生元、益生菌、免疫刺激剂等。
在本发明的背景下,术语“冷水”有机体意指典型地生活在约20℃或更低的平均环境温度中的任何变温动物。同样地,“冷水鱼”为生活在约20℃或更低的平均水温中的鱼类。冷水鱼的典型实例为冷水海鱼,诸如鳕鱼和鲑鱼。
关于鱼类的术语“短肠道”或“短肠”意味着肠的总长度不超过所述鱼的身体长度的约2.5倍。
应了解,可对前文中所描述的本发明特征进行修改,而不会背离如在随附权利要求书中所定义的本发明范围。
- 还没有人留言评论。精彩留言会获得点赞!