纳米硒作为CIK细胞增敏剂的应用的制作方法
本发明属于医药技术领域,特别涉及纳米硒作为CIK细胞增敏剂的应用。
背景技术:
近几年,肿瘤免疫治疗的好消息不断,目前已在一些肿瘤类型如黑色素瘤,胃癌和非小细胞肺癌等的治疗中展示出了强大的抗肿瘤活性,并已有肿瘤免疫治疗药物获得美国FDA(Food and Drug Administration,FDA)批准临床应用。肿瘤免疫治疗由于其卓越的疗效和创新性,在2013年被《科学》杂志评为年度最重要的科学突破[Science,2013,342:1666]。肿瘤免疫治疗有望成为继手术,化疗,放疗,靶向治疗后肿瘤治疗领域的一场革新[Yao Yang,et al.Nanoscale Research Letters,2016,11:285]。CIK细胞是指自体细胞因子诱导的杀伤细胞,它是一种强有力的抗肿瘤或者是抗感染的免疫细胞。CIK细胞能够通过三种途径杀灭肿瘤细胞和病毒感染细胞:①CIK细胞对肿瘤细胞和病毒感染细胞的直接杀伤:CIK细胞可以通过不同的机制识别肿瘤细胞,释放颗粒酶/穿孔素等毒性颗粒,导致肿瘤细胞裂解;②CIK细胞释放的大量炎性细胞因子具有抑瘤杀瘤活性:体外培养的CIK细胞可以分泌多种细胞因子,如IFN-γ、TNF-α、IL-2等,不仅对肿瘤细胞有直接抑制作用,还可通过调节机体免疫系统反应性间接杀伤肿瘤细胞;③CIK细胞能够诱导肿瘤细胞的凋亡:CIK细胞在培养过程中表达FasL(Ⅱ型跨膜糖蛋白)通过与肿瘤细胞膜表达的Fas(Ⅰ型跨膜糖蛋白)结合,诱导肿瘤细胞凋亡。然而由于目前对于CIK细胞抑制肿瘤生长的机制研究不多,同时单独CIK的治疗效果有限,从而影响阻碍细胞治疗的效果。
肝癌是我国高发的危害极大的恶性肿瘤,目前临床上对肝癌的治疗方法包括手术、放化疗和药物治疗等方法。而肝癌对化疗药物和放疗都容易产生耐受性。因此,CIK细胞治疗引起了很大的关注,但是寻找用于细胞治疗的增敏剂能实现刺激CIK细胞分泌更多的细胞因子从而提高细胞治疗的抗肿瘤效果目的。同时,纳米技术的发展也促进了肿瘤细胞治疗的增敏剂的发展。因此,寻找用于免疫治疗的纳米免疫治疗增敏剂能实现选择性抑制肿瘤细胞和减少对正常组织损伤的目的。在我们实验室的前期研究中,发现纳米硒是高效低毒的抗肿瘤药物,同时具有增敏的效果[Bo Yu,et al,Colloids and Surfaces B:Biointerfaces,2016,139,
180–189.]。
技术实现要素:
本发明的首要目的在于克服现有技术的缺点与不足,提供纳米硒作为CIK细胞增敏剂的应用。
本发明的另一目的在于提供一种CIK细胞增敏剂。
本发明的再一目的在于提供一种抗肿瘤药物。
本发明的目的通过下述技术方案实现:纳米硒作为CIK细胞增敏剂的应用,是将纳米硒作为CIK细胞增敏剂辅助CIK细胞进行应用。
纳米硒制备CIK细胞增敏剂的应用,是将纳米硒先与CIK细胞孵育再处理肿瘤细胞,或是肿瘤细胞先经纳米硒进行预处理再加入CIK细胞,或是纳米硒和CIK细胞同时处理肿瘤细胞;纳米硒作用浓度为0.5~10μmol/L,CIK细胞的添加量为按CIK细胞与肿瘤细胞的个数比为5~40:1计算。
所述的纳米硒为单独纳米硒(S-SeNPs),聚乙二醇修饰的纳米硒(PEG-SeNPs),聚乙烯吡咯烷酮修饰的纳米硒(PVP-SeNPs),壳聚糖修饰的纳米硒(CS-SeNPs),多糖修饰的纳米硒,叶酸修饰的纳米硒(叶酸修饰的肿瘤靶向性纳米硒)和转铁蛋白修饰的纳米硒(转铁蛋白修饰的肿瘤靶向性纳米硒)中的至少一种。
所述的多糖修饰的纳米硒优选为茯苓多糖修饰的纳米硒(CMP-SeNPs)。
所述的纳米硒优选为通过如下任一种方法制备得到:
(1)将H2SeO3溶液或Na2SeO3溶液和Vc(维生素c)混合,于4℃进行反应,透析,得到纳米硒(S-SeNPs);
或者是:
(2)将H2SeO3溶液或Na2SeO3溶液和物质A混合,再加入Vc(维生素c)于4℃进行反应,透析,得到纳米硒,其中,所述的物质A为PEG、PVP、CS和多糖中的一种;
或者是:
(3)将物质A和Vc(维生素c)混合,再加入H2SeO3溶液或Na2SeO3溶液于4℃进行反应,透析,得到纳米硒,其中,所述的物质A为PEG、PVP、CS和多糖中的一种。
所述的H2SeO3溶液或Na2SeO3溶液的浓度优选为10mmol/L;H2SeO3溶液或Na2SeO3溶液的添加量为按终浓度1~5mmol/L计算。
所述的物质A的添加量为按终浓度0.5~10mg/ml计算。
所述的Vc和H2SeO3(或Na2SeO3)按摩尔比3~10:1进行配比。
所述的反应的时间为0.5~24小时。
所述的透析为采用透析袋进行透析,透析的时间为12~48小时。
所述的CIK细胞为用常规方法得到的CIK细胞,如通过商业途径购买获得,或用人的外周血、骨髓或脐带血,经单核细胞分离、在体外利用CD-3抗体、IFN-γ和IL-2诱导培养获得。
所述的CIK细胞优选通过如下方法制备得到:
(1)将人的外周血加入PBS缓冲液,再加入人淋巴细胞分离液,离心,取位于上层血浆与下层分离液之间的白膜层,得到单个核细胞层,其中,外周血、PBS缓冲液和人淋巴细胞分离液按体积比1:1:1进行配比;
(2)向单个核细胞层中加入PBS缓冲液,混匀后离心、洗涤,得到单核细胞;
(3)向单核细胞中加入重组人IFN-γ进行培养,第二天加入CD-3单克隆抗体和重组人IL-2继续培养;
(4)每隔2~3天加入新鲜的人淋巴细胞培养基培养14~21天后,得到CIK细胞。
步骤(1)中所述的人的外周血为通过无菌采集正常人的外周血再加入肝素抗凝获得。
步骤(1)中所述的离心优选为800g离心20min。
步骤(2)中所述的离心优选为250g离心10min。
步骤(2)中所述的洗涤优选为用PBS缓冲液洗涤1~3次。
步骤(2)中所述的单核细胞还包括进一步调细胞密度:用人淋巴细胞培养基调节细胞的密度。
步骤(2)中所述的培养的条件优选为在含5%(v/v)CO2、温度为37℃细胞培养箱中培养。
步骤(4)中所述的人淋巴细胞培养基为含有CD-3单克隆抗体和重组IL-2的人淋巴细胞培养基。
一种CIK细胞增敏剂,是基于纳米硒作为CIK细胞增敏剂的应用制备得到,由纳米硒和药物允许的修饰剂组成。
所述的CIK细胞增敏剂可以进一步制成注射剂等多种形式。
一种抗肿瘤药物,由CIK细胞增敏剂和CIK细胞组成,即由纳米硒和CIK细胞组成。
所述的肿瘤包括人肝癌、人非小细胞肺癌、人宫颈癌、黑色素瘤、乳腺癌和脑胶质瘤;优选为肝癌。
本发明中纳米硒能通过CIK增敏高效抑制肝癌细胞HepG2增殖,即可以用于治疗肝癌。
本发明相对于现有技术具有如下的优点及效果:
(1)本发明公开了功能化纳米硒作为CIK细胞免疫治疗增敏剂的应用,包括纳米硒预先与CIK细胞孵育一定的时间再处理肿瘤细胞、纳米硒预处理肿瘤细胞不同的时间再加入CIK细胞以及纳米硒与CIK细胞同时处理肿瘤细胞。本发明利用的纳米硒、叶酸及转铁蛋白修饰的肿瘤靶向性纳米硒(SeNPs)。SeNPs具有CIK细胞增敏特性,并能与CIK细胞产生的细胞因子形成协同作用,在体外细胞实验和小鼠体内实验中对肝癌细胞HepG2有高效的抑制效果,同时也能够明显抑制人非小细胞肺癌细胞A549,人宫颈癌细胞HeLa、黑色素瘤细胞A375、乳腺癌细胞MCF-7及脑胶质瘤细胞C6等多种细胞的增殖。其机制主要是通过调节CIK细胞内细胞因子的产生,进而诱导细胞周期阻滞及肿瘤细胞凋亡。结果提示,SeNPs可作为新型免疫治疗增敏剂进行开发。
(2)目前,CIK细胞治疗引起了很大的关注,但是寻找用于细胞治疗的增敏剂能实现刺激CIK细胞分泌更多的细胞因子从而提高细胞治疗的抗肿瘤效果仍然很迫切。同时,纳米技术的发展也促进了肿瘤细胞治疗的增敏剂的发展。因此,寻找用于免疫治疗的纳米免疫治疗增敏剂是肿瘤治疗需要迫切解决的问题。而在我们实验室的前期研究中,发现纳米硒是高效低毒的抗肿瘤药物,同时具有增敏的效果。因此,开发纳米硒增敏CIK细胞的治疗具有广阔的应用前景。
(3)本发明开发了高效低毒的功能化纳米硒作为CIK细胞免疫治疗的增敏剂。在裸鼠荷瘤模型实验中,功能化纳米硒联合CIK细胞对肿瘤组织的增殖具有明显的抑制效果,且对正常组织毒副性低。
(4)本发明利用维生素C还原亚硒酸钠制备得到纳米硒(SeNPs)。SeNPs具有刺激CIK细胞产生细胞因子(IFN-γ、TNF-α、IL-2等)对肿瘤细胞有直接抑制作用,还可通过调节机体免疫系统反应性间接杀伤肿瘤细胞,从而抑制人肝癌细胞HepG2的增殖。而对照组SeNPs、CIK细胞不具备这种特性。SeNPs与CIK细胞协同作用刺激CIK细胞因子分泌的方式通过凋亡的进程最终诱导HepG2细胞凋亡和G2/M抑制。结果提示,SeNPs具有潜在的作为有效的新型增敏剂改善肝癌的治疗效果。
(5)本发明所得纳米硒增敏剂的原料廉价易得,合成和纯化步骤可操作性强,可通过优化工艺,适当扩大合成规模,实现药物的商业化和应用。
附图说明
图1为纳米硒(S-SeNPs)的粒度表征图。
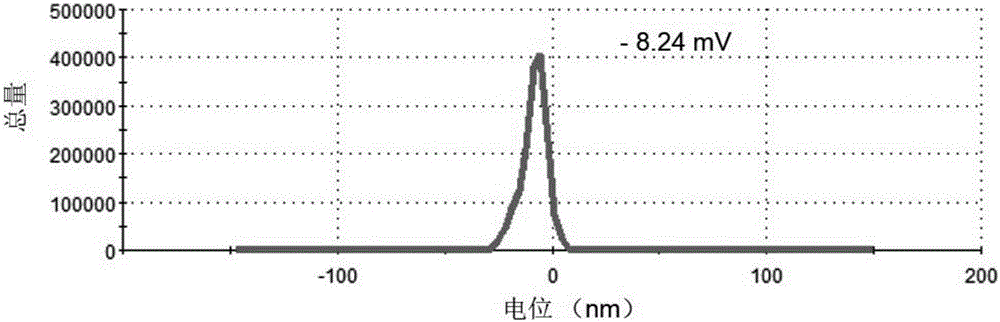
图2为纳米硒(S-SeNPs)的点位表征图。
图3为纳米硒(S-SeNPs)的TEM形貌表征图。
图4为不同数量的CIK细胞对人肝癌细胞HepG2存活率的影响图,其中,处理组与对照组的显著性差异:P<0.05(*)和P<0.01(**)。
图5为不同数量的CIK细胞对人肝癌细胞HepG2的细胞数量与形貌的影响图。
图6为不同浓度的S-SeNPs对CIK细胞(CIK:800000/mL)细胞存活率的影响图,其中,处理组与对照组的显著性差异:P<0.05(*)和P<0.01(**)。
图7为人肝癌细胞HepG2在接受S-SeNPs、CIK细胞以及纳米硒与CIK细胞联合处理24小时后细胞存活率的对比图。
图8为人肝癌细胞HepG2在接受S-SeNPs、CIK以及纳米硒与CIK联合处理24小时后细胞数量与形貌的影响图。
图9为体外S-SeNPs对CIK分泌细胞因子的影响图。
图10为流式细胞术分析S-SeNPs与CIK细胞共同作用后对HepG2细胞周期的影响图。
图11为不同处理对人肝癌细胞HepG2裸鼠异种移植肿瘤裸鼠体重变化的影响图。
图12为不同处理对人肝癌细胞HepG2裸鼠异种移植肿瘤生长体积变化的影响图。
图13为不同处理对人肝癌细胞HepG2裸鼠异种移植肿瘤的相对肿瘤增殖率对比和瘤重对比图;其中,图A为相对肿瘤增殖率,图B为瘤重。
图14为不同处理对裸鼠体内肿瘤以及心肝脾肺肾的毒性的组织切片图。
图15为经不同处理后裸鼠的血液指标分析图,其中,图a~i分别为谷丙转氨酶、谷草转氨酶、乳酸脱氢酶、尿素氮、肌酐、尿酸、血糖、总胆固醇和高密度脂蛋白。
图16为不同浓度的PEG-SeNPs对CIK细胞(CIK:800000/mL)细胞存活率的影响图。
图17为不同浓度的PEG-SeNPs对HepG2细胞(HepG2:20000/mL)细胞存活率的影响图。
图18为人肝癌细胞HepG2在接受PEG-SeNPs、CIK细胞以及纳米硒与CIK细胞联合处理24小时后细胞存活率的对比图。
图19为不同浓度的PVP-SeNPs对CIK细胞(CIK:800000/mL)细胞存活率的影响图,其中,处理组与对照组的显著性差异:P<0.05(*)和P<0.01(**)。
图20为不同浓度的PVP-SeNPs对HepG2细胞(HepG2:20000/mL)细胞存活率的影响图。
图21为人肝癌细胞HepG2在接受PVP-SeNPs、CIK细胞以及纳米硒与CIK细胞联合处理24小时后细胞存活率的对比图。
图22为不同浓度的CS-SeNPs对CIK细胞(CIK:800000/mL)细胞存活率的影响图。
图23为不同浓度的CS-SeNPs对HepG2细胞(HepG2:20000/mL)细胞存活率的影响图。
图24为人肝癌细胞HepG2在接受CS-SeNPs、CIK细胞以及纳米硒与CIK细胞联合处理24小时后细胞存活率的对比图。
图25为不同浓度的CMP-SeNPs对CIK细胞(CIK:800000/mL)细胞存活率的影响图。
图26为不同浓度的CMP-SeNPs对HepG2细胞(HepG2:20000/mL)细胞存活率的影响图。
图27为人肝癌细胞HepG2在接受CMP-SeNPs、CIK细胞以及纳米硒与CIK细胞联合处理24小时后细胞存活率的对比图。
具体实施方式
下面结合实施例对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实施例1纳米硒的制备及表征
本实施例用氧化还原法合成了纳米硒,利用维生素c(Vc,阿拉丁)还原亚硒酸(H2SeO3)或者亚硒酸钠(Na2SeO3),再利用PEG(COOH-PEG5000)、聚乙烯吡咯烷酮(PVP,阿拉丁,P110607)、壳聚糖(CS,国药集团化学试剂有限公司)或茯苓多糖(CMP,湖南补天药业有限公司)修饰纳米硒,即制得(PEG-SeNPs,PVP-SeNPs,CS-SeNPs,CMP-SeNPs),并分别检测它们对CIK细胞存活率的影响以及与CIK细胞共同作用的机制。
1、S-SeNPs的制备:
具体的,在4℃下,将1mL 10mM的H2SeO3溶液或者Na2SeO3溶液(终浓度1~5mM)放入小烧杯中,缓慢加入1mL 40mM Vc(Vc与Se的摩尔比为3~10:1),再用超纯水定容到5mL在4℃反应0.5~24小时,用透析袋在超纯水中透析12~48小时,即得产物S-SeNPs。
根据以上条件,也可将H2SeO3溶液或者Na2SeO3溶液缓慢加入Vc溶液中,同样可制得产物S-SeNPs。
2、PEG-SeNPs的制备:
将1mL 10mM H2SeO3溶液或者Na2SeO3溶液(终浓度1~5mM)与PEG(终浓度为0.5~10mg/ml)混合均匀后,加入1mL 40mM Vc(Vc与Se的摩尔比为3~10:1),再用超纯水定容到5mL在4℃反应0.5~24小时,透析12~48小时,即得产物PEG-SeNPs。
根据以上条件,也可将PEG先与Vc混合,再滴入H2SeO3溶液或者Na2SeO3溶液,同样可制得产物PEG-SeNPs。
3、PVP-SeNPs的制备:
将1mL 10mM H2SeO3溶液或者Na2SeO3溶液(终浓度1~5mM)与PVP(终浓度为0.5~10mg/ml)混合均匀后,加入1mL 40mM Vc(Vc与Se的摩尔比为3~10:1),再用超纯水定容到5mL在4℃反应0.5~24小时,透析12~48小时,即得产物PVP-SeNPs。
根据以上条件,也可将PVP先与Vc混合,再滴入H2SeO3溶液或者Na2SeO3溶液,同样可制得产物PVP-SeNPs。
4、CS-SeNPs的制备:
将1mL 10mM H2SeO3溶液或者Na2SeO3溶液(终浓度1~5mM)与CS(终浓度为0.5~10mg/ml)混合均匀后,加入1mL 40mM Vc(Vc与Se的摩尔比为3~10:1),再用超纯水定容到5mL在4℃反应0.5~24小时,透析12~48小时,即得产物CS-SeNPs。
根据以上条件,也可将CS先与Vc混合,再滴入H2SeO3溶液或者Na2SeO3溶液,同样可制得产物CS-SeNPs。
5、CMP-SeNPs的制备:
将1mL 10mM H2SeO3溶液或者Na2SeO3溶液(终浓度1~5mM)与CMP(终浓度为0.5~10mg/ml)混合均匀后,加入1mL 40mM Vc(Vc与Se的摩尔比为3~10:1),再用超纯水定容到5mL在4℃反应0.5~24小时,透析12~48小时,即得产物CMP-SeNPs。
根据以上条件,也可将CMP先与Vc混合,再滴入H2SeO3溶液或者Na2SeO3溶液,同样可制得产物CMP-SeNPs。
使用马尔文激光粒度仪测量S-SeNPs的粒径和电位。结果如图1和2所示,从图1可见,S-SeNPs分散较均匀,粒径较均一,为进一步的研究提供了基础。图2显示S-SeNPs表面带负电荷较多,比较稳定。通过图3 TEM电镜(透射电子显微镜)的观察,可以看到S-SeNPs成黑色光滑的圆球,粒径大小较均一,大约100nm。
实施例2S-SeNPs与CIK细胞共作用体外抗肝癌肿瘤活性研究
1、HepG2细胞和CIK细胞的培养
(1)HepG2细胞从美国标准菌库(ATCC)购买,用完全培养基(DMEM,Gibco)培养,并在DMEM中加入体积比10%(v/v)的胎牛血清(FBS,Gibco)和1%(v/v)的双抗(青链霉素混合液,Gibco),在37℃有5%(v/v)二氧化碳的湿润的培养箱中培养。
(2)CIK细胞的培养,无菌采集正常人的外周血50ml,肝素抗凝,送回实验室,在无菌超净台中进行后续操作。用与血样等体积的PBS缓冲液(浓度为0.01M,pH 7.4,下同)稀释血样。在无菌离心管中加入与未稀释血样等体积的人淋巴细胞分离液(深圳达科为生物工程有限公司),再将PBS稀释后的血样沿管壁缓慢加于分离液上方,尽量避免血样与分离液混合,保持两液界面清晰。分离液、未稀释血样、PBS的体积比为1:1:1。室温下用水平转子800g离心20min。离心结束后,小心吸取位于上层血浆与下层分离液之间的白膜层,即单个核细胞层。用PBS将体积加至50ml,充分混匀,室温,250g离心10min,用PBS缓冲液重复洗涤1-2次。用人淋巴细胞培养基(TaKaRa,WK593S)将细胞密度调至5×106细胞/ml。加入重组人IFN-γ(1000U/ml,美国peprotech),置于含5%(v/v)CO2,37℃细胞培养箱中培养。第二天加入CD-3单克隆抗体(终浓度50ng/ml,美国peprotech)、重组人IL-2(500IU/ml,美国peprotech),每隔2-3d(天)加入新鲜的人淋巴细胞培养基(含50ng/ml CD-3单克隆抗体、500IU/ml重组IL-2),维持细胞密度在5×106细胞/ml左右。培养14-21d后,所得的混合细胞群即为CIK细胞,用于后续实验。
2、用不同数量的CIK细胞对人肝癌细胞HepG2存活率进行研究:在HepG2细胞培养(20000/mL)24h后,分别加入CIK细胞(加入HepG2细胞数5倍、10倍、20倍和40倍的CIK细胞)处理72h,随后轻轻吸取上层CIK细胞,每孔加入100微升PBS缓冲液,用尼康显微镜给HepG2细胞拍照,之后每孔加入25微升MTT(5mg/mL,Sigma)在含5%(v/v)CO2,37℃细胞培养箱中孵育4-5h。吸出上清液后,每孔加入150微升甲基亚砜(DMSO,天津市百世化工有限公司),以不添加CIK细胞为对照组,用酶标仪在570nm处读取数值,计算细胞的存活率,其中,细胞的存活率按以下公式计算:存活率=处理组吸光值/对照组吸光值×100%。其结果如图4和图5所示,表明CIK细胞对HepG2细胞有一定的活性。
3、用不同浓度S-SeNPs(纳米硒是实施例1中制备得到的)对CIK细胞(CIK:
800000/mL)细胞存活率进行研究:分别用终浓度为0、1.25μM、2.5μM、5μM和10μM的S-SeNPs处理CIK细胞24h、48h、72h,结果如图6所示,低浓度的S-SeNPs对CIK细胞的存活率基本没有影响,表明低浓度S-SeNPs对CIK细胞的无毒性。
4、基于上述研究,我们期待开发SeNPs在免疫领域的应用,然后对功能化的纳米硒(SeNPs)与CIK细胞共同作用的体外抗肿瘤活性进行研究:在HepG2细胞培养(20000/mL)24h后,以不添加CIK细胞和纳米硒为空白对照,实验组分别加入终浓度为4μM的S-SeNPs、CIK细胞(加入HepG2细胞数20倍的CIK细胞)、终浓度为4μM的S-SeNPs与CIK细胞(加入HepG2细胞数20倍的CIK细胞)、终浓度为4μM的S-SeNPs先与CIK细胞(加入HepG2细胞数20倍的CIK细胞)孵育12h后再共同处理HepG2细胞。结果如图7所示,从图中可以看出,细胞经单独S-SeNPs(4μM)处理后,对细胞存活率没有影响。当细胞经CIK细胞处理后发现,使HepG2细胞的存活率下降到70%。S-SeNPs(4μM)与CIK细胞联合处理组中,使HepG2细胞的存活率下降到8%。当用CIK细胞处理时,显现出了细胞抑制作用;而S-SeNPs与CIK细胞共同作用时,处理组显现出了更明显的抑制作用。从图8细胞照片(用尼康显微镜拍摄)也可以得出这一结论。
5、通过体外检测免疫细胞因子的含量(使用Elisa试剂盒检测,博奥森生物)来研究S-SeNPs与CIK细胞联合作用对HepG2细胞生长的抑制作用。在HepG2细胞培养(20000/mL)24h后,以添加CIK细胞(500万个)为对照,实验组分别用终浓度为2μM的S-SeNPs与CIK细胞(500万个)、终浓度为4μM的S-SeNPs与CIK细胞(500万个)进行处理,孵育12h后吸取上清液离心取上清用Elisa试剂盒检测免疫细胞因子的含量。研究结果如图9所示,在HepG2细胞培养24h后,分别加入CIK细胞,S-SeNPs(2μM)与CIK细胞以及S-SeNPs(4μM)与CIK细胞处理12小时后,细胞因子IFN-γ,IL-2,IL-6和IL-15都呈上升的趋势,IL-10和TGF-β呈下降的趋势。这些实验结果说明纳米硒与CIK细胞联合作用抑制HepG2细胞的生长是通过调节免疫细胞因子的表达来实现的。
6、将HepG2细胞(20000/mL)铺入直径为6cm的培养皿中培养24h,分成对照组和实验组:对照组不添加CIK细胞和纳米硒,实验组分别加入终浓度为4μM的S-SeNPs、CIK细胞(加入HepG2细胞数20倍的CIK细胞)、终浓度为0.5μM的S-SeNPs+CIK细胞(加入HepG2细胞数20倍的CIK细胞)、终浓度为1μM的S-SeNPs+CIK细胞(加入HepG2细胞数20倍的CIK细胞)、终浓度为2μM的S-SeNPs+CIK细胞(加入HepG2细胞数20倍的CIK细胞)和终浓度为4μM的S-SeNPs+CIK细胞(加入HepG2细胞数20倍的CIK细胞),处理24h,收集细胞用冷的70%(v/v)乙醇固定过夜,离心扣干,通过碘化丙啶(PI,Sigma)染色固定后,再用流式细胞术分析经过S-SeNPs、CIK细胞以及S-SeNPs与CIK细胞联合处理的HepG2的细胞周期。从图10可知,单独S-SeNPs(4μM)处理组只是引起了轻微的改变,可见单独的药物处理作用效果不明显。而单独的CIK细胞处理组引起了凋亡峰,即凋亡峰从对照组的3.8%增加至30.6%。联合S-SeNPs与CIK的处理组,Sub-G1峰增加至44.8%(1μM S-SeNPs)、63.8%(2μM S-SeNPs)和60.9%(4μM S-SeNPs),且引起了一定程度G2/M期的阻滞,G2/M峰从对照组的20.2%增加至31%(2μM S-SeNPs)和40.5%(4μM S-SeNPs)。流式细胞周期分析的结果提示联合CIK细胞与S-SeNPs可能是通过诱导细胞凋亡和G2/M期阻滞的方式抑制HepG2细胞的增殖。
实施例3S-SeNPs与CIK共同作用对人肝癌细胞HepG2裸鼠异种移植瘤生长的抑制作用
1、制备模型
收集体外培养的人肝癌细胞HepG2(培养方法同实施例2),计数,调整细胞悬液浓度为1×107个/ml,接种0.15mL细胞悬液于裸鼠(BALB/c-nu小鼠,日龄28天,北京华阜康生物科技股份有限公司)右侧腋窝皮下;
2、分组与给药
裸鼠移植瘤用游标卡尺测量移植瘤直径,待肿瘤生长至75-100mm3后将动物随机分组(分成5组),每组10只。同时开始给药,给药方案见组别与给药方案,使用测量瘤径的方法,动态观察(每3天一次)被试物抗肿瘤的效应,给药21天后小鼠处死,手术剥取瘤块称重。
给药方法:
(1)对照组:每只老鼠注射100微升生理盐水,共10只老鼠,每三天注射一次药物(生理盐水),共注射7次。
(2)S-SeNPs:1mg/kg,每只老鼠注射200微升(100微升0.2mg/mL S-SeNPs+100微升生理盐水),共10只老鼠,每三天注射一次药物,共注射7次。
(3)CIK:1000万/只(每只老鼠注射1000万个CIK细胞),每只老鼠注射100微升1亿/mL的CIK细胞,共10只老鼠,每三天注射一次药物,共注射7次。
(4)CIK+0.5mg/kg S-SeNPs:每只老鼠注射200微升(100微升1亿/mL的CIK细胞+100微升0.5mg/mL S-SeNPs),共10只老鼠,每三天注射一次药物,共注射7次。
(5)CIK+1mg/kg S-SeNPs:每只老鼠注射200微升(100微升1亿/mL的CIK细胞+100微升1mg/mL S-SeNPs),共10只老鼠,每三天注射一次药物,共注射7次。
3、观测指标
(1)肿瘤体积(tumor volume,TV)的计算公式为:
TV=1/2×a×b2;
其中:a、b分别表示长宽。
(2)根据测量的结果计算出相对肿瘤体积(relative tumor volume,RTV),计算公式为:
RTV=Vt/V0;
其中:V0为分笼给药时(即d0)测量所得肿瘤体积,Vt为每一次测量时的肿瘤体积。
(3)抗肿瘤活性的评价指标:相对肿瘤增殖率T/C(%),计算公式如下:
其中:TRTV为治疗组RTV;CRTV为模型对照组RTV。
本实验我们研究了功能化的纳米硒(SeNPs)与CIK细胞共同作用人肝癌细胞HepG2裸鼠异种移植瘤生长的抑制作用。从图11可见,S-SeNPs,CIK细胞以及S-SeNPs与CIK细胞联合处理组的小鼠在接受给药后的21天内体重与对照组没有明显区别,表明S-SeNPs,CIK细胞以及S-SeNPs与CIK细胞对小鼠的正常生长没有产生明显的影响,表明其毒副作用较小。同时从图12可以看到,S-SeNPs与CIK联合处理组的小鼠体内肿瘤体积在接受处理第九天后与模型对照组有一定程度减小。21天后S-SeNPs与CIK细胞单独处理组和联合处理组的小鼠体内相对肿瘤体积与模型对照组(25)相比分别减小到24,22,10和8,证明S-SeNPs明显增强CIK细胞对裸鼠异种移植的肝癌细胞的生长抑制效果。在图13中,21天后S-SeNPs与CIK细胞单独处理组和联合处理组的小鼠体内相对肿瘤增值率与模型对照组(100%)相比分别降低到97%,88%,41%和32%;模型对照组,S-SeNPs和CIK处理组的小鼠在接受处理21天后,其体内肿瘤重量分别是4.4g,4.3g和4.0g,而S-SeNPs和CIK细胞联合处理21天后,裸鼠体内肿瘤的重量降低为2.7g和2.3g。而且,经过21天的处理后,通过心、肝、脾、肺和肾的组织切片(图14)以及裸鼠的血液指标分析(血液分析仪)(图15)可以证明SeNPs联合CIK细胞对裸鼠机体的毒性非常小。这些实验结果证明S-SeNPs能够有效增敏CIK细胞体内治疗效果,是一种高效低毒的CIK细胞增敏剂。
实施例4PEG-SeNPs与CIK细胞共作用体外抗肝癌肿瘤活性研究
1、用不同浓度PEG-SeNPs(纳米硒是实施例1中制备得到的)对CIK细胞(CIK:800000/mL)和HepG2(20000/mL)细胞存活率进行研究:分别用终浓度为0、0.3125μM、0.625μM、1.25μM、2.5μM、5μM和10μM的PEG-SeNPs分别处理CIK和HepG2细胞24h,结果如图16和17所示,低浓度的PEG-SeNPs对CIK和HepG2细胞的存活率基本没有影响,表明低浓度PEG-SeNPs对CIK和HepG2细胞的无毒性。
2、基于上述研究,我们期待开发SeNPs在免疫领域的应用,然后对功能化的纳米硒(SeNPs)与CIK细胞共同作用的体外抗肿瘤活性进行研究:在HepG2细胞培养(20000/mL)24h后,以不添加CIK细胞和纳米硒为空白对照,实验组分别加入终浓度为4μM的PEG-SeNPs、CIK细胞(加入HepG2细胞数20倍的CIK细胞)、终浓度为4μM的PEG-SeNPs与CIK细胞(加入HepG2细胞数20倍的CIK细胞)、终浓度为4μM的PEG-SeNPs先与CIK细胞(加入HepG2细胞数20倍的CIK细胞)孵育12h后再共同处理HepG2细胞。结果如图18所示,从图中可以看出,细胞经单独PEG-SeNPs(4μM)处理后,对细胞存活率没有影响。当细胞经CIK细胞处理后发现,使HepG2细胞的存活率下降到70%。
PEG-SeNPs(4μM)与CIK细胞联合处理组中,使HepG2细胞的存活率下降到22%。当用CIK细胞处理时,显现出了细胞抑制作用;而PEG-SeNPs与CIK细胞共同作用时,处理组显现出了更明显的抑制作用。
实施例5PVP-SeNPs与CIK细胞共作用体外抗肝癌肿瘤活性研究
1、用不同浓度PVP-SeNPs(纳米硒是实施例1中制备得到的)对CIK细胞(CIK:800000/mL)和HepG2(20000/mL)细胞存活率进行研究:分别用终浓度为0、0.3125μM、0.625μM、1.25μM、2.5μM、5μM和10μM的PVP-SeNPs分别处理CIK和HepG2细胞24h,结果如图19和20所示,低浓度的PVP-SeNPs对CIK和HepG2细胞的存活率基本没有影响,表明低浓度PVP-SeNPs对CIK和HepG2细胞的无毒性。
2、基于上述研究,我们期待开发SeNPs在免疫领域的应用,然后对功能化的纳米硒(SeNPs)与CIK细胞共同作用的体外抗肿瘤活性进行研究:在HepG2细胞培养(20000/mL)24h后,以不添加CIK细胞和纳米硒为空白对照,实验组分别加入终浓度为4μM的PVP-SeNPs、CIK细胞(加入HepG2细胞数20倍的CIK细胞)、终浓度为4μM的PVP-SeNPs与CIK细胞(加入HepG2细胞数20倍的CIK细胞)、终浓度为4μM的PVP-SeNPs先与CIK细胞(加入HepG2细胞数20倍的CIK细胞)孵育12h后再共同处理HepG2细胞。结果如图21所示,从图中可以看出,细胞经单独PVP-SeNPs(4μM)处理后,对细胞存活率没有影响。当细胞经CIK细胞处理后发现,使HepG2细胞的存活率下降到70%。PVP-SeNPs(4μM)与CIK细胞联合处理组中,使HepG2细胞的存活率下降到22%。当用CIK细胞处理时,显现出了细胞抑制作用;而PVP-SeNPs与CIK细胞共同作用时,处理组显现出了更明显的抑制作用。
实施例6CS-SeNPs与CIK细胞共作用体外抗肝癌肿瘤活性研究
1、用不同浓度CS-SeNPs(纳米硒是实施例1中制备得到的)对CIK细胞(CIK:800000/mL)和HepG2(20000/mL)细胞存活率进行研究:分别用终浓度为0、0.3125μM、0.625μM、1.25μM、2.5μM、5μM和10μM的S-SeNPs分别处理CIK和HepG2细胞24h,结果如图22和23所示,低浓度的CS-SeNPs对CIK和HepG2细胞的存活率基本没有影响,表明低浓度S-SeNPs对CIK和HepG2细胞的无毒性。
2、基于上述研究,我们期待开发SeNPs在免疫领域的应用,然后对功能化的纳米硒(SeNPs)与CIK细胞共同作用的体外抗肿瘤活性进行研究:在HepG2细胞培养(20000/mL)24h后,以不添加CIK细胞和纳米硒为空白对照,实验组分别加入终浓度为4μM的CS-SeNPs、CIK细胞(加入HepG2细胞数20倍的CIK细胞)、终浓度为4μM的CS-SeNPs与CIK细胞(加入HepG2细胞数20倍的CIK细胞)、终浓度为4μM的CS-SeNPs先与CIK细胞(加入HepG2细胞数20倍的CIK细胞)孵育12h后再共同处理HepG2细胞。结果如图24所示,从图中可以看出,细胞经单独CS-SeNPs(4μM)处理后,对细胞存活率没有影响。当细胞经CIK细胞处理后发现,使HepG2细胞的存活率下降到70%。CS-SeNPs(4μM)与CIK细胞联合处理组中,使HepG2细胞的存活率下降到20%。当用CIK细胞处理时,显现出了细胞抑制作用;而CS-SeNPs与CIK细胞共同作用时,处理组显现出了更明显的抑制作用。
实施例7CMP-SeNPs与CIK细胞共作用体外抗肝癌肿瘤活性研究
1、用不同浓度CMP-SeNPs(纳米硒是实施例1中制备得到的)对CIK细胞(CIK:800000/mL)和HepG2(20000/mL)细胞存活率进行研究:分别用终浓度为0、0.3125μM、0.625μM、1.25μM、2.5μM、5μM和10μM的S-SeNPs分别处理CIK和HepG2细胞24h,结果如图25和26所示,低浓度的CMP-SeNPs对CIK和HepG2细胞的存活率基本没有影响,表明低浓度CMP-SeNPs对CIK和HepG2细胞的无毒性。
2、基于上述研究,我们期待开发SeNPs在免疫领域的应用,然后对功能化的纳米硒(SeNPs)与CIK细胞共同作用的体外抗肿瘤活性进行研究:在HepG2细胞培养(20000/mL)24h后,以不添加CIK细胞和纳米硒为空白对照,实验组分别加入终浓度为4μM的CMP-SeNPs、CIK细胞(加入HepG2细胞数20倍的CIK细胞)、终浓度为4μM的CMP-SeNPs与CIK细胞(加入HepG2细胞数20倍的CIK细胞)、终浓度为4μM的CMP-SeNPs先与CIK细胞(加入HepG2细胞数20倍的CIK细胞)孵育12h后再共同处理HepG2细胞。结果如图27所示,从图中可以看出,细胞经单独CMP-SeNPs(4μM)处理后,对细胞存活率没有影响。当细胞经CIK细胞处理后发现,使HepG2细胞的存活率下降到70%。
CMP-SeNPs(4μM)与CIK细胞联合处理组中,使HepG2细胞的存活率下降到31%。当用CIK细胞处理时,显现出了细胞抑制作用;而CMP-SeNPs与CIK细胞共同作用时,处理组显现出了更明显的抑制作用。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!